Количина на супстанција. Крт е единица за количина на супстанција. Бројот на Авогадро
Покрај претходно дискутираните апсолутни и релативна масаатоми и молекули, во хемијата големо значењеима посебна вредност - количината на супстанцијата. Количината на супстанцијата се одредува според бројот структурни единици(атоми, молекули, јони или други честички) на оваа супстанца. Количината на супстанцијата се означува со буквата ν. Веќе знаете дека секоја физичка величина има своја мерна единица. На пример, должината на телото се мери во метри, масата на супстанцијата се мери во килограми. Како се мери количеството на супстанција? За мерење на количината на супстанција, постои посебна единица - крт.
Крте количината на супстанција која содржи онолку честички (атоми, молекули или други) колку што има јаглеродни атоми во 0,012 kg (т.е. 12 g јаглерод. Тоа значи дека еден мол цинк, еден мол алуминиум, еден мол јаглерод содржат еден ист број на атоми. Ова исто така значи дека еден мол молекуларен кислород, еден мол вода содржат ист број на молекули. И во првиот и во вториот случај, бројот на честички (атоми, молекули) содржани во еден мол е еднаков број на атоми во еден мол јаглерод.Експериментално е утврдено дека еден мол од супстанцијата содржи 6,02 x 1023 честички (атоми, молекули или други). честички што ја сочинуваат оваа супстанца. Ако супстанцијата се состои од атоми (на пример, цинк, алуминиум итн.), тогаш еден мол од оваа супстанца е 6,02 1023 од нејзините атоми. Ако супстанцијата се состои од молекули (на пример, кислород, вода, итн.), тогаш еден мол од оваа супстанца е 6,02 x 1023 од нејзините молекули. Оваа вредност од 6,02 x 1023 е именувана по познатиот италијански научник Амедео Авогадро „Авогадрова константа“ и е означена NA. Бројот на Авогадро го покажува бројот на честички во еден мол од супстанцијата, така што би можел да има димензија „честички / мол“. Меѓутоа, бидејќи честичките можат да бидат различни, зборот „честички“ е испуштен и наместо тоа единицата е напишана во димензијата на бројот на Авогадро: „1/mol“ или „mol-1“. Така: NA = 6,02 1023.
Бројот на Авогадромногу голем. Да споредиме: ако соберете 6,02 · 1023 топчиња со радиус од 14 сантиметри, тогаш нивниот вкупен волумен ќе биде приближно ист како и целата наша планета Земја.
За да го одредите бројот на атоми (молекули) во одредена количина на супстанција, мора да користите следнава формула: N = ν NA,
каде N е бројот на честички (атоми или молекули).
На пример, да го одредиме бројот на атоми на алуминиум содржани во 2 мола алуминиумска супстанција: N (Al) = ν (Al) · NA.
N (Al) = 2 mol · 6,02 · 1023 = 12,04 · 1023 (атоми).
Покрај тоа, можете да ја одредите количината на супстанцијата со познат бројатоми (молекули): ![]()
Количина на супстанцијае бројот на честички во дел од супстанцијата.
Количината на супстанцијата е индицирана Грчко писмо ν („голи“)
Крте единица за количина на супстанција. Ова е количина на супстанција (или дел од неа) што содржи 6,02 · 10 23 честички (молекули, атоми или други честички). Заокружено: 6 · 10 23 .
Вредноста 6,02 10 23 mol -1 се нарекува Авогадроова константа и е означена Латинска букваи индекс N A:
N A = 6,02· 10 23 мол
Значи, еден мол од која било супстанција содржи 6,02 · 10 23 молекули, атоми или други честички.
На пример, 1 мол вода H 2 O содржи 6 · 10 23 молекули H 2 O;
1 мол железо Fe содржи 6 10 23 атоми на Fe.
1 мол хлор Cl 2 содржи 6 10 23 Cl 2 молекули.
Во исто време, 1 мол хлор Cl2 содржи 2 молови атоми на хлор Cl.
Затоа, кога пишувате ознаки во загради, означете ја формулата на предметната честичка:
N(Cl2) е бројот на молекули на хлор, а N(Cl) е бројот на атоми на хлор;
ν(Cl 2) е количеството на молекуларна хлорна супстанција, а ν(Cl) е количината на атомска супстанција на хлор.
На пример, да го одредиме бројот на молекули содржани во водата во количина од 0,5 mol:
N(H 2 O) = N A ν(H 2 O) = 6 10 23 mol -1 0,5 mol = 3 10 23.
Моларна масасупстанции M(X) е еднаков на односот на масата на супстанцијата m(X) до соодветната количина на супстанцијата ν(X):
m(X)
М(X) = --
ν(X)
Моларната маса се изразува во грамови по мол (g/mol) или килограми по мол (kg/mol).
1 g/mol = 10 -3 kg/mol.
Моларна масаМ е еднаква на релативна молекуларна масаM r (ако супстанцијата се состои од молекули) или релативна атомска масаA r (ако супстанцијата се состои од атоми).
На пример, според периодниот систем, атомската маса на магнезиум Mg е 24, а неговата моларна маса е 24 g/mol. Односно, тежината на 1 мол магнезиум е 24 грама. Или, поинаку кажано, 24 грама магнезиум содржи 6 10 23 атоми магнезиум.
Крт. Еден мол се зема како единица за количина на супстанција. Ова е количината на супстанција што содржи толку многу условни честички,колку атоми се содржани во 0,012 kg јаглерод-12, односно 6,02045 10 23. Условната честичка може да биде молекула, јон, електрон, групи на честички (на пример, функционална група, дел од молекула, соработник, радикал итн.). Со еден збор, условна честичка е секоја дискретна материјална единица (вклучувајќи макро-објекти, на пример, маса, стол, ногарка за маса итн.). Некои условни честички всушност постојат (молекула H 2, IO 3 - јон, маса, стол), други - чисто условно (молекула NaCI во раствор, половина молекула, протон во раствор).
Макро објектите лесно се бројат поединечно. Додека микро-објектите (атоми, молекули итн.) не можат да се бројат во макро-објект. Затоа, единицата „крт“ на конвенционалните честички е погодна и обично се користи за изразување на бројот на микро-објекти; несоодветно е да се користи за да се процени бројот на макро-објекти. За да го означите бројот на молови на супстанција, користете го симболот n . Запишување n(H +)= 1,0·10 -6 mol значи 6,02·10 23 10 -6 протони;
n(1/5KMn04) = 0,05 mol - 6,02·10 23 ·0,05 конвенционални честички 1/5KMnO4;
n(e)=1 mol - 6,02·10 23 електрони.
Во пракса хемиска анализатакви информации ретко се потребни.
Моларна маса (М) -Ова е маса од 1 мол супстанција. Ако има супстанца со маса м, Тоа М = m/n.Моларната маса има димензија g mol -1.
Нумерички, моларната маса е еднаква на релативната молекуларна маса, т.е. вкупната маса на сите атоми во честичката, поделена со 1/12 од масата на јаглеродниот атом. Роднина молекуларна маса- бездимензионална количина, лесно може да се пресмета од табелите атомски масиелементи.
Моларен волумен (V o) -е волумен од 1 мол супстанција при нормални услови. Обично оваа вредност се користи за гасови, во овој случај V o = 22,4 L mol -1.
Моларен полнеж (Q) -Ова е вкупното полнење на 1 мол од супстанцијата. За единечно наелектризирани честички Q = 96485 C mol -1 (Фарадеј број, F),за z-полначи Q=zF.
Начини за изразување на концентрацијата.ВО аналитичка хемијачесто се занимаваат со количината на супстанција во одреден волумен, т.е. со концентрација. Ова е особено важно за супстанциите во растворите. Единицата за волумен е кубик метар(m 3) или кубен дециметар (dm 3), што е точно еднакво на 1 литар (l).
Моларна концентрација c -односот на бројот на молови на растворена супстанција со волуменот на растворот. Овој термин се однесува на секаков вид условни честички (атоми, јони, молекули, делови од молекули итн.). Така, моларната концентрација се изразува во mol dm -3 или mol l -1 (mol растворена супстанција на литар раствор), скратено како M.
На пример, c(HC1)=0,1 mol-l-1 или c(HC1)=0,1 M; c(1/5KMn04)=0,05 mol l-1 или 0,05M (l/5 KMnO4).
Ајде да разгледаме други начини за изразување на концентрацијата. Масовна концентрација- однос на масата на растворената супстанција Госпоѓицадо волуменот на растворот V,единици за масена концентрација kg dm -3 или kg l -1, како и повеќекратни подмножества*.
Концентрација на волумен - односот на волуменот на растворената супстанција со волуменот на растворот.
Често составот на раствор или други предмети се изразува во удел на компоненти од вкупната количина на супстанција. Погодноста на овој метод на изразување на составот лежи во неговата независност од збирната состојба на објектот.
**** Концентрацијата на масата, изразена во грами супстанција на милилитар, се нарекува Наслов.Оваа единица го даде своето име класичен методанализа - титриметрија.
„Пропорција“ значи однос на бројот на делови од компонентата спрема вкупен бројделови од објектот. Во зависност од избраната единица, се разликуваат моларни (а), маса (ω), волуменски (φ) фракции:
Уделот е изразен во проценти ( масен уделизразено во проценти се нарекува процентуална концентрација),делови на милион (ppm), делови на милијарда (ppb), делови на трилион (ppt). Единиците ppm, ppb и ppt се корисни за проценка на мали количини на супстанции. Во овој случај, дропот (a, ω или φ) треба да се помножи со 10 6, 10 9 или 10 12 за да се добие погоден цел број или блиску до него.
Пример 1.Содржината на аскорбинска киселина во инфузијата од шипинка е 5,5 mg на 1 литар. Изразете ја содржината на аскорбинска киселина во масен удел.
Да го најдеме масениот удел на аскорбинска киселина во растворот (со оглед на тоа дека 1 литар има маса од 10 3 g):
![]()
Оваа бројка е неповолна за пресметки. Ајде да го претвориме во ppm единици (милион -1):
5,5 10 -6 ·10 6 =5,5 милиони-л.
Молалитет - количината на супстанција по единица маса (1 kg) растворувач. Предноста на молалноста е независна од температурата. Сепак, оваа единица ретко се користи во аналитичката хемија.
Еквивалент. Постојат одредени врски помеѓу конвенционалните честички во соединението, наречено стехиометриски. На пример, во молекула NaCI, еден атом на натриум е поврзан со еден атом на хлор; во молекула H 2 CO 3, два протони се поврзани со една CO 3 2- честичка. Стоихиометриски односи се воспоставени и помеѓу честичките кои реагираат, на пример во реакцијата
aA + bB = cC + dD
а условните честички на супстанцијата А реагираат со бусловни честички на супстанцијата Б. Следствено, една честичка А е еквивалентна на b/a честички на супстанцијата Б.
Се нарекува односот b/a фактор на еквивалентност на супстанцијата B и се означени со ¦ eq (B), а условната честичка B што одговара на честичката A во дадена реакција е b/a B или ¦ eq B(B). На пример, во реакцијата
2HC1 + Na 2 CO 3 = NaCI + H 2 CO 3
¦ eq (Na 2 CO 3) = 1/2 , а еквивалентот е конвенционална честичка 1/2 Na 2 CO 3.
Супстанциите реагираат едни со други со еквиваленти - ова закон за множители Далтон во аналитичката хемија служи како основа за сите квантитативни пресметки, особено во титриметриските методи на анализа.
Мол од еквиваленти, како мол од честички, содржи 6,02 10 23 еквиваленти, а моларната маса на еквивалент е нумерички еднаква на збирот на атомските маси на сите негови составни атоми. Еквивалентот на истата супстанција може да се разликува во зависност од реакцијата. На пример, во реакцијата
HC1 + Na 2 CO 3 = NaHCO 3 + NaCI
еквивалент на натриум карбонат е конвенционална честичка Na 2 CO 3 (¦ eq = 1), додека во горната реакција 1/2 Na 2 CO 3 (¦ eq = 1/2).
Во киселинско-базните реакции, еквивалент е условна честичка која во дадена реакција комбинира, заменува, ослободува еден водороден јон или на некој друг начин е еквивалентна на еден водороден јон. Во реакциите на редокс, еквивалент е условна честичка која во дадена реакција додава или донира еден електрон (или на некој друг начин е еквивалентна на еден електрон).
Во пракса, тие не се занимаваат со поединечни еквиваленти или еден хемиски акт, туку со големи агрегати на честички. Во овој случај, стехиометриските односи помеѓу супстанциите се манифестираат во односот на количините на супстанции во молови:
p(A): p(B)=a:b
2.2. Избор на метод за анализа
При изборот на метод за анализа, треба јасно да ја знаете целта на анализата, проблемите што треба да се решат и да ги оцените предностите и недостатоците на достапните методи за анализа.
Пред да ги разгледаме факторите што мора да се земат предвид при изборот на одреден метод на анализа, ќе разговараме за концептите на методот и техниката.
Метод - ова е збир на принципи кои се во основата на анализата без оглед на конкретниот предмет и супстанција што се одредуваат;
методологија - Детален описсите услови и операции за анализа на конкретен објект.
На пример, гравиметрискиот метод на анализа се заснова на определување на масата на соединението што ја содржи или, поретко, ја губи компонентата што се одредува. Техниката за гравиметриско определување на компонентата вклучува: опис на условите за таложење на ова слабо растворливо соединение, метод за одвојување на талогот од растворот, претворање на таложената супстанција во форма погодна за мерење итн. При определување на компонента во специфичен објектМетодологијата, исто така, вклучува опис на операциите на земање мостри и негово подготвување за анализа (на пример, растворање на примерокот во соодветен растворувач и елиминирање на влијанието на супстанциите што го попречуваат определувањето). Да ги погледнеме главните фактори кои треба да се земат предвид при изборот на метод и методологија.
Содржина на компонентата.При изборот на аналитички метод, неопходно е да се земе предвид очекуваната содржина на откриената или утврдената компонента. Важно е не само да се оценува процентоткомпонента во примерокот, неговата концентрација во анализираниот раствор, но и количината на супстанцијата што може да се земе за анализа. Така, изборот на методот на анализа се одредува според апсолутната содржина на компонентата.
Концентрацијата на компонентата што се определува и количината на мостра дадена за анализа може да варира во широки граници. Така, содржината на бакар, никел, хром може да биде десетици проценти во нивните легури, десетини и стотинки од проценти во минерали, руди, легури на други метали. Во исто време, содржината на овие метали во растенијата, живите организми и прехранбените производи мора да се утврди веќе во n 10 -7 - П 10 -5 %, а во особено чисти материи - во n 10 -8 -10 -6 %.
Количината на примерокот добиен за анализа во некои случаи можеби не е ограничен, но во други (одредување на вметнување во минерали, анализа на крв, биомаса, вселенски објекти итн.) е многу мал (милиграми, па дури и фракции од милиграм).
 Чувствителност
метод или техника се определува со минималната количина на супстанција што може да се открие или утврди со даден метод, користејќи дадена техника (построга дефиниција на овој концепт и неговата квантитативно изразувањевиди подоцна во ова поглавје). На сл. Табелата 2.1 ја покажува релативната чувствителност на некои методи. Крајна линијаутврдената содржина ги покажува можностите на методот и најдобар резултат, постигнат при определување на голем број супстанци.
Чувствителност
метод или техника се определува со минималната количина на супстанција што може да се открие или утврди со даден метод, користејќи дадена техника (построга дефиниција на овој концепт и неговата квантитативно изразувањевиди подоцна во ова поглавје). На сл. Табелата 2.1 ја покажува релативната чувствителност на некои методи. Крајна линијаутврдената содржина ги покажува можностите на методот и најдобар резултат, постигнат при определување на голем број супстанци.
Со споредување на чувствителноста на различни методи и проценување на приближната содржина на компонентата во примерокот, хемичарот избира еден или друг метод на анализа. На пример, за да се одреди содржината на натриум во силикатни карпи, се користи гравиметриска метода, што овозможува да се одредат мија-диграми и поголеми количини на натриум; да се определуваат микрограмски количества на ист елемент во растенија и биолошки примероци од животинско потекло - методот на фотометрија на пламен; за определување на натриум во вода со посебна чистота (нано- и пикограмски количини) - метода на ласерска спектроскопија.
Селективност на методот.При спроведување на анализа, тие се занимаваат со широк спектар на објекти - индустриски и земјоделски производи, предмети животната средина, вселенски објекти, уметнички дела итн. Секако, изборот на методот и техниката на анализа се одредуваат не само од задачата за анализа, туку и од својствата и карактеристиките на примерокот. Неопходно е да се земат предвид физичките својства на анализираниот објект: неговиот состојба на агрегација, испарливост, хигроскопност, механичка цврстина, итн. Одредувачките фактори при изборот на методот на анализа се Хемиски својствапример. Во овој случај, важно е да се знаат и да се земат предвид: хемиските својства на базата на примерокот, честопати наречена матрица на анализираниот објект; квалитативен хемиски состав на примерокот; хемиските својства на компонентата што се одредува и нејзините придружни нечистотии.
Знаејќи ги хемиските својства на основата и очекуваните компоненти на анализираниот објект, проценувајќи ги можните пречки, изберете што е можно повеќе селективен метод , односно метод со кој, под дадени услови, саканите компоненти може да се детектираат или идентификуваат без пречки од други присутни компоненти. Во хемиската литература, заедно со терминот „селективност“, се користи и терминот „селективност“.
Ако методот или техниката дозволува откривање или одредување само на една компонента, тогаш се нарекува специфичен .
Можеме да зборуваме за селективноста на методот, техниката и индивидуалната реакција во основата на откривањето или одредувањето на компонентата. Така, методите како што се јонометрија, атомска апсорпција и ензимски методи се карактеризираат со висока селективност. Многу од реакциите во основата на техниките се исто така високо селективни.
На пример, формирање на одредени сложени соединенија со органски реагенси, ензимски и електрохемиски реакции. Специфични се реакциите на интеракција на јод со скроб или супстанции што содржат амониум со алкалии, кои се користат за откривање на јони на јод или амониум.
Техниката на хемиска анализа може да се направи поселективна со менување на условите за анализа (средна pH вредност, концентрација на реагенсот, растворувач итн.); елиминирање на влијанието на компонентите кои пречат со нивно претворање во нереактивна форма (маскирање) или нивно одвојување (таложење, екстракција, хроматографија) од главната компонента. Пример за високо селективна техника е определувањето на никелот во челиците со гравиметриски метод користејќи реакција на таложење на слабо растворливо сложено соединение на никел со диметилглиоксим. Врнежите се вршат во средина со слаб амонијак; железото е маскирано со винска или лимонска киселина.
Имајќи ги предвид методите и техниките, треба да се каже за нив разноврсност - способност да открие или идентификува многу компоненти. Особено е вредно да може да се детектираат или определат многу компоненти истовремено од еден примерок, т.е. анализираат повеќекомпонентни системи. Високата селективност на методот и неговата разновидност не се контрадикторни едни со други: многу универзални методианализата се карактеризира со висока селективност за одредување на поединечни компоненти, на пример, методи како што се хроматографија, некои видови на волтаметрија, атомска емисиона спектроскопија. Користејќи методи на спектроскопија на атомска емисија со помош на индуктивно сврзана плазма и квантни метри, може да се одредат 25-30 различни елементи од еден примерок (без одвојување).
Точност на анализатае колективна карактеристика на метод или техника, вклучувајќи ја неговата исправност и репродуктивност. Кога зборуваат за висока прецизност, да претпоставиме дека резултатите се точни, а ширењето на податоците од анализата е незначително. Точноста често се карактеризира со релативна грешка (грешка) на определувањето како процент.
Барањата за точноста на анализата обично се одредуваат според целта и целите на анализата и природата на предметот. Не е неопходно секогаш да се стремиме кон висока точност.
На пример, при рутински мониторинг на многу металуршки и хемиски индустрии, одредувањето на компонентите може да се изврши со грешка од 10-15%. Во случај кога е важно попрецизно да се знае и содржината на главната компонента и содржината штетни нечистотии(на пример, во фармацевтските и Прехранбена индустрија), грешката не треба да биде поголема од 0,1-1%. За полупроводниците, грешката при определувањето на главните компоненти треба да биде под 0,1%, а ако е можно 0,01%, бидејќи физички својстваод овие соединенија во голема мера зависат од постојаноста на нивниот стехиометриски состав.
Гравиметриските и титриметриските методи се доста точни, чија грешка е обично 0,05- 0,2 и 0,1-0,5%. Од современите методи, најточна е кулометриската, што овозможува одредување на компоненти со грешка од 0,001-0,01%.
Како по правило, барањата за точноста на хемиската анализа ги диктираат технолози, геолози, лекари, физичари итн. Но, аналитичките хемичари секогаш треба да имаат сопственото разбирањепотребата да се постигне една или друга точност при спроведување на анализа. Неоправданото барање за висока точност на определувањето обично ги продолжува и ги зголемува трошоците за хемиската анализа. Така, кога точноста на одредување на одреден број компоненти се зголемува од 2 на 0,2%, времето на анализа се зголемува за повеќе од 20 пати. Претераните барања за точност честопати доведуваат до потреба да се користи сложена и скапа опрема. Така, истражувачот мора да има јасен пристап за избор на повеќе или помалку точен метод, особено кога врши масовни хемиски анализи.
Експрес метод.Услов за експресивност , т.е. брзината на анализа често се поставува како едно од главните барања при изборот на метод или техника на анализа. Задачите за анализа понекогаш ја диктираат потребата да се избере експресен метод. На пример, за време на топењето на челикот на конверторот, кое трае 15-30 минути, содржината на елементите постојано се одредува, односно секоја анализа треба да трае само неколку минути. При изведување на хируршки операции, понекогаш има потреба да се одреди биолошката концентрација во крвта или ткивата на пациентот во рок од неколку минути. активно соединение(уреа, гликоза, лекови, итн.).
Постојат методи кои овозможуваат анализата да се спроведе многу брзо. Така, методите на спектроскопија на атомска емисија со користење на квантни метри овозможуваат да се одредат 15-20 елементи за неколку секунди; Методот на јонометрија користи јоно-селективни електроди, вклучувајќи ги и ензимските електроди, чие време на одговор на содржината на компонентата е 0,5-1 мин.
Треба да се забележи дека во повеќето техники, мерењето на сигналот поврзан со содржината обично е прилично брз чекор. Поголемиот дел од времето за време на хемиската анализа се троши на подготовка на примерокот. Затоа, освен тоа еднакви условиЗа да го намалите времето за анализа, треба да ги изберете најселективните методи за кои не е потребна посебна подготовка на примерокот.
Трошоци за анализа.При изборот на метод на анализа, често е голема улога, особено при спроведување на сериски и масовни анализи, драми трошоци за хемиска анализа,што ги вклучува трошоците за употребената опрема, реагенсите, работното време на аналитичарот, а понекогаш и самиот примерок.
Методите варираат во хардверските трошоци. Најевтини се титриметриските, гравиметриските и потенциометриските методи. Опремата со поголема цена се користи, на пример, во волтаметрија, спектрофотометрија, луминисценција и атомска апсорпција. Највисоката цена на опремата што се користи во методот на анализа за активирање на неутрони, масена спектрометрија, спектроскопија NMR и EPR и спектроскопија на атомска емисија на индуктивно поврзана плазма.
При проценка на трошоците за анализа, се земаат предвид и трошоците и достапноста на реагенсите; времето поминато за откривање или идентификување на една компонента; масата на анализираниот примерок, особено во случаи кога материјалот на самиот анализиран предмет е скап (легури и инготи од платина метали, злато и сл.). Сите други работи се еднакви, за да го решите проблемот, треба да го изберете најевтиниот метод и техника за анализа.
Автоматизација на анализата.При спроведување на масовни хомогени анализи, треба да изберете метод кој овозможува автоматизација на анализата, што ви овозможува да ја олесните работата на аналитичарот со замена на многу рачни, трудоинтензивни операции со автоматски, да ги намалите грешките на поединечните операции, да ја зголемите брзината на анализа, намалување на неговата цена, спроведување на анализа на далечина итн.
Во современите методи на анализа, тенденцијата кон автоматизација се зголемува. Иако автоматизацијата на анализата често бара високи трошоци, неговата употреба се должи на процесот на автоматизација на производството воопшто и на сè поголемите барања за контрола на квалитетот на производите. За повеќе информации за автоматизацијата, видете во Поглавје 16.
Други барања за методи на анализа.Покрај факторите наведени погоре што се земаат предвид при изборот на метод и техника, задачите за анализа може да наметнат други специфични барања за методот.
На пример, спроведување на анализа без да се уништи примерокот (недеструктивна анализа) е неопходна кога се анализираат уметнички дела, археолошки предмети, предмети форензикатаи така натаму. Во овој случај, анализата често се изведува со користење на методи на флуоресценција на Х-зраци и нуклеарна физика.
Во хемиската анализа на подмножества, микрофази на метални инготи, геолошки и археолошки примероци; за време на слој-по-слој анализа на филмови; потребно е да се изврши разјаснување на составот на дамки, удари во ракописи, во предмети за форензичко испитување итн. локална анализа . Во оваа анализа, внесете нова карактеристикаметод - просторна резолуција , т.е., способноста да се направи разлика помеѓу тесно распоредените области на примерокот. Просторната резолуција се одредува според дијаметарот и длабочината на регионот уништен за време на анализата. Највисока просторна резолуција што може да се постигне современи методилокална анализа, - 1 µmна површината и до 1 nm (т.е. неколку моноатомски слоеви) во длабочина. Рендгенските зраци се користат во локалната анализа спектрални методи(микроанализатор со електронска сонда), спектрални методи на атомска емисија со ласерско возбудување, масена спектрометрија.
Еден од важни задачимодерна аналитичка хемија - спроводна хемикалија анализа од далечина (далечинска анализа). Овој проблем се јавува кога се анализира вселенски објекти, истражување на дното на Светскиот океан, кога се анализираат радиоактивни или други супстанции штетни за здравјето на луѓето. Проблемот на анализа на далечина често се решава со помош на нуклеарна физика, масена спектрометрија и други методи.
Така, голем бројФакторите кои треба да се проценат и да се земат предвид при изборот на метод на анализа и оптимален метод за откривање или одредување на компоненти ја прават оваа фаза на хемиска анализа доста сложена. Некоја помошаналитичарот може да добие со решавање на овој проблем со помош на компјутерска симулација.
2.3. Аналитички сигнал. Мерење
По земање мостри и подготовка на примерокот, започнува фазата на хемиска анализа во која се открива компонентата или се одредува нејзината количина. За таа цел мерат аналитички сигнал. Во некои случаи, можно е директно да се одреди содржината. На пример, во гравиметрискиот метод, масата на компонентата што се одредува, на пример, елементарен сулфур или јаглерод, понекогаш директно се мери. Во повеќето методи
аналитичкиот сигнал е просекот на мерењата физичката количинаво завршна фаза на анализа, функционално поврзана со содржината на компонентата што се одредува.
Ова може да биде моменталната јачина, ЕМП на системот, оптичка густина, интензитет на зрачење итн.
Ако е неопходно да се открие некоја компонента, таа обично се поправа изгледаналитички сигнал - појава на талог, боја, линија во спектарот итн. Појавата на аналитички сигнал мора да биде веродостојно снимена. При определување на количината на компонента се мери магнитудааналитички сигнал: маса на седимент, јачина на струја, интензитет на линија на спектарот итн. Потоа содржината на компонентата се пресметува со помош на функционалниот однос аналитички сигнал - содржина: y=f(c),кој се утврдува со пресметка или искуство и може да се прикаже во форма на формула, табела или график. Содржината може да се изрази како апсолутна количина на компонентата што се одредува во молови, во единици маса или преку соодветните концентрации.
При мерење на аналитички сигнал се зема предвид присуството на корисен аналитички сигнал, кој е во функција на содржината на компонентата што се одредува, и позадина на аналитички сигнал, предизвикани од нечистотиите на компонентата што се одредуваат и компонентите кои пречат во растворите, растворувачите и матрицата на примерокот, како и од „шумот“ што произлегува од мерните инструменти, засилувачите и другата опрема. Овие звуци не се поврзани со компонентата што се одредува, туку се надредени на сопствениот аналитички сигнал. Задачата на аналитичарот е да ја минимизира големината на аналитичкиот позадински сигнал и, што е најважно, да ги минимизира неговите флуктуации. Вообичаено, аналитичкиот позадински сигнал се зема предвид при изведување контролен (празен) експеримент,кога низ сите фази на хемиска анализа се изведува примерок што не ја содржи компонентата што се одредува. Корисниот сигнал во овој случај ќе биде аналитички сигнал еднаков на разликата помеѓу измерениот аналитички сигнал и аналитичкиот позадински сигнал.
Врз основа постоечка зависностПомеѓу аналитичкиот сигнал и содржината се наоѓа концентрацијата на компонентата што се одредува. Вообичаено, се користат крива на калибрација, стандарди или адитивни методи. Други методи за одредување на содржината на компонентите опишани во литературата обично се модификации на овие три главни методи.
Најчесто метод на крива на калибрација. Во овој случај, се конструира график во координатите аналитички сигнал - содржина на компонента користејќи споредбени примероци со различни и прецизно познати содржини на компонентата што се одредува. Потоа, со мерење на големината на аналитичкиот сигнал во анализираниот примерок, содржината на компонентата што се одредува се наоѓа според графикот за калибрација (сл. 2.2).
ВО метод на стандарди измерете го аналитичкиот сигнал во спореден примерок (референтен примерок) со позната содржина на компоненти и во анализираниот примерок: на ова = С кат,И y x = Sc x,Каде С- коефициент на пропорционалност. Ако вредноста утврдена под идентични услови Соднапред познато, тогаш пресметката може да се направи со помош на формулата со x = y x /S.Обично се користи соодносот y et /U x= s fl / s x, од каде
Понекогаш се користат два референтни примероци, во кои содржината на компонентата се разликува од очекуваната во анализираниот примерок, во едниот случај за помалку, во другиот за помалку. голема страна. Оваа верзија на методот на стандарди понекогаш се нарекува метод на ограничувачко решение. Содржината на компонентата што се одредува се пресметува со формулата
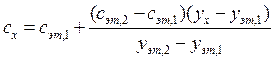
Во случаи кога, при одредување на мали количини на компонента, потребно е да се земе предвид влијанието на матрицата на примерокот врз вредноста на аналитичкиот сигнал, тие често користат адитивен метод - пресметка и графички.
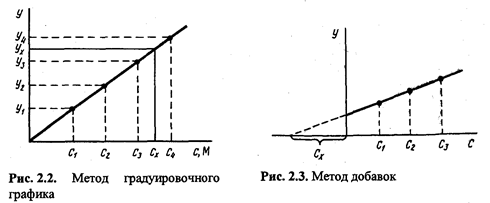
При определување на содржината метод на пресметка земете два делови од анализираниот раствор на мострата. На една од нив се додава додаток на компонентата што се одредува позната содржина. Во двата примерока се мери аналитичкиот сигнал - y xИ y x+ext.Непознатата концентрација на компонентата што се одредува се пресметува со формулата

каде што V add и c add се волуменот и концентрацијата на додадениот раствор на компонентата што се одредува; V-дел од анализираниот примерок.
При определување на содржината на компонента графички метод земете nаликвоти од анализираниот примерок: 1, 2, 3, ..., n.Во аликвоти 2, 3, ..., Ппознати, се воведуваат зголемени количини на компонентата што се одредува. Во сите аликвоти, аналитичкиот сигнал се мери и графикот се исцртува во координатите аналитички сигнал ¾ содржина на одредената компонента, земајќи ја содржината на одредената компонента во делот без додаток (аликвот 1) како условна нула. Екстраполацијата на добиената права линија до пресекот со оската x дава отсечка лоцирана лево од конвенционалната координатна нула, чија вредност на избраната скала и мерни единици одговара на саканата содржина (со x) на утврдена компонента (сл. 2.3).
Стандардниот метод и методот на додавање се применливи за функцијата за линеарна калибрација. Методот на граф за калибрација овозможува користење и на линеарни и нелинеарни аналитички функции на сигнал - содржина. ВО вториот случајПотребен е поголем број на експериментални податоци и резултатот од одредувањето на содржината на компонентата е, по правило, помалку точен.
За да се изгради графикон за калибрација, најдобриот начинзадоволувачки експериментални податоци, обично се користат метод на најмали квадрати (MNC).Основниот предлог на ОЛС вели дека ако за секоја од мексперименталните точки цртаат прави линии на оптималната крива, паралелни оскиординати, тогаш за оптимална (теоретска) крива збирот на квадратни отстапувања на точките од кривата (d i) треба да биде минимален, т.е.
Во хемиската анализа најчесто се користат праволиниски калибрациони графикони, конструирани за одредена опсег на утврдени содржини, т.е. во опсегот на вредности предвидени со оваа техника.
Равенката на права линија може да се запише како y = a + bx.Ако е достапен мекспериментални точки (x 1 y 1, x 2 y 2, ..., x m Y m),тогаш, користејќи го принципот постулат на најмали квадрати, можеме да ги најдеме параметрите АИ бправа линија која најдобро ги задоволува експерименталните податоци

За калибрациона линија што минува низ потеклото на координатите y = b"x,
Забележете дека параметрите АИ бколку е попрецизен и, според тоа, конструираниот графикон за калибрација е поблизок до теоретскиот, толку е поширок опсегот на утврдените содржини над графикот и толку е поголем бројот на споредбени примероци (стандарди). Тбил однесен да го изгради.
Во сите методи на определување непозната содржинасе користат компоненти функционална зависност y=Sx.
Фактор на чувствителност С (понекогаш едноставно се нарекува чувствителност) го карактеризира одговорот на аналитичкиот сигнал на содржината на компонентата. Коефициент на чувствителност -ова е вредноста на првиот извод на функцијата за калибрација при дадена специфична содржина. За праволиниски графикони за калибрација, ова е тангента на аголот на наклон на права линија (види Сл. 2.2):

Колку е поголем факторот на чувствителност С,помалите количини на компонента може да се детектираат и одредат, добивајќи го истиот аналитички сигнал. Колку е повисоко С,толку попрецизно може да се одреди една и иста количина на супстанција. Затоа, кога развива нов метод или техника на хемиска анализа, истражувач, обидувајќи се да го зголеми коефициентот на чувствителност, користи различни техники: концентрација, подобрување на опремата, создавање на нови реагенси итн.
Во сите разгледувани методи се користат референтни примероци (стандарди), односно примероци, примероци, раствори со точно одредена содржина на компоненти. Методите на анализа со користење на референтни примероци се т.н релативни методи хемиска анализа.
Апсолутни (без стандардни) методи во аналитичката хемија има малку - на пример, гравиметриски методи, директна кулометрија, некои варијанти на радиохемиски методи.
Споредбени примероци за релативни методи на анализа може да се подготват од хемиски чисти, стабилни супстанции со познат состав (стандардни супстанции). Во овој случај, содржината на компонентата што се одредува се пресметува со користење хемиска формуластандардна супстанција. Можно е да се подготват споредбени примероци во посебна лабораторија, институција или индустрија, кога ќе се утврди содржината на компонентата различни методи, многу аналитичари на различни инструменти. Најсигурни резултати се добиваат при употреба стандардни примероци(СО) - специјално подготвени материјали, чиј состав и својства се веродостојно утврдени и официјално потврдени од специјални државни метролошки институции.
При спроведување на хемиска анализа, тие обично не се ограничени на единствена дефиницијано спроведе некои паралелни дефиниции (обично 3-5) за ист примерок под исти услови. Просечен резултатсе нарекуваат паралелни дефиниции резултат од анализатаи се означува со cf или x просечно.Отстапувањето на резултатот од анализата од вистинската содржина на компонентата што се одредува (C ist, x ist) се нарекува грешка (или грешка ) дефиниции.
Заедно со откривањето или одредувањето на содржината на компонентата, важно е да се процени веродостојноста на добиените резултати и грешките при мерењето.
2.4 Грешки во хемиската анализа. Обработка на резултатите од мерењето
Ајде да разгледаме некои основни пристапи за класификација на грешки. Според методот на пресметка, грешките може да се поделат на апсолутни и релативни.
Апсолутна грешка еднаква на разликата во просечното мерење на количината Xи вистинската вредност на оваа количина:
Во некои случаи, доколку е потребно, пресметајте ги грешките на единечни определби:
D = x i - x извор
Забележете дека измерената количина во хемиската анализа може да биде или содржина на компонента или аналитички сигнал. Во зависност од тоа дали резултатот од анализата ја преценува или потценува грешката, грешките може да бидат позитивенИ негативен.
Релативна грешка може да се изрази како фракции или проценти и обично нема знак:
![]()
Грешките може да се класифицираат според нивните извори. Бидејќи има исклучително многу извори на грешки, нивната класификација не може да биде недвосмислена. Некои примери за класификација на грешки по извор ќе бидат разгледани подолу.
 Најчесто, грешките се класифицираат според природата на причините што ги предизвикуваат. Во овој случај, грешките се поделени на систематски и случајни, а исто така се разликуваат промашувања (или груби грешки).
Најчесто, грешките се класифицираат според природата на причините што ги предизвикуваат. Во овој случај, грешките се поделени на систематски и случајни, а исто така се разликуваат промашувања (или груби грешки).
ДО систематски вклучуваат грешки кои постојано се предизвикуваат ефикасна причина, постојана во сите димензии или постојано менување сегашниот закон, може да се идентификува и елиминира. Случајно грешките, чии причини се непознати, може да се проценат со помош на методи математичка статистика. Госпоѓица - Ова е грешка која остро го искривува резултатот од анализата и обично лесно се открива, обично предизвикана од невнимание или неспособност на аналитичарот. На сл. 2.4 претставува дијаграм кој ги објаснува концептите на систематски и случајни грешки и промашувања. Правата линија 1 одговара на идеалниот случај кога во сите ННема систематски или случајни грешки во дефинициите. Линија 2 и 3 исто така идеализирани примери на хемиска анализа. Во еден случај (линија 2) нема сосема случајни грешки, туку сите Ндефинициите имаат постојана негативна систематска грешка Dx; во друг случај (линија 3) Нема апсолутно никаква систематска грешка. Линијата ја отсликува реалната ситуација 4: Постојат и случајни и систематски грешки.
Поделба на грешки на систематски и случајни во до одреден степенусловно.
Систематски грешки на еден примерок од резултати при разгледување повеќеподатоците може да се претворат во случајни. На пример, систематска грешка предизвикана од неточни отчитувања на инструментите се претвора во случајна грешка при мерење на аналитички сигнал на различни инструменти во различни лаборатории. Пред да разговараме за систематските и случајните грешки подетално, да ги разгледаме концептите - репродуктивност И право.
Репродуктивност го карактеризира степенот на блискост на поединечните дефиниции едни со други, дисперзијата на поединечните резултати во однос на просекот (сл. 2.5).
Сл.2.5. Репродуктивност и точност на хемиската анализа
Во некои случаи, заедно со терминот „репродуктивност“, се користи терминот „конвергенција“.Во овој случај, под конвергенција подразбираме дисперзија на резултатите од паралелни определувања, а под репродуктивност - дисперзија на резултати добиени со различни методи во различни лаборатории, во различно времеи така натаму.
Во право- ова е квалитетот на хемиската анализа, што ја одразува блискоста до нула систематска грешка. Коректноста го карактеризира отстапувањето на добиениот резултат од анализата од вистинската вредност на измерената вредност (види Сл. 2.5).
2.4.1. Систематски грешки
Еден од главните знаци на систематски грешки е дека грешката е предизвикана од трајна причина.
Честопати изворите на систематски и случајни грешки се исти; ајде да разгледаме некои од нив користејќи го примерот на систематски грешки.
Грешки во методот, или инструментални грешки, поврзани со методот и пред сè со инструментот за мерење на аналитичкиот сигнал. Наједноставен пример за грешки од овој тип е грешката при мерење на аналитички вага, што предизвикува систематска грешка во гравиметрискиот метод на анализа.
Така, ако грешката при мерење е ± 0,2 mg, тогаш минималната релативна грешка на гравиметриското определување (со примерок од 1 g) ќе биде 0,02%. Периодичното тестирање на аналитичките инструменти (спектрофотометри, јономери, поларографи, хроматографи итн.) ја минимизира систематската компонента на инструменталните грешки. Бидејќи повеќето методи за анализа користат референтни примероци, грешките во методот често вклучуваат грешки во референтните примероци, особено стандардните примероци, предизвикани од несовпаѓањето помеѓу вистинската и номиналната содржина на компонентата во нив, разликата во вкупниот хемиски состави структурата на анализираниот примерок и споредбениот примерок. Инструменталната грешка обично претставува само мал дел од вкупната грешка во резултатот од хемиската анализа.
Главниот придонес за севкупната грешка е направен од методолошки грешки, утврдени со методот на определување.
Методолошките грешки вклучуваат грешки при земање мостри, претворање на примерокот во форма погодна за анализа (распуштање, фузија, синтерување, пиролиза), грешки во работата на концентрацијата и одвојување на компонентите.
Особено значајни се грешките поврзани со природата. хемиска реакција, што ја формира основата на методот за откривање или идентификување на компонента.
Така, во гравиметријата, ваквите грешки се предизвикани од, иако мала, но забележлива растворливост на таложената форма, процеси на истовремена преципитација, отстапување од строго стехиометрискиот состав на гравиметриската форма итн. Во титриметријата, типична методолошка грешка е грешка на индикаторот што се јавува поради фактот што избраниот За титрација, индикаторот реагира со титрантот или малку порано или малку подоцна од достигнувањето на точката на еквивалентност.
Сите употребени реагенси, вклучително и вода и други растворувачи, не можат да бидат апсолутно чисти, туку содржат одредена количина на нечистотии што го попречуваат одредувањето, честопати вклучувајќи ги и нечистотиите на компонентите што се одредуваат. Ова е т.н реактивна грешка. Грешките од овој тип, како да се воведени однадвор, вклучуваат и грешки предизвикани од загадување на атмосферата, воздухот во работните простории итн.

Сл.2.6. Начин на различна големина на примерокот:
1 - линеарно променлива грешка; 2 - вистинска вредност; 3- постојана грешка
Еден од главните знаци на систематска грешка е тоа што постојанаво сите димензии или промени според постојано оперативен закон. Треба да се забележи дека апсолутните систематски грешки се поделени на независни и зависни од содржината на компонентата што се одредува, т.е. константна (адитив) и пропорционална (мултипликативна). Постојаните грешки вклучуваат, на пример, капки и некои типови на индикаторски грешки во титриметријата, грешки при мерење во гравиметријата; до пропорционален - некои типови на грешки предизвикани од придонесот на интерферентните нечистотии во аналитичкиот сигнал на компонентата што се одредува. На сл. 2.6 ја илустрира промената во исправноста на одредувањето на содржината на компонентата со зголемување на тежината на анализираниот примерок во присуство на постојана и линеарно променлива грешка. Со зголемување на масата на примерокот од анализираната супстанција во присуство на постојана систематска грешка, големината на релативната грешка се намалува (крива 3), а со линеарно променлива систематска грешка, релативната грешка останува константна (крива 1).
При обработката на резултатите од хемиската анализа, систематските грешки мора да се идентификуваат и елиминираат, или барем да се проценат. Еден од начините да се идентификуваат систематските грешки (проверка на исправноста) е различна големина на примерокот. Со удвојување (метод на удвојување) или зголемување на големината на примерокот за повеќекратно, може да се открие постојана систематска грешка со промена на пронајдената содржина на одредената компонента (види Сл. 2.6).
Има и начин “ се воведе -пронајдено" , кога точно позната количинаутврдена компонента. Компонентата мора да се додаде во истата форма во која се наоѓа во предметот што се анализира и да се спроведе низ сите фази на анализата. Во овој случај, компонентата може да се внесе во матрица на примерок што не ја содржи компонентата што се одредува или да се додаде во примерок што содржи точно одредена количина на компонентата. Доколку во последната фаза на анализа внесената количина на компонентата се определи со доволна точност, тогаш резултатот од анализата се смета за точен.
Друг начин да се провери точноста е да се спореди резултатот од анализата со резултатот добиен од друг независен метод. Во исто време, хемичарот мора да биде сигурен дека методот (методологијата) избрана за споредба го дава точниот резултат и е навистина независен, т.е. определувањето на компонентата се заснова на различни принципи. На пример, при проверка на исправноста на определувањето на компонентата со спектрофотометриски метод, препорачливо е да се користи хроматографски, поларографски или потенциометриски метод за споредба, но не и спектрофотометриски метод со користење на друг реагенс.
Општо прифатен метод за оценување на исправноста е стандардна анализа на примерокот. Ова е најмногу сигурен начинидентификација на систематски грешки, сертификација на исправноста на методот на анализа, аналитичка техника, инструмент за мерење на аналитички сигнал. Стандардните примероци се подготвуваат од материјал чиј состав и својства се сигурно утврдени и официјално сертифицирани. Вообичаено, стандардните примероци (за една или повеќе компоненти) се анализираат со многу методи во неколку лаборатории, така што содржината на компонентите наведени во сертификатот за составот на примерокот може да се земе како вистинска вредност. Незаменлив услов за употреба на стандарден примерок при хемиска анализа е максималната сличност во составот и својствата на стандардниот примерок и анализираниот примерок. Кога се користи стандарден примерок за да се процени исправноста на методот или постапката, се вршат повеќе хемиски анализи на примерокот и пронајдената содржина се споредува со вистинската (потврдена) содржина на компонентата што се одредува.
Евалуацијата на исправноста на методот или техниката треба да се изврши за неколку различни содржиниутврдена компонента, односно користење на два или повеќе стандардни примероци. Стандардните примероци се користат не само за проверка на исправноста конечниот резултатопределување на компонентата, но и во поединечни фази на хемиска анализа со цел да се идентификуваат систематските грешки. На пример, стандардните примероци често се користат за да се идентификуваат грешките при земање примероци и подготовка на примероци, систематски инструментални грешки во фазата на мерење на аналитичкиот сигнал.
Во моментов се подготвуваат државни стандардни примероци (примероци од 1-ва категорија) за метали, легури, производи и меѓупроизводи хемиската индустрија, лековиитн. Особено е тешко да се подготват стандардни примероци на сложени (повеќекомпонентни, повеќефазни, временски нестабилни) супстанции: руди, карпи, прехранбени производи, биомаса, еколошки објекти. Во овие случаи, референтните материјали се подготвуваат од вистински предмети со спроведување на повторени, сложени хемиски анализи низ институции, индустрии, па дури и земји (создавање меѓународни референтни материјали).
За да се решат голем број проблеми, вклучително и за проверка на исправноста, се користат стандардни примероци од 2-та категорија, создадени во одредени индустрии Национална економија, научни и производствени организации, посебни лаборатории.
Аналитичките хемичари понекогаш користат сложени или синтетизирани мешавини на веродостојно анализирани хемикалии за да ја тестираат точноста.
Стандардните примероци се користат не само за идентификување систематски грешки и проверка на точноста, туку и како примероци за споредба во на различни начиниопределување на содржина на непозната компонента.
Се зголемува улогата на референтните материјали во аналитичката хемија. Ова се должи на развојот на нови методи за анализа, проширувањето на опсегот на анализирани објекти, комплицираноста на методите за откривање и одредување компоненти, со се повеќе и повеќе високи барањадо исправноста на хемиската анализа.
Откако ќе се идентификува пристрасноста, таа мора да се процени и коригира. Забележете дека нумеричката проценка на систематската грешка може да се изврши само со грешка ограничена со случајни грешки во анализата. При проценка на систематски грешки, грубо може да се разликуваат три типа на грешки.
До првиот типсе однесуваат на грешки од позната природа, кои може да се пресметаат априори пред да се одреди компонентата и да се земат предвид со воведување соодветна корекција. Примери за такви грешки се грешките на индикаторот и грешките во мерењето на волуменот во титриметријата, грешките во мерењето на гравиметрискиот метод на анализа (види Поглавје 9).
До вториот типможе да се припишат на грешки од позната природа, чии вредности може да се проценат при хемиска анализа или при поставување на посебен експеримент. Тие вклучуваат инструментални, реактивни грешки, грешки во одделни фази на хемиска анализа - методолошки грешки. Ако истражувачот може да ги процени грешките на поединечните фази и операции, тогаш, според законот за додавање грешки, тој може да ја пресмета севкупната грешка на резултатот од анализата. Во табелата 2.1 ги прикажува пресметките на апсолутни и релативни грешкинекои функции.
При пресметување на систематски грешки, мора да се разликуваат два важни случаи.
а) Ако се познати и големините и знаците на грешките на поединечните компоненти, тогаш вкупната грешка се пресметува со помош на формулите дадени во колоната Амаса 2.1. Вредноста на вкупната грешка се добива со одреден знак.
б) Ако се познати само максималните можни грешки на поединечните фази (ова е еквивалентно на фактот дека се познати само апсолутните вредности, но не и знаците на овие грешки), тогаш пресметката се прави според формулите наведени во колона бмаса 2.1. Во овој случај, резултатот од пресметката е исто така абсолутна вредностцелосна грешка. релативизација(од англискиот роднина - роднина), кога, под идентични услови, поединечните аналитички операции се вршат на таков начин што систематските грешки се израмнуваат. Така, во титриметријата се земаат аликвоти од стандардни и анализирани раствори со користење на истите пипети, во гравиметријата се мери празен сад и сад со талог на иста вага, со исти тежини итн. Еден од методите за релативизирање на грешките се спроведува контролно искуство(види дел 2.3). Во овој случај, грешките предизвикани од контаминација од реагенси, вода и прибор се израмнети; грешки во фазата на подготовка на примерокот итн.
До третиот типсе однесуваат на грешки од непозната природа, чии вредности се непознати. Овие грешки тешко се идентификуваат и елиминираат. Тие можат да се откријат само по елиминирање на другите систематски грешки и последователно внимателно испитување на сите фази, операции и услови на анализата. Обично во такви случаи се користи техниката рандомизација (од англискиот случаен - случајно) - пренесување на систематски грешки во категоријата случајни. Можноста за рандомизација се заснова на фактот дека систематската грешка на една појава (метод, уред, изведувач на анализа) кога се разгледува во поширока класа на слични појави (група методи, серија уреди, тим аналитичари) станува променлива вредност, т.е., добива карактеристики на случајна грешка и се проценува со помош на методи на математичка статистика.
2.4.2. Случајни грешки
До почетокот на обработката на резултатите од хемиската анализа со методи на математичка статистика, систематските грешки мора да бидат идентификувани и елиминирани или префрлени во категоријата случајни. Притоа, податоците од анализата се случајни променливи со одредена распределба на веројатност. Пред да ја разгледаме проценката на случајните грешки, да се задржиме на два концепта: популација - хипотетичкото множество на сите замисливи исходи од -∞ до +∞; примерок популација (примерок) - реален број ( n ) резултати што ги има истражувачот.
Севкупноста на резултатите од хемиската анализа се подразбира како сите замисливи резултати кои би можеле да се добијат од анализата на истиот објект различни методи, на различни инструменти, од различни аналитичари. Вообичаено, при анализа на истиот објект, имаме 3-7 резултати (популација на примерок). Прашање за близината на параметрите примерок популацијана параметрите на општата популација е поврзана со големината на примерокот и дистрибутивната функција на случајните променливи. По правило, за резултатите од хемиската анализа со n>20-30 со доволен степен на доверливост и со n>50-100 со добра апроксимација, можеме да претпоставиме дека примерокот ја претставува општата популација.
Една од главните задачи на аналитичарот при проценка на случајни грешки во хемиската анализа е да ја пронајде функцијата на дистрибуција која ги опишува експерименталните податоци. Од математичката статистика произлегува дека случајна вредностсе смета за дадена ако е позната неговата дистрибутивна функција. Оваа функција може да се прикаже графички, во форма на алгебарски однос или табела. Се користат функциите на интегрална и диференцијална дистрибуција на случајна променлива. Интегрална функција F(x) - веројатноста дека случајната променлива Xзема каква било вредност помала од некои дадена вредност А:
Диференцијална функцијараспределба на случајна променлива (j(x)или густина на веројатност, се одредува со релацијата
![]()
каде што Dх = x b – x a. Така, густината на веројатноста е дериват на интегралната функција F(x).
Бројни студии покажаа дека поголемиот дел од податоците аналитички дефиницииако постои општ сет на резултати од хемиска анализа, тие се предмет на закон нормална дистрибуција (Гаусова дистрибуција). Густина на веројатност нормален закондистрибуцијата ја има формата

каде m и s 2 - очекуваната вредности дисперзија (константни параметри).
Очекувана вредност (точно) m за континуирана случајна променлива е дадена со интегралот


Таа ја претставува границата кон која се стреми просекот Xсо неограничено зголемување на големината на примерокот. Така, математичкото очекување е, како да е, просечна вредност за населението како целина, поради што понекогаш се нарекува и општ просек. Во отсуство на систематски грешки, математичкото очекување m е еднакво на вистинската вредност x извор
Дисперзијата s 2 го карактеризира расејувањето на случајна променлива во однос на m и се дефинира како математичко очекување на квадратните отстапувања Xод м :

Позитивна варијанса на квадратен корен Аповикани Стандардна девијација а исто така се користи за карактеризирање на расејување на случајна променлива Xво популацијата во однос на м .
Графичка сликанормална дистрибуција на случајна променлива Xприкажано на сл. 2.7. Вид на кривини во форма на ѕвонче, симетрични во однос на вертикална линијапоминувајќи низ м , зависи од количината на варијанса и, според тоа, од стандардната девијација. Повеќе Стандардна девијација, колку кривата станува порамна.
При обработката на податоците од хемиската анализа, обично се користи нормализираниот закон за нормална дистрибуција, кој се добива при движење од вредноста x на вредноста
Бидејќи во овој случај u= 0, и s 2 = 1, потоа изразот (2.1) се трансформира во

Функцијата за кумулативна нормализирана нормална дистрибуција се користи почесто

При обработката на резултатите од повеќе хемиски анализи и придружните случајни грешки, вообичаено е да се дадат два статистички параметри - ширина интервал на доверба, во која може да лежат резултатите индивидуални анализи, и веројатноста за доверба дека тие спаѓаат во овој интервал. Вредностите на функцијата за интегрална дистрибуција (2.2) се претставени во табели, со помош на кои можете да ја најдете веројатноста со која вредноста uнема да надмине поставена вредност. Почесто, при статистичка обработка на податоците, се користат табеларни вредности на интегралот

која се нарекува нормализирана Лапласова функција. Во табелата 2.2 се дадени веројатности за довербасамо за позитивни вредности ти,бидејќи нормализираната нормална распределба е симетрична. За да се најде доверлива веројатност дека случајна променлива (случајна грешка) паѓа во даден интервал, табеларните вредности на веројатност треба да се удвојат. Значи, користејќи ја табелата. 2.2, може да се покаже дека ако случајната грешка при повеќекратна хемиска анализа (вкупниот сет на резултати од хемиската анализа!) не надминува ± s, ± 2sИ ± 3s,тогаш веројатностите за доверба се 0,6826 (0,3413 2); 0,9544 (0,4772 2) и 0,9973 (0,49865 2). Бидејќи , интервалите што се разгледуваат се u=±1, u=±2 и u=±3, соодветно.
Табела 2.2. Вредности на Лапласовата функција
Законот за нормална дистрибуција за обработка на резултатите од хемиската анализа се користи само ако има голем број на податоци (n>50). Податоците од хемиската анализа обично следат нормална дистрибуција. Сепак, треба да се внимава во однос на резултатите добиени со радиохемиски или биолошки методии при анализа на релативно хетерогени примероци. Доколку постои сомнеж за законитоста на примената на законот за нормална распределба, тогаш треба да ги користите различните опишани во специјализирана литератураначини да се утврди дека резултатите од хемиската анализа се распределуваат прецизно според
Одлуката за потребата од одржување на ваква тетратка не дојде веднаш, туку постепено, со акумулацијата на работното искуство.
На почетокот тоа беше место на крајот работна тетратка– неколку страници за запишување на најважните дефиниции. Тогаш таму беа поставени најважните маси. Потоа дојде сознанието дека на повеќето ученици, за да научат да решаваат проблеми, им требаат строги алгоритамски инструкции, кои тие, пред сè, мора да ги разберат и запомнат.
Тогаш е донесена одлука покрај работната тетратка да се задржи уште една задолжителна тетратка по хемија - хемиски речник. За разлика од работните книги, од кои може да има дури и две во едно учебната година, речникот е една тетратка за целиот курс по хемија. Најдобро е оваа тетратка да има 48 листови и издржлив капак.
Материјалот во оваа тетратка го распоредуваме на следниов начин: на почетокот - најважните дефиниции, кои децата ги препишуваат од учебникот или ги запишуваат под диктат на наставникот. На пример, во првиот час во 8-мо одделение, ова е дефиниција за предметот „хемија“, концептот на „хемиски реакции“. Во текот на учебната година во 8-мо одделение се акумулираат повеќе од триесет од нив. Јас спроведувам анкети за овие дефиниции во некои лекции. На пример, усно прашањедолж синџирот, кога еден ученик му поставува прашање на друг, ако одговорил точно, тоа значи дека веќе го поставува следното прашање; или, кога на еден ученик му поставуваат прашања други ученици, ако не може да одговори, тогаш тие сами си одговараат. Во органската хемија ова се главно дефиниции за класи органска материјаи главните концепти, на пример, „хомолози“, „изомери“ итн.
На крајот на нашата референтна книгаМатеријалот е претставен во форма на табели и дијаграми. На последната страница е првата табела „Хемиски елементи. Хемиски знаци" Потоа табелите „Валентност“, „Киселини“, „Индикатори“, „Електрохемиска серија на метални напони“, „Серија на електронегативност“.
Особено сакам да се задржам на содржината на табелата „Соодветност на киселини со киселински оксиди“:
| Кореспонденција на киселините со киселинските оксиди | ||||
| Киселински оксид | Киселина | |||
| Име | Формула | Име | Формула | Остатоци од киселина, валентност |
| јаглерод (II) моноксид | CO2 | јаглен | H2CO3 | CO3 (II) |
| сулфур(IV) оксид | SO 2 | сулфурна | H2SO3 | SO3(II) |
| сулфур(VI) оксид | СО 3 | сулфурна | H2SO4 | SO 4 (II) |
| силициум (IV) оксид | SiO2 | силикон | H2SiO3 | SiO3 (II) |
| азотен оксид (V) | N2O5 | азот | HNO3 | NO 3 (I) |
| фосфор (V) оксид | P2O5 | фосфор | H3PO4 | PO 4 (III) |
Без разбирање и меморирање на оваа табела, на учениците од осмо одделение им станува тешко да состават равенки за реакција киселински оксидисо алкалии.
Кога ја проучуваме теоријата на електролитичка дисоцијација, на крајот од тетратката запишуваме дијаграми и правила.
Правила за составување јонски равенки:
1. Формулите на силни електролити растворливи во вода се запишани во форма на јони.
2. Напиши ги формулите на едноставни материи, оксиди, слаби електролитии сите нерастворливи материи.
3. Формулите на слабо растворливи материи на левата страна на равенката се напишани во јонска форма, на десната - во молекуларна форма.
При студирањето органска хемијаВо речникот пишуваме општи табели за јаглеводороди, класи на супстанции што содржат кислород и азот, дијаграми за генетски врски.
| Физички количини | |||
| Означување | Име | Единици | Формули |
| количина на супстанција | крт | = N / N A; = m / M; V / V m (за гасови) |
|
| Н А | Константа на Авогадро | молекули, атоми и други честички | N A = 6,02 10 23 |
| Н | број на честички | молекули, атоми и други честички |
N = N A |
| М | моларна маса | g/mol, kg/kmol | M = m /; /М/ = М р |
| м | Тежина | g, kg | m = M; m = V |
| V m | моларен волуменгас | l/mol, m 3/kmol | Vm = 22,4 l / mol = 22,4 m 3 / kmol |
| В | волумен | л, м 3 | V = V m (за гасови); |
| густина | g/ml; | =m/V; M / V m (за гасови) |
|
Над 25 - летен периоднастава по хемија на училиште морав да работам различни програмии учебници. Во исто време, секогаш беше изненадувачки што практично ниту еден учебник не учи како да се решаваат проблемите. На почетокот на студирањето хемија, за систематизирање и консолидирање на знаењето во речникот, моите студенти и јас составуваме табела „Физички величини“ со нови количини:
Кога ги учи учениците како да решаваат проблеми со пресметкатаПридавам големо значење на алгоритмите. Верувам дека строгите упатства за редоследот на дејствата му овозможуваат на слабиот ученик да го разбере решението на проблемите од одреден тип. За силни студенти- ова е можност да го достигнете креативното ниво на вашата иднина хемиско образованиеи самообразование, бидејќи прво треба самоуверено да совладате релативно мал број стандардни техники. Врз основа на ова, способноста правилно да се применат во различни фази на решавање повеќе сложени задачи. Затоа, составив алгоритми за решавање на пресметковни проблеми за сите видови проблеми. училишен курси за воннаставни активности.
Ќе дадам примери за некои од нив.
Алгоритам за решавање проблеми со помош на хемиски равенки.
1. Накратко запиши ги условите на задачата и состави хемиска равенка.
2. Запишете ги податоците за задачата над формулите во хемиската равенка и запишете го бројот на молови под формулите (одреден со коефициентот).
3. Најдете ја количината на супстанција, чија маса или волумен е дадена во изјавата за проблемот, користејќи ги формулите:
М/М; = V / V m (за гасови V m = 22,4 l / mol).
Напишете го добиениот број над формулата во равенката.
4. Најдете ја количината на супстанција чија маса или волумен се непознати. За да го направите ова, резонирајте според равенката: споредете го бројот на бенки според состојбата со бројот на молови според равенката. Доколку е потребно, направете пропорција.
5. Најдете ја масата или волуменот користејќи ги формулите: m = M; V = Vm.
Овој алгоритам е основата која ученикот мора да ја совлада за во иднина да може да решава проблеми користејќи равенки со различни компликации.
Проблеми со вишок и недостаток.
Ако во проблематичните услови се познати количините, масите или волумените на две супстанци кои реагираат одеднаш, тогаш ова е проблем со вишок и недостаток.
Кога го решавате:
1. Треба да ги пронајдете количините на две супстанци кои реагираат користејќи ги формулите:
М/М; = V/V m.
2. Напиши ги добиените молови броеви над равенката. Споредувајќи ги со бројот на молови според равенката, извлечете заклучок за тоа која супстанција е дадена во недостаток.
3. Врз основа на недостатокот, направете дополнителни пресметки.
Проблеми на фракцијата на приносот на производот на реакцијата практично добиени од теоретски можното.
Со помош на равенките на реакцијата се вршат теоретски пресметки и се наоѓаат теоретски податоци за реакциониот производ: теор. , м теоре. или V теорија. . При спроведување на реакции во лабораторија или во индустријата, се случуваат загуби, така што практичните податоци добиени се практични. ,
м пракса. или V практични. секогаш помалку од теоретски пресметаните податоци. Уделот на приносот е означен со буквата (ета) и се пресметува со помош на формулите:
(ова) = практично. / теорија = m вежбај. / m теорија. = V практични / V теорија.
Се изразува како дел од единица или како процент. Може да се разликуваат три типа на задачи:
Ако во изјавата за проблемот се познати податоците за почетната супстанција и делот од приносот на производот од реакцијата, тогаш треба да најдете практично решение. , m практично или V практични. производ за реакција.
Постапка за решение:
1. Направете пресметка користејќи ја равенката врз основа на податоците за почетната супстанција, најдете ја теоријата. , м теоре. или V теорија. производ за реакција;
2. Најдете ја масата или волуменот на производот од реакцијата практично добиен со помош на формулите:
м пракса. = m теоретски ; V практични = V теорија. ; вежбајте. = теоретски .
Ако во изјавата за проблемот се познати податоците за почетната супстанција и практиката. , m практично или V практични. добиениот производ, и треба да ја пронајдете фракцијата на принос на производот на реакцијата.
Постапка за решение:
1. Пресметајте со помош на равенката врз основа на податоците за почетната супстанција, најдете
Теорет. , м теоре. или V теорија. производ за реакција.
2. Најдете ја фракцијата на пропустливост на производот од реакцијата користејќи ги формулите:
Вежбајте. / теорија = m вежбај. / m теорија. = V практични /V теорија.
Ако во проблематичните услови се познати практичните услови. , m практично или V практични. добиениот производ на реакција и неговата фракција на принос, додека треба да најдете податоци за почетната супстанција.
Постапка за решение:
1. Најдете теорија, м теорија. или V теорија. производ на реакција според формулите:
Теорет. = практично / ; m theor. = m вежбај. / ; V теорија. = V практични / .
2. Вршете пресметки користејќи ја равенката заснована на теоријата. , м теоре. или V теорија. производ на реакцијата и пронајдете ги податоците за почетната супстанција.
Се разбира, овие три типа проблеми ги разгледуваме постепено, практикувајќи ги вештините за решавање на секој од нив користејќи го примерот на голем број проблеми.
Проблеми со мешавини и нечистотии.

Чиста материја е онаа што ја има повеќе во смесата, останатите се нечистотии. Ознаки: маса на смеса – m cm, маса чиста супстанција– m p.h., маса на нечистотии – m прибл. , масен удел на чиста супстанција - p.h.
Масен удел на чиста супстанција се наоѓа со помош на формулата: p.h. = m h.v. / m cm, се изразува во фракции од еден или како процент. Да разликуваме 2 типа задачи.
Ако изјавата за проблемот го дава масениот удел на чиста супстанција или масениот удел на нечистотии, тогаш се дава масата на смесата. Зборот „технички“ значи и присуство на мешавина.
Постапка за решение:
1. Најдете ја масата на чистата супстанција со формулата: m h.v. = ж.в. m cm
Ако е даден масениот удел на нечистотии, тогаш прво треба да го пронајдете масениот удел на чистата супстанција: p.h. = 1 - прибл.
2. Врз основа на масата на чистата супстанција, направете дополнителни пресметки користејќи ја равенката.
Ако изјавата за проблемот ја дава масата на почетната смеса и n, m или V на производот од реакцијата, тогаш треба да ја пронајдете масената фракција на чистата супстанција во почетната смеса или масениот удел на нечистотиите во неа.
Постапка за решение:
1. Пресметај со помош на равенката врз основа на податоците за производот од реакцијата и најде n p.v. и м х.в.
2. Најдете го масениот удел на чистата супстанција во смесата користејќи ја формулата: p.h. = m h.v. / m види и масен дел од нечистотии: прибл. = 1 - ж.в
Закон волуметриски односигасови
Волуменот на гасовите се поврзани на ист начин како и нивните количини на супстанции:
V 1 / V 2 = 1 / 2
Овој закон се користи кога се решаваат проблеми со помош на равенки во кои е даден волуменот на гасот и треба да се најде волуменот на друг гас.
Волуменска фракција на гас во смесата.
Vg / Vcm, каде што (phi) е волуменскиот дел на гасот.
Vg – волумен на гас, Vcm – волумен на гасна смеса.
Ако волуменската фракција на гасот и волуменот на смесата се дадени во изјавата за проблемот, тогаш, пред сè, треба да го пронајдете волуменот на гасот: Vg = Vcm.
Волуменот на мешавината на гас се наоѓа со помош на формулата: Vcm = Vg /.
Волуменот на воздух потрошен за согорување на супстанција се наоѓа преку волуменот на кислород пронајден со равенката:
Ваир = V(O 2) / 0,21
Изведување на формули на органски материи со користење на општи формули.
Органските материи формираат хомологни серии кои имаат општи формули. Ова овозможува:
1. Изрази ја релативната молекуларна тежина во однос на бројот n.
M r (C n H 2n + 2) = 12 n + 1 (2n + 2) = 14n + 2.
2. Изедначете го M r, изразено преку n, со вистинското M r и најдете n.
3. Нацртај равенки за реакција во општ погледи изврши пресметки на нив.
Изведување формули на супстанции врз основа на производи за согорување.
1. Анализирајте го составот на производите за согорување и извлечете заклучок за квалитетен составизгорена супстанција: H 2 O -> H, CO 2 -> C, SO 2 -> S, P 2 O 5 -> P, Na 2 CO 3 -> Na, C.
Присуството на кислород во супстанцијата бара верификација. Означете ги индексите во формулата со x, y, z. На пример, CxHyOz (?).
2. Најдете ја количината на супстанции во производите за согорување користејќи ги формулите:
n = m / M и n = V / Vm.
3. Најдете ги количините на елементи содржани во изгорената супстанција. На пример:
Претворете ги броевите во цели броеви делејќи ги со најмалите.
Напишете ја вистинската формула.
Изведување на формули на супстанции врз основа на масените фракции на елементите.
1. Напишете формула, означувајќи ги индексите како x, y, z.
2. Најдете го односот на индексите; за да го направите ова, поделете го масениот удел на секој елемент со неговата атомска маса: x: y: z = 1 / Ar 1: 2 / Ar 2: 3 / Ar 3.
3. Намалете ги добиените броеви на цели броеви делејќи ги со најмалиот од нив. Доколку е потребно, по делењето, помножете се со 2, 3, 4, 5.
Овој метод на решение ја одредува наједноставната формула. За повеќето неоргански материи се совпаѓа со вистинската, за органските материи е обратно.
Изведување формули на супстанции врз основа на масените фракции на елементите, доколку се познати податоците за пронаоѓање на моларната маса на супстанцијата.
Најдете ја моларната маса на супстанцијата користејќи ги формулите:
а) ако е позната густината на гасот: M = Vm = g / l 22,4 l / mol; r = m/V.
б) ако се знае релативна густина: M 1 = D 2 M 2, M = D H2 2, M = D O2 32,
M = D воздух 29, M = D N2 28, итн.
Метод 1: најдете наједноставната формуласупстанции (види претходниот алгоритам) и наједноставната моларна маса. Потоа споредете ја вистинската моларна маса со наједноставната и зголемете ги индексите во формулата за потребниот број пати.
Метод 2: најдете ги индексите користејќи ја формулата n = (e) Mr / Ar(e).
Ако масениот удел на еден од елементите е непознат, тогаш треба да се најде. За да го направите ова, одземете го масениот удел на другиот елемент од 100% или од единството.
Постепено, во текот на изучувањето на хемијата, алгоритмите за решавање проблеми се акумулираат во хемискиот речник различни типови. А ученикот секогаш знае каде да најде потребната формулаили потребните информации за решавање на некој проблем.
Многу студенти сакаат да чуваат таква тетратка, тие самите ја дополнуваат со разни референтни материјали.
Што се однесува до воннаставните активности, јас и моите ученици имаме и посебна тетратка за снимање алгоритми за решавање на проблеми кои надминуваат училишна наставна програма. Во истата тетратка за секој тип на проблем запишуваме по 1-2 примери, а останатите задачи ги решаваат во друга тетратка. И, ако размислите за тоа, меѓу илјадниците различни проблеми што се појавуваат на испитот по хемија на сите универзитети, можете да идентификувате 25 - 30 различни видови проблеми. Се разбира, има многу варијации меѓу нив.
Во развојот на алгоритми за решавање проблеми во изборните часови, многу ми помогна прирачникот на А.А. Кушнарева. (Учење за решавање проблеми по хемија, - М., Училиште - прес, 1996).
Способноста за решавање проблеми во хемијата е главниот критериум за креативно совладување на предметот. Тоа е преку решавање на проблеми различни нивоакомплексноста, курсот по хемија може ефективно да се совлада.
Доколку студентот има јасно разбирање за сите можни видови проблеми и има решено голем број проблеми од секој тип, тогаш тој ќе може да се справи со испитот по хемија во форма на обединет државен испит и при влез на универзитети.
