Во лекција 5“ Хемиска формула„од курсот“ Хемија за кукли„Ќе ги дефинираме хемиските формули и нивните индекси, а исто така ќе ги откриеме разликите помеѓу хемиските формули на супстанции со молекуларна и немолекуларна структура. Да ве потсетам дека во последната лекција „“ ги дефиниравме хемиските соединенија, ги разгледавме разликите помеѓу органските и неорганските соединенија, а исто така откривме што значи квалитативен и квантитативен состав.
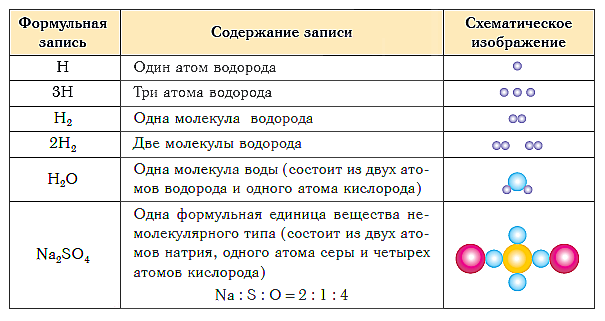
Составот на која било супстанција се изразува како хемиска формула.
Хемиска формулае конвенционална нотација на составот на супстанцијата со користење на хемиски симболи и индекси.
Квалитативниот состав е прикажан со помош на знаците (симболите) на хемиските елементи, а квантитативниот состав - со помош на индекси кои се запишани десно и веднаш под знаците на хемиските елементи.
Индекс- бројот на атоми на даден хемиски елемент во формулата на супстанцијата.
На пример, хемиската формула на едноставната супстанција водород е напишана на следниов начин:
и гласи „пепел-два“.
Хемиски формули на супстанции со молекуларна структура
Формули на диатомски молекули: кислород - O 2 („о-два“), хлор - Cl 2 („хлор-два“), азот - N 2 („ен-два“). Триатомската молекула на озон и молекулата на сулфур со осум атомски се означени со формулите O 3 („о-три“) и S 8 („es-осум“).
Формулите на молекулите на сложените супстанции исто така го одразуваат нивниот квалитативен и квантитативен состав. На пример, формулата на водата, како што веројатно веќе добро знаете, е H 2 O („пепел-два-о“), метанот е CH4 („це-пепел-четири“), а амонијакот е NH 3 (“ ен- пепел-три“). Формулите на сите сложени супстанции се читаат на ист начин. На пример, формулата на сулфурна киселина е H 2 SO 4 („пепел-два-е-о-четири“), а онаа на гликозата е C 6 H 12 O 6 („tse-six-пепел-дванаесет-о- шест“).
Хемиски формули на супстанции со молекуларна структура (тие се нарекуваат молекуларни формули) прикажете го составот на елементарните делови, т.е., конвенционалните „тули“ од кои се составени овие супстанции. Ваквите елементарни компоненти ( елементарни структурни единици, или едноставно структурни единици) во овој случај се молекули.
Што ако супстанцијата има немолекуларна структура? Хемиските формули на едноставни супстанции од овој тип (на пример, метали) се пишуваат едноставно со знаците на соодветните елементи без подлоги (или, поточно, со индекс еднаков на еден, кој не е запишан). Така, формулата на едноставната супстанција на железо е Fe, бакар е Cu, алуминиум е Al.
Составот на сложените супстанции со немолекуларна структура се изразува со помош на формули кои покажуваат наједноставен однос на атомски броевиразлични хемиски елементи во овие супстанции. Таквите формули се нарекуваат наједноставниот. На пример, наједноставната формула за кварц - главната компонента на речен песок - е SiO 2. Покажува дека во кварцниот кристал има два атоми кислород по атом на силициум, т.е. наједноставниот однос на бројот на атоми на силициум и кислород во оваа супстанца е 1:2. Наједноставната формула Al 2 O 3 покажува дека во ова соединение наједноставниот однос помеѓу бројот на атоми на алуминиум и кислород е 2:3.
Група атоми чиј состав одговара на наједноставната формула на супстанција со немолекуларна структура се нарекува нејзина формула единица.
Единицата за формула, кујнска сол NaCl („натриум хлор“) е група од еден атом на натриум и еден атом на хлор. Единицата за формула со креда CaCO 3 („калциум-це-о-три“) е група од еден атом на калциум, еден јаглероден атом и три атоми на кислород.
Слично се читаат формулите на посложени соединенија со немолекуларна структура. Дополнително, означен е само бројот на групи на атоми затворени во загради: Al 2 (SO 4) 3 („алуминиум-два-е-о-четири-три пати“), Mg(NO 3) 2 („магнезиум-ен -о-три -двапати") итн.
Така, структурни единици на супстанции молекуларна структурасе молекули. Структурни единици на супстанции немолекуларна структурасе нивни формула единици .
Табелата подолу ја прикажува формулата за нотација и шематски приказ на составот на супстанции од различни видови.
Кратки заклучоци од лекцијата:
- Квалитативниот и квантитативниот состав на супстанцијата се изразува со користење на хемиски формули.
- Хемиската формула на супстанција со молекуларна структура го покажува составот на нејзината молекула, која е елементарна структурна единица на оваа супстанца.
- Хемиската формула на супстанција со немолекуларна структура го покажува наједноставниот однос на атомите во нејзината формула единица.
Надеж лекција 5" Хемиска формула„Беше јасно и информативно. Ако имате какви било прашања, напишете ги во коментарите.
Класификацијата на неорганските материи и нивната номенклатура се заснова на наједноставната и најконстантна карактеристика со текот на времето - хемиски состав, кој ги прикажува атомите на елементите кои формираат дадена супстанција во нивниот нумерички однос. Ако супстанцијата е составена од еден атом, т.е. е форма на постоење на овој елемент во слободна форма, тогаш тој се нарекува едноставен супстанција; ако супстанцијата е составена од атоми на два или повеќе елементи, тогаш се нарекува комплексна супстанција. Обично се нарекуваат сите едноставни материи (освен монатомските) и сите сложени материи хемиски соединенија, бидејќи во нив атомите на еден или различни елементи се поврзани едни со други со хемиски врски.
Номенклатурата на неоргански материи се состои од формули и имиња. Хемиска формула - приказ на составот на супстанцијата со помош на симболи на хемиски елементи, нумерички индекси и некои други знаци. Хемиско име - слика на составот на супстанција со користење на збор или група зборови. Конструкцијата на хемиските формули и имиња се одредува според системот правила за номенклатура.
Симболите и имињата на хемиските елементи се дадени во Периодниот систем на елементи од Д.И. Менделеев. Елементите се конвенционално поделени на метали И неметали . Неметалите ги вклучуваат сите елементи од групата VIIIA (благородни гасови) и групата VIIA (халогени), елементи од групата VIA (освен полониум), елементите азот, фосфор, арсен (VA група); јаглерод, силициум (IVA група); бор (IIIA група), како и водород. Останатите елементи се класифицирани како метали.
При составување на имињата на супстанциите, обично се користат руски имиња на елементи, на пример, диоксиген, ксенон дифлуорид, калиум селенат. Традиционално, за некои елементи, корените на нивните латински имиња се воведуваат во деривативни термини:
На пример: карбонат, манганат, оксид, сулфид, силикат.
Наслови едноставни материисе состои од еден збор - име на хемиски елемент со нумерички префикс, на пример:
 Се користат следните нумерички префикси:
Се користат следните нумерички префикси:
 Неопределен број се означува со нумерички префикс n- поли.
Неопределен број се означува со нумерички префикс n- поли.
За некои едноставни материи користат и посебенимиња како што се О 3 - озон, П 4 - бел фосфор.
Хемиски формули комплексни супстанциисоставена од ознаката електропозитивни(условни и реални катјони) и електронегативни(условни и реални анјони) компоненти, на пример, CuSO 4 (тука Cu 2+ е реален катјон, SO 4 2- е реален анјон) и PCl 3 (тука P +III е условен катјон, Cl-I е условен анјон).
Наслови комплексни супстанциисоставена според хемиските формули од десно кон лево. Тие се составени од два збора - имиња на електронегативни компоненти (во номинативен случај) и електропозитивни компоненти (во генитив), на пример:
CuSO 4 - бакар (II) сулфат
PCl 3 - фосфор трихлорид
LaCl 3 - лантан (III) хлорид
CO - јаглерод моноксид
Бројот на електропозитивни и електронегативни компоненти во имињата се означува со нумеричките префикси дадени погоре (универзален метод) или со состојби на оксидација (ако може да се одредат со формулата) користејќи римски бројки во загради (знакот плус е испуштен). Во некои случаи, полнењето на јоните се дава (за катјони и анјони со сложен состав), користејќи арапски бројки со соодветниот знак.
Следниве специјални имиња се користат за обични повеќеелементни катјони и анјони:
Се користи и за мал број добро познати материи посебеннаслови:
![]() 1. Киселински и базни хидроксиди. Соли
1. Киселински и базни хидроксиди. Соли
Хидроксидите се вид на сложени супстанции кои содржат атоми на некој елемент Е (освен флуор и кислород) и хидроксилни групи OH; општа формула на хидроксиди E(OH) n, Каде n= 1÷6. Форма на хидроксиди E(OH) n повикани орто-облик; на n> 2 хидроксид, исто така, може да се најде во мета-форма, која вклучува, покрај E атомите и OH групите, атоми на кислород O, на пример E(OH) 3 и EO(OH), E(OH) 4 и E(OH) 6 и EO 2 (OH) 2 .
Хидроксидите се поделени во две групи со спротивни хемиски својства: кисели и базни хидроксиди.
^ Кисели хидроксиди содржат атоми на водород, кои можат да се заменат со метални атоми кои подлежат на правилото за стехиометриска валентност. Повеќето киселински хидроксиди се наоѓаат во мета-форма, а атомите на водород во формулите на киселите хидроксиди се дадени на прво место, на пример, H 2 SO 4, HNO 3 и H 2 CO 3, а не SO 2 (OH) 2, NO 2 (OH) и CO ( OH) 2. Општата формула на киселинските хидроксиди е H XЕО на, каде што електронегативната компонента ЕО на X-наречен киселински остаток. Ако сите атоми на водород не се заменат со метал, тогаш тие остануваат како дел од киселинскиот остаток.
Имињата на обичните киселински хидроксиди се состојат од два збора: вистинското име со завршетокот „аја“ и групен збор „киселина“. Еве ги формулите и соодветните имиња на вообичаените киселински хидроксиди и нивните кисели остатоци (цртичка значи дека хидроксидот не е познат во слободна форма или во кисел воден раствор):
Помалку вообичаените киселински хидроксиди се именувани според номенклатурните правила за сложени соединенија, на пример:
 Имињата на киселинските остатоци се користат за да се конструираат имињата на солите.
Имињата на киселинските остатоци се користат за да се конструираат имињата на солите.
^ Основни хидроксиди содржат јони на хидроксид, кои можат да се заменат со киселински остатоци кои подлежат на правилото за стехиометриска валентност. Сите основни хидроксиди се наоѓаат во орто-облик; нивната општа формула е M(OH) n, Каде n= 1,2 (поретко 3,4) и М n+ - метален катјон. Примери на формули и имиња на основни хидроксиди:
 Најважната хемиска особина на базичните и киселинските хидроксиди е нивната интеракција едни со други за да формираат соли ( реакција на формирање на сол), На пример:
Најважната хемиска особина на базичните и киселинските хидроксиди е нивната интеракција едни со други за да формираат соли ( реакција на формирање на сол), На пример:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O
Ca(OH) 2 + 2H 2 SO 4 = Ca (HSO 4) 2 + 2H 2 O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Солите се еден вид сложени материи кои содржат М катјони n+ и киселински остатоци*.
Соли со општа формула М X(ЕО на) nповикани просек соли и соли со несупституирани атоми на водород - киселосоли. Понекогаш солите содржат и хидроксид и/или оксидни јони; таквите соли се нарекуваат главенсоли. Еве примери и имиња на соли:
 Киселините и базните соли може да се претворат во средни соли со реакција со соодветниот основен и кисел хидроксид, на пример:
Киселините и базните соли може да се претворат во средни соли со реакција со соодветниот основен и кисел хидроксид, на пример:
Ca(HSO4)2 + Ca(OH) = CaSO4 + 2H2O
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = Ca 2 SO 4 + 2H 2 O
Исто така, постојат соли кои содржат два различни катјони: тие често се нарекуваат двојни соли, На пример:
 2. Киселински и базни оксиди
2. Киселински и базни оксиди
Оксиди Е XЗА на- производи за целосна дехидрација на хидроксиди:
 Киселини хидроксиди (H 2 SO 4, H 2 CO 3) киселинските оксиди одговараат(SO 3, CO 2) и базични хидроксиди (NaOH, Ca(OH) 2) - основни оксиди(Na 2 O, CaO), а состојбата на оксидација на елементот Е не се менува кога се движи од хидроксид во оксид. Пример за формули и имиња на оксиди:
Киселини хидроксиди (H 2 SO 4, H 2 CO 3) киселинските оксиди одговараат(SO 3, CO 2) и базични хидроксиди (NaOH, Ca(OH) 2) - основни оксиди(Na 2 O, CaO), а состојбата на оксидација на елементот Е не се менува кога се движи од хидроксид во оксид. Пример за формули и имиња на оксиди:
 Киселините и базните оксиди ги задржуваат својствата за формирање сол на соодветните хидроксиди кога се во интеракција со хидроксиди со спротивни својства или едни со други:
Киселините и базните оксиди ги задржуваат својствата за формирање сол на соодветните хидроксиди кога се во интеракција со хидроксиди со спротивни својства или едни со други:
N 2 O 5 + 2NaOH = 2NaNO 3 + H 2 O
3CaO + 2H 3 PO 4 = Ca 3 (PO 4) 2 + 3H 2 O
La 2 O 3 + 3SO 3 = La 2 (SO 4) 3
^ 3. Амфотерични оксиди и хидроксиди
Амфотеричностхидроксиди и оксиди - хемиско својство кое се состои во формирање на два реда соли од нив, на пример, за алуминиум хидроксид и алуминиум оксид:
(а) 2Al(OH) 3 + 3SO 3 = Al 2 (SO 4) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2 O
(б) 2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
Така, алуминиум хидроксид и оксид во реакциите (а) ги покажуваат својствата главенхидроксиди и оксиди, т.е. реагираат со кисели хидроксиди и оксид, формирајќи ја соодветната сол - алуминиум сулфат Al 2 (SO 4) 3, додека во реакциите (б) тие исто така покажуваат својства киселахидроксиди и оксиди, т.е. реагираат со основен хидроксид и оксид, формирајќи сол - натриум диоксоалуминат (III) NaAlO 2. Во првиот случај, елементот алуминиум покажува својство на метал и е дел од електропозитивната компонента (Al 3+), во вториот - својство на неметал и е дел од електронегативната компонента на формулата за сол ( AlO 2 -).
Ако овие реакции се појават во воден раствор, тогаш составот на добиените соли се менува, но присуството на алуминиум во катјонот и анјонот останува:
2Al(OH) 3 + 3H 2 SO 4 = 2 (SO 4) 3
Al(OH) 3 + NaOH = Na
Овде, сложените јони 3+ - хексаквалуминиум(III) катјон, - - тетрахидроксоалуминат(III) јон се означени во квадратни загради.
Елементите кои покажуваат метални и неметални својства во соединенијата се нарекуваат амфотерични, тие вклучуваат елементи од А-групите на периодниот систем - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po итн., како како и повеќето елементи од Б-групите - Cr, Mn, Fe, Zn, Cd, Au итн. Амфотерските оксиди се нарекуваат исто како и основните, на пример:
 Во орто- или (и) мета- форма. Еве примери на амфотерни хидроксиди:
Во орто- или (и) мета- форма. Еве примери на амфотерни хидроксиди:
 Амфотерните оксиди не секогаш одговараат на амфотерните хидроксиди, бидејќи при обидот да се добие второто, се формираат хидрирани оксиди, на пример:
Амфотерните оксиди не секогаш одговараат на амфотерните хидроксиди, бидејќи при обидот да се добие второто, се формираат хидрирани оксиди, на пример:
 Ако амфотеричен елемент во соединението има неколку оксидациски состојби, тогаш амфотеричноста на соодветните оксиди и хидроксиди (и, следствено, амфотеричноста на самиот елемент) ќе се изрази поинаку. За ниски оксидациони состојби, хидроксидите и оксидите имаат доминација на основни својства, а самиот елемент има метални својства, така што речиси секогаш е вклучен во составот на катјоните. За високи оксидациски состојби, напротив, хидроксидите и оксидите имаат доминација на киселински својства, а самиот елемент има неметални својства, така што речиси секогаш е вклучен во составот на анјоните. Така, манган (II) оксид и хидроксид имаат доминантни основни својства, а самиот манган е дел од катјоните од типот 2+, додека манган (VII) оксидот и хидроксидот имаат доминантни киселински својства, а самиот манган е дел од MnO 4 - тип анјон.. На амфотерните хидроксиди со висока доминација на киселински својства им се доделуваат формули и имиња моделирани по кисели хидроксиди, на пример HMn VII O 4 - манганова киселина.
Ако амфотеричен елемент во соединението има неколку оксидациски состојби, тогаш амфотеричноста на соодветните оксиди и хидроксиди (и, следствено, амфотеричноста на самиот елемент) ќе се изрази поинаку. За ниски оксидациони состојби, хидроксидите и оксидите имаат доминација на основни својства, а самиот елемент има метални својства, така што речиси секогаш е вклучен во составот на катјоните. За високи оксидациски состојби, напротив, хидроксидите и оксидите имаат доминација на киселински својства, а самиот елемент има неметални својства, така што речиси секогаш е вклучен во составот на анјоните. Така, манган (II) оксид и хидроксид имаат доминантни основни својства, а самиот манган е дел од катјоните од типот 2+, додека манган (VII) оксидот и хидроксидот имаат доминантни киселински својства, а самиот манган е дел од MnO 4 - тип анјон.. На амфотерните хидроксиди со висока доминација на киселински својства им се доделуваат формули и имиња моделирани по кисели хидроксиди, на пример HMn VII O 4 - манганова киселина.
Така, поделбата на елементите на метали и неметали е условена; Помеѓу елементите (Na, K, Ca, Ba итн.) со чисто метални својства и елементите (F, O, N, Cl, S, C итн.) со чисто неметални својства, постои голема група. на елементи со амфотерични својства.
4. Бинарни соединенија
Широк тип на неоргански комплексни супстанции се бинарни соединенија. Тие ги вклучуваат, пред сè, сите соединенија со два елементи (освен базни, кисели и амфотерни оксиди), на пример H 2 O, KBr, H 2 S, Cs 2 (S 2), N 2 O, NH 3, HN 3, CaC2, SiH4. Електропозитивните и електронегативните компоненти на формулите на овие соединенија вклучуваат поединечни атоми или врзани групи на атоми од истиот елемент.
Повеќеелементните супстанции, во чии формули една од компонентите содржи неповрзани атоми на неколку елементи, како и едноелементни или повеќеелементни групи на атоми (освен хидроксиди и соли), се сметаат како бинарни соединенија, на пример CSO, IO 2 F 3, SBrO 2 F, CrO (O 2) 2, PSI 3, (CaTi) O 3, (FeCu) S 2, Hg (CN) 2, (PF 3) 2 O, VCl 2 (NH 2). Така, CSO може да се претстави како CS 2 соединение во кое еден атом на сулфур е заменет со атом на кислород.
Имињата на бинарните соединенија се конструирани според вообичаените правила за номенклатура, на пример:
 За некои бинарни соединенија се користат специјални имиња, чиј список беше даден претходно.
За некои бинарни соединенија се користат специјални имиња, чиј список беше даден претходно.
Хемиските својства на бинарните соединенија се доста разновидни, така што тие често се поделени во групи по име на анјони, т.е. Одделно се разгледуваат халидите, халкогенидите, нитридите, карбидите, хидридите и др.. Меѓу бинарните соединенија има и такви кои имаат некои карактеристики на други видови неоргански материи. Така, соединенијата CO, NO, NO 2 и (Fe II Fe 2 III) O 4, чии имиња се конструирани со зборот оксид, не можат да се класифицираат како оксиди (кисели, базични, амфотерни). Јаглерод моноксид CO, азот моноксид NO и азот диоксид NO 2 немаат соодветни киселински хидроксиди (иако овие оксиди се формираат од неметали C и N), ниту пак формираат соли чии анјони би ги вклучиле атомите C II, N II и N IV. Двоен оксид (Fe II Fe 2 III) O 4 - дијрон(III)-железо(II) оксид, иако содржи атоми на амфотерниот елемент - железо во електропозитивната компонента, но во две различни состојби на оксидација, како резултат на што , при интеракција со киселински хидроксиди, формира не една, туку две различни соли.
Бинарни соединенија како AgF, KBr, Na 2 S, Ba(HS) 2, NaCN, NH 4 Cl и Pb(N 3) 2 се изградени, како соли, од вистински катјони и анјони, поради што се наречени сол-како бинарни соединенија (или едноставно соли). Тие може да се сметаат како производи на замена на атоми на водород во соединенијата HF, HCl, HBr, H 2 S, HCN и HN 3. Вторите во воден раствор имаат кисела функција и затоа нивните раствори се нарекуваат киселини, на пример HF (аква) - флуороводородна киселина, H 2 S (аква) - хидросулфидна киселина. Сепак, тие не припаѓаат на типот на киселински хидроксиди, а нивните деривати не припаѓаат на солите во класификацијата на неоргански материи.
ТЕСТ ПО ХЕМИЈА
14. Која количина на Cr(OH) 3 содржи ист број еквиваленти како и 174,96 g Mg(OH) 2?
Моларната маса на магнезиум хидроксид е 58,32 g/mol, а еквивалентната маса е 29,16 g/mol. Затоа, масата на магнезиум хидроксид од 174,96 g содржи 174,96 g: 29,16 g/mol = 6 mol-equiv.
Моларната маса на еквивалентот на хром хидроксид (III) е 1/3 M Cr(OH)3 или 34,34 g/mol, а 6 mol-equiv од оваа супстанца ќе бидат 34,33 g/mol x 6 mol = 205,98 g.
Така, 205,98 g Cr(OH)3 содржи ист број на еквиваленти како и 174,96 g Mg(OH)2.
34. Колку и какви вредности може да земе магнетниот квантен број m l со орбиталниот квантен број l=0,1,2,3? Кои елементи во периодниот систем се нарекуваат елементи s-, p-, d-, f-? Наведи примери
Бројот на вредности на магнетниот квантен број зависи од орбиталниот квантен број и е еднаков на
(21 + 1), каде што 1 е орбиталниот квантен број. Затоа, кога l=0 m л =0,
на l=1 m лзема вредности -1,0, +1;
на 1=2 м лзема вредности -2,-1, 0,+1,+2;
на = 3м лможе да земе вредности -3,-2,-1, 0, +1,+2,+3.
Хемиските елементи во атомите од кои орбиталите s-, p-, d-, f- се исполнети со електрони, соодветно, се нарекуваат s-, p-, d-, f-елементи.
На пример, s-елементите вклучуваат H, He, како и алкални и земноалкални метали (метали од 1A и 11A групи - Na, K, Rb, Be. Ca, Mg, Sg, итн.)
П-елементите вклучуваат, на пример, елементи кои завршуваат периоди во периодичниот систем на елементи (освен првиот период) - B, C, N, Ne, J, Cl, Br, P, S, F, As, Se, Ar, Rn, Te и др.
Д-елементите вклучуваат елементи лоцирани во големи периоди помеѓу s-елементите и p-елементите, на пример, Fe, Mn, Cr, Ti, Mo, Pt, Co, Ru, Rh итн.
Ф-елементите вклучуваат лантаниди, на пример, Ce, Nd, Pm, Sm, Eu, Gd и актиниди, на пример, Th, U, Np, Pu, Am итн.
54. Која е најниската оксидациска состојба на водородот, флуорот, сулфурот и азот? Зошто? Составете формули за соединенија на калциум со овие елементи во оваа оксидациска состојба. Кои се имињата на соодветните соединенија?
Водородниот атом има еден валентен електрон. Затоа, најниската оксидациска состојба на водородот ќе биде -1 (атом на водород прифаќа 1 електрон од друг елемент). Водородот ја покажува оваа најниска состојба на оксидација +2 -1 во соединението CaH2. Ова соединение се нарекува калциум хидрид.
Атомот на флуор има седум валентни електрони, еден електрон недостасува за да се заврши нивото на енергија. Затоа, најниската (и единствена) оксидациска состојба на флуорот е -1. Флуорните соединенија во оваа состојба на оксидација +2 -1 се нарекуваат флуориди. На пример, CaF 2 е калциум флуорид.
Атомот на сулфур има шест валентни електрони, два електрони недостасуваат за да се заврши нивото на енергија. Затоа, најниската состојба на оксидација на сулфурот е -2. Сулфурните соединенија во оваа состојба на оксидација +2 -2 се нарекуваат сулфиди. На пример, CaS е калциум сулфид.
Атомот на азот има пет валентни електрони; три електрони недостасуваат пред да заврши загубата на енергија. Затоа, најниската оксидациска состојба на азот е -3. Азотните соединенија во оваа состојба на оксидација +2 -3 се нарекуваат нитриди. Ca 3 N 2 е калциум нитрид.
74. Што треба да се разбере со оксидационата состојба на атомот? Да се определи оксидационата состојба на јаглеродниот атом и неговата валентност во соединенијата: CH 4 ; CH3 OH; UNSC; CO 2
Состојбата на оксидација е условното полнење на атомот во соединението, пресметано од претпоставката дека се состои само од јони. Оксидацискиот број може да биде негативен, позитивен или нула и може да биде цел или дробен број. Алгебарскиот збир на оксидационите состојби на атомите во соединението е секогаш еднаков на нула, а во сложениот јон е еднаков на полнежот на јонот.
Во дадените јаглеродни соединенија, јаглеродниот атом е четиривалентен. Но, степенот на оксидација на јаглеродниот атом во овие соединенија е различен.
Во метанот - CH 4 - оксидационата состојба на јаглеродот е 4.
Во метанол - CH3OH - јаглерод оксидациона состојба - 2; во мравја киселина HCOOH - јаглерод оксидациона состојба +2; во јаглерод диоксид - CO 2 - јаглерод оксидациона состојба +4.
94. Со согорување на 11,5 g течен етил алкохол се ослободиле 308,71 kJ топлина. Напишете ја термохемиската равенка за реакцијата што резултира со формирање на водена пареа и јаглерод диоксид. Пресметајте ја топлината на формирање на C 2 H 5 OH (l). Одговор: -277,67 kJ
C 2 H 5 OH (l) + 3 O 2 (g) = 2 CO 2 (g) + 3 H 2 O (p)
1 мол течен етил алкохол има маса од 46 g.
За да составиме термохемиска равенка, да ја создадеме пропорцијата:
11,5 g етанол ------------ 308,71 kJ
46 g етанол ------------ x kJ
Тогаш термохемиската равенка на метанот ќе има форма:
C2H5OH (l) + 3 02 (g) = 2 C02 (g) + 3 H2O (p); ∆Н° = -1234,84
Термичкиот ефект на реакцијата го запишуваме со знак минус, бидејќи топлината се ослободува за време на реакцијата.
Според Хесовиот закон, термичкиот ефект на реакцијата не зависи од транзицискиот пат, туку зависи само од конечната и почетната состојба на системот.
∆Н° реакција = ∑∆Н° конечна. - ∑∆Н° повратен почеток
Ги земаме стандардните енталпии за формирање на почетните супстанции и производите на реакцијата од референтната книга:
∆H° примерок CO 2 (g) = -393,51 kJ/mol,
∆Н° arr H 2 O (пареа) = -241,83 kJ/mol
∆H° примерок O 2 (g) = 0 kJ/mol.
∆H° arr (C 2 H 5 OH (l)) = [∆H° arr (H 2 O) *3 + ∆H° arr (CO 2) *2] - ∆H° реакција = [(-241, 83)*3 + (- 393,51)*2 - (-1234, 84) = - 277,68 kJ/mol
114. Кој од карбонатите: BeCO3, CaCO3 или BaCO3 може да се добие со дејство на соодветните оксиди со CO 2? Која реакција се јавува најенергично? Извлечете заклучок со пресметување на ΔG° 298 реакции
Да ги земеме од референтната книга стандардните вредности на Гибсовата енергија ∆G° 298 за почетните материи и финалните производи на реакциите: ∆G° 298 BeO = -569,54 kJ/mol, ∆G° 298 BeCO3 = -944,75, ∆G° 298 BaO = -525,84 kJ/mol, ∆G° 298 ВаСО 3 = -1132,77 kJ/mol; ∆G° 298 CaO = -603,46 kJ/mol,
∆G° 298 CaCO 3 = -1128,35 kJ/mol; ∆G° 298 CO 2 = -394,37 kJ/mol;
Тогаш за реакцијата BeO(k) + CO 2 (g) = BeCO3(k) стандардната вредност на Гибсовата енергија ќе биде:
944,75-[(-569,54)+(-394,37)]=+19,16 kJ/mol.
Позитивната вредност на Гибсовата енергија за оваа реакција покажува дека во стандардни услови оваа реакција се одвива претежно од десно кон лево и берилиум кабонат не може да се добие од BeO и CO 2.
За реакцијата BaO(k) + CO 2 (g) = BaCO3(k) стандардната вредност на Гибсовата енергија ќе биде:
1132,77-[(-525,84)+(-394,37)]=-212,56 kJ/mol/
За реакцијата CaO(k) + CO 2 (g) = CaCO3(k) стандардната вредност на Гибсовата енергија ќе биде:
1128,35-[(-603,46)+(-394,37)]=-130,52 kJ/mol.
Гибсовата енергетска вредност за овие реакции е негативна и овие процеси продолжуваат во напредна насока, односно на овој начин може да се добијат калциум и бариум карбонати. Најенергичната реакција ќе се случи помеѓу бариум оксид и јаглерод диоксид, бидејќи енергетската вредност на Гибс за оваа реакција ќе има најнегативна вредност.
134. Рамнотежата на хомогениот систем 4 HCl (g) + O 2 (g) ↔ 2H 2 0 (g) + 2Cl 2 (g) е воспоставена при следните концентрации на реактантите mol/l: [H 2 O] p = 0,14; [Cl2] p =0,14; [HCl] P = 0,20; [O 2 ] p = 0,32. Пресметајте ги почетните концентрации на водород хлорид и кислород
[H 2 0] p = 0,14 mol/l
[Cl 2 ] p = 0,14 mol/l
[HCl] P = 0,20 mol/l
[O 2 ] p = 0,32 mol/l
Реф =? ref=?
Врз основа на равенката на реакцијата, целиот хлор (2 mol) се формира од водород хлорид (4 mol), а целата вода е формирана од оригиналниот водород хлорид и кислород.
Затоа, за да се формираат 0,14 мол хлор, мора да реагираат 0,28 мол водород хлорид, а за да се добијат 0,14 мол вода, треба да реагираат 0,07 мол кислород.
Така, почетната концентрација на HCl беше 0,20 + 0,28 = 0,48 mol/l, а почетната концентрација на O 2 беше еднаква на 0,32 + 0,07 = 0,39 mol/l.
Одговор: Почетните концентрации на водород хлорид и кислород се 0,48 mol/L и 0,39 mol/L, соодветно.
154. За неутрализирање на 1 литар раствор кој содржи 1,4 g KOH, потребни се 50 cm 3 киселински раствор. Пресметајте ја моларната концентрација на еквивалентот на киселинскиот раствор
Ајде да го најдеме титарот на растворот KOH:
Сега да ја пресметаме моларната концентрација на еквивалентот на растворот KOH:
Знаејќи ја моларната концентрација на еквивалентот на растворот на KOH, ја пресметуваме моларната концентрација на киселинскиот еквивалент:
174. Колку грама уреа CO(NH 2) 2 треба да се растворат во 75 g вода за да се намали температурата на кристализација на растворот за 0,465°? Криоскопската константа на водата е 1,86
Моларната маса на уреа е 60 g/mol. Намалување на температурата на замрзнување на растворот ∆T K = 0,465 °C.
Според законот на Раул, намалувањето на температурата на кристализација на растворот во споредба со температурата на кристализација на чист растворувач зависи од криоскопската константа на растворувачот и молалната концентрација на растворената супстанција. Од тука можете да ја пресметате масата на растворената супстанција - уреа во раствор.
194. Напиши молекуларни и јонско-молекуларни равенки за реакции кои се изразуваат со јонско-молекуларни равенки
Fe(OH)3 + 3 H + = Fe 3+ + 3 H 2 O
Cd 2+ + 2 OH - = Cd(OH) 2
H + + NO 2 - =HNO 2
Fe(OH) 3 (t)+ 3 HCl = FeCl 3 + 3 H 2 O
Fe(OH) 3 (t) + 3 H + + 3 Cl - = Fe 3+ + 3Cl - + 3 H 2 O
Fe(OH) 3 (t) + 3 H + = Fe 3+ + 3 H 2 O
Cd(NO 3) 2 + 2 KOH = Cd(OH) 2 (t)+ 2 KNO 3
Cd 2+ + 2NO 3 +2K + +2OH - = Cd(OH) 2 (t)+ 2 K + + 2 NO 3 -
Cd 2 + 2 OH - = Cd(OH) 2 (t)
HC1 + NaNO2 = НNO2 + NaС1
Н + + Сl - + Na + + NO 2 - = НNO 2 + Na + + Сl -
H + +NO 2 - =HNO 2
214. При мешање на A1 2 (SO 4) 3 и Na 2 CO 3, секоја од земените соли се хидролизира неповратно за да се формира соодветната база и киселина. Изразете ја оваа заедничка хидролиза користејќи јонски и молекуларни равенки
A1 2 (SO 4) 3 + 3 Na 2 CO 3 + 3 H 2 O → 2 A1 (OH) 3 (t) + 3 Na 2 SO 4 + 3SO 2 (g)
2 A1 3+ + 3 SO 4 2- + 6 Na + + 3SO 3 2- + 3 H 2 O → 2 Fe(OH) 3 (t) + 6 Na + + 3 SO 4 2- + 3SO 2 (g)
2 A1 3+ + 3SO 3 2- + 3 H 2 O → 2 A1(OH) 3 (t) + 3SO 2 (g)
254. Железните и сребрените плочи се поврзуваат со надворешен спроводник и се потопуваат во раствор од сулфурна киселина. Нацртајте дијаграм на оваа галванска ќелија и напишете електронски равенки за процесите на анодата и катодата.
(-)Fe |H 2 S0 4 | |Н 2 S0 4 |Аg(+)
Процесот Fe-2 e = Fe 2+ се јавува на анодата (железото), електроните минуваат низ проводникот до сребрената плоча и процесот се случува на површината на сребрената катода
2 N + + 2 e = N 2 T.
Железната плоча ќе се раствори и сребрената плоча ќе покаже еволуција на водород.
274. Состави електронски равенки за процесите што се случуваат на графитни електроди при електролиза на раствор од KBr. Која маса на супстанција се ослободува на катодата и анодата ако електролизата се изведува 1 час 35 минути со струја од 15 А? Одговор: 0,886 g; 70,79 g
При електролиза на воден раствор на калиум бромид со инертни (графитни) електроди на катодата, се јавува процес на редукција на молекулите на водата и се ослободува водород:
2Н 2 О+2е =Н 2 +2О1H -
На анодата доаѓа до процес на оксидација на бромидните јони и се ослободува бром: 2Br - - 2е = Br 2 Моларната маса на водородниот еквивалент е 1 g/mol, а моларната маса на еквивалентот на бром е 79,904 g/mol. .
Потоа, според законите на Фарадеј, може да се најде масата на водород и бром, кои се ослободуваат на катодата и анодата, соодветно.
294. Кој метал е посоодветен да се избере за заштита на шарите од корозија на обвивката на оловниот кабел: цинк, магнезиум или хром? Зошто? Составете електронски равенки за анодните и катодните процеси на атмосферска корозија. Каков е составот на производите од корозија?
Во жртвената заштита, заштитникот, поактивен метал од металот на конструкцијата што се заштитува, служи како анода и се уништува, а со тоа ја штити структурата од уништување. Затоа, колку е понегативен потенцијалот на заштитниот метал, толку поефикасна ќе биде заштитата за заштита. Најмал потенцијал ќе биде за магнезиум -2,37 V, (за цинк - 0,763 V; за хром - 0,74 V)
Бидејќи обвивката на кабелот е направена од олово, галванскиот пар магнезиум-олово ќе има најголема потенцијална разлика. А магнезиумот ќе послужи како најдобра заштитна заштита.
За време на атмосферска корозија на површината на заштитник од магнезиум, се случува следниот процес:
2Mg – 4е = 2Mg 2+
Електроните минуваат низ проводникот до кабелот за олово и се јавува деполаризација на кислородот на површината на оловото:
O 2 + 2 H 2 O + 4е = 4 OH -
Производот на атмосферска корозија ќе биде магнезиум хидроксид
2 Mg 2+ + 4 OH - = 2 Mg(OH) 2
314. Напиши изрази за константите на нестабилност на следните сложени јони: [Аg(СN) 2 ] - ; [Аg(NН 3) 2] + ; [Аg(SСМ) 2 ] - . Знаејќи дека тие се соодветно еднакви на 1,0 * 10 -21, 6,8 * 10 -8, 2,1 * 10 -11, наведете во кој раствор што ги содржи овие јони, со еднаква моларна концентрација на јони Ag +, има повеќе?
Да ги запишеме изразите за константата на нестабилност за овие сложени јони:

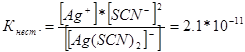
На дадена температура, вредноста на константата на нестабилност е константна вредност. Колку е помала константата на нестабилност, толку е постабилен комплексот, па затоа најголема концентрација на јони на сребро ќе биде во растворот што го содржи сложениот јон [Аg(NНз) 2 ] +.
Литература
1. Ахметов Н.С. Општа и неорганска хемија. М, 2002 година.
2. Karapetyants M.Kh., Drakin S.I. Општа и неорганска хемија. M. 1994 година.
3. Glinka L. I. Општа хемија. M. 1984 година.
