7.11. Структурата на супстанциите со ковалентни врски
Супстанциите во кои од сите видови хемиски врски има само ковалентна, се поделени во две нееднакви групи: молекуларни (многу) и немолекуларни (многу помалку).
Кристалите на цврстите молекуларни супстанции се состојат од молекули слабо врзани заедно со силите на интермолекуларната интеракција на молекулите. Таквите кристали немаат висока јачина и цврстина (размислете мраз или шеќер). Нивните точки на топење и вриење се исто така ниски (види Табела 22).
Табела 22. Точки на топење и вриење на некои молекуларни супстанции
Супстанција |
Супстанција |
||||
| H 2 | – 259 | – 253 | BR 2 | – 7 | 58 |
| N 2 | – 210 | – 196 | H2O | 0 | 100 |
| HCl | – 112 | – 85 | P 4 | 44 | 257 |
| NH 3 | – 78 | – 33 | C 10 H 8 (нафтален) | 80 | 218 |
| SO 2 | – 75 | – 10 | С 8 | 119 |
За разлика од нивните молекуларни колеги, немолекуларните супстанции со ковалентни врски формираат многу тврди кристали. Дијамантските кристали (најтешката супстанција) припаѓаат на овој тип.
Во дијамантски кристал (сл. 7.5), секој јаглероден атом е поврзан со четири други јаглеродни атоми со едноставни ковалентни врски (хибридизација sp 3). Јаглеродните атоми формираат тродимензионална рамка. Во суштина, целиот дијамантски кристал е една огромна и многу силна молекула.
Силиконските кристали, широко користени во радио електрониката и електронското инженерство, имаат иста структура.
Ако замените половина од атомите на јаглерод во дијамантот со атоми на силициум без да ја нарушите структурата на рамката на кристалот, ќе добиете кристал од силициум карбид SiC - исто така многу тврда супстанција што се користи како абразивен материјал. Обичниот кварцен песок (силициум диоксид) исто така припаѓа на овој тип на кристална супстанција. Кварцот е многу тврда супстанција; Под името „шмиргла“ се користи и како абразивен материјал. Кварцната структура лесно се добива со вметнување на атоми на кислород помеѓу секои два атома на силициум во силиконски кристал. Во овој случај, секој атом на силициум ќе биде поврзан со четири атоми на кислород, а секој атом на кислород со два атоми на силициум.
Кристалите од дијамант, силициум, кварц и слични структури се нарекуваат атомски кристали.
Атомски кристал е кристал кој се состои од атоми на еден или повеќе елементи поврзани со хемиски врски.
Хемиската врска во атомски кристал може да биде ковалентна или метална.
Како што веќе знаете, секој атомски кристал, како јонски кристал, е огромна „супермолекула“. Структурната формула на таквата „супермолекула“ не може да се запише - можете само да го покажете нејзиниот фрагмент, на пример:

За разлика од молекуларните супстанции, супстанциите што формираат атомски кристали се меѓу најогноотпорните (види табела 23.).
Табела 23. Точки на топење и вриење на некои немолекуларни супстанцииСо ковалентни врски
Ваквите високи температури на топење се сосема разбирливи ако се потсетиме дека кога овие супстанции се топат, не се раскинуваат слабите меѓумолекуларни врски, туку силните хемиски врски. Од истата причина, многу супстанции кои формираат атомски кристали не се топат кога се загреваат, туку се распаѓаат или веднаш се трансформираат во состојба на пареа (сублимираат), на пример, графитот се сублимира на 3700 o C.
| Силикон - Si.Многу тврди, кршливи силиконски кристали изгледаат како метал, но сепак е неметал. Врз основа на видот на електричната спроводливост, оваа супстанца е класифицирана како полупроводник, што ја одредува нејзината огромна важност во современиот свет. Силиконот е најважниот полупроводнички материјал. Радија, телевизори, компјутери, модерни телефони, електронски часовници, соларни панели и многу други апарати за домаќинство и индустриски уреди содржат транзистори, микроциркути и фотоелементи направени од единечни кристали на силициум со висока чистота како најважни структурни елементи. Технички силициум се користи во производството на челик и обоената металургија. Во однос на хемиските својства, силиконот е прилично инертна супстанција, тој реагира само на високи температури. Силициум диоксид - SiO 2 .Друго име за оваа супстанца е силика. Силициум диоксидот се јавува во природата во две форми: кристален и аморфен. Многу полускапоцени и украсни камења се сорти на кристален силициум диоксид (кварц): камен кристал, јаспис, халцедон, агат. а опалот е аморфна форма на силициум диоксид. Кварцот е многу распространет во природата, бидејќи дините во пустините и песочните брегови на реките и морињата се сите кварцен песок. Кварцот е безбојна кристална, многу тврда и огноотпорна супстанција. Тој е инфериорен во однос на цврстината на дијамантот и корундот, но, сепак, широко се користи како абразивен материјал. Кварценот песок е широко користен во градежништвото и индустријата за градежни материјали. Кварцното стакло се користи за изработка на лабораториски стакларија и научни инструменти бидејќи не пука при нагли температурни промени. Во однос на неговите хемиски својства, силициум диоксидот е кисел оксид, но тој реагира со алкали само кога е споен. На високи температури, силициум диоксид и графит се користат за производство на силициум карбид - карборунд. Карборундот е втората најтврда супстанција по дијамантот; исто така се користи за правење тркала за брусење и „шкурка“. |
7.12. Поларитет на ковалентна врска. Електронегативност
Потсетете се дека изолираните атоми на различни елементи имаат различни склоности и да се откажат и да прифатат електрони. Овие разлики опстојуваат по формирањето на ковалентна врска. Односно, атомите на некои елементи имаат тенденција да го привлечат електронскиот пар на ковалентна врска кон себе посилно од атомите на другите елементи.
Размислете за молекула HCl.
Користејќи го овој пример, да видиме како можеме да го процениме поместувањето на електронскиот комуникациски облак користејќи моларни енергии на јонизација и средства за електронот. 1312 kJ/mol и 1251 kJ/mol - разликата е незначителна, приближно 5%. 73 kJ/mol и 349 kJ/mol - тука разликата е многу поголема: енергијата на афинитетот на електроните на атомот на хлор е речиси пет пати поголема од онаа за атомот на водород. Од ова можеме да заклучиме дека електронскиот пар на ковалентната врска во молекулата на водород хлорид е во голема мера поместен кон атомот на хлор. Со други зборови, сврзувачките електрони поминуваат повеќе време во близина на атомот на хлор отколку во близина на атомот на водород. Оваа нерамномерна распределба на густината на електроните доведува до прераспределба на електричните полнежи внатре во молекулата. на атомот на водород е позитивен, а на атомот на хлор е негативен.
Во овој случај, се вели дека врската е поларизирана, а самата врска се нарекува поларна ковалентна врска.
Ако електронскиот пар на ковалентна врска не е поместен на ниту еден од поврзаните атоми, односно електроните на врската подеднакво припаѓаат на врзаните атоми, тогаш таквата врска се нарекува неполарна ковалентна врска.
Концептот на „формално полнење“ во случај на ковалентна врска е исто така применлив. Само во дефиницијата не треба да зборуваме за јони, туку за атоми. Во принцип, може да се даде следнава дефиниција.
Во молекулите во кои ковалентни врски се формираат само со механизам за размена, формалните полнежи на атомите се еднакви на нула. Така, во молекулата на HCl, формалните полнежи и на атомите на хлор и на водород се нула. Следствено, во оваа молекула реалните (ефикасни) полнежи на атомите на хлор и водород се еднакви на парцијалните (вишок) полнежи.
Не е секогаш лесно да се одреди знакот на парцијално полнење на атом на еден или друг елемент во молекулата врз основа на моларните енергии на јонизација и афинитетот кон електродата, односно да се процени во која насока се електронските парови на врски. се префрли. Обично, за овие цели, се користи друга енергетска карактеристика на атомот - електронегативност.
Во моментов, не постои единствена, општоприфатена ознака за електронегативност. Може да се означи со буквите E/O. Исто така, не постои единствен, општо прифатен метод за пресметување на електронегативност. На поедноставен начин, може да се претстави како половина од збирот на моларните јонизациски енергии и афинитетот на електроните - ова беше еден од првите начини да се пресмета.
Апсолутните вредности на електронегативноста на атомите на различни елементи се користат многу ретко. Најчесто користена е релативната електронегативност, означена со c. Првично, оваа вредност беше дефинирана како однос на електронегативноста на атом на даден елемент до електронегативноста на атом на литиум. Последователно, методите на неговото пресметување малку се променија.
Релативната електронегативност е бездимензионална величина. Неговите вредности се дадени во Додаток 10.
Бидејќи релативната електронегативност зависи првенствено од енергијата на јонизација на атомот (енергијата на афинитетот на електронот е секогаш многу помала), тогаш во систем на хемиски елементи таа се менува приближно исто како и енергијата на јонизација, односно се зголемува дијагонално од цезиумот (0,86). до флуор (4.10). Вредностите на релативната електронегативност на хелиум и неон дадени во табелата немаат практично значење, бидејќи овие елементи не формираат соединенија.
Користејќи ја табелата за електронегативност, можете лесно да одредите кон кој од двата атома се поместени електроните што ги поврзуваат овие атоми и, според тоа, знаците на парцијалните полнежи што произлегуваат од овие атоми.
| H2O | Врската е поларна | |||
| H 2 | Атомите се исти | H--H | Врската е неполарна | |
| CO2 | Врската е поларна | |||
| Cl2 | Атомите се исти | Cl--Cl | Врската е неполарна | |
| H2S | Врската е поларна |
Така, во случај на формирање на ковалентна врска помеѓу атоми на различни елементи, таквата врска секогаш ќе биде поларна, а во случај на формирање на ковалентна врска помеѓу атоми на истиот елемент (во едноставни супстанции), врската во повеќето случаи е неполарна.
Колку е поголема разликата во електронегативноста на врзаните атоми, толку е пополарна ковалентната врска помеѓу овие атоми.
| Водород сулфид H 2 S– безбоен гас со карактеристичен мирис карактеристичен за расипани јајца; отровен. Термички е нестабилен и се распаѓа кога се загрева. Водородниот сулфид е малку растворлив во вода; неговиот воден раствор се нарекува хидросулфидна киселина. Водородниот сулфид предизвикува (катализира) корозија на металите; токму овој гас е „виновен“ за затемнувањето на среброто. Природно се наоѓа во некои минерални води. Во процесот на живот, тој е формиран од некои бактерии. Водородниот сулфид е деструктивен за сите живи суштества. Во длабочините на Црното Море е откриен слој од водород сулфид и предизвикува загриженост кај научниците: животот на морските жители таму е под постојана закана. |
ПОЛАРНА КОВАЛЕНТНА ВРСКА, НЕПОЛАРНА КОВАЛЕНТНА ВРСКА, АПСОЛУТНА ЕЛЕКТРОНЕГАТИВНОСТ, РЕЛАТИВНА ЕЛЕКТРОНЕГАТИВНОСТ.
1. Експериментите и последователните пресметки покажаа дека ефективното полнење на силициум во силициум тетрафлуорид е +1,64 e, а на ксенон во ксенон хексафлуорид +2,3 e. Определете ги вредностите на парцијалните полнежи на атомите на флуор во овие соединенија. 2. Составете ги структурните формули на следните супстанции и, користејќи ги ознаките " " и " ", карактеризирајте го поларитетот на ковалентните врски во молекулите на овие соединенија: а) CH 4, CCl 4, SiCl 4; б) H2O, H2S, H2Se, H2Te; в) NH3, NF3, NCl3; г) SO 2, Cl 2 O, OF 2.
3. Користејќи ја табелата за електронегативност, наведете во кое од соединенијата врската е пополарна: а) CCl 4 или SiCl 4 ; б) H2S или H2O; в) NF 3 или NCl 3; г) Cl 2 O или OF 2.
7.13. Механизам на донаторско-акцептор на формирање на врска
Во претходните параграфи, детално научивте за два вида врски: јонски и ковалентни. Потсетиме дека јонската врска се формира кога електронот целосно се пренесува од еден атом во друг. Ковалентен - кога се делат неспарени електрони на врзани атоми.
Покрај тоа, постои уште еден механизам за формирање на врска. Ајде да го разгледаме користејќи го примерот на интеракцијата на молекула на амонијак со молекула на бор трифлуорид:

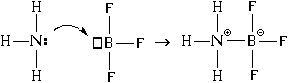
Како резултат на тоа, помеѓу атомите на азот и бор се појавуваат и ковалентни и јонски врски. Во овој случај, атом на азот е донаторелектронски пар (го „дава“ за формирање на врска), а атомот на бор - акцептор(го „прифаќа“ при формирање на врска). Оттука и името на механизмот за формирање на таква врска - “ донатор-акцептор“.
Кога се формира врска со помош на механизмот донор-акцептор, и ковалентна и јонска врска се формираат истовремено.
Секако, по формирањето на врската, поради разликата во електронегативноста на врзаните атоми, доаѓа до поларизација на врската и настануваат делумни полнежи, со што се намалуваат ефективни (реални) полнежи на атомите.
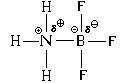
Ајде да погледнеме други примери.
Доколку до молекулата на амонијак има високополарна молекула на хлороводород, во која има значително парцијално полнење на атомот на водород, тогаш во овој случај улогата на акцепторот на електронскиот пар ќе ја игра атомот на водород. Неговиот 1 с-АО, иако не е целосно празен, како атомот на бор во претходниот пример, густината на електроните во облакот на оваа орбитала е значително намалена.

Просторната структура на добиениот катјон е амониум јон NH 4 е слична на структурата на молекулата на метанот, односно сите четири N-H врски се сосема исти.
Формирањето на јонски кристали на амониум хлорид NH 4 Cl може да се набљудува со мешање на гасот на амонијак со гасот водород хлорид:
NH 3 (g) + HCl (g) = NH 4 Cl (cr)
Не само азотниот атом може да биде донатор на електронски пар. Тоа може да биде, на пример, атом на кислород на молекула на вода. Молекулата на вода ќе комуницира со истиот водород хлорид на следниов начин:
Добиениот H3O катјон се нарекува јон на оксониуми, како што наскоро ќе дознаете, е од големо значење во хемијата.
Како заклучок, да ја разгледаме електронската структура на молекулата на јаглерод моноксид (јаглерод моноксид) CO:
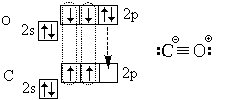
Покрај три ковалентни врски (тројна врска), содржи и јонска врска.
Услови за формирање на врска според механизмот донор-акцептор:
1) присуство на осамен пар валентни електрони во еден од атомите;
2) присуство на слободна орбитала на валентното подниво на друг атом.
Механизмот на донаторско-акцептор на формирање на врска е доста распространет. Особено често се јавува при формирање на соединенија г-елементи. Скоро сечии атоми г-елементите имаат многу празни валентни орбитали. Затоа, тие се активни акцептори на електронски парови.
МЕХАНИЗАМ НА ДОНАТОР-АКСЕПТОР НА ФОРМИРАЊЕ НА ВРЗНИЦА, АМОНИУМ ЈОН, ОКСОНИУМ ЈОН, УСЛОВИ ЗА ФОРМИРАЊЕ НА ВРЗНИЦА ОД МЕХАНИЗАМОТ ДОНАТОР-ПРИМАТЕЛ.
1. Направете равенки за реакција и шеми за формирање
а) амониум бромид NH 4 Br од амонијак и водород бромид;
б) амониум сулфат (NH 4) 2 SO 4 од амонијак и сулфурна киселина.
2. Создадете равенки за реакција и шеми за интеракција за а) вода со водород бромид; б) вода со сулфурна киселина.
3. Кои атоми во четирите претходни реакции се донатори на електронски пар, а кои акцептори? Зошто? Објаснете го вашиот одговор со дијаграми на валентните поднивоа.
4.Структурна формула на азотна киселина Аглите помеѓу O–N–O врските се блиску до 120 o. Дефинирај:
а) тип на хибридизација на азотниот атом;
б) кој АО од азотен атом учествува во формирањето на -врската;
в) кој АО од азотен атом учествува во формирањето на -врската според механизмот донор-акцептор.
Што мислите, колку е приближно еднаков аголот помеѓу H–O–N врските во оваа молекула? 5. Создадете ја структурната формула на цијанидниот јон CN (негативен полнеж на јаглеродниот атом). Познато е дека цијанидите (соединенија кои содржат таков јон) и јаглерод моноксид CO се силни отрови, а нивното биолошко дејство е многу слично. Понудете го вашето објаснување за близината на нивното биолошко дејство.
7.14. Метална врска. Метали
Се формира ковалентна врска помеѓу атомите кои се слични по нивната склоност да се откажат и да добиваат електрони само кога големини на врзаните атоми се мали. Во овој случај, густината на електроните во областа на преклопувачките електронски облаци е значајна, а атомите се покажаа дека се цврсто врзани, како, на пример, во молекулата HF. Ако барем еден од поврзаните атоми има голем радиус, формирањето на ковалентна врска станува помалку поволно, бидејќи густината на електроните во областа на преклопувачките електронски облаци за големи атоми е многу помала отколку за малите. Пример за таква молекула со послаба врска е молекулата HI (со помош на Табела 21, споредете ги енергиите на атомизација на молекулите HF и HI).
А сепак помеѓу големите атоми ( р o > 1.1) се јавува хемиска врска, но во овој случај таа се формира поради споделувањето на сите (или дел) од валентните електрони на сите поврзани атоми. На пример, во случај на атоми на натриум, сите 3 с-електрони од овие атоми и се формира единствен електронски облак:
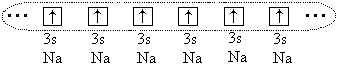
Атомите формираат кристал со металкомуникација
На овој начин, и атоми на ист елемент и атоми на различни елементи можат да се поврзат едни со други. Во првиот случај, едноставни супстанции наречени метали, а во втората - сложени супстанции наречени меѓуметални соединенија.
Од сите супстанции со метални врски меѓу атомите, за металите ќе научите само на училиште. Каква е просторната структура на металите? Металниот кристал се состои од атомски скелети, останувајќи по социјализацијата на валентни електрони и електронскиот облак на социјализираните електрони. Атомските јадра обично формираат многу блиско пакување, а електронскиот облак го зафаќа целиот преостанат слободен волумен на кристалот.
Главните видови на густо пакување се кубно најблиско пакување(KPU) и хексагонално блиско пакување(ГПУ). Имињата на овие пакувања се поврзани со симетријата на кристалите во кои се реализираат. Некои метали формираат лабаво спакувани кристали - кубни во центарот на телото(ОТСК). Моделите за волумен и топка и стап на овие пакувања се прикажани на слика 7.6.
Кубното блиско пакување е формирано од атоми на Cu, Al, Pb, Au и некои други елементи. Шестоаголно блиско пакување - атоми на Be, Zn, Cd, Sc и ред други. Кубното пакување на атоми во центарот на телото е присутно во кристали на алкални метали, елементи од VB и VIB групи. Некои метали може да имаат различни структури на различни температури. Причините за таквите разлики и структурните карактеристики на металите сè уште не се целосно разбрани.
Кога се топат, металните кристали се претвораат во метални течности. Видот на хемиската врска помеѓу атомите не се менува.
Металната врска нема насоченост и заситеност. Во овој поглед, тоа е слично на јонска врска.
Во случај на меѓуметални соединенија, можеме да зборуваме и за поларизација на металната врска.
Карактеристични физички својства на металите:
1) висока електрична спроводливост;
2) висока топлинска спроводливост;
3) висока еластичност.

Точките на топење на различни метали се многу различни едни од други: најниската точка на топење е за живата (- 39 o C), а највисоката е за волфрам (3410 o C).
| Берилиум Be- светло сив, лесен, прилично тврд, но обично кршлив метал. Точка на топење 1287 o C. Во воздухот се покрива со оксидна фолија. Берилиумот е прилично редок метал; живите организми во процесот на нивната еволуција практично немаа никаков контакт со него, па затоа не е чудно што е отровен за животинскиот свет. Се користи во нуклеарната технологија. Цинкот Zn е бел мек метал со синкава нијанса. Точка на топење 420 o C. Во воздухот и водата е покриен со тенок густ филм од цинк оксид, кој спречува понатамошна оксидација. Во производството се користи за галванизација на лимови, цевки, жици, заштита на железо од корозија. Волфрам В.Тој е најогноотпорен од сите метали: точката на топење на волфрамот е 3387 o C. Вообичаено, волфрамот е прилично кршлив, но по внимателно чистење станува еластичен, што овозможува да се извлече тенка жица од неа, од која се вртат филаментите на се прават светилки. Сепак, најголемиот дел од произведениот волфрам се користи за производство на тврди и отпорни на абење легури кои можат да ги задржат овие својства кога се загреваат дури и до 1000 o C. |
МЕТАЛ, ИНТЕРМЕТАЛИЧНО СОСИЕНИЕ, МЕТАЛИЧНА ВРСКА, НАЈТЕСНА ПАКУВАЊЕ.
1. За да се карактеризираат различни пакувања, се користи концептот на „коефициент на полнење на просторот“, односно односот на волуменот на атомите до волуменот на кристалот
Каде V a -волумен на атом,
Z е бројот на атоми во единица ќелија,
V i- волумен на единицата ќелија.
Атомите во овој случај се претставени со крути топчиња со радиус Р, допирајќи се еден со друг. Волумен на топката В w = (4/3) Р 3 .
Определете го факторот за пополнување простор за пакување на големо и bcc.
2. Користејќи ги вредностите на металните радиуси (Додаток 9), пресметајте ја единечната големина на ќелијата на а) бакар (CPU), б) алуминиум (CPU) и в) цезиум (BCC).
Силите на Вандервалс
Силите на Ван дер Валс (Ван дер Валс, холандски научник, 1873) ја одредуваат интеракцијата помеѓу молекулите. Тие вклучуваат
интеракции дипол-дипол, индукција и дисперзија.
Дипол-диполинтеракцијата се јавува помеѓу спротивните полови на постојаните диполи. Индукцијасе јавуваат интеракции помеѓу диполи и неполарни молекули. Дипол делува на неполарна молекула претворајќи ја во индуциран дипол. Се јавува привлечност помеѓу постојаните и индуцираните диполи, чија енергија е пропорционална на растојанието помеѓу центрите на молекулите. Енергијата на индуктивната интеракција се зголемува со зголемување на поларизираноста на молекулите (способноста на молекулата да формира дипол).
Дисперзивнасе јавува интеракција помеѓу моменталните диполи на неполарни молекули. Флуктуациите на електричната густина се случуваат во која било молекула, што резултира со појава на моментални диполи, кои пак предизвикуваат моментални диполи во соседните молекули.
Енергијата на сите видови интеракции кои се разгледуваат е обратно пропорционална на растојанието помеѓу центрите на молекулите до шестата сила.
3.2. Водородна врска
Водородната врска се јавува како резултат на интеракцијата на позитивно поларизираниот водород на една молекула и негативно поларизиран атом на друга молекула. На пример, ...H + ─F - ...H + ─F - ... Ако во молекулата се формира водородна врска, таа се нарекува интрамолекуларна.
Кога се појавуваат водородни врски, се формираат димери, тримери или полимерни структури. Ова доведува до зголемување на вискозноста, диелектричната константа, точките на вриење и топење, топлината на фузија и испарување.
Просторна конфигурација на молекулите
Просторната структура на молекулите се одредува според бројот на атоми во молекулата и насоката на хемиските врски.
Диатомските молекули (H 2), триатомските молекули CaCl 2, C 2 H 2) имаат линеарна структура.
Триатомските молекули можат да имаат аголна структура (H 2 S, H 2 O); пирамидална (NH 3); рамен триаголник (AlCl 3, BF 3).
Полиатомските молекули имаат посложени конфигурации - тетраедарски (CH 4), октаедарски (SF 6); циклична (C 4 H 8, C 6 H 6), итн.
Водород флуорид
хидроген сулфид
Бор флуорид
Тест задачи
1. Во кои молекули хемиската врска е поларна F2, CO, N2, HBr?
2. Определи ја валентноста на флуорот и фосфорот во земјата и возбудените состојби.
3. Наведете го механизмот на формирање на хемиски врски во молекулите на CO, вода, амониум хидроксид, амониум катјон.
4. Што проазо, магнезиум хлорид, алуминиум бромид, водород селенид, ацетилен, ппен, пентан?
5. Наведете ги електронските конфигурации на молекулите на кислород и водород хлорид користејќи го методот MO.
6. Користејќи го методот MS, утврдете дали е можно формирање на јони
H 2 + , He 2 + , O 2 - .
7. Нацртај енергетски дијаграми на молекулите на азот и флуор со помош на методот MO.
8. Какви видови на ван дер Валс сили се присутни во молекулите на водород пероксид, вода, водород бромид, етил алкохол, метанал?
9. Од кои параметри зависи должината на хемиската врска?
10. Како се менува енергијата на хемиската врска во водород халидната серија од водород флуорид во водород јодид?
11. Како се менува енергијата на хемиската врска помеѓу јаглеродите во низата: единечни, двојни, тројни, ароматични?
Формирање и својства на хемиски врски
Хемиска врска се формира само ако, како што атомите се приближуваат еден кон друг, вкупната енергија на системот се намалува.
Хемиското поврзување настанува кога облаците од неспарени електрони со антипаралелни вртења се преклопуваат поради електростатската интеракција на атомските јадра со зголемена густина на електрони меѓу нив.
Да го разгледаме, на пример, формирањето на врска во молекула на водород. Кога водородните атоми се спојуваат, нивните електронски облаци продираат еден во друг, што се нарекува преклопување на електронскиот облак (сл. 4.1).
Ориз. 4.1.Преклопување на електронски облаци при формирање на молекула на водород.
Се зголемува густината на електроните помеѓу јадрата. Јадрата се привлекуваат едни со други. Како резултат на тоа, енергијата на системот се намалува (сл. 4.2). Меѓутоа, кога атомите се многу блиску еден до друг, одбивноста на јадрата нагло се зголемува. Оптимално растојание помеѓу јадрата – должина на комуникација (л sv), при што системот има минимална енергија. Кога атомите преминуваат во оваа состојба, се ослободува енергија, наречена врзувачка енергија (Est).
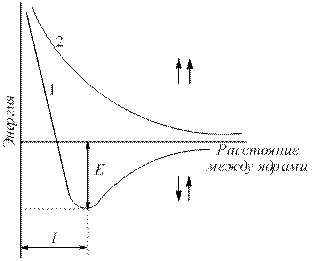
Ориз. 4.2 .
Зависност на енергијата на системи на два атоми на водород со паралелни (1) и антипаралелни (2) спини од растојанието помеѓу јадрата (Е – енергија на врзување).
Ако врската е формирана од идентични атоми, на пример H–H, Cl–Cl, NºN, тогаш споделените електрони се рамномерно распоредени меѓу нив. Оваа врска се нарекува ковалентна неполарна комуникација.
Ако еден од атомите посилно привлекува електрони, тогаш електронскиот пар се поместува кон овој атом. Во овој случај, постои поларен ковалентен поврзување. Електронегативноста (ЕО) може да послужи како критериум за способноста на атомот да привлече електрон. Колку е поголем ЕО на атомот, толку е поголема веројатноста електронскиот пар да се префрли кон јадрото на тој атом. Затоа, се карактеризира разликата во електронегативноста на атомите комуникациски поларитет.
Во случај на голема разлика во EO на атомите, на пример, помеѓу s-метали од првата и втората група од периодичниот систем и неметалите од групите VI, VII (LiF, CsCl, K 2 O, итн. ), не само поместување на густината на електроните, туку и целосна транзиција може да се случи електрон во поелектронегативен атом за да формира позитивен и негативен јон. Јонска хемиска врска е електростатско заемодејство на негативно и позитивно наелектризираните јони во хемиско соединение.
Така, врските се разликуваат по поларитет.
Поларитет на комуникација
Поларитет на комуникацијасе должи на различната електронегативност на атомите меѓу кои се формира хемиска врска.
Поради поместувањето на парот на електронската врска до поелектронегативен атом, тој добива делумно (ефективен) негативен полнеж (δ–). Вториот атом добива делумно позитивен полнеж (δ+). Така настанува дипол, кој е електрично неутрален систем со две еднакви позитивни и негативни полнежи сместени на одредено растојание. l dедни од други (должина на дипол). Мерка за поларитетот на врската е електричниот момент на диполот (μm), еднаков на производот од ефективно полнење и должината на диполот l d.
| . | (4.1) |
Електричниот момент на дипол има мерна единица кулон на метар (C×m). Како мерна единица се користи и несистемската мерна единица debye – D, еднаква на 3,3 × 10 –30 C × m (Табела 4.1).
Како што може да се види од табелата. 4.1, електричниот диполен момент се зголемува со зголемување на EO разликата.
Табела 4.1
Електричен диполен момент на хемиска врска во молекулите
| Поврзување | ЕО разлика | μ Св, Д | Поврзување | ЕО разлика | μ Св, Д |
| H–F | 1,9 | 1,98 | НО | 1,4 | 1,53 |
| Н–Сl | 0,9 | 1,03 | N–N | 0,9 | 1,3 |
| H–Br | 0,74 | 0,78 | H–S | 0,4 | 0,7 |
| Н–Јас | 0,4 | 0,38 | Н-С | 0,4 | 0,3 |
Поларна ковалентна врска со δ се приближува до 1 може да се смета за јонска врска. Сепак, дури и за јонските соединенија δ е под единството. Затоа, секоја јонска врска има одредена количина на ковалентност. Хемиската врска во повеќето хемиски соединенија ги комбинира својствата на ковалентни и јонски врски. Поларитетот на врската може да се промени.
За време на интеракцијата на атомите чии вредности на електронегативност се разликуваат, но не остро, заедничкиот електронски пар се префрла на поелектронегативен атом. Ова е најчестиот тип на хемиска врска, кој се наоѓа и во неоргански и во органски соединенија. Ковалентните врски целосно ги вклучуваат оние врски кои се формираат според механизмот донор-акцептор. формирање на амониум јон со механизам на донор-акцептор.
9 Метод на валентна врска.
Методот на валентна врска првпат бил користен во 1927 година од германските научници В. Хајтлер и Ф. Лондон, кои извршиле квантно-механичко пресметување на атомот на водород. Методот BC претпоставува дека атомите во молекулата ја задржуваат својата индивидуалност. Електронски пар ја населува орбиталата на едниот или другиот атом. Хајтлер и Лондон покажаа дека кога два атома на водород со антипаралелни вртења се приближуваат еден кон друг, енергијата на системот се намалува, што се должи на зголемувањето на густината на електроните во просторот помеѓу јадрата на атомите кои содејствуваат. Кога атомите со паралелни вртења се приближуваат еден до друг, енергијата на системот се зголемува и во овој случај не се формира молекула. Методот BC се заснова на следните основни принципи: 1) хемиска врска помеѓу два атома настанува како резултат на преклопување на AOs со формирање на електронски парови. 2) атомите кои влегуваат во хемиска врска разменуваат електрони едни со други, кои формираат сврзувачки парови. Само неспарените електрони на атомите можат да учествуваат во формирањето на заеднички електронски парови. Енергијата на размена на електрони помеѓу атомите го дава главниот придонес во енергијата на хемиската врска. Дополнителен придонес даваат Куломовите сили на интеракцијата на честичките. 3) во согласност со принципот на Паули, хемиската врска се формира само кога електроните со антипаралелни спинови комуницираат. 4) карактеристиките на хемиската врска се одредуваат според видот на преклопување на АО
Крива на сврзувачка енергија помеѓу молекулите наспроти растојанието
10 Валентност – способноста на атомот да формира хемиски врски. Мерка за валентност е бројот на хемиски врски. Валентните способности на атомот се определуваат со бројот на неспарени (валентни) електрони на надворешниот слој и бројот на врски што можат да се формираат со механизмот донор-акцептор. Состојба на оксидација - конвенционалното полнење на атом во молекула, пресметано под претпоставката дека сите врски се јонски по природа. Ова значи дека поелектронегативен атом, поместувајќи еден електронски пар кон себе, добива полнеж од -1, а два електронски парови добиваат полнење од -2. Врската помеѓу идентични атоми не придонесува за состојбата на оксидација. Така, врската помеѓу атомите C-C одговара на нивната нулта оксидациска состојба. Во врската C-H, јаглеродот, како поелектронегативен атом, има полнење од -1, а во врската C-O, полнежот на јаглеродот (помал електронегативен) е +1. Оксидационата состојба на атомот во молекулата се пресметува како алгебарски збир на полнежите што ги даваат сите врски на даден атом. Така, во молекулата CH 3 Cl, три врски C-H даваат вкупно полнење на атомот C еднаков на - 3, а врската C-Cl дава полнеж +1. Затоа, состојбата на оксидација на јаглеродниот атом во ова соединение е:
Во возбудена состојба, валентноста на атомите се зголемува. Ова се должи на феноменот на испарување и промоција ( премин кон слободна орбитала) на електрони во надворешниот слој.
11 .
Хемиска врска- меѓуатомска интеракција предизвикана од преклопување на надворешните електронски обвивки на атомите, придружено со намалување на вкупната енергија на добиениот систем. Хемиска врска може да се формира со донирање на еден или повеќе неспарени електрони од секој атом (повеќе врски) за да се формираат електронски парови (ковалентна врска), или со тоа што еден атом доминира на електронски пар, а другиот атом зафаќа празна електронска орбитала (донатор-акцептор обврзница). Само електроните од надворешната електронска обвивка учествуваат во формирањето на хемиска врска, а внатрешните нивоа на електрони не се засегнати. Како резултат на тоа, кога се формира хемиска врска, секој атом формира пополнета електронска обвивка од надворешното електронско ниво, која се состои од два (двојни) или осум (октет) електрони. Хемиската врска се карактеризира со должина и енергија. Должината на хемиската врска е растојанието помеѓу јадрата на врзаните атоми. Енергијата на хемиската врска покажува колку енергија треба да се потроши за да се одвојат два атома меѓу кои постои хемиска врска до растојанието на кое оваа хемиска врска ќе се прекине. Главните видови на хемиски врски- ковалентна, јонска, водородна, метална.
Заситеност на комуникацијатаобезбедува постојан состав на молекули и го дефинира концептот на валентност. Ако еден атом има n неспарени електрони, тогаш овој атом може да формира n хемиски врски со други атоми од кои секој има по еден неспарен електрон. Според тоа, валентноста на елементот е еднаква на бројот на неспарени електрони во атомот или бројот на формирани ковалентни врски. Принципот на сатурација е изведен од принципот на Паули и значи дека секој електрон може да учествува во формирањето на само една ковалентна врска. Поларитет на хемиски врски - карактеристика на хемиска врска, што покажува промена во распределбата на густината на електроните во просторот околу јадрата во споредба со распределбата на густината на електроните во неутралните атоми што ја формираат оваа врска.
Таканаречените ефективни полнежи на атомите се користат како квантитативна мерка за поларитетот на врската.
Ефективното полнење се дефинира како разлика помеѓу полнежот на електроните лоцирани во одреден регион на просторот во близина на јадрото и полнежот на јадрото. Сепак, оваа мерка има само условно и приближно значење, бидејќи е невозможно недвосмислено да се идентификува регион во молекулата што се однесува исклучиво на поединечен атом, а во случај на неколку врски, на одредена врска.
Присуството на ефективно полнење може да се означи со симболи на полнеж на атомите (на пример, H + δ - Cl - δ, каде δ е одредена фракција од елементарното полнење).
12 Водородна врска.Овој тип на врска може само условно да се нарече хемиски и поправилно се припишува на интермолекуларните и интрамолекуларните интеракции. Водородна врска се јавува помеѓу врзан водороден атом на една молекула и електронегативен атом на друга молекула. Водородната врска е делумно електростатска, а делумно донорска-акцепторна природа. Јасен пример за имплементација на таква врска може да биде комбинацијата на неколку молекули на вода во кластери. Во молекулата на вода, атомот на кислород ја префрла својата густина на електрони кон себе, стекнувајќи делумно негативен полнеж, а водородот, соодветно, е делумно позитивен и може да комуницира со осамениот електронски пар кислород на соседната молекула. Водородна врска може да настане не само помеѓу различни молекули, туку и во самата молекула.Ван дер Валсовата интеракција настанува поради појавата на индуцирани диполни моменти. Овој тип на интеракција може да се случи и помеѓу различни молекули и во рамките на една молекула помеѓу соседните атоми поради појавата на диполен момент во атомите за време на движењето на електроните. Интеракцијата на Ван дер Валс може да биде привлечна или одбивна. Интермолекуларната интеракција е од природата на привлечност, а интрамолекуларната интеракција е одбивна. Интрамолекуларните ван дер Валс интеракции имаат значаен придонес во геометријата на молекулата. Формирањето на меѓумолекуларни водородни врски доведува до значителна промена во својствата на супстанциите: зголемување на вискозноста, диелектричната константа, точките на топење и вриење, топлината на испарување и топење. На пример, вода , водород флуоридот и амонијакот имаат ненормално високи точки на вриење и топење. Под влијание на водородните врски се менуваат и хемиските својства. Бидејќи многу соединенија содржат ковалентни поларни H–O и H–N врски, водородните врски се многу чести. Се појавуваат не само во водата, туку и во разни кристални материи, полимери, протеини, живи организми... Поради нивните ниски вредности енергија водородните врски релативно лесно се кршат и повторно се формираат. Енергијата на водородната врска се зголемува со зголемување на електронегативноста (ЕО) и намалување на големината на атомите Б. Затоа, најсилните водородни врски се јавуваат кога атомите Б се F, O или N
13-14 Во зависност од растојанието помеѓу честичките што ја сочинуваат супстанцијата и од природата и енергијата интермолекуларна интеракција (IMI) меѓу нив, супстанцијата може да биде во една од трите состојби на агрегација: цврста, течна и гасовита.
ВО гас состојба, енергијата на интеракција помеѓу честичките е многу помала од нивната кинетичка енергија:
Е ММВ<< Е кин .
Затоа, молекулите на гасот (атомите) не се држат заедно, туку се движат слободно во волумен значително поголем од волуменот на самите честички. Силите на интермолекуларната интеракција се појавуваат кога молекулите се приближуваат доволно една до друга. Слабата интермолекуларна интеракција ја одредува малата густина на гасот, желбата за неограничено проширување и способноста да се изврши притисок врз ѕидовите на садот, што ја попречува оваа желба. Молекулите на гасот се во случајно, хаотично движење и нема ред во гасот во однос на распоредот на молекулите.
Состојбата на гасот се карактеризира со: температура - T, притисок - p и волумен - V. При ниски притисоци и високи температури, сите типични гасови се однесуваат приближно исто. Но, веќе при обични и, особено, ниски температури и високи притисоци, индивидуалноста на гасовите почнува да се појавува. Зголемувањето на надворешниот притисок и намалувањето на температурата ги зближуваат честичките на гасот, така што меѓумолекуларната интеракција почнува да се манифестира во поголема мера. За такви гасови повеќе не е можно да се примени равенката Менделеев-Клапејрон, но треба да се користи равенката Ван дер Валс:
каде што a и b се константни членови кои го земаат предвид присуството на привлечни сили помеѓу молекулите и сопствениот волумен на молекулите, соодветно.Кога гасовите се компресирани, кога има значително зголемување на нивната густина, силите ММВ стануваат сè позабележителни, што доведува до создавање услови за формирање на различни соработници од молекули. Соработниците се релативно нестабилни групи на молекули. Од природата на компонентите ММВ произлегува дека универзалните сили на интеракција се зголемуваат со зголемувањето на атомските големини (поларизираноста нагло се зголемува, затоа, колку е потешки истиот тип на честички (атоми или молекули) на супстанцијата, толку обично е поголем степенот на нивната поврзаност на дадена температура, толку е помал температури таквата супстанција преминува од гас во течност.
ВО течности MMW силите се пропорционални со кинетичката енергија на молекуларното движење:
E MMV » E kin.
Затоа, течноста има својство флуидност, го добива обликот на садот во кој се става. Особеноста на течната структура е во тоа не постои редослед на долг дострел, туку има редослед со краток дострел во распоредот на молекулите . Манифестацијата на редот со краток дострел е дека молекулите лоцирани во 1-та сфера на околината на дадената молекула се задржуваат во поголема мера во близина на неа и, на тој начин, одредуваат одреден редослед. Меѓутоа, во течностите може да се појави уште поголем ред со елемент за нарачка со долг дострел. Ова се случува во случаи кога универзалните сили на IMV се надополнуваат со специфичните сили на IMV (водородна врска)
За солидна состојба, односот на енергија е валиден:
Е ММВ > Е роднина.
Цврстата состојба на материјата главно се наоѓа во форма на кристали. Кристалите се состојат од честички (атоми, молекули, јони) на материја ориентирани на одреден начин релативно едни на други. Природата на оваа ориентација е таква што супстанциите кои се доволно оддалечени од избраната честичка се во строго дефинирана положба и на фиксно растојание. Ова својство се нарекува присуство нарачка со долг дострел во кристали. Формите на кристалите можат да бидат различни.
15 Карактеристична карактеристика на кристалната состојба е присуството системи на строго подредени честички, кој се нарекува кристална решетка. Кристалната решетка може да се добие со одредено движење (превод) во просторот на некоја најмала група на честички т.н. единица ќелија.
Карактеристиките на кристалите се: висок степен на ред (присуство на ред со краток и долг дострел), одредена симетрија на елементарните ќелии што ги формираат и, како последица на тоа, анизотропија (т.е. зависност од насоката) на својствата.
Во зависност од тоа кои честички лежат на јазлите на кристалната решетка, се разликуваат јонски, атомски, молекуларни и метални решетки.
Јонска решеткасе состои од јони со спротивен знак наизменично на јазлите. Во овој случај, јоните можат да бидат едноставни (Na +, Cl - ..) и сложени (NH 4 +, NO 3 - ...). Поради фактот што јонската врска е незаситена и ненасочена, јонската решетка се карактеризира со висока координативни броеви(c.f. = 6,8) . Координативен број - бројот на најблиските честички што ги опкружуваат избраните . Поради високата јачина на јонската врска, јонските кристални решетки се силни и нивните кристали имаат високи точки на топење. Примери на соединенија со јонски кристални решетки: NaCl, NH 4 NO 3 итн.
Атомска решеткасе состои од атоми поврзани со ковалентни врски, на пример, во дијамант, графит. Координативните броеви овде се одредуваат според бројот на s-врски на централниот атом со околните атоми и не достигнуваат големи вредности (често околу 4). Поради високата јачина на ковалентната врска, таквите решетки се многу силни, а супстанциите се карактеризираат со високи точки на топење. Познато е дека дијамантот е најтешката природна супстанција.
Молекуларна решеткасодржи молекули во јазли кои се поврзани едни со други поради меѓумолекуларните сили. Молекуларните решетки се со мала цврстина, а супстанциите со такви решетки (цврсти H 2, O 2, N 2, CO 2, H 2 O) обично имаат ниски точки на топење.
Метална решеткаможе конвенционално да се прикаже во форма на позитивно наелектризирани јони лоцирани на јазли и електрони кои се движат во меѓупростори. Координативниот број овде достигнува големи вредности (8-12). Јачината на металната решетка варира во голема мера и силно зависи од присуството на туѓи нечистотии. Во металите постои хемиска врска наречена метална врска. Во основа, Металната врска е посебен вид ковалентна врска. Настанува како резултат на „масивно“ преклопување на облаците од надворешни (валентни) електрони на метални атоми.
16
Едно од најсуштинските својства на атомите на елементите, кое одредува каква врска се формира меѓу нив - јонска или ковалентна, е Електронегативност
, т.е. способноста на атомите во соединението да привлекуваат електрони. Условната квантитативна проценка на електронегативноста е дадена со релативната скала на електронегативност. Во периоди постои општа тенденција за зголемување на електронегативноста на елементите, а во групи - за нивно намалување. Елементите се подредени во серија според нивната електронегативност, врз основа на која може да се спореди електронегативноста на елементите лоцирани во различни периоди. Видот на хемиската врска зависи од тоа колку е голема разликата во вредностите на електронегативност на поврзувачките атоми на елементите. Колку повеќе атомите на елементите што ја формираат врската се разликуваат по електронегативност, толку е поларна хемиската врска. Нацртајте остра линија помеѓу типовите
хемиски врски не се можни. Во повеќето соединенија, типот на хемиската врска е среден; на пример, високополарен ковалентен
хемиската врска е блиску до јонска врска. Во зависност од тоа кој од ограничувачките случаи хемиската врска е поблиска по својата природа, таа се класифицира или како јонска или како ковалентна поларна врска. Јонска врска
е екстремен случај на поларизирана ковалентна врска, кога заедничкиот електронски пар целосно му припаѓа на еден од атомите. Во овој случај, на еден од атомите се реализира целосно позитивен полнеж, а на другиот целосно негативен полнеж. Овој тип на врска е карактеристичен за солите. На пример, натриум хлорид е NaCl. Секој од атомите придонесува по еден електрон да формира заеднички електронски пар. Сепак, Cl целосно го поместува добиениот електронски пар кон себе и со тоа добива целосен негативен полнеж, а Na, кој во овој случај нема ниту еден електрон на надворешното електронско ниво, има целосен позитивен полнеж. Најважните разлики помеѓу јонските врски и другите видови хемиски врски се недостаток на насокаИ незаситеност. Затоа кристалите формирани поради јонските врски гравитираат кон различни густи пакувања на соодветните јони.
17 Просторна структура на молекулитезависи од природата на хемиската врска што се јавува помеѓу атомите, а со тоа и од структурата на нивната електронска обвивка. Бидејќи електроните од типот s-, p-, d- и f-тип од секој од атомите во интеракција можат да учествуваат во хемиска врска, структурата на молекулите зависи од видот и бројот на електроните, како и од можноста за формирање на хибрид обврзници. Често хемиските врски се формираат од електрони лоцирани во различни атомски орбитали (на пример, s - и p - орбитали). И покрај ова, врските се покажаа со еднаква вредност и се наоѓаат симетрично, што е обезбедено хибридизација на атомски орбитали . Орбиталната хибридизација е промена на обликот на некои орбитали при формирање на ковалентна врска за да се постигне поефикасно преклопување на орбиталите.Како резултат на хибридизацијата се појавуваат нови хибридни орбитали кои се ориентирани во просторот на тој начин што по нивното преклопување со орбиталите на другите атоми, добиените електронски парови се колку што е можно подалеку еден од друг пријател. Ова ја минимизира енергијата на одбивање помеѓу електроните во молекулата.Хибридизацијата не е реален процес. Овој концепт беше воведен за да се опише геометриската структура на молекулата. Обликот на честичките кои произлегуваат од формирањето на ковалентни врски кои вклучуваат хибридни атомски орбитали зависи од бројот и видот на овие орбитали. Во овој случај, σ-врските создаваат цврст „скелет“ на честичката:
Орбитали вклучени во хибридизација. Вид на хибридизација Просторен облик на молекулата Примери
S,P sp – хибридизација Линеарен BeCl2
s, p, p sp 2 – хибридизација Триаголен (рамен тригонален) AlCl 3
s, p, p, p sp 3 – хибридизација Tetrahedral CH 4
Ако електронските облаци се преклопуваат долж линијата што ги поврзува центрите на атомите, тогаш таквата ковалентна врска се нарекува сигма ( )-врска
Ковалентна врска формирана со странично преклопување Р-орбитали на соседните јаглеродни атоми се нарекува пи ( )-врска.
