Jumlah bahan. Mol ialah unit kuantiti bahan. Nombor Avogadro
Sebagai tambahan kepada yang dibincangkan sebelum ini mutlak dan jisim relatif atom dan molekul, dalam kimia sangat penting mempunyai nilai istimewa - jumlah bahan. Jumlah bahan ditentukan oleh nombor unit struktur(atom, molekul, ion atau zarah lain) bahan ini. Jumlah bahan dilambangkan dengan huruf ν. Anda sudah tahu bahawa mana-mana kuantiti fizik mempunyai unit ukurannya sendiri. Sebagai contoh, panjang badan diukur dalam meter, jisim bahan diukur dalam kilogram. Bagaimanakah jumlah bahan diukur? Untuk mengukur jumlah bahan, terdapat unit khas - tahi lalat.
Tahi lalat ialah jumlah bahan yang mengandungi seberapa banyak zarah (atom, molekul atau lain-lain) kerana terdapat atom karbon dalam 0.012 kg (iaitu 12 g karbon. Ini bermakna satu mol zink, satu mol aluminium, satu mol karbon mengandungi satu dan bilangan atom yang sama Ini juga bermakna satu mol oksigen molekul, satu mol air mengandungi bilangan molekul yang sama Dalam kedua-dua kes pertama dan kedua, bilangan zarah (atom, molekul) yang terkandung dalam satu mol adalah sama 1023 zarah yang terdiri daripada bahan Jika bahan terdiri daripada atom (contohnya, zink, aluminium, dll.), maka satu mol bahan ini ialah 6.02 x 1023 daripada atomnya , oksigen, air, dsb.), maka satu tahi lalat bahan ini ialah 6.02 x 1023 daripada molekulnya Nilai 6.02 x 1023 ini dinamakan sempena nama saintis Itali terkenal Amedeo Avogadro "pemalar Avogadro" dan dilambangkan dengan NA. Nombor Avogadro menunjukkan bilangan zarah dalam satu mol bahan, jadi ia boleh mempunyai dimensi "zarah / mol". Walau bagaimanapun, kerana zarah boleh berbeza, perkataan "zarah" ditinggalkan dan sebaliknya unit ditulis dalam dimensi nombor Avogadro: "1/mol" atau "mol-1". Oleh itu: NA = 6.02 1023.
Nombor Avogadro sangat besar. Mari bandingkan: jika anda mengumpul 6.02 · 1023 bola dengan jejari 14 sentimeter, maka jumlah isipadunya akan lebih kurang sama dengan keseluruhan planet Bumi kita.
Untuk menentukan bilangan atom (molekul) dalam jumlah bahan tertentu, anda mesti menggunakan formula berikut: N = ν NA,
di mana N ialah bilangan zarah (atom atau molekul).
Sebagai contoh, mari kita tentukan bilangan atom aluminium yang terkandung dalam 2 mol bahan aluminium: N (Al) = ν (Al) · NA.
N (Al) = 2 mol · 6.02 · 1023 = 12.04 · 1023 (atom).
Selain itu, anda boleh menentukan jumlah bahan dengan nombor yang diketahui atom (molekul): ![]()
Kuantiti bahan ialah bilangan zarah dalam bahagian bahan.
Jumlah bahan ditunjukkan huruf Yunani ν (“bogel”)
Tahi lalat ialah unit kuantiti sesuatu bahan. Ini ialah jumlah bahan (atau sebahagian daripadanya) yang mengandungi 6.02 · 10 23 zarah (molekul, atom atau zarah lain). Bulat: 6 · 10 23 .
Nilai 6.02 10 23 mol -1 dipanggil pemalar Avogadro dan dilambangkan huruf latin dan indeks N A:
N A = 6.02· 10 23 mol
Jadi, satu mol sebarang bahan mengandungi 6.02 · 10 23 molekul, atom atau zarah lain.
Contohnya, 1 mol air H 2 O mengandungi 6 · 10 23 molekul H 2 O;
1 mol besi Fe mengandungi 6 10 23 atom Fe.
1 mol klorin Cl 2 mengandungi 6 10 23 molekul Cl 2.
Pada masa yang sama, 1 mol klorin Cl2 mengandungi 2 mol atom klorin Cl.
Oleh itu, apabila menulis notasi dalam kurungan, nyatakan formula zarah yang dimaksudkan:
N(Cl 2) ialah bilangan molekul klorin, dan N(Cl) ialah bilangan atom klorin;
ν(Cl 2) ialah jumlah bahan klorin molekul, dan ν(Cl) ialah jumlah bahan klorin atom.
Sebagai contoh, mari kita tentukan bilangan molekul yang terkandung dalam air dalam jumlah 0.5 mol:
N(H 2 O) = N A ν(H 2 O) = 6 10 23 mol -1 0.5 mol = 3 10 23.
Jisim molar bahan-bahan M(X) adalah sama dengan nisbah jisim bahan m(X) kepada jumlah bahan yang sepadan ν(X):
m(X)
M(X) = --
ν(X)
Jisim molar dinyatakan dalam gram per mol (g/mol) atau kilogram per mol (kg/mol).
1 g/mol = 10 -3 kg/mol.
Jisim molarM sama dengan jisim molekul relatifM r (jika bahan terdiri daripada molekul) atau jisim atom relatifA r (jika bahan terdiri daripada atom).
Sebagai contoh, menurut jadual berkala, jisim atom magnesium Mg ialah 24, dan jisim molarnya ialah 24 g/mol. Iaitu, berat 1 mol magnesium ialah 24 gram. Atau, dengan kata lain, 24 gram magnesium mengandungi 6 10 23 atom magnesium.
Tahi lalat. Satu mol diambil sebagai unit kuantiti bahan. Ini adalah jumlah bahan yang mengandungi begitu banyak zarah bersyarat, berapa banyak atom yang terkandung dalam 0.012 kg karbon-12, iaitu 6.02045 10 23. Zarah bersyarat boleh menjadi molekul, ion, elektron, kumpulan zarah (contohnya, kumpulan berfungsi, sebahagian daripada molekul, sekutu, radikal, dll.). Dalam satu perkataan, zarah bersyarat ialah sebarang unit bahan diskret (termasuk objek makro, contohnya, meja, kerusi, kaki meja, dll.). Sesetengah zarah bersyarat sebenarnya wujud (molekul H 2, IO 3 - ion, meja, kerusi), yang lain - secara bersyarat (molekul NaCI dalam larutan, setengah molekul, proton dalam larutan).
Objek makro mudah dikira secara individu. Manakala objek mikro (atom, molekul, dll.) tidak boleh dikira dalam objek makro. Oleh itu, unit "mol" zarah konvensional adalah mudah dan biasanya digunakan untuk menyatakan bilangan objek mikro adalah tidak sesuai untuk menggunakannya untuk menganggarkan bilangan objek makro. Untuk menyatakan bilangan mol sesuatu bahan, gunakan simbol n . Menulis n(H +)= 1.0·10 -6 mol bermakna 6.02·10 23 10 -6 proton;
n(1/5KMn0 4) = 0.05 mol - 6.02·10 23 ·0.05 zarah konvensional 1/5KMnO 4 ;
n(e)=1 mol - 6.02·10 23 elektron.
Dalam latihan analisis kimia maklumat sedemikian jarang diperlukan.
Jisim molar (M) - Ini ialah jisim 1 mol bahan. Jika terdapat bahan dengan jisim m, Itu M = m/n. Jisim molar mempunyai dimensi g mol -1.
Secara berangka, jisim molar adalah sama dengan jisim molekul relatif, iaitu, jumlah jisim semua atom dalam zarah, dibahagikan dengan 1/12 daripada jisim atom karbon. relatif jisim molekul- kuantiti tanpa dimensi, ia boleh dikira dengan mudah daripada jadual jisim atom elemen.
Isipadu molar (V o) - ialah isipadu 1 mol bahan pada keadaan biasa. Biasanya nilai ini digunakan untuk gas, dalam kes ini V o = 22.4 l mol -1.
Cas molar (Q) - Ini ialah jumlah cas bagi 1 mol bahan itu. Untuk zarah bercas tunggal Q= 96485 C mol -1 (nombor Faraday, F), untuk pengecas z Q=zF.
Cara untuk menyatakan penumpuan. DALAM kimia Analisis sering berurusan dengan jumlah bahan dalam isipadu tertentu, iaitu dengan penumpuan. Ini amat penting untuk bahan dalam larutan. Unit isipadu ialah meter padu(m 3) atau desimeter padu (dm 3), yang betul-betul sama dengan 1 liter (l).
Kepekatan molar c - nisbah bilangan mol zat terlarut kepada isipadu larutan. Istilah ini digunakan untuk sebarang jenis zarah bersyarat (atom, ion, molekul, bahagian molekul, dll.). Oleh itu, kepekatan molar dinyatakan dalam mol dm -3 atau mol l -1 (mol zat terlarut per liter larutan), disingkatkan sebagai M.
Contohnya, c(HC1)=0.1 mol-l -1 atau c(HC1)=0.1 M; c(1/5KMn0 4)=0.05 mol l -1 atau 0.05M(l/5 KMnO 4).
Mari kita pertimbangkan cara lain untuk menyatakan tumpuan. Kepekatan jisim- nisbah jisim terlarut Cik kepada isipadu larutan V, unit kepekatan jisim kg dm -3 atau kg l -1, serta berbilang subganda*.
Kepekatan isipadu - nisbah isipadu zat terlarut kepada isipadu larutan.
Selalunya komposisi penyelesaian atau objek lain dinyatakan dalam bahagian komponen daripada jumlah keseluruhan bahan. Kemudahan kaedah menyatakan komposisi ini terletak pada kebebasannya daripada keadaan agregat objek.
**** Kepekatan jisim, dinyatakan dalam gram bahan per mililiter, dipanggil kapsyen. Unit ini memberikan namanya kaedah klasik analisis - titrimetri.
"Kadaran" bermaksud nisbah bilangan bahagian komponen kepada jumlah nombor bahagian objek. Bergantung kepada unit yang dipilih, pecahan molar (a), jisim (ω), isipadu (φ) dibezakan:
Bahagian dinyatakan sebagai peratusan ( pecahan jisim dinyatakan sebagai peratusan dipanggil peratusan kepekatan), bahagian per juta (ppm), bahagian per bilion (ppb), bahagian per trilion (ppt). Unit ppm, ppb dan ppt berguna untuk menilai kuantiti bahan yang kecil. Dalam kes ini, pecahan (a, ω atau φ) hendaklah didarab dengan 10 6, 10 9 atau 10 12 untuk mendapatkan integer mudah atau hampir dengannya.
Contoh 1. Kandungan asid askorbik dalam infusi rosehip ialah 5.5 mg setiap 1 liter. Nyatakan kandungan asid askorbik dalam pecahan jisim.
Mari kita cari pecahan jisim asid askorbik dalam larutan (memandangkan 1 liter mempunyai jisim 10 3 g):
![]()
Nombor ini menyusahkan untuk pengiraan. Mari kita tukarkan kepada unit ppm (juta -1):
5.5 10 -6 ·10 6 =5.5 juta-l.
Molaliti - jumlah bahan per unit jisim (1 kg) pelarut. Kelebihan molaliti adalah bebas daripada suhu. Walau bagaimanapun, unit ini jarang digunakan dalam kimia analisis.
Bersamaan. Terdapat hubungan tertentu antara zarah konvensional dalam sebatian, dipanggil stoikiometrik. Sebagai contoh, dalam molekul NaCI satu atom natrium terikat kepada satu atom klorin, dalam molekul H 2 CO 3 dua proton terikat kepada satu zarah CO 3 2-. Hubungan stoikiometri juga diwujudkan antara zarah yang bertindak balas, contohnya dalam tindak balas
aA + bB = cC + dD
dan zarah bersyarat bahan A bertindak balas dengan b zarah bersyarat bahan B. Akibatnya, satu zarah A bersamaan dengan zarah b/a bahan B.
Nisbah b/a dipanggil faktor kesetaraan bahan B dan dilambangkan dengan ¦ eq (B), dan zarah bersyarat B yang sepadan dengan zarah A dalam tindak balas yang diberi ialah b/a B atau ¦ eq B(B). Sebagai contoh, dalam tindak balas
2HC1 + Na 2 CO 3 = NaCI + H 2 CO 3
¦ eq (Na 2 CO 3) = 1/2 , dan yang setara ialah zarah konvensional 1/2 Na 2 CO 3.
Bahan bertindak balas antara satu sama lain dengan setara - ini hukum gandaan Dalton dalam kimia analitik berfungsi sebagai asas untuk semua pengiraan kuantitatif, terutamanya dalam kaedah analisis titrimetri.
Mol setara, seperti mol zarah, mengandungi 6.02 10 23 setara, dan jisim molar setara secara numerik adalah sama dengan jumlah jisim atom semua atom konstituennya. Setara bahan yang sama mungkin berbeza bergantung pada tindak balas. Sebagai contoh, dalam tindak balas
HC1 + Na 2 CO 3 = NaHCO 3 + NaCI
setara dengan natrium karbonat ialah zarah konvensional Na 2 CO 3 (¦ eq = 1), manakala dalam tindak balas di atas 1/2 Na 2 CO 3 (¦ eq = 1/2).
Dalam tindak balas asid-bes, setara ialah zarah bersyarat yang dalam tindak balas tertentu bergabung, menggantikan, membebaskan satu ion hidrogen, atau dalam beberapa cara lain bersamaan dengan satu ion hidrogen. Dalam tindak balas redoks, setara ialah zarah bersyarat yang dalam tindak balas tertentu menambah atau menderma satu elektron (atau dalam beberapa cara lain bersamaan dengan satu elektron).
Dalam amalan, mereka tidak berurusan dengan setara individu atau satu tindakan kimia, tetapi dengan agregat zarah yang besar. Dalam kes ini, hubungan stoikiometri antara bahan ditunjukkan dalam nisbah jumlah bahan dalam tahi lalat:
p(A):p(B)=a:b
2.2. Memilih Kaedah Analisis
Apabila memilih kaedah analisis, anda perlu mengetahui dengan jelas tujuan analisis, masalah yang perlu diselesaikan, dan menilai kelebihan dan kekurangan kaedah analisis yang ada.
Sebelum mempertimbangkan faktor-faktor yang mesti diambil kira semasa memilih kaedah analisis tertentu, kita akan membincangkan konsep kaedah dan teknik.
Kaedah - ini ialah satu set prinsip yang mendasari analisis tanpa mengira objek dan bahan khusus yang ditentukan;
metodologi - Penerangan terperinci semua keadaan dan operasi untuk menganalisis objek tertentu.
Sebagai contoh, kaedah analisis gravimetrik adalah berdasarkan penentuan jisim sebatian yang mengandungi atau, kurang kerap, kehilangan komponen yang ditentukan. Teknik untuk penentuan gravimetrik komponen termasuk: perihalan syarat untuk pemendakan sebatian yang tidak larut ini, kaedah untuk mengasingkan mendakan daripada larutan, menukar bahan termendak kepada bentuk yang sesuai untuk ditimbang, dsb. Apabila menentukan komponen dalam objek tertentu Metodologi juga termasuk penerangan tentang operasi pensampelan dan menyediakannya untuk analisis (contohnya, melarutkan sampel dalam pelarut yang sesuai dan menghapuskan pengaruh bahan yang mengganggu penentuan). Mari kita lihat faktor utama yang perlu diambil kira semasa memilih kaedah dan metodologi.
Kandungan komponen. Apabila memilih kaedah analisis, adalah perlu untuk mengambil kira kandungan yang dijangkakan bagi komponen yang dikesan atau ditentukan. Penting bukan sahaja untuk menilai peratusan komponen dalam sampel, kepekatannya dalam larutan yang dianalisis, tetapi juga jumlah bahan yang boleh diambil untuk analisis. Oleh itu, pilihan kaedah analisis ditentukan oleh kandungan mutlak komponen.
Kepekatan komponen yang ditentukan dan jumlah sampel yang disediakan untuk analisis boleh berbeza-beza dalam had yang luas. Oleh itu, kandungan kuprum, nikel, kromium boleh berpuluh-puluh peratus dalam aloinya, persepuluh dan perseratus peratus dalam mineral, bijih, aloi logam lain. Pada masa yang sama, kandungan logam ini dalam tumbuhan, organisma hidup, dan produk makanan mesti ditentukan sudah dalam n 10 -7 - P 10 -5 %, dan terutamanya dalam bahan tulen - dalam n 10 -8 -10 -6 %.
Jumlah sampel yang diterima untuk analisis dalam beberapa kes mungkin tidak terhad, tetapi dalam yang lain (penentuan kemasukan dalam mineral, analisis darah, biojisim, objek angkasa, dll.) adalah sangat kecil (miligram atau bahkan pecahan miligram).
 Sensitiviti
kaedah atau teknik ditentukan oleh jumlah bahan minimum yang boleh dikesan atau ditentukan oleh kaedah tertentu, menggunakan teknik tertentu (takrifan yang lebih ketat tentang konsep ini dan ungkapan kuantitatif lihat kemudian dalam bab ini). Dalam Rajah. Jadual 2.1 menunjukkan sensitiviti relatif beberapa kaedah. Pokoknya kandungan ditentukan menunjukkan keupayaan kaedah dan hasil terbaik, dicapai dalam penentuan beberapa bahan.
Sensitiviti
kaedah atau teknik ditentukan oleh jumlah bahan minimum yang boleh dikesan atau ditentukan oleh kaedah tertentu, menggunakan teknik tertentu (takrifan yang lebih ketat tentang konsep ini dan ungkapan kuantitatif lihat kemudian dalam bab ini). Dalam Rajah. Jadual 2.1 menunjukkan sensitiviti relatif beberapa kaedah. Pokoknya kandungan ditentukan menunjukkan keupayaan kaedah dan hasil terbaik, dicapai dalam penentuan beberapa bahan.
Dengan membandingkan sensitiviti pelbagai kaedah dan menganggarkan anggaran kandungan komponen dalam sampel, ahli kimia memilih satu atau kaedah analisis yang lain. Sebagai contoh, untuk menentukan kandungan natrium dalam batu silikat, kaedah gravimetrik digunakan, yang memungkinkan untuk menentukan miya-digram dan jumlah natrium yang lebih tinggi; untuk menentukan kuantiti mikrogram unsur yang sama dalam tumbuhan dan sampel biologi asal haiwan - kaedah fotometri nyalaan; untuk penentuan natrium dalam air ketulenan khas (kuantiti nano dan picogram) - kaedah spektroskopi laser.
Pemilihan kaedah. Apabila menjalankan analisis, mereka berurusan dengan pelbagai jenis objek - produk perindustrian dan pertanian, objek persekitaran, objek angkasa, karya seni, dsb. Sememangnya, pilihan kaedah dan teknik analisis ditentukan bukan sahaja oleh tugas analisis, tetapi juga oleh sifat dan ciri sampel. Ia adalah perlu untuk mengambil kira sifat fizikal objek yang dianalisis: itu keadaan pengagregatan, turun naik, higroskopisitas, kekuatan mekanikal, dsb. Faktor penentu apabila memilih kaedah analisis ialah Sifat kimia sampel. Dalam kes ini, adalah penting untuk mengetahui dan mengambil kira: sifat kimia asas sampel, sering dipanggil matriks objek yang dianalisis; komposisi kimia kualitatif sampel; sifat kimia komponen yang ditentukan dan kekotoran yang disertakan.
Mengetahui sifat kimia asas dan komponen jangkaan objek yang dianalisis, menilai kemungkinan gangguan, pilih seberapa banyak yang mungkin kaedah terpilih , iaitu kaedah yang mana, dalam keadaan tertentu, komponen yang dikehendaki boleh dikesan atau dikenal pasti tanpa gangguan daripada komponen lain yang ada. Dalam kesusasteraan kimia, bersama-sama dengan istilah "selektiviti", istilah "selektiviti" digunakan.
Jika kaedah atau teknik membenarkan pengesanan atau penentuan hanya satu komponen, maka ia dipanggil khusus .
Kita boleh bercakap tentang selektiviti kaedah, teknik dan tindak balas individu yang mendasari pengesanan atau penentuan komponen. Oleh itu, kaedah seperti ionometri, penyerapan atom dan kaedah enzimatik dicirikan oleh selektiviti yang tinggi. Banyak tindak balas yang mendasari teknik juga sangat selektif.
Sebagai contoh, pembentukan sebatian kompleks tertentu dengan reagen organik, tindak balas enzim dan elektrokimia. Tindak balas interaksi iodin dengan kanji atau bahan yang mengandungi ammonium dengan alkali, yang digunakan untuk mengesan iodin atau ion ammonium, adalah khusus.
Teknik analisis kimia boleh dibuat lebih selektif dengan mengubah keadaan analisis (pH sederhana, kepekatan reagen, pelarut, dll.); menghapuskan pengaruh komponen yang mengganggu dengan menukarkannya ke dalam bentuk tidak reaktif (menopeng) atau mengasingkannya (kerpasan, pengekstrakan, kromatografi) daripada komponen utama. Contoh teknik yang sangat selektif ialah penentuan nikel dalam keluli dengan kaedah gravimetrik menggunakan tindak balas pemendakan sebatian kompleks nikel yang tidak larut dengan dimetilglioksim. Pemendakan dilakukan dalam persekitaran ammonia yang lemah; besi bertopeng dengan asid tartarik atau sitrik.
Memandangkan kaedah dan teknik, ia harus dikatakan tentang mereka serba boleh - keupayaan untuk mengesan atau mengenal pasti banyak komponen. Ia amat berharga untuk dapat mengesan atau menentukan banyak komponen secara serentak daripada sampel tunggal, i.e. menganalisis sistem multikomponen. Pemilihan kaedah yang tinggi dan serba boleh tidak bercanggah antara satu sama lain: banyak kaedah sejagat analisis dicirikan oleh selektiviti tinggi untuk menentukan komponen individu, contohnya, kaedah seperti kromatografi, beberapa jenis voltammetri, spektroskopi pelepasan atom. Menggunakan kaedah spektroskopi pelepasan atom menggunakan plasma dan meter kuantum yang digandingkan secara induktif, 25-30 unsur berbeza boleh ditentukan daripada satu sampel (tanpa pemisahan).
Ketepatan analisis ialah ciri kolektif kaedah atau teknik, termasuk ketepatan dan kebolehulangannya. Apabila mereka bercakap tentang ketepatan tinggi, andaikan bahawa keputusan adalah betul dan penyebaran data analisis adalah tidak penting. Ketepatan sering dicirikan oleh ralat relatif (ralat) penentuan sebagai peratusan.
Keperluan untuk ketepatan analisis biasanya ditentukan oleh tujuan dan objektif analisis, dan sifat objek. Ia tidak perlu sentiasa berusaha untuk ketepatan yang tinggi.
Sebagai contoh, semasa pemantauan rutin banyak industri metalurgi dan kimia, penentuan komponen boleh dilakukan dengan ralat 10-15%. Dalam kes di mana penting untuk mengetahui dengan lebih tepat kedua-dua kandungan komponen utama dan kandungannya kekotoran berbahaya(contohnya, dalam bidang farmaseutikal dan Industri Makanan), ralat tidak boleh lebih tinggi daripada 0.1-1%. Untuk semikonduktor, ralat dalam menentukan komponen utama hendaklah di bawah 0.1%, dan jika boleh 0.01%, kerana ciri-ciri fizikal sebatian ini sebahagian besarnya bergantung pada ketekalan komposisi stoikiometrinya.
Kaedah gravimetrik dan titrimetri agak tepat, ralatnya biasanya 0.05- 0,2 dan 0.1-0.5%. Daripada kaedah moden, yang paling tepat ialah coulometrik, membolehkan penentuan komponen dengan ralat 0.001-0.01%.
Sebagai peraturan, keperluan untuk ketepatan analisis kimia ditentukan oleh ahli teknologi, ahli geologi, doktor, ahli fizik, dll. Tetapi ahli kimia analitik harus sentiasa mempunyai pemahaman sendiri keperluan untuk mencapai satu atau lain ketepatan semasa menjalankan analisis. Keperluan yang tidak wajar untuk ketepatan penentuan yang tinggi biasanya memanjangkan dan meningkatkan kos analisis kimia. Oleh itu, apabila ketepatan menentukan bilangan komponen meningkat daripada 2 kepada 0.2%, masa analisis meningkat lebih daripada 20 kali ganda. Keperluan yang berlebihan untuk ketepatan sering membawa kepada keperluan untuk menggunakan peralatan yang kompleks dan mahal. Oleh itu, penyelidik mesti mempunyai pendekatan yang jelas untuk memilih kaedah yang lebih atau kurang tepat, terutamanya semasa menjalankan analisis kimia massa.
Kaedah nyata. Keperluan untuk ekspresif , iaitu, kelajuan analisis, sering dikemukakan sebagai salah satu keperluan utama apabila memilih kaedah atau teknik analisis. Tugasan analisis kadangkala menentukan keperluan untuk memilih kaedah ekspres. Sebagai contoh, semasa penukar lebur keluli, yang berlangsung selama 15-30 minit, kandungan unsur ditentukan berulang kali, iaitu, setiap analisis perlu mengambil masa beberapa minit sahaja. Apabila melakukan operasi pembedahan, kadangkala terdapat keperluan untuk menentukan kepekatan biologi dalam darah atau tisu pesakit dalam masa beberapa minit. sebatian aktif(urea, glukosa, ubat, dll.).
Terdapat kaedah yang membolehkan analisis dijalankan dengan cepat. Oleh itu, kaedah spektroskopi pelepasan atom menggunakan meter kuantum memungkinkan untuk menentukan 15-20 unsur dalam beberapa saat; Kaedah ionometri menggunakan elektrod selektif ion, termasuk elektrod enzim, yang masa tindak balasnya kepada kandungan komponen ialah 0.5-1 min.
Perlu diingatkan bahawa dalam kebanyakan teknik, mengukur isyarat yang berkaitan dengan kandungan biasanya merupakan langkah yang agak cepat. Kebanyakan masa semasa analisis kimia dibelanjakan untuk penyediaan sampel. Oleh itu, selain daripada itu syarat sama rata Untuk mengurangkan masa analisis, anda harus memilih kaedah yang paling selektif yang tidak memerlukan penyediaan sampel khas.
Kos analisis. Apabila memilih kaedah analisis, selalunya peranan besar, terutamanya apabila menjalankan analisis bersiri dan massa, lakonan kos analisis kimia, yang termasuk kos peralatan yang digunakan, reagen, masa kerja penganalisis, dan kadangkala sampel itu sendiri.
Kaedah berbeza dalam kos perkakasan. Yang paling murah ialah kaedah titrimetrik, gravimetrik, dan potensiometrik. Peralatan dengan kos yang lebih tinggi digunakan, contohnya, dalam voltammetri, spektrofotometri, luminescence, dan penyerapan atom. Kos tertinggi peralatan yang digunakan dalam kaedah analisis pengaktifan neutron, spektrometri jisim, spektroskopi NMR dan EPR, dan spektroskopi pelepasan atom plasma berganding induktif.
Apabila menganggarkan kos analisis, kos dan ketersediaan reagen juga diambil kira; masa yang dihabiskan untuk mengesan atau mengenal pasti satu komponen; jisim sampel yang dianalisis, terutamanya dalam kes di mana bahan objek yang dianalisis itu sendiri mahal (aloi dan jongkong logam platinum, emas, dll.). Semua perkara lain adalah sama, untuk menyelesaikan masalah, anda harus memilih kaedah dan teknik analisis yang paling murah.
Automasi analisis. Apabila menjalankan analisis homogen massa, anda harus memilih kaedah yang membolehkan automasi analisis, yang membolehkan anda memudahkan kerja penganalisis dengan menggantikan banyak operasi manual, intensif buruh dengan yang automatik, mengurangkan ralat operasi individu, meningkatkan kelajuan analisis, mengurangkan kosnya, menjalankan analisis pada jarak jauh, dsb.
Dalam kaedah analisis moden, kecenderungan ke arah automasi semakin meningkat. Walaupun automasi analisis sering memerlukan kos yang tinggi, penggunaannya adalah disebabkan oleh proses automasi pengeluaran secara umum dan keperluan yang sentiasa meningkat untuk kawalan kualiti produk. Untuk maklumat lanjut tentang automasi, lihat Bab 16.
Keperluan lain untuk kaedah analisis. Sebagai tambahan kepada faktor-faktor yang disenaraikan di atas yang diambil kira semasa memilih kaedah dan teknik, tugasan analisis mungkin mengenakan keperluan khusus lain pada kaedah tersebut.
Contohnya, menjalankan analisis tanpa memusnahkan sampel (analisis tidak merosakkan) adalah perlu apabila menganalisis karya seni, objek arkeologi, objek forensik dan sebagainya. Dalam kes ini, analisis sering dijalankan menggunakan kaedah pendarfluor sinar-X dan fizik nuklear.
Dalam analisis kimia kemasukan, mikrofasa jongkong logam, sampel geologi dan arkeologi; semasa analisis lapisan demi lapisan filem; penjelasan tentang komposisi noda, pukulan dalam manuskrip, dalam objek pemeriksaan forensik, dan lain-lain perlu dilakukan analisis tempatan . Dalam analisis ini, masukkan ciri baru kaedah - resolusi spatial , iaitu, keupayaan untuk membezakan antara kawasan sampel yang berjarak rapat. Resolusi spatial ditentukan oleh diameter dan kedalaman kawasan yang dimusnahkan semasa analisis. Resolusi spatial tertinggi boleh dicapai kaedah moden analisis tempatan, - 1 µm pada permukaan dan sehingga 1 nm (iaitu, beberapa lapisan monoatomik) secara mendalam. X-ray digunakan dalam analisis tempatan kaedah spektrum(penganalisis mikro kuar elektron), kaedah spektrum pelepasan atom dengan pengujaan laser, spektrometri jisim.
Satu daripada tugas penting kimia analitik moden - kimia pengalir analisis dari jauh (analisis jauh). Masalah ini timbul semasa menganalisis objek angkasa, penerokaan dasar Lautan Dunia, apabila menganalisis bahan radioaktif atau lain-lain yang berbahaya kepada kesihatan manusia. Masalah analisis pada jarak sering diselesaikan menggunakan fizik nuklear, spektrometri jisim dan kaedah lain.
Oleh itu, nombor besar Faktor-faktor yang perlu dinilai dan diambil kira semasa memilih kaedah analisis dan kaedah optimum untuk mengesan atau menentukan komponen menjadikan peringkat analisis kimia ini agak rumit. Sedikit bantuan penganalisis boleh mendapatkan dengan menyelesaikan masalah ini menggunakan simulasi komputer.
2.3. Isyarat analisis. Pengukuran
Selepas pensampelan dan penyediaan sampel, peringkat analisis kimia bermula, di mana komponen dikesan atau kuantitinya ditentukan. Untuk tujuan ini, mereka mengukur isyarat analisis. Dalam sesetengah kes, adalah mungkin untuk menentukan kandungan secara langsung. Sebagai contoh, dalam kaedah gravimetrik, jisim komponen yang ditentukan, contohnya, unsur sulfur atau karbon, kadangkala diukur secara langsung. Dalam kebanyakan kaedah
isyarat analisis ialah purata ukuran kuantiti fizikal pada peringkat akhir analisis, berkaitan secara fungsional dengan kandungan komponen yang ditentukan.
Ini mungkin kekuatan semasa, EMF sistem, ketumpatan optik, keamatan sinaran, dsb.
Sekiranya perlu untuk mengesan mana-mana komponen, ia biasanya ditetapkan penampilan isyarat analitik - kemunculan mendakan, warna, garisan dalam spektrum, dsb. Kemunculan isyarat analitik mesti direkodkan dengan pasti. Apabila menentukan jumlah komponen, ia diukur magnitud isyarat analitik: jisim sedimen, kekuatan semasa, keamatan garis spektrum, dsb. Kemudian kandungan komponen dikira menggunakan isyarat analitik - hubungan fungsi kandungan: y=f(c), yang ditubuhkan melalui pengiraan atau pengalaman dan boleh dibentangkan dalam bentuk formula, jadual atau graf. Kandungan boleh dinyatakan sebagai jumlah mutlak komponen yang ditentukan dalam tahi lalat, dalam unit jisim, atau melalui kepekatan yang sepadan.
Apabila mengukur isyarat analisis, kehadiran isyarat analisis berguna, yang merupakan fungsi kandungan komponen yang ditentukan, diambil kira, dan latar belakang isyarat analitik, disebabkan oleh kekotoran komponen yang ditentukan dan mengganggu komponen dalam larutan, pelarut dan matriks sampel, serta "bunyi" yang timbul dalam alat pengukur, penguat dan peralatan lain. Bunyi ini tidak berkaitan dengan komponen yang ditentukan, tetapi ditumpangkan pada isyarat analitiknya sendiri. Tugas penganalisis adalah untuk meminimumkan magnitud isyarat latar belakang analisis dan, yang paling penting, untuk meminimumkan turun naiknya. Biasanya, isyarat latar belakang analitikal diambil kira semasa melakukan eksperimen kawalan (kosong), apabila, melalui semua peringkat analisis kimia, sampel dijalankan yang tidak mengandungi komponen yang ditentukan. Isyarat berguna dalam kes ini ialah isyarat analitik yang sama dengan perbezaan antara isyarat analitik yang diukur dan isyarat latar belakang analitikal.
berdasarkan pergantungan sedia ada Di antara isyarat analitik dan kandungan, kepekatan komponen yang ditentukan ditemui. Biasanya, keluk penentukuran, piawaian atau kaedah tambahan digunakan. Kaedah lain untuk menentukan kandungan komponen yang diterangkan dalam literatur biasanya pengubahsuaian tiga kaedah utama ini.
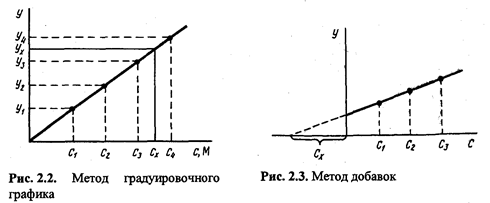
Paling biasa kaedah lengkung penentukuran. Dalam kes ini, graf dibina dalam isyarat analisis koordinat - kandungan komponen menggunakan sampel perbandingan dengan kandungan komponen yang berbeza dan diketahui dengan tepat. Kemudian, setelah mengukur magnitud isyarat analitik dalam sampel yang dianalisis, kandungan komponen yang ditentukan ditemui mengikut graf penentukuran (Rajah 2.2).
DALAM kaedah piawai ukur isyarat analitik dalam sampel perbandingan (sampel rujukan) dengan kandungan komponen yang diketahui dan dalam sampel yang dianalisis: di sini = lantai S, Dan y x = Sc x, di mana S- pekali perkadaran. Jika nilai ditentukan dalam keadaan yang sama S diketahui lebih awal, maka pengiraan boleh dibuat menggunakan formula dengan x = y x /S. Biasanya nisbah digunakan y et /U x= s fl / s x, dari mana
Kadangkala dua sampel rujukan digunakan, di mana kandungan komponen berbeza daripada yang dijangkakan dalam sampel yang dianalisis, dalam satu kes kurang, dalam satu lagi kurang. sebelah besar. Versi kaedah piawai ini kadangkala dipanggil kaedah penyelesaian mengehadkan. Kandungan komponen yang ditentukan dikira menggunakan formula
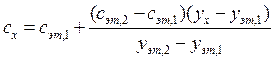
Dalam kes di mana, apabila menentukan kuantiti kecil komponen, adalah perlu untuk mengambil kira pengaruh matriks sampel pada nilai isyarat analisis, mereka sering menggunakan kaedah tambahan - pengiraan dan grafik.
Apabila menentukan kandungan kaedah pengiraan Ambil dua aliquot larutan sampel yang dianalisis. Bahan tambahan bagi komponen yang ditentukan ditambah kepada salah satu daripadanya kandungan yang diketahui. Dalam kedua-dua sampel, isyarat analitik diukur - y x Dan y x+ext. Kepekatan yang tidak diketahui bagi komponen yang ditentukan dikira menggunakan formula

di mana V tambah dan c tambah ialah isipadu dan kepekatan larutan tambahan bagi komponen yang ditentukan; V- aliquot sampel yang dianalisis.
Semasa menentukan kandungan sesuatu komponen kaedah grafik ambil n aliquot sampel yang dianalisis: 1, 2, 3, ..., n. Dalam aliquot 2, 3, ..., P diketahui, peningkatan jumlah komponen yang ditentukan diperkenalkan. Dalam semua aliquot, isyarat analisis diukur dan graf diplotkan dalam koordinat isyarat analisis¾kandungan komponen analit, mengambil kandungan komponen analit dalam aliquot tanpa aditif (aliquot 1) sebagai sifar bersyarat. Ekstrapolasi garis lurus yang terhasil ke persimpangan dengan paksi-x memberikan segmen yang terletak di sebelah kiri sifar koordinat konvensional, yang nilainya pada skala dan unit pengukuran yang dipilih sepadan dengan kandungan yang dikehendaki (dengan x) komponen sedang ditentukan (Rajah 2.3).
Kaedah standard dan kaedah penambahan boleh digunakan untuk fungsi penentukuran linear. Kaedah graf penentukuran membenarkan penggunaan kedua-dua isyarat analisis linear dan bukan linear - fungsi kandungan. DALAM kes yang terakhir bilangan data eksperimen yang lebih besar diperlukan dan hasil penentuan kandungan komponen, sebagai peraturan, kurang tepat.
Untuk membina graf penentukuran, cara yang paling baik data eksperimen yang memuaskan, biasanya digunakan kaedah kuasa dua terkecil (MNC). Cadangan asas OLS menyatakan bahawa jika bagi setiap m titik eksperimen melukis garis lurus ke lengkung optimum, paksi selari ordinat, maka untuk lengkung optimum (teoretikal) jumlah sisihan kuasa dua titik daripada lengkung (d i) hendaklah minimum, i.e.
Dalam analisis kimia, graf penentukuran rectilinear paling kerap digunakan, dibina untuk yang khusus julat kandungan yang ditentukan, iaitu dalam julat nilai yang disediakan oleh teknik ini.
Persamaan garis lurus boleh ditulis sebagai y = a + bx. Jika ada m mata eksperimen (x 1 y 1 , x 2 y 2, ..., x m Y m), kemudian, menggunakan postulat prinsip kuasa dua terkecil, kita boleh mencari parameter A Dan b garis lurus yang paling sesuai dengan data eksperimen
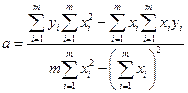

Untuk garisan penentukuran yang melalui asal koordinat y = b"x,
Perhatikan bahawa parameter A Dan b lebih tepat dan, oleh itu, lebih dekat graf penentukuran yang dibina dengan graf teori, lebih luas julat kandungan yang ditentukan graf dibina dan lebih banyak bilangan sampel perbandingan (standard) T telah diambil untuk membinanya.
Dalam semua kaedah penentuan kandungan yang tidak diketahui komponen digunakan pergantungan fungsi y=Sx.
Faktor sensitiviti S (kadang-kadang hanya dipanggil sensitiviti) mencirikan tindak balas isyarat analisis kepada kandungan komponen. Pekali sensitiviti - ini ialah nilai terbitan pertama bagi fungsi penentukuran pada kandungan tertentu yang diberikan. Untuk graf penentukuran rectilinear, ini ialah tangen bagi sudut kecondongan garis lurus (lihat Rajah 2.2):

Semakin tinggi faktor sensitiviti S, jumlah komponen yang lebih kecil boleh dikesan dan ditentukan, mendapatkan isyarat analisis yang sama. Semakin tinggi S, semakin tepat satu dan jumlah bahan yang sama boleh ditentukan. Itulah sebabnya, apabila membangunkan kaedah atau teknik analisis kimia baru, penyelidik, cuba meningkatkan pekali sensitiviti, menggunakan pelbagai teknik: kepekatan, peningkatan peralatan, penciptaan reagen baru, dsb.
Dalam semua kaedah yang dipertimbangkan, sampel rujukan (standard) digunakan, iaitu sampel, sampel, penyelesaian dengan kandungan komponen yang ditentukan dengan tepat. Kaedah analisis menggunakan sampel rujukan adalah yang dipanggil kaedah relatif analisis kimia.
Kaedah mutlak (bebas standard). dalam kimia analitik terdapat sedikit - contohnya, kaedah gravimetrik, coulometri langsung, beberapa varian kaedah radiokimia.
Sampel perbandingan untuk kaedah analisis relatif boleh disediakan daripada bahan kimia tulen dan stabil yang diketahui komposisinya (bahan standard). Dalam kes ini, kandungan komponen yang ditentukan dikira menggunakan formula kimia bahan piawai. Adalah mungkin untuk menyediakan sampel perbandingan di makmal, institusi atau industri yang berasingan, apabila kandungan komponen itu diwujudkan kaedah yang berbeza, ramai penganalisis pada instrumen yang berbeza. Keputusan yang paling boleh dipercayai diperoleh apabila menggunakan sampel standard(СО) - bahan yang disediakan khas, komposisi dan sifatnya telah ditubuhkan dengan pasti dan disahkan secara rasmi oleh institusi metrologi negeri khas.
Apabila menjalankan analisis kimia, mereka biasanya tidak terhad kepada definisi tunggal tetapi laksanakan beberapa takrifan selari (biasanya 3-5) untuk sampel yang sama di bawah keadaan yang sama. Hasil purata takrif selari dipanggil hasil analisis dan dilambangkan dengan rujuk atau x purata Sisihan hasil analisis daripada kandungan sebenar komponen yang ditentukan (C ist, x ist) dipanggil kesilapan (atau kesilapan ) takrifan.
Bersama-sama dengan mengesan atau menentukan kandungan komponen, adalah penting untuk menilai kebolehpercayaan keputusan yang diperoleh dan ralat pengukuran.
2.4. Kesilapan dalam analisis kimia. Pemprosesan hasil pengukuran
Mari kita pertimbangkan beberapa pendekatan asas untuk klasifikasi ralat. Mengikut kaedah pengiraan, ralat boleh dibahagikan kepada mutlak dan relatif.
Ralat mutlak sama dengan perbezaan dalam ukuran purata kuantiti X dan nilai sebenar kuantiti ini:
Dalam sesetengah kes, jika perlu, hitung ralat penentuan tunggal:
D = x i - x sumber
Ambil perhatian bahawa kuantiti yang diukur dalam analisis kimia boleh sama ada kandungan komponen atau isyarat analisis. Bergantung pada sama ada keputusan analisis melebihkan anggaran atau meremehkan ralat, ralat mungkin positif Dan negatif.
Ralat relatif boleh dinyatakan sebagai pecahan atau peratusan dan biasanya tidak mempunyai tanda:
![]()
Ralat boleh dikelaskan mengikut sumbernya. Oleh kerana terdapat banyak sumber ralat, klasifikasinya tidak boleh jelas. Beberapa contoh klasifikasi ralat mengikut sumber akan dibincangkan di bawah.
 Selalunya, ralat dikelaskan mengikut jenis sebab yang menyebabkannya. Dalam kes ini, ralat dibahagikan kepada sistematik dan rawak, dan ralat (atau ralat kasar) juga dibezakan.
Selalunya, ralat dikelaskan mengikut jenis sebab yang menyebabkannya. Dalam kes ini, ralat dibahagikan kepada sistematik dan rawak, dan ralat (atau ralat kasar) juga dibezakan.
KEPADA sistematik termasuk kesilapan yang sentiasa disebabkan sebab cekap, malar dalam semua dimensi atau sentiasa berubah undang-undang semasa, boleh dikenal pasti dan dihapuskan. rawak ralat, yang puncanya tidak diketahui, boleh dinilai menggunakan kaedah statistik matematik. Cik - Ini adalah ralat yang secara mendadak memesongkan hasil analisis dan biasanya mudah dikesan, biasanya disebabkan oleh kecuaian atau ketidakcekapan penganalisis. Dalam Rajah. 2.4 membentangkan gambar rajah yang menerangkan konsep ralat dan ralat sistematik dan rawak. Garis lurus 1 sepadan dengan kes ideal apabila semuanya N Tiada ralat sistematik atau rawak dalam definisi. Baris 2 dan 3 juga contoh ideal analisis kimia. Dalam satu kes (baris 2) tiada ralat rawak sama sekali, tetapi semuanya N takrifan mempunyai ralat sistematik negatif yang berterusan Dx; dalam kes lain (baris 3) Tiada ralat sistematik sama sekali. Garis itu menggambarkan keadaan sebenar 4: Terdapat ralat rawak dan ralat sistematik.
Membahagikan ralat kepada sistematik dan rawak dalam pada tahap tertentu bersyarat.
Ralat sistematik satu sampel keputusan semasa mempertimbangkan lebih data mungkin bertukar menjadi rawak. Contohnya, ralat sistematik yang disebabkan oleh bacaan instrumen yang salah bertukar menjadi ralat rawak apabila mengukur isyarat analitik pada instrumen yang berbeza di makmal yang berbeza. Sebelum membincangkan kesilapan sistematik dan rawak dengan lebih terperinci, mari kita pertimbangkan konsep - kebolehulangan Dan betul.
Kebolehulangan mencirikan tahap kedekatan definisi individu antara satu sama lain, serakan keputusan individu berbanding purata (Rajah 2.5).
Rajah.2.5. Kebolehulangan dan ketepatan analisis kimia
Dalam sesetengah kes, bersama-sama dengan istilah "kebolehulangan", istilah ini digunakan "penumpuan". Dalam kes ini, dengan penumpuan yang kami maksudkan adalah penyebaran keputusan penentuan selari, dan dengan kebolehulangan - penyebaran hasil yang diperolehi oleh kaedah yang berbeza dalam makmal yang berbeza, dalam masa yang berbeza dan sebagainya.
Betul- ini adalah kualiti analisis kimia, mencerminkan kehampiran kepada ralat sistematik sifar. Ketepatan mencirikan sisihan hasil analisis yang diperoleh daripada nilai sebenar nilai yang diukur (lihat Rajah 2.5).
2.4.1. Kesilapan sistematik
Salah satu tanda utama kesilapan sistematik ialah kesilapan itu disebabkan oleh sebab yang kekal.
Selalunya sumber ralat sistematik dan rawak adalah sama; mari kita pertimbangkan beberapa daripadanya menggunakan contoh ralat sistematik.
Kesilapan kaedah, atau kesilapan instrumental, dikaitkan dengan kaedah dan, terutama sekali, dengan instrumen untuk mengukur isyarat analisis. Contoh paling mudah bagi ralat jenis ini ialah ralat penimbang pada neraca analitik, yang menyebabkan ralat sistematik dalam kaedah analisis gravimetrik.
Oleh itu, jika ralat penimbang ialah ±0.2 mg, maka ralat relatif minimum penentuan gravimetri (dengan sampel 1 g) ialah 0.02%. Ujian berkala bagi instrumen analisis (spektrofotometer, ionomer, polarograf, kromatografi, dll.) meminimumkan komponen sistematik ralat instrumental. Oleh kerana kebanyakan kaedah analisis menggunakan sampel rujukan, ralat kaedah selalunya termasuk ralat dalam sampel rujukan, khususnya sampel standard, yang disebabkan oleh percanggahan antara kandungan sebenar dan nominal komponen di dalamnya, perbezaan dalam jumlah komposisi kimia dan struktur sampel yang dianalisis dan sampel perbandingan. Ralat instrumental biasanya hanya menyumbang sebahagian kecil daripada jumlah ralat dalam keputusan analisis kimia.
Sumbangan utama kepada kesilapan keseluruhan dibuat oleh kesilapan metodologi, ditentukan dengan kaedah penentuan.
Kesilapan metodologi termasuk ralat dalam pensampelan, menukar sampel ke dalam bentuk yang sesuai untuk analisis (pembubaran, pelakuran, pensinteran, pirolisis), ralat dalam operasi kepekatan dan pengasingan komponen.
Terutama yang patut diberi perhatian ialah kesilapan yang berkaitan dengan alam semula jadi. tindak balas kimia, yang menjadi asas kepada kaedah untuk mengesan atau mengenal pasti komponen.
Oleh itu, dalam gravimetri, ralat tersebut disebabkan oleh, walaupun kecil, tetapi ketara keterlarutan bentuk mendakan, proses kopresipitasi, sisihan daripada komposisi stoikiometri yang ketat bagi bentuk gravimetri, dsb. Dalam titrimetri, ralat metodologi biasa ialah ralat penunjuk yang timbul kerana fakta bahawa yang dipilih Untuk pentitratan, penunjuk bertindak balas dengan titran sama ada lebih awal sedikit atau lewat sedikit daripada mencapai titik kesetaraan.
Semua reagen yang digunakan, termasuk air dan pelarut lain, tidak boleh benar-benar tulen, tetapi mengandungi sejumlah kekotoran tertentu yang mengganggu penentuan, selalunya termasuk kekotoran komponen yang ditentukan. Inilah yang dipanggil ralat reaktif. Kesilapan jenis ini, seolah-olah diperkenalkan dari luar, juga termasuk kesilapan yang disebabkan oleh pencemaran atmosfera, udara di dalam premis kerja, dll.

Rajah.2.6. Kaedah mengubah saiz sampel:
1 - ralat yang berbeza-beza secara linear; 2 - nilai sebenar; 3- ralat berterusan
Salah satu tanda utama kesilapan sistematik ialah ia tetap dalam semua dimensi atau perubahan mengikut undang-undang yang sentiasa beroperasi. Perlu diingatkan bahawa ralat sistematik mutlak dibahagikan kepada bebas dan bergantung kepada kandungan komponen yang ditentukan, iaitu, malar (tambahan) dan berkadar (darab). Ralat malar termasuk, sebagai contoh, titisan dan beberapa jenis ralat penunjuk dalam titrimetri, ralat penimbang dalam gravimetri; kepada berkadar - beberapa jenis ralat yang disebabkan oleh sumbangan kekotoran yang mengganggu kepada isyarat analisis komponen yang ditentukan. Dalam Rajah. 2.6 Perubahan dalam ketepatan menentukan kandungan komponen dengan peningkatan berat sampel yang dianalisis dengan kehadiran ralat yang malar dan berbeza secara linear digambarkan. Dengan peningkatan jisim sampel bahan yang dianalisis dengan kehadiran ralat sistematik yang berterusan, nilai ralat relatif berkurangan (lengkung 3), dan dengan ralat sistematik yang berbeza secara linear, ralat relatif kekal malar (lengkung 1).
Semasa memproses keputusan analisis kimia, ralat sistematik mesti dikenal pasti dan dihapuskan, atau sekurang-kurangnya dinilai. Salah satu cara untuk mengenal pasti ralat sistematik (menyemak ketepatan) ialah saiz sampel yang berbeza-beza. Dengan menggandakan (kaedah penggandaan) atau meningkatkan saiz sampel dengan beberapa kali, ralat sistematik yang berterusan boleh dikesan dengan menukar kandungan ditemui komponen yang ditentukan (lihat Rajah 2.6).
Ada juga caranya "diperkenalkan -dijumpai" , bila tepat kuantiti yang diketahui komponen yang ditentukan. Komponen mesti ditambah dalam bentuk yang sama di mana ia berada dalam objek yang dianalisis dan dijalankan melalui semua peringkat analisis. Dalam kes ini, komponen boleh dimasukkan ke dalam matriks sampel yang tidak mengandungi komponen yang ditentukan, atau ditambah kepada sampel yang mengandungi jumlah komponen yang ditentukan dengan tepat. Jika pada peringkat terakhir analisis jumlah komponen yang dimasukkan ditentukan dengan ketepatan yang mencukupi, maka keputusan analisis dianggap betul.
Satu lagi cara untuk menyemak ketepatan adalah membandingkan keputusan analisis dengan keputusan yang diperolehi oleh yang lain kaedah bebas. Pada masa yang sama, ahli kimia mesti memastikan bahawa kaedah (metodologi) yang dipilih untuk perbandingan memberikan hasil yang betul dan benar-benar bebas, iaitu, penentuan komponen adalah berdasarkan prinsip yang berbeza. Sebagai contoh, apabila menyemak ketepatan penentuan komponen dengan kaedah spektrofotometri, adalah dinasihatkan untuk menggunakan kaedah kromatografi, polarografi atau potensiometri untuk perbandingan, tetapi bukan kaedah spektrofotometri menggunakan reagen lain.
Kaedah yang diterima umum untuk menilai ketepatan ialah analisis sampel standard. Ini yang paling banyak cara yang boleh dipercayai pengenalpastian ralat sistematik, pensijilan ketepatan kaedah analisis, teknik analisis, instrumen untuk mengukur isyarat analisis. Sampel standard disediakan daripada bahan yang komposisi dan sifatnya boleh dipercayai dan diperakui secara rasmi. Biasanya, sampel standard (untuk satu atau lebih komponen) dianalisis dengan banyak kaedah di beberapa makmal, jadi kandungan komponen yang ditunjukkan dalam sijil komposisi sampel boleh diambil sebagai nilai sebenar. Syarat yang amat diperlukan untuk penggunaan sampel piawai dalam analisis kimia ialah persamaan maksimum dalam komposisi dan sifat sampel piawai dan sampel yang dianalisis. Apabila menggunakan sampel standard untuk menilai ketepatan kaedah atau prosedur, analisis kimia berbilang sampel dijalankan dan kandungan yang ditemui dibandingkan dengan kandungan sebenar (diperakui) bagi komponen yang ditentukan.
Penilaian ketepatan kaedah atau teknik perlu dijalankan untuk beberapa kandungan yang berbeza komponen yang ditentukan, iaitu menggunakan dua atau lebih sampel piawai. Sampel standard digunakan bukan sahaja untuk menyemak ketepatan keputusan akhir penentuan komponen, tetapi juga pada peringkat individu analisis kimia untuk mengenal pasti ralat sistematik. Sebagai contoh, sampel standard sering digunakan untuk mengenal pasti ralat dalam pensampelan dan penyediaan sampel, ralat instrumental sistematik pada peringkat mengukur isyarat analisis.
Pada masa ini, sampel standard negeri (sampel kategori pertama) sedang disediakan untuk logam, aloi, produk dan perantaraan industri kimia, ubat-ubatan dan lain-lain. Sangat sukar untuk menyediakan sampel standard bahan kompleks (berbilang komponen, berbilang fasa, tidak stabil dalam masa): bijih, batu, produk makanan, biojisim, objek alam sekitar. Dalam kes ini, bahan rujukan disediakan daripada objek sebenar dengan menjalankan analisis kimia kompleks yang berulang merentasi institusi, industri dan juga negara (mencipta bahan rujukan antarabangsa).
Untuk menyelesaikan beberapa masalah, termasuk untuk menyemak ketepatan, sampel standard kategori ke-2, yang dibuat dalam industri tertentu, digunakan ekonomi negara, saintifik dan organisasi pengeluaran, makmal berasingan.
Ahli kimia analitik kadangkala menggunakan campuran terkompaun atau tersintesis bahan kimia yang dianalisis dengan pasti untuk menguji ketepatan.
Sampel standard digunakan bukan sahaja untuk mengenal pasti ralat sistematik dan menyemak ketepatan, tetapi juga sebagai sampel perbandingan dalam dalam pelbagai cara penentuan kandungan komponen yang tidak diketahui.
Peranan bahan rujukan dalam kimia analitik semakin meningkat. Ini disebabkan oleh pembangunan kaedah analisis baru, pengembangan julat objek yang dianalisis, komplikasi kaedah untuk mengesan dan menentukan komponen, dengan lebih banyak lagi. keperluan yang tinggi kepada ketepatan analisis kimia.
Setelah berat sebelah dikenal pasti, ia mesti dinilai dan diperbetulkan. Ambil perhatian bahawa penilaian berangka ralat sistematik boleh dijalankan hanya dengan ralat yang dihadkan oleh ralat rawak dalam analisis. Apabila menilai ralat sistematik, tiga jenis ralat boleh dibezakan secara kasar.
Kepada jenis pertama merujuk kepada ralat yang diketahui, yang boleh dikira secara priori sebelum menentukan komponen dan diambil kira dengan memperkenalkan pembetulan yang sesuai. Contoh ralat tersebut ialah ralat penunjuk dan ralat ukuran isipadu dalam titrimetri, ralat penimbang dalam kaedah analisis gravimetri (lihat Bab 9).
Kepada jenis kedua boleh dikaitkan dengan ralat yang diketahui, nilainya boleh dinilai semasa analisis kimia atau semasa menyediakan eksperimen khas. Ini termasuk ralat instrumental, reaktif, ralat dalam peringkat individu analisis kimia - ralat metodologi. Jika penyelidik boleh menilai ralat peringkat dan operasi individu, maka, mengikut undang-undang menambah ralat, dia boleh mengira ralat keseluruhan hasil analisis. Dalam jadual 2.1 menunjukkan pengiraan mutlak dan kesilapan relatif beberapa fungsi.
Apabila mengira ralat sistematik, dua kes penting mesti dibezakan.
a) Jika kedua-dua magnitud dan tanda-tanda ralat komponen individu diketahui, maka jumlah ralat dikira menggunakan formula yang diberikan dalam lajur A meja 2.1. Nilai jumlah ralat diperoleh dengan tanda tertentu.
b) Jika hanya ralat maksimum yang mungkin bagi peringkat individu diketahui (ini bersamaan dengan fakta bahawa hanya nilai mutlak yang diketahui, tetapi bukan tanda-tanda ralat ini), maka pengiraan dibuat mengikut formula yang ditunjukkan dalam kolum b meja 2.1. Dalam kes ini, hasil pengiraan juga nilai mutlak ralat total. relativisasi(dari bahasa Inggeris relatif - relatif), apabila, dalam keadaan yang sama, operasi analisis individu dijalankan sedemikian rupa sehingga ralat sistematik diratakan. Oleh itu, dalam titrimetri, aliquot penyelesaian piawai dan dianalisis diambil menggunakan pipet yang sama dalam gravimetri, mangkuk kosong dan mangkuk dengan sedimen ditimbang pada skala yang sama, dengan pemberat yang sama, dsb. Salah satu kaedah untuk ralat relativizing; sedang melaksanakan pengalaman mengawal(lihat bahagian 2.3). Dalam kes ini, ralat yang disebabkan oleh pencemaran daripada reagen, air, dan perkakas diratakan; kesilapan dalam peringkat penyediaan sampel, dsb.
Kepada jenis ketiga merujuk kepada kesilapan yang tidak diketahui sifatnya, yang nilainya tidak diketahui. Ralat ini sukar dikenal pasti dan dihapuskan. Ia boleh dikesan hanya selepas menghapuskan ralat sistematik yang lain dan pemeriksaan teliti seterusnya semua peringkat, operasi dan keadaan analisis. Biasanya dalam kes sedemikian teknik digunakan rawak (dari bahasa Inggeris rawak - secara kebetulan) - memindahkan ralat sistematik ke kategori rawak. Kemungkinan rawak adalah berdasarkan fakta bahawa ralat sistematik satu fenomena (kaedah, instrumen, pelaku analisis) apabila dipertimbangkan dalam kelas yang lebih luas fenomena serupa (sekumpulan kaedah, satu siri instrumen, satu pasukan penganalisis ) menjadi nilai pembolehubah, iaitu, ia memperoleh ciri-ciri ralat rawak dan dinilai menggunakan kaedah statistik matematik.
2.4.2. Ralat rawak
Pada permulaan pemprosesan keputusan analisis kimia dengan kaedah statistik matematik, ralat sistematik mesti dikenal pasti dan dihapuskan atau dipindahkan ke kategori rawak. Selain itu, data analisis adalah pembolehubah rawak dengan taburan kebarangkalian tertentu. Sebelum mempertimbangkan anggaran ralat rawak, mari kita memikirkan dua konsep: penduduk - set hipotesis semua hasil yang boleh difikirkan daripada -∞ hingga +∞; populasi sampel (sampel) - nombor nyata ( n ) hasil yang pengkaji dapat.
Keseluruhan keputusan analisis kimia difahami sebagai semua keputusan yang boleh difikirkan yang boleh diperoleh daripada analisis objek yang sama pelbagai kaedah, pada instrumen yang berbeza, oleh penganalisis yang berbeza. Biasanya, apabila menganalisis objek yang sama, kita mempunyai 3-7 keputusan (populasi sampel). Soalan tentang kedekatan parameter populasi sampel kepada parameter populasi umum dikaitkan dengan saiz sampel dan fungsi taburan pembolehubah rawak. Sebagai peraturan, untuk keputusan analisis kimia dengan n>20-30 dengan tahap kebolehpercayaan yang mencukupi dan dengan n>50-100 dengan anggaran yang baik, kita boleh mengandaikan bahawa sampel mewakili populasi umum.
Salah satu tugas utama penganalisis apabila menilai ralat rawak dalam analisis kimia adalah untuk mencari fungsi taburan yang menerangkan data eksperimen. Daripada statistik matematik ia mengikutinya nilai rawak dianggap diberi jika fungsi pengedarannya diketahui. Fungsi ini boleh dipersembahkan secara grafik, dalam bentuk hubungan algebra atau jadual. Fungsi taburan kamiran dan pembezaan pembolehubah rawak digunakan. Fungsi kamiran F(x) - kebarangkalian bahawa pembolehubah rawak X mengambil sebarang nilai kurang daripada beberapa nilai yang diberikan A:
Fungsi pembezaan taburan pembolehubah rawak (j(x) atau ketumpatan kebarangkalian, ditentukan oleh hubungan
![]()
dengan Dх = x b – x a. Oleh itu, ketumpatan kebarangkalian ialah terbitan bagi fungsi kamiran F(x).
Banyak kajian telah menunjukkan bahawa majoriti data takrifan analitikal jika terdapat set umum keputusan analisis kimia, ia tertakluk kepada undang-undang taburan normal (Taburan Gaussian). Ketumpatan Kebarangkalian undang-undang biasa pengedaran mempunyai bentuk

di mana m dan s 2 - nilai yang dijangkakan dan serakan (parameter malar).
Nilai yang dijangkakan (benar) m bagi pembolehubah rawak selanjar diberi oleh kamiran


Ia mewakili had di mana purata cenderung X dengan peningkatan tanpa had dalam saiz sampel. Oleh itu, jangkaan matematik adalah, seolah-olah, nilai purata untuk populasi secara keseluruhan, itulah sebabnya ia kadang-kadang dipanggil purata umum. Sekiranya tiada ralat sistematik, jangkaan matematik m adalah sama dengan nilai sebenar x sumber
Serakan s 2 mencirikan serakan pembolehubah rawak berbanding m dan ditakrifkan sebagai jangkaan matematik sisihan kuasa dua. X daripada m :

Varians punca kuasa dua positif A dipanggil sisihan piawai dan juga digunakan untuk mencirikan serakan pembolehubah rawak X dalam populasi berbanding m .
Imej grafik taburan normal pembolehubah rawak X ditunjukkan dalam Rajah. 2.7. Jenis lengkung berbentuk loceng, simetri berkenaan dengan garis menegak melalui m , bergantung kepada jumlah varians dan, oleh itu, pada sisihan piawai. Lebih banyak sisihan piawai, semakin rata keluk itu.
Apabila memproses data analisis kimia, hukum normal taburan normal biasanya digunakan, yang diperoleh apabila bergerak dari nilai x ke nilai
Sejak dalam kes ini u= 0, dan s 2 = 1, kemudian ungkapan (2.1) diubah menjadi

Fungsi taburan normal ternormal kumulatif digunakan lebih kerap

Apabila memproses keputusan analisis kimia berbilang dan ralat rawak yang disertakan, adalah kebiasaan untuk memberikan dua parameter statistik - lebar selang keyakinan, di mana keputusan mungkin terletak analisis individu, dan kebarangkalian keyakinan bahawa mereka termasuk dalam selang ini. Nilai fungsi taburan kamiran (2.2) dibentangkan dalam jadual, dengan menggunakan mana anda boleh mencari kebarangkalian nilai u tidak akan mengatasi tetapkan nilai. Lebih kerap, apabila memproses data secara statistik, nilai terjadual bagi kamiran digunakan

yang dipanggil fungsi Laplace ternormal. Dalam jadual 2.2 diberikan kebarangkalian keyakinan hanya untuk nilai positif awak, kerana taburan normal ternormal adalah simetri. Untuk mencari kebarangkalian keyakinan bahawa pembolehubah rawak (ralat rawak) jatuh dalam selang waktu tertentu, nilai kebarangkalian yang dijadualkan hendaklah digandakan. Jadi, menggunakan jadual. 2.2, boleh ditunjukkan bahawa jika ralat rawak semasa analisis kimia berbilang (jumlah set keputusan analisis kimia!) tidak melebihi ±s, ±2s Dan ±3s, maka kebarangkalian keyakinan ialah 0.6826 (0.3413 2); 0.9544 (0.4772 2) dan 0.9973 (0.49865 2). Oleh kerana , selang yang dipertimbangkan ialah u=±1, u=±2 dan u=±3, masing-masing.
Jadual 2.2. Nilai fungsi Laplace
Hukum taburan normal untuk memproses keputusan analisis kimia hanya digunakan jika terdapat sejumlah besar data (n>50). Data analisis kimia biasanya mengikut taburan normal. Walau bagaimanapun, berhati-hati harus dilakukan mengenai keputusan yang diperolehi oleh radiokimia atau kaedah biologi dan apabila menganalisis sampel yang agak heterogen. Jika terdapat sebarang keraguan tentang kesahihan penggunaan undang-undang taburan normal, maka anda harus menggunakan pelbagai yang diterangkan dalam kesusasteraan khusus cara untuk menetapkan bahawa keputusan analisis kimia diedarkan dengan tepat mengikut
Keputusan tentang keperluan untuk mengekalkan buku nota sedemikian tidak datang serta-merta, tetapi secara beransur-ansur, dengan pengumpulan pengalaman kerja.
Pada mulanya ia adalah tempat di penghujung buku kerja– beberapa halaman untuk merekodkan definisi yang paling penting. Kemudian meja yang paling penting diletakkan di sana. Kemudian datang kesedaran bahawa kebanyakan pelajar, untuk belajar menyelesaikan masalah, memerlukan arahan algoritma yang ketat, yang mereka, pertama sekali, mesti faham dan ingat.
Ketika itulah keputusan datang untuk menyimpan, sebagai tambahan kepada buku kerja, satu lagi buku nota wajib dalam kimia - kamus kimia. Tidak seperti buku kerja, yang mungkin terdapat dua dalam satu tahun sekolah, kamus adalah buku nota tunggal untuk keseluruhan kursus kimia. Lebih baik jika buku nota ini mempunyai 48 helaian dan penutup yang tahan lama.
Kami menyusun bahan dalam buku nota ini seperti berikut: pada mulanya - definisi yang paling penting, yang disalin oleh kanak-kanak dari buku teks atau menulis di bawah imlak guru. Sebagai contoh, dalam pelajaran pertama dalam gred ke-8, ini adalah definisi subjek "kimia", konsep "tindak balas kimia". Semasa tahun persekolahan di gred ke-8, lebih daripada tiga puluh daripadanya terkumpul. Saya menjalankan tinjauan tentang definisi ini dalam beberapa pelajaran. Sebagai contoh, soalan lisan sepanjang rantai, apabila seorang pelajar bertanya soalan kepada yang lain, jika dia menjawab dengan betul, bermakna dia sudah bertanya soalan seterusnya; atau, apabila seorang pelajar ditanya soalan oleh pelajar lain, jika dia tidak dapat menjawab, maka mereka menjawab sendiri. Dalam kimia organik, ini terutamanya definisi kelas bahan organik dan konsep utama, sebagai contoh, "homolog", "isomer", dll.
Pada penghujung kami Buku rujukan Bahan tersebut dipersembahkan dalam bentuk jadual dan gambar rajah. Pada halaman terakhir ialah jadual pertama "Unsur kimia. Tanda-tanda kimia" Kemudian jadual "Valence", "Asid", "Penunjuk", "Siri elektrokimia voltan logam", "Siri keelektronegatifan".
Saya terutamanya ingin memikirkan kandungan jadual "Korespondensi asid dengan oksida asid":
| Korespondensi asid kepada oksida asid | ||||
| Asid oksida | Asid | |||
| Nama | Formula | Nama | Formula | Sisa asid, valency |
| karbon(II) monoksida | CO2 | arang | H2CO3 | CO3(II) |
| sulfur(IV) oksida | JADI 2 | sulfur | H2SO3 | SO3(II) |
| sulfur(VI) oksida | JADI 3 | sulfurik | H2SO4 | SO 4 (II) |
| silikon(IV) oksida | SiO2 | silikon | H2SiO3 | SiO3(II) |
| nitrik oksida (V) | N2O5 | nitrogen | HNO3 | NO3 (I) |
| fosforus(V) oksida | P2O5 | fosforus | H3PO4 | PO 4 (III) |
Tanpa memahami dan menghafal jadual ini, menjadi sukar bagi pelajar gred 8 untuk menyusun persamaan tindak balas asid oksida dengan alkali.
Apabila mengkaji teori pemisahan elektrolitik, kami menulis gambar rajah dan peraturan di hujung buku nota.
Peraturan untuk menyusun persamaan ion:
1. Formula elektrolit kuat larut dalam air ditulis dalam bentuk ion.
2. Tulis formula bahan ringkas, oksida, elektrolit lemah dan semua bahan yang tidak larut.
3. Formula bahan yang kurang larut di sebelah kiri persamaan ditulis dalam bentuk ionik, di sebelah kanan - dalam bentuk molekul.
Ketika belajar kimia organik Kami menulis dalam kamus jadual umum mengenai hidrokarbon, kelas bahan yang mengandungi oksigen dan nitrogen, gambar rajah mengenai sambungan genetik.
| Kuantiti fizikal | |||
| Jawatan | Nama | Unit | Formula |
| jumlah bahan | tahi lalat | = N / N A ; = m / M; V / V m (untuk gas) |
|
| N A | Pemalar Avogadro | molekul, atom dan zarah lain | N A = 6.02 10 23 |
| N | bilangan zarah | molekul, atom dan zarah lain |
N = N A |
| M | jisim molar | g/mol, kg/kmol | M = m / ; /M/ = M r |
| m | berat badan | g, kg | m = M ; m = V |
| V m | isipadu molar gas | l/mol, m 3/kmol | Vm = 22.4 l / mol = 22.4 m 3 / kmol |
| V | kelantangan | l, m 3 | V = V m (untuk gas); |
| ketumpatan | g/ml; | =m/V; M / V m (untuk gas) |
|
Lebih 25 - tempoh musim panas mengajar kimia di sekolah saya terpaksa bekerja program yang berbeza dan buku teks. Pada masa yang sama, ia sentiasa mengejutkan bahawa hampir tidak ada buku teks yang mengajar cara menyelesaikan masalah. Pada permulaan mempelajari kimia, untuk mensistematikkan dan menyatukan pengetahuan dalam kamus, saya dan pelajar saya menyusun jadual "Kuantiti fizikal" dengan kuantiti baharu:
Apabila mengajar pelajar cara menyelesaikan masalah pengiraan Saya mementingkan algoritma. Saya percaya bahawa arahan yang ketat untuk urutan tindakan membolehkan pelajar yang lemah memahami penyelesaian masalah jenis tertentu. Untuk pelajar yang kuat- ini adalah peluang untuk mencapai tahap kreatif masa depan anda pendidikan kimia dan pendidikan diri, sejak mula-mula anda perlu menguasai sebilangan kecil teknik standard dengan yakin. Atas dasar ini, keupayaan untuk menerapkannya dengan betul pada peringkat penyelesaian yang berbeza tugasan yang kompleks. Oleh itu, saya telah menyusun algoritma untuk menyelesaikan masalah pengiraan untuk semua jenis masalah. kursus sekolah dan untuk aktiviti kokurikulum.
Saya akan memberikan contoh sebahagian daripada mereka.
Algoritma untuk menyelesaikan masalah menggunakan persamaan kimia.
1. Tuliskan secara ringkas keadaan masalah dan karang persamaan kimia.
2. Tulis data masalah di atas formula dalam persamaan kimia, dan tulis bilangan mol di bawah formula (ditentukan oleh pekali).
3. Cari jumlah bahan, jisim atau isipadu yang diberikan dalam pernyataan masalah, menggunakan formula:
M/M; = V / V m (untuk gas V m = 22.4 l / mol).
Tulis nombor yang terhasil di atas formula dalam persamaan.
4. Cari jumlah bahan yang tidak diketahui jisim atau isipadunya. Untuk melakukan ini, sebab mengikut persamaan: bandingkan bilangan mol mengikut keadaan dengan bilangan mol mengikut persamaan. Jika perlu, buat perkadaran.
5. Cari jisim atau isipadu menggunakan formula: m = M; V = Vm.
Algoritma ini adalah asas yang mesti dikuasai oleh pelajar supaya pada masa hadapan dia akan dapat menyelesaikan masalah menggunakan persamaan dengan pelbagai komplikasi.
Masalah lebihan dan kekurangan.
Jika dalam keadaan masalah kuantiti, jisim atau isipadu dua bahan bertindak balas diketahui sekaligus, maka ini adalah masalah dengan lebihan dan kekurangan.
Apabila menyelesaikannya:
1. Anda perlu mencari kuantiti dua bahan bertindak balas menggunakan formula:
M/M; = V/V m .
2. Tulis nombor mol yang terhasil di atas persamaan. Membandingkannya dengan bilangan tahi lalat mengikut persamaan, buat kesimpulan tentang bahan mana yang diberikan dalam kekurangan.
3. Berdasarkan kekurangan, buat pengiraan selanjutnya.
Masalah mengenai pecahan hasil produk tindak balas yang diperoleh secara praktikal daripada yang mungkin secara teori.
Menggunakan persamaan tindak balas, pengiraan teori dijalankan dan data teori untuk hasil tindak balas ditemui: teori. , m teori. atau teori V. . Apabila menjalankan tindak balas di makmal atau dalam industri, kerugian berlaku, jadi data praktikal yang diperoleh adalah praktikal. ,
m amalkan. atau V praktikal. sentiasa kurang daripada data yang dikira secara teori. Bahagian hasil ditetapkan oleh huruf (eta) dan dikira menggunakan formula:
(ini) = praktikal. / teori = m amalan. / m teori. = V praktikal / Teori V.
Ia dinyatakan sebagai pecahan unit atau sebagai peratusan. Tiga jenis tugas boleh dibezakan:
Jika dalam pernyataan masalah data untuk bahan permulaan dan pecahan hasil produk tindak balas diketahui, maka anda perlu mencari penyelesaian yang praktikal. , m praktikal atau V praktikal. hasil tindak balas.
Prosedur penyelesaian:
1. Jalankan pengiraan menggunakan persamaan berdasarkan data bagi bahan permulaan, cari teorinya. , m teori. atau teori V. hasil tindak balas;
2. Cari jisim atau isipadu hasil tindak balas yang diperoleh secara praktikal menggunakan formula:
m amalkan. = m teori ; V praktikal = Teori V. ; berlatih. = teori .
Jika dalam pernyataan masalah data untuk bahan permulaan dan amalan diketahui. , m praktikal atau V praktikal. produk yang terhasil, dan anda perlu mencari pecahan hasil produk tindak balas.
Prosedur penyelesaian:
1. Kira menggunakan persamaan berdasarkan data bagi bahan permulaan, cari
Teori. , m teori. atau teori V. hasil tindak balas.
2. Cari pecahan hasil produk tindak balas menggunakan formula:
Berlatih. / teori = m amalan. / m teori. = V praktikal /V teori.
Sekiranya keadaan praktikal diketahui dalam keadaan masalah. , m praktikal atau V praktikal. hasil tindak balas yang terhasil dan pecahan hasilnya, sementara anda perlu mencari data untuk bahan permulaan.
Prosedur penyelesaian:
1. Cari teori, teori m. atau teori V. hasil tindak balas mengikut formula:
Teori. = praktikal / ; m teori. = m amalan. / ; Teori V. = V praktikal / .
2. Lakukan pengiraan menggunakan persamaan berdasarkan teori. , m teori. atau teori V. hasil tindak balas dan cari data bagi bahan permulaan.
Sudah tentu, kami menganggap ketiga-tiga jenis masalah ini secara beransur-ansur, mempraktikkan kemahiran menyelesaikan setiap daripada mereka menggunakan contoh beberapa masalah.
Masalah pada campuran dan kekotoran.

Bahan tulen adalah bahan yang lebih banyak dalam campuran, selebihnya adalah kekotoran. Jawatan: jisim campuran – m cm, jisim bahan tulen– m p.h., jisim kekotoran – m lebih kurang. , pecahan jisim bahan tulen - p.h.
Pecahan jisim bahan tulen didapati menggunakan formula: p.h. = m h.v. / m cm, ia dinyatakan dalam pecahan satu atau sebagai peratusan. Mari kita bezakan 2 jenis tugasan.
Jika penyataan masalah memberikan pecahan jisim bahan tulen atau pecahan jisim bendasing, maka jisim campuran diberikan. Perkataan "teknikal" juga bermaksud kehadiran campuran.
Prosedur penyelesaian:
1. Cari jisim bahan tulen menggunakan formula: m h.v. = h.v. m cm
Jika pecahan jisim bendasing diberikan, maka anda perlu mencari pecahan jisim bahan tulen terlebih dahulu: p.h. = 1 - lebih kurang.
2. Berdasarkan jisim bahan tulen, buat pengiraan selanjutnya menggunakan persamaan.
Jika penyataan masalah memberikan jisim campuran awal dan n, m atau V hasil tindak balas, maka anda perlu mencari pecahan jisim bahan tulen dalam campuran awal atau pecahan jisim kekotoran di dalamnya.
Prosedur penyelesaian:
1. Kira menggunakan persamaan berdasarkan data bagi hasil tindak balas dan cari n p.v. dan m h.v.
2. Cari pecahan jisim bahan tulen dalam campuran menggunakan formula: p.h. = m h.v. / m lihat dan pecahan jisim kekotoran: lebih kurang. = 1 - h.v
Undang-undang hubungan volumetrik gas
Isipadu gas dikaitkan dengan cara yang sama seperti kuantiti bahannya:
V 1 / V 2 = 1 / 2
Undang-undang ini digunakan apabila menyelesaikan masalah menggunakan persamaan di mana isipadu gas diberikan dan anda perlu mencari isipadu gas lain.
Pecahan isipadu gas dalam campuran.
Vg / Vcm, dengan (phi) ialah pecahan isipadu gas.
Vg – isipadu gas, Vcm – isipadu campuran gas.
Jika pecahan isipadu gas dan isipadu campuran diberikan dalam pernyataan masalah, maka, pertama sekali, anda perlu mencari isipadu gas: Vg = Vcm.
Isipadu campuran gas didapati menggunakan formula: Vcm = Vg /.
Isipadu udara yang dibelanjakan untuk pembakaran bahan didapati melalui isipadu oksigen yang ditemui oleh persamaan:
Vair = V(O 2) / 0.21
Terbitan formula bahan organik menggunakan formula am.
Bahan organik membentuk siri homolog yang mempunyai formula am. Ini membenarkan:
1. Nyatakan berat molekul relatif dalam sebutan nombor n.
M r (C n H 2n + 2) = 12 n + 1 (2n + 2) = 14n + 2.
2. Samakan M r, dinyatakan melalui n, dengan M r sebenar dan cari n.
3. Lukiskan persamaan tindak balas dalam Pandangan umum dan melakukan pengiraan ke atasnya.
Menghasilkan formula bahan berdasarkan hasil pembakaran.
1. Menganalisis komposisi hasil pembakaran dan membuat kesimpulan tentang komposisi berkualiti bahan terbakar: H 2 O -> H, CO 2 -> C, SO 2 -> S, P 2 O 5 -> P, Na 2 CO 3 -> Na, C.
Kehadiran oksigen dalam bahan memerlukan pengesahan. Nyatakan indeks dalam formula dengan x, y, z. Contohnya, CxHyOz (?).
2. Cari jumlah bahan dalam produk pembakaran menggunakan formula:
n = m / M dan n = V / Vm.
3. Cari jumlah unsur yang terkandung dalam bahan yang dibakar. Sebagai contoh:
Menukar nombor kepada integer dengan membahagikannya dengan terkecil.
Tulis formula yang benar.
Terbitan formula bahan berdasarkan pecahan jisim unsur.
1. Tulis formula, menandakan indeks sebagai x, y, z.
2. Cari nisbah indeks; untuk melakukan ini, bahagikan pecahan jisim setiap unsur dengan jisim atomnya: x: y: z = 1 / Ar 1: 2 / Ar 2: 3 / Ar 3.
3. Kurangkan nombor yang terhasil kepada integer dengan membahagikannya dengan yang terkecil. Jika perlu, selepas membahagi, darab dengan 2, 3, 4, 5.
Kaedah penyelesaian ini menentukan formula yang paling mudah. Bagi kebanyakan bahan bukan organik ia bertepatan dengan yang benar, untuk bahan organik ia adalah sebaliknya.
Menerbitkan formula bahan berdasarkan pecahan jisim unsur, jika data untuk mencari jisim molar bahan diketahui.
Cari jisim molar bahan menggunakan formula:
a) jika ketumpatan gas diketahui: M = Vm = g / l 22.4 l / mol; r = m/V.
b) jika diketahui ketumpatan relatif: M 1 = D 2 M 2, M = D H2 2, M = D O2 32,
M = D udara 29, M = D N2 28, dsb.
Kaedah 1: cari formula paling mudah bahan (lihat algoritma sebelumnya) dan jisim molar termudah. Kemudian bandingkan jisim molar sebenar dengan yang paling mudah dan tingkatkan indeks dalam formula dengan bilangan kali yang diperlukan.
Kaedah 2: cari indeks menggunakan formula n = (e) Mr / Ar(e).
Jika pecahan jisim salah satu unsur tidak diketahui, maka ia perlu dicari. Untuk melakukan ini, tolak pecahan jisim unsur lain daripada 100% atau daripada perpaduan.
Secara beransur-ansur, semasa mempelajari kimia, algoritma penyelesaian masalah terkumpul dalam kamus kimia jenis yang berbeza. Dan pelajar sentiasa tahu di mana untuk mencari formula yang diperlukan atau maklumat yang diperlukan untuk menyelesaikan masalah.
Ramai pelajar suka menyimpan buku nota seperti itu, mereka sendiri menambahnya dengan pelbagai bahan rujukan.
Bagi aktiviti kokurikulum, saya dan pelajar saya juga mempunyai buku nota berasingan untuk menulis algoritma untuk menyelesaikan masalah yang melampaui kurikulum sekolah. Dalam buku nota yang sama, untuk setiap jenis masalah kami menulis 1-2 contoh; mereka menyelesaikan masalah lain dalam buku nota lain. Dan, jika anda fikirkan, antara beribu-ribu masalah berbeza yang muncul pada peperiksaan kimia di semua universiti, anda boleh mengenal pasti 25 - 30 jenis masalah yang berbeza. Sudah tentu, terdapat banyak variasi di antara mereka.
Dalam membangunkan algoritma untuk menyelesaikan masalah dalam kelas elektif, manual A.A. banyak membantu saya. Kushnareva. (Belajar untuk menyelesaikan masalah dalam kimia, - M., Sekolah - akhbar, 1996).
Keupayaan menyelesaikan masalah dalam kimia adalah kriteria utama untuk penguasaan kreatif subjek. Ia adalah melalui penyelesaian masalah tahap yang berbeza kerumitan, kursus kimia boleh dikuasai dengan berkesan.
Sekiranya pelajar mempunyai pemahaman yang jelas tentang semua jenis masalah yang mungkin dan telah menyelesaikan sejumlah besar masalah setiap jenis, maka dia akan dapat menghadapi peperiksaan kimia dalam bentuk Peperiksaan Negeri Bersepadu dan apabila memasuki universiti.
