Oppløsning som en fysisk kjemisk prosess
Løsninger dannes ved interaksjon mellom et løsemiddel og et løst stoff. Prosessen med interaksjon mellom et løsningsmiddel og et løst stoff kalles solvasjon (hvis løsningsmidlet er vann - hydrering).

Fig. 1 Prosessen med å løse opp elektrolytter.
Oppløsningen fortsetter med dannelsen av produkter av forskjellige former og styrker - hydrater. Dette involverer både fysisk og kjemisk natur. Oppløsningsprosessen på grunn av denne typen interaksjon av komponenter er ledsaget av forskjellige termiske fenomener.
Energiegenskaper oppløsning er varmen fra dannelsen av løsningen, betraktet som algebraisk sum termiske effekter av alle endo- og eksoterme stadier av prosessen. De viktigste blant dem er:
- varmeabsorberende prosesser - ødeleggelse av krystallgitteret, brudd av kjemiske bindinger i molekyler;
- varmegenererende prosesser - dannelse av produkter av interaksjon av et oppløst stoff med et løsningsmiddel (hydrater), etc.
Hvis energien til ødeleggelse krystallgitter mindre hydratiseringsenergi av det oppløste stoffet, deretter skjer oppløsning med frigjøring av varme (oppvarming observeres). Oppløsningen av NaOH er således en eksoterm prosess: 884 kJ/mol brukes på ødeleggelse av krystallgitteret, og under dannelsen av hydratiserte Na+ og OH- ioner frigjøres henholdsvis 422 og 510 kJ/mol.
Hvis energien til krystallgitteret er større enn hydratiseringsenergien, skjer oppløsning med absorpsjon av varme (når du tilbereder en vandig løsning av NH 4 NO 3, observeres en reduksjon i temperaturen).
Den gjensidige løseligheten av væsker eller faste stoffer i væsker avhenger av en rekke egenskaper til disse stoffene: kjemisk natur, størrelse og struktur til partikler, elektrisk ladning(når det gjelder ioner), dipolmomenter osv.
Den såkalte ubegrensede løseligheten er kjent når to væsker oppløses i hverandre i alle proporsjoner, og begrenset når løseligheten til en væske i en annen er begrenset til en viss konsentrasjon.
Med begrenset gjensidig løselighet av to væsker A og B, løses hver av dem opp, og etter bunnfelling dannes det to lag, som er plassert over hverandre i rekkefølge av avtagende tetthet og består av ett av en løsning av B i A, og den andre av en løsning av A i B.
Løsninger inntar en mellomposisjon mellom kjemiske forbindelser og mekaniske blandinger. Løsninger skiller seg fra kjemiske forbindelser ved variasjonen av deres sammensetning, og fra sistnevnte ved deres homogenitet. Det er derfor løsninger kalles enfasesystemer med variabel sammensetning, dannet av minst to uavhengige komponenter.
DI. Mendeleev var den første som vurderte oppløsning ikke bare som fysisk prosess, men også som en prosess kjemisk interaksjon løsemiddel med løsemiddel. Spesielt under oppløsning blir energi (oppløsningsvarme) alltid absorbert eller frigjort og volumet av væsken endres.
Studerer løsninger ved hjelp av ulike metoder gjort det mulig å fastslå tilstedeværelsen i mange av dem av såkalte solvater eller hydrater, som dannes som et resultat av de tilsvarende prosessene for solvatisering og hydratisering.
Hydratering av stoffer i vandige løsninger er et separat tilfelle av solvatisering av ethvert løsningsmiddel. Hvis løsningsmidlet er vann, kalles disse forbindelsene hydrater. Hydratiseringsprosessen bør betraktes som en kjemisk reaksjon ved å tilsette vann til et stoff. Hydrering skjer under påvirkning av kreftene til molekylær interaksjon mellom vannmolekyler og det hydrerte stoffet. Salter er hydrert av ioner som har betydelige elektriske felt, som tiltrekker elektriske polare vannmolekyler. Hvordan sterkere felt ion, det vil si at jo større ladning og mindre radius er, jo sterkere er det hydrert og jo sterkere hydrater dannes. Dannelsen av solvater endrer i mange tilfeller egenskapene til det oppløste stoffet, noe som lett kan bestemmes ved direkte observasjon.
For eksempel har jod, som består av individuelle molekyler, en fiolett farge i gassform. Den samme fargen bevares når jod er oppløst i bensin. Hvis jod er oppløst i alkohol, oppnås en mørkebrun løsning. Denne fargeendringen indikerer tilstedeværelsen av interaksjon mellom jod- og alkoholmolekylene.
Hydrater er ganske ustabile forbindelser i mange tilfeller dekomponerer de når oppløsninger fordampes. Men noen ganger er hydreringsvann så tett bundet til molekylene til det oppløste stoffet at når sistnevnte skilles fra løsningen, blir det en del av krystallene. Slike medisinske substanser inkluderer glukose, terpenhydrat, magnesiumsulfat, kobbersulfat, alun, kodein, etc., som er krystallinske hydrater med forskjellig innhold krystallisasjonsvann. Når vann fjernes fra krystallinske hydrater, endres de utseende Og individuelle eiendommer(kobbersulfat, gips, krystallinsk brus, etc.).
Individuelle ioner av salt oppløst i vann forblir også i hydrert tilstand, noe som er av avgjørende betydning for mange egenskaper til saltløsninger. Ideen om hydratisering av ioner i løsninger ble først uttrykt av I.A. Kablukov og V.A. Kistyakovsky.
Den begrensende løseligheten til mange stoffer i vann (eller andre løsemidler) er konstant verdi, tilsvarende konsentrasjonen av den mettede løsningen ved en gitt temperatur. Det er en kvalitativ egenskap for løselighet og er gitt i oppslagsverk i gram per 100 g løsemiddel (under visse forhold).
Legemidlet anses som oppløst hvis det ikke oppdages partikler av stoffet i løsningen når det observeres i gjennomlyst lys. Når det gjelder løselighet, er de til en viss grad styrt av det gamle prinsippet "lik oppløses i like" ( liknende liknende solventur), det vil si i lyset moderne utsikt Basert på strukturen til molekylet ser det slik ut: i ikke-polare løsningsmidler (bensin, eter, etc.) løses ulike forbindelser med ikke-polare eller lavpolare molekyler godt og stoffer av andre typer løses ikke opp. Tvert imot løser et løsemiddel med sterkt polar karakter av molekylene (vann), som regel opp stoffer med molekyler som er polare og delvis ioniske typer og løser ikke opp stoffer med ikke-polare molekyler. Polare løsemidler inkluderer væsker som kombinerer en stor dielektrisk konstant, et stort dipolmoment, med tilstedeværelsen funksjonelle grupper, sikre dannelsen av koordinering ( for det meste hydrogen) bindinger: vann, syrer, lavere alkoholer og glykoler, aminer, etc. Tilstedeværelsen av polare grupper i molekylet til et stoff påvirker i stor grad dets løselighet.
Som regel er stoffer svært løselige i vann og i hverandre hvis det ikke er mer enn tre hydrokarbonradikalatomer per polar gruppe. Ved større tilstedeværelse av hydrokarbonradikaler oppstår det så store dispersjonskrefter mellom molekylene at de hindrer oppløsning av slike stoffer i polare løsningsmidler.
Polare stoffer er stoffer med ioniske (ioniske krystaller) og polar binding(polare molekyler), for eksempel natriumklorid.
Ikke-polare løsningsmidler inkluderer væsker med et lite dipolmoment som ikke har aktive funksjonelle grupper, for eksempel hydrokarboner, alkylhalogenider, etc. Ikke-polare stoffer- dette er stoffer med en strengt symmetrisk struktur, uten elektriske poler (for eksempel parafin, terpentin, kamfer, tymol, etc.).
Regelen ovenfor er imidlertid ikke alltid gyldig, spesielt når den brukes på komplekse organiske forbindelser, som inneholder både polare (-OH, -SO3H, -NH2, -COOH, -COONa) og ikke-polare (alkyl- eller arylradikaler) grupper. Disse forbindelsene inkluderer karbohydrater, alkoholer, ketoner, organiske syrer, aminer osv. Løseligheten til disse stoffene avhenger av overvekt av polare eller ikke-polare grupper. For eksempel er etylalkohol C 2 H 5 OH blandbar med vann i alle forhold, amylalkohol C 5 H 11 OH - ikke mer enn 10 %, og cetylalkohol C 16 H 33 OH er praktisk talt uløselig i vann
Løselighet avhenger av typen av oppløst stoff og løsningsmiddel, temperatur og trykk.
1) Naturen til det løselige stoffet.

Fig.2 Arten av det oppløste stoffet.
Krystallinske stoffer er delt inn i:
P - svært løselig (mer enn 1,0 g per 100 g vann);
M - lett løselig (0,1 g - 1,0 g per 100 g vann);
H - uløselig (mindre enn 0,1 g per 100 g vann).
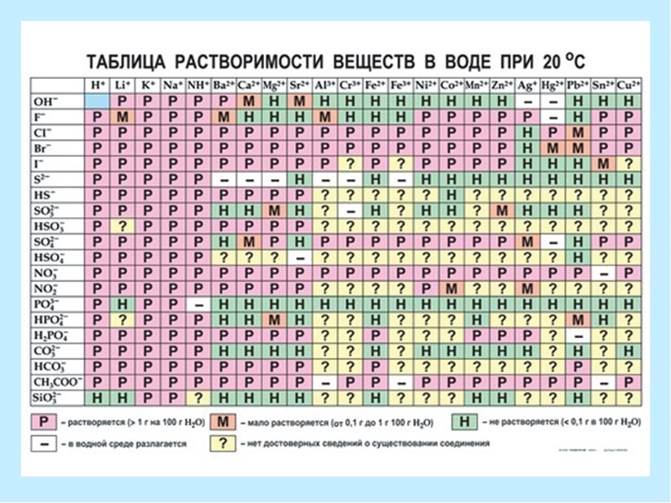
Fig.3. Løselighetstabell.
2) Løsemidlets natur. Når en løsning dannes, erstattes bindingene mellom partiklene til hver komponent med bindinger mellom partiklene forskjellige komponenter. For at det skal dannes nye bindinger, må komponentene i løsningen ha samme type bindinger, dvs. være av samme art. Derfor ioniske stoffer løses opp i polare løsemidler og dårlig i ikke-polare, og
molekylære stoffer- omvendt.
Vann er et unikt, mest vanlig og tilgjengelig løsningsmiddel. Vandige løsninger av uorganiske (salter, syrer, baser) og organiske (aminosyrer, nitrogenholdige baser, nukleinsyrer) stoffer, lav – og høymolekylære forbindelser, elektrolytter og ikke-elektrolytter, danner grunnlaget for de viktigste biologiske væsker, der alle fysiske og kjemiske prosesser finner sted som sikrer kroppens liv. For eksempel, i medisin bruker de kunstige analoger av biologiske væsker - kolloidale og saltvannserstatningsløsninger.

Ris. 4. Avhengighet av løseligheten til stoffer av oppløselighetens natur.
3) Temperaturens påvirkning. Hvis oppløsningen av et stoff er en eksoterm prosess, reduseres oppløseligheten med økende temperatur (for eksempel Ca(OH)2 i vann) og omvendt. De fleste salter er preget av en økning i løselighet ved oppvarming. Nesten alle gasser løses opp ved frigjøring av varme. Løseligheten til gasser i væsker avtar med økende temperatur og øker med synkende temperatur.
4) Effekt av trykk. Med økende trykk øker løseligheten av gasser i væsker, og med synkende trykk avtar den.
Løsninger av stoffer med molar masse mindre enn 5000 g/mol kalles løsninger av lavmolekylære forbindelser (LMC), og løsninger av stoffer med en molar masse på mer enn 5000 g/mol kalles løsninger av høymolekylære forbindelser (HMC).
Ved tilstedeværelse eller fravær elektrolytisk dissosiasjon NMS-løsninger er delt inn i to klasser - løsninger av elektrolytter og ikke-elektrolytter.
Tabell 1.
Tabell over elektrolytter og ikke-elektrolytter.
Elektrolyttløsninger er løsninger av salter, syrer, baser og amfolytter som dissosieres til ioner. For eksempel løsninger av KNO3, HCl, KOH, Al(OH)3, glycin. Den elektriske ledningsevnen til elektrolyttløsninger er høyere enn løsningsmidlets.
Ikke-elektrolyttløsninger er løsninger av stoffer som praktisk talt ikke dissosieres i vann. For eksempel løsninger av sukrose, glukose, urea. Den elektriske ledningsevnen til ikke-elektrolyttløsninger skiller seg lite fra løsningsmidlets.
Løsninger av NMS (elektrolytter og ikke-elektrolytter) kalles sanne i motsetning til kolloidale løsninger. Ekte løsninger karakterisert ved homogenitet i sammensetningen og fravær av en grenseflate mellom det oppløste stoffet og løsningsmidlet. Størrelsen på oppløste partikler (ioner og molekyler) er mindre enn 10 -9 m.
De fleste spiraler er polymerer, molekylene som (makromolekyler) består av stort nummer repeterende grupper eller monomerenheter koblet til hverandre kjemiske bindinger. IUD-løsninger kalles polyelektrolyttløsninger.
Polyelektrolytter inkluderer polysyrer (heparin, polyadenylsyre, polyasparaginsyre, etc.), polybaser (polylysin), polyamfolytter (proteiner, nukleinsyrer).
Egenskapene til spiralløsninger skiller seg vesentlig fra egenskapene til NMS-løsninger.
Du vet allerede at det skjer ulike endringer med kropper og stoffer, som kalles fenomener, og husk at de er delt inn i fysiske og kjemiske. I fysiske fenomener, sammensetningen av ren individuelle stoffer forblir uendret, men bare hans aggregeringstilstand eller formen og størrelsen på kropper.
Fysiske fenomener, uttrykt i endringer i stoffets aggregerte tilstand eller formen og størrelsen på legemer, bestemmer de viktigste bruksområdene i nasjonal økonomi. Dermed lar plastisiteten til aluminium det trekkes inn i tråd eller rulles inn i tynn folie; den elektriske ledningsevnen og den komparative lettheten til aluminium gjør det mulig å bruke det som kraftoverføringsledninger og legeringer - i flykonstruksjon; termisk ledningsevne, plastisitet og ikke-toksisitet - ved fremstilling av servise, etc.
Mange måter å bli ren på kjemiske substanser er i hovedsak fysiske fenomener. Disse inkluderer destillasjon, krystallisering, filtrering, sublimering, etc. For eksempel er metoden for destillasjon (fig. 84), eller destillasjon, basert på forskjellen i kokepunkt for stoffer.
Ris. 84.
Destillasjon
Denne metoden produserer vann renset fra stoffer oppløst i det. Dette vannet kalles destillert. Den brukes til å tilberede medisinske løsninger og til å helle inn i kjølesystemet til biler.
Destillasjon som en metode for å separere flytende blandinger brukes til å oppnå fra naturlig olje individuelle petroleumsprodukter. Industriell installasjon for kontinuerlig destillasjon av olje består den av en rørformet ovn (fig. 85, 1) for oppvarming av oljen og en separasjons- eller rektifiseringskolonne (fig. 85, 2), hvor oljen deles i fraksjoner (destillater) - individuelle oljeprodukter.
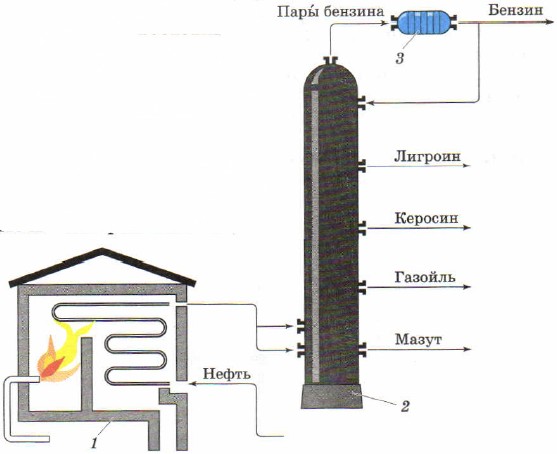
Ris. 85.
Diagram over en rørformet installasjon for kontinuerlig oljedestillasjon:
1 - rørformet ovn; 2 - destillasjonskolonne; 3 - kjøleskap
En lang rørledning er plassert i en spoleformet rørovn. Ovnen varmes opp ved å brenne fyringsolje eller gass. Olje tilføres kontinuerlig gjennom rørledningen, hvor den varmes opp til 320-350 °C og kommer inn i destillasjonskolonnen i form av en blanding av væske og damp.
Destillasjonskolonnen er et sylindrisk apparat av stål som er ca. 40 m høyt. Det har flere titalls horisontale skillevegger med hull, såkalte plater. Oljedamp som kommer inn i kolonnen stiger opp og passerer gjennom hull i platene. Gradvis avkjøling når de beveger seg oppover, blir de flytende på visse plater avhengig av kokepunktet og tettheten. Hydrokarboner er mindre flyktige og blir flytende allerede på de første platene, og danner en gassoljefraksjon, mer flyktige hydrokarboner samles høyere og danner en parafinfraksjon, naftafraksjonen samles enda høyere, de mest flyktige hydrokarboner forlater kolonnen i form av damper og danner bensin. En tykk svart væske samler seg under - fyringsolje. Det brukes som drivstoff, samt for å skaffe smøreoljer gjennom ytterligere destillasjon.
Destillasjonsmetode flytende luft ligger til grunn for å oppnå fra det individuelle komponenter- nitrogen (det koker bort først), oksygen osv.

Ris. 86.
Filtrering
For å rense salter brukes krystalliseringsmetoden. I dette tilfellet løses for eksempel naturlig salt i vann og filtreres deretter (fig. 86). Resultatet er en løsning av bordsalt, renset fra sand, leire og andre urenheter som er uløselige i vann. Deretter skilles saltet fra løsningen ved fordampning (fig. 87), vannet fordamper, og saltkrystaller blir igjen i porselenskoppen.
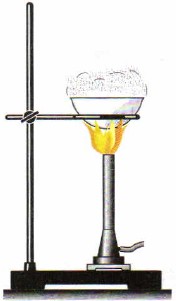
Ris. 87.
Fordampning
Filtreringsmetoden er basert på forskjellige båndbredde porøst materiale - et filter i forhold til partiklene som utgjør blandingen. Filter for rengjøring drikker vann Ved vannbehandlingsanlegg er det et lag med sand. I en støvsuger som renser luften fra støv som er suspendert i den, brukes papir- eller stofffiltre; i medisin, ved pleie av pasienter eller under operasjon, brukes flerlags gasbind som et filter.
For å oppnå rent jod og svovel brukes et fysisk fenomen som sublimering, dvs. overgangen til et stoff fra fast tilstand til gassform ved å omgå væskefasen (fig. 88). Under sublimering fordamper den krystallinske substansen i den oppvarmede delen av enheten, og i den avkjølte delen kondenserer den igjen for å danne krystaller. Is er i stand til å sublimere; det er ikke for ingenting at vått tøy tørker ut selv i kulde.
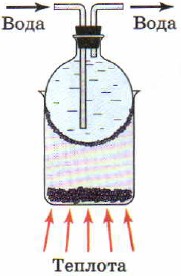
Ris. 88.
Sublimering av jod
Sublimering bestemte bruken av fast stoff karbondioksid CO 2 (som du vet kalles det tørris) for oppbevaring av mat, spesielt iskrem.
Ris. 89.
Oljeseparasjonskolonne
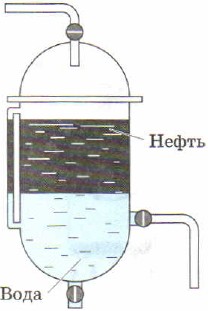
Ulike tettheter av stoffer ligger til grunn for denne metoden for å separere blandinger, for eksempel bunnfelling. For eksempel blandinger av olje og vann, vegetabilsk olje og vannet skilles raskt og er derfor lett å skille fra hverandre ved hjelp av en skilletrakt (Fig. 89, 90).

Ris. 90.
Skilletrakt
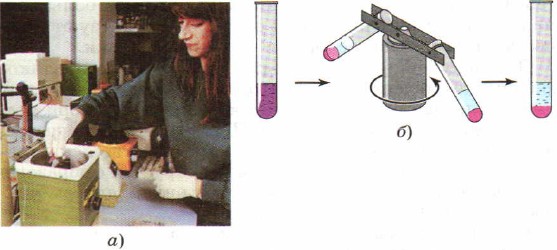
For å fremskynde prosessen med å separere blandinger, i stedet for å sette seg inn laboratoriepraksis Sentrifugering brukes ofte, som fikk dette navnet på grunn av en spesiell enhet - en sentrifuge. Reagensrør med en blanding av stoffer plasseres i en sentrifuge. De slår på enheten, som begynner, som en karusell, å intensivt snurre reagensrørene som er festet i den. Under påvirkning av sentrifugalkraften til partikkelen forskjellige stoffer motta forskjellige akselerasjoner, siden de har forskjellige tettheter, og blandingen separeres (fig. 91).
Ris. 91.
Sentrifugering:
a - fotografi av en sentrifuge; b - sentrifugedriftsdiagram
Stikkord og fraser
- Destillasjon eller destillasjon.
- Destillert vann.
- Krystallisering og fordampning.
- Filtrering.
- Sublimering.
- Beslutningspåvirkning.
- Skilletrakt.
- Sentrifugering.
Arbeid med datamaskin
- Se den elektroniske søknaden. Studer leksjonsmaterialet og fullfør de tildelte oppgavene.
- Søk på Internett e-post adresse, som kan tjene tilleggskilder, som avslører innholdet i søkeord og setninger i avsnittet. Tilby din hjelp til læreren med å forberede en ny leksjon - send en melding innen søkeord og setninger i neste avsnitt.
Spørsmål og oppgaver
- Hvilken metode for å separere blandinger er beskrevet i A. Belyaevs science fiction-verk "The Air Seller"?
- Hvor kommer troen fra at saltsøl fører til krangel? Hvordan forene folk som kranglet om saltsøl?
- Angi metoder for å separere følgende blandinger: a) tannpulver og salt; b) alkohol og vann; c) bensin og vann.
- Hvordan rengjøre og desinfisere mens du reiser elvevann og gjøre den egnet for drikking og matlaging?
- Hvorfor bruker heisarbeidere en spesiell maske når de sikter og sorterer korn?
- Hvilken metode bruker du for å fjerne teblader fra teblader når du heller det fra en tekanne gjennom en sil?
Leder: Boger Natalya Vladimirovna, kjemilærer
Emne: "Oppløsning - en fysisk eller kjemisk prosess?"
Utdanningsinstitusjon: MBOU Kargasokskaya Secondary School nr. 2, landsbyen Kargasok, Tomsk-regionen
Medieressurser brukt: WORD-tekstredigering, Internett-ressurser
1) Studiens relevans (hvorfor dette emnet tatt av forfatteren for forskning)
Vi har studert fysikk i to år nå, vi brenner for denne vitenskapen, vi studerer grunnleggende lover og fysiske fenomener. Og det har alltid vært klart for oss at prosessen med å løse opp sukker, salt og annet løselige stoffer i vann - et fysisk fenomen. I år begynte vi å studere ny vitenskap– kjemi. Og for en overraskelse det var for oss at oppløsningsprosessen er et kjemisk fenomen. Kjemi er vitenskapen om stoffer, egenskaper og deres transformasjoner. Men i prosessen med å løse opp sukker i vann, fikk vi verken en syre, en alkali eller noe annet stoff. Sukker forblir sukker.
2) Definisjon av forskningsemnet (Hva skal studeres?)
Vi var interessert i spørsmålet om hvordan de er forskjellige fysiske endringer fra kjemikalier? Dette er ikke et veldig enkelt spørsmål.
3) Formulering av problemstillingen. Hva er problemet? Hvilket spørsmål skal besvares?
Finn ut om prosessen med å løse opp stoffer i vann er fysisk eller kjemisk.
4) Foreslå en hypotese. Hva kan være det mulige svaret?
Vi legger frem en hypotese : Det er mulig at linjen mellom fysiske og kjemiske transformasjoner er vilkårlig og vilkårlig.
5) Hypotesetesting.
På sånn som det er nå arbeidet foregår i tre retninger:
- Teoretisk analyse av vitenskapelig litteratur;
- Fysisk og kjemisk eksperiment;
- Analyse av eksperimentelle data.
Arbeid i første retning gjorde det mulig å vurdere teoretiske problemstillinger prosessen med å løse opp stoffer i vann. Problemet med oppløsning har vært av interesse for mennesket i lang tid. Alkymister, og deretter kjemikere fra påfølgende århundrer, prøvde å avdekke essensen av oppløsningsprosessen. Dermed antok den engelske kjemikeren R. Boyle (1627-1691) at løsemiddelpartikler har pigger, kroker og andre innretninger som de fester seg til partikler av det oppløste stoffet ved hjelp av, og det er derfor oppløsning skjer.
Han uttrykte en mer vitenskapelig mening om oppløsningen av M.V. Lomonosov (1711-1765): "saltpartikler skilles fra hverandre ved virkningen av vannpartikler ..." og ved å feste seg til vannpartiklene begynner de sammen å bevege seg fremover og spres gjennom løsningsmidlet.
På 1800-tallet ble forskning på løsninger videreført av D.I. Mendeleev (1834-1907). Veldig viktig han la vekt på studiet av termiske effekter under oppløsning. Det er kjent at når noen stoffer løses opp, frigjøres varme, og når andre løses opp, absorberes varme.
Teorien om oppløsning ble utviklet i verkene til den svenske vitenskapsmannen Svante Arrhenius (1859-1927). Han foreslo at stoffet i løsning brytes ned til ioner. Deretter har den russiske forskeren I.A. Kablukov (1857-1942) kombinerte teorien om elektrolytisk dissosiasjon til S. Arrhenius med hydratteorien til D.I. Mendeleev. Han la frem antagelsen om hydrering (interaksjon med vann) av ionene som ble dannet i løsningen, noe som ble bevist eksperimentelt.
Tilhengere av den fysiske teorien om løsninger, som ble utviklet av Van't Hoff, Arrhenius og Oswald, mente at oppløsningsprosessen er et resultat av diffusjon, dvs. penetrering av det oppløste stoffet inn i mellomrommene mellom vannmolekyler, dvs. fysiske fenomen.
Tilhengere av den kjemiske teorien om løsninger, som ble utviklet av D.I. Mendeleev, I.A. Kablukov, V.A. Kistyakovsky, mente at oppløsningsprosessen er en kjemisk interaksjon mellom et oppløst stoff og vann.
Etter å ha vurdert teoretiske problemstillinger, begynte vi den eksperimentelle delen av arbeidet vårt.
La oss gjennomføre et eksperiment, mål som skal demonstrere at nåroppløsningsprosessen skjer uniform distribusjon ett stoff i et annet, der det oppløste stoffet går over i den aggregerte tilstanden til et løsemiddel, dvs. et fysisk fenomen oppstår.
Erfaring nr. 1. Diffusjonsfenomenet ved å bruke eksemplet med kaliumpermanganat
Hvis flere granuler av kaliumpermanganat legges i et beger med vann, kan vi se hvordan mengden fast avtar gradvis. Samtidig får vannet som er tilsatt krystaller nye egenskaper. En karmosinrød farge vises.
Konklusjon : Vi observerer diffusjonsprosessen – Dette er den spontane gjensidige penetrasjonen av molekyler av ett stoff inn i mellomrommene mellom molekylene til et annet. Det oppstår fordi molekylene til ett og annet stoff gjensidig penetrerer hverandre.
Erfaring nr. 2. Effekt av temperatur på diffusjonsprosessen
Det viser seg at diffusjonshastigheten til visse stoffer kan påvirkes av endringer i temperaturen. For å være sikker på dette tok vi to glass, ett med varmt og det andre med kaldt vann. En lik mengde kaliumpermanganat ble helt. I et av glassene vil diffusjonen gå mye raskere. Som forteller oss livserfaring, skjer diffusjon jo raskere jo høyere temperatur de diffuserende stoffene har.
Konklusjon: Jo høyere temperatur på stoffer, jo raskere skjer diffusjon.
Den kjemiske interaksjonen mellom et stoff og et løsemiddel bedømmes av visse tegn. La oss liste opp tegnene kjemiske reaksjoner:
- fargeendring;
- utseende av lukt;
- dannelse og oppløsning av sediment;
- gass utgivelse;
- frigjøring eller absorpsjon av varme.
La oss gjennomføre et eksperiment, mål som viser at når løsninger dannes, kan varme frigjøres.
Erfaring nr. 3. Varmefrigjør når syre er oppløst i vann.
For dette eksperimentet tok vi følgende utstyr: svovelsyre(98%), vann, temperatursensor, 100 ml beger I løpet av forsøket, da en liten mengde (5 ml) svovelsyre ble oppløst i vann i 1 ml porsjoner, ble det observert en betydelig temperaturøkning.
Kjemisk reaksjonsprosess:
Konklusjon: Når svovelsyre ble oppløst i vann, observerte vi en betydelig temperaturøkning, og dette er et tegn på en kjemisk reaksjon.
Forsøk nr. 4. Absorpsjon av varme når salt er oppløst i vann.
Formål: å demonstrere at varme kan absorberes under dannelsen av løsninger.
Kjemisk reaksjon:
For eksperimentet tok vi 5 g kaliumnitrat og løste det opp i 10 ml vann.
Konklusjon : Vi observerte en nedgang i temperatur når kaliumnitrat ble oppløst i vann, og dette er et tegn på en kjemisk interaksjon.
Kompleksiteten i oppløsningsprosessen bevises ikke bare av termiske effekter, men også et slikt tegn på kjemiske reaksjoner som fargeendring.
Erfaring nr. 5 .Fargeforandring under saltoppløsning.
La oss ta hvitt pulver kobbersulfat og løs det i vann. Dette skaper en løsning blå farge. Dette beviser at under oppløsning skjer en kjemisk prosess - hydrering av ioner:
Hvis løsningen fordampes, faller blå krystaller ut. Bevaring av fargen på krystallene indikerer at under krystallisering av saltet fra løsninger blir de hydratiserte ionene ikke ødelagt, men bevart
Konklusjon: Stoffer hvis krystallgitter inneholder hydratiserte ioner kalles krystallhydrater, og vannet som inngår i krystallhydratet kalles krystallisasjonsvann.
Erfaring nr. 6 Fargeendring under jodoppløsning.
Vi utførte et eksperiment ved å løse opp jod i ulike løsemidler. Joddamp har lilla. Den samme fargen finnes i en løsning av jod i bensin. I vann er en løsning av jod gul, i benzen eller alkohol er den brun (dette er fargen på den kjente jodtinkturen), i en løsning av polyvinylalkohol er joden blå (dette er fargen på stoffet jodinol). Og ikke bare endres fargen i forskjellige løsemidler, den oppfører seg også kjemisk forskjellig.
Konklusjon: Oppløste molekyler binder seg til løsemiddelmolekyler, noe som resulterer i dannelsen av nye. kjemiske forbindelser.
6 ) Forklaring av resultater. Mulige konklusjoner.
Vi fant ut hva oppløsningsprosessen er - fysisk eller kjemisk. Vi studerte de teoretiske problemstillingene i oppløsningsprosessen. Vi undersøkte tegn på fysiske og kjemiske fenomener under oppløsning. Alle de vurderte egenskapene og prosessene ble eksperimentelt bekreftet. Som et resultat av studien fant vi ut at oppløsningsprosessen er en fysisk og kjemisk prosess, og løsninger er et enhetlig (homogent) system som består av partikler av et oppløst stoff, et løsningsmiddel og produktene av deres interaksjon - hydrater. Vi fant ut at grensen mellom fysisk og kjemiske fenomener stort sett betinget. Det ble utført tilfeldig av forskere. Oppløsningsprosessen kan klassifiseres som fysisk på noen måter, og kjemisk på andre. Derfor begynte slike prosesser å bli kalt fysisk-kjemiske fenomener.
De formulerte konklusjonene lar oss vurdere at formålet med studien er oppnådd. Dette er imidlertid ikke slutten på vår forskning den konfronterer oss med ny oppgave- Hvorfor vandige løsninger Noen stoffer leder elektrisk strøm, finn årsaken til dette fenomenet. Men det blir en annen studie.
- Forbereder for presentasjonen forskningsmateriale. Skrive rapport.
Det ble benyttet anledninger til å skrive rapporten tekstredigerer WORD Det endelige materialet presenteres også i form av en presentasjon laget i POWER POINT-editoren.
Som et resultat av arbeidet ble følgende litteratur brukt:
- Alikbekov L.Yu. Underholdende oppgaver og eksperimenter i kjemi M. Drofa, 2006.
- Gorev L.A. Underholdende eksperimenter i fysikk. M. Education, 1985
- Magasinet "Vitenskap og liv", nr. 5 2004.
- Kuznetsova L.M. Kjemi 9. klasse. M. Mnemosyne, 2003.
- Olma Encyclopedia. Transformasjoner av materie. Kjemi. M. Olma Media Group, 2013.
- Internett-ressurs.
Oppløsning er prosessen med jevn fordeling av ett stoff i et annet, der det oppløste stoffet går over i den aggregerte tilstanden av løsemiddel
Løsningen er kjemisk system, dannet av flere stoffer, mellom hvilke det ikke er noen grensesnitt.
Fysisk teori løsninger:
Oppløsning er en diffusjonsprosess, det er løsninger homogene blandinger
Kjemisk teori løsninger:
Oppløsning er prosessen med kjemisk interaksjon av et oppløst stoff med vann - hydrering, løsninger - forbindelser hydrater
La oss vurdere prosessen med å løse opp stoffer.
Hvis vi for eksempel tilsetter sukker til te, kan vi observere hvordan mengden fast stoff gradvis avtar. Hvis teen er kald, løses sukkeret sakte opp. Tvert imot, hvis teen er varm og rørt med en skje, skjer oppløsning raskt. Når de er i vann, danner sukkermolekyler på overflaten av granulerte sukkerkrystaller bindinger med vannmolekyler. I dette tilfellet binder flere vannmolekyler seg til ett sukkermolekyl. Den termiske bevegelsen til vannmolekyler fører til at sukkermolekylene som er knyttet til dem, bryter bort fra krystallen og beveger seg inn i tykkelsen på løsemiddelmolekylene. Sukkermolekyler som har gått fra krystallen inn i løsningen kan bevege seg gjennom hele volumet av løsningen sammen med vannmolekyler på grunn av diffusjon. Hvis løsningen varmes eller røres, skjer diffusjonen mer intenst og sukkeret løses opp raskere. Sukkermolekyler fordeles jevnt og løsningen blir like søt gjennom hele volumet.
Stoffer endres ikke når de er oppløst etter fordampning av løsninger, vi kan få det oppløste stoffet i fast tilstand. Under oppløsning blir krystallgitteret til det oppløste stoffet ødelagt og partiklene beveger seg i løsningen, derfor er oppløsning en fysisk prosess. For å gjennomføre en slik prosess er det nødvendig å bruke energi.
Men når oppløste molekyler binder seg til vannmolekyler, dannes det faktisk nye kjemiske forbindelser. Disse molekylære assosiatene har ikke en konstant sammensetning. Deres vanlig navn- hydrater. Prosessen med å binde stoffer med vann kalles hydrering. Når løsninger fordampes, ødelegges hydrater og krystallinsk substans. Noen stoffer er imidlertid i stand til å danne stabile hydrater, som kan inneholde vann selv i krystallinsk tilstand. Slike stoffer kalles krystallinske hydrater. De kan isoleres fra løsningen ved å forsiktig fordampe vannet. I formlene til slike stoffer er krystallisasjonsvannet indikert etter formelen til forbindelsen med et multiplikasjonstegn. For eksempel: CuSO 4 5H 2 O - kobbersulfat, FeS04 · 7H20 - jernsulfat. Hydratdannelse, dvs. nye stoffer, indikerer at oppløsning er en kjemisk prosess.
Studiet av de termiske fenomenene som oppstår under denne prosessen bidrar til å forstå essensen av oppløsningsprosessen. Det er kjent at et av tegnene på kjemiske reaksjoner er frigjøring av varme, og for fysiske fenomener er det nødvendig å bruke energi. Oppløsningen av svovelsyre er ledsaget av sterk oppvarming av løsningen. Dette er resultatet av en kjemisk interaksjon mellom vann og oppløste molekyler - hydrering er ledsaget av frigjøring av energi. Og oppløsningen av ammoniumnitrat er ledsaget av avkjøling av løsningen. I dette tilfellet brukes mer energi på den fysiske prosessen med ødeleggelse av krystallgitteret enn det som genereres under produksjonen av hydrater.
Ovennevnte fakta indikerer at oppløsning bør betraktes som en fysisk-kjemisk prosess.
Hjemmelekser: avsnitt 34, øvelse 2
lære definisjoner
Elektrolytter og ikke-elektrolytter.
Elektrolytter– dette er stoffer hvis løsninger eller smelter leder elektrisk strøm.
Ikke-elektrolytter– dette er stoffer hvis løsninger eller smelter ikke leder elektrisk strøm.
Elektrolytisk dissosiasjon– Dette er nedbrytningen av en elektrolytt til fritt bevegelige ioner når den er oppløst i vann eller når den smeltes.
Elektrolytter når det er oppløst i vann eller
smelting bryte opp (dissosiere) til ioner – positivt (kationer) og negativ (anioner) ladede partikler.
Ionerer mer stabile elektroniske tilstander enn atomer. De kan bestå av ett atom - dette er enkle ioner(Na +, Mg 2+, Al 3+, etc.) - eller fra flere atomer - dette er komplekse ioner(NO 3 -, SO 2- 4, RO Z- 4, etc.).
I løsninger og smelter elektrolytter leder elektrisitet .
Under påvirkning elektrisk strøm ioner får retningsbevegelse: positivt ladede ioner beveger seg mot katoden, negativt ladede beveger seg mot anoden. Derfor kalles førstnevnte kationer, sistnevnte - anioner. Retningsbevegelsen til ioner skjer som et resultat av deres tiltrekning av motsatt ladede elektroder.
Dissosiasjon- en reversibel prosess: parallelt med desintegrasjonen av molekyler til ioner (dissosiasjon), skjer prosessen med å kombinere ioner (assosiasjon).
Derfor, i ligningene for elektrolytisk dissosiasjon, i stedet for likhetstegnet, brukes reversibilitetstegnet. For eksempel ligningen for dissosiasjonen av elektrolyttmolekylet KA inn i kationen K + og anionet A - in generelt syn er registrert
KA ↔ K + + A -
Lekser: paragraf 35, eks. 1,4,5,lær definisjoner
Grunnleggende bestemmelser i TED.
1. Elektrolytter, når de er oppløst i vann, brytes opp (dissosieres) til ioner - positive og negative.
2. Under påvirkning av elektrisk strøm får ioner retningsbevegelse: positivt ladede partikler beveger seg mot katoden, negativt ladede partikler beveger seg mot anoden. Derfor kalles positivt ladede partikler kationer, og negativt ladede partikler kalles anioner.
3. Rettet bevegelse oppstår som et resultat av tiltrekning av deres motsatt ladede elektroder (katoden er negativt ladet, og anoden er positivt ladet).
4. Ionisering er en reversibel prosess: parallelt med desintegrering av molekyler til ioner (dissosiasjon), skjer prosessen med å kombinere ioner til molekyler (assosiasjon).
Basert på teorien om elektrolytisk dissosiasjon kan vi gi følgende definisjoner for hovedkoblingsklasser:
Syrer er elektrolytter hvis dissosiasjon produserer bare hydrogenioner som kationer. For eksempel,
HCl → H+ + Cl-;
CH 3 COOH H + + CH 3 COO - .
Basiciteten til en syre bestemmes av antall hydrogenkationer som dannes under dissosiasjon. Således er HCl, HNO 3 monobasiske syrer, H 2 SO 4, H 2 CO 3 er dibasiske, H 3 PO 4, H 3 AsO 4 er tribasiske.
Baser er elektrolytter hvis dissosiasjon produserer bare hydroksidioner som anioner. For eksempel,
KOH → K + + OH - ,
NH4OH NH4+ + OH-.
Baser som er løselige i vann kalles alkalier.
Surheten til en base bestemmes av antall hydroksylgrupper. For eksempel er KOH, NaOH en-syre baser, Ca(OH) 2 er to-syre, Sn(OH) 4 er fire-syre, etc.
Salter er elektrolytter, hvis dissosiasjon produserer metallkationer (så vel som NH 4 + ion) og anioner syrerester. For eksempel,
CaCl 2 → Ca 2+ + 2Cl - ,
NaF → Na + + F-.
Elektrolytter, under dissosiasjonen av hvilke, avhengig av forholdene, kan samtidig danne både hydrogenkationer og anioner - hydroksidioner kalles amfotere. For eksempel,
H 2 O H + + OH - ,
Zn(OH) 2 Zn 2+ +2OH - ,
Zn(OH)2 2H + +ZnO22- eller
Zn(OH)2 + 2H202- + 2H+.
Lekser: paragraf 36, eks. 2-5, lær definisjoner
