Aine kogus. Mool on aine koguse ühik. Avogadro number
Lisaks eelnevalt käsitletud absoluutsele ja suhteline mass aatomid ja molekulid keemias suur tähtsus on eriline väärtus – aine hulk. Aine koguse määrab arv struktuuriüksused(aatomid, molekulid, ioonid või muud osakesed). Aine kogust tähistatakse tähega ν. Te juba teate, et igal füüsikalisel suurusel on oma mõõtühik. Näiteks keha pikkust mõõdetakse meetrites, aine massi kilogrammides. Kuidas mõõdetakse aine kogust? Aine koguse mõõtmiseks on spetsiaalne ühik - mool.
Sünnimärk on aine kogus, mis sisaldab nii palju osakesi (aatomeid, molekule või teisi), kui on süsinikuaatomeid 0,012 kg-s (st 12 g süsinikus. See tähendab, et üks mool tsinki, üks mool alumiiniumi, üks mool süsinikku sisaldavad üks ja sama arv aatomeid See tähendab ka seda, et üks mool molekulaarset hapnikku, üks mool vett sisaldavad nii esimesel kui ka teisel juhul ühes moolis sisalduvate osakeste (aatomite, molekulide) arv. on võrdne aatomite arv ühes süsiniku moolis. On katseliselt kindlaks tehtud, et üks mool ainet sisaldab 6,02 x 1023 osakest (aatomeid, molekule või teisi). 1023 osakest, millest see koosneb , hapnik, vesi jne), siis on üks selle aine mool selle molekulidest 6,02 x 1023. See väärtus 6,02 x 1023 on nime saanud kuulsa itaalia teadlase Amedeo Avogadro järgi ja seda tähistatakse NA. Avogadro arv näitab osakeste arvu aine ühes moolis, seega võib selle mõõde olla "osakesed / mool". Kuna aga osakesed võivad olla erinevad, jäetakse sõna “osakesed” välja ja selle asemel kirjutatakse ühik Avogadro numbri mõõtmes: “1/mol” või “mol-1”. Seega: NA = 6,02 1023.
Avogadro number väga suur. Võrdleme: kui kogute 6,02 · 1023 14-sentimeetrise raadiusega palli, on nende kogumaht ligikaudu sama suur kui kogu meie planeedil Maa.
Aatomite (molekulide) arvu määramiseks teatud koguses aines peate kasutama järgmine valem: N = ν NA,
kus N on osakeste (aatomite või molekulide) arv.
Näiteks määrame alumiiniumi aatomite arvu 2 mooli alumiiniumaines: N (Al) = ν (Al) · NA.
N (Al) = 2 mol · 6,02 · 1023 = 12,04 · 1023 (aatomid).
Lisaks saate määrata aine koguse teadaolev number aatomid (molekulid): ![]()
Aine kogus on osakeste arv aine ühes osas.
Aine kogus on näidatud Kreeka kiri ν ("alasti")
Sünnimärk on aine koguse ühik. See on aine kogus (või osa sellest), mis sisaldab 6,02 · 10 23 osakest (molekule, aatomeid või muid osakesi). Ümardatud: 6 · 10 23 .
Väärtust 6,02 10 23 mol -1 nimetatakse Avogadro konstandiks ja seda tähistatakse Ladina täht ja indeks N A:
NA = 6,02· 10 23 mol
Niisiis, üks mool mis tahes ainest sisaldab 6,02 · 10 23 molekuli, aatomit või muid osakesi.
Näiteks 1 mool vett H 2 O sisaldab 6 · 10 23 molekuli H 2 O;
1 mool rauda Fe sisaldab 6 10 23 Fe aatomit.
1 mool kloori Cl 2 sisaldab 6 10 23 Cl 2 molekuli.
Samal ajal sisaldab 1 mool kloori Cl2 2 mooli kloori aatomeid Cl.
Seetõttu märkige sulgudes märgete kirjutamisel kõnealuse osakese valem:
N(Cl 2) on kloori molekulide arv ja N(Cl) on kloori aatomite arv;
ν(Cl 2) on molekulaarse kloori aine kogus ja ν(Cl) on kloori aatomaine kogus.
Näiteks määrame vees sisalduvate molekulide arvu koguses 0,5 mol:
N(H2O) = N A ν(H2O) = 6 10 23 mol -1 0,5 mol = 3 10 23.
Molaarmass ained M(X) on võrdne aine massi m(X) ja vastava aine koguse ν(X) suhtega:
m(X)
M(X) = --
ν(X)
Molaarmassi väljendatakse grammides mooli kohta (g/mol) või kilogrammides mooli kohta (kg/mol).
1 g/mol = 10-3 kg/mol.
MolaarmassM võrdub suhtelise molekulmassigaM r (kui aine koosneb molekulidest) või suhteline aatommassA r (kui aine koosneb aatomitest).
Näiteks vastavalt perioodilisustabel, magneesiumi Mg aatommass on 24 ja selle molaarmass 24 g/mol. See tähendab, et 1 mooli magneesiumi kaal on 24 grammi. Või teisiti öeldes sisaldab 24 grammi magneesiumi 6 10 23 magneesiumi aatomit.
Sünnimärk. Üks mool võetakse aine koguseühikuna. See on aine kogus, mis sisaldab nii palju tingimuslikud osakesed, mitu aatomit sisaldab 0,012 kg süsinik-12, st 6,02045 10 23. Tingimuslik osake võib olla molekul, ioon, elektron, osakeste rühmad (näiteks funktsionaalne rühm, molekuli osa, assotsieerunud, radikaal jne). Ühesõnaga, tingimuslik osake on mis tahes diskreetne materiaalne üksus (sh makroobjektid, näiteks laud, tool, lauajalg jne). Mõned tingimuslikud osakesed on tegelikult olemas (H 2 molekul, IO 3 - ioon, laud, tool), teised - puhtalt tinglikult (NaCI molekul lahuses, pool molekuli, prooton lahuses).
Makroobjekte on lihtne eraldi loendada. Kusjuures mikroobjekte (aatomeid, molekule jne) makroobjektis üles lugeda ei saa. Seetõttu on tavaliste osakeste ühik "mool" mugav ja seda kasutatakse tavaliselt mikroobjektide arvu väljendamiseks, seda ei ole kohane kasutada makroobjektide arvu hindamiseks. Aine moolide arvu tähistamiseks kasutage sümbolit n . Kirjutades n(H +)= 1,0·10 -6 mol, tähendab 6,02·10 23 10 -6 prootonit;
n(1/5KMn04) = 0,05 mol - 6,02 · 10 23 · 0,05 tavalist osakest 1/5KMnO4;
n(e)=1 mol - 6,02·10 23 elektroni.
Praktikas keemiline analüüs sellist teavet on harva vaja.
Molaarmass (M) - See on 1 mooli aine mass. Kui on ainet massiga m, See M = m/n. Molaarmassi mõõde on g mol -1.
Numbriliselt on molaarmass võrdne suhtelise molekulmassiga, st osakese kõigi aatomite kogumassiga, jagatud 1/12 süsinikuaatomi massist. Sugulane molekulmass- mõõtmeteta kogus, seda saab tabelitest hõlpsasti arvutada aatomi massid elemendid.
Molaarmaht (V o) - on 1 mooli aine maht at normaalsetes tingimustes. Tavaliselt kasutatakse seda väärtust antud juhul gaaside puhul V o = 22,4 L mol-1.
Molaarlaeng (Q) - See on 1 mooli aine kogulaeng. Ühekordselt laetud osakeste jaoks Q= 96485 C mol -1 (Faraday number, F), z-laadijate jaoks Q=zF.
Kontsentratsiooni väljendamise viisid. IN analüütiline keemia tegelevad sageli sisalduva aine kogusega teatud maht, st. keskendumisega. See on eriti oluline lahustes olevate ainete puhul. Mahuühik on kuupmeeter(m 3) või kuupdetsimeeter (dm 3), mis on täpselt võrdne 1 liitriga (l).
Molaarne kontsentratsioon c - lahustunud aine moolide arvu ja lahuse ruumala suhe. See termin kehtib mis tahes tüüpi tingimuslike osakeste (aatomid, ioonid, molekulid, molekulide osad jne) kohta. Seega väljendatakse molaarset kontsentratsiooni mol dm -3 või mol l -1 (mol lahustunud aine liitri lahuse kohta), lühendatult M.
Näiteks c(HC1)=0,1 mol-1-1 või c(HC1)=0,1 M; c(1/5KMn04) = 0,05 mol l-1 või 0,05 M (l/5 KMn04).
Mõelgem teistele keskendumise väljendamise viisidele. Massi kontsentratsioon- lahustunud aine massisuhe Prl lahuse mahuni V, massikontsentratsiooni ühikud kg dm -3 või kg l -1, samuti mitmekordsed alamkorrutised*.
Mahukontsentratsioon - lahustunud aine mahu ja lahuse ruumala suhe.
Tihti väljendatakse lahuse või muude objektide koostist komponentide osakaal aine koguhulgast. Selle kompositsiooni väljendamise meetodi mugavus seisneb selle sõltumatuses objekti koondseisundist.
**** Nimetatakse massikontsentratsiooniks, mida väljendatakse aine grammides milliliitri kohta pealdis. See üksus andis oma nime klassikaline meetod analüüs - titrimeetria.
"Proportsioon" tähendab komponendi osade arvu suhet koguarv objekti osad. Sõltuvalt valitud ühikust eristatakse molaar- (a), massi (ω), mahu (φ) fraktsioone:
Osakaal on väljendatud protsentides ( massiosa nimetatakse protsentides väljendatuna protsentuaalne kontsentratsioon), miljondikosa (ppm), osa miljardi kohta (ppb), osa triljoni kohta (ppt). Ühikud ppm, ppb ja ppt on kasulikud ainete väikeste koguste hindamiseks. Sel juhul tuleks murdosa (a, ω või φ) korrutada 10 6, 10 9 või 10 12-ga, et saada mugav või sellele lähedane täisarv.
Näide 1. Askorbiinhappe sisaldus kibuvitsamarja infusioonis on 5,5 mg 1 liitri kohta. Väljendage askorbiinhappe sisaldus massiosades.
Leiame askorbiinhappe massiosa lahuses (arvestades, et 1 liitri mass on 10 3 g):
![]()
See arv on arvutuste jaoks ebamugav. Teisendame selle ppm ühikuteks (miljon -1):
5,5 10 -6 ·10 6 =5,5 miljonit-l.
Molaalsus - aine kogus lahusti massiühiku (1 kg) kohta. Molaalsuse eelis ei sõltu temperatuurist. Kuid seda ühikut kasutatakse analüütilises keemias harva.
Samaväärne. Ühendis olevate tavaliste osakeste vahel on teatud seosed, mida nimetatakse stöhhiomeetrilisteks. Näiteks NaCI molekulis on üks naatriumi aatom seotud ühe klooriaatomiga H 2 CO 3 molekulis, kaks prootonit on seotud ühe CO 3 2- osakesega. Stöhhiomeetrilised suhted luuakse ka reageerivate osakeste vahel, näiteks reaktsioonis
aA + bB = cC + dD
ja aine A tingimuslikud osakesed reageerivad b aine B tingimuslikud osakesed. Järelikult on üks osake A samaväärne aine B b/a osakestega.
Suhet b/a nimetatakse aine ekvivalentsustegur B ja on tähistatud ¦ ekv (B) ja tingimuslik osake B, mis vastab osakesele A antud reaktsioonis, on b/a B või ¦ eq B(B). Näiteks reaktsioonis
2HC1 + Na2CO3 = NaCI + H2CO3
¦ ekv (Na2CO3) = 1/2 , ja ekvivalent on tavaline osake 1/2 Na2CO3.
Ained reageerivad üksteisega ekvivalentide kaudu – see kordajate seadus Dalton analüütilises keemias on kõigi kvantitatiivsete arvutuste aluseks, eriti titrimeetriliste analüüsimeetodite puhul.
Ekvivalentide mool, nagu osakeste mool, sisaldab 6,02 10 23 ekvivalenti ja ekvivalendi molaarmass on arvuliselt võrdne kõigi selle koostisosade aatomite aatommasside summaga. Sama aine ekvivalent võib olenevalt reaktsioonist erineda. Näiteks reaktsioonis
HC1 + Na2CO3 = NaHC03 + NaCI
naatriumkarbonaadi ekvivalent on tavaline osake Na 2 CO 3 (¦ ekv = 1), samas kui ülaltoodud reaktsioonis 1/2 Na 2 CO 3 (¦ ekv = 1/2).
Happe-aluse reaktsioonides on ekvivalent tingimuslik osake, mis antud reaktsioonis ühendab, asendab, vabastab ühe vesinikiooni või on mõnel muul viisil samaväärne ühe vesinikuiooniga. Redoksreaktsioonides on ekvivalent tingimuslik osake, mis antud reaktsioonis lisab või loovutab ühe elektroni (või on mõnel muul viisil samaväärne ühe elektroniga).
Praktikas ei käsitle nad mitte üksikuid ekvivalente ega üksikut keemilist toimingut, vaid suuri osakeste agregaate. Sel juhul avalduvad ainetevahelised stöhhiomeetrilised seosed ainete koguste suhtes moolides:
p(A):p(B)=a:b
2.2. Analüüsimeetodi valimine
Analüüsimeetodit valides tuleb selgelt teada analüüsi eesmärki, lahendamist vajavaid probleeme ning hinnata olemasolevate analüüsimeetodite eeliseid ja puudusi.
Enne kui hakata kaaluma tegureid, mida tuleb konkreetse analüüsimeetodi valimisel arvesse võtta, käsitleme meetodi ja tehnika mõisteid.
meetod - see on analüüsi aluseks olevate põhimõtete kogum, olenemata konkreetsest määratletavast objektist ja ainest;
metoodika - Täpsem kirjeldus kõik tingimused ja toimingud konkreetse objekti analüüsimiseks.
Näiteks gravimeetriline analüüsimeetod põhineb ühendi massi määramisel, mis sisaldab või harvemini kaotab määratavat komponenti. Komponendi gravimeetrilise määramise tehnika hõlmab: selle halvasti lahustuva ühendi sadestamise tingimuste kirjeldust, meetodit sademe lahusest eraldamiseks, sadestunud aine kaalumiseks sobivasse vormi jne. komponent sisse konkreetne objekt Metoodika sisaldab ka proovide võtmise ja analüüsiks ettevalmistamise toimingute kirjeldust (näiteks proovi lahustamist sobivas lahustis ja määramist segavate ainete mõju kõrvaldamist). Vaatame peamisi tegureid, mida tuleb meetodi ja tehnika valikul arvesse võtta.
Komponendi sisu. Analüütilise meetodi valikul on vaja arvestada avastatud või määratud komponendi eeldatavat sisaldust. Oluline on mitte ainult hinnata protsentides komponent proovis, selle kontsentratsioon analüüsitavas lahuses, aga ka aine kogus, mida saab analüüsiks võtta. Seega määrab analüüsimeetodi valiku komponendi absoluutne sisaldus.
Määratava komponendi kontsentratsioon ja analüüsiks antava proovi kogus võivad varieeruda suurtes piirides. Seega võib vase, nikli, kroomi sisaldus nende sulamites olla kümneid, mineraalides, maakides, muude metallide sulamites kümnendikke ja sajandikuid. Samal ajal tuleb nende metallide sisaldus taimedes, elusorganismides ja toiduainetes määrata juba sisse n 10 -7 - P 10 -5 %, ja eriti puhastes ainetes - sisse n 10 -8 -10 -6 %.
Analüüsiks saadava proovi kogus ei pruugi mõnel juhul olla piiratud, kuid mõnel juhul (mineraalide lisandite määramine, vere, biomassi, kosmoseobjektide analüüs jne) on see väga väike (milligrammid või isegi milligrammi murdosad).
 Tundlikkus
meetod või tehnika määratakse aine minimaalse koguse järgi, mida on võimalik antud meetodiga tuvastada või määrata antud tehnikat kasutades (selle mõiste ja selle täpsem määratlus kvantitatiivne väljendus vt hiljem selles peatükis). Joonisel fig. Tabelis 2.1 on näidatud mõne meetodi suhteline tundlikkus. Alumine joon määratud sisu demonstreerib meetodi võimalusi ja parim tulemus, mis saavutatakse mitmete ainete määramisel.
Tundlikkus
meetod või tehnika määratakse aine minimaalse koguse järgi, mida on võimalik antud meetodiga tuvastada või määrata antud tehnikat kasutades (selle mõiste ja selle täpsem määratlus kvantitatiivne väljendus vt hiljem selles peatükis). Joonisel fig. Tabelis 2.1 on näidatud mõne meetodi suhteline tundlikkus. Alumine joon määratud sisu demonstreerib meetodi võimalusi ja parim tulemus, mis saavutatakse mitmete ainete määramisel.
Võrreldes erinevate meetodite tundlikkust ja hinnates komponendi ligikaudset sisaldust proovis, valib keemik ühe või teise analüüsimeetodi. Näiteks naatriumisisalduse määramiseks silikaatkivimites kasutatakse gravimeetrilist meetodit, mis võimaldab määrata miya-digrammi ja suuremaid naatriumi koguseid; sama elemendi mikrogrammiste koguste määramiseks taimedes ja loomse päritoluga bioloogilistes proovides - leekfotomeetria meetod; naatriumi määramiseks eripuhtusega vees (nano- ja pikogrammi kogused) - laserspektroskoopia meetod.
Meetodi selektiivsus. Analüüsi läbiviimisel tegelevad nad väga erinevate objektidega - tööstus- ja põllumajandustooted, esemed keskkond, kosmoseobjektid, kunstiteosed jne. Loomulikult ei määra analüüsimeetodi ja -tehnika valikut mitte ainult analüüsiülesanne, vaid ka valimi omadused ja omadused. On vaja arvestada analüüsitava objekti füüsikalisi omadusi: selle agregatsiooni olek, lenduvus, hügroskoopsus, mehaaniline tugevus jne. Analüüsimeetodi valikul on määravad tegurid Keemilised omadused näidis. Sel juhul on oluline teada ja arvestada: proovialuse keemilisi omadusi, mida sageli nimetatakse analüüsitava objekti maatriksiks; proovi kvalitatiivne keemiline koostis; määratava komponendi ja sellega kaasnevate lisandite keemilised omadused.
Teades aluse keemilisi omadusi ja analüüsitava objekti eeldatavaid komponente, hinnates võimalikke häireid, valige võimalikult palju valikuline meetod , see tähendab meetodit, mille abil saab antud tingimustes soovitud komponente tuvastada või identifitseerida ilma teiste olemasolevate komponentide sekkumiseta. Keemiakirjanduses kasutatakse koos terminiga "selektiivsus" ka terminit "selektiivsus".
Kui meetod või tehnika võimaldab tuvastada või määrata ainult ühte komponenti, siis seda nimetatakse spetsiifiline .
Võime rääkida komponendi tuvastamise või määramise aluseks oleva meetodi, tehnika ja individuaalse reaktsiooni selektiivsusest. Seega iseloomustab selliseid meetodeid nagu ionomeetria, aatomabsorptsioon ja ensümaatilised meetodid kõrge selektiivsus. Paljud meetodite aluseks olevad reaktsioonid on samuti väga selektiivsed.
Näiteks teatud kompleksühendite moodustumine orgaaniliste reagentidega, ensümaatilised ja elektrokeemilised reaktsioonid. Joodi või ammooniumiioonide tuvastamiseks kasutatavad joodi ja tärklise või ammooniumi sisaldavate ainete ja leeliste vastasmõju reaktsioonid on spetsiifilised.
Keemilise analüüsi tehnikat saab muuta selektiivsemaks, muutes analüüsitingimusi (keskkonna pH, reaktiivi kontsentratsioon, lahusti jne); segavate komponentide mõju kõrvaldamine, muutes need mittereaktiivsesse vormi (maskimine) või eraldades (sadestamine, ekstraheerimine, kromatograafia) põhikomponendist. Väga selektiivse tehnika näide võib olla nikli määramine terastes gravimeetrilise meetodiga, kasutades halvasti lahustuva nikli kompleksühendi sadestamist dimetüülglüoksiimiga. Sadestamine toimub nõrgalt ammoniaagi keskkonnas; raud maskeeritakse viinhappe või sidrunhappega.
Arvestades meetodeid ja tehnikaid, tuleks nende kohta öelda mitmekülgsus - võime tuvastada või tuvastada paljusid komponente. Eriti väärtuslik on see, kui ühest proovist on võimalik tuvastada või määrata korraga palju komponente, s.t. analüüsida mitmekomponentseid süsteeme. Meetodi kõrge selektiivsus ja mitmekülgsus ei ole üksteisega vastuolus: palju universaalsed meetodid analüüse iseloomustab suur selektiivsus üksikute komponentide määramisel, näiteks sellised meetodid nagu kromatograafia, teatud tüüpi voltammeetria, aatomiemissioonspektroskoopia. Aatomiemissioonspektroskoopia meetodeid kasutades induktiivsidestatud plasma- ja kvantmeetreid kasutades saab ühest proovist (eraldamata) määrata 25-30 erinevat elementi.
Analüüsi täpsus on meetodi või tehnika kollektiivne tunnus, sealhulgas selle korrektsus ja reprodutseeritavus. Kui nad räägivad kõrge täpsusega, eeldame, et tulemused on õiged ja analüüsiandmete levik on ebaoluline. Täpsust iseloomustab sageli määramise suhteline viga (viga) protsentides.
Analüüsi täpsuse nõuded määratakse tavaliselt analüüsi eesmärgi ja eesmärkide ning objekti iseloomuga. Alati ei pea püüdlema suure täpsuse poole.
Näiteks paljude metallurgia- ja keemiatööstuse rutiinse seire käigus saab komponentide määramise läbi viia 10-15% veaga. Juhul, kui on oluline nii põhikomponendi sisu kui ka sisu täpsemalt teada kahjulikud lisandid(näiteks farmaatsia- ja Toidutööstus), ei tohiks viga olla suurem kui 0,1–1%. Pooljuhtide puhul peaks põhikomponentide määramise viga olema alla 0,1% ja võimalusel 0,01%, kuna füüsikalised omadused Nende ühendite sisaldus sõltub suuresti nende stöhhiomeetrilise koostise püsivusest.
Gravimeetrilised ja titrimeetrilised meetodid on üsna täpsed, mille viga on tavaliselt 0,05- 0,2 ja 0,1-0,5%. Kaasaegsetest meetoditest on kõige täpsem kulomeetriline, mis võimaldab määrata komponente veaga 0,001-0,01%.
Reeglina dikteerivad keemilise analüüsi täpsuse nõudeid tehnoloogid, geoloogid, arstid, füüsikud jne. Kuid analüütilistel keemikutel peaks alati olema enda arusaamühe või teise täpsuse saavutamise vajadus analüüsi läbiviimisel. Põhjendamatu kõrge määramistäpsuse nõue pikendab ja suurendab tavaliselt keemilise analüüsi maksumust. Seega, kui komponentide arvu määramise täpsus suureneb 2-lt 0,2%-le, pikeneb analüüsiaeg rohkem kui 20 korda. Liialdatud nõuded täpsusele toovad sageli kaasa vajaduse kasutada keerukaid ja kalleid seadmeid. Seega peab teadlasel olema selge peaga lähenemine enam-vähem täpse meetodi valikule, eriti masskeemilisi analüüse tehes.
Ekspress meetod. Nõue jaoks väljendusrikkus , st analüüsi kiirust esitatakse sageli analüüsimeetodi või -tehnika valikul ühe peamise nõudena. Analüüsiülesanded nõuavad mõnikord ekspressmeetodi valimist. Näiteks konverterterase sulatamisel, mis kestab 15-30 minutit, määratakse elementide sisaldus korduvalt, st iga analüüs peaks kestma vaid mõne minuti. Kirurgiliste operatsioonide tegemisel tekib mõnikord vajadus mõne minuti jooksul määrata bioloogiline kontsentratsioon patsiendi veres või kudedes. aktiivne ühend(uurea, glükoos, ravim jne).
On meetodeid, mis võimaldavad analüüsi väga kiiresti läbi viia. Seega võimaldavad kvantmeetreid kasutavad aatomiemissioonispektroskoopia meetodid määrata mõne sekundiga 15-20 elementi; Ionomeetriameetodil kasutatakse ioonselektiivseid elektroode, sh ensüümelektroode, mille reaktsiooniaeg komponendi sisaldusele on 0,5-1 min.
Tuleb märkida, et enamiku tehnikate puhul on sisuga seotud signaali mõõtmine tavaliselt üsna kiire samm. Suurem osa keemilise analüüsi ajast kulub proovi ettevalmistamisele. Seega, muu kui see võrdsed tingimused Analüüsiaja vähendamiseks tuleks valida kõige selektiivsemad meetodid, mis ei nõua proovi spetsiaalset ettevalmistamist.
Analüüsi maksumus. Analüüsimeetodi valikul on sageli suur roll, eriti seeria- ja massanalüüside, näidendite tegemisel keemilise analüüsi maksumus, mis sisaldab kasutatud seadmete, reaktiivide, analüütiku tööaja ja mõnikord ka proovi enda maksumust.
Meetodid erinevad riistvarakulude poolest. Odavaimad on titrimeetrilised, gravimeetrilised ja potentsiomeetrilised meetodid. Suurema maksumusega seadmeid kasutatakse näiteks voltammeetria, spektrofotomeetria, luminestsentsi ja aatomabsorptsiooni alal. Kõrgeim seadmete maksumus, mida kasutatakse neutronite aktiveerimise analüüsimeetodis, massispektromeetrias, NMR- ja EPR-spektroskoopias ning induktiivsidestatud plasma aatomiemissioonspektroskoopias.
Analüüsi maksumuse hindamisel võetakse arvesse ka reaktiivide maksumust ja saadavust; ühe komponendi tuvastamiseks või tuvastamiseks kulunud aeg; analüüsitava proovi mass, eriti juhtudel, kui analüüsitava objekti enda materjal on kallis (plaatinametallide sulamid ja valuplokid, kuld jne). Kui kõik muud asjaolud on võrdsed, tuleks probleemi lahendamiseks valida odavaim meetod ja analüüsitehnika.
Analüüsi automatiseerimine. Masshomogeensete analüüside tegemisel tuleks valida analüüsi automatiseerimist võimaldav meetod, mis võimaldab lihtsustada analüütiku tööd, asendades paljud käsitsi tehtavad töömahukad toimingud automaatsete toimingutega, vähendada üksikute toimingute vigu, suurendada analüüsi kiirust. analüüsida, selle maksumust vähendada, analüüsi teha distantsilt jne.
Kaasaegsetes analüüsimeetodites on tendents automatiseerimisele tõusmas. Kuigi sageli nõuab analüüsi automatiseerimine kõrged kulud, selle kasutamine on tingitud tootmise automatiseerimise protsessist üldiselt ja üha suurenevatest nõuetest toodete kvaliteedikontrollile. Lisateavet automatiseerimise kohta leiate 16. peatükist.
Muud nõuded analüüsimeetoditele. Lisaks eelpool loetletud teguritele, mida meetodi ja tehnika valikul arvesse võetakse, võivad analüüsiülesanded seada meetodile muid spetsiifilisi nõudeid.
Näiteks analüüsi läbiviimine proovi hävitamata (mittepurustav analüüs) on vajalik kunstiteoste, arheoloogiliste esemete, esemete analüüsimisel kohtuekspertiisi ja nii edasi. Sel juhul tehakse analüüs sageli röntgenfluorestsentsi ja tuumafüüsika meetoditega.
Inklusioonide, metalliplokkide mikrofaaside, geoloogiliste ja arheoloogiliste proovide keemilises analüüsis; filmide kiht-kihi analüüsi käigus; tuleb läbi viia plekkide koostise selgitamine käsikirjades, kohtuekspertiisi objektides jne. lokaalne analüüs . Selles analüüsis sisestage uus omadus meetod - ruumiline eraldusvõime , st võime eristada proovi tihedalt asetsevaid alasid. Ruumiline eraldusvõime määratakse analüüsi käigus hävinud piirkonna läbimõõdu ja sügavuse järgi. Kõrgeim ruumiline eraldusvõime kaasaegsed meetodid lokaalne analüüs, - 1 µm pinnal ja sügavusel kuni 1 nm (s.o mitu üheaatomilist kihti). Lokaalses analüüsis kasutatakse röntgenikiirgust spektraalmeetodid(elektronsondi mikroanalüsaator), aatomiemissiooni spektraalmeetodid laserergastuse abil, massispektromeetria.
Üks neist tähtsaid ülesandeid kaasaegne analüütiline keemia – juhtiv keemia analüüs distantsilt (kauganalüüs). See probleem ilmneb analüüsimisel kosmoseobjektid, maailmamere põhja uurimine, radioaktiivsete või muude inimeste tervisele kahjulike ainete analüüsimisel. Kauganalüüsi probleem lahendatakse sageli tuumafüüsika, massispektromeetria ja muude meetodite abil.
Seega suur number Tegurid, mida tuleb analüüsimeetodi ja komponentide tuvastamise või määramise optimaalse meetodi valimisel hinnata ja arvesse võtta, muudavad selle keemilise analüüsi etapi üsna keeruliseks. Mingi abi analüütik saab selle probleemi lahendada arvutisimulatsiooni abil.
2.3. Analüütiline signaal. Mõõtmine
Pärast proovi võtmist ja proovi ettevalmistamist algab keemilise analüüsi etapp, mille käigus tuvastatakse komponent või määratakse selle kogus. Sel eesmärgil nad mõõdavad analüütiline signaal. Mõnel juhul on võimalik sisu otse määrata. Näiteks gravimeetrilise meetodi puhul mõõdetakse mõnikord otse määratava komponendi, näiteks elementaarse väävli või süsiniku, massi. Enamikus meetodites
analüütiline signaal on mõõtmiste keskmine füüsiline kogus analüüsi viimases etapis, funktsionaalselt seotud määratava komponendi sisuga.
See võib olla voolutugevus, süsteemi EMF, optiline tihedus, kiirguse intensiivsus jne.
Kui on vaja mõnda komponenti tuvastada, siis see tavaliselt fikseeritakse välimus analüütiline signaal - sademe, värvi, joone ilmumine spektris jne. Analüütilise signaali ilmumine tuleb usaldusväärselt registreerida. Komponendi koguse määramisel mõõdetakse seda suurusjärk analüütiline signaal: sette mass, voolutugevus, spektrijoone intensiivsus jne. Seejärel arvutatakse komponendi sisaldus analüütilise signaali ja sisu funktsionaalsuhte abil: y=f(c), mis on paika pandud arvutuste või kogemuste põhjal ja mida saab esitada valemi, tabeli või graafiku kujul. Sisaldust võib väljendada määratud komponendi absoluuthulgana moolides, massiühikutes või vastavate kontsentratsioonide kaudu.
Analüütilise signaali mõõtmisel võetakse arvesse kasuliku analüütilise signaali olemasolu, mis sõltub määratava komponendi sisust ja analüütiline signaali taust, mis on põhjustatud määratava komponendi lisanditest ja segavatest komponentidest lahustes, lahustites ja proovimaatriksis, samuti mõõteriistades, võimendites ja muudes seadmetes tekkivast "mürast". Need mürad ei ole seotud määratava komponendiga, vaid kattuvad selle enda analüütilise signaaliga. Analüütiku ülesanne on minimeerida analüütilise taustasignaali suurust ja, mis kõige tähtsam, minimeerida selle kõikumisi. Tavaliselt võetakse sooritamisel arvesse analüütilist taustasignaali kontroll (tühi) katse, kui kõigi keemilise analüüsi etappide käigus võetakse proov, mis ei sisalda määratavat komponenti. Sel juhul on kasulik signaal analüütiline signaal, mis on võrdne mõõdetud analüütilise signaali ja analüütilise taustsignaali vahelise erinevusega.
Põhineb olemasolevast sõltuvusest Analüütilise signaali ja sisu vahelt leitakse määratava komponendi kontsentratsioon. Tavaliselt kasutatakse kalibreerimiskõverat, standardeid või aditiivseid meetodeid. Teised kirjanduses kirjeldatud meetodid komponentide sisalduse määramiseks on tavaliselt nende kolme põhimeetodi modifikatsioonid.
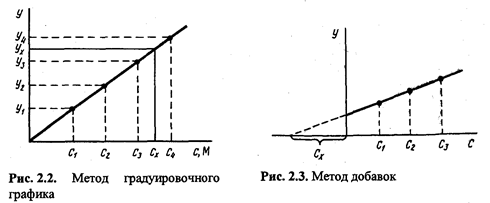
Kõige tavalisem kalibreerimiskõvera meetod. Sel juhul koostatakse koordinaatide analüütilise signaali - komponendi sisu - graafik, kasutades võrdlusnäidiseid, mille komponendi sisaldus on erinev ja täpselt teada. Seejärel, pärast analüüsitavas proovis analüütilise signaali suuruse mõõtmist, leitakse kalibreerimisgraafiku järgi (joonis 2.2) määratava komponendi sisaldus.
IN standardite meetod mõõta analüütilist signaali teadaoleva komponendisisaldusega võrdlusproovis (võrdlusproovis) ja analüüsitud proovis: selle juures = Sс korrus, Ja y x = Sc x, Kus S- proportsionaalsuskoefitsient. Kui väärtus määratakse samadel tingimustel S ette teada, siis saab arvutuse teha valemi abil koos x = y x /S. Tavaliselt kasutatakse suhet y et /U x= s fl / s x, kust
Mõnikord kasutatakse kahte võrdlusproovi, milles komponendi sisaldus erineb analüüsitavas proovis eeldatust ühel juhul vähem, teisel vähem. suur pool. Seda standardimeetodi versiooni nimetatakse mõnikord piirav lahendusmeetod. Määratava komponendi sisaldus arvutatakse valemi abil
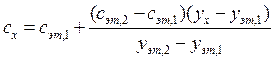
Juhtudel, kui komponendi väikeste koguste määramisel on vaja arvestada proovimaatriksi mõju analüütilise signaali väärtusele, kasutavad nad sageli aditiivne meetod - arvutus ja graafika.
Sisu määramisel arvutusmeetod võtta kaks alikvooti analüüsitud proovilahusest. Ühele neist lisatakse määratava komponendi lisand tuntud sisu. Mõlemas proovis mõõdetakse analüütilist signaali - y x Ja y x+ext. Määratava komponendi tundmatu kontsentratsioon arvutatakse valemi abil

kus V ext ja c ext on määratava komponendi lisatud lahuse maht ja kontsentratsioon; V- analüüsitud proovi alikvoot.
Komponendi sisu määramisel graafiline meetod võta n analüüsitud proovi alikvoodid: 1, 2, 3, ..., n. Alikvootides 2, 3, ..., P Teadaolevalt sisestatakse määratava komponendi suurenevad kogused. Kõigis alikvootides mõõdetakse analüütilist signaali ja analüüdi komponendi analüütilise signaali ¾sisalduse koordinaatidesse joonistatakse graafik, võttes tingimuslikuks nulliks analüüdi komponendi sisalduse ilma lisandita alikvoodis (alikvoot 1). Saadud sirge ekstrapoleerimine lõikumiskohani x-teljega annab kokkuleppelise koordinaadi nullist vasakul asuva lõigu, mille väärtus valitud skaalal ja mõõtühikutel vastab soovitud sisule (koos x-ga). komponendi määramisel (joonis 2.3).
Lineaarse kalibreerimisfunktsiooni jaoks on rakendatavad standardmeetod ja liitmismeetod. Kalibreerimisgraafiku meetod võimaldab kasutada nii lineaarseid kui ka mittelineaarseid analüütilisi signaali – sisu funktsioone. IN viimasel juhul vaja on suuremat arvu katseandmeid ja komponentide sisalduse määramise tulemus on reeglina vähem täpne.
Kalibreerimisgraafiku koostamiseks parim viis rahuldavad katseandmed, tavaliselt kasutatakse vähimruutude meetod (MNC). OLS-i põhilause ütleb, et kui iga m katsepunktid tõmbavad sirgeid jooni optimaalsele kõverale, paralleelsed teljed ordinaadid, siis optimaalse (teoreetilise) kõvera jaoks peaks punktide kõverast (d i) kõrvalekallete ruutsumma olema minimaalne, s.t.
Keemilises analüüsis kasutatakse kõige sagedamini sirgjoonelisi kalibreerimisgraafikuid, mis on konstrueeritud konkreetse konkreetse jaoks määratud sisu vahemik, st selle tehnikaga ette nähtud väärtuste vahemikus.
Sirge võrrandi saab kirjutada järgmiselt y = a + bx. Kui see on olemas m katsepunktid (x 1 y 1, x 2 y 2, ..., x m Y m), siis saame vähimruutude printsiibi postulaadi kasutades leida parameetrid A Ja b sirgjoon, mis vastab kõige paremini katseandmetele
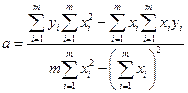

Koordinaatide alguspunkti läbiva kalibreerimisjoone jaoks y = b"x,
Pange tähele, et parameetrid A Ja b mida täpsem ja seega ka lähedasem on konstrueeritud kalibreerimisgraafik teoreetilisele, seda laiemale määratud sisuvahemikule graafik üles ehitatakse ja seda suurem on võrdlusnäidiste (standardite) arv T võeti seda ehitama.
Kõigis määramismeetodites tundmatu sisu kasutatakse komponente funktsionaalne sõltuvus y = Sx.
Tundlikkuse tegur S (mõnikord nimetatakse seda lihtsalt tundlikkuseks) iseloomustab analüütilise signaali vastust komponendi sisule. Tundlikkuse tegur - see on kalibreerimisfunktsiooni esimese tuletise väärtus antud konkreetse sisu juures. Sirgjooneliste kalibreerimisgraafikute puhul on see sirge kaldenurga puutuja (vt joonis 2.2):

Mida kõrgem on tundlikkuse tegur S, komponendi väiksemaid koguseid saab tuvastada ja määrata, saades sama analüütilise signaali. Mida kõrgem S, seda täpsemalt saab määrata üht ja sama ainekogust. Sellepärast kasutab teadlane keemilise analüüsi uue meetodi või tehnika väljatöötamisel tundlikkuse koefitsienti suurendada erinevaid tehnikaid: kontsentreerimine, seadmete täiustamine, uute reaktiivide loomine jne.
Kõigi vaadeldavate meetodite puhul kasutatakse võrdlusproove (standardeid), s.o täpselt määratud komponentide sisaldusega proove, proove, lahuseid. Etalonproove kasutavad analüüsimeetodid on nn suhtelised meetodid keemiline analüüs.
Absoluutsed (standardivabad) meetodid analüütilises keemias on vähe - näiteks gravimeetrilised meetodid, otsekulomeetria, mõned radiokeemiliste meetodite variandid.
Suhteliste analüüsimeetodite võrdlusproove saab valmistada teadaoleva koostisega keemiliselt puhastest stabiilsetest ainetest (standardained). Sel juhul arvutatakse määratava komponendi sisaldus kasutades keemiline valem standardaine. Võrdlusproove on võimalik valmistada eraldi laboris, asutuses või tööstuses, kui komponendi sisaldus on kindlaks tehtud erinevaid meetodeid, palju analüütikuid erinevate instrumentide kohta. Kõige usaldusväärsemad tulemused saadakse kasutamisel standardnäidised(СО) - spetsiaalselt valmistatud materjalid, mille koostis ja omadused on usaldusväärselt kindlaks tehtud ja ametlikult sertifitseeritud spetsiaalsete riiklike metroloogiaasutuste poolt.
Keemilise analüüsi tegemisel ei piirdu need tavaliselt sellega ühtne määratlus aga läbi viia mõned paralleelsed määratlused (tavaliselt 3-5) sama proovi jaoks samadel tingimustel. Keskmine tulemus nimetatakse paralleelmääratlusi analüüsi tulemus ja tähistatakse vrd või x keskm. Analüüsitulemuse kõrvalekallet määratava komponendi tegelikust sisaldusest (C ist, x ist) nimetatakse viga (või viga ) määratlused.
Koos komponendi tuvastamise või sisalduse määramisega on oluline hinnata saadud tulemuste ja mõõtmisvigade usaldusväärsust.
2.4 Vead keemilises analüüsis. Mõõtmistulemuste töötlemine
Vaatleme mõningaid põhilisi lähenemisviise vigade klassifitseerimiseks. Vastavalt arvutusmeetodile saab vead jagada absoluutseks ja suhteliseks.
Absoluutne viga võrdne suuruse keskmise mõõtmise vahega X ja selle koguse tegelik väärtus:
Mõnel juhul arvutage vajaduse korral üksikute määramiste vead:
D = x i - x allikas
Pange tähele, et keemilises analüüsis võib mõõdetud kogus olla kas komponendi sisu või analüütiline signaal. Olenevalt sellest, kas analüüsitulemus hindab viga üle või alahindab, võivad vead olla positiivne Ja negatiivne.
Suhteline viga saab väljendada murdude või protsentidena ja tavaliselt puudub märk:
![]()
Vigu saab liigitada nende allikate järgi. Kuna vigade allikaid on äärmiselt palju, ei saa nende klassifikatsioon olla üheselt mõistetav. Allpool käsitletakse mõningaid näiteid vigade klassifitseerimisest allika järgi.
 Kõige sagedamini klassifitseeritakse vead neid põhjustavate põhjuste olemuse järgi. Sel juhul jagatakse vead süstemaatilisteks ja juhuslikeks ning eristatakse ka möödalaskmisi (või jämedaid vigu).
Kõige sagedamini klassifitseeritakse vead neid põhjustavate põhjuste olemuse järgi. Sel juhul jagatakse vead süstemaatilisteks ja juhuslikeks ning eristatakse ka möödalaskmisi (või jämedaid vigu).
TO süstemaatiline sisaldama pidevalt tekitatavaid vigu tõhus põhjus, püsiv kõikides mõõtmetes või pidevalt muutuv kehtiv seadus, saab tuvastada ja kõrvaldada. Juhuslik vigu, mille põhjused pole teada, saab hinnata meetoditega matemaatiline statistika. Igatsema - See on analüüsi tulemust järsult moonutav ja tavaliselt kergesti tuvastatav viga, mille põhjuseks on tavaliselt analüütiku hooletus või ebakompetentsus. Joonisel fig. 2.4 esitab diagrammi, mis selgitab süstemaatiliste ja juhuslike vigade ja möödalaskmiste mõisteid. Sirge joon 1 vastab ideaaljuhule, kui kokku N Määratlustes ei ole süstemaatilisi ega juhuslikke vigu. 2. read ja 3 ka idealiseeritud keemilise analüüsi näiteid. Ühel juhul (rida 2) pole täiesti juhuslikke vigu, vaid kõik N definitsioonidel on pidev negatiivne süstemaatiline viga Dx; teisel juhul (rida 3) Süstemaatilist viga pole absoluutselt. Rida peegeldab tegelikku olukorda 4: Esineb nii juhuslikke kui ka süstemaatilisi vigu.
Vigade jagamine süstemaatiliseks ja juhuslikuks teatud määral tinglikult.
Ühe tulemuste valimi süstemaatilised vead kaalumisel rohkem andmed võivad muutuda juhuslikeks. Näiteks süstemaatiline viga, mis on põhjustatud instrumendi valedest näidudest, muutub erinevates laborites erinevatel instrumentidel analüütilise signaali mõõtmisel juhuslikuks veaks. Enne süstemaatiliste ja juhuslike vigade põhjalikumat käsitlemist vaatleme mõisteid - reprodutseeritavus Ja õige.
Reprodutseeritavus iseloomustab üksikute definitsioonide lähedusastet üksteisele, üksikute tulemuste hajumist keskmise suhtes (joon. 2.5).
Joon.2.5. Keemilise analüüsi reprodutseeritavus ja täpsus
Mõnel juhul kasutatakse seda terminit koos terminiga "reprodutseeritavus". "konvergents". Konvergentsi all peame antud juhul silmas paralleelmääramiste tulemuste hajumist ja reprodutseeritavuse all erinevate meetoditega erinevates laborites saadud tulemuste hajumist, erinev aeg ja nii edasi.
Õige- see on keemilise analüüsi kvaliteet, mis peegeldab süstemaatilise vea nullilähedust. Korrektsus iseloomustab saadud analüüsitulemuse hälvet mõõdetud väärtuse tegelikust väärtusest (vt joonis 2.5).
2.4.1. Süstemaatilised vead
Üks süstemaatiliste vigade peamisi märke on see, et vea põhjuseks on püsiv põhjus.
Sageli on süstemaatiliste ja juhuslike vigade allikad samad, vaatleme mõnda neist süstemaatiliste vigade näitel.
Meetodi vead, või instrumentaalsed vead, seotud meetodi ja eelkõige analüütilise signaali mõõtmise instrumendiga. Lihtsaim näide seda tüüpi vigadest on analüütiliste kaalude kaalumisviga, mis põhjustab gravimeetrilises analüüsimeetodis süstemaatilise vea.
Seega, kui kaalumisviga on ±0,2 mg, on gravimeetrilise määramise minimaalne suhteline viga (prooviga 1 g) 0,02%. Analüütiliste instrumentide (spektrofotomeetrid, ionomeerid, polarograafid, kromatograafid jne) perioodiline testimine minimeerib instrumentaalvigade süstemaatilise komponendi. Kuna enamikus analüüsimeetodites kasutatakse võrdlusproove, hõlmavad meetodi vead sageli võrdlusproovides, eelkõige standardproovides esinevaid vigu, mis on põhjustatud neis sisalduva komponendi tegeliku ja nominaalse sisalduse lahknevusest, kogusumma erinevusest. keemiline koostis ning analüüsitava proovi ja võrdlusproovi struktuur. Instrumentaalne viga moodustab tavaliselt vaid väikese osa keemilise analüüsi tulemuse koguveast.
Peamine panus üldisesse veasse pärineb metoodilised vead, määratakse kindlaks määramismeetodiga.
Metoodiliste vigade hulka kuuluvad vead proovivõtmisel, proovi muutmisel analüüsiks mugavaks vormiks (lahustumine, sulatamine, paagutamine, pürolüüs), vead kontsentreerimisel ja komponentide eraldamisel.
Eriti tähelepanuväärsed on loodusega seotud vead. keemiline reaktsioon, mis on komponendi tuvastamise või tuvastamise meetodi aluseks.
Seega põhjustavad gravimeetrias selliseid vigu sadestunud vormi, kuigi väike, kuid märgatav lahustuvus, koossadestamisprotsessid, kõrvalekalded gravimeetrilise vormi rangelt stöhhiomeetrilisest koostisest jne. Titrimeetria puhul on tüüpiline metoodiline viga indikaatori viga, mis tekib sellest, et valitud Tiitrimiseks reageerib indikaator tiitrimisega kas veidi varem või veidi hiljem kui ekvivalentpunkti jõudmine.
Kõik kasutatavad reaktiivid, sealhulgas vesi ja muud lahustid, ei saa olla absoluutselt puhtad, vaid sisaldavad teatud koguses määramist segavaid lisandeid, sealhulgas sageli ka määratavate komponentide lisandeid. See on nn reaktiivne viga. Seda tüüpi, justkui väljastpoolt sisse toodud vigade hulka kuuluvad ka õhusaaste, tööruumide õhu jms põhjustatud vead.

Joon.2.6. Valimi suuruse muutmise meetod:
1 - lineaarselt muutuv viga; 2 - tegelik väärtus; 3- pidev viga
Üks peamisi süstemaatilise vea tunnuseid on see konstantne kõigis mõõtmetes või muutudes vastavalt pidevalt toimivale seadusele. Tuleb märkida, et absoluutsed süstemaatilised vead jagunevad sõltumatuteks ja sõltuvateks määratava komponendi sisaldusest, st konstantseteks (liituv) ja proportsionaalseteks (kordistav). Pidevate vigade hulka kuuluvad näiteks tilga- ja teatud tüüpi indikaatorivead titrimeetrias, kaalumisvead gravimeetrias; proportsionaalseks - teatud tüüpi vead, mis on põhjustatud segavate lisandite panusest määratava komponendi analüütilisse signaali. Joonisel fig. 2.6 illustreerib komponendi sisalduse määramise õigsuse muutumist koos analüüsitava proovi massi suurenemisega konstantse ja lineaarselt muutuva vea olemasolul. Analüüsitava aine proovi massi suurenemisel püsiva süstemaatilise vea olemasolul suhtelise vea suurus väheneb (kõver 3), ja lineaarselt muutuva süstemaatilise vea korral jääb suhteline viga konstantseks (kõver 1).
Keemilise analüüsi tulemuste töötlemisel tuleb süstemaatilised vead tuvastada ja kõrvaldada või vähemalt hinnata. Üks viise süstemaatilise vea tuvastamiseks (õigsuse kontrollimine) on varieeruv valimi suurus. Kahekordistades (kahekordistades) või suurendades valimi suurust mitmekordselt, saab kindlaksmääratud komponendi leitud sisalduse muutmisega tuvastada konstantse süstemaatilise vea (vt joonis 2.6).
On ka viis "tutvustas -leitud" , millal täpselt teadaolev kogus määratud komponent. Komponent tuleb lisada samal kujul, nagu see on analüüsitavas objektis, ja viia läbi analüüsi kõik etapid. Sel juhul võib komponendi sisestada proovimaatriksisse, mis ei sisalda määratavat komponenti, või lisada proovile, mis sisaldab täpselt määratud kogust komponenti. Kui analüüsi viimases etapis määratakse komponendi sisestatud kogus piisava täpsusega, loetakse analüüsi tulemus õigeks.
Teine võimalus täpsust kontrollida on analüüsi tulemuse võrdlemine teise poolt saadud tulemusega sõltumatu meetod. Samas peab keemik olema kindel, et võrdluseks valitud meetod (metoodika) annab õige tulemuse ja on tõeliselt sõltumatu, st komponendi määramine toimub erinevatel põhimõtetel. Näiteks komponendi määramise õigsuse kontrollimisel spektrofotomeetrilise meetodiga on soovitav kasutada võrdluseks kromatograafilist, polarograafilist või potentsiomeetrilist meetodit, mitte aga spektrofotomeetrilist meetodit, kus kasutatakse teist reaktiivi.
Üldtunnustatud meetod korrektsuse hindamiseks on standardproovi analüüs. See on kõige rohkem usaldusväärne viis süstemaatiliste vigade tuvastamine, analüüsimeetodi õigsuse tõendamine, analüüsitehnika, analüütilise signaali mõõtmise instrument. Standardproovid valmistatakse materjalist, mille koostis ja omadused on usaldusväärselt kindlaks tehtud ja ametlikult sertifitseeritud. Tavaliselt analüüsitakse standardproove (ühe või mitme komponendi puhul) paljude meetoditega mitmes laboris, mistõttu võib proovi koostise tunnistusel märgitud komponentide sisaldust võtta tõeliseks väärtuseks. Standardproovi keemilises analüüsis kasutamise vältimatu tingimus on standardproovi ja analüüsitava proovi koostise ja omaduste maksimaalne sarnasus. Standardproovi kasutamisel meetodi või protseduuri õigsuse hindamiseks tehakse proovi mitu keemilist analüüsi ning leitud sisaldust võrreldakse määratava komponendi tegeliku (sertifitseeritud) sisaldusega.
Meetodi või tehnika õigsuse hindamine tuleks läbi viia mitme puhul erinevat sisu määratud komponenti, st kasutades kahte või enamat standardproovi. Standardproove ei kasutata mitte ainult õigsuse kontrollimiseks lõpptulemus komponendi määramisel, aga ka keemilise analüüsi üksikutel etappidel, et tuvastada süstemaatilisi vigu. Näiteks kasutatakse standardproove sageli proovivõtu ja proovi ettevalmistamise vigade, süstemaatiliste instrumentaalvigade tuvastamiseks analüütilise signaali mõõtmise etapis.
Hetkel valmistatakse ette riiklikud standardproovid (I kategooria proovid) metallidele, sulamitele, toodetele ja vaheainetele keemiatööstus, ravimid jne. Eriti keeruline on valmistada standardproove komplekssetest (mitmekomponentsetest, mitmefaasilistest, ajaliselt ebastabiilsetest) ainetest: maagid, kivid, toiduained, biomass, keskkonnaobjektid. Sellistel juhtudel valmistatakse võrdlusmaterjalid reaalsetest objektidest, tehes korduvaid keerulisi keemilisi analüüse asutustes, tööstusharudes ja isegi riikides (luues rahvusvahelisi võrdlusmaterjale).
Mitmete probleemide lahendamiseks, sealhulgas õigsuse kontrollimiseks, kasutatakse teatud tööstusharudes loodud 2. kategooria standardnäidiseid. Rahvamajandus, teadus- ja tootmisorganisatsioonid, eraldi laborid.
Analüütilised keemikud kasutavad mõnikord täpsuse kontrollimiseks kombineeritud või sünteesitud segusid usaldusväärselt analüüsitud kemikaalidest.
Standardproove ei kasutata mitte ainult süstemaatiliste vigade tuvastamiseks ja täpsuse kontrollimiseks, vaid ka võrdlusproovidena erinevatel viisidel teadmata komponentide sisalduse määramine.
Võrdlusmaterjalide roll analüütilises keemias suureneb. Selle põhjuseks on uute analüüsimeetodite väljatöötamine, analüüsitavate objektide ringi laienemine, komponentide tuvastamise ja määramise meetodite keerukus, üha enam kõrged nõuded keemilise analüüsi õigsusele.
Kui eelarvamus on tuvastatud, tuleb seda hinnata ja parandada. Pange tähele, et süstemaatilise vea numbrilist hindamist saab läbi viia ainult veaga, mis on piiratud analüüsi juhuslike vigadega. Süsteemsete vigade hindamisel saab jämedalt eristada kolme tüüpi vigu.
Esimesele tüübile viidata teadaoleva iseloomuga vigadele, mida saab enne komponendi määramist eelnevalt välja arvutada ja asjakohase paranduse sisseviimisega arvesse võtta. Sellised vead on näiteks indikaatorivead ja mahu mõõtmise vead titrimeetrias, kaalumisvead gravimeetrilises analüüsimeetodis (vt 9. peatükk).
Teise tüübi juurde võib omistada teadaoleva iseloomuga vigadele, mille väärtusi saab hinnata keemilise analüüsi käigus või spetsiaalse katse tegemisel. Nende hulka kuuluvad instrumentaalsed, reaktiivsed vead, vead keemilise analüüsi üksikutes etappides - metoodilised vead. Kui uurija oskab hinnata üksikute etappide ja operatsioonide vigu, siis vastavalt vigade liitmise seadusele saab ta välja arvutada analüüsitulemuse üldvea. Tabelis 2.1 näitab absoluutse ja arvutusi suhtelised vead mõned funktsioonid.
Süsteemsete vigade arvutamisel tuleb eristada kahte olulist juhtumit.
a) Kui on teada nii üksikute komponentide vigade suurused kui ka märgid, siis arvutatakse koguviga veerus toodud valemite abil A laud 2.1. Koguvea väärtus saadakse kindla märgiga.
b) Kui on teada ainult üksikute etappide maksimaalsed võimalikud vead (see võrdub tõsiasjaga, et teada on ainult absoluutväärtused, kuid mitte nende vigade tunnused), tehakse arvutus vastavalt jaotises näidatud valemitele. veerg b laud 2.1. Sel juhul on ka arvutustulemus absoluutväärtus totaalne viga. relativiseerimine(inglise keelest - suhteline), kui identsetel tingimustel tehakse üksikuid analüütilisi toiminguid nii, et süstemaatilised vead tasandatakse. Seega võetakse titrimeetris standard- ja analüüsitud lahuste alikvoodid samade pipettide abil gravimeetria puhul, tühi tiigel ja settega tiigel kaalutakse samadel kaaludel, samade kaaludega jne. Üks vigade relativiseerimise meetoditest; teostab kontrolli kogemus(vt lõik 2.3). Sel juhul tasandatakse reaktiivide, vee ja riistade saastumisest tingitud vead; vead proovi ettevalmistamise etapis jne.
Kolmanda tüübi juurde viitavad tundmatu iseloomuga vigadele, mille väärtused on teadmata. Neid vigu on raske tuvastada ja kõrvaldada. Neid saab tuvastada alles pärast muude süstemaatiliste vigade kõrvaldamist ja järgnevat analüüsi kõigi etappide, toimingute ja tingimuste hoolikat uurimist. Tavaliselt kasutatakse sellistel juhtudel tehnikat randomiseerimine (inglise keelest random - juhuslikult) - süstemaatiliste vigade ülekandmine juhuslike kategooriasse. Randomiseerimise võimalus põhineb asjaolul, et ühe nähtuse (meetodi, seadme, analüüsi teostaja) süstemaatiline viga, kui seda vaadelda laiemas sarnaste nähtuste klassis (meetodite rühm, seadmete seeria, analüütikute meeskond) muutub muutuvaks väärtuseks, st omandab juhusliku vea tunnused ja seda hinnatakse matemaatilise statistika meetoditega.
2.4.2. Juhuslikud vead
Keemilise analüüsi tulemuste matemaatilise statistika meetoditega töötlemise alguseks tuleb süstemaatilised vead tuvastada ja kõrvaldada või viia juhuslikkuse kategooriasse. Veelgi enam, analüüsiandmed on teatud tõenäosusjaotusega juhuslikud muutujad. Enne juhuslike vigade hindamise kaalumist peatume kahel kontseptsioonil: elanikkonnast - kõigi mõeldavate tulemuste hüpoteetiline kogum vahemikus -∞ kuni +∞; näidispopulatsioon (proov) - reaalarv ( n ) tulemused, mis teadlasel on.
Keemilise analüüsi tulemuste kogu all mõistetakse kõiki mõeldavaid tulemusi, mida on võimalik saada sama objekti analüüsist erinevaid meetodeid, erinevatel instrumentidel, erinevate analüütikute poolt. Tavaliselt on sama objekti analüüsimisel meil 3-7 tulemust (valimispopulatsioon). Küsimus parameetrite läheduse kohta näidispopulatsioonüldkogumi parameetritele seostatakse valimi suuruse ja juhuslike muutujate jaotusfunktsiooniga. Reeglina võime n>20-30 piisava usaldusväärsusega ja n>50-100 hea lähendusega keemilise analüüsi tulemuste puhul eeldada, et valim esindab üldkogumit.
Analüütiku üheks peamiseks ülesandeks keemilise analüüsi juhuslike vigade hindamisel on leida katseandmeid kirjeldav jaotusfunktsioon. Matemaatilisest statistikast järeldub, et juhuslik väärtus loetakse antud, kui selle jaotusfunktsioon on teada. Seda funktsiooni saab esitada graafiliselt, algebralise seose või tabeli kujul. Kasutatakse juhusliku suuruse integraal- ja diferentsiaaljaotuse funktsioone. Integraalfunktsioon F(x) – tõenäosus, et juhuslik suurus X võtab mis tahes väärtuse vähem kui mõni antud väärtus V:
Diferentsiaalfunktsioon juhusliku muutuja jaotus (j(x) või tõenäosustihedus, määratakse seosega
![]()
kus Dх = x b – x a. Seega on tõenäosustihedus integraalfunktsiooni tuletis F(x).
Arvukad uuringud on näidanud, et enamik andmeid analüütilised määratlused kui on olemas üldine keemilise analüüsi tulemuste kogum, siis nende suhtes kohaldatakse seadus normaaljaotus (Gaussi jaotus). Tõenäosuse tihedus tavaline seadus levitamisel on vorm

kus m ja s 2 - oodatud väärtus ja dispersioon (konstantsed parameetrid).
Oodatud väärtus (tõsi) m pideva juhusliku suuruse korral on antud integraaliga


See tähistab piiri, milleni keskmine kipub X valimi suuruse piiramatu suurenemisega. Seega on matemaatiline ootus justkui rahvastiku kui terviku keskmine väärtus, mistõttu seda mõnikord nimetatakse ka üldkeskmiseks. Süstemaatiliste vigade puudumisel on matemaatiline ootus m võrdne tegeliku väärtusega x allikas
Dispersioon s 2 iseloomustab juhusliku suuruse hajumist m suhtes ja on defineeritud kui ruuduhälvete matemaatiline ootus X alates m :

Positiivne ruutjuure dispersioon A helistas standardhälve ja seda kasutatakse ka juhusliku suuruse hajumise iseloomustamiseks X rahvaarvus m .
Graafiline pilt juhusliku suuruse normaaljaotus X näidatud joonisel fig. 2.7. Kellakujuliste kõverate tüüp, sümmeetriline vertikaalne joon läbides m , sõltub dispersiooni suurusest ja seega ka standardhälbest. Rohkem standardhälve, seda lamedamaks kõver muutub.
Keemilise analüüsi andmete töötlemisel kasutatakse tavaliselt normaaljaotuse normaliseeritud seadust, mis saadakse väärtuselt x liikumisel väärtusele
Kuna antud juhul u= 0 ja s 2 = 1, siis teisendatakse avaldis (2.1) järgmiseks

Sagedamini kasutatakse kumulatiivset normaliseeritud normaaljaotuse funktsiooni

Mitme keemilise analüüsi tulemuste ja nendega kaasnevate juhuslike vigade töötlemisel on tavaks anda kaks statistilist parameetrit - laius usaldusvahemik, mille sees võivad tulemused olla individuaalsed analüüsid, ja usalduse tõenäosus, et need jäävad sellesse intervalli. Integraaljaotusfunktsiooni (2.2) väärtused on toodud tabelites, mille abil saate leida tõenäosuse, millega väärtus u ei ületa seatud väärtus. Andmete statistilisel töötlemisel kasutatakse sagedamini integraali tabeliväärtusi

mida nimetatakse normaliseeritud Laplace'i funktsiooniks. Tabelis 2.2 on antud usalduse tõenäosused ainult positiivsed väärtused sina, kuna normaliseeritud normaaljaotus on sümmeetriline. Et leida usaldustõenäosust, et juhuslik suurus (juhuslik viga) langeb etteantud intervallisse, tuleks tabelis esitatud tõenäosusväärtused kahekordistada. Niisiis, kasutades tabelit. 2.2, saab näidata, et kui juhuslik viga mitme keemilise analüüsi käigus (keemiaanalüüsi tulemuste kogusumma!) ei ületa ±s, ±2s Ja ±3 s, siis usaldustõenäosused on 0,6826 (0,3413 2); 0,9544 (0,4772 2) ja 0,9973 (0,49865 2). Kuna , on vaadeldavad intervallid vastavalt u=±1, u=±2 ja u=±3.
Tabel 2.2. Laplace'i funktsiooni väärtused
Keemilise analüüsi tulemuste töötlemiseks kasutatakse normaaljaotuse seadust ainult siis, kui andmeid on palju (n>50). Keemilise analüüsi andmed järgivad tavaliselt normaaljaotust. Siiski tuleb olla ettevaatlik radiokeemiliste või bioloogilised meetodid ja suhteliselt heterogeensete proovide analüüsimisel. Kui tekib kahtlus normaaljaotuse seaduse kohaldamise seaduslikkuses, siis tuleks kasutada erinevaid lõigus kirjeldatud seadusi. erialakirjandus viisid, kuidas teha kindlaks, et keemilise analüüsi tulemused jagunevad täpselt vastavalt
Otsus sellise märkmiku hooldamise vajaduse kohta ei tulnud kohe, vaid järk-järgult, töökogemuse kogunedes.
Alguses oli see koht lõpus töövihik– mitu lehekülge olulisemate määratluste salvestamiseks. Siis pandi sinna tähtsamad lauad. Siis jõudis arusaam, et enamik õpilasi vajab ülesannete lahendamise õppimiseks rangeid algoritmilisi juhiseid, mida nad ennekõike peavad mõistma ja meeles pidama.
Siis tuligi otsus hoida lisaks töövihikule veel üks kohustuslik keemia vihik - keemiasõnastik. Erinevalt töövihikutest, mida võib olla isegi kaks ühes õppeaastal, sõnastik on üks märkmik kogu keemiakursuse jaoks. Parim on, kui sellel sülearvutil on 48 lehte ja vastupidav kaas.
Korraldame selle märkmiku materjali järgmiselt: alguses - olulisemad määratlused, mille lapsed kopeerivad õpikust või kirjutavad üles õpetaja dikteerimisel. Näiteks 8. klassi esimeses tunnis on see aine "keemia" määratlus, mõiste "keemilised reaktsioonid". 8. klassis koguneb neid õppeaasta jooksul üle kolmekümne. Mõnes õppetükis viin läbi nende määratluste kohta küsitlusi. Näiteks, suuline küsimus mööda ketti, kui üks õpilane esitab teisele küsimuse, kui ta vastas õigesti, tähendab see, et ta esitab juba järgmise küsimuse; või kui ühele õpilasele esitavad küsimused teised õpilased, kui ta ei oska vastata, vastavad nad ise. Orgaanilises keemias on need peamiselt klassimääratlused orgaaniline aine ja peamised mõisted, näiteks "homoloogid", "isomeerid" jne.
Meie lõpus teatmeteos Materjal on esitatud tabelite ja diagrammide kujul. Viimasel lehel on kõige esimene tabel “Keemilised elemendid. Keemilised märgid" Seejärel tabelid “Valents”, “Happed”, “Indikaatorid”, “Metalli pingete elektrokeemilised seeriad”, “Elektronegatiivsuse jada”.
Eriti tahan peatuda tabeli “Hapete vastavus happeoksiididele” sisul:
| Hapete ja happeoksiidide vastavus | ||||
| Happe oksiid | Hape | |||
| Nimi | Valem | Nimi | Valem | Happejääk, valents |
| süsinik(II)monooksiid | CO2 | kivisüsi | H2CO3 | CO3(II) |
| väävel(IV)oksiid | SO 2 | väävlis | H2SO3 | SO3(II) |
| väävel(VI)oksiid | SO 3 | väävelhape | H2SO4 | SO 4 (II) |
| räni(IV)oksiid | SiO2 | räni | H2SiO3 | SiO3(II) |
| lämmastikoksiid (V) | N2O5 | lämmastik | HNO3 | NO3 (I) |
| fosfor(V)oksiid | P2O5 | fosforit | H3PO4 | PO 4 (III) |
Ilma seda tabelit mõistmata ja pähe õppimata muutub 8. klassi õpilastel reaktsioonivõrrandite koostamine keeruliseks happelised oksiidid leelistega.
Elektrolüütilise dissotsiatsiooni teooriat uurides paneme vihiku lõppu kirja diagrammid ja reeglid.
Ioonvõrrandite koostamise reeglid:
1. Vees lahustuvate tugevate elektrolüütide valemid on kirjutatud ioonidena.
2. Kirjutage lihtsate ainete, oksiidide valemid, nõrgad elektrolüüdid ja kõik lahustumatud ained.
3. Halvasti lahustuvate ainete valemid võrrandi vasakul küljel on kirjutatud ioonsel kujul, paremal - molekulaarsel kujul.
Õppides orgaaniline keemia Kirjutame sõnastikku süsivesinike üldtabelid, hapnikku ja lämmastikku sisaldavate ainete klassid, skeemid geneetiliste seoste kohta.
| Füüsikalised kogused | |||
| Määramine | Nimi | Ühikud | Valemid |
| aine kogus | sünnimärk | = N/NA; = m/M; V / V m (gaaside jaoks) |
|
| N A | Avogadro konstant | molekulid, aatomid ja muud osakesed | NA = 6,02 10 23 |
| N | osakeste arv | molekulid, aatomid ja muud osakesed |
N = N A |
| M | molaarmass | g/mol, kg/kmol | M = m/; /M/ = M r |
| m | kaal | g, kg | m = M; m = V |
| Vm | molaarne maht gaas | l/mol, m 3/kmol | Vm = 22,4 l / mol = 22,4 m 3 / kmol |
| V | maht | l, m 3 | V = V m (gaaside puhul); |
| tihedus | g/ml; | =m/V; M / V m (gaaside jaoks) |
|
üle 25- suveperiood keemia õpetamine koolis, millega pidin tegelema erinevaid programme ja õpikud. Samas oli alati üllatav, et praktiliselt ükski õpik ei õpeta ülesandeid lahendama. Keemia õppimise alguses koostame õpilastega teadmiste süstematiseerimiseks ja kinnistamiseks sõnaraamatusse tabeli “Füüsikalised suurused” uute suurustega:
Õpetades õpilastele, kuidas lahendada arvutusprobleemid Pean algoritmidele suurt tähtsust. Usun, et tegevuste järjestuse ranged juhised võimaldavad nõrgal õpilasel mõista teatud tüüpi probleemide lahendamist. Sest tugevad õpilased- see on võimalus jõuda oma tuleviku loomingulisele tasemele keemiaharidus ja eneseharimine, kuna kõigepealt peate enesekindlalt valdama suhteliselt väikese arvu standardtehnikaid. Selle põhjal oskus neid õigesti rakendada erinevates lahendamise etappides rohkem keerulised ülesanded. Seetõttu olen koostanud igat tüüpi ülesannete arvutusülesannete lahendamise algoritmid. koolikursus ja kooliväliste tegevuste jaoks.
Toon neist mõned näited.
Algoritm ülesannete lahendamiseks keemiliste võrrandite abil.
1. Kirjutage lühidalt üles ülesande tingimused ja koostage keemiline võrrand.
2. Kirjutage ülesande andmed keemilise võrrandi valemite kohale ja moolide arv valemite alla (määratud koefitsiendiga).
3. Leidke valemite abil aine kogus, mille mass või maht on antud ülesandepüstituses:
M/M; = V / V m (gaaside puhul V m = 22,4 l / mol).
Kirjutage saadud arv võrrandisse valemi kohale.
4. Leidke aine kogus, mille mass või maht on teadmata. Selleks arutlege võrrandi järgi: võrrelge seisundile vastavat moolide arvu võrrandi järgi. Vajadusel tehke proportsioon.
5. Leidke mass või maht valemite abil: m = M; V = Vm.
See algoritm on aluseks, mida õpilane peab valdama, et ta saaks tulevikus lahendada ülesandeid erinevate komplikatsioonidega võrrandite abil.
Probleemid liigse ja defitsiidiga.
Kui probleemtingimustes on korraga teada kahe reageeriva aine kogused, massid või mahud, siis on tegemist liig- ja defitsiidi probleemiga.
Selle lahendamisel:
1. Peate leidma kahe reageeriva aine kogused, kasutades valemeid:
M/M; = V/V m.
2. Kirjutage saadud moolide arvud võrrandi kohale. Võrreldes neid võrrandi järgi moolide arvuga, tehke järeldus, milline aine on antud defitsiidis.
3. Puuduse põhjal teha edasised arvutused.
Probleemid teoreetiliselt võimalikust praktiliselt saadud reaktsioonisaaduse saagise murdosaga.
Reaktsioonivõrrandite abil tehakse teoreetilised arvutused ja leitakse reaktsiooniprodukti teoreetilised andmed: teoor. , m teoor. või V teooria. . Reaktsioonide läbiviimisel laboris või tööstuses tekivad kadud, seega on saadud praktilised andmed praktilised. ,
m tava. või V praktiline. alati vähem kui teoreetiliselt arvutatud andmed. Tootlusosa tähistatakse tähega (eta) ja arvutatakse järgmiste valemite abil:
(see) = praktiline. / teooria = m harjutada. / m teoor. = V praktiline / V teoor.
Seda väljendatakse ühiku murdosa või protsendina. Eristada saab kolme tüüpi ülesandeid:
Kui ülesandepüstituses on lähteaine andmed ja reaktsioonisaaduse saagise osa teada, siis tuleb leida praktiline lahendus. , m praktiline või V praktiline. reaktsiooniprodukt.
Lahenduse protseduur:
1. Viige lähteaine andmete põhjal läbi võrrandi abil arvutus, leidke teooria. , m teoor. või V teooria. reaktsiooniprodukt;
2. Leidke valemite abil praktiliselt saadud reaktsioonisaaduse mass või maht:
m tava. = m teoreetiline ; V praktiline = V teooria. ; praktiline = teoreetiline .
Kui ülesandepüstituses on lähteaine ja praktika andmed teada. , m praktiline või V praktiline. saadud produkti ja peate leidma reaktsioonisaaduse saagise fraktsiooni.
Lahenduse protseduur:
1. Arvutage lähteaine andmetel põhineva võrrandi abil, leidke
Theor. , m teoor. või V teooria. reaktsiooniprodukt.
2. Leidke reaktsioonisaaduse saagise osa valemite abil:
Harjuta. / teooria = m harjutada. / m teoor. = V praktiline /V teooria.
Kui probleemtingimustes on teada praktilised tingimused. , m praktiline või V praktiline. saadud reaktsioonisaadus ja selle saagisosa, samal ajal kui peate leidma andmed lähteaine kohta.
Lahenduse protseduur:
1. Leia teooria, m teooria. või V teooria. reaktsiooniprodukt vastavalt valemitele:
Theor. = praktiline / ; m teoor. = m harjutada. / ; V teoor. = V praktiline / .
2. Soorita arvutused teoorial põhineva võrrandi abil. , m teoor. või V teooria. reaktsiooni korrutis ja leida lähteaine andmed.
Loomulikult käsitleme neid kolme tüüpi probleeme järk-järgult, harjutades nende lahendamise oskusi mitme probleemi näitel.
Probleemid segude ja lisanditega.

Puhas aine on see, mida on segus rohkem, ülejäänud on lisandid. Nimetused: segu mass – m cm, mass puhas aine– m p.h., lisandite mass – m u. , puhta aine massiosa - p.h.
Puhta aine massiosa leitakse järgmise valemi abil: p.h. = m h.v. / m cm, seda väljendatakse ühe murdosades või protsentides. Eristame 2 tüüpi ülesandeid.
Kui ülesande püstitus annab puhta aine massiosa või lisandite massiosa, siis on antud segu mass. Sõna “tehniline” tähendab ka segu olemasolu.
Lahenduse protseduur:
1. Leidke puhta aine mass valemiga: m h.v. = h.v. m cm
Kui on antud lisandite massiosa, siis tuleb esmalt leida puhta aine massiosa: p.h. = 1 - u.
2. Puhta aine massi põhjal tehke võrrandi abil edasised arvutused.
Kui ülesande püstitus annab algsegu massi ja reaktsioonisaaduse massi n, m või V, siis tuleb leida lähtesegus oleva puhta aine massiosa või selles sisalduvate lisandite massiosa.
Lahenduse protseduur:
1. Arvutage reaktsioonisaaduse andmetel põhineva võrrandi abil ja leidke n p.v. ja m h.v.
2. Leidke segus oleva puhta aine massiosa valemiga: p.h. = m h.v. / m lisandite näha ja massiosa: u. = 1 - h.v
Seadus mahulised suhted gaasid
Gaaside mahud on seotud samamoodi nagu nende ainete kogused:
V 1/V 2 = 1/2
Seda seadust kasutatakse ülesannete lahendamisel võrrandite abil, milles on antud gaasi ruumala ja peate leidma teise gaasi ruumala.
Gaasi mahuosa segus.
Vg / Vcm, kus (phi) on gaasi mahuosa.
Vg – gaasi maht, Vcm – gaasisegu maht.
Kui ülesande püstituses on antud gaasi mahuosa ja segu maht, siis tuleb kõigepealt leida gaasi maht: Vg = Vcm.
Gaasisegu maht leitakse valemiga: Vcm = Vg /.
Aine põlemisel kulutatud õhu maht leitakse võrrandiga leitud hapniku mahu kaudu:
Vair = V(O2) / 0,21
Orgaaniliste ainete valemite tuletamine üldvalemite abil.
Orgaanilised ained moodustavad homoloogseid seeriaid, millel on üldvalemid. See võimaldab:
1. Väljendage suhteline molekulmass arvuga n.
Mr (Cn H 2n + 2) = 12 n + 1 (2n + 2) = 14n + 2.
2. Võrdsusta n kaudu väljendatud M r tõelise M r-ga ja leia n.
3. Koostage reaktsioonivõrrandid üldine vaade ja teha nende põhjal arvutusi.
Põlemissaadustel põhinevate ainete valemite tuletamine.
1. Analüüsida põlemissaaduste koostist ja teha järeldus selle kohta kvaliteetne koostis põlenud aine: H 2 O -> H, CO 2 -> C, SO 2 -> S, P 2 O 5 -> P, Na 2 CO 3 -> Na, C.
Hapniku olemasolu aines vajab kontrollimist. Tähistage valemis olevaid indekseid x, y, z-ga. Näiteks CxHyOz (?).
2. Leidke ainete hulk põlemisproduktides, kasutades valemeid:
n = m/M ja n = V/Vm.
3. Leidke põletatud aines sisalduvate elementide kogused. Näiteks:
Teisendage arvud täisarvudeks, jagades need väikseimaga.
Kirjutage õige valem.
Ainete valemite tuletamine elementide massiosade põhjal.
1. Kirjutage valem, märkides indeksid x, y, z.
2. Leidke selleks indeksite suhe, jagage iga elemendi massiosa selle aatommassiga: x: y: z = 1 / Ar 1: 2 / Ar 2: 3 / Ar 3.
3. Tahandage saadud arvud täisarvudeks, jagades need neist väikseimaga. Vajadusel korrutage pärast jagamist 2, 3, 4, 5-ga.
See lahendusmeetod määrab lihtsaima valemi. Enamiku anorgaaniliste ainete puhul langeb see kokku tõelisega, orgaaniliste ainete puhul vastupidi.
Ainete valemite tuletamine elementide massiosade põhjal, kui on teada andmed aine molaarmassi leidmiseks.
Leidke aine molaarmass järgmiste valemite abil:
a) kui gaasi tihedus on teada: M = Vm = g / l 22,4 l / mol; r = m/V.
b) kui on teada suhteline tihedus: M 1 = D 2 M 2, M = D H2 2, M = D O2 32,
M = D õhk 29, M = D N2 28 jne.
1. meetod: leidke kõige lihtsam valem ained (vt eelmist algoritmi) ja kõige lihtsam molaarmass. Seejärel võrrelge tegelikku molaarmassi kõige lihtsamaga ja suurendage valemis olevaid indekseid vajaliku arvu kordi.
2. meetod: leidke indeksid valemiga n = (e) Mr / Ar(e).
Kui ühe elemendi massiosa pole teada, tuleb see leida. Selleks lahutage 100% või ühtsusest teise elemendi massiosa.
Järk-järgult kogunevad keemia õppimise käigus keemiasõnastikku probleemide lahendamise algoritmid erinevad tüübid. Ja õpilane teab alati, kust leida vajalik valem või probleemi lahendamiseks vajalikku teavet.
Paljudele õpilastele meeldib sellist märkmikku pidada, nad ise täiendavad seda erinevate teatmematerjalidega.
Mis puudutab klassivälist tegevust, siis on meil õpilastega ka eraldi vihik, kuhu kirjutada algoritme, mille abil lahendada probleeme, mis ulatuvad kaugemale. kooli õppekava. Samasse vihikusse kirjutame iga ülesandetüübi kohta 1-2 näidet, mis lahendavad ülejäänud ülesanded teises märkmikus. Ja kui järele mõelda, siis kõigi ülikoolide keemiaeksamil esinevate tuhandete erinevate ülesannete hulgast saate tuvastada 25-30 erinevat tüüpi ülesannet. Muidugi on nende hulgas palju variatsioone.
Valikainete klasside ülesannete lahendamise algoritmide väljatöötamisel aitas mind palju A.A käsiraamat. Kušnareva. (Keemia ülesandeid lahendama õppimine, - M., Kool - ajakirjandus, 1996).
Keemiaprobleemide lahendamise oskus on aine loomingulise valdamise põhikriteerium. See toimub probleemide lahendamise kaudu erinevad tasemed keerukust, saab keemiakursuse tõhusalt omandada.
Kui õpilasel on selge arusaam kõigist võimalikest ülesannetest ja ta on lahendanud suure hulga igat tüüpi ülesandeid, saab ta hakkama keemiaeksamiga ühtse riigieksami vormis ja ülikoolidesse sisseastumisel.
