7.11. Kovalentsete sidemetega ainete struktuur
Ained, milles igat tüüpi keemilistest sidemetest on ainult kovalentne side, jagatakse kahte ebavõrdsesse rühma: molekulaarsed (väga palju) ja mittemolekulaarsed (palju vähem).
Tahkete molekulaarsete ainete kristallid koosnevad molekulidest, mis on omavahel nõrgalt seotud molekulidevahelise interaktsiooni jõududega. Sellistel kristallidel ei ole suurt tugevust ja kõvadust (mõelge jääle või suhkrule). Nende sulamis- ja keemistemperatuur on samuti madal (vt tabel 22).
Tabel 22. Mõnede molekulaarsete ainete sulamis- ja keemistemperatuurid
Aine |
Aine |
||||
| H 2 | – 259 | – 253 | BR 2 | – 7 | 58 |
| N 2 | – 210 | – 196 | H2O | 0 | 100 |
| HCl | – 112 | – 85 | P 4 | 44 | 257 |
| NH3 | – 78 | – 33 | C 10 H 8 (naftaleen) | 80 | 218 |
| SO 2 | – 75 | – 10 | S 8 | 119 |
Erinevalt nende molekulaarsetest kolleegidest moodustavad kovalentsete sidemetega mittemolekulaarsed ained väga kõvasid kristalle. Sellesse tüüpi kuuluvad teemantkristallid (kõige kõvem aine).
Teemantkristallis (joonis 7.5) on iga süsinikuaatom ühendatud nelja teise süsinikuaatomiga lihtsate kovalentsete sidemetega (sp 3 hübridisatsioon). Süsinikuaatomid moodustavad kolmemõõtmelise raamistiku. Põhimõtteliselt on kogu teemandikristall üks tohutu ja väga tugev molekul.
Raadioelektroonikas ja elektroonikatehnikas laialdaselt kasutatavatel ränikristallidel on sama struktuur.
Kui asendada pool teemandis olevatest süsinikuaatomitest räni aatomitega ilma kristalli karkassstruktuuri rikkumata, saadakse ränikarbiidi SiC kristall – samuti väga kõva aine, mida kasutatakse abrasiivmaterjalina. Seda tüüpi kristalsete ainete hulka kuulub ka tavaline kvartsliiv (ränidioksiid). Kvarts on väga kõva aine; Nimetuse "smirgel" all kasutatakse seda ka abrasiivse materjalina. Kvartsi struktuuri on lihtne saada, sisestades ränikristalli iga kahe räni aatomi vahele hapnikuaatomid. Sel juhul on iga räni aatom seotud nelja hapnikuaatomiga ja iga hapnikuaatom kahe räni aatomiga.
Teemandi, räni, kvartsi ja sarnaste struktuuride kristalle nimetatakse aatomikristallideks.
Aatomikristall on kristall, mis koosneb ühe või mitme elemendi aatomitest, mis on omavahel seotud keemiliste sidemetega.
Keemiline side aatomikristallides võib olla kovalentne või metalliline.
Nagu te juba teate, on iga aatomikristall, nagu ioonkristall, tohutu "supermolekul". Sellise "supermolekuli" struktuurivalemit ei saa üles kirjutada - saate näidata ainult selle fragmenti, näiteks:

Erinevalt molekulaarsetest ainetest on aatomikristalle moodustavad ained ühed kõige tulekindlamad (vt tabel 23).
Tabel 23. Mõnede mittemolekulaarsete ainete sulamis- ja keemistemperatuurid Koos kovalentsed sidemed
Sellised kõrged sulamistemperatuurid on täiesti arusaadavad, kui meenutame, et kui need ained sulavad, siis ei katke mitte nõrgad molekulidevahelised sidemed, vaid tugevad keemilised sidemed. Samal põhjusel paljud aatomikristalle moodustavad ained kuumutamisel ei sula, vaid lagunevad või lähevad kohe auruolekusse (sublimaadid), näiteks grafiit sublimeerub 3700 o C juures.
| Räni – Si. Väga kõvad, rabedad ränikristallid näevad välja nagu metall, kuid siiski on tegemist mittemetalliga. Elektrijuhtivuse tüübi järgi klassifitseeritakse see aine pooljuhtideks, mis määrab selle tohutu tähtsuse tänapäeva maailmas. Räni on kõige olulisem pooljuhtmaterjal. Raadiod, televiisorid, arvutid, kaasaegsed telefonid, elektroonilised kellad, päikesepaneelid ja paljud teised kodu- ja tööstusseadmed sisaldavad kõige olulisemate konstruktsioonielementidena ülipuhta räni monokristallidest valmistatud transistore, mikroskeeme ja fotoelemente. Tehnilist räni kasutatakse terase tootmisel ja värvilise metallurgias. Oma keemiliste omaduste poolest on räni üsna inertne aine, see reageerib ainult kõrgetel temperatuuridel. Ränidioksiid – SiO 2 . Selle aine teine nimi on ränidioksiid. Ränidioksiid esineb looduses kahel kujul: kristalne ja amorfne. Paljud poolvääriskivid ja dekoratiivkivid on kristallilise ränidioksiidi (kvartsi) sordid: mäekristall, jaspis, kaltsedon, ahhaat. ja opaal on ränidioksiidi amorfne vorm. Kvarts on looduses väga levinud, sest kõrbete luited ning jõgede ja merede liivakaldad on kõik kvartsliiv. Kvarts on värvitu kristalne, väga kõva ja tulekindel aine. Selle kõvadus on madalam kui teemant ja korund, kuid sellest hoolimata kasutatakse seda laialdaselt abrasiivse materjalina. Kvartsliiva kasutatakse laialdaselt ehituses ja ehitusmaterjalide tööstuses. Kvartsklaasi kasutatakse laboratoorsete klaasnõude ja teaduslike instrumentide valmistamiseks, kuna see ei pragune äkiliste temperatuurimuutuste korral. Oma keemiliste omaduste poolest on ränidioksiid happeline oksiid, kuid leelistega reageerib see ainult sulamisel. Kõrgel temperatuuril kasutatakse ränidioksiidi ja grafiiti ränikarbiidi – karborundi – tootmiseks. Karborund on teemandi järel kõvasti teine aine, sellest valmistatakse ka lihvkettaid ja “liivapaberit”. |
7.12. Kovalentse sideme polaarsus. Elektronegatiivsus
Tuletame meelde, et erinevate elementide isoleeritud aatomitel on erinev kalduvus nii elektrone loobuda kui ka vastu võtta. Need erinevused püsivad pärast kovalentse sideme moodustumist. See tähendab, et mõne elemendi aatomid tõmbavad kovalentse sideme elektronpaari enda külge tugevamini kui teiste elementide aatomid.
Mõelge molekulile HCl.
Selle näite abil vaatame, kuidas saame hinnata elektronide sidepilve nihet, kasutades molaarseid ionisatsioonienergiaid ja vahendeid elektronile. 1312 kJ/mol ja 1251 kJ/mol – vahe on tühine, umbes 5%. 73 kJ/mol ja 349 kJ/mol – siin on erinevus palju suurem: klooriaatomi elektronide afiinsusenergia on peaaegu viis korda suurem kui vesinikuaatomi oma. Sellest võime järeldada, et vesinikkloriidi molekulis on kovalentse sideme elektronpaar suures osas nihkunud klooriaatomi poole. Teisisõnu veedavad siduvad elektronid klooriaatomi läheduses rohkem aega kui vesinikuaatomi läheduses. Selline elektrontiheduse ebaühtlane jaotus viib elektrilaengute ümberjaotumiseni molekulis.Aatomitel tekivad osalised (liigsed) laengud; vesinikuaatomil on see positiivne ja kloori aatomil negatiivne.
Sel juhul öeldakse, et side on polariseeritud ja sidet ennast nimetatakse polaarseks kovalentseks sidemeks.
Kui kovalentse sideme elektronpaar ei ole nihkunud ühelegi seotud aatomile, st sideme elektronid kuuluvad võrdselt seotud aatomite hulka, siis nimetatakse sellist sidet mittepolaarseks kovalentseks sidemeks.
Kohaldatav on ka kovalentse sideme puhul "formaalse laengu" mõiste. Ainult definitsioonis ei tohiks me rääkida ioonidest, vaid aatomitest. Üldiselt võib anda järgmise definitsiooni.
Molekulides, milles kovalentsed sidemed moodustuvad ainult vahetusmehhanismi abil, on aatomite formaalsed laengud võrdsed nulliga. Seega on HCl-i molekulis nii kloori- kui ka vesinikuaatomi formaalsed laengud nullid. Järelikult on selles molekulis kloori- ja vesinikuaatomite tegelikud (efektiivsed) laengud võrdsed osaliste (liigsete) laengutega.
Moolaarsete ionisatsioonienergiate ja elektroodi afiinsuse põhjal ei ole alati lihtne määrata molekuli ühe või teise elemendi aatomi osalaengu märki, st hinnata, millises suunas on sidemete elektronpaarid. nihkunud. Tavaliselt kasutatakse nendel eesmärkidel teist aatomile iseloomulikku energiat - elektronegatiivsust.
Praegu ei ole elektronegatiivsuse jaoks ühtset üldtunnustatud tähistust. Seda saab tähistada tähtedega E/O. Samuti pole elektronegatiivsuse arvutamiseks ühtset üldtunnustatud meetodit. Lihtsustatult võib seda esitada poolena molaarsete ionisatsioonienergiate ja elektronide afiinsuse summast – see oli üks esimesi viise selle arvutamiseks.
Erinevate elementide aatomite elektronegatiivsuse absoluutväärtusi kasutatakse väga harva. Kõige sagedamini kasutatakse suhtelist elektronegatiivsust, mida tähistatakse c-ga. Algselt määratleti see väärtus antud elemendi aatomi elektronegatiivsuse ja liitiumi aatomi elektronegatiivsuse suhtena. Seejärel muutusid selle arvutamise meetodid mõnevõrra.
Suhteline elektronegatiivsus on mõõtmeteta suurus. Selle väärtused on toodud lisas 10.
Kuna suhteline elektronegatiivsus sõltub eelkõige aatomi ionisatsioonienergiast (elektronide afiinsusenergia on alati palju väiksem), siis keemiliste elementide süsteemis muutub see ligikaudu sama palju kui ionisatsioonienergia ehk suureneb diagonaalselt tseesiumist (0,86) fluoriks (4.10). Tabelis toodud heeliumi ja neooni suhtelise elektronegatiivsuse väärtustel pole praktilist tähtsust, kuna need elemendid ei moodusta ühendeid.
Elektronegatiivsuse tabeli abil saate hõlpsalt kindlaks teha, millise kahe aatomi poole on neid aatomeid ühendavad elektronid nihkunud, ja seega ka nendel aatomitel tekkivate osalaengute märgid.
| H2O | Ühendus on polaarne | |||
| H 2 | Aatomid on samad | H--H | Ühendus on mittepolaarne | |
| CO2 | Ühendus on polaarne | |||
| Cl2 | Aatomid on samad | Cl--Cl | Ühendus on mittepolaarne | |
| H2S | Ühendus on polaarne |
Seega on erinevate elementide aatomite vahel kovalentse sideme tekkimisel selline side alati polaarne ning sama elemendi aatomite vahelise kovalentse sideme tekkimisel (lihtainetes) side on enamikul juhtudel mittepolaarne.
Mida suurem on sidemetega aatomite elektronegatiivsuse erinevus, seda polaarsemaks osutub nende aatomitevaheline kovalentne side.
| Vesiniksulfiid H2S– mädamunadele iseloomuliku lõhnaga värvitu gaas; mürgine. See on termiliselt ebastabiilne ja laguneb kuumutamisel. Vesiniksulfiid lahustub vees vähe, selle vesilahust nimetatakse vesiniksulfiidhappeks. Vesiniksulfiid kutsub esile (katalüüsib) metallide korrosiooni, just see gaas on "süüdi" hõbeda tumenemises. Seda leidub looduslikult mõnes mineraalvees. Eluprotsessis moodustavad selle mõned bakterid. Vesiniksulfiid on hävitav kõigile elusolenditele. Musta mere sügavustest avastati vesiniksulfiidikiht, mis teeb teadlastele muret: sealsete mereelanike elu on pidevas ohus. |
POLAARNE KOVALENTSIDE, MITTEPOLAARNE KOVALENTSIDE, ABSOLUUTNE ELEKTRONEGATIIVSUS, SUHTELINE ELEKTRONEGATIIVSUS.
1. Katsed ja hilisemad arvutused näitasid, et räni efektiivne laeng ränitetrafluoriidis on +1,64 e ja ksenooni laeng ksenoonheksafluoriidis +2,3 e. Määrake nende ühendite fluori aatomite osalaengute väärtused. 2. Koostage järgmiste ainete struktuurivalemid ja, kasutades tähiseid " " ja " ", iseloomustage kovalentsete sidemete polaarsust nende ühendite molekulides: a) CH 4, CCl 4, SiCl 4; b) H2O, H2S, H2Se, H2Te; c) NH3, NF3, NCl3; d) SO 2, Cl 2 O, OF 2.
3.Kasutades elektronegatiivsuse tabelit, märkige, millistes ühendites on side polaarsem: a) CCl 4 või SiCl 4 ; b) H2S või H20; c) NF3 või NCl3; d) Cl2O või OF 2.
7.13. Sidemete moodustumise doonor-aktseptor mehhanism
Eelmistes lõikudes õppisite üksikasjalikult kahte tüüpi sidemeid: ioonseid ja kovalentseid sidemeid. Tuletame meelde, et ioonside tekib siis, kui elektron kandub täielikult ühelt aatomilt teisele. Kovalentne – seotud aatomite paaritute elektronide jagamisel.
Lisaks on sidemete moodustamiseks veel üks mehhanism. Vaatleme seda ammoniaagi molekuli ja boortrifluoriidi molekuli interaktsiooni näitel:

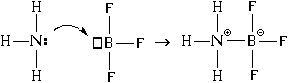
Selle tulemusena tekivad lämmastiku- ja booriaatomite vahel nii kovalentsed kui ka ioonsed sidemed. Sel juhul on lämmastikuaatom doonor elektronpaar ("annab" selle sideme moodustamiseks) ja boori aatom - aktsepteerija("aksepteerib" selle ühenduse loomisel). Sellest ka sellise ühenduse moodustamise mehhanismi nimi - “ doonor-aktsepteerija".
Kui side moodustub doonor-aktseptormehhanismi abil, moodustuvad samaaegselt nii kovalentne side kui ka ioonside.
Loomulikult toimub pärast sideme tekkimist seotud aatomite elektronegatiivsuse erinevuse tõttu sideme polariseerumine ja tekivad osalaengud, mis vähendavad aatomite efektiivseid (reaalseid) laenguid.
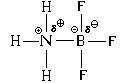
Vaatame teisi näiteid.
Kui ammoniaagi molekuli kõrval on ülipolaarne vesinikkloriidi molekul, milles vesinikuaatomil on märkimisväärne osalaeng, siis sel juhul hakkab elektronpaari aktseptori rolli täitma vesinikuaatom. Selle 1 s-AO, kuigi mitte täiesti tühi, nagu eelmise näite booriaatom, väheneb elektrontihedus selle orbitaali pilves oluliselt.

Saadud katiooni ruumiline struktuur on ammooniumi ioon NH4 sarnaneb metaani molekuli struktuuriga, see tähendab, et kõik neli N-H sidet on täpselt ühesugused.
Ammooniumkloriidi NH 4 Cl ioonsete kristallide moodustumist saab jälgida gaasilise ammoniaagi segamisel gaasilise vesinikkloriidiga:
NH3 (g) + HCl (g) = NH4Cl (cr)
Mitte ainult lämmastikuaatom ei saa olla elektronpaari doonor. See võib olla näiteks veemolekuli hapnikuaatom. Veemolekul interakteerub sama vesinikkloriidiga järgmiselt:
Saadud H3O katiooni nimetatakse oksooniumi ioon ja nagu varsti saate teada, on sellel keemias suur tähtsus.
Kokkuvõtteks vaatleme süsinikmonooksiidi (süsinikmonooksiidi) CO molekuli elektroonilist struktuuri:
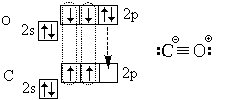
Lisaks kolmele kovalentsele sidemele (kolmikside) sisaldab see ka ioonset sidet.
Sidemete moodustamise tingimused vastavalt doonor-aktseptormehhanismile:
1) üksiku valentselektronide paari olemasolu ühes aatomis;
2) vaba orbitaali olemasolu teise aatomi valentsi alamtasandil.
Sidemete moodustumise doonor-aktseptormehhanism on üsna laialt levinud. Eriti sageli esineb see ühendite moodustumise ajal d-elemendid. Peaaegu kõigi aatomid d-elementidel on palju tühje valentsorbitaale. Seetõttu on nad aktiivsed elektronpaaride vastuvõtjad.
SIDEME MOODUSTAMISE DOONOR-AKTSEPTOR MEHHANISM, AMMOONIUMION, OKSOONIUMIOON, SIDEME MOODUSTAMISE TINGIMUSED DOONOR-AKTSEPTOR MEHHANISMIGA.
1.Koosta reaktsioonivõrrandid ja moodustamisskeemid
a) ammooniumbromiid NH4Br ammoniaagist ja vesinikbromiidist;
b) ammooniumsulfaat (NH 4) 2 SO 4 ammoniaagist ja väävelhappest.
2. Koostada reaktsioonivõrrandid ja vastastikmõju skeemid a) vee ja vesinikbromiidi jaoks; b) vesi väävelhappega.
3.Millised nelja eelneva reaktsiooni aatomid on elektronpaari doonorid ja millised aktseptorid? Miks? Selgitage oma vastust valentsi alamtasemete diagrammidega.
4.Lämmastikhappe struktuurivalem.O–N–O sidemete vahelised nurgad on lähedased 120 o. Määratlege:
a) lämmastikuaatomi hübridisatsiooni tüüp;
b) milline lämmastikuaatomi AO osaleb -sideme moodustamises;
c) milline lämmastikuaatomi AO osaleb -sideme moodustumisel vastavalt doonor-aktseptor mehhanismile.
Mis teie arvates on selle molekuli H-O-N sidemete vaheline nurk ligikaudu võrdne? 5.Koostage tsüaniidiooni CN (süsinikuaatomi negatiivne laeng) struktuurivalem. Teadaolevalt on tsüaniidid (sellist iooni sisaldavad ühendid) ja süsinikmonooksiid CO tugevad mürgid ning nende bioloogiline toime on väga sarnane. Paku oma selgitust nende bioloogilise toime läheduse kohta.
7.14. Metallist ühendus. Metallid
Kovalentne side moodustub aatomite vahel, mis on sarnase kalduvuse poolest loobuda ja saada elektrone ainult siis, kui seotud aatomite suurused on väikesed. Sel juhul on elektrontihedus kattuvate elektronpilvede piirkonnas märkimisväärne ja aatomid osutuvad tihedalt seotud, nagu näiteks HF molekulis. Kui vähemalt üks seotud aatomitest on suure raadiusega, muutub kovalentse sideme moodustumine vähem soodsaks, kuna suurte aatomite elektrontihedus kattuvate elektronpilvede piirkonnas on palju väiksem kui väikeste aatomite puhul. Sellise nõrgema sidemega molekuli näide on HI molekul (tabeli 21 abil võrrelge HF ja HI molekulide pihustusenergiat).
Ja veel suurte aatomite vahel ( r o > 1.1) tekib keemiline side, kuid sel juhul tekib see kõigi seotud aatomite valentselektronide (või osade) jagamise tõttu. Näiteks naatriumi aatomite puhul on kõik 3 s- nende aatomite elektronid ja moodustub üks elektronpilv:
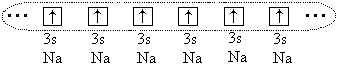
Aatomid moodustavad kristalli koos metallist suhtlemine
Sel moel saavad nii sama elemendi aatomid kui ka erinevate elementide aatomid omavahel sidemeid luua. Esimesel juhul lihtsad ained nn metallid, ja teises - komplekssed ained nn intermetallilised ühendid.
Kõigist ainetest, millel on aatomite vahel metallilised sidemed, õpite metallide kohta alles koolis. Milline on metallide ruumiline struktuur? Metallkristall koosneb aatomi skeletid, mis jääb alles pärast valentselektronide sotsialiseerumist ja sotsialiseerunud elektronide elektronpilve. Aatomisüdamikud moodustavad tavaliselt väga tiheda tihendi ja elektronipilv võtab enda alla kogu ülejäänud kristalli vaba ruumala.
Peamised tihedate pakendite tüübid on kuup lähim pakkimine(KPU) ja kuusnurkne tihe pakend(GPU). Nende pakendite nimed on seotud nende kristallide sümmeetriaga, milles need realiseeritakse. Mõned metallid moodustavad lõdvalt pakitud kristalle - kehakeskne kuup(OTSK). Nende pakendite mahu- ja palli- ja pulgamudelid on näidatud joonisel 7.6.
Kuubikujulise tihendi moodustavad Cu, Al, Pb, Au ja mõnede teiste elementide aatomid. Kuusnurkne tihendus - Be, Zn, Cd, Sc ja mitmete teiste aatomid. Aatomite kehakeskne kuubikujuline pakend esineb leelismetallide kristallides, VB- ja VIB-rühmade elementides. Mõnel metallil võib erinevatel temperatuuridel olla erinev struktuur. Metallide selliste erinevuste ja struktuuriomaduste põhjused pole siiani täielikult mõistetavad.
Sulamisel muutuvad metallikristallid metallist vedelikud. Aatomitevahelise keemilise sideme tüüp ei muutu.
Metallsidemel puudub suunalisus ja küllastus. Selles suhtes sarnaneb see ioonsidemega.
Intermetalliliste ühendite puhul saame rääkida ka metallilise sideme polariseeritavusest.
Metallide iseloomulikud füüsikalised omadused:
1) kõrge elektrijuhtivus;
2) kõrge soojusjuhtivus;
3) kõrge elastsus.

Erinevate metallide sulamistemperatuurid on üksteisest väga erinevad: madalaim sulamistemperatuur on elavhõbedal (- 39 o C), kõrgeim aga volframil (3410 o C).
| Berüllium Be- helehall, kerge, üsna kõva, kuid tavaliselt rabe metall. Sulamistemperatuur 1287 o C. Õhus kattub see oksiidkilega. Berüllium on üsna haruldane metall, evolutsiooniprotsessis olevad elusorganismid ei puutunud sellega praktiliselt kokku, mistõttu pole üllatav, et see on loomamaailmale mürgine. Seda kasutatakse tuumatehnoloogias. Tsink Zn on valge pehme sinaka varjundiga metall. Sulamistemperatuur 420 o C. Õhus ja vees on see kaetud õhukese tiheda tsinkoksiidi kilega, mis takistab edasist oksüdeerumist. Tootmises kasutatakse seda lehtede, torude, juhtmete galvaniseerimiseks, raua kaitsmiseks korrosiooni eest. Wolfram W. See on kõigist metallidest kõige tulekindlam: volframi sulamistemperatuur on 3387 o C. Tavaliselt on volfram üsna habras, kuid pärast hoolikat puhastamist muutub see plastiliseks, mis võimaldab tõmmata sellest peenikest traati, millest väljuvad niidid. tehakse lambipirnid. Suurem osa toodetud volframist kasutatakse aga kõvade ja kulumiskindlate sulamite tootmiseks, mis suudavad need omadused säilitada isegi kuni 1000 o C kuumutamisel. |
METALL, METALLIDE VAHELINE SIDE, METALLILINE SIDE, KÕIGE KÕIGE PAKEND.
1. Erinevate pakendite iseloomustamiseks kasutatakse mõistet "ruumi täitekoefitsient" ehk aatomite ruumala ja kristalli ruumala suhet.
Kus V a - aatomi maht,
Z on aatomite arv rakus,
V i- ühiku lahtri maht.
Aatomeid esindavad sel juhul jäigad raadiusega kuulid R, puudutades üksteist. Palli maht V w = (4/3) R 3 .
Määrake hulgi- ja bcc-pakendite ruumi täitmistegur.
2. Arvutage metalliraadiuste väärtusi (lisa 9) kasutades a) vase (CPU), b) alumiiniumi (CPU) ja c) tseesiumi (BCC) ühiku suurus.
Vanderwaalsi jõud
Van der Waalsi jõud (Van der Waals, Hollandi teadlane, 1873) määravad molekulidevahelise vastasmõju. Nad sisaldavad
dipool-dipool, induktsioon ja dispersioon interaktsioonid.
Dipool-dipool interaktsioon toimub püsivate dipoolide vastaspooluste vahel. Induktsioon interaktsioonid tekivad dipoolide ja mittepolaarsete molekulide vahel. Dipool mõjutab mittepolaarset molekuli, muutes selle indutseeritud dipooliks. Püsi- ja indutseeritud dipoolide vahel tekib külgetõmme, mille energia on võrdeline molekulide tsentrite vahelise kaugusega. Induktiivse interaktsiooni energia suureneb koos molekulide polariseeritavuse suurenemisega (molekuli võime moodustada dipool).
Hajutav interaktsioon toimub mittepolaarsete molekulide hetkeliste dipoolide vahel. Elektrilise tiheduse kõikumised esinevad igas molekulis, mille tulemusena tekivad hetkelised dipoolid, mis omakorda indutseerivad naabermolekulides hetkelisi dipoole.
Igat tüüpi interaktsioonide energia on pöördvõrdeline molekulide tsentrite vahelise kaugusega kuuenda astmeni.
3.2. Vesinikside
Vesinikside tekib ühe molekuli positiivselt polariseeritud vesiniku ja teise molekuli negatiivselt polariseeritud aatomi interaktsiooni tulemusena. Näiteks ...H + ─F - ...H + ─F - ... Kui molekuli sees tekib vesinikside, nimetatakse seda molekulisiseseks.
Vesiniksidemete tekkimisel tekivad dimeerid, trimmerid või polümeerstruktuurid. See toob kaasa viskoossuse, dielektrilise konstandi, keemis- ja sulamispunktide, sulamis- ja aurustumissoojuse suurenemise.
Molekulide ruumiline konfiguratsioon
Molekulide ruumilise struktuuri määrab molekulis olevate aatomite arv ja keemiliste sidemete suund.
Kaheaatomilised molekulid (H 2), kolmeaatomilised CaCl 2, C 2 H 2) on lineaarse struktuuriga.
Kolmeaatomilised molekulid võivad olla nurkstruktuuriga (H 2 S, H 2 O); püramiidne (NH 3); lame kolmnurk (AlCl 3, BF 3).
Polüaatomilised molekulid on keerulisema konfiguratsiooniga – tetraeedriline (CH 4), oktaeedriline (SF 6); tsükliline (C 4 H 8, C 6 H 6) jne.
Vesinikfluoriid
vesiniksulfiid
Boorfluoriid
Testiülesanded
1. Millistes molekulides on keemiline side polaarne?F2, CO, N2, HBr?
2. Määrake fluori ja fosfori valentsus põhi- ja ergastatud olekus.
3. Näidake keemiliste sidemete moodustumise mehhanismi CO, vee, ammooniumhüdroksiidi, ammooniumkatiooni molekulides.
4. Mis proaso, magneesiumkloriid, alumiiniumbromiid, vesinikseleniid, atsetüleen, ppeen, pentaan?
5. Esitage hapniku ja vesinikkloriidi molekulide elektroonilised konfiguratsioonid MO meetodil.
6. MS meetodil tehke kindlaks, kas ioonide teke on võimalik
H2+, He2+, O2-.
7. Joonistage lämmastiku ja fluori molekulide energiadiagrammid MO meetodil.
8. Mis tüüpi van der Waalsi jõud esinevad vesinikperoksiidi, vee, vesinikbromiidi, etüülalkoholi, metanaali molekulides?
9. Millistest parameetritest sõltub keemilise sideme pikkus?
10. Kuidas muutub keemilise sideme energia vesinikhalogeniidi seerias vesinikfluoriidist vesinikjodiidiks?
11. Kuidas muutub süsiniku vahelise keemilise sideme energia reas: üksik-, kahe-, kolmekordne, aromaatne?
Keemiliste sidemete teke ja omadused
Keemiline side tekib ainult siis, kui aatomite lähenemisel süsteemi koguenergia väheneb.
Keemiline side tekib siis, kui antiparalleelsete spinnidega paaritute elektronide pilved kattuvad aatomituumade elektrostaatilise interaktsiooni tõttu nendevahelise suurenenud elektrontihedusega.
Vaatleme näiteks sideme tekkimist vesiniku molekulis. Vesinikuaatomite ühinemisel tungivad nende elektronpilved üksteisesse, mida nimetatakse elektronpilvede kattumiseks (joonis 4.1).
Riis. 4.1.Elektronipilvede kattumine vesiniku molekuli moodustumisel.
Tuumadevaheline elektrontihedus suureneb. Tuumad tõmbavad üksteist ligi. Selle tulemusena väheneb süsteemi energia (joon. 4.2). Kui aatomid on aga väga lähestikku, suureneb tuumade tõrjumine järsult. Optimaalne südamike vaheline kaugus – side pikkus (l sv), mille juures süsteemil on minimaalne energia. Aatomite üleminekul sellesse olekusse vabaneb energia, nn siduv energia (E St).
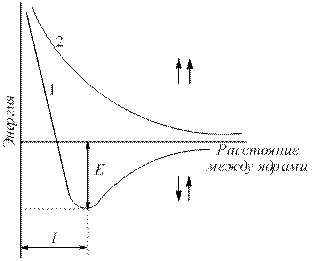
Riis. 4.2 .
Kahe paralleelse (1) ja antiparalleelse (2) vesinikuaatomi süsteemide energia sõltuvus tuumadevahelisest kaugusest (E – sidumisenergia).
Kui sideme moodustavad identsed aatomid, näiteks H–H, Cl–Cl, NºN, jaotuvad jagatud elektronid nende vahel ühtlaselt. Seda ühendust nimetatakse kovalentne mittepolaarne suhtlemine.
Kui üks aatomitest tõmbab elektrone tugevamini ligi, siis elektronpaar nihkub selle aatomi poole. Sel juhul on olemas polaarne kovalentne ühendus. Elektronegatiivsus (EO) võib olla kriteeriumiks aatomi võimele elektrone ligi tõmmata. Mida kõrgem on aatomi EO, seda suurem on tõenäosus, et elektronpaar nihkub selle aatomi tuuma poole. Seetõttu iseloomustab aatomite elektronegatiivsuse erinevus kommunikatsiooni polaarsus.
Aatomite EO suure erinevuse korral näiteks perioodilise süsteemi esimese ja teise rühma s-metallide ning VI, VII rühmade mittemetallide (LiF, CsCl, K 2 O jne) vahel. ), võib toimuda mitte ainult elektrontiheduse nihe, vaid ka täielik üleminek elektronegatiivsemale aatomile, moodustades positiivse ja negatiivse iooni. Iooniline keemiline side on negatiivselt ja positiivselt laetud ioonide elektrostaatiline vastastikmõju keemilises ühendis.
Seega erinevad sidemed polaarsuse poolest.
Kommunikatsiooni polaarsus
Kommunikatsiooni polaarsus on tingitud nende aatomite erinevast elektronegatiivsusest, mille vahel tekib keemiline side.
Elektronsideme paari nihkumise tõttu elektronegatiivsemale aatomile omandab see osalise (efektiivse) negatiivse laengu (δ–). Teine aatom omandab osalise positiivse laengu (δ+). Nii tekib dipool, mis on elektriliselt neutraalne süsteem, millel on kaks võrdse suurusega positiivset ja negatiivset laengut, mis asuvad teatud kaugusel l düksteisest (dipooli pikkus). Sideme polaarsuse mõõt on dipooli elektrimoment (μm), mis on võrdne efektiivse laengu ja dipooli pikkuse korrutisega l d.
| . | (4.1) |
Dipooli elektrimomendi mõõtühik on kulon meetri kohta (C × m). Mõõtühikuna kasutatakse ka süsteemivälist mõõtühikut debye – D, mis võrdub 3,3 × 10 –30 C × m (tabel 4.1).
Nagu tabelist näha. 4.1, elektriline dipoolmoment suureneb EO erinevuse suurenedes.
Tabel 4.1
Keemilise sideme elektriline dipoolmoment molekulides
| Ühendus | EO erinevus | μ St, D | Ühendus | EO erinevus | μ St, D |
| H–F | 1,9 | 1,98 | AGA | 1,4 | 1,53 |
| Н–Сl | 0,9 | 1,03 | N–N | 0,9 | 1,3 |
| H–Br | 0,74 | 0,78 | H–S | 0,4 | 0,7 |
| Н-I | 0,4 | 0,38 | N–S | 0,4 | 0,3 |
Polaarset kovalentset sidet, mille δ läheneb 1-le, võib pidada ioonseks sidemeks. Kuid isegi ioonsete ühendite puhul on δ alla ühtsuse. Seetõttu on igal ioonsel sidemel teatav kovalentsus. Enamiku keemiliste ühendite keemiline side ühendab kovalentsete ja ioonsete sidemete omadused. Ühenduse polaarsus võib muutuda.
Aatomite interaktsiooni ajal, mille elektronegatiivsuse väärtused erinevad, kuid mitte järsult, nihkub ühine elektronpaar elektronegatiivsema aatomi poole. See on kõige levinum keemilise sideme tüüp, mida leidub nii anorgaanilistes kui orgaanilistes ühendites. Kovalentsed sidemed hõlmavad täielikult neid sidemeid, mis moodustuvad doonor-aktseptor mehhanismi järgi. ammooniumioonide moodustumine doonor-aktseptor mehhanismi abil.
9 Valentssideme meetod.
Valentssideme meetodit kasutasid esmakordselt 1927. aastal Saksa teadlased W. Heitler ja F. London, kes viisid läbi vesinikuaatomi kvantmehaanilise arvutuse. BC-meetod eeldab, et molekulis olevad aatomid säilitavad oma individuaalsuse. Elektronpaar asustab ühe või teise aatomi orbitaali. Heitler ja London näitasid, et kui kaks antiparalleelsete spinnidega vesinikuaatomit lähenevad üksteisele, siis süsteemi energia väheneb, mis on tingitud elektrontiheduse suurenemisest interakteeruvate aatomite tuumade vahelises ruumis. Kui paralleelsete spinnidega aatomid lähenevad üksteisele, suureneb süsteemi energia ja sel juhul molekuli ei teki. BC meetod põhineb järgmistel aluspõhimõtetel: 1) keemiline side kahe aatomi vahel tekib AO-de kattumisel elektronpaaride moodustumisega. 2) keemilisesse sidemesse sisenevad aatomid vahetavad omavahel elektrone, mis moodustavad sidepaare. Ühiste elektronpaaride moodustumisel saavad osaleda ainult paarita aatomite elektronid. Aatomitevahelise elektronvahetuse energia annab peamise panuse keemilise sideme energiasse. Täiendava panuse annavad osakeste vastasmõju Coulombi jõud. 3) Pauli printsiibi kohaselt tekib keemiline side ainult antiparalleelsete spinnidega elektronide vastastikmõjul. 4) keemilise sideme omadused määratakse AO kattuvuse tüübi järgi
Molekulidevahelise sidumisenergia kõver kauguse suhtes
10 Valents – aatomi võime moodustada keemilisi sidemeid. Valentsi mõõt on keemiliste sidemete arv. Aatomi valentsusvõime määrab paaritute (valents)elektronide arv väliskihil ja sidemete arv, mida saab moodustada doonor-aktseptormehhanism. Oksüdatsiooni olek - aatomi tavalaeng molekulis, mis arvutatakse eeldusel, et kõik sidemed on olemuselt ioonsed. See tähendab, et elektronegatiivsem aatom, mis nihutab ühe elektronipaari enda poole, omandab laengu -1 ja kaks elektronipaari laengu -2. Side identsete aatomite vahel ei aita kaasa oksüdatsiooni olekule. Seega vastab C-C aatomite vaheline side nende nulloksüdatsiooniastmele. C-H sides on süsiniku kui elektronegatiivsema aatomi laeng -1 ja C-O sides süsiniku (vähem elektronegatiivse) laeng on +1. Aatomi oksüdatsiooniaste molekulis arvutatakse laengute algebralise summana, mille annavad antud aatomi kõik sidemed Seega annavad CH 3 Cl molekulis kolm CH sidet C-aatomi kogulaengu, mis on võrdne - 3 ja C-Cl side annab laengu +1. Seetõttu on selle ühendi süsinikuaatomi oksüdatsiooniaste:
Ergastatud olekus aatomite valents suureneb. Selle põhjuseks on nähtus aurutamine ja edutamine ( üleminek vabale orbitaalile) elektronide väliskihis.
11 .
Keemiline side- aatomitevaheline interaktsioon, mis on põhjustatud aatomite väliste elektronkihtide kattumisest, millega kaasneb tekkiva süsteemi koguenergia vähenemine. Keemilise sideme võib moodustada igast aatomist ühe või enama paaritu elektroni loovutamisega (mitmed sidemed) elektronpaaride moodustamiseks (kovalentne side) või kui üks aatom domineerib elektronipaaris ja teine aatom hõivab vaba elektronorbitaali (doonor-aktseptor). võlakiri). Keemilise sideme moodustumisel osalevad ainult elektronid välisest elektronkihist ja see ei mõjuta sisemiste elektronide taset. Selle tulemusena moodustab iga aatom keemilise sideme moodustumisel välise elektroonilise tasandi täidetud elektronkihi, mis koosneb kahest (dublett) või kaheksast (oktett) elektronist. Keemilist sidet iseloomustavad pikkus ja energia. Keemilise sideme pikkus on kaugus seotud aatomite tuumade vahel. Keemilise sideme energia näitab, kui palju energiat tuleb kulutada, et eraldada kaks aatomit, mille vahel on keemiline side, kuni kauguseni, mil see keemiline side katkeb. Keemiliste sidemete peamised tüübid - kovalentne, ioonne, vesinik, metalliline.
Kommunikatsiooni küllastus annab molekulide konstantse koostise ja määratleb valentsi mõiste. Kui aatomil on n paardumata elektroni, võib see aatom moodustada n keemilist sidet teiste aatomitega, millest igaühel on üks paaritu elektron. Seetõttu on elemendi valents võrdne paaritute elektronide arvuga aatomis või moodustunud kovalentsete sidemete arvuga. Küllastusprintsiip tuleneb Pauli printsiibist ja tähendab, et iga elektron saab osaleda ainult ühe kovalentse sideme moodustamises. Keemiliste sidemete polaarsus - keemilisele sidemele iseloomulik, mis näitab elektrontiheduse jaotuse muutumist tuuma ümbritsevas ruumis võrreldes elektrontiheduse jaotusega seda sidet moodustavates neutraalsetes aatomites.
Sideme polaarsuse kvantitatiivseks mõõtmiseks kasutatakse aatomite nn efektiivseid laenguid.
Efektiivset laengut defineeritakse kui erinevust mõnes ruumipiirkonnas tuuma lähedal asuvate elektronide laengu ja tuuma laengu vahel. Sellel mõõdul on aga ainult tingimuslik ja ligikaudne tähendus, kuna molekulis ei ole võimalik üheselt identifitseerida piirkonda, mis on seotud eranditult üksiku aatomiga ja mitme sideme korral konkreetse sidemega.
Efektiivse laengu olemasolu saab näidata aatomite laengute sümbolitega (näiteks H + δ - Cl − δ, kus δ on teatud osa elementaarlaengust).
12 Vesinikside. Seda tüüpi sidemeid saab ainult tinglikult nimetada keemiliseks ja see on õigemini omistatud molekulidevahelistele ja molekulisisestele interaktsioonidele. Vesinikside tekib ühe molekuli seotud vesinikuaatomi ja teise molekuli elektronegatiivse aatomi vahel. Vesinikside on oma olemuselt osaliselt elektrostaatiline ja osaliselt doonor-aktseptor. Selge näide sellise ühenduse rakendamisest võib olla mitme veemolekuli ühendamine klastriteks. Veemolekulis nihutab hapnikuaatom oma elektrontiheduse enda poole, omandades osalise negatiivse laengu ja vastavalt sellele on vesinik osaliselt positiivne ja võib interakteeruda naabermolekuli hapniku üksiku elektronpaariga. Vesinikside võib tekkida mitte ainult erinevate molekulide vahel, vaid ka molekuli enda sees Van der Waalsi interaktsioon toimub indutseeritud dipoolmomentide esinemise tõttu. Seda tüüpi interaktsioon võib toimuda nii erinevate molekulide vahel kui ka ühe molekuli sees naaberaatomite vahel, kuna elektronide liikumise ajal tekib aatomites dipoolmoment. Van der Waalsi suhtlus võib olla atraktiivne või eemaletõukav. Molekulidevaheline interaktsioon on külgetõmbe iseloomuga ja molekulidevaheline interaktsioon on tõrjuv. Intramolekulaarsetel van der Waalsi interaktsioonidel on oluline panus molekuli geomeetriasse. Molekulidevaheliste vesiniksidemete moodustumine toob kaasa olulise muutuse ainete omadustes: viskoossuse, dielektrilise konstandi, sulamis- ja keemistemperatuuride, aurustumis- ja sulamistemperatuuride suurenemise. Näiteks, vesi , vesinikfluoriidil ja ammoniaagil on ebatavaliselt kõrged keemis- ja sulamistemperatuurid. Vesiniksidemete mõjul muutuvad ka keemilised omadused. Kuna paljud ühendid sisaldavad kovalentseid polaarseid H–O ja H–N sidemeid, on vesiniksidemed väga levinud. Neid ei esine mitte ainult vees, vaid ka erinevates kristalsetes ainetes, polümeerides, valkudes, elusorganismides... Oma madalate väärtuste tõttu energiat vesiniksidemed katkevad ja tekivad uuesti suhteliselt kergesti. Vesiniksideme energia suureneb elektronegatiivsuse (EO) suurenemise ja B-aatomite suuruse vähenemisega, mistõttu tekivad tugevaimad vesiniksidemed, kui B-aatomiteks on F, O või N
13-14 Olenevalt aine moodustavate osakeste vahelisest kaugusest ning olemusest ja energiast molekulidevaheline interaktsioon (IMI) nende vahel võib aine olla ühes kolmest agregatsiooni olekust: tahke, vedel ja gaasiline.
IN gaas olekus on osakeste vahelise interaktsiooni energia palju väiksem kui nende kineetiline energia:
E MMV<< Е кин .
Seetõttu ei hoita gaasimolekule (aatomeid) koos, vaid liiguvad vabalt osakeste endi mahust oluliselt suuremas mahus. Molekulidevahelised interaktsioonijõud ilmnevad siis, kui molekulid on üksteisele piisavalt lähedal. Nõrk molekulidevaheline interaktsioon määrab gaasi madala tiheduse, soovi piiramatu paisumise järele ja võime avaldada survet anuma seintele, mis seda soovi takistavad. Gaasi molekulid on juhuslikus, kaootilises liikumises ja gaasis puudub molekulide paigutuse järjekord.
Gaasi olekut iseloomustavad: temperatuur - T, rõhk - p ja maht - V. Madalal rõhul ja kõrgel temperatuuril käituvad kõik tüüpilised gaasid ligikaudu ühtemoodi. Kuid juba tavalistel ja eriti madalatel temperatuuridel ja kõrgel rõhul hakkab ilmnema gaaside individuaalsus. Välisrõhu tõus ja temperatuuri langus lähendavad gaasiosakesi, mistõttu hakkab suuremal määral avalduma molekulidevaheline interaktsioon. Selliste gaaside puhul ei ole enam võimalik rakendada Mendelejevi-Clapeyroni võrrandit, kuid kasutada tuleks van der Waalsi võrrandit:
kus a ja b on konstantsed liikmed, mis võtavad arvesse tõmbejõudude olemasolu molekulide vahel ja vastavalt molekulide enda ruumala. Gaaside kokkusurumisel ja nende tiheduse olulisel suurenemisel mõjuvad jõud MMV muutuvad üha märgatavamaks, mis viib tingimuste loomiseni molekulidest erinevate assotsiatsioonide moodustamiseks. Associates on suhteliselt ebastabiilsed molekulide rühmad. Komponentide olemusest MMV sellest järeldub, et universaalsed interaktsioonijõud suurenevad koos aatomite suuruse suurenemisega (polariseeritavus suureneb järsult, seega mida raskemad on aine sama tüüpi osakesed (aatomid või molekulid), seda kõrgem on nende seostusaste antud temperatuuril, seda madalam on temperatuuridel läheb selline aine gaasist vedelikuks.
IN vedelikud MMW jõud on proportsionaalsed molekulaarse liikumise kineetilise energiaga:
E MMV » E kin.
Seetõttu on vedelikul omadus voolavus, võtab selle anuma kuju, millesse see asetatakse. Vedeliku struktuuri eripära seisneb selles ei ole kaugjärjestust, küll aga on molekulide paigutuses lühimaakord . Lühiajalise järjestuse ilming seisneb selles, et antud molekuli keskkonna 1. sfääris asuvad molekulid püsivad suuremal määral selle läheduses ja määravad seega teatud järjestuse. Vedelikes võib aga tekkida veelgi suurem kord kaugkorralduselemendiga. See juhtub juhtudel, kui IMV universaalseid jõude täiendavad IMV spetsiifilised jõud (vesinikside)
Sest tahke olekus, energiasuhe kehtib:
E MMV > E kin.
Aine tahket olekut leidub peamiselt kristallide kujul. Kristallid koosnevad aineosakestest (aatomitest, molekulidest, ioonidest), mis on üksteise suhtes teatud viisil orienteeritud. Selle orientatsiooni olemus on selline, et ained, mis on valitud osakesest piisavalt kaugel, on rangelt määratletud asendis ja kindlal kaugusel. Seda omadust nimetatakse kohalolekuks pikamaa tellimus kristallides. Kristallide kuju võib olla erinev.
15 Kristallilise oleku iseloomulik tunnus on olemasolu rangelt järjestatud osakeste süsteemid, mida nimetatakse kristallvõre. Kristallvõre võib saada mingi väikseima osakeste rühma, nn. ühikrakk.
Kristallide tunnused on: kõrge järjestuse aste (lühi- ja kaugjärjestuse olemasolu), nende moodustatavate elementaarrakkude teatav sümmeetria ja sellest tulenevalt omaduste anisotroopsus (s.o sõltuvus suunast).
Sõltuvalt sellest, millised osakesed asuvad kristallvõre sõlmedes, eristatakse ioon-, aatom-, molekulaar- ja metallvõre.
Ioonvõre koosneb vastasmärgiga ioonidest, mis vahelduvad sõlmedes. Sel juhul võivad ioonid olla lihtsad (Na +, Cl - ..) ja komplekssed (NH 4 +, NO 3 - ...). Tänu sellele, et ioonside on küllastumata ja mittesuunaline, iseloomustab ioonvõre kõrge kooskõlastusnumbrid(vrd = 6,8) . Koordinatsiooniarv – valitud objekti ümbritsevate lähimate osakeste arv . Tänu suurele ioonse sideme tugevusele on ioonsed kristallvõred tugevad ja nende kristallidel on kõrge sulamistemperatuur. Ioonsete kristallvõredega ühendite näited: NaCl, NH 4 NO 3 jne.
Aatomvõre koosneb kovalentsete sidemetega ühendatud aatomitest, näiteks teemandis, grafiidis. Siinsed koordinatsiooninumbrid määratakse keskse aatomi s-sidemete arvu järgi ümbritsevate aatomitega ja need ei saavuta suuri väärtusi (sageli umbes 4). Kovalentse sideme suure tugevuse tõttu on sellised võred väga tugevad ja aineid iseloomustavad kõrged sulamistemperatuurid. On teada, et teemant on kõige kõvem looduslik aine.
Molekulaarvõre sisaldab sõlmedes molekule, mis on omavahel ühendatud molekulidevaheliste jõudude toimel. Molekulaarvõred on madala tugevusega ja selliste võretega ainetel (tahke H 2, O 2, N 2, CO 2, H 2 O) on tavaliselt madal sulamistemperatuur.
Metallist rest võib tinglikult kujutada positiivselt laetud ioonide kujul, mis paiknevad sõlmedes ja elektronide kujul, mis liiguvad vahekohtades. Siinne koordineerimisnumber ulatub suurte väärtusteni (8-12). Metallvõre tugevus on väga erinev ja sõltub tugevalt võõrlisandite olemasolust. Metallides on keemiline side nn metallist side. Põhimõtteliselt Metallside on kovalentse sideme eritüüp. See tekib metalliaatomite väliste (valents)elektronide pilvede "massiivse" kattumise tagajärjel.
16
Elementide aatomite üks olulisemaid omadusi, mis määrab, milline side nende vahel moodustub - ioonne või kovalentne, on Elektronegatiivsus
, st. ühendis olevate aatomite võime elektrone ligi tõmmata. Elektronegatiivsuse tingimusliku kvantitatiivse hinnangu annab suhtelise elektronegatiivsuse skaala. Perioodidel on üldine tendents elementide elektronegatiivsuse suurenemisele ja rühmades nende vähenemisele. Elemendid on paigutatud nende elektronegatiivsuse järgi jadadesse, mille alusel saab võrrelda erinevatel perioodidel paiknevate elementide elektronegatiivsust. Keemilise sideme tüüp sõltub sellest, kui suur on elementide ühendavate aatomite elektronegatiivsuse väärtuste erinevus. Mida rohkem sidet moodustavate elementide aatomid erinevad elektronegatiivsuselt, seda polaarsem on keemiline side. Tõmmake tüüpide vahele terav joon
keemilised sidemed pole võimalikud. Enamikus ühendites on keemilise sideme tüüp vahepealne; näiteks väga polaarne kovalentne
keemiline side on lähedane ioonsidemele. Sõltuvalt sellest, kummal piirjuhtumil on keemiline side oma olemuselt lähedasem, liigitatakse see kas ioonseks või kovalentseks polaarseks sidemeks. Iooniline side
on polariseeritud kovalentse sideme äärmuslik juhtum, kui jagatud elektronpaar kuulub täielikult ühele aatomitest. Sel juhul realiseerub ühel aatomil täiesti positiivne laeng ja teisel täiesti negatiivne laeng. Seda tüüpi side on iseloomulik sooladele. Näiteks naatriumkloriid on NaCl. Iga aatom annab ühise elektronipaari moodustamiseks ühe elektroni. Cl aga nihutab tekkinud elektronipaari täielikult enda poole ja omandab seeläbi täieliku negatiivse laengu ning Na, millel sel juhul pole välisel elektroonilisel tasandil ainsatki elektroni, on täielik positiivne laeng. Kõige olulisemad erinevused ioonsidemete ja muud tüüpi keemiliste sidemete vahel on suuna puudumine Ja küllastumatus. Seetõttu graviteerivad ioonsete sidemete tõttu tekkinud kristallid vastavate ioonide erinevate tihedate pakkide poole.
17 Molekulide ruumiline struktuur sõltub aatomite vahel tekkiva keemilise sideme olemusest ja seega ka nende elektroonilise kesta struktuurist. Kuna keemilises sidemes võivad osaleda iga interakteeruva aatomi s-, p-, d- ja f-tüüpi elektronid, sõltub molekulide struktuur elektronide tüübist ja arvust, samuti võimalusest moodustada hübriid. võlakirjad. Sageli moodustavad keemilised sidemed elektronid, mis asuvad erinevatel aatomiorbitaalidel (näiteks s - ja p - orbitaalid). Vaatamata sellele osutuvad ühendused võrdse väärtusega ja paiknevad sümmeetriliselt, mis on tagatud aatomiorbitaalide hübridisatsioon . Orbitaalhübridisatsioon on osade orbitaalide kuju muutmine kovalentse sideme moodustumisel orbitaalide efektiivsema kattumise saavutamiseks Hübridisatsiooni tulemusena tekivad uued hübriidorbitaalid, mis on ruumis orienteeritud nii, et pärast nende kattumist teiste aatomite orbitaalidega on tekkinud elektronpaarid üksteisest võimalikult kaugel sõbrad. See minimeerib molekulis olevate elektronide vahelist tõukeenergiat Hübridiseerumine ei ole reaalne protsess. See mõiste võeti kasutusele molekuli geomeetrilise struktuuri kirjeldamiseks. Hübriidsete aatomiorbitaalide kovalentsete sidemete moodustumisel tekkivate osakeste kuju sõltub nende orbitaalide arvust ja tüübist. Sel juhul loovad σ-sidemed osakese jäiga "skeleti":
Hübridisatsioonis osalevad orbitaalid. Hübridisatsiooni tüüp Molekuli ruumiline kuju Näited
S,P sp – hübridisatsioon Lineaarne BeCl2
s, p, p sp 2 – hübridisatsioon Kolmnurkne (tasane trigonaal) AlCl 3
s, p, p, p sp 3 – hübridisatsioon Tetrahedral CH 4
Kui elektronpilved kattuvad piki aatomite keskpunkte ühendavat joont, siis sellist kovalentset sidet nimetatakse sigma ( )-ühendus
Kovalentne side, mis moodustub külgmise kattumise teel R-nimetatakse naabersüsinikuaatomite orbitaale pi( )-ühendus.
