1. Besi huguswa na asidi kuunda chumvi na maji:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O
2. C oksidi za asidi, kutengeneza chumvi na maji:
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
3. Alkali huguswa na oksidi za amphoteric na hidroksidi, kutengeneza chumvi na maji:
2NaOH + Cr 2 O 3 = 2NaCrO 2 + H 2 O
KOH + Cr(OH) 3 = KCrO 2 + 2H 2 O
4. Alkali humenyuka pamoja na chumvi mumunyifu, na kutengeneza msingi dhaifu, mvua, au gesi:
2NaOH + NiCl 2 = Ni(OH) 2 ¯ + 2NaCl
msingi
2KOH + (NH 4) 2 SO 4 = 2NH 3 + 2H 2 O + K 2 SO 4
Ba(OH) 2 + Na 2 CO 3 = BaCO 3 ¯ + 2NaOH
5. Alkali huguswa na baadhi ya metali, ambazo zinalingana na oksidi za amphoteric:
2NaOH + 2Al + 6H 2 O = 2Na + 3H 2
6. Athari ya alkali kwenye kiashirio:
OH - + phenolphthalein ® rangi nyekundu
OH - + litmus ® Rangi ya bluu
7. Mtengano wa besi kadhaa wakati wa joto:
Сu(OH) 2 ® CuO + H 2 O
Hidroksidi za amphoteric – misombo ya kemikali, kuonyesha mali ya besi na asidi zote. Hidroksidi za amphoteric zinalingana na oksidi za amphoteric (tazama aya ya 3.1).
Hidroksidi za amphoteric kawaida huandikwa kwa fomu ya msingi, lakini pia zinaweza kuandikwa kwa fomu ya asidi:
Zn(OH) 2 Û H 2 ZnO 2
msingi
Tabia za kemikali hidroksidi za amphoteric
1. Hidroksidi za amphoteric huingiliana na asidi na oksidi za asidi:
Kuwa(OH) 2 + 2HCl = BeCl 2 + 2H 2 O
Kuwa(OH) 2 + SO 3 = BeSO 4 + H 2 O
2. Kuingiliana na alkali na oksidi za msingi alkali na madini ya alkali ya ardhi:
Al(OH) 3 + NaOH = NaAlO 2 + 2H 2 O;
H 3 AlO 3 asidi metaaluminate ya sodiamu
(H 3 AlO 3 ® HAlO 2 + H 2 O)
2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Hidroksidi zote za amphoteric ni elektroliti dhaifu
Chumvi
Chumvi-Hii vitu tata, yenye ioni za chuma na mabaki ya asidi. Chumvi ni bidhaa za uingizwaji kamili au sehemu ya ioni za hidrojeni na ioni za chuma (au amonia) katika asidi. Aina za chumvi: kati (kawaida), tindikali na msingi.
Chumvi za kati- hizi ni bidhaa za uingizwaji kamili wa cations hidrojeni katika asidi na chuma (au amonia) ions: Na 2 CO 3, NiSO 4, NH 4 Cl, nk.
Kemikali mali ya chumvi kati
1. Chumvi huingiliana na asidi, alkali na chumvi nyingine, na kutengeneza electrolyte dhaifu au precipitate; au gesi:
Ba(NO 3) 2 + H 2 SO 4 = BaSO 4 ¯ + 2HNO 3
Na 2 SO 4 + Ba(OH) 2 = BaSO 4 ¯ + 2NaOH
CaCl 2 + 2AgNO 3 = 2AgCl¯ + Ca(NO 3) 2
2CH 3 COONA + H 2 SO 4 = Na 2 SO 4 + 2CH 3 COOH
NiSO 4 + 2KOH = Ni(OH) 2 ¯ + K 2 SO 4
msingi
NH 4 NO 3 + NaOH = NH 3 + H 2 O + NaNO 3
2. Chumvi huingiliana na metali zinazofanya kazi zaidi. Zaidi chuma hai huondoa ile isiyo na kazi kidogo kutoka kwa suluhisho la chumvi (Kiambatisho 3).
Zn + CuSO 4 = ZnSO 4 + Cu
Chumvi za asidi - hizi ni bidhaa za uingizwaji usio kamili wa cations hidrojeni katika asidi na chuma (au ammoniamu) ions: NaHCO 3, NaH 2 PO 4, Na 2 HPO 4, nk. Chumvi za asidi zinaweza kuundwa tu na asidi ya polybasic. Takriban chumvi zote za asidi huyeyuka sana katika maji.
Kupata chumvi za asidi na kuzibadilisha kuwa chumvi za kati
1. Chumvi ya asidi hupatikana kwa kujibu ziada ya asidi au oksidi ya asidi na msingi:
H 2 CO 3 + NaOH = NaHCO 3 + H 2 O
CO 2 + NaOH = NaHCO 3
2. Wakati asidi ya ziada inapoingiliana na oksidi ya msingi:
2H 2 CO 3 + CaO = Ca(HCO 3) 2 + H 2 O
3. Chumvi ya asidi hupatikana kutoka kwa chumvi za kati kwa kuongeza asidi:
· jina lisilojulikana
Na 2 SO 3 + H 2 SO 3 = 2NaHSO 3;
Na 2 SO 3 + HCl = NaHSO 3 + NaCl
4. Chumvi za asidi hubadilishwa kuwa chumvi za wastani kwa kutumia alkali:
NaHCO 3 + NaOH = Na 2 CO 3 + H 2 O
Chumvi za msingi- hizi ni bidhaa za uingizwaji usio kamili wa vikundi vya hydroxo (OH - ) misingi mabaki ya asidi: MgOHCl, AlOHSO 4, nk. Chumvi za msingi zinaweza kuundwa tu na besi dhaifu za metali za polyvalent. Chumvi hizi kwa ujumla huyeyuka kwa kiasi.
Kupata chumvi za kimsingi na kuzibadilisha kuwa chumvi za kati
1. Chumvi za kimsingi hupatikana kwa kujibu ziada ya msingi na asidi au oksidi ya asidi:
Mg(OH) 2 + HCl = MgOHCl¯ + H 2 O
haidroksi-
kloridi ya magnesiamu
Fe(OH) 3 + SO 3 = FeOHSO 4 ¯ + H 2 O
haidroksi-
chuma (III) sulfate
2. Chumvi za msingi huundwa kutoka kwa chumvi ya kati kwa kuongeza ukosefu wa alkali:
Fe 2 (SO 4) 3 + 2NaOH = 2FeOHSO 4 + Na 2 SO 4
3. Chumvi za kimsingi hubadilishwa kuwa chumvi za wastani kwa kuongeza asidi (ikiwezekana ile inayolingana na chumvi):
MgOHCl + HCl = MgCl 2 + H 2 O
2MgOHCl + H 2 SO 4 = MgCl 2 + MgSO 4 + 2H 2 O
ELECTROLITE
Electrolytes- hizi ni vitu vinavyotengana katika ions katika suluhisho chini ya ushawishi wa molekuli za kutengenezea polar (H 2 O). Kulingana na uwezo wao wa kujitenga (kugawanyika ndani ya ions), elektroliti kwa kawaida hugawanywa katika nguvu na dhaifu. Elektroliti zenye nguvu hutengana karibu kabisa (katika suluhu za dilute), wakati elektroliti dhaifu hujitenga na ioni kwa sehemu tu.
KWA elektroliti zenye nguvu kuhusiana:
· asidi kali(ona uk. 20);
· sababu kali– alkali (tazama uk. 22);
· karibu chumvi zote mumunyifu.
Elektroliti dhaifu ni pamoja na:
asidi dhaifu (tazama uk. 20);
· besi si alkali;
Moja ya sifa kuu za electrolyte dhaifu ni kujitenga mara kwa mara – KWA . Kwa mfano, kwa asidi ya monobasic.
HAI H + +A - ,
ambapo, ni mkusanyiko wa usawa wa H + ions;
- mkusanyiko wa usawa wa anions ya asidi A - ;
- mkusanyiko wa usawa wa molekuli za asidi;
Au kwa msingi dhaifu,
MOH Û M + +OH - ,
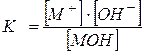 ,
,
ambapo, ni mkusanyiko wa usawa wa M + cations;
- mkusanyiko wa usawa wa ioni za hidroksidi OH - ;
- mkusanyiko wa usawa wa molekuli dhaifu za msingi.
Vipindi vya kujitenga kwa baadhi elektroliti dhaifu(kwa t = 25 ° С)
| Dawa | KWA | Dawa | KWA |
| HCOOH | K = 1.8×10 -4 | H3PO4 | K 1 = 7.5×10 -3 |
| CH3COOH | K = 1.8×10 -5 | K 2 = 6.3×10 -8 | |
| HCN | K = 7.9×10 -10 | K 3 = 1.3×10 -12 | |
| H2CO3 | K 1 = 4.4×10 -7 | HClO | K = 2.9×10 -8 |
| K2 = 4.8×10 -11 | H3BO3 | K 1 = 5.8×10 -10 | |
| HF | K = 6.6×10 -4 | K2 = 1.8×10 -13 | |
| HNO2 | K = 4.0×10 -4 | K 3 = 1.6×10 -14 | |
| H2SO3 | K 1 = 1.7×10 -2 | H2O | K = 1.8×10 -16 |
| K 2 = 6.3×10 -8 | NH 3 × H 2 O | K = 1.8×10 -5 | |
| H2S | K 1 = 1.1×10 -7 | Al(OH) 3 | K 3 = 1.4×10 -9 |
| K2 = 1.0×10 -14 | Zn(OH)2 | K 1 = 4.4×10 -5 | |
| H2SiO3 | K 1 = 1.3×10 -10 | K 2 = 1.5×10 -9 | |
| K2 = 1.6×10 -12 | Cd(OH)2 | K 2 = 5.0×10 -3 | |
| Fe(OH)2 | K 2 = 1.3×10 -4 | Cr(OH)3 | K 3 = 1.0×10 -10 |
| Fe(OH) 3 | K2 = 1.8×10 -11 | Ag(OH) | K = 1.1×10 -4 |
| K 3 = 1.3×10 -12 | Pb(OH)2 | K 1 = 9.6×10 -4 | |
| Cu(OH)2 | K 2 = 3.4×10 -7 | K 2 = 3.0×10 -8 | |
| Ni(OH)2 | K 2 = 2.5×10 -5 |
4.4 Mtengano wa joto besi zisizo na maji.
Besi nyingi zisizo na maji hutengana wakati wa joto. Bidhaa za mtengano zitakuwa oksidi za metali zinazofanana na maji. Joto la kupokanzwa hutegemea chuma ambacho ni sehemu ya msingi na huanzia 200 ° C na hapo juu.
Wacha tuandike athari za mtengano wa zinki, shaba, na hidroksidi za alumini:
Bidhaa za majibu hapo juu ni maji na oksidi za chuma:, na.
4.5 Mwingiliano na chumvi za chuma.
Mmenyuko huu ni tabia ya alkali. Hidroksidi za potasiamu. sodiamu Lithiamu inaingiliana na chumvi za chuma, kama matokeo ya ambayo hidroksidi zisizo na maji za metali hizi hupita:
Kutumia athari hizi, hidroksidi zisizo na maji za metali nyingi hupatikana, ambazo hutumiwa katika awali ya kemikali, dawa, nk.
Sura ya 5. Matumizi ya besi katika kemia na sekta.
Besi hutumiwa sana katika maabara ya kemia na sekta ya kemikali, wanapata matumizi yao katika maisha ya kila siku.
Hebu fikiria matumizi ya besi zinazotumiwa zaidi.
Katika maabara ya kemikali na katika sekta, hidroksidi ya sodiamu ni mojawapo ya vitendanishi maarufu zaidi.
Hidroksidi ya sodiamu,.
Inatumika kutengeneza chumvi mbalimbali za sodiamu: sulfate, nitrate, nitriti, chromate, silicates, au glasi ya maji, Florida, chumvi. asidi za kikaboni. Inatumika katika uzalishaji wa massa kutoka kwa kuni wakati wa kupikia krafti, nyuzi za bandia, sabuni na sabuni, mawakala wa mvua na emulsifiers, rangi, oksidi ya alumini kutoka kwa bauxite, phenoli. Imejumuishwa katika elektroliti kwa chuma cha bluing, metali za oksidi, haswa alumini, kwa michakato ya electrolytic katika teknolojia ya bati na zinki.
Hidroksidi ya potasiamu, .
Hutumika kama nyenzo ya kuanzia kwa utengenezaji wa chumvi nyingi za potasiamu, sabuni za kioevu na dyes kadhaa. Inatumika kama elektroliti, pamoja na hidroksidi ya lithiamu, katika betri za nickel-cadmium, katika mfumo wa suluhisho la pombe kwa utengenezaji wa xanthates - wa kati katika utengenezaji wa mawakala wa kuelea.
Hidroksidi ya amonia, .
Uzalishaji wake ulimwenguni ni takriban tani milioni 10 - 12. Inatumika kama mbolea katika uzalishaji wa chakula cha mifugo ili kuongeza thamani yao ya lishe na kama kihifadhi, katika uzalishaji wa soda, rangi, katika uzalishaji wa electrolytic wa misombo ya manganese, katika mazoezi ya maabara.
Hidroksidi ya kalsiamu,.
Hidroksidi ya kalsiamu (chokaa iliyokatwa) hutumiwa katika utengenezaji wa vifaa vya ujenzi; chokaa cha chokaa hufanywa kutoka kwake. Inatumika kutengeneza bleach (mchanganyiko) na misombo mingine ya kalsiamu, mbolea ya chokaa, na mawakala wa kinga ya mimea. Hidroksidi ya kalsiamu hutumiwa kulainisha maji, ngozi kuwa nyeusi, na kugeuza maji machafu, kutenganisha chumvi za asidi za kikaboni kutoka kwa juisi za mimea.
Hidroksidi ya lithiamu,.
Inatumika kujaza betri za alkali, ambayo huongeza maisha yao, na hutumiwa kwa ajili ya utengenezaji wa enamels na kioo.
Hidroksidi ya magnesiamu,.
Inatumika katika tasnia ya ujenzi, kama sehemu ya vifaa vya miundo inayostahimili moto, kwa utengenezaji wa bidhaa za kemia za kauri. Inatumika katika dawa kama wakala wa kupunguza upole (kwa asidi ya juu juisi ya tumbo).
Maombi ya hidroksidi zingine ambazo hazijajulikana sana zimeorodheshwa katika Jedwali la 3
Jedwali 3. Maombi ya hidroksidi za chuma.
| № | Jina la hidroksidi | Kemikali | Maombi |
| 1. | Hidroksidi ya shaba | Inatumika kama rangi ya glasi, enamels na glazes, mordant kwa vitambaa vya kutia rangi, na kama dawa ya kuua kuvu. Kiimarishaji cha nailoni kwa ajili ya utayarishaji wa reagent ya Schweitzer. | |
| 2. | Hidroksidi ya zinki | Filler ya mpira, sehemu ya rangi, katika dawa ya mifugo kama sehemu ya marashi. | |
| 3. | Hidroksidi ya cobalt | Hutumika kuzalisha vichocheo, rangi,... |
|
| 4. | Cadmium hidroksidi | Inatumika kwa ajili ya utayarishaji wa misombo ya cadmium, kama kitendanishi cha uchambuzi, kwa ajili ya uzalishaji wa molekuli hai katika vyanzo vya sasa vya cadmium. | |
| 5. | Alumini hidroksidi | Inatumika kutengeneza misombo ya alumini, kama kizuia moto katika rangi na plastiki, sehemu ya dawa za meno, na wakala wa kufunika na wa adsorbent katika dawa. | |
| 6. | Berili hidroksidi | Inatumika kutengeneza keramik za kinzani. crucibles, sehemu ya glasi ambayo hupitisha mionzi ya UV vizuri. | |
| 7. | Hidroksidi ya bati | Kwa vitambaa vya etching, hasa hariri. | |
| 8. | Hidroksidi ya risasi | Kwa vitambaa vya etching, kwa ajili ya kufanya kioo, kujaza betri. | |
| 9. | Bismuth hidroksidi | Kutumika katika utengenezaji wa enamels na keramik, kioo na maalum. kioo, kwa ajili ya uzalishaji wa vifaa vya ultrasonic | |
| 10. | Chromium hidroksidi | Inatumika katika kemia ya uchambuzi. | |
| 11. | Hidroksidi ya manganese | Inatumika kupata misombo ya manganese. | |
| 12. | Hidroksidi ya chuma | Msingi wa uzalishaji wa chuma cha chuma, kuchorea rangi |
Hitimisho.
Misingi ni moja ya madarasa dutu isokaboni, ambayo, pamoja na asidi, oksidi na chumvi, hufanya msingi wa kemia isiyo ya kawaida. Zinatumika sana ndani maeneo mbalimbali tasnia ya kemia na kemikali. Kwa msaada wao, mbolea hupatikana, Vifaa vya Ujenzi, kioo cha rangi. Bila wao, tungepoteza betri za alkali nyepesi na za kiuchumi na vifaa vingi vya matibabu.
Kazi ya kazi hii ilikuwa kupanga maarifa juu ya tabaka hili la isokaboni vitu vya kemikali kama misingi, ilikuwa ni lazima kuleta pamoja kemikali zao na mali za kimwili, uzalishaji na matumizi yao katika tasnia.
Inaendelea Tahadhari maalum ilijitolea kuangazia dhana ya besi, kama moja ya madarasa ya dutu isokaboni kulingana na nadharia za kisasa za msingi wa asidi za Brønsted, Lewis, Izmailov. Usanovich. Pia kuzingatiwa mbinu za viwanda kupata alkali kwa kutumia mfano wa hidroksidi ya sodiamu [3, Art. 36 - 42 ]. Umakini mwingi kulipwa kwa njia za kutumia besi katika maisha ya kila siku na katika tasnia ya kemikali, matibabu na ujenzi, ambapo hupata matumizi yao. Maeneo makuu ya matumizi ya vitu maalum yameorodheshwa katika meza maalum ya kumbukumbu kwa urahisi wa matumizi.
Utafiti wa mali ya besi ina umuhimu mkubwa katika masomo ya kemia, na vile vile kwa ukuzaji wa mtazamo wa ulimwengu wa kisayansi.
Orodha ya fasihi iliyotumika.
1. Glinka N. L. kemia ya jumla. - L.: Kemia, 1988. - 702 p.
2. Kreshkov A.P., Yaroslavtsev A.A. Kozi ya kemia ya uchambuzi. - M.: Kemia, 1964. - 430 p.
3. Podobaev N. I. Electrolysis. - M.: Elimu, 1989, 100 p.
4. Nguzo M. E. Kemia ya uchambuzi. - M.: Dawa, 1981. - 286 p.
5. Rabinovich V. A., Khavin Z. Ya. Kratky kitabu cha kumbukumbu ya kemikali. - L.: Kemia, 1978. - 331 p.
6. Kemia: Uchapishaji wa marejeleo/ mh. W. Schröter, K.-H, Lautenschläger, H. Bibrak et al.: Trans. pamoja naye. - M.: Kemia, 1989. - 648 p.
7. Ensaiklopidia ya kemikali katika juzuu 5 / ed. I. L. Knunyants. -M.: Ensaiklopidia ya Soviet, 1990.
8. Shchukirev S. A. Kemia isokaboni. -M.: shule ya kuhitimu, 1970. - 437 p.
Huko Uholanzi, ambapo nchi zote mbili ziliuza pamba, na Waingereza walisaidia Gueuze, ambao waliasi nira ya Uhispania. Chini ya hali hizi, na basi maendeleo ya haraka mahusiano ya ubepari nchini Uingereza Ulimwengu Mpya- sehemu ya nyuma ya Uhispania, hazina tajiri zaidi na soko pana zaidi - ikawa lengo na chambo kwa wasafiri wa Kiingereza, kwa weredi. Wafanyabiashara wa Kiingereza na waungwana. Uharamia ndani ya maji ...
Mti. Hakuna maana katika kuongeza kinzani kinyume kati ya eco- na biocentrism. Inafaa zaidi kuzungumza juu ya kile kinachowaunganisha, kile wanachofanana, ni nini kinachoweza kutumika kama msingi wa jukwaa la kawaida maadili ya mazingira. Haya ni haya yafuatayo pointi muhimu: 1) kila kitu, watu binafsi, aina za viumbe hai, na mifumo ikolojia ina manufaa yao wenyewe, haki, thamani yao ya asili, kwa sababu ni ya thamani...
Kwa 1.5% ya idadi ya watu. Kwa hiyo, niko mbali na swali la nini ni nguvu na nini ni dhaifu asasi za kiraia, ninaendelea na swali la nne katika ratiba yangu - kuhusu mashirika ya kiraia na ukuaji wa uchumi. Mwandishi huyo huyo wa nadharia ya vitendo vya pamoja, ambaye tayari ametajwa na mimi, Mansur Olson, aliuliza sana maslahi Uliza- kuhusu nchi yetu, kwa njia. Huwezi kuonana uso kwa uso. Sisi...
Kusoma jiolojia na sayansi ya udongo, lazima tukubali kwamba kazi ya jiografia ni kusoma jiometri tu, lakini sio mali ya nyenzo. uso wa dunia. Katika uundaji wa hisabati, hii ina maana kwamba kitu cha utafiti wa geomorphology inapaswa kuzingatiwa si mpaka wa kuweka L yenyewe, lakini ramani yake katika nafasi P, i.e. uso katika nafasi ya Euclidean yenye sura tatu, mfano...
Kimwili na Tabia za kemikali misingi. Tahadhari za usalama wakati wa kufanya kazi na alkali. Dhana ya hidroksidi za amphoteric
Besi za mumunyifu wa maji (alkali) ni yabisi nyeupe, mumunyifu sana katika maji. Katika joto la chumba Ca (OH)2 na Sr (OH)2 zina umumunyifu wa chini. Besi zisizoyeyuka katika maji ni yabisi, kwa mfano, Al (OH)3 ni nyeupe, Cu (OH)2 rangi ya bluu, Fe (OH)3 ina rangi ya kahawia.
Besi mumunyifu na isiyoyeyuka huonyesha idadi ya sifa za kawaida na bainifu za kemikali.
1. Athari za ufumbuzi wa alkali kwenye ufumbuzi wa kiashiria (kawaida tu kwa alkali). Katika suluhisho la alkali, litmus na karatasi ya kiashiria cha ulimwengu wote ina rangi ya bluu, machungwa ya methyl ni ya machungwa-njano, na phenolphthalein ni nyekundu.
2. Mwingiliano wa besi na asidi kuunda chumvi na maji - mmenyuko wa neutralization (tabia ya zote mbili. besi za mumunyifu, na isiyoyeyuka):
KOH + HCl = KCl + H2O
3. Mwingiliano wa besi na oksidi za asidi kuunda chumvi na maji (kawaida tu kwa alkali):
2NaOH + CO2 = Na2CO3 + H2O
4. Mwingiliano wa besi na miyeyusho ya chumvi kuunda msingi mwingine na chumvi nyingine (kawaida tu kwa alkali):
2KOH + CuSO4 = K2SO4 + Cu (OH)2 ¯
Mchanganyiko wa chumvi ambayo humenyuka na suluhisho la alkali lazima iwe pamoja na chuma ambacho kinaweza kutengeneza msingi usio na maji.
5. Mtengano misingi isiyoyeyuka inapokanzwa na malezi ya oksidi na maji (tabia tu kwa besi zisizo na maji):
2Fe (OH)3 Fe2O3 + 3H2O
Wakati wa kufanya kazi na alkali, unapaswa kuwa mwangalifu sana, kwani meadows ina vitu vikali sana. Ikiwa suluhisho la alkali linaingia kwenye ngozi yako, lazima uioshe mara moja na maji ya bomba hadi hisia ya utamu itatoweka, kisha suuza (neutralize) na suluhisho. asidi dhaifu(acetic au boric) na uende kwenye kituo cha huduma ya kwanza.
Tayari tumegundua kuwa besi huguswa na asidi katika mmenyuko wa neutralization kuunda chumvi. Besi zilizo na besi, pamoja na asidi zilizo na asidi, haziingii kwenye mmenyuko wa neutralization. Lakini kuna hidroksidi ambazo huguswa na asidi na besi zote, na kutengeneza chumvi. Hidroksidi hizo huitwa amphoteric. Hidroksidi za amphoteric zinaonyesha sifa za besi katika athari na asidi, na sifa za asidi katika athari na besi. Hidroksidi zote za amphoteric hazimunyiki vizuri katika maji. Hizi ni pamoja na hidroksidi ya zinki Zn (OH)2, hidroksidi ya alumini Al (OH)3, hidroksidi ya berili Kuwa (OH)2, chromium (III) hidroksidi Cr (OH)3, ferrum (III) hidroksidi Fe (OH)3 na wengine. Wacha tuzingatie mali ya kemikali ya hidroksidi za amphoteric kwa kutumia hidroksidi ya zinki kama mfano.
1. Mwitikio wa asidi kuunda chumvi na maji:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2. Mwingiliano na alkali kuunda chumvi na maji:
Zn(OH)2 + 2NaOH Na2ZnO2 + 2H2O
