ಆವರ್ತಕ ಕೋಷ್ಟಕದಲ್ಲಿನ ಅಂಶಗಳ ನಿಯೋಜನೆ ಮತ್ತು ರಾಸಾಯನಿಕ ಅಂಶಗಳ ಗುಣಲಕ್ಷಣಗಳ ನಡುವಿನ ಸಂಬಂಧ, ಸರಳ ಪದಾರ್ಥಗಳು, ಹೈಡ್ರೋಜನ್ ಮತ್ತು ಆಮ್ಲಜನಕದೊಂದಿಗೆ ಅಂಶಗಳ ಸಂಯುಕ್ತಗಳು. ಪರಮಾಣು ತ್ರಿಜ್ಯದ ಪರಿಕಲ್ಪನೆ ಮತ್ತು ಅಂಶಗಳ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ
ಆವರ್ತಕ ಕೋಷ್ಟಕದಲ್ಲಿನ ಅಂಶಗಳ ಸ್ಥಾನ ಮತ್ತು ಪರಮಾಣು ತ್ರಿಜ್ಯ, ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ, ಲೋಹೀಯ ಮತ್ತು ಲೋಹವಲ್ಲದ ಗುಣಲಕ್ಷಣಗಳಂತಹ ರಾಸಾಯನಿಕ ಅಂಶಗಳ ಗುಣಲಕ್ಷಣಗಳ ನಡುವಿನ ಸಂಬಂಧವನ್ನು ಪರಿಗಣಿಸೋಣ.
ಪರಮಾಣು ತ್ರಿಜ್ಯವು ಪರಮಾಣುವಿನ ಎಲೆಕ್ಟ್ರಾನ್ ಶೆಲ್ನ ಗಾತ್ರವನ್ನು ತೋರಿಸುವ ಮೌಲ್ಯವಾಗಿದೆ. ಇದು ರಾಸಾಯನಿಕ ಅಂಶಗಳ ಪರಮಾಣುಗಳ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಅವಲಂಬಿಸಿರುವ ಒಂದು ಪ್ರಮುಖ ಪ್ರಮಾಣವಾಗಿದೆ. ಮುಖ್ಯ ಉಪಗುಂಪುಗಳಲ್ಲಿ, ಪರಮಾಣು ನ್ಯೂಕ್ಲಿಯಸ್ನ ಚಾರ್ಜ್ ಹೆಚ್ಚಾದಂತೆ, ಸಂಖ್ಯೆ ಎಲೆಕ್ಟ್ರಾನಿಕ್ ಮಟ್ಟಗಳು, ಆದ್ದರಿಂದ, ಮುಖ್ಯ ಉಪಗುಂಪುಗಳಲ್ಲಿ ಪರಮಾಣು ಸಂಖ್ಯೆಯನ್ನು ಹೆಚ್ಚಿಸುವುದರೊಂದಿಗೆ ಪರಮಾಣು ತ್ರಿಜ್ಯವು ಹೆಚ್ಚಾಗುತ್ತದೆ. ಅವಧಿಗಳಲ್ಲಿ ಪರಮಾಣು ನ್ಯೂಕ್ಲಿಯಸ್ನ ಚಾರ್ಜ್ನಲ್ಲಿ ಹೆಚ್ಚಳವಿದೆ ರಾಸಾಯನಿಕ ಅಂಶ, ಇದು ನ್ಯೂಕ್ಲಿಯಸ್ಗೆ ಹೊರಗಿನ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಹೆಚ್ಚಿದ ಆಕರ್ಷಣೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ. ಇದರ ಜೊತೆಗೆ, ನ್ಯೂಕ್ಲಿಯಸ್ನ ಚಾರ್ಜ್ ಹೆಚ್ಚಾದಂತೆ, ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಸಂಖ್ಯೆಯು ಹೆಚ್ಚಾಗುತ್ತದೆ ಬಾಹ್ಯ ಮಟ್ಟ, ಆದಾಗ್ಯೂ, ಎಲೆಕ್ಟ್ರಾನಿಕ್ ಮಟ್ಟಗಳ ಸಂಖ್ಯೆಯು ಹೆಚ್ಚಾಗುವುದಿಲ್ಲ. ಈ ಕ್ರಮಬದ್ಧತೆಗಳು ನ್ಯೂಕ್ಲಿಯಸ್ ಸುತ್ತಲೂ ಎಲೆಕ್ಟ್ರಾನ್ ಶೆಲ್ ಅನ್ನು ಬಿಗಿಗೊಳಿಸುವುದಕ್ಕೆ ಕಾರಣವಾಗುತ್ತವೆ. ಆದ್ದರಿಂದ, ಅವಧಿಗಳಲ್ಲಿ ಪರಮಾಣು ಸಂಖ್ಯೆಯನ್ನು ಹೆಚ್ಚಿಸುವುದರೊಂದಿಗೆ ಪರಮಾಣು ತ್ರಿಜ್ಯವು ಕಡಿಮೆಯಾಗುತ್ತದೆ.
ಉದಾಹರಣೆಗೆ, O (ಆಮ್ಲಜನಕ), C (ಕಾರ್ಬನ್), Li (ಲಿಥಿಯಂ), F (ಫ್ಲೋರಿನ್), N (ನೈಟ್ರೋಜನ್) ಎಂಬ ರಾಸಾಯನಿಕ ಅಂಶಗಳನ್ನು ಪರಮಾಣು ತ್ರಿಜ್ಯವನ್ನು ಕಡಿಮೆ ಮಾಡುವ ಕ್ರಮದಲ್ಲಿ ಜೋಡಿಸೋಣ. ನೀಡಲಾದ ರಾಸಾಯನಿಕ ಅಂಶಗಳು ಎರಡನೇ ಅವಧಿಯಲ್ಲಿವೆ. ಒಂದು ಅವಧಿಯಲ್ಲಿ, ಹೆಚ್ಚುತ್ತಿರುವ ಪರಮಾಣು ಸಂಖ್ಯೆಯೊಂದಿಗೆ ಪರಮಾಣು ತ್ರಿಜ್ಯವು ಕಡಿಮೆಯಾಗುತ್ತದೆ. ಆದ್ದರಿಂದ, ಸೂಚಿಸಲಾದ ರಾಸಾಯನಿಕ ಅಂಶಗಳನ್ನು ಅವುಗಳ ಸರಣಿ ಸಂಖ್ಯೆಗಳ ಹೆಚ್ಚುತ್ತಿರುವ ಕ್ರಮದಲ್ಲಿ ಬರೆಯಬೇಕು: ಲಿ, ಸಿ, ಎನ್, ಒ, ಎಫ್ (ಲಿಥಿಯಂ, ಕಾರ್ಬನ್, ಸಾರಜನಕ, ಆಮ್ಲಜನಕ, ಫ್ಲೋರಿನ್)
ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಎನ್ನುವುದು ವೇಲೆನ್ಸಿ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಆಕರ್ಷಿಸಲು ಸಂಯುಕ್ತಗಳಲ್ಲಿನ ಪರಮಾಣುವಿನ ಸಾಮರ್ಥ್ಯ, ಅಂದರೆ. ಪರಮಾಣುಗಳ ನಡುವೆ ರಾಸಾಯನಿಕ ಬಂಧಗಳನ್ನು ರೂಪಿಸುವ ಸಹಾಯದಿಂದ ಆ ಎಲೆಕ್ಟ್ರಾನ್ಗಳು. ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯು ಪರಮಾಣು ನ್ಯೂಕ್ಲಿಯಸ್ ಹೊರಗಿನಿಂದ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಆಕರ್ಷಿಸುವ ಸಾಮರ್ಥ್ಯವನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ ಶಕ್ತಿಯ ಮಟ್ಟ. ಬಲವಾದ ಆಕರ್ಷಣೆ, ಹೆಚ್ಚಿನ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ. ಪರಮಾಣು ತ್ರಿಜ್ಯವು ಚಿಕ್ಕದಾಗಿದೆ, ಹೊರಗಿನ ಶಕ್ತಿಯ ಮಟ್ಟದ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ನಡುವಿನ ಆಕರ್ಷಣೆಯ ಬಲವು ಹೆಚ್ಚಾಗುತ್ತದೆ. ಪರಿಣಾಮವಾಗಿ, ಅವಧಿಗಳು ಮತ್ತು ಮುಖ್ಯ ಉಪಗುಂಪುಗಳಲ್ಲಿನ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯ ಬದಲಾವಣೆಯು ಪರಮಾಣು ತ್ರಿಜ್ಯದಲ್ಲಿನ ಬದಲಾವಣೆಗೆ ವಿರುದ್ಧವಾಗಿರುತ್ತದೆ. ಆದ್ದರಿಂದ, ಮುಖ್ಯ ಉಪಗುಂಪುಗಳಲ್ಲಿ, ಹೆಚ್ಚುತ್ತಿರುವ ಪರಮಾಣು ಸಂಖ್ಯೆಯೊಂದಿಗೆ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಕಡಿಮೆಯಾಗುತ್ತದೆ. ಹೆಚ್ಚುತ್ತಿರುವ ಪರಮಾಣು ಸಂಖ್ಯೆಯ ಅವಧಿಗಳಲ್ಲಿ, ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಹೆಚ್ಚಾಗುತ್ತದೆ.
ಉದಾಹರಣೆಗೆ, Br (ಬ್ರೋಮಿನ್), F (ಫ್ಲೋರಿನ್), I (ಅಯೋಡಿನ್), Cl (ಕ್ಲೋರಿನ್) ಎಂಬ ರಾಸಾಯನಿಕ ಅಂಶಗಳನ್ನು ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿಯನ್ನು ಹೆಚ್ಚಿಸುವ ಕ್ರಮದಲ್ಲಿ ಜೋಡಿಸೋಣ. ನೀಡಿರುವ ರಾಸಾಯನಿಕ ಅಂಶಗಳು ಇದರಲ್ಲಿವೆ ಮುಖ್ಯ ಉಪಗುಂಪುಏಳನೇ ಗುಂಪು. ಮುಖ್ಯ ಉಪಗುಂಪುಗಳಲ್ಲಿ, ಹೆಚ್ಚುತ್ತಿರುವ ಪರಮಾಣು ಸಂಖ್ಯೆಯೊಂದಿಗೆ ಎಲೆಕ್ಟ್ರೋನೆಜಿಟಿವಿಟಿ ಕಡಿಮೆಯಾಗುತ್ತದೆ. ಆದ್ದರಿಂದ, ಸೂಚಿಸಲಾದ ರಾಸಾಯನಿಕ ಅಂಶಗಳನ್ನು ಅವುಗಳ ಸರಣಿ ಸಂಖ್ಯೆಗಳ ಕಡಿಮೆ ಕ್ರಮದಲ್ಲಿ ಬರೆಯಬೇಕು: I, Br, Cl, F (ಅಯೋಡಿನ್, ಬ್ರೋಮಿನ್, ಕ್ಲೋರಿನ್, ಫ್ಲೋರಿನ್).
ಲೋಹೀಯ ಗುಣಲಕ್ಷಣಗಳು ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಬಿಟ್ಟುಕೊಡಲು ರಾಸಾಯನಿಕ ಅಂಶಗಳ ಪರಮಾಣುಗಳ ಗುಣಲಕ್ಷಣಗಳಾಗಿವೆ. ಲೋಹೀಯ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುವ ರಾಸಾಯನಿಕ ಅಂಶಗಳು ಸಾಮಾನ್ಯವಾಗಿ ಅವುಗಳ ಹೊರಗಿನ ಶೆಲ್ನಲ್ಲಿ ಒಂದರಿಂದ ಮೂರು ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ. ನಾನ್ಮೆಟಾಲಿಕ್ ಗುಣಲಕ್ಷಣಗಳು ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಸ್ವೀಕರಿಸಲು ರಾಸಾಯನಿಕ ಅಂಶಗಳ ಪರಮಾಣುಗಳ ಗುಣಲಕ್ಷಣಗಳಾಗಿವೆ. ಲೋಹವಲ್ಲದ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುವ ರಾಸಾಯನಿಕ ಅಂಶಗಳು ಸಾಮಾನ್ಯವಾಗಿ ಅವುಗಳ ಹೊರಗಿನ ಶೆಲ್ನಲ್ಲಿ ನಾಲ್ಕರಿಂದ ಎಂಟು ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ. ಬಾಹ್ಯ ಶಕ್ತಿಯ ಮಟ್ಟದಿಂದ ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಹೆಚ್ಚು ಸುಲಭವಾಗಿ ಬಿಟ್ಟುಬಿಡಲಾಗುತ್ತದೆ, ಹೆಚ್ಚಿನ ಲೋಹೀಯ ಗುಣಲಕ್ಷಣಗಳು ಮತ್ತು ಅದರ ಪ್ರಕಾರ, ಲೋಹವಲ್ಲದ ಗುಣಲಕ್ಷಣಗಳು ಕಡಿಮೆಯಾಗುತ್ತವೆ. ಬಾಹ್ಯ ಶಕ್ತಿಯ ಮಟ್ಟದಿಂದ ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಬಿಟ್ಟುಕೊಡುವುದು ಸುಲಭ, ಪರಮಾಣು ತ್ರಿಜ್ಯವು ದೊಡ್ಡದಾಗಿದೆ, ಏಕೆಂದರೆ ನ್ಯೂಕ್ಲಿಯಸ್ ಮತ್ತು ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ನಡುವಿನ ಆಕರ್ಷಣೆಯ ಬಲವು ಅವುಗಳ ನಡುವಿನ ಅಂತರವನ್ನು ಹೆಚ್ಚಿಸುವುದರೊಂದಿಗೆ ಕಡಿಮೆಯಾಗುತ್ತದೆ. ಪರಿಣಾಮವಾಗಿ, ರಾಸಾಯನಿಕ ಅಂಶಗಳ ಲೋಹೀಯ ಗುಣಲಕ್ಷಣಗಳಲ್ಲಿನ ಬದಲಾವಣೆಯು ಅವುಗಳ ಪರಮಾಣು ತ್ರಿಜ್ಯದಲ್ಲಿನ ಬದಲಾವಣೆಯಂತೆಯೇ ಇರುತ್ತದೆ. ಆದ್ದರಿಂದ, ಮುಖ್ಯ ಉಪಗುಂಪುಗಳಲ್ಲಿ, ಹೆಚ್ಚುತ್ತಿರುವ ಸರಣಿ ಸಂಖ್ಯೆಯೊಂದಿಗೆ ಲೋಹೀಯ ಗುಣಲಕ್ಷಣಗಳು ಹೆಚ್ಚಾಗುತ್ತವೆ ಮತ್ತು ಹೆಚ್ಚುತ್ತಿರುವ ಸರಣಿ ಸಂಖ್ಯೆಯೊಂದಿಗೆ, ಲೋಹೀಯ ಗುಣಲಕ್ಷಣಗಳು ಕಡಿಮೆಯಾಗುತ್ತವೆ. ಲೋಹವಲ್ಲದ ಗುಣಲಕ್ಷಣಗಳು, ಇದಕ್ಕೆ ವಿರುದ್ಧವಾಗಿ, ಮುಖ್ಯ ಉಪಗುಂಪುಗಳಲ್ಲಿ ಹೆಚ್ಚುತ್ತಿರುವ ಸರಣಿ ಸಂಖ್ಯೆಯೊಂದಿಗೆ ಕಡಿಮೆಯಾಗುತ್ತವೆ ಮತ್ತು ಹೆಚ್ಚುತ್ತಿರುವ ಸರಣಿ ಸಂಖ್ಯೆಯನ್ನು ಹೊಂದಿರುವ ಅವಧಿಗಳಲ್ಲಿ ಅವು ಹೆಚ್ಚಾಗುತ್ತವೆ.
ಉದಾಹರಣೆಗೆ, ನಾವು ರಾಸಾಯನಿಕ ಅಂಶಗಳನ್ನು Al, S, Mg, Cl, Na ಅನ್ನು ಲೋಹವಲ್ಲದ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೆಚ್ಚಿಸುವ ಕ್ರಮದಲ್ಲಿ ಜೋಡಿಸೋಣ. ನೀಡಲಾದ ರಾಸಾಯನಿಕ ಅಂಶಗಳು ಮೂರನೇ ಅವಧಿಯಲ್ಲಿವೆ. ಅವಧಿಗಳಲ್ಲಿ, ಹೆಚ್ಚುತ್ತಿರುವ ಪರಮಾಣು ಸಂಖ್ಯೆಯೊಂದಿಗೆ ಲೋಹವಲ್ಲದ ಗುಣಲಕ್ಷಣಗಳು ಹೆಚ್ಚಾಗುತ್ತವೆ. ಆದ್ದರಿಂದ, ಸೂಚಿಸಲಾದ ರಾಸಾಯನಿಕ ಅಂಶಗಳನ್ನು ಅವುಗಳ ಸರಣಿ ಸಂಖ್ಯೆಗಳ ಹೆಚ್ಚುತ್ತಿರುವ ಕ್ರಮದಲ್ಲಿ ಬರೆಯಬೇಕು: Na, Mg, Al, S, Cl ಆವರ್ತಕ ಕೋಷ್ಟಕದಲ್ಲಿನ ರಾಸಾಯನಿಕ ಅಂಶಗಳ ಸ್ಥಾನ ಮತ್ತು ಆಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಅನುಗುಣವಾದ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಗುಣಲಕ್ಷಣಗಳ ನಡುವಿನ ಸಂಬಂಧವನ್ನು ಪರಿಗಣಿಸೋಣ. ಇದು ಮೂರನೇ ಅವಧಿಯ ಅಂಶಗಳನ್ನು ಉದಾಹರಣೆಯಾಗಿ ಬಳಸಿಕೊಂಡು ಈ ರಾಸಾಯನಿಕ ಅಂಶಗಳನ್ನು ರೂಪಿಸುತ್ತದೆ. ಮೂರನೇ ಅವಧಿಯು ರಾಸಾಯನಿಕ ಅಂಶಗಳನ್ನು ಒಳಗೊಂಡಿದೆ: Na, Mg, Al, Si, P, S, Cl, Ar
ಈ ಅಂಶಗಳು ಕೆಳಗಿನ ಸಂಯೋಜನೆಯ ಹೆಚ್ಚಿನ ಆಕ್ಸೈಡ್ಗಳನ್ನು ರೂಪಿಸುತ್ತವೆ (ಜಡ ರಾಸಾಯನಿಕ ಅಂಶ ಆರ್ಗಾನ್ ಆಕ್ಸೈಡ್ ಅನ್ನು ರೂಪಿಸುವುದಿಲ್ಲ): Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
ಸೋಡಿಯಂ ಆಕ್ಸೈಡ್ ಮತ್ತು ಮೆಗ್ನೀಸಿಯಮ್ ಆಕ್ಸೈಡ್ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತವೆ ಮೂಲ ಆಕ್ಸೈಡ್ಗಳು, ಅಲ್ಯೂಮಿನಿಯಂ ಆಕ್ಸೈಡ್ ಒಂದು ಆಂಫೊಟೆರಿಕ್ ಆಕ್ಸೈಡ್ ಆಗಿದೆ, ಎಲ್ಲಾ ಆಕ್ಸೈಡ್ಗಳು (ಸಿಲಿಕಾನ್ (IV) ಆಕ್ಸೈಡ್, ಫಾಸ್ಫರಸ್ (V) ಆಕ್ಸೈಡ್, ಸಲ್ಫರ್ (VI) ಆಕ್ಸೈಡ್, ಕ್ಲೋರಿನ್ (VII) ಆಕ್ಸೈಡ್) ಆಮ್ಲೀಯ ಆಕ್ಸೈಡ್ಗಳ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತವೆ. ಜೊತೆಗೆ, Na2O - MgO ಸರಣಿಯಲ್ಲಿ ಮೂಲ ಗುಣಲಕ್ಷಣಗಳು ದುರ್ಬಲಗೊಳ್ಳುತ್ತವೆ ಮತ್ತು SiO2 - P2O5 - SO3 - Cl2O7 ಸರಣಿಯಲ್ಲಿ ಆಮ್ಲ ಗುಣಲಕ್ಷಣಗಳುತೀವ್ರಗೊಳ್ಳುತ್ತಿವೆ.
ಈ ಅವಧಿಯಲ್ಲಿ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಗುಣಲಕ್ಷಣಗಳಲ್ಲಿನ ಬದಲಾವಣೆಯ ಸ್ವರೂಪವನ್ನು ವಿಶ್ಲೇಷಿಸಲು ಸಹ ಸಾಧ್ಯವಿದೆ, ಇದು ಅನುರೂಪವಾಗಿದೆ ಹೆಚ್ಚಿನ ಆಕ್ಸೈಡ್ಗಳು: NaOH, Mg (OH)2, Al (OH)3, H2SiO3, H3PO4, H2SO4, HClO4.
ಸೋಡಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಮತ್ತು ಮೆಗ್ನೀಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಬೇಸ್ಗಳ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತವೆ, ಅಲ್ಯೂಮಿನಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್, ಎಲ್ಲಾ ಇತರ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಆಮ್ಲಗಳ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತವೆ: ಸಿಲಿಕೇಟ್ ಆಮ್ಲ, ಆರ್ಥೋಫಾಸ್ಫೇಟ್ ಆಮ್ಲ, ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲ, ಕ್ಲೋರಿಕ್ ಆಮ್ಲ. ಇದರ ಜೊತೆಗೆ, NaOH - Mg (OH) 2 ಸರಣಿಯಲ್ಲಿ ಮೂಲ ಗುಣಲಕ್ಷಣಗಳು ದುರ್ಬಲಗೊಳ್ಳುತ್ತವೆ ಮತ್ತು H2SiO3 - H3PO4 - H2SO4 - HClO4 ಸರಣಿಯಲ್ಲಿ ಆಮ್ಲೀಯ ಗುಣಲಕ್ಷಣಗಳು ಹೆಚ್ಚಾಗುತ್ತವೆ.
ಹೀಗಾಗಿ, ಕೆಲವು ಅಂಶಗಳ ಸರಣಿಯಲ್ಲಿ, ಮೂಲ ಆಕ್ಸೈಡ್ಗಳ ಗುಣಲಕ್ಷಣಗಳು ಮತ್ತು ಅವುಗಳ ಅನುಗುಣವಾದ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ದುರ್ಬಲಗೊಳ್ಳುತ್ತವೆ ಮತ್ತು ಅದೇ ದಿಕ್ಕಿನಲ್ಲಿ ಆಮ್ಲೀಯ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೆಚ್ಚಿಸಲಾಗುತ್ತದೆ. ಮೂಲದಿಂದ ಪರಿವರ್ತನೆ ಆಮ್ಲ ಆಕ್ಸೈಡ್ಗಳು, ಮತ್ತು, ಅದರ ಪ್ರಕಾರ, ಆಂಫೊಟೆರಿಕ್ ಆಕ್ಸೈಡ್ ಅಥವಾ ಹೈಡ್ರಾಕ್ಸೈಡ್ನಿಂದಾಗಿ ಬೇಸ್ಗಳಿಂದ ಆಮ್ಲಗಳಿಗೆ ಒಂದು ಅವಧಿಯಲ್ಲಿ ನಡೆಸಲಾಗುತ್ತದೆ. ಈ ಮಾದರಿಯು ಎರಡನೇ ಮತ್ತು ಮೂರನೇ ಅವಧಿಗಳಿಗೆ ಮಾನ್ಯವಾಗಿದೆ ಆವರ್ತಕ ಕೋಷ್ಟಕ. ದೀರ್ಘಾವಧಿಯ ಅಂಶಗಳಿಗೆ, ಸಂಕೀರ್ಣ ಮಾದರಿಗಳನ್ನು ಗಮನಿಸಬಹುದು.
ಅಡಿಯಲ್ಲಿ ತ್ರಿಜ್ಯ ಪರಮಾಣುಕೊಟ್ಟಿರುವ ಕೋರ್ ನಡುವಿನ ಅಂತರವನ್ನು ಸೂಚಿಸುತ್ತದೆ ಪರಮಾಣುಮತ್ತು ಅದರ ದೂರದ ಎಲೆಕ್ಟ್ರಾನ್ ಕಕ್ಷೆ. ಇಂದು, ಪರಮಾಣು ತ್ರಿಜ್ಯದ ಮಾಪನದ ಸಾಮಾನ್ಯವಾಗಿ ಅಂಗೀಕರಿಸಲ್ಪಟ್ಟ ಘಟಕವೆಂದರೆ ಪಿಕೋಮೀಟರ್ (pm). ತ್ರಿಜ್ಯವನ್ನು ನಿರ್ಧರಿಸಿ ಪರಮಾಣುಬಹಳ ಸುಲಭ.
ನಿಮಗೆ ಅಗತ್ಯವಿರುತ್ತದೆ
- ಮೆಂಡಲೀವ್ ಅವರ ಆವರ್ತಕ ಕೋಷ್ಟಕ
ಸೂಚನೆಗಳು
ಮೊದಲನೆಯದಾಗಿ, ನೀವು ಸಾಮಾನ್ಯ ಆವರ್ತಕ ಕೋಷ್ಟಕವನ್ನು ಹೊಂದಿರಬೇಕು, ಇದರಲ್ಲಿ ಎಲ್ಲವನ್ನೂ ಕ್ರಮವಾಗಿ ಜೋಡಿಸಲಾಗಿದೆ ಮನುಕುಲಕ್ಕೆ ತಿಳಿದಿದೆರಾಸಾಯನಿಕ ಅಂಶಗಳು. ಯಾವುದೇ ರಸಾಯನಶಾಸ್ತ್ರದ ಉಲ್ಲೇಖ ಪುಸ್ತಕದಲ್ಲಿ ಈ ಕೋಷ್ಟಕವನ್ನು ಕಂಡುಹಿಡಿಯುವುದು ತುಂಬಾ ಸುಲಭ, ಶಾಲಾ ಪಠ್ಯಪುಸ್ತಕ, ಅಥವಾ ಇದನ್ನು ನಿಮ್ಮ ಸ್ಥಳೀಯ ಪುಸ್ತಕದಂಗಡಿಯಲ್ಲಿ ಪ್ರತ್ಯೇಕವಾಗಿ ಖರೀದಿಸಬಹುದು.
ಬಲ ಬದಿಯಲ್ಲಿ ಮೇಲಿನ ಮೂಲೆಯಲ್ಲಿಪ್ರತಿಯೊಂದು ರಾಸಾಯನಿಕ ಅಂಶವು ತನ್ನದೇ ಆದದ್ದಾಗಿದೆ ಕ್ರಮ ಸಂಖ್ಯೆ. ಈ ಸಂಖ್ಯೆಯು ಪರಮಾಣು ಸಂಖ್ಯೆಯೊಂದಿಗೆ ಸಂಪೂರ್ಣವಾಗಿ ಹೊಂದಿಕೆಯಾಗುತ್ತದೆ ತ್ರಿಜ್ಯನೀಡಿದ ಪರಮಾಣು.
ಉದಾಹರಣೆಗೆ, ಕ್ಲೋರಿನ್ನ ಪರಮಾಣು ಸಂಖ್ಯೆ (Cl) 17. ಇದರರ್ಥ ನ್ಯೂಕ್ಲಿಯಸ್ನಿಂದ ದೂರ ಪರಮಾಣುಕ್ಲೋರಿನ್ ತನ್ನ ದೂರದ ಕಕ್ಷೆಗೆ, ಸ್ಥಿರ ಎಲೆಕ್ಟ್ರಾನ್ನ ಚಲನೆಯು 17 ಗಂಟೆಗೆ. ನೀವು ಪರಮಾಣು ತ್ರಿಜ್ಯವನ್ನು ಮಾತ್ರವಲ್ಲ, ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ವಿತರಣೆಯನ್ನೂ ಸಹ ಕಂಡುಹಿಡಿಯಬೇಕಾದರೆ ಎಲೆಕ್ಟ್ರಾನ್ ಕಕ್ಷೆಗಳು, ನಂತರ ಈ ಡೇಟಾವನ್ನು ರಾಸಾಯನಿಕ ಅಂಶದ ಹೆಸರಿನ ಬಲಭಾಗದಲ್ಲಿರುವ ಸಂಖ್ಯೆಗಳ ಕಾಲಮ್ನಿಂದ ಒತ್ತಿಹೇಳಬಹುದು.
ಭೂಮಿಯ ರಚನೆಯನ್ನು ಕೋರ್, ಮ್ಯಾಂಟಲ್ ಮತ್ತು ಕ್ರಸ್ಟ್ ಎಂದು ವಿಂಗಡಿಸಲಾಗಿದೆ. ಮೂಲ - ಕೇಂದ್ರ ಭಾಗ, ಮೇಲ್ಮೈಯಿಂದ ದೂರದಲ್ಲಿದೆ. ನಿಲುವಂಗಿಯು ಕ್ರಸ್ಟ್ ಕೆಳಗೆ ಮತ್ತು ಮೇಲೆ ಇದೆ ಕರ್ನಲ್ಗಳು. ಅಂತಿಮವಾಗಿ, ಕಾರ್ಟೆಕ್ಸ್ ಹೊರಭಾಗವಾಗಿದೆ ಹಾರ್ಡ್ ಶೆಲ್ಗ್ರಹಗಳು.

ಸೂಚನೆಗಳು
ಅಸ್ತಿತ್ವವನ್ನು ಸೂಚಿಸುವ ಮೊದಲಿಗರಲ್ಲಿ ಒಬ್ಬರು ಕರ್ನಲ್ಗಳು 18 ನೇ ಶತಮಾನದಲ್ಲಿ ಬ್ರಿಟಿಷ್ ರಸಾಯನಶಾಸ್ತ್ರಜ್ಞ ಮತ್ತು ಭೌತಶಾಸ್ತ್ರಜ್ಞ ಹೆನ್ರಿ ಕ್ಯಾವೆಂಡಿಶ್. ಅವರು ದ್ರವ್ಯರಾಶಿಯನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡಲು ನಿರ್ವಹಿಸುತ್ತಿದ್ದರು ಮತ್ತು ಸರಾಸರಿ ಸಾಂದ್ರತೆಭೂಮಿ. ಅವರು ಭೂಮಿಯ ಸಾಂದ್ರತೆಯನ್ನು ಮೇಲ್ಮೈಯಲ್ಲಿನ ಬಂಡೆಗಳ ಸಾಂದ್ರತೆಯೊಂದಿಗೆ ಹೋಲಿಸಿದರು. ಎಂದು ಕಂಡುಬಂದಿದೆ ಮೇಲ್ಮೈ ಸಾಂದ್ರತೆಗಮನಾರ್ಹವಾಗಿ ಸರಾಸರಿಗಿಂತ ಕಡಿಮೆ.
ಜರ್ಮನ್ ಭೂಕಂಪಶಾಸ್ತ್ರಜ್ಞ ಇ.ವಿಚರ್ಟ್ ಅಸ್ತಿತ್ವವನ್ನು ಸಾಬೀತುಪಡಿಸಿದರು ಕರ್ನಲ್ಗಳು 1897 ರಲ್ಲಿ ಇಳಿಯಿತು. 1910 ರಲ್ಲಿ ಅಮೇರಿಕನ್ ಭೂಭೌತಶಾಸ್ತ್ರಜ್ಞ ಬಿ ಕರ್ನಲ್ಗಳು– 2900 ಕಿ.ಮೀ. ವಿಜ್ಞಾನಿಗಳ ಪ್ರಕಾರ, ಕೋರ್ ಕಬ್ಬಿಣದ ಸಂಬಂಧವನ್ನು ಹೊಂದಿರುವ ನಿಕಲ್ ಮತ್ತು ಇತರ ಅಂಶಗಳನ್ನು ಒಳಗೊಂಡಿದೆ: ಚಿನ್ನ, ಕಾರ್ಬನ್, ಕೋಬಾಲ್ಟ್, ಜರ್ಮೇನಿಯಮ್ ಮತ್ತು ಇತರರು.
ಸರಾಸರಿ ತ್ರಿಜ್ಯ ಕರ್ನಲ್ಗಳು 3500 ಕಿಲೋಮೀಟರ್ ಆಗಿದೆ. ಜೊತೆಗೆ, ಕಟ್ಟಡದಲ್ಲಿ ಕರ್ನಲ್ಗಳುಭೂಮಿಯು ಘನವನ್ನು ಬಿಡುಗಡೆ ಮಾಡುತ್ತದೆ ಒಳಗಿನ ತಿರುಳು, ಹೊಂದಿರುವ ತ್ರಿಜ್ಯಸುಮಾರು 1300 ಕಿಲೋಮೀಟರ್, ಮತ್ತು ದ್ರವದ ಹೊರಭಾಗ ತ್ರಿಜ್ಯಓಮ್ ಸುಮಾರು 2200 ಕಿಲೋಮೀಟರ್. ಮಧ್ಯದಲ್ಲಿ ಕರ್ನಲ್ಗಳುತಾಪಮಾನವು 5000 ° C ತಲುಪುತ್ತದೆ. ಸಮೂಹ ಕರ್ನಲ್ಗಳುಸುಮಾರು 2 10^24 ಕೆಜಿ ಎಂದು ಅಂದಾಜಿಸಲಾಗಿದೆ.
ಗ್ರಹಗಳ ರಚನೆ ಮತ್ತು ಪರಮಾಣುವಿನ ರಚನೆಯ ನಡುವೆ ಸಾದೃಶ್ಯವನ್ನು ಎಳೆಯಬಹುದು. ಪರಮಾಣು ಕೇಂದ್ರ ಭಾಗವಾದ ನ್ಯೂಕ್ಲಿಯಸ್ ಅನ್ನು ಸಹ ಹೊಂದಿದೆ, ಹೆಚ್ಚಿನ ದ್ರವ್ಯರಾಶಿಯು ನ್ಯೂಕ್ಲಿಯಸ್ನಲ್ಲಿ ಕೇಂದ್ರೀಕೃತವಾಗಿರುತ್ತದೆ. ಆಯಾಮಗಳು ಪರಮಾಣು ನ್ಯೂಕ್ಲಿಯಸ್ಗಳುಹಲವಾರು ಫೆಮ್ಟೋಮೀಟರ್ಗಳನ್ನು ರೂಪಿಸಿ (ಲ್ಯಾಟಿನ್ ಫೆಮ್ಟೊ - 15 ರಿಂದ). "ಫೆಮ್ಟೋ" ಎಂಬ ಪೂರ್ವಪ್ರತ್ಯಯವು ಹತ್ತರಿಂದ ಮೈನಸ್ ಹದಿನೈದನೆಯ ಶಕ್ತಿಯಿಂದ ಗುಣಿಸುವುದು ಎಂದರ್ಥ. ಹೀಗಾಗಿ, ಪರಮಾಣುವಿನ ನ್ಯೂಕ್ಲಿಯಸ್ ಪರಮಾಣುವಿಗಿಂತ 10 ಸಾವಿರ ಪಟ್ಟು ಚಿಕ್ಕದಾಗಿದೆ ಮತ್ತು 10^21 ಪಟ್ಟು ಸಣ್ಣ ಗಾತ್ರಗಳು ಕರ್ನಲ್ಗಳುಭೂಮಿ.
ಮೌಲ್ಯಮಾಪನ ಮಾಡಲು ತ್ರಿಜ್ಯಗ್ರಹಗಳು, ಪರೋಕ್ಷ ಭೂರಾಸಾಯನಿಕ ಮತ್ತು ಜಿಯೋಫಿಸಿಕಲ್ ವಿಧಾನಗಳನ್ನು ಬಳಸಿ. ಪರಮಾಣುವಿನ ಸಂದರ್ಭದಲ್ಲಿ, ಭಾರೀ ನ್ಯೂಕ್ಲಿಯಸ್ಗಳ ಕೊಳೆತವನ್ನು ವಿಶ್ಲೇಷಿಸಲಾಗುತ್ತದೆ, ಜ್ಯಾಮಿತೀಯವನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುವುದಿಲ್ಲ. ತ್ರಿಜ್ಯ, ಎಷ್ಟು ತ್ರಿಜ್ಯಕ್ರಮಗಳು ಪರಮಾಣು ಶಕ್ತಿಗಳು. ಪರಮಾಣುವಿನ ಗ್ರಹಗಳ ರಚನೆಯ ಕಲ್ಪನೆಯನ್ನು ರುದರ್ಫೋರ್ಡ್ ಮುಂದಿಟ್ಟರು. ಸಾಮೂಹಿಕ ಅವಲಂಬನೆ ಕರ್ನಲ್ಗಳುನಿಂದ ತ್ರಿಜ್ಯಆದರೆ ರೇಖಾತ್ಮಕವಾಗಿಲ್ಲ.
ಸೂಚನೆ
ಆವರ್ತಕ ಕೋಷ್ಟಕಕ್ಕೆ ಧನ್ಯವಾದಗಳು, ಪರಮಾಣು ತ್ರಿಜ್ಯವನ್ನು ಮಾತ್ರ ಕಂಡುಹಿಡಿಯುವುದು ತುಂಬಾ ಸುಲಭ, ಆದರೆ ಪರಮಾಣು ದ್ರವ್ಯರಾಶಿ, ಆಣ್ವಿಕ ತೂಕ, ನಿರ್ದಿಷ್ಟ ಅಂಶದ ಅವಧಿ ಮತ್ತು ಸರಣಿ, ಹಾಗೆಯೇ ಕಕ್ಷೆಗಳ ಸಂಖ್ಯೆಯ ಜೊತೆಗೆ ಎಲೆಕ್ಟ್ರಾನ್ ಕಕ್ಷೆಗಳಲ್ಲಿ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ವಿತರಣೆ.
ಪರಮಾಣುವಿನ ಅತ್ಯಂತ ಜನಪ್ರಿಯ ಮಾದರಿಯೆಂದರೆ 1913 ರಲ್ಲಿ ನೀಲ್ಸ್ ಬೋರ್ ಅಳವಡಿಸಿಕೊಂಡರು. ಇದನ್ನು ಗ್ರಹಗಳ ಮಾದರಿ ಎಂದೂ ಕರೆಯುತ್ತಾರೆ. ಗ್ರಹಗಳಂತೆ ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಇದಕ್ಕೆ ಕಾರಣ ಸೌರ ಮಂಡಲ, ಸೂರ್ಯನ ಸುತ್ತ ಚಲಿಸು - ಪರಮಾಣುವಿನ ನ್ಯೂಕ್ಲಿಯಸ್ಗಳು. ಎಲೆಕ್ಟ್ರಾನ್ ಚಲನೆಯ ಕಕ್ಷೆಗಳು ಸ್ಥಿರವಾಗಿರುತ್ತವೆ. ಈ ಮಾದರಿಯ ಅಭಿವೃದ್ಧಿಯು ಹೊಸ ದಿಕ್ಕಿನ ಅಭಿವೃದ್ಧಿಗೆ ಪ್ರಚೋದನೆಯನ್ನು ನೀಡಿತು ಸೈದ್ಧಾಂತಿಕ ಭೌತಶಾಸ್ತ್ರ - ಕ್ವಾಂಟಮ್ ಮೆಕ್ಯಾನಿಕ್ಸ್.
ಎಲೆಕ್ಟ್ರಾನ್ ಚಲನೆಯ ಕಕ್ಷೆಯ ಮೊದಲ ತ್ರಿಜ್ಯವನ್ನು ಬೋರ್ ತ್ರಿಜ್ಯ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ ಮತ್ತು ಮೊದಲ ಕಕ್ಷೆಯಲ್ಲಿರುವ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಶಕ್ತಿಯನ್ನು ಪರಮಾಣುವಿನ ಅಯಾನೀಕರಣ ಶಕ್ತಿ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.
ಉಪಯುಕ್ತ ಸಲಹೆ
ಯಾವುದೇ ಪರಮಾಣುವಿನ ತ್ರಿಜ್ಯವು ಅದರ ನ್ಯೂಕ್ಲಿಯಸ್ನಲ್ಲಿರುವ ಪ್ರೋಟಾನ್ಗಳ ಸಂಖ್ಯೆಗೆ ವಿಲೋಮ ಅನುಪಾತದಲ್ಲಿರುತ್ತದೆ ಎಂಬುದು ಗಮನಿಸಬೇಕಾದ ಸಂಗತಿ. ಚಾರ್ಜ್ಗೆ ಸಮಾನವಾಗಿರುತ್ತದೆಅದರ ತಿರುಳು.
ಪರಮಾಣು ತ್ರಿಜ್ಯವನ್ನು ನಿರ್ಧರಿಸುವುದು ಸಹ ಕೆಲವು ಸಮಸ್ಯೆಗಳನ್ನು ಉಂಟುಮಾಡುತ್ತದೆ.ಮೊದಲನೆಯದಾಗಿ, ಪರಮಾಣು ಕಟ್ಟುನಿಟ್ಟಾಗಿ ವ್ಯಾಖ್ಯಾನಿಸಲಾದ ಮೇಲ್ಮೈ ಮತ್ತು ತ್ರಿಜ್ಯವನ್ನು ಹೊಂದಿರುವ ಗೋಳವಲ್ಲ. ಪರಮಾಣು ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಮೋಡದಿಂದ ಸುತ್ತುವರಿದ ನ್ಯೂಕ್ಲಿಯಸ್ ಎಂದು ನೆನಪಿಸಿಕೊಳ್ಳಿ. ನ್ಯೂಕ್ಲಿಯಸ್ನಿಂದ ದೂರ ಹೋಗುವಾಗ ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಕಂಡುಹಿಡಿಯುವ ಸಂಭವನೀಯತೆಯು ಕ್ರಮೇಣ ಒಂದು ನಿರ್ದಿಷ್ಟ ಗರಿಷ್ಠಕ್ಕೆ ಹೆಚ್ಚಾಗುತ್ತದೆ ಮತ್ತು ನಂತರ ಕ್ರಮೇಣ ಕಡಿಮೆಯಾಗುತ್ತದೆ, ಆದರೆ ಆಗುತ್ತದೆ ಶೂನ್ಯಕ್ಕೆ ಸಮಅಪರಿಮಿತ ದೊಡ್ಡ ಅಂತರದಲ್ಲಿ ಮಾತ್ರ. ಎರಡನೆಯದಾಗಿ, ತ್ರಿಜ್ಯವನ್ನು ನಿರ್ಧರಿಸಲು ನಾವು ಕೆಲವು ಸ್ಥಿತಿಯನ್ನು ಆರಿಸಿದರೆ, ಅಂತಹ ತ್ರಿಜ್ಯವನ್ನು ಇನ್ನೂ ಪ್ರಾಯೋಗಿಕವಾಗಿ ಅಳೆಯಲಾಗುವುದಿಲ್ಲ.
ಪ್ರಯೋಗವು ನಮಗೆ ಇಂಟರ್ನ್ಯೂಕ್ಲಿಯರ್ ದೂರವನ್ನು ಮಾತ್ರ ನಿರ್ಧರಿಸಲು ಅನುಮತಿಸುತ್ತದೆ, ಅಂದರೆ, ಬಂಧದ ಉದ್ದಗಳು (ಮತ್ತು ನಂತರ ಅಂಜೂರ 2.21 ರ ಶೀರ್ಷಿಕೆಯಲ್ಲಿ ಕೆಲವು ಮೀಸಲಾತಿಗಳೊಂದಿಗೆ). ಅವುಗಳನ್ನು ನಿರ್ಧರಿಸಲು, ಎಕ್ಸ್-ರೇ ಡಿಫ್ರಾಕ್ಷನ್ ವಿಶ್ಲೇಷಣೆ ಅಥವಾ ಎಲೆಕ್ಟ್ರಾನ್ ಡಿಫ್ರಾಕ್ಷನ್ ವಿಧಾನವನ್ನು (ಎಲೆಕ್ಟ್ರಾನ್ ಡಿಫ್ರಾಕ್ಷನ್ ಆಧಾರದ ಮೇಲೆ) ಬಳಸಲಾಗುತ್ತದೆ. ಪರಮಾಣುವಿನ ತ್ರಿಜ್ಯ ಎಂದು ಊಹಿಸಲಾಗಿದೆ ಅರ್ಧಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆಒಂದೇ ಪರಮಾಣುಗಳ ನಡುವಿನ ಚಿಕ್ಕ ಅಂತರ ಪರಮಾಣು ಅಂತರ.
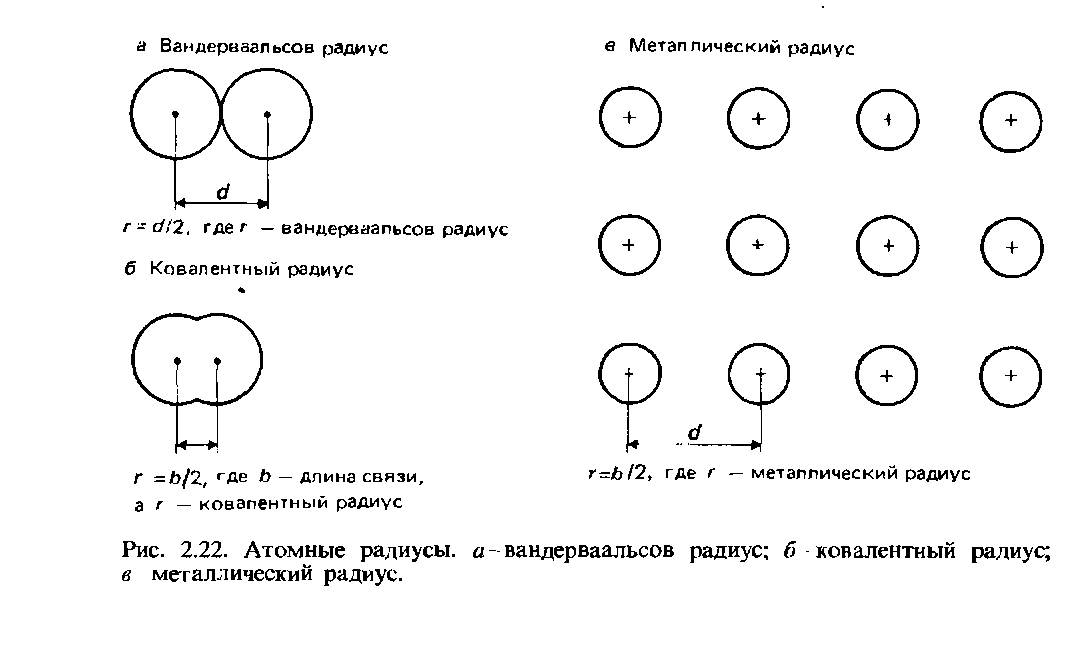
ವಾಂಡರ್ ವಾಲ್ಸ್ ತ್ರಿಜ್ಯ. ಬಂಧವಿಲ್ಲದ ಪರಮಾಣುಗಳಿಗೆ, ಚಿಕ್ಕ ಅಂತರ ಪರಮಾಣು ಅಂತರದ ಅರ್ಧವನ್ನು ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ತ್ರಿಜ್ಯ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಈ ವ್ಯಾಖ್ಯಾನವನ್ನು ಅಂಜೂರದಿಂದ ವಿವರಿಸಲಾಗಿದೆ. 2.22.
ಅಕ್ಕಿ. 2.21. ಲಿಂಕ್ ಉದ್ದ. ಅಣುಗಳು ನಿರಂತರವಾಗಿ ಕಂಪಿಸುವುದರಿಂದ, ಇಂಟರ್ನ್ಯೂಕ್ಲಿಯರ್ ದೂರ ಅಥವಾ ಬಂಧದ ಉದ್ದವು ಸ್ಥಿರ ಮೌಲ್ಯವನ್ನು ಹೊಂದಿರುವುದಿಲ್ಲ. ಈ ರೇಖಾಚಿತ್ರವು ಸರಳವಾದ ಡಯಾಟಮಿಕ್ ಅಣುವಿನ ರೇಖೀಯ ಕಂಪನವನ್ನು ಕ್ರಮಬದ್ಧವಾಗಿ ಪ್ರತಿನಿಧಿಸುತ್ತದೆ. ಕಂಪನಗಳು ಬಂಧದ ಉದ್ದವನ್ನು ಎರಡು ಬಂಧಿತ ಪರಮಾಣುಗಳ ಕೇಂದ್ರಗಳ ನಡುವಿನ ಅಂತರವನ್ನು ಸರಳವಾಗಿ ವ್ಯಾಖ್ಯಾನಿಸಲು ಅನುಮತಿಸುವುದಿಲ್ಲ. ಇನ್ನಷ್ಟು ನಿಖರವಾದ ವ್ಯಾಖ್ಯಾನಈ ರೀತಿ ಕಾಣುತ್ತದೆ: ಬಂಧದ ಉದ್ದವು ಬಂಧಿತ ಪರಮಾಣುಗಳ ನಡುವಿನ ಅಂತರವಾಗಿದೆ, ಎರಡು ಪರಮಾಣುಗಳ ದ್ರವ್ಯರಾಶಿಯ ಕೇಂದ್ರಗಳ ನಡುವೆ ಅಳೆಯಲಾಗುತ್ತದೆ ಮತ್ತು ಕನಿಷ್ಠ ಬಂಧ ಶಕ್ತಿಗೆ ಅನುಗುಣವಾಗಿರುತ್ತದೆ. ಕನಿಷ್ಠ ಶಕ್ತಿಯನ್ನು ಮೋರ್ಸ್ ಕರ್ವ್ನಲ್ಲಿ ತೋರಿಸಲಾಗಿದೆ (ಚಿತ್ರ 2.1 ನೋಡಿ).

ಕೋಷ್ಟಕ 2.6. ಇಂಗಾಲ ಮತ್ತು ಸಲ್ಫರ್ ಅಲೋಟ್ರೋಪ್ಗಳ ಸಾಂದ್ರತೆ ಕೋಷ್ಟಕ 2.7. ಕಾರ್ಬನ್-ಕಾರ್ಬನ್ ಬಂಧಗಳ ಉದ್ದ
ಕೋವೆಲೆಂಟ್ ತ್ರಿಜ್ಯಗಳು.ಕೋವೆಲೆಂಟ್ ತ್ರಿಜ್ಯವನ್ನು ಪರಸ್ಪರ ಬಂಧಿತವಾಗಿರುವ ಎರಡು ಒಂದೇ ಪರಮಾಣುಗಳ ನಡುವಿನ ಅಂತರ ನ್ಯೂಕ್ಲಿಯರ್ ಅಂತರದ ಅರ್ಧದಷ್ಟು (ಬಂಧದ ಉದ್ದ) ಎಂದು ವ್ಯಾಖ್ಯಾನಿಸಲಾಗಿದೆ ಕೋವೆಲನ್ಸಿಯ ಬಂಧ (ಚಿತ್ರ 2.22, ಬಿ). ಉದಾಹರಣೆಯಾಗಿ, ಕ್ಲೋರಿನ್ ಅಣು Cl2 ಅನ್ನು ತೆಗೆದುಕೊಳ್ಳೋಣ, ಅದರ ಬಂಧದ ಉದ್ದವು 0.1988 nm ಆಗಿದೆ. ಕ್ಲೋರಿನ್ನ ಕೋವೆಲನ್ಸಿಯ ತ್ರಿಜ್ಯವು 0.0944 nm ಎಂದು ಊಹಿಸಲಾಗಿದೆ.
ಒಂದು ಅಂಶದ ಪರಮಾಣುವಿನ ಕೋವೆಲನ್ಸಿಯ ತ್ರಿಜ್ಯವನ್ನು ತಿಳಿದುಕೊಳ್ಳುವುದರಿಂದ, ನೀವು ಇನ್ನೊಂದು ಅಂಶದ ಪರಮಾಣುವಿನ ಕೋವೆಲನ್ಸಿಯ ತ್ರಿಜ್ಯವನ್ನು ಲೆಕ್ಕ ಹಾಕಬಹುದು. ಉದಾಹರಣೆಗೆ, ಪ್ರಾಯೋಗಿಕವಾಗಿ ಸೆಟ್ ಮೌಲ್ಯ CH3Cl ನಲ್ಲಿ C-Cl ಬಾಂಡ್ ಉದ್ದವು 0.1767 nm ಆಗಿದೆ. ಈ ಮೌಲ್ಯದಿಂದ ಕ್ಲೋರಿನ್ನ ಕೋವೆಲನ್ಸಿಯ ತ್ರಿಜ್ಯವನ್ನು (0.0994 nm) ಕಳೆಯುವುದರಿಂದ, ಇಂಗಾಲದ ಕೋವೆಲೆಂಟ್ ತ್ರಿಜ್ಯವು 0.0773 nm ಎಂದು ನಾವು ಕಂಡುಕೊಳ್ಳುತ್ತೇವೆ. ಈ ಲೆಕ್ಕಾಚಾರದ ವಿಧಾನವು ಸಂಕಲನದ ತತ್ವವನ್ನು ಆಧರಿಸಿದೆ, ಅದರ ಪ್ರಕಾರ ಪರಮಾಣು ತ್ರಿಜ್ಯಗಳು ಪಾಲಿಸುತ್ತವೆ ಸರಳ ಕಾನೂನುಜೊತೆಗೆ. ಹೀಗಾಗಿ, C-Cl ಬಂಧದ ಉದ್ದವು ಕಾರ್ಬನ್ ಮತ್ತು ಕ್ಲೋರಿನ್ನ ಕೋವೆಲನ್ಸಿಯ ತ್ರಿಜ್ಯಗಳ ಮೊತ್ತವಾಗಿದೆ. ಸಂಕಲನದ ತತ್ವವು ಸರಳ ಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳಿಗೆ ಮಾತ್ರ ಅನ್ವಯಿಸುತ್ತದೆ. ಡಬಲ್ ಮತ್ತು ಟ್ರಿಪಲ್ ಕೋವೆಲನ್ಸಿಯ ಬಂಧಗಳು ಚಿಕ್ಕದಾಗಿದೆ (ಕೋಷ್ಟಕ 2.7).
ಸರಳ ಕೋವೆಲನ್ಸಿಯ ಬಂಧದ ಉದ್ದವು ಅಣುವಿನಲ್ಲಿ ಅದರ ಪರಿಸರವನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ. ಉದಾಹರಣೆಗೆ, ಉದ್ದ C-H ಬಾಂಡ್ಗಳು 0.1070 nm ನಿಂದ ಟ್ರಿಬ್ಸ್ಟಿಟ್ಯೂಟೆಡ್ ಕಾರ್ಬನ್ ಪರಮಾಣುವಿನಿಂದ CH3CN ಸಂಯುಕ್ತದಲ್ಲಿ 0.115 nm ವರೆಗೆ ಬದಲಾಗುತ್ತದೆ.
ಲೋಹದ ತ್ರಿಜ್ಯ. ಲೋಹೀಯ ತ್ರಿಜ್ಯವು ನೆರೆಯ ಅಯಾನುಗಳ ನಡುವಿನ ಅಂತರ ಪರಮಾಣು ಅಂತರದ ಅರ್ಧದಷ್ಟು ಸಮಾನವಾಗಿರುತ್ತದೆ ಎಂದು ಊಹಿಸಲಾಗಿದೆ ಸ್ಫಟಿಕ ಜಾಲರಿಲೋಹ (ಚಿತ್ರ 2.22, ಸಿ). ಪರಮಾಣು ತ್ರಿಜ್ಯ ಎಂಬ ಪದವು ಸಾಮಾನ್ಯವಾಗಿ ಲೋಹವಲ್ಲದ ಅಂಶಗಳ ಪರಮಾಣುಗಳ ಕೋವೆಲನ್ಸಿಯ ತ್ರಿಜ್ಯವನ್ನು ಸೂಚಿಸುತ್ತದೆ ಮತ್ತು ಲೋಹೀಯ ತ್ರಿಜ್ಯ ಎಂಬ ಪದವು ಲೋಹೀಯ ಅಂಶಗಳ ಪರಮಾಣುಗಳನ್ನು ಸೂಚಿಸುತ್ತದೆ.
ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯ. ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯವು ಸ್ಫಟಿಕದಂತಹ ಅಯಾನಿಕ್ ಸಂಯುಕ್ತದಲ್ಲಿ (ಉಪ್ಪು) ಪಕ್ಕದ ಮೊನೊಟಾಮಿಕ್ (ಸರಳ) ಅಯಾನುಗಳ ನಡುವಿನ ಅಂತರ ಪರಮಾಣು ಅಂತರದ ಎರಡು ಭಾಗಗಳಲ್ಲಿ ಒಂದಾಗಿದೆ.ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯವನ್ನು ನಿರ್ಧರಿಸುವುದು ಸಾಕಷ್ಟು ಸಮಸ್ಯೆಗಳಿಂದ ಕೂಡಿದೆ, ಏಕೆಂದರೆ ಇಂಟರ್ಯಾನಿಕ್ ದೂರವನ್ನು ಪ್ರಾಯೋಗಿಕವಾಗಿ ಅಳೆಯಲಾಗುತ್ತದೆ ಮತ್ತು ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯವಲ್ಲ. ಆಂತರಿಕ ಅಂತರಗಳು ಸ್ಫಟಿಕ ಜಾಲರಿಯಲ್ಲಿ ಅಯಾನುಗಳ ಪ್ಯಾಕಿಂಗ್ ಅನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ. ಅಂಜೂರದಲ್ಲಿ. 2.23 ಮೂರು ತೋರಿಸುತ್ತದೆ ಸಂಭವನೀಯ ಮಾರ್ಗಗಳುಸ್ಫಟಿಕ ಜಾಲರಿಯಲ್ಲಿ ಅಯಾನುಗಳ ಪ್ಯಾಕಿಂಗ್. ದುರದೃಷ್ಟವಶಾತ್, ಪ್ರಾಯೋಗಿಕವಾಗಿ ಅಳೆಯಲಾದ ಇಂಟರ್ಯಾನಿಕ್ ದೂರಗಳು
ಅಕ್ಕಿ. 2.23. ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯಗಳು, ಸಿ-ಅಯಾನುಗಳು ಪರಸ್ಪರ ಸ್ಪರ್ಶಿಸುತ್ತವೆ, ಆದರೆ ಕ್ಯಾಟಯಾನುಗಳು ಅಯಾನುಗಳನ್ನು ಸ್ಪರ್ಶಿಸುವುದಿಲ್ಲ; b-cations ಅಯಾನುಗಳೊಂದಿಗೆ ಸಂಪರ್ಕದಲ್ಲಿವೆ, ಆದರೆ ಅಯಾನುಗಳು ಪರಸ್ಪರ ಸಂಪರ್ಕದಲ್ಲಿಲ್ಲ; ಅಯಾನುಗಳ ಸಾಂಪ್ರದಾಯಿಕವಾಗಿ ಅಂಗೀಕರಿಸಲ್ಪಟ್ಟ ವ್ಯವಸ್ಥೆಗೆ, ಇದರಲ್ಲಿ ಕ್ಯಾಟಯಾನುಗಳು ಅಯಾನುಗಳೊಂದಿಗೆ ಸಂಪರ್ಕದಲ್ಲಿರುತ್ತವೆ ಮತ್ತು ಅಯಾನುಗಳು ಪರಸ್ಪರ ಸಂಪರ್ಕದಲ್ಲಿರುತ್ತವೆ. ದೂರವನ್ನು ಪ್ರಾಯೋಗಿಕವಾಗಿ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ. ಇದು ಅಯಾನ್ನ ತ್ರಿಜ್ಯದ ಎರಡು ಪಟ್ಟು ಎಂದು ತೆಗೆದುಕೊಳ್ಳಲಾಗಿದೆ. ಇದು ಅಯಾನು ಮತ್ತು ಕ್ಯಾಷನ್ನ ತ್ರಿಜ್ಯಗಳ ಮೊತ್ತವಾದ ಇಂಟರ್ಯಾನಿಕ್ ದೂರ b ಅನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡಲು ನಮಗೆ ಅನುಮತಿಸುತ್ತದೆ. ಇಂಟರ್ಯಾನಿಕ್ ದೂರವನ್ನು ತಿಳಿದುಕೊಳ್ಳುವುದು b, ನಾವು ಕ್ಯಾಷನ್ನ ತ್ರಿಜ್ಯವನ್ನು ಲೆಕ್ಕ ಹಾಕಬಹುದು.
ಈ ಮೂರು ಪ್ಯಾಕೇಜಿಂಗ್ ವಿಧಾನಗಳಲ್ಲಿ ಯಾವುದನ್ನು ಪ್ರತಿಯೊಂದರಲ್ಲೂ ವಾಸ್ತವವಾಗಿ ಕೈಗೊಳ್ಳಲಾಗುತ್ತದೆ ಎಂದು ನಿರ್ಣಯಿಸಲು ನಮಗೆ ಅನುಮತಿಸಬೇಡಿ ನಿರ್ದಿಷ್ಟ ಪ್ರಕರಣ. ಎರಡು ಅಯಾನುಗಳ ತ್ರಿಜ್ಯಕ್ಕೆ ಅನುಗುಣವಾದ ಎರಡು ಭಾಗಗಳಾಗಿ ಇಂಟರ್ಯಾನಿಕ್ ದೂರವನ್ನು ವಿಭಜಿಸುವ ಅನುಪಾತವನ್ನು ಕಂಡುಹಿಡಿಯುವುದು ಸಮಸ್ಯೆಯಾಗಿದೆ, ಬೇರೆ ರೀತಿಯಲ್ಲಿ ಹೇಳುವುದಾದರೆ, ಒಂದು ಅಯಾನು ವಾಸ್ತವವಾಗಿ ಎಲ್ಲಿ ಕೊನೆಗೊಳ್ಳುತ್ತದೆ ಮತ್ತು ಇನ್ನೊಂದು ಎಲ್ಲಿ ಪ್ರಾರಂಭವಾಗುತ್ತದೆ ಎಂಬುದನ್ನು ನಿರ್ಧರಿಸಲು. ತೋರಿಸಿರುವಂತೆ, ಉದಾಹರಣೆಗೆ, ಅಂಜೂರದಲ್ಲಿ. 2.12, ಈ ಪ್ರಶ್ನೆಯನ್ನು ಕಾರ್ಡ್ಗಳಿಂದಲೂ ಪರಿಹರಿಸಲಾಗುವುದಿಲ್ಲ ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆಲವಣಗಳು ಈ ತೊಂದರೆಯನ್ನು ನಿವಾರಿಸಲು, ಇದನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಊಹಿಸಲಾಗಿದೆ: 1) ಆಂತರಿಕ ಅಂತರವು ಎರಡು ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯಗಳ ಮೊತ್ತವಾಗಿದೆ, 2) ಅಯಾನುಗಳು ಗೋಳಾಕಾರದ ಆಕಾರದಲ್ಲಿರುತ್ತವೆ ಮತ್ತು 3) ಪಕ್ಕದ ಗೋಳಗಳು ಪರಸ್ಪರ ಸಂಪರ್ಕದಲ್ಲಿರುತ್ತವೆ. ಕೊನೆಯ ಊಹೆಯು ಅಂಜೂರದಲ್ಲಿ ತೋರಿಸಿರುವ ಅಯಾನು ಪ್ಯಾಕಿಂಗ್ ವಿಧಾನಕ್ಕೆ ಅನುರೂಪವಾಗಿದೆ. 2.23, f. ಒಂದು ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯ ತಿಳಿದಿದ್ದರೆ, ಇತರ ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯಗಳನ್ನು ಸಂಯೋಜಕತೆಯ ತತ್ವದ ಆಧಾರದ ಮೇಲೆ ಲೆಕ್ಕ ಹಾಕಬಹುದು.
ತ್ರಿಜ್ಯದ ಹೊಂದಾಣಿಕೆ ವಿವಿಧ ರೀತಿಯ. ಕೋಷ್ಟಕದಲ್ಲಿ 2.8 3 ನೇ ಅವಧಿಯ ಮೂರು ಅಂಶಗಳಿಗೆ ವಿವಿಧ ರೀತಿಯ ತ್ರಿಜ್ಯಗಳ ಮೌಲ್ಯಗಳನ್ನು ತೋರಿಸುತ್ತದೆ. ಹೆಚ್ಚಿನದನ್ನು ನೋಡುವುದು ಸುಲಭ ದೊಡ್ಡ ಮೌಲ್ಯಗಳುಅಯಾನಿಕ್ ಮತ್ತು ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ತ್ರಿಜ್ಯಕ್ಕೆ ಸೇರಿದೆ.ಅಂಜೂರದಲ್ಲಿ. 11.9 ಆರ್ಗಾನ್ ಹೊರತುಪಡಿಸಿ, 3 ನೇ ಅವಧಿಯ ಎಲ್ಲಾ ಅಂಶಗಳಿಗೆ ಅಯಾನುಗಳು ಮತ್ತು ಪರಮಾಣುಗಳ ಗಾತ್ರಗಳನ್ನು ಹೋಲಿಸುತ್ತದೆ. ಪರಮಾಣುಗಳ ಗಾತ್ರವನ್ನು ಅವುಗಳ ಕೋವೆಲನ್ಸಿಯ ತ್ರಿಜ್ಯದಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ. ಕ್ಯಾಟಯಾನುಗಳು ಪರಮಾಣುಗಳಿಗಿಂತ ಚಿಕ್ಕದಾಗಿದೆ ಮತ್ತು ಅಯಾನುಗಳು ಎಂದು ಗಮನಿಸಬೇಕು ದೊಡ್ಡ ಗಾತ್ರಗಳುಅದೇ ಅಂಶಗಳ ಪರಮಾಣುಗಳಿಗಿಂತ. ಎಲ್ಲಾ ವಿಧದ ತ್ರಿಜ್ಯಗಳಿಂದ ಪ್ರತಿ ಅಂಶಕ್ಕೆ ಚಿಕ್ಕ ಮೌಲ್ಯಯಾವಾಗಲೂ ಕ್ಯಾಷನ್ ತ್ರಿಜ್ಯಕ್ಕೆ ಸೇರಿದೆ.
ಕೋಷ್ಟಕ 2.8. ವಿವಿಧ ರೀತಿಯ ಪರಮಾಣು ತ್ರಿಜ್ಯಗಳ ಹೋಲಿಕೆ


ಪ್ರಾಯೋಗಿಕ ನಿರ್ಣಯ.ಸರಳ ಅಣುಗಳು ಮತ್ತು ಪಾಲಿಟಾಮಿಕ್ ಅಯಾನುಗಳ ಆಕಾರವನ್ನು ನಿರ್ಧರಿಸಲು, ಅಥವಾ ಹೆಚ್ಚು ನಿಖರವಾಗಿ, ಬಂಧದ ಉದ್ದಗಳು ಮತ್ತು ಬಂಧದ ಕೋನಗಳು (ಬಂಧಗಳ ನಡುವಿನ ಕೋನಗಳು), ವಿವಿಧ ಪ್ರಾಯೋಗಿಕ ವಿಧಾನಗಳು. ಇವುಗಳಲ್ಲಿ ಮೈಕ್ರೋವೇವ್ ಸ್ಪೆಕ್ಟ್ರೋಸ್ಕೋಪಿ, ಹಾಗೆಯೇ ವಿವರ್ತನೆಯನ್ನು ಅಧ್ಯಯನ ಮಾಡುವ ವಿಧಾನಗಳು ಸೇರಿವೆ ಕ್ಷ-ಕಿರಣಗಳು(ಎಕ್ಸರೆ ವಿವರ್ತನೆ), ನ್ಯೂಟ್ರಾನ್ಗಳು (ನ್ಯೂಟ್ರಾನ್ ಡಿಫ್ರಾಕ್ಷನ್) ಅಥವಾ ಎಲೆಕ್ಟ್ರಾನ್ಗಳು (ಎಲೆಕ್ಟ್ರಾನ್ ಡಿಫ್ರಾಕ್ಷನ್). ಮುಂದಿನ ಅಧ್ಯಾಯವು ಎಕ್ಸ್-ರೇ ಡಿಫ್ರಾಕ್ಷನ್ ಅನ್ನು ಹೇಗೆ ನಿರ್ಧರಿಸಲು ಬಳಸಬಹುದು ಎಂಬುದನ್ನು ವಿವರಿಸುತ್ತದೆ ಸ್ಫಟಿಕ ರಚನೆ. ಆದಾಗ್ಯೂ, ಎಲೆಕ್ಟ್ರಾನ್ ಡಿಫ್ರಾಕ್ಷನ್ (ಎಲೆಕ್ಟ್ರಾನ್ ಡಿಫ್ರಾಕ್ಷನ್ ಅನ್ನು ಅಧ್ಯಯನ ಮಾಡುವ ವಿಧಾನ) ಸಾಮಾನ್ಯವಾಗಿ ಅನಿಲ ಹಂತದಲ್ಲಿ ಸರಳ ಅಣುಗಳ ಆಕಾರವನ್ನು ನಿರ್ಧರಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ. ಈ ವಿಧಾನವು ಬಳಕೆಯನ್ನು ಆಧರಿಸಿದೆ ತರಂಗ ಗುಣಲಕ್ಷಣಗಳುಎಲೆಕ್ಟ್ರಾನ್ಗಳು. ಅಧ್ಯಯನದಲ್ಲಿರುವ ಅನಿಲದ ಮಾದರಿಯ ಮೂಲಕ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಕಿರಣವನ್ನು ರವಾನಿಸಲಾಗುತ್ತದೆ. ಅನಿಲ ಅಣುಗಳು ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಚದುರಿಸುತ್ತವೆ, ಇದರ ಪರಿಣಾಮವಾಗಿ ವಿವರ್ತನೆಯ ಮಾದರಿ ಉಂಟಾಗುತ್ತದೆ. ಅದನ್ನು ವಿಶ್ಲೇಷಿಸುವ ಮೂಲಕ, ಅಣುಗಳಲ್ಲಿ ಬಂಧದ ಉದ್ದ ಮತ್ತು ಬಂಧದ ಕೋನಗಳನ್ನು ನಿರ್ಧರಿಸಲು ಸಾಧ್ಯವಿದೆ. ಈ ವಿಧಾನವು X- ಕಿರಣಗಳ ಚದುರುವಿಕೆಯಿಂದ ರೂಪುಗೊಂಡ ವಿವರ್ತನೆಯ ಮಾದರಿಯ ವಿಶ್ಲೇಷಣೆಯಲ್ಲಿ ಬಳಸಿದಂತೆಯೇ ಇರುತ್ತದೆ.
ಪರಮಾಣು ತ್ರಿಜ್ಯಗಳು ಪರಮಾಣು ತ್ರಿಜ್ಯಗಳು
ಅಣುಗಳು ಮತ್ತು ಸ್ಫಟಿಕಗಳಲ್ಲಿ ಇಂಟರ್ಟಾಮಿಕ್ (ಅಂತರನ್ಯೂಕ್ಲಿಯರ್) ಅಂತರವನ್ನು ಅಂದಾಜು ಮಾಡಲು ಸಾಧ್ಯವಾಗಿಸುವ ಗುಣಲಕ್ಷಣಗಳು. ಪರಮಾಣು ತ್ರಿಜ್ಯಗಳು 0.1 nm ಕ್ರಮದಲ್ಲಿವೆ. ಎಕ್ಸ್-ರೇ ಡೇಟಾದಿಂದ ಮುಖ್ಯವಾಗಿ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ ರಚನಾತ್ಮಕ ವಿಶ್ಲೇಷಣೆ.
ಪರಮಾಣು ತ್ರಿಜ್ಯಪರಮಾಣು ತ್ರಿಜ್ಯ, ಅಣುಗಳು ಮತ್ತು ಸ್ಫಟಿಕಗಳಲ್ಲಿನ ಅಂತರ ಪರಮಾಣು (ಅಂತರ್ನ್ಯೂಕ್ಲಿಯರ್) ಅಂತರವನ್ನು ಅಂದಾಜು ಮಾಡಲು ಅನುಮತಿಸುವ ಗುಣಲಕ್ಷಣಗಳು.
ಪರಮಾಣು ಅಥವಾ ಅಯಾನಿನ ಪರಿಣಾಮಕಾರಿ ತ್ರಿಜ್ಯವನ್ನು ಅದರ ಕ್ರಿಯೆಯ ಗೋಳದ ತ್ರಿಜ್ಯವೆಂದು ಅರ್ಥೈಸಲಾಗುತ್ತದೆ ಮತ್ತು ಪರಮಾಣು (ಅಯಾನ್) ಅನ್ನು ಸಂಕುಚಿತಗೊಳಿಸಲಾಗದ ಚೆಂಡು ಎಂದು ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ. ಪರಮಾಣುವಿನ ಗ್ರಹಗಳ ಮಾದರಿಯನ್ನು ಬಳಸಿಕೊಂಡು, ಅದನ್ನು ಕಕ್ಷೆಯಲ್ಲಿ ಸುತ್ತುವ ನ್ಯೂಕ್ಲಿಯಸ್ ಎಂದು ಪ್ರತಿನಿಧಿಸಲಾಗುತ್ತದೆ. (ಸೆಂ.ಮೀ.ಆರ್ಬಿಟಲ್ಸ್)ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ತಿರುಗುತ್ತವೆ. ಮೆಂಡಲೀವ್ ಆವರ್ತಕ ಕೋಷ್ಟಕದಲ್ಲಿನ ಅಂಶಗಳ ಅನುಕ್ರಮವು ಭರ್ತಿ ಮಾಡುವ ಅನುಕ್ರಮಕ್ಕೆ ಅನುರೂಪವಾಗಿದೆ ಎಲೆಕ್ಟ್ರಾನಿಕ್ ಚಿಪ್ಪುಗಳು. ಅಯಾನಿನ ಪರಿಣಾಮಕಾರಿ ತ್ರಿಜ್ಯವು ಎಲೆಕ್ಟ್ರಾನ್ ಚಿಪ್ಪುಗಳ ಭರ್ತಿಯ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿರುತ್ತದೆ, ಆದರೆ ಇದು ಹೊರಗಿನ ಕಕ್ಷೆಯ ತ್ರಿಜ್ಯಕ್ಕೆ ಸಮನಾಗಿರುವುದಿಲ್ಲ. ಪರಿಣಾಮಕಾರಿ ತ್ರಿಜ್ಯವನ್ನು ನಿರ್ಧರಿಸಲು, ಸ್ಫಟಿಕ ರಚನೆಯಲ್ಲಿನ ಪರಮಾಣುಗಳು (ಅಯಾನುಗಳು) ಸ್ಪರ್ಶಿಸುವ ಕಟ್ಟುನಿಟ್ಟಿನ ಚೆಂಡುಗಳಾಗಿ ಪ್ರತಿನಿಧಿಸಲ್ಪಡುತ್ತವೆ, ಆದ್ದರಿಂದ ಅವುಗಳ ಕೇಂದ್ರಗಳ ನಡುವಿನ ಅಂತರವು ತ್ರಿಜ್ಯದ ಮೊತ್ತಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ. ಪರಮಾಣು ಮತ್ತು ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯಗಳನ್ನು ಇಂಟರ್ಟಾಮಿಕ್ ಅಂತರಗಳ ಎಕ್ಸ್-ರೇ ಮಾಪನಗಳಿಂದ ಪ್ರಾಯೋಗಿಕವಾಗಿ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ ಮತ್ತು ಕ್ವಾಂಟಮ್ ಯಾಂತ್ರಿಕ ಪರಿಕಲ್ಪನೆಗಳ ಆಧಾರದ ಮೇಲೆ ಸೈದ್ಧಾಂತಿಕವಾಗಿ ಲೆಕ್ಕಹಾಕಲಾಗುತ್ತದೆ.
ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯಗಳ ಗಾತ್ರಗಳು ಈ ಕೆಳಗಿನ ನಿಯಮಗಳನ್ನು ಪಾಲಿಸುತ್ತವೆ:
1. ಆವರ್ತಕ ಕೋಷ್ಟಕದ ಒಂದು ಲಂಬಸಾಲಿನೊಳಗೆ, ಅಯಾನುಗಳ ತ್ರಿಜ್ಯಗಳು c ಸಮಾನ ಶುಲ್ಕಹೆಚ್ಚಾಗುವುದರೊಂದಿಗೆ ಹೆಚ್ಚಳ ಪರಮಾಣು ಸಂಖ್ಯೆ, ಎಲೆಕ್ಟ್ರಾನ್ ಶೆಲ್ಗಳ ಸಂಖ್ಯೆಯು ಹೆಚ್ಚಾಗುತ್ತದೆ ಮತ್ತು ಆದ್ದರಿಂದ ಪರಮಾಣುವಿನ ಗಾತ್ರ.
2. ಅದೇ ಅಂಶಕ್ಕೆ, ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯವು ಹೆಚ್ಚಾಗುವುದರೊಂದಿಗೆ ಹೆಚ್ಚಾಗುತ್ತದೆ ಋಣಾತ್ಮಕ ಶುಲ್ಕಮತ್ತು ಹೆಚ್ಚುತ್ತಿರುವಾಗ ಕಡಿಮೆಯಾಗುತ್ತದೆ ಧನಾತ್ಮಕ ಆವೇಶ. ಅಯಾನ್ ತ್ರಿಜ್ಯ ತ್ರಿಜ್ಯಕ್ಕಿಂತ ಹೆಚ್ಚುಕ್ಯಾಶನ್, ಏಕೆಂದರೆ ಅಯಾನು ಹೆಚ್ಚಿನ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ ಮತ್ತು ಕ್ಯಾಷನ್ ಕೊರತೆಯನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಉದಾಹರಣೆಗೆ, Fe, Fe 2+, Fe 3+ ಗಾಗಿ ಪರಿಣಾಮಕಾರಿ ತ್ರಿಜ್ಯವು ಕ್ರಮವಾಗಿ 0.126, 0.080 ಮತ್ತು 0.067 nm ಆಗಿದೆ, Si 4-, Si, Si 4+ ಗೆ ಪರಿಣಾಮಕಾರಿ ತ್ರಿಜ್ಯವು 0.198, 0.118 ಮತ್ತು 0.040 nm ಆಗಿದೆ.
3. ಪರಮಾಣುಗಳು ಮತ್ತು ಅಯಾನುಗಳ ಗಾತ್ರಗಳು ಮೆಂಡಲೀವ್ ವ್ಯವಸ್ಥೆಯ ಆವರ್ತಕತೆಯನ್ನು ಅನುಸರಿಸುತ್ತವೆ; ವಿನಾಯಿತಿಗಳು ಸಂಖ್ಯೆ 57 (ಲ್ಯಾಂಥನಮ್) ನಿಂದ ಸಂಖ್ಯೆ 71 (ಲುಟೆಟಿಯಮ್) ವರೆಗಿನ ಅಂಶಗಳಾಗಿವೆ, ಅಲ್ಲಿ ಪರಮಾಣುಗಳ ತ್ರಿಜ್ಯಗಳು ಹೆಚ್ಚಾಗುವುದಿಲ್ಲ, ಆದರೆ ಏಕರೂಪವಾಗಿ ಕಡಿಮೆಯಾಗುತ್ತವೆ (ಲ್ಯಾಂಥನೈಡ್ ಸಂಕೋಚನ ಎಂದು ಕರೆಯಲ್ಪಡುತ್ತವೆ), ಮತ್ತು ಸಂಖ್ಯೆ 89 (ಆಕ್ಟಿನಿಯಮ್) ನಿಂದ ನಂತರದ ಅಂಶಗಳು (ಆಕ್ಟಿನೈಡ್ ಸಂಕೋಚನ ಎಂದು ಕರೆಯಲ್ಪಡುವ).
ರಾಸಾಯನಿಕ ಅಂಶದ ಪರಮಾಣು ತ್ರಿಜ್ಯವು ಸಮನ್ವಯ ಸಂಖ್ಯೆಯನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ (ಸೆಂ.ಮೀ.ಸಮನ್ವಯ ಸಂಖ್ಯೆ). ಸಮನ್ವಯ ಸಂಖ್ಯೆಯಲ್ಲಿನ ಹೆಚ್ಚಳವು ಯಾವಾಗಲೂ ಪರಸ್ಪರ ಅಂತರಗಳ ಹೆಚ್ಚಳದೊಂದಿಗೆ ಇರುತ್ತದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಎರಡು ವಿಭಿನ್ನ ಸಮನ್ವಯ ಸಂಖ್ಯೆಗಳಿಗೆ ಅನುಗುಣವಾದ ಪರಮಾಣು ತ್ರಿಜ್ಯಗಳ ಮೌಲ್ಯಗಳಲ್ಲಿನ ಸಾಪೇಕ್ಷ ವ್ಯತ್ಯಾಸವು ರಾಸಾಯನಿಕ ಬಂಧದ ಪ್ರಕಾರವನ್ನು ಅವಲಂಬಿಸಿರುವುದಿಲ್ಲ (ಹೋಲಿಸಲಾದ ಸಮನ್ವಯ ಸಂಖ್ಯೆಗಳೊಂದಿಗೆ ರಚನೆಗಳಲ್ಲಿನ ಬಂಧದ ಪ್ರಕಾರವು ಒಂದೇ ಆಗಿರುತ್ತದೆ). ಸಮನ್ವಯ ಸಂಖ್ಯೆಯಲ್ಲಿನ ಬದಲಾವಣೆಯೊಂದಿಗೆ ಪರಮಾಣು ತ್ರಿಜ್ಯದಲ್ಲಿನ ಬದಲಾವಣೆಯು ಬಹುರೂಪಿ ರೂಪಾಂತರಗಳ ಸಮಯದಲ್ಲಿ ಪರಿಮಾಣದ ಬದಲಾವಣೆಗಳ ಪ್ರಮಾಣವನ್ನು ಗಮನಾರ್ಹವಾಗಿ ಪರಿಣಾಮ ಬೀರುತ್ತದೆ. ಉದಾಹರಣೆಗೆ, ಕಬ್ಬಿಣವನ್ನು ತಂಪಾಗಿಸುವಾಗ, ಅದರ ರೂಪಾಂತರವು ಮುಖ-ಕೇಂದ್ರಿತ ಘನ ಲ್ಯಾಟಿಸ್ನೊಂದಿಗೆ 906 o C ನಲ್ಲಿ ನಡೆಯುವ ದೇಹ-ಕೇಂದ್ರಿತ ಘನ ಲ್ಯಾಟಿಸ್ನೊಂದಿಗೆ ಮಾರ್ಪಾಡು ಮಾಡಲು, ಪರಿಮಾಣದಲ್ಲಿ 9% ರಷ್ಟು ಹೆಚ್ಚಳದೊಂದಿಗೆ ಇರಬೇಕು. ವಾಸ್ತವದಲ್ಲಿ ಪರಿಮಾಣದ ಹೆಚ್ಚಳವು 0.8% ಆಗಿದೆ. 12 ರಿಂದ 8 ರ ಸಮನ್ವಯ ಸಂಖ್ಯೆಯಲ್ಲಿನ ಬದಲಾವಣೆಯಿಂದಾಗಿ, ಕಬ್ಬಿಣದ ಪರಮಾಣು ತ್ರಿಜ್ಯವು 3% ರಷ್ಟು ಕಡಿಮೆಯಾಗುತ್ತದೆ ಎಂಬುದು ಇದಕ್ಕೆ ಕಾರಣ. ಅಂದರೆ, ಪಾಲಿಮಾರ್ಫಿಕ್ ರೂಪಾಂತರಗಳ ಸಮಯದಲ್ಲಿ ಪರಮಾಣು ತ್ರಿಜ್ಯದಲ್ಲಿನ ಬದಲಾವಣೆಗಳು ಪರಮಾಣು ತ್ರಿಜ್ಯವು ಬದಲಾಗದೆ ಇದ್ದಲ್ಲಿ ಸಂಭವಿಸಬೇಕಾದ ಪರಿಮಾಣದ ಬದಲಾವಣೆಗಳಿಗೆ ಹೆಚ್ಚಾಗಿ ಸರಿದೂಗಿಸುತ್ತದೆ. ಅಂಶಗಳ ಪರಮಾಣು ತ್ರಿಜ್ಯಗಳು ಒಂದೇ ಸಮನ್ವಯ ಸಂಖ್ಯೆಯನ್ನು ಹೊಂದಿದ್ದರೆ ಮಾತ್ರ ಅವುಗಳನ್ನು ಹೋಲಿಸಬಹುದು.
ಪರಮಾಣು (ಅಯಾನಿಕ್) ತ್ರಿಜ್ಯಗಳು ಸಹ ರಾಸಾಯನಿಕ ಬಂಧದ ಪ್ರಕಾರವನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ.
ಜೊತೆ ಹರಳುಗಳಲ್ಲಿ ಲೋಹದ ಬಂಧ (ಸೆಂ.ಮೀ.ಮೆಟಲ್ ಲಿಂಕ್)ಪರಮಾಣು ತ್ರಿಜ್ಯವನ್ನು ಹತ್ತಿರದ ಪರಮಾಣುಗಳ ನಡುವಿನ ಅಂತರ ಪರಮಾಣು ಅಂತರದ ಅರ್ಧದಷ್ಟು ಎಂದು ವ್ಯಾಖ್ಯಾನಿಸಲಾಗಿದೆ. ಘನ ಪರಿಹಾರಗಳ ಸಂದರ್ಭದಲ್ಲಿ (ಸೆಂ.ಮೀ.ಘನ ಪರಿಹಾರಗಳು)ಲೋಹೀಯ ಪರಮಾಣು ತ್ರಿಜ್ಯಗಳು ಸಂಕೀರ್ಣ ರೀತಿಯಲ್ಲಿ ಬದಲಾಗುತ್ತವೆ.
ಕೋವೆಲನ್ಸಿಯ ಬಂಧವನ್ನು ಹೊಂದಿರುವ ಅಂಶಗಳ ಕೋವೆಲನ್ಸಿಯ ತ್ರಿಜ್ಯವನ್ನು ಒಂದೇ ಕೋವೆಲನ್ಸಿಯ ಬಂಧದಿಂದ ಸಂಪರ್ಕಿಸಲಾದ ಹತ್ತಿರದ ಪರಮಾಣುಗಳ ನಡುವಿನ ಅಂತರ ಪರಮಾಣು ಅಂತರದ ಅರ್ಧದಷ್ಟು ಎಂದು ತಿಳಿಯಲಾಗುತ್ತದೆ. ಕೋವೆಲನ್ಸಿಯ ತ್ರಿಜ್ಯದ ವೈಶಿಷ್ಟ್ಯವೆಂದರೆ ಒಂದೇ ಸಮನ್ವಯ ಸಂಖ್ಯೆಗಳೊಂದಿಗೆ ವಿಭಿನ್ನ ಕೋವೆಲನ್ಸಿಯ ರಚನೆಗಳಲ್ಲಿ ಅವುಗಳ ಸ್ಥಿರತೆ. ಆದ್ದರಿಂದ, ಅಂತರಗಳು ಏಕ ಬಂಧಗಳುವಜ್ರದಲ್ಲಿ ಎಸ್-ಎಸ್ ಮತ್ತು ಸ್ಯಾಚುರೇಟೆಡ್ ಹೈಡ್ರೋಕಾರ್ಬನ್ಗಳುಒಂದೇ ಮತ್ತು 0.154 nm ಗೆ ಸಮಾನವಾಗಿರುತ್ತದೆ.
ಅಯಾನಿಕ್ ಬಂಧಗಳನ್ನು ಹೊಂದಿರುವ ಪದಾರ್ಥಗಳಲ್ಲಿ ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯ (ಸೆಂ.ಮೀ.ಅಯಾನಿಕ್ ಬಾಂಡ್)ಹತ್ತಿರದ ಅಯಾನುಗಳ ನಡುವಿನ ಅಂತರದ ಅರ್ಧದಷ್ಟು ಮೊತ್ತವನ್ನು ನಿರ್ಧರಿಸಲಾಗುವುದಿಲ್ಲ. ನಿಯಮದಂತೆ, ಕ್ಯಾಟಯಾನುಗಳು ಮತ್ತು ಅಯಾನುಗಳ ಗಾತ್ರಗಳು ತೀವ್ರವಾಗಿ ಭಿನ್ನವಾಗಿರುತ್ತವೆ. ಇದರ ಜೊತೆಗೆ, ಅಯಾನುಗಳ ಸಮ್ಮಿತಿಯು ಗೋಳಾಕಾರದಿಂದ ಭಿನ್ನವಾಗಿರುತ್ತದೆ. ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯವನ್ನು ಅಂದಾಜು ಮಾಡಲು ಹಲವಾರು ವಿಧಾನಗಳಿವೆ. ಈ ವಿಧಾನಗಳ ಆಧಾರದ ಮೇಲೆ, ಅಂಶಗಳ ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯಗಳನ್ನು ಅಂದಾಜಿಸಲಾಗಿದೆ, ಮತ್ತು ನಂತರ ಇತರ ಅಂಶಗಳ ಅಯಾನಿಕ್ ತ್ರಿಜ್ಯಗಳನ್ನು ಪ್ರಾಯೋಗಿಕವಾಗಿ ನಿರ್ಧರಿಸಿದ ಇಂಟರ್ಟಾಮಿಕ್ ಅಂತರದಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ.
ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ತ್ರಿಜ್ಯಗಳು ಪರಮಾಣುಗಳ ಪರಿಣಾಮಕಾರಿ ಗಾತ್ರಗಳನ್ನು ನಿರ್ಧರಿಸುತ್ತವೆ ಉದಾತ್ತ ಅನಿಲಗಳು. ಇದರ ಜೊತೆಗೆ, ವ್ಯಾನ್ ಡೆರ್ ವಾಲ್ಸ್ ಪರಮಾಣು ತ್ರಿಜ್ಯಗಳು ಪರಸ್ಪರ ಸಂಪರ್ಕ ಹೊಂದಿರದ ಹತ್ತಿರದ ಒಂದೇ ಪರಮಾಣುಗಳ ನಡುವಿನ ಅಂತರದ ಅಂತರದ ಅರ್ಧದಷ್ಟು ಎಂದು ಪರಿಗಣಿಸಲಾಗಿದೆ. ರಾಸಾಯನಿಕ ಬಂಧ, ಅಂದರೆ ವಿವಿಧ ಅಣುಗಳಿಗೆ ಸೇರಿದವು (ಉದಾಹರಣೆಗೆ, ಆಣ್ವಿಕ ಸ್ಫಟಿಕಗಳಲ್ಲಿ).
ಲೆಕ್ಕಾಚಾರಗಳು ಮತ್ತು ನಿರ್ಮಾಣಗಳಲ್ಲಿ ಪರಮಾಣು (ಅಯಾನಿಕ್) ತ್ರಿಜ್ಯಗಳನ್ನು ಬಳಸುವಾಗ, ಅವುಗಳ ಮೌಲ್ಯಗಳನ್ನು ಒಂದು ವ್ಯವಸ್ಥೆಯ ಪ್ರಕಾರ ನಿರ್ಮಿಸಲಾದ ಕೋಷ್ಟಕಗಳಿಂದ ತೆಗೆದುಕೊಳ್ಳಬೇಕು.
ವಿಶ್ವಕೋಶ ನಿಘಂಟು. 2009 .
ಇತರ ನಿಘಂಟುಗಳಲ್ಲಿ "ಪರಮಾಣು ತ್ರಿಜ್ಯಗಳು" ಏನೆಂದು ನೋಡಿ:
ಪರಮಾಣುಗಳ ಗುಣಲಕ್ಷಣಗಳು ಅಣುಗಳು ಮತ್ತು ಸ್ಫಟಿಕಗಳಲ್ಲಿನ ಅಂತರ ಪರಮಾಣು (ಅಂತರ್ನ್ಯೂಕ್ಲಿಯರ್) ಅಂತರವನ್ನು ಅಂದಾಜು ಮಾಡಲು ಸಾಧ್ಯವಾಗಿಸುತ್ತದೆ. ಪರಮಾಣುಗಳು ಸ್ಪಷ್ಟವಾದ ಗಡಿಗಳನ್ನು ಹೊಂದಿಲ್ಲ, ಆದಾಗ್ಯೂ, ಕ್ವಾಂಟಮ್ನ ಪರಿಕಲ್ಪನೆಗಳ ಪ್ರಕಾರ. ಯಂತ್ರಶಾಸ್ತ್ರ, ಒಂದು ನಿರ್ದಿಷ್ಟ ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಕಂಡುಹಿಡಿಯುವ ಸಂಭವನೀಯತೆ ಕೋರ್ನಿಂದ ದೂರ ... ... ಭೌತಿಕ ವಿಶ್ವಕೋಶ
ಅಣುಗಳು ಮತ್ತು ಸ್ಫಟಿಕಗಳಲ್ಲಿನ ಅಂತರ ಪರಮಾಣು (ಅಂತರ್ನ್ಯೂಕ್ಲಿಯರ್) ಅಂತರವನ್ನು ಅಂದಾಜು ಮಾಡಲು ಅನುಮತಿಸುವ ಗುಣಲಕ್ಷಣಗಳು. ಎಕ್ಸ್-ರೇ ರಚನಾತ್ಮಕ ವಿಶ್ಲೇಷಣೆ ಡೇಟಾದಿಂದ ಮುಖ್ಯವಾಗಿ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ... ಬಿಗ್ ಎನ್ಸೈಕ್ಲೋಪೀಡಿಕ್ ಡಿಕ್ಷನರಿ
ಪರಮಾಣುಗಳ ಪರಿಣಾಮಕಾರಿ ಗುಣಲಕ್ಷಣಗಳು, ಅಣುಗಳು ಮತ್ತು ಸ್ಫಟಿಕಗಳಲ್ಲಿನ ಅಂತರಪರಮಾಣು (ಅಂತರ್ನ್ಯೂಕ್ಲಿಯರ್) ಅಂತರವನ್ನು ಅಂದಾಜು ಮಾಡಲು ಅನುವು ಮಾಡಿಕೊಡುತ್ತದೆ. ಕ್ವಾಂಟಮ್ ಮೆಕ್ಯಾನಿಕ್ಸ್ನ ಪರಿಕಲ್ಪನೆಗಳ ಪ್ರಕಾರ, ಪರಮಾಣುಗಳು ಸ್ಪಷ್ಟವಾದ ಗಡಿಗಳನ್ನು ಹೊಂದಿಲ್ಲ, ಆದರೆ ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಕಂಡುಹಿಡಿಯುವ ಸಂಭವನೀಯತೆ ... ... ರಾಸಾಯನಿಕ ವಿಶ್ವಕೋಶ
ಪರಮಾಣುಗಳ ಗುಣಲಕ್ಷಣಗಳು ವಸ್ತುಗಳಲ್ಲಿನ ಪರಸ್ಪರ ಅಂತರವನ್ನು ಅಂದಾಜು ಮಾಡಲು ಸಾಧ್ಯವಾಗಿಸುತ್ತದೆ. ಕ್ವಾಂಟಮ್ ಮೆಕ್ಯಾನಿಕ್ಸ್ ಪ್ರಕಾರ, ಪರಮಾಣುವಿಗೆ ಯಾವುದೇ ನಿರ್ದಿಷ್ಟ ಗಡಿಗಳಿಲ್ಲ, ಆದರೆ ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಕಂಡುಹಿಡಿಯುವ ಸಂಭವನೀಯತೆ ದೂರವನ್ನು ನೀಡಲಾಗಿದೆಪರಮಾಣುವಿನ ನ್ಯೂಕ್ಲಿಯಸ್ನಿಂದ ಆರಂಭವಾಗಿ... ... ಗ್ರೇಟ್ ಸೋವಿಯತ್ ಎನ್ಸೈಕ್ಲೋಪೀಡಿಯಾ
