Розчинення як фізико- хімічний процес
Розчини утворюються при взаємодії розчинника та розчиненої речовини. Процес взаємодії розчинника та розчиненої речовини називається сольватацією (якщо розчинником є вода – гідратацією).

Рис.1 Процес розчинення електролітів.
Розчинення протікає з утворенням різних за формою та міцністю продуктів - гідратів. При цьому беруть участь сили як фізичної, так і хімічної природи. Процес розчинення внаслідок такого роду взаємодій компонентів супроводжується різними тепловими явищами.
Енергетичною характеристикоюрозчинення є теплота утворення розчину, що розглядається як алгебраїчна суматеплових ефектів усіх ендо- та екзотермічних стадій процесу. Найбільш значними серед них є:
– процеси, що поглинають тепло - руйнування кристалічних ґрат, розриви хімічних зв'язків у молекулах;
- Що виділяють тепло процеси - утворення продуктів взаємодії розчиненої речовини з розчинником (гідрати) та ін.
Якщо енергія руйнування кристалічних ґратменше енергії гідратації розчиненої речовини, розчинення йде з виділенням теплоти (спостерігається розігрівання). Так, розчинення NaOH – екзотермічний процес: на руйнування кристалічних ґрат витрачається 884 кДж/моль, а при утворенні гідратованих іонів Na+ та OH- виділяється відповідно 422 та 510 кДж/моль.
Якщо енергія кристалічних ґрат більше енергії гідратації, то розчинення протікає з поглинанням теплоти (при приготуванні водного розчину NH 4 NO 3 спостерігається зниження температури).
Взаємна розчинність рідин або твердих речовин у рідинах залежить від ряду властивостей цих речовин: хімічної природи, величини та будови частинок, електричного заряду(у разі іонів), дипольних моментів тощо.
Відома так звана необмежена розчинність, коли дві рідини розчиняються одна в іншій у всіх співвідношеннях, і обмежена, коли розчинність однієї рідини в іншій обмежена певною концентрацією.
При обмеженій взаємній розчинності двох рідин А і Б кожна з них розчиняється, причому після відстоювання утворюється два шари, які розташовуються одна над одною в порядку зменшення щільності і складаються один з розчину Б в А, а інший - з розчину А в Б.
Розчини займають проміжне положення між хімічними сполуками та механічними сумішами. Від хімічних сполук розчини відрізняються змінністю свого складу, а від других – своєю однорідністю. Ось чому розчинами називають однофазні системи змінного складу, утворені не менш як двома незалежними компонентами.
Д.І. Менделєєв вперше став розглядати розчинення не лише як фізичний процес, але і як процес хімічної взаємодіїрозчиняється з розчинником. Зокрема, при розчиненні завжди поглинається або виділяється енергія (теплота розчинення) та змінюється об'єм рідини.
Дослідження розчинів за допомогою різних методівдало можливість встановити наявність у багатьох з них так званих сольватів або гідратів, які утворюються в результаті відповідних процесів сольватації та гідратації.
Гідратація речовин у водних розчинах становить окремий випадок сольватації будь-яким розчинником. Якщо розчинник вода, ці сполуки називаються гідратами. Процес гідратації слід розглядати як хімічну реакцію приєднання води до речовини. Гідратація відбувається під впливом сил молекулярної взаємодії молекул води та гідратованої речовини. Солі гідратуються іонами, що мають значні електричні поляякі притягують електричні полярні молекули води. Чим сильніше полеіона, тобто чим більший його заряд і менший радіус, тим сильніше він гідратується і тим міцніше утворені гідрати. Утворення сольватів у багатьох випадках змінює властивості речовини, що розчиняється, що легко визначається безпосереднім спостереженням.
Наприклад, йод, що складається з окремих молекул, у газоподібному стані має фіолетове забарвлення. Таке ж фарбування зберігається при розчиненні йоду у бензині. Якщо ж йод розчинити у спирті, виходить розчин темно-коричневого кольору. Ця зміна забарвлення свідчить про наявність взаємодії між молекулами йоду та спирту.
Гідрати – досить нестійкі сполуки, у багатьох випадках розкладаються вже при випаровуванні розчинів. Але іноді гідратна вода настільки міцно пов'язана з молекулами розчиненої речовини, що при виділенні останнього розчину вона входить до складу його кристалів. До таких лікарських речовин відносяться глюкоза, терпингідрат, магнію сульфат, міді сульфат, галун, кодеїн та ін., які є кристалогідратами з різним змістомкристалізаційної води. При видаленні води з кристалогідратів вони змінюють зовнішній вигляді окремі властивості(міді сульфат, гіпс, кристалічна сода та ін.).
У гідратованому стані перебувають і окремі іони розчиненої у воді солі, що має значення для багатьох властивостей розчинів солей. Ідею гідратації іонів у розчинах було вперше висловлено І.А. Каблуковим та В.А. Кістяковським.
Гранична розчинність багатьох речовин у воді (або в інших розчинниках) є постійну величину, що відповідає концентрації насиченого розчину при даній температурі. Вона є якісною характеристикою розчинності та наводиться у довідниках у грамах на 100 г розчинника (за певних умов).
Препарат вважають розчиненим, якщо в розчині при спостереженні в світлі, що проходить, не виявляються частинки речовини. Щодо розчинності до певної міри керуються старим положенням «подібне розчиняється в подібному» ( similia similibus solventur), тобто у світлі сучасних поглядівна будову молекули це представляється так: у неполярних розчинниках (бензин, ефір та ін.) добре розчиняються різні сполуки з неполярними або малополярними молекулами та не розчиняються речовини іншого типу. Навпаки, розчинник з сильно вираженим полярним характером молекул (вода), як правило, розчиняє речовини з молекулами полярного та частково іонного типівта не розчиняє речовини з неполярними молекулами. До полярних розчинників відносяться рідини, що поєднують велику постійну діелектричну, великий дипольний момент, з наявністю функціональних груп, що забезпечують освіту координаційних ( здебільшоговодневих) зв'язків: вода, кислоти, нижчі спирти та гліколі, аміни і т. д. Наявність полярних груп у молекулі речовини сильно впливає на його розчинність.
Як правило, речовини добре розчиняються у воді та одна в одній, якщо на кожну полярну групу припадає не більше трьох атомів вуглеводневого радикалу. За більшої наявності вуглеводневих радикалів між молекулами виникають такі великі дисперсійні сили, що вони перешкоджають розчиненню таких речовин у полярних розчинниках.
Полярні речовини - це речовини з іонною (іонні кристали) та полярним зв'язком(Полярні молекули), наприклад, натрію хлорид.
До неполярних розчинників відносяться рідини з малим дипольним моментом, що не мають активних функціональних груп, наприклад, вуглеводні, галоїдалкіли та ін. Неполярні речовини- Це речовини строго симетричної структури, без електричних полюсів (наприклад, парафін, скипидар, камфора, тимол та ін).
Однак вищенаведене правило не завжди дійсне, особливо у застосуванні до складних органічних сполукякі містять як полярні (-ОН, -SO 3 H, -NH 2 , -COOH, -COONa), так і неполярні (алкільні або арильні радикали) групи. До таких сполук відносяться вуглеводи, спирти, кетони, органічні кислоти, Аміни та ін Розчинність цих речовин залежить від переважання полярних або неполярних груп. Наприклад, спирт етиловий З 2 Н 5 ВІН змішується з водою в будь-яких співвідношеннях, аміловий З 5 Н 11 ВІН - не вище 10 %, а спирт цетиловий З 16 Н 33 ВІН практично у воді не розчиняється
Розчинність залежить від природи речовини, що розчиняється, і розчинника, температури і тиску.
1) Природа розчиняється речовини.

Рис.2 Природа розчиненої речовини.
Кристалічні речовини поділяються на:
P - добре розчинні (понад 1,0 г на 100 г води);
M – малорозчинні (0,1 г – 1,0 г на 100 г води);
Н – нерозчинні (менше 0,1 г на 100 г води).
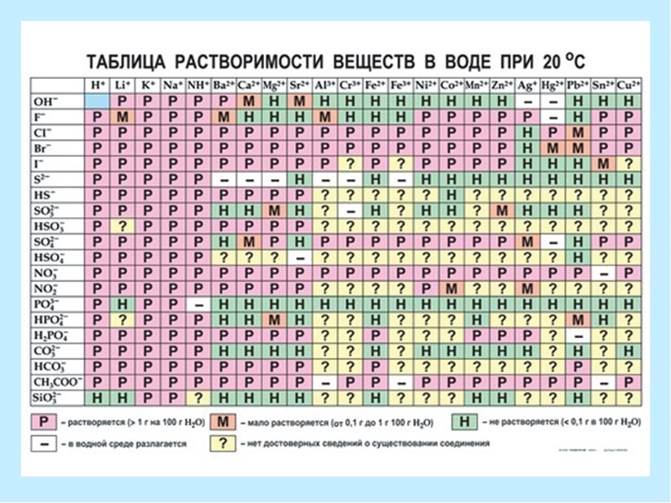
Рис.3. Таблиця розчинності.
2) Природа розчинника. При утворенні розчину зв'язку між частинками кожного компонента замінюються зв'язками між частинками різних компонентів. Щоб нові зв'язки могли утворитися компоненти розчину повинні мати однотипні зв'язки, тобто. бути однією природою. Тому іонні речовинирозчиняються в полярних розчинниках і погано неполярних, а
молекулярні речовини- Навпаки.
Вода – унікальний, найбільш поширений та доступний розчинник. Водні розчини неорганічних (солі, кислоти, основи) та органічних (амінокислоти, азотисті основи, нуклеїнові кислоти) речовин, низько - і високомолекулярних сполук, електролітів і неелектролітів, складають основу найважливіших біологічних рідин, у яких протікають все фізико – хімічні процеси, які забезпечують життєдіяльність організму. Наприклад, у медицині використовують штучні аналоги біологічних рідин – колоїдні та сольові кровозамінні розчини.

Мал. 4. Залежність розчинності речовин від природи розчинності.
3) Вплив температури. Якщо розчинення речовини є екзотермічним процесом, то з підвищенням температури його розчинність зменшується (наприклад, Ca(OH)2 у воді) і навпаки. Більшість солей характерно збільшення розчинності при нагріванні. Майже всі гази розчиняються з виділенням тепла. Розчинність газів у рідинах з підвищенням температури зменшується, а зі зниженням збільшується.
4) Вплив тиску. З підвищенням тиску розчинність газів у рідинах збільшується, і з пониженням зменшується.
Розчини речовин з молярною масоюменше 5000 г/моль називаються розчинами низькомолекулярних сполук (НМС), а розчини речовин із молярною масою більше 5000 г/моль – розчинами високомолекулярних сполук (ВМС).
За наявністю чи відсутністю електролітичної дисоціаціїрозчини НМС поділяють на два класи – розчини електролітів та неелектролітів.
Таблиця 1.
Таблиця електролітів та неелектролітів.
Розчини електролітів – розчини, що дисоціюють на іони солей, кислот, основ, амфолітів. Наприклад, розчини KNО3, HCl, КОН, Аl(ОН)3, гліцину. Електрична провідність розчинів електролітів вища, ніж розчинника.
Розчини неелектролітів – розчини речовин, що практично не дисоціюють у воді. Наприклад, розчини сахарози, глюкози, сечовини. Електрична провідність розчинів неелектроліт мало відрізняється від розчинника.
Розчини НМС (електролітів та неелектролітів) називаються істинними на відміну від колоїдних розчинів. Справжні розчинихарактеризуються гомогенністю складу та відсутністю поверхні розділу між розчиненою речовиною та розчинником. Розмір розчинених частинок (іонів та молекул) менше 10 -9 м.
Більшість ВМС – полімери, молекули яких (макромолекули) складаються з великої кількостіповторюваних угруповань або мономерних ланок, з'єднаних між собою хімічними зв'язками. Розчини ВМС називають розчинами поліелектролітів.
До поліелектролітів відносяться полікислоти (гепарин, поліаденілова кислота, поліаспарагінова кислота та ін), поліоснови (полілізин), поліамфоліти (білки, нуклеїнові кислоти).
Властивості розчинів ВМС значно відрізняються від властивостей розчинів НМС.
Ви вже знаєте, що з тілами та речовинами відбуваються різні зміни, які називають явищами, і пам'ятайте, що їх поділяють на фізичні та хімічні. При фізичних явищах склад чистих індивідуальних речовинзалишається без зміни, а змінюється лише його агрегатний станабо форма та розміри тел.
Фізичні явища, що виражаються в змінах агрегатного стану речовини або форми та розмірів тіл, визначають найважливіші області застосування їх у народному господарстві. Так, пластичність алюмінію дозволяє витягувати його в дріт або прокочувати тонку фольгу; електропровідність і порівняльна легкість алюмінію дозволяють використовувати його як проводи ліній електропередачі, а сплави - в літакобудуванні; теплопровідність, пластичність та неотруйність - при виготовленні посуду і т.д.
Багато способів отримання чистих хімічних речовин, Власне, фізичні явища. До них відносять перегонку, кристалізацію, фільтрування, сублімацію та ін. Наприклад, на відмінності температур кипіння речовин заснований спосіб дистиляції (рис. 84), або перегонки.
Мал. 84.
Дистиляція
Цим способом одержують воду, очищену від розчинених у ній речовин. Така вода називається дистильованою. Саме її використовують для приготування лікарських розчинів та для заливання в систему охолодження автомобілів.
Перегонку як спосіб поділу рідких сумішей застосовують для отримання з природної нафтиокремих нафтопродуктів. Промислова установкадля безперервної перегонки нафти складається з трубчастої печі (рис. 85, 1) для нагрівання нафти та розділової, або ректифікаційної колони (рис. 85, 2), де нафта поділяється на фракції (дистиляти) - окремі нафтопродукти.
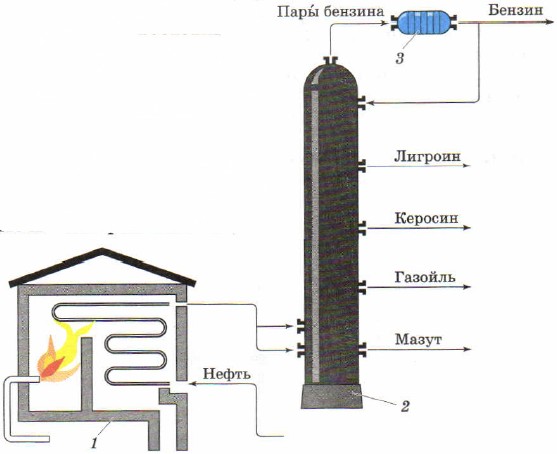
Мал. 85.
Схема трубчастої установки для безперервної перегонки нафти:
1 - трубчаста піч; 2 – ректифікаційна колона; 3 - холодильник
У трубчастій печі у вигляді змійовика розташований довгий трубопровід. Пекти обігрівається палаючим мазутом або газом. По трубопроводу безперервно подається нафта, в ньому вона нагрівається до 320-350 ° С і у вигляді суміші рідини та пари надходить у колону ректифікації.
Ректифікаційна колона - сталевий циліндричний апарат заввишки близько 40 м. Вона має всередині кілька десятків горизонтальних перегородок з отворами, про тарілок. Пари нафти, надходячи в колону, піднімаються нагору і проходять через отвори в тарілках. Поступово охолоджуючись при своєму русі вгору, вони зріджуються на тих чи інших тарілках залежно від температури кипіння і щільності. Вуглеводні менш леткі і зріджуються вже на перших тарілках, утворюючи газойльову фракцію, більш леткі вуглеводні збираються вище і утворюють гасову фракцію, ще вище збирається лігроїнова фракція, найбільш леткі вуглеводні виходять у вигляді пари з колони і утворюють бензин. Внизу збирається густа чорна рідина – мазут. Його використовують як паливо, а також для отримання мастил шляхом додаткової перегонки.
Спосіб перегонки рідкого повітрялежить в основі отримання з нього окремих складових частин- азоту (він википає першим), кисню та ін.

Мал. 86.
Фільтрування
Для очищення солей використовують спосіб кристалізації. При цьому, наприклад, природну сіль розчиняють у воді і фільтрують (мал. 86). В результаті одержують розчин кухонної солі, очищений від піску, глини та інших нерозчинних у воді домішок. Потім сіль виділяють з розчину випарюванням (рис. 87), вода випаровується, а у фарфоровій чашці залишаються кристали солі.
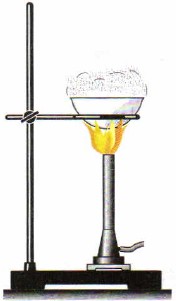
Мал. 87.
Випарювання
Спосіб фільтрування заснований на різній пропускну здатністьпористого матеріалу - фільтра по відношенню до складових суміш частинок. Фільтр для очищення питної водина станціях водоочищення служить шар піску. У пилососі, який очищає повітря від зваженого в ньому пилу, застосовують паперові або матер'яні фільтри; в медицині при догляді за хворими або під час хірургічної операції використовують як фільтр багатошарові марлеві пов'язки.
Для отримання чистих йоду та сірки використовують таке фізичне явище, як сублімація (сублімація), тобто перехід речовини з твердого стануу газоподібне, минаючи рідку фазу (рис. 88). При сублімації в частині приладу, що нагрівається, кристалічна речовина випаровується, а в охолоджуваній - знову конденсується з утворенням кристалів. Лід здатний до сублімації, недарма мокра білизна висихає і на морозі.
Мал. 88.
Лікування йоду
сублімація визначила використання твердого Вуглекислий газСО 2 (як ви знаєте, його називають сухим льодом) для зберігання продуктів, і насамперед морозива.
Мал. 89.
Нафторозділювальна колонка
Різна щільність речовин є основою такого способу поділу сумішей, як відстоювання. Наприклад, суміші нафти та води, рослинного маслаі води швидко розшаровуються і тому їх легко відокремити один від одного за допомогою ділильної лійки (рис. 89, 90).

Мал. 90.
Ділища вирва
Щоб прискорити процес поділу сумішей, замість відстоювання в лабораторної практикичасто використовують центрифугування, яке отримало таку назву через особливий прилад - центрифуги. У центрифугу поміщають пробірки із сумішшю речовин. Включають прилад, який починає, подібно до каруселі, інтенсивно розкручувати закріплені в ньому пробірки. Під дією відцентрової сили частки різних речовинотримують різне прискорення, оскільки мають різною щільністю, і суміш поділяється (рис. 91).
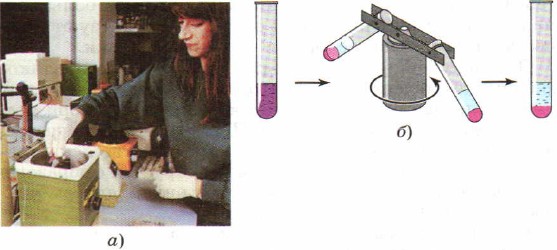
Мал. 91.
Центрифугування:
а – фотографія центрифуги; б - схема дії центрифуги
Ключові слова та словосполучення
- Дистиляція, чи перегонка.
- Дистильована вода.
- Кристалізація та випарювання.
- Фільтрування.
- Лікування.
- Відстоювання.
- Ділища вирва.
- Центрифугування.
Робота з комп'ютером
- Зверніться до електронної програми. Вивчіть матеріал уроку та виконайте запропоновані завдання.
- Знайдіть в Інтернеті електронні адреси, які можуть служити додатковими джерелами, що розкривають зміст ключових слів та словосполучень параграфа Запропонуйте вчителю свою допомогу у підготовці нового уроку - зробіть повідомлення по ключовим словамта словосполученням наступного параграфа.
Запитання та завдання
- Який спосіб поділу сумішей описаний у науково-фантастичному творі О. Бєляєва «Продавець повітря»?
- Звідки бере початок повір'я, що розсипана сіль - до сварки? Як помирити людей, які посварилися через розсипану соль?
- Вкажіть способи поділу наступних сумішей: а) зубний порошок та кухонна сіль; б) спирт та вода; в) бензин та вода.
- Як у похідних умовах очистити та знезаразити річкову водуі зробити її придатною для пиття та приготування їжі?
- Чому працівники елеваторів (зерносховищ) при просіюванні та сортуванні зерна надягають спеціальну маску?
- Який спосіб очищення чайної заварки від чаю ви використовуєте, коли наливаєте її з чайника через ситечко?
Керівник: Богер Наталія Володимирівна, учитель хімії
Тема: «Розчин – фізичний чи хімічний процес?»
Освітня установа: МБОУ Каргасокська ЗОШ №2 п. Каргасок, Томська область
Медіаресурси, що використовуються: текстовий редактор WORD, ресурси мережі Інтернет
1) Актуальність дослідження (чому дана темавзята автором для дослідження)
Вже два роки ми вивчаємо фізику, захоплюємося цією наукою, вивчаємо основні закони, фізичні явища. І для нас завжди було зрозуміло, що процес розчинення цукру, солі та інших розчинних речовину воді – фізичне явище. Цього року ми почали вивчати нову науку- Хімію. І яким було для нас здивуванням, що процес розчинення – хімічне явище. Хімія - наука про речовини, властивості та їх перетворення. Але в процесі розчинення цукру у воді ми не отримали ні кислоти, ні лугу, ні якоїсь іншої речовини. Цукор так і залишився цукром.
2) Визначення предмета дослідження (Що підлягає вивченню?)
Нас зацікавило питання, чим же відрізняються фізичні змінивід хімічних? Це не дуже просте питання.
3) Формулювання проблеми. У чому полягає проблема? На яке питання має відповісти?
З'ясувати, фізичним чи хімічним є процес розчинення речовин у воді.
4) Висунення гіпотези. Якою може бути відповідь?
Ми висунули гіпотезу : можливо, що грань між фізичними та хімічними перетвореннями умовна, проведена довільно.
5) Перевірка гіпотези.
на даному етапіробота проходить за трьома напрямками:
- Теоретичний аналіз наукової літератури;
- Фізичний та хімічний експеримент;
- Аналіз експериментальних даних.
Робота в рамках першого напряму надала можливість розглянути теоретичні питанняпроцесу розчинення речовин у воді Проблема розчинення здавна цікавила людину. Сутність процесу розчинення намагалися розгадати ще алхіміки, та був хіміки наступних століть. Так, англійський хімік Р, Бойль (1627-1691) припускав, що частинки розчинника мають шипи, гачки та інші пристосування, за допомогою яких зчіплюються з частинками розчиненої речовини, від чого відбувається розчинення.
Більш науково висловив думку про розчинення М.В. Ломоносов(1711-1765): «частинки солі відокремлюються друг від друга дією частинок води…» і, зчіпляючись з водними частинками, разом починають рухатися поступово і розносяться розчинником».
У ХІХ столітті дослідження розчинів продовжив Д.І. Менделєєв (1834-1907). Велике значеннявін надавав вивченню теплових ефектів під час розчинення. Відомо, що при розчиненні одних речовин теплота виділяється, а за інших – поглинається.
Теорія розчинення набула розвитку на роботах шведського вченого Сванте Аррениуса (1859-1927). Він припустив, що речовина у розчині розпадається на іони. Надалі російський учений І.А. Каблуков (1857-1942) поєднав теорію електролітичної дисоціації С. Арреніуса з гідратною теорією Д.І. Менделєєва. Він висунув припущення про гідратацію (взаємодія з водою) іонів, що утворюються в розчині, що і було доведено експериментально.
Прибічники фізичної теорії розчинів, яку розвивали Вант-Гофф, Арреніус та Освальд, вважали, що процес розчинення є наслідком дифузії, тобто. проникнення розчиненої речовини проміжки між молекулами води, тобто. фізичне явище.
Прихильники хімічної теорії розчинів, що розвивали Д.І. Менделєєв, І.А. Каблуков, В.А. Кістяковський, вважали, що процес розчинення є хімічною взаємодією розчиненої речовини та води.
Розглянувши теоретичні питання, ми розпочали експериментальну частину нашої роботи.
Проведемо досвід, мета якого продемонструвати, що зарозчиненні відбувається процес рівномірного розподілуоднієї речовини в іншому, при якому розчиняється речовина перетворюється на агрегатний стан розчинника, тобто. відбувається фізичне явище.
Досвід №1. Явище дифузії на прикладі перманганату калію
Якщо у хімічну склянку з водою помістити кілька гранул перманганату калію, ми можемо спостерігати як кількість твердої речовинипоступово зменшується. При цьому вода, в яку були додані кристали, набуває нових властивостей. З'являється малинове забарвлення.
Висновок : Ми спостерігаємо процес дифузії. – це мимовільне взаємне проникнення молекул однієї речовини у проміжки між молекулами іншої. Відбувається вона тому, що молекули однієї та іншої речовини взаємно проникають одна між одною.
Досвід №2. Вплив температури на процес дифузії
Виявляється, швидкість дифузії певних речовин можна впливати зміна температури. Щоб переконатися в цьому, ми взяли дві склянки, одну з гарячої, а іншу з холодною водою. Насипали однакову кількість перманганату калію. В одній зі склянок дифузія піде набагато швидше. Як підказує нам життєвий досвід, дифузія відбувається тим швидше, що вища температура диффундирующих речовин.
Висновок: Що температура речовин, то швидше відбувається дифузія.
Про хімічну взаємодію речовини з розчинником судять за деякими ознаками. Перелічимо ознаки хімічних реакцій:
- зміна кольору;
- поява запаху;
- утворення та розчинення осаду;
- виділення газу;
- виділення чи поглинання теплоти.
Проведемо досвід, ціль якого продемонструвати, що при освіті розчинів може відбуватися виділення теплоти.
Досвід №3. Виділення теплоти при розчиненні кислоти у воді.
Для цього експерименту ми взяли таке обладнання: сірчана кислота(98%), вода, датчик температури, хімічна склянка на 100мл.В ході експерименту при розчиненні у воді невеликої кількості (5мл) сірчаної кислоти порціями по 1мл спостерігали значне підвищення температури.
Хімічна реакція процесу:
Висновок: При розчиненні сірчаної кислоти у воді ми спостерігали значне підвищення температури, але це ознака хімічної реакції.
Досвід №4. Поглинання теплоти під час розчинення солі у воді.
Ціль: продемонструвати, що при утворенні розчинів може відбуватися поглинання теплоти.
Хімічна реакція:
Для експерименту ми взяли 5г нітрату калію та розчинили в 10мл води.
Висновок : Ми спостерігали зниження температури при розчиненні нітрату калію у воді, а це ознака хімічної взаємодії.
Про складність процесу розчинення свідчать не лише теплові ефекти, а й такий ознака хімічних реакцій, як зміна кольору.
Досвід №5 .Зміна кольору в процесі розчинення солі.
Візьмемо білий порошоксульфату міді та розчинний його у воді. При цьому утворюється розчин блакитного кольору. Це доводить, що при розчиненні відбувається хімічний процес – гідратація іонів:
Якщо розчин випарювати, випадають блакитні кристали. Збереження фарбування кристалів свідчить про те, що при кристалізації солі з розчинів гідратовані іони не руйнуються, а зберігаються
Висновок: Речовини, в кристалічні грати яких входять гідратовані іони, називають кристалогідратами, а воду, що входить до складу кристалогідрату - кристалізаційної.
Досвід №6 Зміна кольору у процесі розчинення йоду.
Ми провели експеримент, розчиняючи йод у різних розчинниках. Пари йоду мають Фіолетовий колір. Такий самий колір і у розчину йоду в бензині. У воді розчин йоду жовтий, у бензолі чи спирті – коричневий (цей колір знайомої всім йодної настойки), у розчині полівінілового спирту йод синій (це колір лікарського засобу йодинолу). І змінюється не тільки колір у різних розчинниках, хімічно поводиться теж по-різному.
Висновок: Молекули розчиненої речовини зв'язуються з молекулами розчинника, у результаті утворюються нові хімічні сполуки.
6 ) Пояснення результатів. Можливі висновки.
Ми з'ясували, яким є процес розчинення – фізичним чи хімічним. Ми вивчили теоретичні питання процесу розчинення. Розглянули ознаки фізичних та хімічних явищ при розчиненні. Експериментально підтвердили всі розглянуті ознаки та процеси. В результаті проведеного дослідження ми з'ясували, що процес розчинення є фізико – хімічним процесом, а розчини – це однорідна (гомогена) система, що складається з частинок розчиненої речовини, розчинника та продуктів їхньої взаємодії – гідратів. Ми з'ясували, що грань між фізичними та хімічними явищамибагато в чому умовна. Вона проведена вченими довільно. p align="justify"> Процес розчинення за деякими ознаками можна віднести до фізичних, а за іншими - до хімічних. Тому такі процеси почали називати фізико-хімічними явищами.
Сформульовані висновки дозволяють судити у тому, що мета дослідження досягнуто. Однак на цьому наше дослідження не закінчено, воно ставить перед нами нове завдання- чому водні розчиниДеякі речовини проводять електричний струм, знайти причину такого явища. Але це буде інше дослідження.
- Підготовка до презентації дослідницького матеріалу. Написання звіту.
Для написання звіту було використано можливості текстового редактора WORD.Підсумковий матеріал представлений також у вигляді презентації, виконаної в редакторі POWER POINT.
В результаті роботи була використана наступна література:
- Алікбеков Л.Ю. Цікаві завданнята досліди з хімії М.Дрофа,2006.
- Горьов Л.А. Цікаві дослідипо фізиці. М. Просвітництво, 1985р.
- Журнал "Наука і життя", № 5 2004р.
- Кузнєцова Л.М. Хімія 9клас. М. Мнемозіна, 2003.
- Олма енциклопедія. Перетворення речовини. Хімія. М. Олма Медіа Груп,2013.
- Інтернет ресурс.
Розчинення - це процес рівномірного розподілу однієї речовини в іншій, при якому розчиняється речовина переходить в агрегатний стан розчинника
Розчин – це хімічна система, утворена кількома речовинами, між якими немає поверхонь розділу
Фізична теоріярозчинів:
Розчинення – це процес дифузії, розчини – це однорідні суміші
Хімічна теоріярозчинів:
Розчинення – це процес хімічної взаємодії речовини, що розчиняється, з водою – гідратація, розчини – сполуки гідрати
Розглянемо процес розчинення речовин.
Наприклад, якщо ми додаємо в чай цукор, то можемо спостерігати, як кількість твердої речовини поступово зменшується. Якщо холодний чай, то цукор розчиняється повільно. Навпаки, якщо гарячий чай і розмішується ложечкою, то розчинення відбувається швидко. Потрапляючи у воду, молекули цукру, що знаходяться на поверхні кристалів цукрового піску, утворюють зв'язки з молекулами води. При цьому з однією молекулою цукру зв'язується декілька молекул води. Тепловий рух молекул води змушує пов'язані з ними молекули цукру відриватися від кристала та переходити в товщу молекул розчинника. Молекули цукру, що перейшли з кристала розчин, можуть пересуватися по всьому об'єму розчину разом з молекулами води завдяки дифузії. Якщо розчин нагріти або перемішувати, дифузія відбувається інтенсивніше і розчинення цукру проходить швидше. Молекули цукру розподіляються рівномірно і розчин стає однаково солодким у всьому обсязі.
Речовини при розчиненні не змінюються, після випарювання розчинів ми можемо отримати розчинену речовину у твердому стані. При розчиненні руйнується кристалічна решітка розчиненої речовини та її частинки переміщуються в розчині, отже, розчинення – це фізичний процес. Для здійснення такого процесу необхідно витратити енергію.
Але коли молекули розчиненої речовини зв'язуються з молекулами води, фактично утворюються нові хімічні сполуки. Ці молекулярні асоціати немає постійного складу. Їх загальна назва- Гідрати. Процес зв'язування речовин із водою називається гідратацією. При випарюванні розчинів відбувається руйнування гідратів та утворення кристалічної речовини. Однак деякі речовини здатні утворювати стійкі гідрати, які можуть містити воду у кристалічному стані. Такі речовини називаються кристалогідратами. Їх можна виділити із розчину, обережно випаровуючи воду. У таких формулах кристалізаційна вода вказується після формули сполуки зі знаком множення. Наприклад: CuSO 4 ·5H 2 O - мідний купорос, FeSO 4 · 7H 2 O - залізний купорос. Освіта гідратів, тобто. нових речовин, що свідчить, що розчинення - хімічний процес.
Розібратися по суті процесу розчинення допомагає вивчення теплових явищ, що відбуваються при цьому. Відомо, що одним із ознак хімічних реакцій є виділення теплоти, а для фізичних явищ необхідно витрачати енергію. Розчинення сірчаної кислоти супроводжується сильним розігрівом розчину. Це результат хімічної взаємодії між молекулами води та розчиненої речовини – гідратація супроводжується виділенням енергії. А розчинення нітрату амонію супроводжується охолодженням розчину. У цьому випадку на фізичний процес руйнування кристалічних ґрат витрачається більше енергії, ніж утворюється при отриманні гідратів.
Наведені факти свідчать, що розчинення слід вважати фізико-хімічним процесом.
Домашнє завдання: параграф 34 , упр.
вивчити визначення
Електроліти та неелектроліти.
Електроліти– це речовини, розчини чи розплави яких проводять електричний струм.
Неелектроліти- Це речовини, розчини або розплави яких не проводять електричний струм.
Електролітична дисоціація– це розпад електроліту на іони, що вільно переміщаються при розчиненні його у воді або при плавленні.
Електролітипри розчиненні у воді або
розплавлення розпадаються (дисоціюють) на іони – позитивно (катіони) та негативно (аніони) заряджені частинки.
Іониперебувають у більш стійких електронних станах, Чим атоми. Вони можуть складатися з одного атома – це прості іони(Na + , Mg 2+ , Аl 3+ і т.д.) - або з кількох атомів - це складні іони(NО 3 - , SO 2- 4 , РВ З- 4 і т.д.).
У розчинах та розплавах електроліти проводять електричний струм .
Під дією електричного струмуіони набувають спрямованого руху: позитивно заряджені іони рухаються до катода, негативно заряджені - до анода. Тому перші називаються катіонами, другі – аніонами. Спрямований рух іонів відбувається внаслідок тяжіння їх протилежно зарядженими електродами.
Дисоціація- Оборотний процес: паралельно з розпадом молекул на іони (дисоціація) протікає процес з'єднання іонів (асоціація).
Тому в рівняннях електролітичної дисоціації замість знаку рівності ставлять знак оборотності. Наприклад, рівняння дисоціації молекули електроліту КA на катіон К+ та аніон А - в загальному виглядізаписується
КА ↔ K++ A -
Домашнє завдання: параграф 35, упр. 1,4,5,вивчити визначення
Основні засади ТЕД.
1. Електроліти при розчиненні у воді розпадаються (дисоціюють) на іони – позитивні та негативні.
2. Під дією електричного струму іони набувають направленого руху: позитивно заряджені частинки рухаються до катода, негативно заряджені – до анода. Тому позитивно заряджені частинки називаються катіонами, а негативно заряджені – аніонами.
3. Спрямований рух відбувається внаслідок тяжіння їх протилежно зарядженими електродами (катод заряджений негативно, а анод – позитивно).
4. Іонізація - оборотний процес: паралельно з розпадом молекул на іони (дисоціація) протікає процес з'єднання іонів у молекули (асоціація).
Грунтуючись на теорії електролітичної дисоціації, можна дати наступні визначеннядля основних класів з'єднань:
Кислотами називаються електроліти, при дисоціації яких як катіони утворюються лише іони водню. Наприклад,
HCl → H + + Cl -;
CH 3 COOH H + + CH 3 COO -.
Основність кислоти визначається числом катіонів водню, що утворюються під час дисоціації. Так, HCl, HNO 3 – одноосновні кислоти, H 2 SO 4 , H 2 CO 3 – двоосновні, H 3 PO 4 , H 3 AsO 4 – триосновні.
Підставами називають електроліти, при дисоціації яких як аніони утворюються лише гідроксид-іони. Наприклад,
KOH → K + + OH - ,
NH 4 OH NH 4 + + OH-.
Розчинні у воді основи називаються лугами.
Кислотність основи визначається числом його гідроксильних груп. Наприклад, KOH, NaOH – однокислотні основи, Ca(OH) 2 – двокислотна, Sn(OH) 4 – чотирикислотна і т.д.
Солями називають електроліти, при дисоціації яких утворюються катіони металів (а також іон NH 4 +) та аніони кислотних залишків. Наприклад,
CaCl 2 → Ca 2+ + 2Cl - ,
NaF → Na + + F - .
Електроліти, при дисоціації яких одночасно, залежно від умов, можуть утворюватися і катіони водню, і аніони – гідроксид-іони називаються амфотерними. Наприклад,
H 2 O H + +OH - ,
Zn(OH) 2 Zn 2+ +2OH - ,
Zn(OH) 2 2H + +ZnO 2 2- або
Zn(OH) 2 + 2H 2 O 2- + 2H + .
Домашнє завдання: параграф 36,упр. 2-5, вивчити визначення
