1. ಉಪ್ಪು ಮತ್ತು ನೀರನ್ನು ರೂಪಿಸಲು ಬೇಸ್ಗಳು ಆಮ್ಲಗಳೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯಿಸುತ್ತವೆ:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O
2. ಸಿ ಆಮ್ಲ ಆಕ್ಸೈಡ್ಗಳು, ಉಪ್ಪು ಮತ್ತು ನೀರನ್ನು ರೂಪಿಸುವುದು:
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
3. ಕ್ಷಾರಗಳು ಆಂಫೊಟೆರಿಕ್ ಆಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯಿಸಿ, ಉಪ್ಪು ಮತ್ತು ನೀರನ್ನು ರೂಪಿಸುತ್ತವೆ:
2NaOH + Cr 2 O 3 = 2NaCrO 2 + H 2 O
KOH + Cr(OH) 3 = KCrO 2 + 2H 2 O
4. ಕ್ಷಾರಗಳು ಕರಗುವ ಲವಣಗಳೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯಿಸುತ್ತವೆ, ದುರ್ಬಲ ಬೇಸ್, ಅವಕ್ಷೇಪ ಅಥವಾ ಅನಿಲವನ್ನು ರೂಪಿಸುತ್ತವೆ:
2NaOH + NiCl 2 = Ni(OH) 2 ¯ + 2NaCl
ಬೇಸ್
2KOH + (NH 4) 2 SO 4 = 2NH 3 + 2H 2 O + K 2 SO 4
Ba(OH) 2 + Na 2 CO 3 = BaCO 3 ¯ + 2NaOH
5. ಕ್ಷಾರಗಳು ಕೆಲವು ಲೋಹಗಳೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯಿಸುತ್ತವೆ, ಇದು ಆಂಫೋಟೆರಿಕ್ ಆಕ್ಸೈಡ್ಗಳಿಗೆ ಅನುರೂಪವಾಗಿದೆ:
2NaOH + 2Al + 6H 2 O = 2Na + 3H 2
6. ಸೂಚಕದ ಮೇಲೆ ಕ್ಷಾರದ ಪರಿಣಾಮ:
ಓಹ್ - + ಫೀನಾಲ್ಫ್ಥಲೀನ್ ® ಕಡುಗೆಂಪು ಬಣ್ಣ
ಓಹ್ - + ಲಿಟ್ಮಸ್ ® ನೀಲಿ ಬಣ್ಣ
7. ಬಿಸಿ ಮಾಡಿದಾಗ ಕೆಲವು ನೆಲೆಗಳ ವಿಭಜನೆ:
Сu(OH) 2 ® CuO + H 2 O
ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು – ರಾಸಾಯನಿಕ ಸಂಯುಕ್ತಗಳು, ಬೇಸ್ ಮತ್ತು ಆಮ್ಲಗಳ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತದೆ. ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಆಂಫೊಟೆರಿಕ್ ಆಕ್ಸೈಡ್ಗಳಿಗೆ ಸಂಬಂಧಿಸಿವೆ (ಪ್ಯಾರಾಗ್ರಾಫ್ 3.1 ನೋಡಿ).
ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಬೇಸ್ ರೂಪದಲ್ಲಿ ಬರೆಯಲಾಗುತ್ತದೆ, ಆದರೆ ಅವುಗಳನ್ನು ಆಮ್ಲದ ರೂಪದಲ್ಲಿ ಪ್ರತಿನಿಧಿಸಬಹುದು:
Zn(OH) 2 Û H 2 ZnO 2
ಅಡಿಪಾಯ
ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳು ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು
1. ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಆಮ್ಲಗಳು ಮತ್ತು ಆಮ್ಲ ಆಕ್ಸೈಡ್ಗಳೊಂದಿಗೆ ಸಂವಹನ ನಡೆಸುತ್ತವೆ:
Be(OH) 2 + 2HCl = BeCl 2 + 2H 2 O
Be(OH) 2 + SO 3 = BeSO 4 + H 2 O
2. ಕ್ಷಾರಗಳೊಂದಿಗೆ ಸಂವಹನ ಮತ್ತು ಮೂಲ ಆಕ್ಸೈಡ್ಗಳುಕ್ಷಾರೀಯ ಮತ್ತು ಕ್ಷಾರೀಯ ಭೂಮಿಯ ಲೋಹಗಳು:
Al(OH) 3 + NaOH = NaAlO 2 + 2H 2 O;
H 3 AlO 3 ಆಮ್ಲ ಸೋಡಿಯಂ ಮೆಟಾಲುಮಿನೇಟ್
(H 3 AlO 3 ® HalO 2 + H 2 O)
2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
ಎಲ್ಲಾ ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ದುರ್ಬಲ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳಾಗಿವೆ
ಲವಣಗಳು
ಲವಣಗಳು- ಇದು ಸಂಕೀರ್ಣ ಪದಾರ್ಥಗಳು, ಲೋಹದ ಅಯಾನುಗಳು ಮತ್ತು ಆಮ್ಲದ ಶೇಷವನ್ನು ಒಳಗೊಂಡಿರುತ್ತದೆ. ಲವಣಗಳು ಆಮ್ಲಗಳಲ್ಲಿ ಲೋಹದ (ಅಥವಾ ಅಮೋನಿಯಂ) ಅಯಾನುಗಳೊಂದಿಗೆ ಹೈಡ್ರೋಜನ್ ಅಯಾನುಗಳ ಸಂಪೂರ್ಣ ಅಥವಾ ಭಾಗಶಃ ಬದಲಿ ಉತ್ಪನ್ನಗಳಾಗಿವೆ. ಲವಣಗಳ ವಿಧಗಳು: ಮಧ್ಯಮ (ಸಾಮಾನ್ಯ), ಆಮ್ಲೀಯ ಮತ್ತು ಮೂಲ.
ಮಧ್ಯಮ ಲವಣಗಳು- ಇವುಗಳು ಲೋಹದ (ಅಥವಾ ಅಮೋನಿಯಂ) ಅಯಾನುಗಳೊಂದಿಗೆ ಆಮ್ಲಗಳಲ್ಲಿನ ಹೈಡ್ರೋಜನ್ ಕ್ಯಾಟಯಾನುಗಳ ಸಂಪೂರ್ಣ ಬದಲಿ ಉತ್ಪನ್ನಗಳಾಗಿವೆ: Na 2 CO 3, NiSO 4, NH 4 Cl, ಇತ್ಯಾದಿ.
ಮಧ್ಯಮ ಲವಣಗಳ ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳು
1. ಲವಣಗಳು ಆಮ್ಲಗಳು, ಕ್ಷಾರಗಳು ಮತ್ತು ಇತರ ಲವಣಗಳೊಂದಿಗೆ ಸಂವಹನ ನಡೆಸುತ್ತವೆ, ದುರ್ಬಲ ಎಲೆಕ್ಟ್ರೋಲೈಟ್ ಅಥವಾ ಅವಕ್ಷೇಪವನ್ನು ರೂಪಿಸುತ್ತವೆ; ಅಥವಾ ಅನಿಲ:
Ba(NO 3) 2 + H 2 SO 4 = BaSO 4 ¯ + 2HNO 3
Na 2 SO 4 + Ba(OH) 2 = BaSO 4 ¯ + 2NaOH
CaCl 2 + 2AgNO 3 = 2AgCl¯ + Ca(NO 3) 2
2CH 3 COONa + H 2 SO 4 = Na 2 SO 4 + 2CH 3 COOH
NiSO 4 + 2KOH = Ni(OH) 2 ¯ + K 2 SO 4
ಬೇಸ್
NH 4 NO 3 + NaOH = NH 3 + H 2 O + NaNO 3
2. ಲವಣಗಳು ಹೆಚ್ಚು ಸಕ್ರಿಯ ಲೋಹಗಳೊಂದಿಗೆ ಸಂವಹನ ನಡೆಸುತ್ತವೆ. ಇನ್ನಷ್ಟು ಸಕ್ರಿಯ ಲೋಹಉಪ್ಪು ದ್ರಾವಣದಿಂದ ಕಡಿಮೆ ಸಕ್ರಿಯವಾಗಿರುವ ಒಂದನ್ನು ಸ್ಥಳಾಂತರಿಸುತ್ತದೆ (ಅನುಬಂಧ 3).
Zn + CuSO 4 = ZnSO 4 + Cu
ಆಮ್ಲ ಲವಣಗಳು - ಇವುಗಳು ಲೋಹದ (ಅಥವಾ ಅಮೋನಿಯಂ) ಅಯಾನುಗಳೊಂದಿಗೆ ಆಮ್ಲಗಳಲ್ಲಿನ ಹೈಡ್ರೋಜನ್ ಕ್ಯಾಟಯಾನುಗಳ ಅಪೂರ್ಣ ಬದಲಿ ಉತ್ಪನ್ನಗಳಾಗಿವೆ: NaHCO 3, NaH 2 PO 4, Na 2 HPO 4, ಇತ್ಯಾದಿ. ಆಮ್ಲ ಲವಣಗಳು ಪಾಲಿಬಾಸಿಕ್ ಆಮ್ಲಗಳಿಂದ ಮಾತ್ರ ರೂಪುಗೊಳ್ಳುತ್ತವೆ. ಬಹುತೇಕ ಎಲ್ಲಾ ಆಮ್ಲ ಲವಣಗಳು ನೀರಿನಲ್ಲಿ ಹೆಚ್ಚು ಕರಗುತ್ತವೆ.
ಆಮ್ಲೀಯ ಲವಣಗಳನ್ನು ಪಡೆಯುವುದು ಮತ್ತು ಅವುಗಳನ್ನು ಮಧ್ಯಮ ಲವಣಗಳಾಗಿ ಪರಿವರ್ತಿಸುವುದು
1. ಆಸಿಡ್ ಲವಣಗಳನ್ನು ಹೆಚ್ಚುವರಿ ಆಮ್ಲ ಅಥವಾ ಆಮ್ಲ ಆಕ್ಸೈಡ್ ಅನ್ನು ಬೇಸ್ನೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯಿಸುವ ಮೂಲಕ ಪಡೆಯಲಾಗುತ್ತದೆ:
H 2 CO 3 + NaOH = NaHCO 3 + H 2 O
CO 2 + NaOH = NaHCO 3
2. ಹೆಚ್ಚುವರಿ ಆಮ್ಲವು ಮೂಲ ಆಕ್ಸೈಡ್ನೊಂದಿಗೆ ಸಂವಹನ ನಡೆಸಿದಾಗ:
2H 2 CO 3 + CaO = Ca (HCO 3) 2 + H 2 O
3. ಆಮ್ಲವನ್ನು ಸೇರಿಸುವ ಮೂಲಕ ಮಧ್ಯಮ ಲವಣಗಳಿಂದ ಆಮ್ಲ ಲವಣಗಳನ್ನು ಪಡೆಯಲಾಗುತ್ತದೆ:
· ನಾಮಸೂಚಕ
Na 2 SO 3 + H 2 SO 3 = 2NaHSO 3;
Na 2 SO 3 + HCl = NaHSO 3 + NaCl
4. ಕ್ಷಾರವನ್ನು ಬಳಸಿಕೊಂಡು ಆಮ್ಲ ಲವಣಗಳನ್ನು ಮಧ್ಯಮ ಲವಣಗಳಾಗಿ ಪರಿವರ್ತಿಸಲಾಗುತ್ತದೆ:
NaHCO 3 + NaOH = Na 2 CO 3 + H 2 O
ಮೂಲ ಲವಣಗಳು- ಇವು ಹೈಡ್ರಾಕ್ಸೋ ಗುಂಪುಗಳ ಅಪೂರ್ಣ ಪರ್ಯಾಯದ ಉತ್ಪನ್ನಗಳಾಗಿವೆ (OH - ) ಮೈದಾನಗಳು ಆಮ್ಲ ಶೇಷ: MgOHCl, AlOHSO 4, ಇತ್ಯಾದಿ. ಮೂಲಭೂತ ಲವಣಗಳು ಪಾಲಿವಾಲೆಂಟ್ ಲೋಹಗಳ ದುರ್ಬಲ ನೆಲೆಗಳಿಂದ ಮಾತ್ರ ರೂಪುಗೊಳ್ಳುತ್ತವೆ. ಈ ಲವಣಗಳು ಸಾಮಾನ್ಯವಾಗಿ ಕಡಿಮೆ ಕರಗುತ್ತವೆ.
ಮೂಲ ಲವಣಗಳನ್ನು ಪಡೆಯುವುದು ಮತ್ತು ಅವುಗಳನ್ನು ಮಧ್ಯಮ ಲವಣಗಳಾಗಿ ಪರಿವರ್ತಿಸುವುದು
1. ಆಸಿಡ್ ಅಥವಾ ಆಸಿಡ್ ಆಕ್ಸೈಡ್ನೊಂದಿಗೆ ಬೇಸ್ನ ಹೆಚ್ಚುವರಿ ಪ್ರತಿಕ್ರಿಯಿಸುವ ಮೂಲಕ ಮೂಲ ಲವಣಗಳನ್ನು ಪಡೆಯಲಾಗುತ್ತದೆ:
Mg(OH) 2 + HCl = MgOHCl¯ + H 2 O
ಹೈಡ್ರೋಕ್ಸೋ-
ಮೆಗ್ನೀಸಿಯಮ್ ಕ್ಲೋರೈಡ್
Fe(OH) 3 + SO 3 = FeOHSO 4 ¯ + H 2 O
ಹೈಡ್ರೋಕ್ಸೋ-
ಕಬ್ಬಿಣ (III) ಸಲ್ಫೇಟ್
2. ಕ್ಷಾರದ ಕೊರತೆಯನ್ನು ಸೇರಿಸುವ ಮೂಲಕ ಮಧ್ಯಮ ಉಪ್ಪಿನಿಂದ ಮೂಲ ಲವಣಗಳು ರೂಪುಗೊಳ್ಳುತ್ತವೆ:
Fe 2 (SO 4) 3 + 2NaOH = 2FeOHSO 4 + Na 2 SO 4
3. ಆಮ್ಲವನ್ನು ಸೇರಿಸುವ ಮೂಲಕ ಮೂಲ ಲವಣಗಳನ್ನು ಮಧ್ಯಮ ಲವಣಗಳಾಗಿ ಪರಿವರ್ತಿಸಲಾಗುತ್ತದೆ (ಮೇಲಾಗಿ ಉಪ್ಪುಗೆ ಅನುಗುಣವಾಗಿರುವುದು):
MgOHCl + HCl = MgCl 2 + H 2 O
2MgOHCl + H 2 SO 4 = MgCl 2 + MgSO 4 + 2H 2 O
ಎಲೆಕ್ಟ್ರೋಲೈಟ್ಗಳು
ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳು- ಇವು ಧ್ರುವೀಯ ದ್ರಾವಕ ಅಣುಗಳ (H 2 O) ಪ್ರಭಾವದ ಅಡಿಯಲ್ಲಿ ದ್ರಾವಣದಲ್ಲಿ ಅಯಾನುಗಳಾಗಿ ವಿಭಜನೆಯಾಗುವ ವಸ್ತುಗಳು. ಬೇರ್ಪಡಿಸುವ ಸಾಮರ್ಥ್ಯದ ಆಧಾರದ ಮೇಲೆ (ಅಯಾನುಗಳಾಗಿ ಒಡೆಯುತ್ತವೆ), ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳನ್ನು ಸಾಂಪ್ರದಾಯಿಕವಾಗಿ ಬಲವಾದ ಮತ್ತು ದುರ್ಬಲವಾಗಿ ವಿಂಗಡಿಸಲಾಗಿದೆ. ಬಲವಾದ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳು ಬಹುತೇಕ ಸಂಪೂರ್ಣವಾಗಿ (ತೆಳುವಾದ ದ್ರಾವಣಗಳಲ್ಲಿ) ವಿಭಜನೆಯಾಗುತ್ತವೆ, ಆದರೆ ದುರ್ಬಲ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳು ಭಾಗಶಃ ಮಾತ್ರ ಅಯಾನುಗಳಾಗಿ ವಿಭಜನೆಯಾಗುತ್ತವೆ.
TO ಬಲವಾದ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳುಸಂಬಂಧಿಸಿ:
· ಬಲವಾದ ಆಮ್ಲಗಳು(ಪುಟ 20 ನೋಡಿ);
· ಬಲವಾದ ಕಾರಣಗಳು- ಅಲ್ಕಾಲಿಸ್ (ಪುಟ 22 ನೋಡಿ);
· ಬಹುತೇಕ ಎಲ್ಲಾ ಕರಗುವ ಲವಣಗಳು.
ದುರ್ಬಲ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳು ಸೇರಿವೆ:
ದುರ್ಬಲ ಆಮ್ಲಗಳು (ಪುಟ 20 ನೋಡಿ);
· ನೆಲೆಗಳು ಕ್ಷಾರವಲ್ಲ;
ದುರ್ಬಲ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯದ ಮುಖ್ಯ ಗುಣಲಕ್ಷಣಗಳಲ್ಲಿ ಒಂದಾಗಿದೆ ವಿಘಟನೆ ಸ್ಥಿರ – TO . ಉದಾಹರಣೆಗೆ, ಮೊನೊಬಾಸಿಕ್ ಆಮ್ಲಕ್ಕಾಗಿ,
HA Û H + +A - ,
ಅಲ್ಲಿ, H + ಅಯಾನುಗಳ ಸಮತೋಲನ ಸಾಂದ್ರತೆ;
- ಆಮ್ಲ ಅಯಾನುಗಳ ಸಮತೋಲನ ಸಾಂದ್ರತೆ A - ;
- ಆಮ್ಲ ಅಣುಗಳ ಸಮತೋಲನ ಸಾಂದ್ರತೆ,
ಅಥವಾ ಇದಕ್ಕಾಗಿ ದುರ್ಬಲ ಅಡಿಪಾಯ,
MOH Û M + +OH - ,
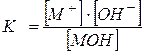 ,
,
ಅಲ್ಲಿ, M + ಕ್ಯಾಟಯಾನ್ಗಳ ಸಮತೋಲನ ಸಾಂದ್ರತೆ;
- ಹೈಡ್ರಾಕ್ಸೈಡ್ ಅಯಾನುಗಳ ಸಮತೋಲನ ಸಾಂದ್ರತೆ OH - ;
- ದುರ್ಬಲ ಮೂಲ ಅಣುಗಳ ಸಮತೋಲನ ಸಾಂದ್ರತೆ.
ಕೆಲವರ ವಿಘಟನೆ ಸ್ಥಿರಾಂಕಗಳು ದುರ್ಬಲ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳು(t = 25 ° C ನಲ್ಲಿ)
| ವಸ್ತು | TO | ವಸ್ತು | TO |
| HCOOH | ಕೆ = 1.8×10 -4 | H3PO4 | ಕೆ 1 = 7.5×10 -3 |
| CH3COOH | ಕೆ = 1.8×10 -5 | ಕೆ 2 = 6.3×10 -8 | |
| ಹೆಚ್.ಸಿ.ಎನ್ | ಕೆ = 7.9×10 -10 | ಕೆ 3 = 1.3×10 -12 | |
| H2CO3 | ಕೆ 1 = 4.4×10 -7 | HClO | ಕೆ = 2.9×10 -8 |
| K2 = 4.8×10 -11 | H3BO3 | ಕೆ 1 = 5.8×10 -10 | |
| HF | ಕೆ = 6.6×10 -4 | K2 = 1.8×10 -13 | |
| HNO2 | ಕೆ = 4.0×10 -4 | ಕೆ 3 = 1.6×10 -14 | |
| H2SO3 | ಕೆ 1 = 1.7×10 -2 | H2O | ಕೆ = 1.8×10 -16 |
| ಕೆ 2 = 6.3×10 -8 | NH 3 × H 2 O | ಕೆ = 1.8×10 -5 | |
| H2S | ಕೆ 1 = 1.1×10 -7 | ಅಲ್(OH) 3 | ಕೆ 3 = 1.4×10 -9 |
| K2 = 1.0×10 -14 | Zn(OH)2 | ಕೆ 1 = 4.4×10 -5 | |
| H2SiO3 | ಕೆ 1 = 1.3×10 -10 | ಕೆ 2 = 1.5×10 -9 | |
| K2 = 1.6×10 -12 | ಸಿಡಿ(OH)2 | ಕೆ 2 = 5.0×10 -3 | |
| Fe(OH)2 | ಕೆ 2 = 1.3×10 -4 | Cr(OH)3 | ಕೆ 3 = 1.0×10 -10 |
| Fe(OH) 3 | K2 = 1.8×10 -11 | Ag(OH) | ಕೆ = 1.1×10 -4 |
| ಕೆ 3 = 1.3×10 -12 | Pb(OH)2 | ಕೆ 1 = 9.6×10 -4 | |
| Cu(OH)2 | ಕೆ 2 = 3.4×10 -7 | ಕೆ 2 = 3.0×10 -8 | |
| ನಿ(OH)2 | ಕೆ 2 = 2.5×10 -5 |
4.4 ಉಷ್ಣ ವಿಘಟನೆನೀರಿನಲ್ಲಿ ಕರಗದ ನೆಲೆಗಳು.
ಅನೇಕ ನೀರಿನಲ್ಲಿ ಕರಗದ ನೆಲೆಗಳು ಬಿಸಿಯಾದಾಗ ಕೊಳೆಯುತ್ತವೆ. ವಿಭಜನೆಯ ಉತ್ಪನ್ನಗಳು ಅನುಗುಣವಾದ ಲೋಹಗಳು ಮತ್ತು ನೀರಿನ ಆಕ್ಸೈಡ್ಗಳಾಗಿರುತ್ತದೆ. ತಾಪನ ತಾಪಮಾನವು ಬೇಸ್ನ ಭಾಗವಾಗಿರುವ ಲೋಹದ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿರುತ್ತದೆ ಮತ್ತು 200 ° C ಮತ್ತು ಅದಕ್ಕಿಂತ ಹೆಚ್ಚಿನ ವ್ಯಾಪ್ತಿಯಲ್ಲಿರುತ್ತದೆ.
ಸತು, ತಾಮ್ರ ಮತ್ತು ಅಲ್ಯೂಮಿನಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ವಿಭಜನೆಯ ಪ್ರತಿಕ್ರಿಯೆಗಳನ್ನು ನಾವು ಬರೆಯೋಣ:
ಮೇಲಿನ ಪ್ರತಿಕ್ರಿಯೆಗಳ ಉತ್ಪನ್ನಗಳು ನೀರು ಮತ್ತು ಲೋಹದ ಆಕ್ಸೈಡ್ಗಳು: , ಮತ್ತು .
4.5 ಲೋಹದ ಲವಣಗಳೊಂದಿಗೆ ಸಂವಹನ.
ಈ ಪ್ರತಿಕ್ರಿಯೆಯು ಕ್ಷಾರಗಳ ಲಕ್ಷಣವಾಗಿದೆ. ಪೊಟ್ಯಾಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು. ಸೋಡಿಯಂ ಲಿಥಿಯಂ ಲೋಹದ ಲವಣಗಳೊಂದಿಗೆ ಸಂವಹನ ನಡೆಸುತ್ತದೆ, ಇದರ ಪರಿಣಾಮವಾಗಿ ಈ ಲೋಹಗಳ ಕರಗದ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಅವಕ್ಷೇಪಿಸುತ್ತವೆ:
ಈ ಪ್ರತಿಕ್ರಿಯೆಗಳನ್ನು ಬಳಸಿಕೊಂಡು, ಅನೇಕ ಲೋಹಗಳ ನೀರಿನಲ್ಲಿ ಕರಗದ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳನ್ನು ಪಡೆಯಲಾಗುತ್ತದೆ, ನಂತರ ಅವುಗಳನ್ನು ರಾಸಾಯನಿಕ ಸಂಶ್ಲೇಷಣೆ, ಔಷಧ, ಇತ್ಯಾದಿಗಳಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ.
ಅಧ್ಯಾಯ 5. ರಸಾಯನಶಾಸ್ತ್ರ ಮತ್ತು ಉದ್ಯಮದಲ್ಲಿ ನೆಲೆಗಳ ಬಳಕೆ.
ಬೇಸ್ಗಳನ್ನು ರಸಾಯನಶಾಸ್ತ್ರ ಪ್ರಯೋಗಾಲಯ ಮತ್ತು ಎರಡರಲ್ಲೂ ವ್ಯಾಪಕವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ ರಾಸಾಯನಿಕ ಉದ್ಯಮ, ಅವರು ದೈನಂದಿನ ಜೀವನದಲ್ಲಿ ತಮ್ಮ ಅಪ್ಲಿಕೇಶನ್ ಅನ್ನು ಕಂಡುಕೊಳ್ಳುತ್ತಾರೆ.
ಹೆಚ್ಚು ವ್ಯಾಪಕವಾಗಿ ಬಳಸಲಾಗುವ ಬೇಸ್ಗಳ ಅಪ್ಲಿಕೇಶನ್ ಅನ್ನು ಪರಿಗಣಿಸೋಣ.
ರಾಸಾಯನಿಕ ಪ್ರಯೋಗಾಲಯಗಳಲ್ಲಿ ಮತ್ತು ಉದ್ಯಮದಲ್ಲಿ, ಸೋಡಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಅತ್ಯಂತ ಜನಪ್ರಿಯ ಕಾರಕಗಳಲ್ಲಿ ಒಂದಾಗಿದೆ.
ಸೋಡಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್, .
ವಿವಿಧ ಸೋಡಿಯಂ ಲವಣಗಳನ್ನು ಉತ್ಪಾದಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ: ಸಲ್ಫೇಟ್, ನೈಟ್ರೇಟ್, ನೈಟ್ರೈಟ್, ಕ್ರೋಮೇಟ್, ಸಿಲಿಕೇಟ್ಗಳು, ಅಥವಾ ನೀರಿನ ಗಾಜು, ಫ್ಲೋರಿಡಾ, ಲವಣಗಳು ಸಾವಯವ ಆಮ್ಲಗಳು. ಕ್ರಾಫ್ಟ್ ಅಡುಗೆ, ಕೃತಕ ನಾರುಗಳು, ಸಾಬೂನು ಮತ್ತು ಸಮಯದಲ್ಲಿ ಮರದಿಂದ ತಿರುಳು ಉತ್ಪಾದನೆಯಲ್ಲಿ ಇದನ್ನು ಬಳಸಲಾಗುತ್ತದೆ ಮಾರ್ಜಕಗಳು, ತೇವಗೊಳಿಸುವ ಏಜೆಂಟ್ಗಳು ಮತ್ತು ಎಮಲ್ಸಿಫೈಯರ್ಗಳು, ಬಣ್ಣಗಳು, ಬಾಕ್ಸೈಟ್ನಿಂದ ಅಲ್ಯೂಮಿನಿಯಂ ಆಕ್ಸೈಡ್, ಫೀನಾಲ್ಗಳು. ಬ್ಲ್ಯೂಯಿಂಗ್ ಸ್ಟೀಲ್, ಆಕ್ಸಿಡೈಸಿಂಗ್ ಲೋಹಗಳು, ವಿಶೇಷವಾಗಿ ಅಲ್ಯೂಮಿನಿಯಂಗಾಗಿ ಎಲೆಕ್ಟ್ರೋಲೈಟ್ಗಳಲ್ಲಿ ಸೇರಿಸಲಾಗಿದೆ ಎಲೆಕ್ಟ್ರೋಲೈಟಿಕ್ ಪ್ರಕ್ರಿಯೆಗಳುತವರ ಮತ್ತು ಸತು ತಂತ್ರಜ್ಞಾನದಲ್ಲಿ.
ಪೊಟ್ಯಾಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್, .
ಅನೇಕ ಪೊಟ್ಯಾಸಿಯಮ್ ಲವಣಗಳು, ದ್ರವ ಸೋಪುಗಳು ಮತ್ತು ಕೆಲವು ಬಣ್ಣಗಳ ಉತ್ಪಾದನೆಗೆ ಆರಂಭಿಕ ವಸ್ತುವಾಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತದೆ. ಇದನ್ನು ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯವಾಗಿ, ಲಿಥಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ನೊಂದಿಗೆ, ನಿಕಲ್-ಕ್ಯಾಡ್ಮಿಯಮ್ ಬ್ಯಾಟರಿಗಳಲ್ಲಿ, ಕ್ಸಾಂಥೇಟ್ಗಳ ಉತ್ಪಾದನೆಗೆ ಆಲ್ಕೋಹಾಲ್ ದ್ರಾವಣದ ರೂಪದಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ - ಫ್ಲೋಟೇಶನ್ ಏಜೆಂಟ್ಗಳ ಉತ್ಪಾದನೆಯಲ್ಲಿ ಮಧ್ಯವರ್ತಿಗಳು.
ಅಮೋನಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್, .
ಪ್ರಪಂಚದಲ್ಲಿ ಇದರ ಉತ್ಪಾದನೆಯು ಸುಮಾರು 10 - 12 ಮಿಲಿಯನ್ ಟನ್ಗಳು. ಪಶು ಆಹಾರದ ಉತ್ಪಾದನೆಯಲ್ಲಿ ಅವುಗಳ ಪೌಷ್ಟಿಕಾಂಶದ ಮೌಲ್ಯವನ್ನು ಹೆಚ್ಚಿಸಲು ಮತ್ತು ಸಂರಕ್ಷಕವಾಗಿ, ಸೋಡಾ, ವರ್ಣಗಳ ಉತ್ಪಾದನೆಯಲ್ಲಿ, ಮ್ಯಾಂಗನೀಸ್ ಸಂಯುಕ್ತಗಳ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯ ಉತ್ಪಾದನೆಯಲ್ಲಿ ಇದನ್ನು ಗೊಬ್ಬರವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ. ಪ್ರಯೋಗಾಲಯ ಅಭ್ಯಾಸ.
ಕ್ಯಾಲ್ಸಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್, .
ಕ್ಯಾಲ್ಸಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ (ಸ್ಲೇಕ್ಡ್ ಸುಣ್ಣ) ಅನ್ನು ಕಟ್ಟಡ ಸಾಮಗ್ರಿಗಳ ಉತ್ಪಾದನೆಯಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ; ಸುಣ್ಣದ ಗಾರೆ ಅದರಿಂದ ತಯಾರಿಸಲಾಗುತ್ತದೆ. ಇದನ್ನು ಬ್ಲೀಚ್ (ಮಿಶ್ರಣ) ಮತ್ತು ಇತರ ಕ್ಯಾಲ್ಸಿಯಂ ಸಂಯುಕ್ತಗಳು, ನಿಂಬೆ ರಸಗೊಬ್ಬರಗಳು ಮತ್ತು ಸಸ್ಯ ರಕ್ಷಣಾತ್ಮಕ ಏಜೆಂಟ್ಗಳನ್ನು ತಯಾರಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ. ಕ್ಯಾಲ್ಸಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಅನ್ನು ನೀರನ್ನು ಮೃದುಗೊಳಿಸಲು, ಚರ್ಮವನ್ನು ಕಂದುಬಣ್ಣಗೊಳಿಸಲು ಮತ್ತು ತಟಸ್ಥಗೊಳಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ ತ್ಯಾಜ್ಯನೀರು, ಸಸ್ಯ ರಸಗಳಿಂದ ಸಾವಯವ ಆಮ್ಲಗಳ ಲವಣಗಳನ್ನು ಪ್ರತ್ಯೇಕಿಸಿ.
ಲಿಥಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್, .
ಕ್ಷಾರೀಯ ಬ್ಯಾಟರಿಗಳನ್ನು ತುಂಬಲು ಇದನ್ನು ಬಳಸಲಾಗುತ್ತದೆ, ಇದು ಅವರ ಜೀವಿತಾವಧಿಯನ್ನು ಹೆಚ್ಚಿಸುತ್ತದೆ ಮತ್ತು ದಂತಕವಚಗಳು ಮತ್ತು ಗಾಜಿನ ತಯಾರಿಕೆಗೆ ಬಳಸಲಾಗುತ್ತದೆ.
ಮೆಗ್ನೀಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್, .
ನಿರ್ಮಾಣ ಉದ್ಯಮದಲ್ಲಿ, ಸೆರಾಮಿಕ್ ರಾಸಾಯನಿಕ ಸಾಮಾನುಗಳ ತಯಾರಿಕೆಗಾಗಿ ಬೆಂಕಿ-ನಿರೋಧಕ ರಚನಾತ್ಮಕ ವಸ್ತುಗಳ ಒಂದು ಅಂಶವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ. ಔಷಧದಲ್ಲಿ ಸೌಮ್ಯವಾದ ತಟಸ್ಥಗೊಳಿಸುವ ಏಜೆಂಟ್ ಆಗಿ ಬಳಸಲಾಗುತ್ತದೆ (ಹೆಚ್ಚಿನ ಆಮ್ಲೀಯತೆಗೆ ಗ್ಯಾಸ್ಟ್ರಿಕ್ ರಸ).
ಇತರ ಕಡಿಮೆ ಸಾಮಾನ್ಯ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಅಪ್ಲಿಕೇಶನ್ಗಳನ್ನು ಕೋಷ್ಟಕ 3 ರಲ್ಲಿ ಪಟ್ಟಿ ಮಾಡಲಾಗಿದೆ
ಕೋಷ್ಟಕ 3. ಲೋಹದ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಅನ್ವಯಗಳು.
| № | ಹೈಡ್ರಾಕ್ಸೈಡ್ ಹೆಸರು | ರಾಸಾಯನಿಕ | ಅಪ್ಲಿಕೇಶನ್ |
| 1. | ತಾಮ್ರದ ಹೈಡ್ರಾಕ್ಸೈಡ್ | ಗಾಜು, ಎನಾಮೆಲ್ಗಳು ಮತ್ತು ಮೆರುಗುಗಳಿಗೆ ವರ್ಣದ್ರವ್ಯವಾಗಿ, ಬಟ್ಟೆಗಳಿಗೆ ಡೈಯಿಂಗ್ ಮಾಡಲು ಮಾರ್ಡೆಂಟ್ ಮತ್ತು ಶಿಲೀಂಧ್ರನಾಶಕವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ. ಶ್ವೀಟ್ಜರ್ನ ಕಾರಕದ ತಯಾರಿಕೆಗಾಗಿ ನೈಲಾನ್ ಸ್ಟೇಬಿಲೈಸರ್. | |
| 2. | ಸತು ಹೈಡ್ರಾಕ್ಸೈಡ್ | ರಬ್ಬರ್ ಫಿಲ್ಲರ್, ಪೇಂಟ್ ಕಾಂಪೊನೆಂಟ್, ಪಶುವೈದ್ಯಕೀಯ ಔಷಧದಲ್ಲಿ ಮುಲಾಮುಗಳ ಅಂಶವಾಗಿ. | |
| 3. | ಕೋಬಾಲ್ಟ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ | ವೇಗವರ್ಧಕಗಳು, ವರ್ಣದ್ರವ್ಯಗಳು,... |
|
| 4. | ಕ್ಯಾಡ್ಮಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ | ಕ್ಯಾಡ್ಮಿಯಮ್ ಸಂಯುಕ್ತಗಳ ತಯಾರಿಕೆಗೆ, ವಿಶ್ಲೇಷಣಾತ್ಮಕ ಕಾರಕವಾಗಿ, ಕ್ಯಾಡ್ಮಿಯಮ್ ಪ್ರಸ್ತುತ ಮೂಲಗಳಲ್ಲಿ ಸಕ್ರಿಯ ದ್ರವ್ಯರಾಶಿಯ ಉತ್ಪಾದನೆಗೆ ಬಳಸಲಾಗುತ್ತದೆ. | |
| 5. | ಅಲ್ಯೂಮಿನಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ | ಇದು ಅಲ್ಯೂಮಿನಿಯಂ ಸಂಯುಕ್ತಗಳನ್ನು ಉತ್ಪಾದಿಸಲು, ಬಣ್ಣಗಳು ಮತ್ತು ಪ್ಲಾಸ್ಟಿಕ್ಗಳಲ್ಲಿ ಅಗ್ನಿಶಾಮಕವಾಗಿ, ಟೂತ್ಪೇಸ್ಟ್ಗಳ ಒಂದು ಘಟಕವಾಗಿ ಮತ್ತು ಔಷಧದಲ್ಲಿ ಹೊದಿಕೆ ಮತ್ತು ಆಡ್ಸರ್ಬೆಂಟ್ ಏಜೆಂಟ್ ಆಗಿ ಬಳಸಲಾಗುತ್ತದೆ. | |
| 6. | ಬೆರಿಲಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ | ವಕ್ರೀಕಾರಕ ಪಿಂಗಾಣಿಗಳನ್ನು ಉತ್ಪಾದಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ. ಕ್ರೂಸಿಬಲ್ಸ್, UV ಕಿರಣಗಳನ್ನು ಚೆನ್ನಾಗಿ ರವಾನಿಸುವ ಕನ್ನಡಕಗಳ ಒಂದು ಘಟಕ. | |
| 7. | ಟಿನ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ | ಎಚ್ಚಣೆ ಬಟ್ಟೆಗಳಿಗೆ, ವಿಶೇಷವಾಗಿ ರೇಷ್ಮೆ. | |
| 8. | ಸೀಸದ ಹೈಡ್ರಾಕ್ಸೈಡ್ | ಎಚ್ಚಣೆ ಬಟ್ಟೆಗಳಿಗೆ, ಗಾಜು ತಯಾರಿಸಲು, ಬ್ಯಾಟರಿ ಫಿಲ್ಲರ್. | |
| 9. | ಬಿಸ್ಮತ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ | ಎನಾಮೆಲ್ಸ್ ಮತ್ತು ಸೆರಾಮಿಕ್ಸ್, ಸ್ಫಟಿಕ ಮತ್ತು ವಿಶೇಷ ತಯಾರಿಕೆಯಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ. ಗಾಜು, ಅಲ್ಟ್ರಾಸಾನಿಕ್ ವಸ್ತುಗಳ ಉತ್ಪಾದನೆಗೆ | |
| 10. | ಕ್ರೋಮಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ | ವಿಶ್ಲೇಷಣಾತ್ಮಕ ರಸಾಯನಶಾಸ್ತ್ರದಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ. | |
| 11. | ಮ್ಯಾಂಗನೀಸ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ | ಮ್ಯಾಂಗನೀಸ್ ಸಂಯುಕ್ತಗಳನ್ನು ಪಡೆಯಲು ಬಳಸಲಾಗುತ್ತದೆ. | |
| 12. | ಕಬ್ಬಿಣದ ಹೈಡ್ರಾಕ್ಸೈಡ್ | ಲೋಹೀಯ ಕಬ್ಬಿಣ, ಬಣ್ಣ ವರ್ಣದ್ರವ್ಯಗಳ ಉತ್ಪಾದನೆಗೆ ಆಧಾರ |
ತೀರ್ಮಾನ.
ಅಡಿಪಾಯಗಳು ತರಗತಿಗಳಲ್ಲಿ ಒಂದಾಗಿದೆ ಅಜೈವಿಕ ವಸ್ತುಗಳು, ಇದು ಆಮ್ಲಗಳು, ಆಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಲವಣಗಳ ಜೊತೆಗೆ ಅಜೈವಿಕ ರಸಾಯನಶಾಸ್ತ್ರದ ಆಧಾರವಾಗಿದೆ. ಅವುಗಳನ್ನು ವ್ಯಾಪಕವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ ವಿವಿಧ ಪ್ರದೇಶಗಳುರಸಾಯನಶಾಸ್ತ್ರ ಮತ್ತು ರಾಸಾಯನಿಕ ಉದ್ಯಮ. ಅವರ ಸಹಾಯದಿಂದ, ರಸಗೊಬ್ಬರಗಳನ್ನು ಪಡೆಯಲಾಗುತ್ತದೆ, ನಿರ್ಮಾಣ ಸಾಮಗ್ರಿಗಳು, ಬಣ್ಣದ ಗಾಜು. ಅವುಗಳಿಲ್ಲದೆ, ನಾವು ಬೆಳಕು ಮತ್ತು ಆರ್ಥಿಕ ಕ್ಷಾರೀಯ ಬ್ಯಾಟರಿಗಳು ಮತ್ತು ಅನೇಕ ವೈದ್ಯಕೀಯ ಸರಬರಾಜುಗಳನ್ನು ಕಳೆದುಕೊಳ್ಳುತ್ತೇವೆ.
ಈ ವರ್ಗದ ಅಜೈವಿಕ ಜ್ಞಾನವನ್ನು ವ್ಯವಸ್ಥಿತಗೊಳಿಸುವುದು ಈ ಕೆಲಸದ ಕಾರ್ಯವಾಗಿತ್ತು ರಾಸಾಯನಿಕ ವಸ್ತುಗಳುಮೂಲಭೂತವಾಗಿ, ಅವುಗಳ ರಾಸಾಯನಿಕವನ್ನು ಒಟ್ಟುಗೂಡಿಸುವುದು ಅಗತ್ಯವಾಗಿತ್ತು ಮತ್ತು ಭೌತಿಕ ಗುಣಲಕ್ಷಣಗಳು, ಅವರ ಉತ್ಪಾದನೆ ಮತ್ತು ಉದ್ಯಮದಲ್ಲಿ ಬಳಕೆ.
ಪ್ರಗತಿಯಲ್ಲಿದೆ ವಿಶೇಷ ಗಮನಬ್ರಾನ್ಸ್ಟೆಡ್, ಲೆವಿಸ್, ಇಜ್ಮೈಲೋವ್ ಅವರ ಆಧುನಿಕ ಆಸಿಡ್-ಬೇಸ್ ಸಿದ್ಧಾಂತಗಳ ಆಧಾರದ ಮೇಲೆ ಅಜೈವಿಕ ವಸ್ತುಗಳ ವರ್ಗಗಳಲ್ಲಿ ಒಂದಾಗಿ ಬೇಸ್ಗಳ ಪರಿಕಲ್ಪನೆಯನ್ನು ಹೈಲೈಟ್ ಮಾಡಲು ಮೀಸಲಿಡಲಾಗಿದೆ. ಉಸಾನೋವಿಚ್. ಸಹ ಪರಿಗಣಿಸಲಾಗಿದೆ ಕೈಗಾರಿಕಾ ವಿಧಾನಗಳುಸೋಡಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ [3, ಕಲೆಯ ಉದಾಹರಣೆಯನ್ನು ಬಳಸಿಕೊಂಡು ಕ್ಷಾರವನ್ನು ಪಡೆಯುವುದು. 36 – 42]. ಹೆಚ್ಚು ಗಮನದೈನಂದಿನ ಜೀವನದಲ್ಲಿ ಮತ್ತು ರಾಸಾಯನಿಕ, ವೈದ್ಯಕೀಯ ಮತ್ತು ನಿರ್ಮಾಣ ಉದ್ಯಮಗಳಲ್ಲಿ ನೆಲೆಗಳನ್ನು ಬಳಸುವ ವಿಧಾನಗಳಿಗೆ ಪಾವತಿಸಲಾಗುತ್ತದೆ, ಅಲ್ಲಿ ಅವರು ತಮ್ಮ ಅಪ್ಲಿಕೇಶನ್ ಅನ್ನು ಕಂಡುಕೊಳ್ಳುತ್ತಾರೆ. ನಿರ್ದಿಷ್ಟ ಪದಾರ್ಥಗಳ ಅನ್ವಯದ ಮುಖ್ಯ ಕ್ಷೇತ್ರಗಳು ಬಳಕೆಯ ಸುಲಭತೆಗಾಗಿ ವಿಶೇಷ ಉಲ್ಲೇಖ ಕೋಷ್ಟಕದಲ್ಲಿ ಪಟ್ಟಿಮಾಡಲಾಗಿದೆ.
ಆಧಾರಗಳ ಗುಣಲಕ್ಷಣಗಳ ಅಧ್ಯಯನವು ಹೊಂದಿದೆ ಹೆಚ್ಚಿನ ಪ್ರಾಮುಖ್ಯತೆರಸಾಯನಶಾಸ್ತ್ರದ ಅಧ್ಯಯನದಲ್ಲಿ, ಹಾಗೆಯೇ ವೈಜ್ಞಾನಿಕ ವಿಶ್ವ ದೃಷ್ಟಿಕೋನದ ಬೆಳವಣಿಗೆಗೆ.
ಬಳಸಿದ ಸಾಹಿತ್ಯದ ಪಟ್ಟಿ.
1. ಗ್ಲಿಂಕಾ ಎನ್.ಎಲ್. ಸಾಮಾನ್ಯ ರಸಾಯನಶಾಸ್ತ್ರ. - ಎಲ್.: ರಸಾಯನಶಾಸ್ತ್ರ, 1988. - 702 ಪು.
2. ಕ್ರೆಶ್ಕೋವ್ A.P., ಯಾರೋಸ್ಲಾವ್ಟ್ಸೆವ್ A.A. ವಿಶ್ಲೇಷಣಾತ್ಮಕ ರಸಾಯನಶಾಸ್ತ್ರದ ಕೋರ್ಸ್. - ಎಂ.: ರಸಾಯನಶಾಸ್ತ್ರ, 1964. - 430 ಪು.
3. ಪೊಡೊಬಾವ್ ಎನ್.ಐ. ವಿದ್ಯುದ್ವಿಭಜನೆ. – ಎಂ.: ಶಿಕ್ಷಣ, 1989, 100 ಪು.
4. ಪೋಲೀಸ್ ಎಂ. ಇ. ವಿಶ್ಲೇಷಣಾತ್ಮಕ ರಸಾಯನಶಾಸ್ತ್ರ. - ಎಂ.: ಮೆಡಿಸಿನ್, 1981. - 286 ಪು.
5. ರಾಬಿನೋವಿಚ್ ವಿ.ಎ., ಖಾವಿನ್ ಝಡ್.ಯಾ. ಕ್ರಾಟ್ಕಿ ರಾಸಾಯನಿಕ ಉಲ್ಲೇಖ ಪುಸ್ತಕ. - ಎಲ್.: ರಸಾಯನಶಾಸ್ತ್ರ, 1978. - 331 ಪು.
6. ರಸಾಯನಶಾಸ್ತ್ರ: ಉಲ್ಲೇಖ ಪ್ರಕಟಣೆ/ ಸಂ. W. ಶ್ರೋಟರ್, K.-H, ಲೌಟೆನ್ಸ್ಚ್ಲೇಗರ್, H. ಬಿಬ್ರಾಕ್ ಮತ್ತು ಇತರರು: ಟ್ರಾನ್ಸ್. ಅವನ ಜೊತೆ. - ಎಂ.: ರಸಾಯನಶಾಸ್ತ್ರ, 1989. - 648 ಪು.
7. ರಾಸಾಯನಿಕ ವಿಶ್ವಕೋಶ 5 ಸಂಪುಟಗಳಲ್ಲಿ / ಸಂ. I. L. Knunyants. - ಎಂ.: ಸೋವಿಯತ್ ವಿಶ್ವಕೋಶ, 1990.
8. ಶುಕರೆವ್ ಎಸ್. ಎ. ಅಜೈವಿಕ ರಸಾಯನಶಾಸ್ತ್ರ. - ಎಂ.: ಪದವಿ ಶಾಲಾ, 1970. - 437 ಪು.
ನೆದರ್ಲ್ಯಾಂಡ್ಸ್ನಲ್ಲಿ, ಎರಡೂ ದೇಶಗಳು ಉಣ್ಣೆಯನ್ನು ಮಾರಿದವು ಮತ್ತು ಸ್ಪ್ಯಾನಿಷ್ ನೊಗದ ವಿರುದ್ಧ ಬಂಡಾಯವೆದ್ದ ಗ್ಯುಜ್ಗೆ ಬ್ರಿಟಿಷರು ಸಹಾಯ ಮಾಡಿದರು. ಈ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ, ಅಂದಿನ ಜೊತೆ ತ್ವರಿತ ಅಭಿವೃದ್ಧಿಇಂಗ್ಲೆಂಡ್ನಲ್ಲಿ ಬೂರ್ಜ್ವಾ ಸಂಬಂಧಗಳು ಹೊಸ ಪ್ರಪಂಚ- ಸ್ಪೇನ್ನ ಹಿಂಭಾಗ, ಶ್ರೀಮಂತ ಖಜಾನೆ ಮತ್ತು ವಿಶಾಲವಾದ ಮಾರುಕಟ್ಟೆ - ಇಂಗ್ಲಿಷ್ ಸಾಹಸಿಗಳಿಗೆ ತಾರಕ್ಗಾಗಿ ಗುರಿ ಮತ್ತು ಬೆಟ್ ಆಯಿತು ಇಂಗ್ಲಿಷ್ ವ್ಯಾಪಾರಿಗಳುಮತ್ತು ಮಹನೀಯರು. ನೀರಿನಲ್ಲಿ ಕಡಲ್ಗಳ್ಳತನ...
ಮರ. ಪರಿಸರ ಮತ್ತು ಜೈವಿಕ ಕೇಂದ್ರೀಕರಣದ ನಡುವಿನ ವಿರೋಧಾಭಾಸಗಳನ್ನು ಕೃತಕವಾಗಿ ಹೆಚ್ಚಿಸುವುದರಲ್ಲಿ ಯಾವುದೇ ಅರ್ಥವಿಲ್ಲ. ಯಾವುದು ಅವರನ್ನು ಒಂದುಗೂಡಿಸುತ್ತದೆ, ಅವರು ಸಾಮಾನ್ಯವಾಗಿ ಏನು ಹೊಂದಿದ್ದಾರೆ, ಯಾವುದಕ್ಕೆ ಆಧಾರವಾಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸಬಹುದು ಎಂಬುದರ ಕುರಿತು ಮಾತನಾಡುವುದು ಹೆಚ್ಚು ಸೂಕ್ತವಾಗಿದೆ. ಸಾಮಾನ್ಯ ವೇದಿಕೆಪರಿಸರ ನೀತಿಶಾಸ್ತ್ರ. ಇವು ಈ ಕೆಳಗಿನಂತಿವೆ ಪ್ರಮುಖ ಅಂಶಗಳು: 1) ಎಲ್ಲವೂ, ವ್ಯಕ್ತಿಗಳು, ಜೀವಿಗಳ ಜಾತಿಗಳು ಮತ್ತು ಪರಿಸರ ವ್ಯವಸ್ಥೆಗಳು ತಮ್ಮದೇ ಆದ ಒಳ್ಳೆಯದು, ಹಕ್ಕುಗಳು, ತಮ್ಮದೇ ಆದ ಸ್ವಾಭಾವಿಕ ಮೌಲ್ಯವನ್ನು ಹೊಂದಿವೆ, ಏಕೆಂದರೆ ಅವುಗಳು ಮೌಲ್ಯಯುತವಾಗಿವೆ ...
ಅವರ 1.5% ಜನಸಂಖ್ಯೆಗೆ. ಆದ್ದರಿಂದ, ನಾನು ಬಲ ಯಾವುದು ದುರ್ಬಲ ಎಂಬ ಪ್ರಶ್ನೆಯಿಂದ ದೂರವಿದ್ದೇನೆ ನಾಗರಿಕ ಸಮಾಜ, ನಾನು ಸಾವಯವವಾಗಿ ನನ್ನ ವೇಳಾಪಟ್ಟಿಯಲ್ಲಿ ನಾಲ್ಕನೇ ಪ್ರಶ್ನೆಗೆ ಹೋಗುತ್ತೇನೆ - ನಾಗರಿಕ ಸಮಾಜದ ಬಗ್ಗೆ ಮತ್ತು ಆರ್ಥಿಕ ಬೆಳವಣಿಗೆ. ನಾನು ಈಗಾಗಲೇ ಉಲ್ಲೇಖಿಸಿರುವ ಸಾಮೂಹಿಕ ಕ್ರಿಯೆಗಳ ಸಿದ್ಧಾಂತದ ಅದೇ ಲೇಖಕ ಮನ್ಸೂರ್ ಓಲ್ಸನ್ ಕೇಳಿದರು ಆಸಕ್ತಿ ಕೇಳಿ- ನಮ್ಮ ದೇಶದ ಬಗ್ಗೆ, ಮೂಲಕ. ನೀವು ಮುಖಾಮುಖಿ ನೋಡಲು ಸಾಧ್ಯವಿಲ್ಲ. ನಮಗೆ...
ಭೂವಿಜ್ಞಾನ ಮತ್ತು ಮಣ್ಣಿನ ವಿಜ್ಞಾನವನ್ನು ಅಧ್ಯಯನ ಮಾಡುವಾಗ, ಭೂರೂಪಶಾಸ್ತ್ರದ ಕಾರ್ಯವು ಜ್ಯಾಮಿತೀಯವನ್ನು ಮಾತ್ರ ಅಧ್ಯಯನ ಮಾಡುವುದು, ಆದರೆ ವಸ್ತು ಗುಣಲಕ್ಷಣಗಳನ್ನು ಅಲ್ಲ ಎಂದು ನಾವು ಒಪ್ಪಿಕೊಳ್ಳಬೇಕು. ಭೂಮಿಯ ಮೇಲ್ಮೈ. ಗಣಿತದ ಸೂತ್ರೀಕರಣದಲ್ಲಿ, ಇದರರ್ಥ ಭೂರೂಪಶಾಸ್ತ್ರದ ಅಧ್ಯಯನದ ವಸ್ತುವನ್ನು L ಸೆಟ್ನ ಗಡಿಯಾಗಿ ಪರಿಗಣಿಸಬಾರದು, ಆದರೆ ಬಾಹ್ಯಾಕಾಶ P ಗೆ ಅದರ ಮ್ಯಾಪಿಂಗ್, ಅಂದರೆ. ಮೂರು ಆಯಾಮದ ಯೂಕ್ಲಿಡಿಯನ್ ಜಾಗದಲ್ಲಿ ಮೇಲ್ಮೈ, ಮೂಲಮಾದರಿ...
ದೈಹಿಕ ಮತ್ತು ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳುಮೈದಾನಗಳು. ಕ್ಷಾರಗಳೊಂದಿಗೆ ಕೆಲಸ ಮಾಡುವಾಗ ಸುರಕ್ಷತಾ ಮುನ್ನೆಚ್ಚರಿಕೆಗಳು. ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಪರಿಕಲ್ಪನೆ
ನೀರಿನಲ್ಲಿ ಕರಗುವ ನೆಲೆಗಳು (ಕ್ಷಾರಗಳು). ಘನವಸ್ತುಗಳು ಬಿಳಿ, ನೀರಿನಲ್ಲಿ ಹೆಚ್ಚು ಕರಗುತ್ತದೆ. ನಲ್ಲಿ ಕೊಠಡಿಯ ತಾಪಮಾನ Ca (OH)2 ಮತ್ತು Sr (OH)2 ಕಡಿಮೆ ಕರಗುವಿಕೆಯನ್ನು ಹೊಂದಿವೆ. ನೀರಿನಲ್ಲಿ ಕರಗದ ನೆಲೆಗಳು ಘನವಸ್ತುಗಳಾಗಿವೆ, ಉದಾಹರಣೆಗೆ, Al (OH)3 ಬಿಳಿ, Cu (OH)2 ನೀಲಿ ಬಣ್ಣ, Fe (OH)3 ಕಂದು ಬಣ್ಣದಲ್ಲಿರುತ್ತದೆ.
ಕರಗುವ ಮತ್ತು ಕರಗದ ನೆಲೆಗಳು ಹಲವಾರು ಸಾಮಾನ್ಯ ಮತ್ತು ವಿಶಿಷ್ಟ ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತವೆ.
1. ಸೂಚಕ ಪರಿಹಾರಗಳ ಮೇಲೆ ಕ್ಷಾರ ದ್ರಾವಣಗಳ ಪರಿಣಾಮ (ಕ್ಷಾರಗಳಿಗೆ ಮಾತ್ರ ವಿಶಿಷ್ಟವಾಗಿದೆ). ಕ್ಷಾರ ದ್ರಾವಣದಲ್ಲಿ, ಲಿಟ್ಮಸ್ ಮತ್ತು ಸಾರ್ವತ್ರಿಕ ಸೂಚಕ ಕಾಗದವನ್ನು ಹೊಂದಿರುತ್ತದೆ ನೀಲಿ ಬಣ್ಣ, ಮೀಥೈಲ್ ಕಿತ್ತಳೆ ಕಿತ್ತಳೆ-ಹಳದಿ ಮತ್ತು ಫೀನಾಲ್ಫ್ಥಲೀನ್ ಕಡುಗೆಂಪು ಬಣ್ಣದ್ದಾಗಿದೆ.
2. ಉಪ್ಪು ಮತ್ತು ನೀರನ್ನು ರೂಪಿಸಲು ಆಮ್ಲಗಳೊಂದಿಗೆ ಬೇಸ್ಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆ - ತಟಸ್ಥೀಕರಣ ಪ್ರತಿಕ್ರಿಯೆ (ಎರಡರ ಲಕ್ಷಣ ಕರಗುವ ನೆಲೆಗಳು, ಮತ್ತು ಕರಗದ):
KOH + HCl = KCl + H2O
3. ಉಪ್ಪು ಮತ್ತು ನೀರನ್ನು ರೂಪಿಸಲು ಆಮ್ಲ ಆಕ್ಸೈಡ್ಗಳೊಂದಿಗಿನ ಬೇಸ್ಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆ (ಕ್ಷಾರಗಳಿಗೆ ಮಾತ್ರ ವಿಶಿಷ್ಟವಾಗಿದೆ):
2NaOH + CO2 = Na2CO3 + H2O
4. ಉಪ್ಪು ದ್ರಾವಣಗಳೊಂದಿಗೆ ಬೇಸ್ಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಯು ಮತ್ತೊಂದು ಬೇಸ್ ಮತ್ತು ಇನ್ನೊಂದು ಉಪ್ಪನ್ನು ರೂಪಿಸಲು (ಕ್ಷಾರಗಳಿಗೆ ಮಾತ್ರ ವಿಶಿಷ್ಟವಾಗಿದೆ):
2KOH + CuSO4 = K2SO4 + Cu (OH)2 ¯
ಕ್ಷಾರ ದ್ರಾವಣದೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯಿಸುವ ಉಪ್ಪಿನ ಸಂಯೋಜನೆಯು ಕರಗದ ಬೇಸ್ ಅನ್ನು ರೂಪಿಸುವ ಸಾಮರ್ಥ್ಯವನ್ನು ಹೊಂದಿರುವ ಲೋಹವನ್ನು ಒಳಗೊಂಡಿರಬೇಕು.
5. ವಿಭಜನೆ ಕರಗದ ನೆಲೆಗಳುಆಕ್ಸೈಡ್ ಮತ್ತು ನೀರಿನ ರಚನೆಯೊಂದಿಗೆ ಬಿಸಿ ಮಾಡಿದಾಗ (ಕರಗದ ನೆಲೆಗಳಿಗೆ ಮಾತ್ರ ಗುಣಲಕ್ಷಣ):
2Fe (OH)3 Fe2O3 + 3H2O
ಕ್ಷಾರಗಳೊಂದಿಗೆ ಕೆಲಸ ಮಾಡುವಾಗ, ನೀವು ತುಂಬಾ ಜಾಗರೂಕರಾಗಿರಬೇಕು, ಏಕೆಂದರೆ ಹುಲ್ಲುಗಾವಲುಗಳು ತುಂಬಾ ಆಕ್ರಮಣಕಾರಿ ವಸ್ತುಗಳನ್ನು ಒಳಗೊಂಡಿರುತ್ತವೆ. ಕ್ಷಾರ ದ್ರಾವಣವು ನಿಮ್ಮ ಚರ್ಮದ ಮೇಲೆ ಬಂದರೆ, ಮಾಧುರ್ಯದ ಭಾವನೆ ಕಣ್ಮರೆಯಾಗುವವರೆಗೆ ನೀವು ತಕ್ಷಣ ಅದನ್ನು ಹರಿಯುವ ನೀರಿನಿಂದ ತೊಳೆಯಬೇಕು, ನಂತರ ದ್ರಾವಣದಿಂದ ತೊಳೆಯಿರಿ (ತಟಸ್ಥಗೊಳಿಸಿ). ದುರ್ಬಲ ಆಮ್ಲ(ಅಸಿಟಿಕ್ ಅಥವಾ ಬೋರಿಕ್) ಮತ್ತು ಪ್ರಥಮ ಚಿಕಿತ್ಸಾ ಕೇಂದ್ರಕ್ಕೆ ಹೋಗಿ.
ಲವಣಗಳನ್ನು ರೂಪಿಸಲು ತಟಸ್ಥೀಕರಣ ಕ್ರಿಯೆಯಲ್ಲಿ ಬೇಸ್ಗಳು ಆಮ್ಲಗಳೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯಿಸುತ್ತವೆ ಎಂದು ನಾವು ಈಗಾಗಲೇ ಕಂಡುಕೊಂಡಿದ್ದೇವೆ. ಬೇಸ್ಗಳೊಂದಿಗೆ ಬೇಸ್ಗಳು, ಹಾಗೆಯೇ ಆಮ್ಲಗಳೊಂದಿಗೆ ಆಮ್ಲಗಳು, ತಟಸ್ಥೀಕರಣದ ಪ್ರತಿಕ್ರಿಯೆಗೆ ಪ್ರವೇಶಿಸುವುದಿಲ್ಲ. ಆದರೆ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಇವೆ, ಅದು ಆಮ್ಲಗಳು ಮತ್ತು ಬೇಸ್ಗಳೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯಿಸುತ್ತದೆ, ಲವಣಗಳನ್ನು ರೂಪಿಸುತ್ತದೆ. ಅಂತಹ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳನ್ನು ಆಂಫೋಟೆರಿಕ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಆಮ್ಲಗಳೊಂದಿಗಿನ ಪ್ರತಿಕ್ರಿಯೆಗಳಲ್ಲಿ ಬೇಸ್ಗಳ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಮತ್ತು ಬೇಸ್ಗಳೊಂದಿಗಿನ ಪ್ರತಿಕ್ರಿಯೆಗಳಲ್ಲಿ ಆಮ್ಲಗಳ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತವೆ. ಎಲ್ಲಾ ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ನೀರಿನಲ್ಲಿ ಕಳಪೆಯಾಗಿ ಕರಗುತ್ತವೆ. ಇವುಗಳಲ್ಲಿ ಸತು ಹೈಡ್ರಾಕ್ಸೈಡ್ Zn (OH) 2, ಅಲ್ಯೂಮಿನಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ Al (OH) 3, ಬೆರಿಲಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ Be (OH) 2, ಕ್ರೋಮಿಯಂ (III) ಹೈಡ್ರಾಕ್ಸೈಡ್ Cr (OH) 3, ಫೆರಮ್ (III) ಹೈಡ್ರಾಕ್ಸೈಡ್ Fe (OH) 3 ಮತ್ತು ಇತರರು . ಝಿಂಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಅನ್ನು ಬಳಸಿಕೊಂಡು ಆಂಫೊಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಉದಾಹರಣೆಯಾಗಿ ಪರಿಗಣಿಸೋಣ.
1. ಉಪ್ಪು ಮತ್ತು ನೀರನ್ನು ರೂಪಿಸಲು ಆಮ್ಲದೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯೆ:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2. ಉಪ್ಪು ಮತ್ತು ನೀರನ್ನು ರೂಪಿಸಲು ಕ್ಷಾರದೊಂದಿಗೆ ಪರಸ್ಪರ ಕ್ರಿಯೆ:
Zn(OH)2 + 2NaOH Na2ZnO2 + 2H2O
