Opløsning som en fysisk kemisk proces
Opløsninger dannes ved vekselvirkning mellem et opløsningsmiddel og et opløst stof. Processen med interaktion mellem et opløsningsmiddel og et opløst stof kaldes solvation (hvis opløsningsmidlet er vand - hydrering).

Fig. 1 Processen med at opløse elektrolytter.
Opløsning fortsætter med dannelsen af produkter af forskellige former og styrker - hydrater. Dette involverer både fysisk og kemisk natur. Opløsningsprocessen på grund af denne form for interaktion mellem komponenter er ledsaget af forskellige termiske fænomener.
Energikarakteristika opløsning er dannelsesvarmen af opløsningen, betragtet som algebraisk sum termiske effekter af alle endo- og eksoterme stadier af processen. De mest betydningsfulde blandt dem er:
- varmeabsorberende processer - ødelæggelse af krystalgitteret, brydning af kemiske bindinger i molekyler;
- varmegenererende processer - dannelsen af produkter af interaktion af et opløst stof med et opløsningsmiddel (hydrater) osv.
Hvis energien til ødelæggelse krystalgitter mindre hydreringsenergi af det opløste stof, derefter sker opløsning med frigivelse af varme (opvarmning observeres). Opløsningen af NaOH er således en eksoterm proces: 884 kJ/mol bruges på ødelæggelse af krystalgitteret, og under dannelsen af hydrerede Na+ og OH- ioner frigives henholdsvis 422 og 510 kJ/mol.
Hvis krystalgitterets energi er større end hydratiseringsenergien, sker opløsning med absorption af varme (ved fremstilling af en vandig opløsning af NH 4 NO 3 observeres et fald i temperaturen).
Den gensidige opløselighed af væsker eller faste stoffer i væsker afhænger af en række egenskaber ved disse stoffer: kemisk natur, størrelse og struktur af partikler, elektrisk ladning(ved ioner), dipolmomenter mv.
Den såkaldte ubegrænsede opløselighed er kendt, når to væsker opløses i hinanden i alle forhold, og begrænset, når opløseligheden af en væske i en anden er begrænset til en vis koncentration.
Med begrænset gensidig opløselighed af to væsker A og B opløses hver af dem, og efter bundfældning dannes der to lag, som er placeret over hinanden i rækkefølge af faldende massefylde og består af en af en opløsning af B i A, og den anden af en løsning af A i B.
Opløsninger indtager en mellemposition mellem kemiske forbindelser og mekaniske blandinger. Opløsninger adskiller sig fra kemiske forbindelser ved variationen af deres sammensætning og fra sidstnævnte ved deres homogenitet. Det er grunden til, at løsninger kaldes enkeltfasede systemer med variabel sammensætning, dannet af mindst to uafhængige komponenter.
DI. Mendeleev var den første til at overveje opløsning ikke kun som fysisk proces, men også som en proces kemisk interaktion opløst stof med opløsningsmiddel. Især under opløsning absorberes eller frigives energi (opløsningsvarme) altid, og væskens volumen ændres.
Undersøgelse af løsninger vha forskellige metoder gjort det muligt at fastslå tilstedeværelsen i mange af dem af såkaldte solvater eller hydrater, som dannes som følge af de tilsvarende processer for solvatisering og hydratisering.
Hydratering af stoffer i vandige opløsninger er et separat tilfælde af solvatisering med ethvert opløsningsmiddel. Hvis opløsningsmidlet er vand, kaldes disse forbindelser hydrater. Hydratiseringsprocessen skal betragtes som en kemisk reaktion ved at tilsætte vand til et stof. Hydrering sker under påvirkning af kræfterne i molekylær interaktion mellem vandmolekyler og det hydrerede stof. Salte er hydreret af ioner, der har betydelige elektriske felter, som tiltrækker elektriske polære vandmolekyler. Hvordan stærkere felt ion, det vil sige, jo større ladning og mindre radius er, jo stærkere er den hydreret og jo stærkere dannes hydraterne. Dannelsen af solvater ændrer i mange tilfælde det opløste stofs egenskaber, hvilket let bestemmes ved direkte observation.
For eksempel har jod, som består af individuelle molekyler, en violet farve i gasform. Den samme farve bevares, når jod opløses i benzin. Hvis jod er opløst i alkohol, er opløsningen mørkebrun. Denne farveændring indikerer tilstedeværelsen af interaktion mellem jod- og alkoholmolekyler.
Hydrater er ret ustabile forbindelser; i mange tilfælde nedbrydes de, når opløsninger fordampes. Men nogle gange er hydreringsvand så tæt bundet til det opløste stofs molekyler, at når sidstnævnte adskilles fra opløsningen, bliver det en del af dets krystaller. Sådanne medicinske stoffer omfatter glucose, terpenhydrat, magnesiumsulfat, kobbersulfat, alun, codein osv., som er krystallinske hydrater med forskelligt indhold krystallisationsvand. Når vand fjernes fra krystallinske hydrater, ændres de udseende Og enkelte ejendomme(kobbersulfat, gips, krystallinsk sodavand osv.).
Individuelle ioner af salt opløst i vand forbliver også i en hydreret tilstand, hvilket er af afgørende betydning for mange egenskaber ved saltopløsninger. Ideen om hydrering af ioner i opløsninger blev først udtrykt af I.A. Kablukov og V.A. Kistyakovsky.
Den begrænsende opløselighed af mange stoffer i vand (eller andre opløsningsmidler) er konstant værdi, svarende til koncentrationen af den mættede opløsning ved en given temperatur. Det er en kvalitativ egenskab for opløselighed og er angivet i opslagsbøger i gram pr. 100 g opløsningsmiddel (under visse betingelser).
Lægemidlet anses for at være opløst, hvis der ikke påvises partikler af stoffet i opløsningen, når det observeres i transmitteret lys. Med hensyn til opløselighed er de til en vis grad styret af det gamle princip "lige opløses i lignende" ( lignende lignende opløsningsmidler), altså i lyset moderne udsigt Baseret på strukturen af molekylet ser det sådan ud: I upolære opløsningsmidler (benzin, æter osv.) opløses forskellige forbindelser med upolære eller lavpolære molekyler godt, og stoffer af andre typer opløses ikke. Tværtimod opløser et opløsningsmiddel med en stærkt polær karakter af molekylerne (vand) som regel stoffer med molekyler, der er polære og delvist ioniske typer og opløser ikke stoffer med ikke-polære molekyler. Polære opløsningsmidler omfatter væsker, der kombinerer en stor dielektrisk konstant, et stort dipolmoment med tilstedeværelsen funktionelle grupper, sikre dannelsen af koordinering ( for det meste hydrogen) bindinger: vand, syrer, lavere alkoholer og glycoler, aminer osv. Tilstedeværelsen af polære grupper i et stofs molekyle påvirker i høj grad dets opløselighed.
Som regel er stoffer meget opløselige i vand og i hinanden, hvis der ikke er mere end tre kulbrinte-radikalatomer pr. polær gruppe. Ved en større tilstedeværelse af kulbrinteradikaler opstår der så store dispersionskræfter mellem molekylerne, at de forhindrer opløsning af sådanne stoffer i polære opløsningsmidler.
Polære stoffer er stoffer med ioniske (ioniske krystaller) og polær binding(polære molekyler), for eksempel natriumchlorid.
Ikke-polære opløsningsmidler omfatter væsker med et lille dipolmoment, som ikke har aktive funktionelle grupper, for eksempel kulbrinter, alkylhalogenider osv. Ikke-polære stoffer- disse er stoffer med en strengt symmetrisk struktur uden elektriske poler (for eksempel paraffin, terpentin, kamfer, thymol osv.).
Ovenstående regel er dog ikke altid gyldig, især når den anvendes på komplekse organiske forbindelser, som indeholder både polære (-OH, -SO3H, -NH2, -COOH, -COONa) og ikke-polære (alkyl- eller arylradikaler) grupper. Disse forbindelser omfatter kulhydrater, alkoholer, ketoner, organiske syrer, aminer osv. Disse stoffers opløselighed afhænger af overvægten af polære eller ikke-polære grupper. For eksempel er ethylalkohol C 2 H 5 OH blandbar med vand i ethvert forhold, amylalkohol C 5 H 11 OH - ikke mere end 10%, og cetylalkohol C 16 H 33 OH er praktisk talt uopløseligt i vand
Opløselighed afhænger af arten af det opløste stof og opløsningsmidlet, temperatur og tryk.
1) Arten af det opløselige stof.

Fig.2 Arten af det opløste stof.
Krystallinske stoffer er opdelt i:
P - meget opløselig (mere end 1,0 g pr. 100 g vand);
M - let opløselig (0,1 g - 1,0 g pr. 100 g vand);
H - uopløselig (mindre end 0,1 g pr. 100 g vand).
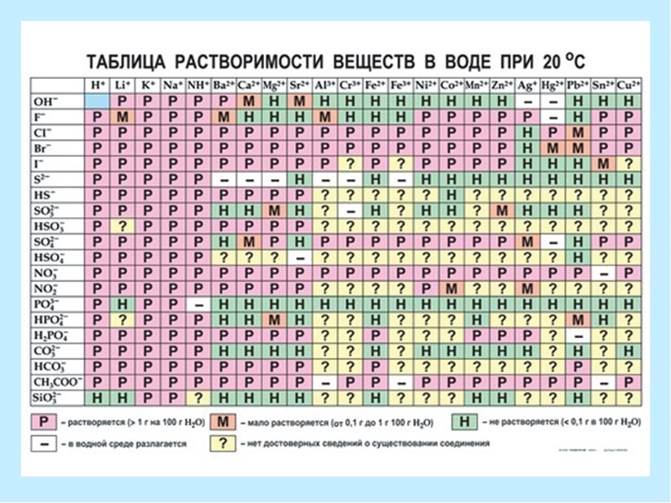
Fig.3. Opløselighedstabel.
2) Opløsningsmidlets beskaffenhed. Når en opløsning dannes, erstattes bindingerne mellem partiklerne i hver komponent af bindinger mellem partiklerne forskellige komponenter. For at der kan dannes nye bindinger, skal komponenterne i løsningen have samme type bindinger, dvs. være af samme karakter. Derfor ioniske stoffer opløses i polære opløsningsmidler og dårligt i ikke-polære, og
molekylære stoffer- omvendt.
Vand er et unikt, mest almindeligt og tilgængeligt opløsningsmiddel. Vandige opløsninger af uorganiske (salte, syrer, baser) og organiske (aminosyrer, nitrogenholdige baser, nukleinsyrer) stoffer, lav – og højmolekylære forbindelser, elektrolytter og ikke-elektrolytter, danner grundlaget for de vigtigste biologiske væsker, hvor alle fysiske og kemiske processer finder sted, der sikrer kroppens liv. For eksempel bruger de i medicin kunstige analoger af biologiske væsker - kolloide og saltvandsbloderstatningsopløsninger.

Ris. 4. Afhængighed af stoffers opløselighed af opløselighedens art.
3) Temperaturens indflydelse. Hvis opløsningen af et stof er en eksoterm proces, falder dets opløselighed med stigende temperatur (For eksempel Ca(OH)2 i vand) og omvendt. De fleste salte er karakteriseret ved en stigning i opløselighed, når de opvarmes. Næsten alle gasser opløses ved frigivelse af varme. Opløseligheden af gasser i væsker falder med stigende temperatur og stiger med faldende temperatur.
4) Effekt af tryk. Med stigende tryk øges opløseligheden af gasser i væsker, og med faldende tryk falder den.
Opløsninger af stoffer med Molar masse mindre end 5000 g/mol kaldes opløsninger af lavmolekylære forbindelser (LMC), og opløsninger af stoffer med en molær masse på mere end 5000 g/mol kaldes opløsninger af højmolekylære forbindelser (HMC).
Ved tilstedeværelse eller fravær elektrolytisk dissociation NMS-løsninger er opdelt i to klasser - opløsninger af elektrolytter og ikke-elektrolytter.
Tabel 1.
Tabel over elektrolytter og ikke-elektrolytter.
Elektrolytopløsninger er opløsninger af salte, syrer, baser og amfolytter, der dissocierer til ioner. For eksempel opløsninger af KNO3, HCl, KOH, Al(OH)3, glycin. Den elektriske ledningsevne af elektrolytopløsninger er højere end opløsningsmidlets.
Ikke-elektrolytopløsninger er opløsninger af stoffer, der praktisk talt ikke dissocierer i vand. For eksempel opløsninger af saccharose, glucose, urinstof. Den elektriske ledningsevne af ikke-elektrolyt-opløsninger adskiller sig lidt fra opløsningsmidlets.
Løsninger af NMS (elektrolytter og ikke-elektrolytter) kaldes sande i modsætning til kolloide opløsninger. Ægte løsninger kendetegnet ved homogenitet af sammensætningen og fraværet af en grænseflade mellem det opløste stof og opløsningsmidlet. Størrelsen af opløste partikler (ioner og molekyler) er mindre end 10 -9 m.
De fleste spiraler er polymerer, hvis molekyler (makromolekyler) består af stort antal gentagne grupper eller monomerenheder forbundet med hinanden kemiske bindinger. IUD-løsninger kaldes polyelektrolytløsninger.
Polyelektrolytter indbefatter polysyrer (heparin, polyadenylsyre, polyasparaginsyre osv.), polybaser (polylysin), polyamfolytter (proteiner, nukleinsyrer).
Egenskaberne af IUD-opløsninger adskiller sig væsentligt fra egenskaberne af NMS-opløsninger.
Du ved allerede, at der sker forskellige forandringer med kroppe og stoffer, som kaldes fænomener, og husk, at de er opdelt i fysiske og kemiske. I fysiske fænomener, sammensætningen af ren enkelte stoffer forbliver uændret, men kun hans aggregeringstilstand eller kroppens form og størrelse.
Fysiske fænomener, udtrykt i ændringer i stoffets aggregerede tilstand eller kroppes form og størrelse, bestemmer de vigtigste områder af deres anvendelse i national økonomi. Således tillader aluminiums plasticitet at blive trukket ind i tråd eller rullet ind i tynd folie; den elektriske ledningsevne og sammenlignelige lethed af aluminium gør det muligt at bruge det som kraftoverførselsledninger og legeringer - i flykonstruktion; termisk ledningsevne, plasticitet og ikke-toksicitet - ved fremstilling af tallerkener mv.
Mange måder at blive ren på kemiske stoffer er i bund og grund fysiske fænomener. Disse omfatter destillation, krystallisation, filtrering, sublimering osv. For eksempel er destillationsmetoden (fig. 84) eller destillation baseret på forskellen i stoffers kogepunkter.
Ris. 84.
Destillation
Denne metode producerer vand renset fra stoffer opløst i det. Dette vand kaldes destilleret. Det bruges til fremstilling af medicinske opløsninger og til at hælde ind i bilers kølesystem.
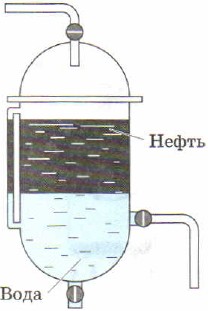
Destillation som en metode til at adskille flydende blandinger bruges til at opnå fra naturlig olie individuelle olieprodukter. Industriel installation til kontinuerlig destillation af olie består den af en rørformet ovn (fig. 85, 1) til opvarmning af olien og en separations- eller rektifikationssøjle (fig. 85, 2), hvor olien er opdelt i fraktioner (destillater) - individuelle olieprodukter.
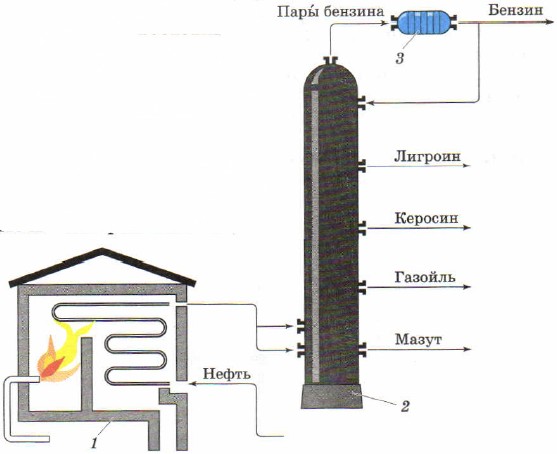
Ris. 85.
Diagram over en rørformet installation til kontinuerlig oliedestillation:
1 - rørformet ovn; 2 - destillationskolonne; 3 - køleskab
En lang rørledning er placeret i en spoleformet rørovn. Brændeovnen opvarmes ved afbrænding af brændselsolie eller gas. Olie tilføres løbende gennem rørledningen, hvor den opvarmes til 320-350 °C og kommer ind i destillationskolonnen i form af en blanding af væske og damp.
Destillationssøjlen er et cylindrisk stålapparat på omkring 40 m. Det har indvendigt flere snese vandrette skillevægge med huller, de såkaldte plader. Oliedamp, der kommer ind i søjlen, stiger op og passerer gennem huller i pladerne. Gradvist afkøling efterhånden som de bevæger sig opad, bliver de flydende på visse plader afhængigt af deres kogepunkt og densitet. Kulbrinter er mindre flygtige og flydende allerede på de første plader, danner en gasoliefraktion, mere flygtige kulbrinter opsamles højere og danner en petroleumsfraktion, naphthafraktionen opsamles endnu højere, de mest flygtige kulbrinter forlader kolonnen i form af dampe og danner benzin. En tyk sort væske samler sig nedenfor - brændselsolie. Det bruges som brændstof, samt til at opnå smøreolier gennem yderligere destillation.
Destillationsmetode flydende luft ligger til grund for at opnå fra det individuelle komponenter- nitrogen (det koger væk først), ilt mv.

Ris. 86.
Filtrering
For at rense salte anvendes krystallisationsmetoden. I dette tilfælde opløses f.eks. naturligt salt i vand og filtreres derefter (fig. 86). Resultatet er en opløsning af bordsalt, renset fra sand, ler og andre urenheder, der er uopløselige i vand. Derefter skilles saltet fra opløsningen ved inddampning (fig. 87), vandet fordamper, og saltkrystaller bliver tilbage i porcelænskoppen.
Ris. 87.
Fordampning
Filtreringsmetoden er baseret på forskellige båndbredde porøst materiale - et filter i forhold til de partikler, der udgør blandingen. Filter til rengøring drikker vand På vandbehandlingsanlæg er der et lag sand. I en støvsuger, der renser luften fra støv, der er suspenderet i den, bruges papir- eller stoffiltre; i medicin, ved pleje af patienter eller under operation anvendes flerlags gazeforbindinger som filter.
For at opnå rent jod og svovl anvendes et fysisk fænomen som sublimering, dvs. et stofs overgang fra fast tilstand til gasform, uden om væskefasen (fig. 88). Under sublimering fordamper det krystallinske stof i den opvarmede del af apparatet, og i den afkølede del kondenserer det igen for at danne krystaller. Is er i stand til at sublimere; det er ikke for ingenting, at vådt vasketøj tørrer ud selv i kulden.
Ris. 88.
Sublimering af jod
Sublimering bestemte brugen af fast stof carbondioxid CO 2 (det kaldes som bekendt tøris) til opbevaring af mad, især is.
Ris. 89.
Olieseparationskolonne
Forskellige densiteter af stoffer ligger til grund for denne metode til adskillelse af blandinger, såsom bundfældning. For eksempel blandinger af olie og vand, vegetabilsk olie og vandene adskilles hurtigt og er derfor nemme at adskille fra hinanden ved hjælp af en skilletragt (fig. 89, 90).

Ris. 90.
Skilletragt
For at fremskynde processen med at adskille blandinger i stedet for at sætte sig ind laboratoriepraksis Centrifugering bruges ofte, som fik dette navn på grund af en speciel enhed - en centrifuge. Reagensglas med en blanding af stoffer placeres i en centrifuge. De tænder for enheden, der begynder, som en karrusel, intensivt at dreje reagensglassene fast i den. Under påvirkning af partiklens centrifugalkraft forskellige stoffer modtage forskellige accelerationer, da de har forskellige tætheder og blandingen adskilles (fig. 91).
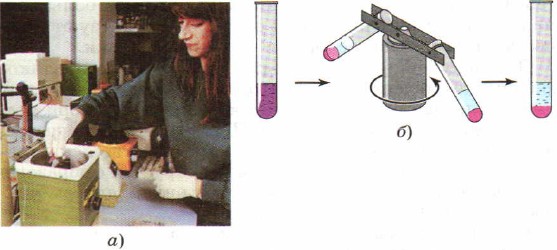
Ris. 91.
Centrifugering:
a - fotografi af en centrifuge; b - centrifugedriftsdiagram
Nøgleord og sætninger
- Destillation eller destillation.
- Destilleret vand.
- Krystallisation og fordampning.
- Filtrering.
- Sublimering.
- Fortalervirksomhed.
- Skilletragt.
- Centrifugering.
Arbejde med computer
- Der henvises til den elektroniske ansøgning. Studer lektionsmaterialet og udfør de tildelte opgaver.
- Søg på internettet email adresse, som kan tjene yderligere kilder, der afslører indholdet af søgeord og sætninger i afsnittet. Tilbyd din hjælp til læreren med at forberede en ny lektion - send en besked pr søgeord og sætninger i næste afsnit.
Spørgsmål og opgaver
- Hvilken metode til at adskille blandinger er beskrevet i A. Belyaevs science fiction-værk "The Air Seller"?
- Hvor kommer troen fra, at spildt salt fører til et skænderi? Hvordan forsoner man folk, der skændtes om spildt salt?
- Angiv metoder til adskillelse af følgende blandinger: a) tandpulver og salt; b) alkohol og vand; c) benzin og vand.
- Sådan rengøres og desinficeres under rejser flodvand og gøre den velegnet til at drikke og lave mad?
- Hvorfor bærer elevatorarbejdere en særlig maske, når de sigter og sorterer korn?
- Hvilken metode bruger du til at fjerne teblade fra teblade, når du hælder det fra en tekande gennem en si?
Leder: Boger Natalya Vladimirovna, kemilærer
Emne: "Opløsning - en fysisk eller kemisk proces?"
Uddannelsesinstitution: MBOU Kargasokskaya Secondary School nr. 2, landsbyen Kargasok, Tomsk-regionen
Anvendte medieressourcer: WORD-teksteditor, internetressourcer
1) Studiens relevans (hvorfor dette emne taget af forfatteren til forskning)
Vi har studeret fysik i to år nu, vi brænder for denne videnskab, vi studerer de grundlæggende love og fysiske fænomener. Og det har altid været klart for os, at processen med at opløse sukker, salt og andet opløselige stoffer i vand - et fysisk fænomen. I år begyndte vi at studere ny videnskab– kemi. Og hvilken overraskelse det var for os, at opløsningsprocessen er et kemisk fænomen. Kemi er videnskaben om stoffer, egenskaber og deres omdannelser. Men i processen med at opløse sukker i vand fik vi hverken en syre, en base eller noget andet stof. Sukker forbliver sukker.
2) Definition af forskningsemnet (Hvad skal undersøges?)
Vi var interesserede i spørgsmålet om, hvordan de adskiller sig fysiske ændringer fra kemikalier? Dette er ikke et meget simpelt spørgsmål.
3) Formulering af problemstillingen. Hvad er problemet? Hvilket spørgsmål skal besvares?
Find ud af, om processen med at opløse stoffer i vand er fysisk eller kemisk.
4) Foreslå en hypotese. Hvad kan det mulige svar være?
Vi fremsætter en hypotese : Det er muligt, at linjen mellem fysiske og kemiske transformationer er vilkårlig og vilkårlig.
5) Hypotesetestning.
På på dette tidspunkt arbejdet foregår i tre retninger:
- Teoretisk analyse af videnskabelig litteratur;
- Fysisk og kemisk eksperiment;
- Analyse af eksperimentelle data.
Arbejdet i den første retning gjorde det muligt at overveje teoretiske problemstillinger processen med at opløse stoffer i vand. Problemet med opløsning har været af interesse for mennesket i lang tid. Alkymister, og derefter kemikere fra de efterfølgende århundreder, forsøgte at optrevle essensen af opløsningsprocessen. Den engelske kemiker R. Boyle (1627-1691) antog således, at opløsningsmiddelpartikler har pigge, kroge og andre anordninger, ved hjælp af hvilke de klæber til partikler af det opløste stof, hvorfor opløsning sker.
Han udtrykte en mere videnskabelig mening om opløsningen af M.V. Lomonosov (1711-1765): "saltpartikler adskilles fra hinanden ved påvirkning af vandpartikler...", og ved at klæbe til vandpartiklerne begynder de sammen at bevæge sig fremad og spredes gennem opløsningsmidlet."
I det 19. århundrede blev forskningen i løsninger videreført af D.I. Mendelejev (1834-1907). Stor betydning han lagde vægt på studiet af termiske virkninger under opløsning. Man ved, at når nogle stoffer opløses, frigives der varme, mens andre absorberes.
Teorien om opløsning blev udviklet i værker af den svenske videnskabsmand Svante Arrhenius (1859-1927). Han foreslog, at stoffet i opløsning nedbrydes til ioner. Efterfølgende har den russiske videnskabsmand I.A. Kablukov (1857-1942) kombinerede teorien om elektrolytisk dissociation af S. Arrhenius med hydratteorien fra D.I. Mendeleev. Han fremsatte antagelsen om hydrering (interaktion med vand) af ionerne dannet i opløsningen, hvilket blev bevist eksperimentelt.
Tilhængere af den fysiske teori om løsninger, som blev udviklet af Van't Hoff, Arrhenius og Oswald, mente, at opløsningsprocessen er resultatet af diffusion, dvs. indtrængning af det opløste stof ind i mellemrummene mellem vandmolekyler, dvs. fysiske fænomen.
Tilhængere af den kemiske teori om løsninger, som blev udviklet af D.I. Mendeleev, I.A. Kablukov, V.A. Kistyakovsky, mente, at opløsningsprocessen er en kemisk interaktion mellem et opløst stof og vand.
Efter at have overvejet teoretiske spørgsmål begyndte vi den eksperimentelle del af vores arbejde.
Lad os udføre et eksperiment, mål som skal demonstrere, at hvornåropløsningsprocessen finder sted ensartet fordeling et stof i et andet, hvor det opløste stof går over i den aggregerede tilstand af et opløsningsmiddel, dvs. opstår et fysisk fænomen.
Erfaring nr. 1. Fænomenet diffusion ved hjælp af eksemplet med kaliumpermanganat
Hvis vi placerer flere granulat af kaliumpermanganat i et bægerglas med vand, kan vi observere, hvordan mængden solid falder gradvist. Samtidig får vandet, der er tilsat krystaller, nye egenskaber. En karminrød farve vises.
Konklusion : Vi observerer diffusionsprocessen – Dette er den spontane gensidige penetrering af molekyler af et stof ind i mellemrummene mellem molekylerne i et andet. Det opstår, fordi molekylerne af et og et andet stof gensidigt trænger ind i hinanden.
Erfaring nr. 2. Temperaturens indvirkning på diffusionsprocessen
Det viser sig, at diffusionshastigheden af visse stoffer kan påvirkes af ændringer i temperaturen. For at sikre os dette tog vi to glas, det ene med varmt og det andet med koldt vand. En lige stor mængde kaliumpermanganat blev hældt. I et af glassene vil diffusionen gå meget hurtigere. Som fortæller os livserfaring, sker diffusion jo hurtigere jo højere temperatur de diffuserende stoffer er.
Konklusion: Jo højere stoffers temperatur er, jo hurtigere sker diffusionen.
Den kemiske interaktion mellem et stof og et opløsningsmiddel bedømmes ud fra visse tegn. Lad os liste tegnene kemiske reaktioner:
- farveændring;
- udseende af lugt;
- dannelse og opløsning af sediment;
- gas frigivelse;
- frigivelse eller optagelse af varme.
Lad os udføre et eksperiment, mål hvilket viser, at når opløsninger dannes, kan der frigives varme.
Erfaring nr. 3. Varmefrigivelse når syre er opløst i vand.
Til dette eksperiment tog vi følgende udstyr: svovlsyre(98%), vand, temperaturføler, 100 ml bægerglas Under forsøget, da en lille mængde (5 ml) svovlsyre blev opløst i vand i 1 ml portioner, blev der observeret en signifikant temperaturstigning.
Kemisk reaktionsproces:
Konklusion: Når svovlsyre blev opløst i vand, observerede vi en betydelig temperaturstigning, og det er et tegn på en kemisk reaktion.
Forsøg nr. 4. Optagelse af varme, når salt er opløst i vand.
Formål: at demonstrere, at varme kan absorberes under dannelsen af opløsninger.
Kemisk reaktion:
Til eksperimentet tog vi 5 g kaliumnitrat og opløste det i 10 ml vand.
Konklusion : Vi observerede et fald i temperaturen, når kaliumnitrat blev opløst i vand, og dette er et tegn på en kemisk vekselvirkning.
Kompleksiteten af opløsningsprocessen fremgår ikke kun af termiske effekter, men også sådan et tegn på kemiske reaktioner som farveændring.
Erfaring nr. 5 .Farveændring under saltopløsning.
Lad os tage Hvidt pulver kobbersulfat og opløs det i vand. Dette skaber en løsning blå farve. Dette beviser, at der under opløsning sker en kemisk proces - hydrering af ioner:
Hvis opløsningen fordampes, falder blå krystaller ud. Bevarelsen af farven på krystallerne indikerer, at under krystallisation af saltet fra opløsninger ødelægges de hydratiserede ioner ikke, men bevares
Konklusion: Stoffer, hvis krystalgitre indeholder hydratiserede ioner, kaldes krystalhydrater, og vandet, der indgår i krystalhydratet, kaldes krystallisationsvand.
Erfaring nr. 6 Farveændring under jodopløsning.
Vi udførte et forsøg med at opløse jod i forskellige opløsningsmidler. Joddamp har lilla. Den samme farve findes i en opløsning af jod i benzin. I vand er en opløsning af jod gul, i benzen eller alkohol er den brun (dette er farven på den velkendte jodtinktur), i en opløsning af polyvinylalkohol er jodet blå (dette er farven på lægemidlet iodinol). Og ikke alene ændres farven i forskellige opløsningsmidler, den opfører sig også kemisk forskelligt.
Konklusion: Opløste molekyler binder sig til opløsningsmiddelmolekyler, hvilket resulterer i dannelsen af nye. kemiske forbindelser.
6 ) Forklaring af resultater. Mulige konklusioner.
Vi fandt ud af, hvad opløsningsprocessen er - fysisk eller kemisk. Vi studerede de teoretiske problemstillinger i opløsningsprocessen. Vi undersøgte tegnene på fysiske og kemiske fænomener under opløsning. Alle de betragtede karakteristika og processer blev eksperimentelt bekræftet. Som et resultat af undersøgelsen fandt vi ud af, at opløsningsprocessen er en fysisk og kemisk proces, og opløsninger er et ensartet (homogent) system bestående af partikler af et opløst stof, et opløsningsmiddel og produkterne af deres interaktion - hydrater. Vi fandt ud af, at grænsen mellem fysisk og kemiske fænomener stort set betinget. Det blev udført tilfældigt af videnskabsmænd. Opløsningsprocessen kan klassificeres som fysisk på nogle måder og kemisk på andre. Derfor begyndte sådanne processer at blive kaldt fysisk-kemiske fænomener.
De formulerede konklusioner giver os mulighed for at vurdere, at formålet med undersøgelsen er nået. Dette er dog ikke slutningen på vores forskning; det konfronterer os med ny opgave- Hvorfor vandige opløsninger Nogle stoffer leder elektrisk strøm, find årsagen til dette fænomen. Men det bliver en anden undersøgelse.
- Forberedelse til præsentationen forskningsmateriale. At skrive en rapport.
Mulighederne blev brugt til at skrive rapporten tekst editor ORD Det endelige materiale præsenteres også i form af en præsentation lavet i POWER POINT editoren.
Som et resultat af arbejdet blev følgende litteratur brugt:
- Alikbekov L.Yu. Underholdende opgaver og eksperimenter i kemi M. Drofa, 2006.
- Gorev L.A. Underholdende eksperimenter i fysik. M. Education, 1985
- Magasinet "Science and Life", nr. 5 2004.
- Kuznetsova L.M. Kemi 9 klasse. M. Mnemosyne, 2003.
- Olma Encyclopedia. Transformationer af stof. Kemi. M. Olma Media Group, 2013.
- Internetressource.
Opløsning er processen med ensartet fordeling af et stof i et andet, hvor det opløste stof går over i den aggregerede tilstand af opløsningsmiddel
Løsningen er kemiske system, dannet af flere stoffer, mellem hvilke der ikke er nogen grænseflader.
Fysisk teori løsninger:
Opløsning er en diffusionsproces, det er løsninger homogene blandinger
Kemisk teori løsninger:
Opløsning er processen med kemisk interaktion af et opløst stof med vand - hydrering, opløsninger - forbindelser hydrater
Lad os overveje processen med at opløse stoffer.
Hvis vi for eksempel tilsætter sukker til te, kan vi observere, hvordan mængden af fast stof gradvist aftager. Hvis teen er kold, opløses sukkeret langsomt. Tværtimod, hvis teen er varm og omrørt med en ske, så sker opløsningen hurtigt. Når de er i vand, danner sukkermolekyler placeret på overfladen af granulerede sukkerkrystaller bindinger med vandmolekyler. I dette tilfælde binder flere vandmolekyler sig til et sukkermolekyle. Den termiske bevægelse af vandmolekyler får sukkermolekylerne forbundet med dem til at bryde væk fra krystallen og bevæge sig ind i tykkelsen af opløsningsmiddelmolekylerne. Sukkermolekyler, der er gået fra krystallen ind i opløsningen, kan bevæge sig gennem hele opløsningens volumen sammen med vandmolekyler på grund af diffusion. Hvis opløsningen opvarmes eller omrøres, sker diffusionen mere intens, og sukkeret opløses hurtigere. Sukkermolekyler fordeles jævnt, og opløsningen bliver lige så sød i hele volumen.
Stoffer ændrer sig ikke, når de opløses; efter fordampning af opløsninger kan vi opnå det opløste stof i fast tilstand. Under opløsning ødelægges det opløste stofs krystalgitter, og dets partikler bevæger sig i opløsningen, derfor er opløsning en fysisk proces. For at udføre en sådan proces er det nødvendigt at bruge energi.
Men når opløste molekyler binder sig til vandmolekyler, dannes der faktisk nye kemiske forbindelser. Disse molekylære associater har ikke en konstant sammensætning. Deres almindeligt navn- fugter. Processen med at binde stoffer med vand kaldes hydrering. Når opløsninger fordampes, ødelægges og dannes hydrater krystallinsk stof. Nogle stoffer er dog i stand til at danne stabile hydrater, som kan indeholde vand selv i krystallinsk tilstand. Sådanne stoffer kaldes krystallinske hydrater. De kan isoleres fra opløsning ved forsigtigt at fordampe vandet. I formlerne for sådanne stoffer er krystallisationsvandet angivet efter formlen for forbindelsen med et multiplikationstegn. For eksempel: CuSO 4 5H 2 O - kobbersulfat, FeSO 4 7H 2 O - jernsulfat. Hydratdannelse, dvs. nye stoffer, indikerer, at opløsning er en kemisk proces.
Studiet af de termiske fænomener, der opstår under denne proces, hjælper med at forstå essensen af opløsningsprocessen. Det er kendt, at et af tegnene på kemiske reaktioner er frigivelsen af varme, og for fysiske fænomener er det nødvendigt at bruge energi. Opløsningen af svovlsyre er ledsaget af stærk opvarmning af opløsningen. Dette er resultatet af en kemisk interaktion mellem vand og opløste molekyler - hydrering ledsages af frigivelse af energi. Og opløsningen af ammoniumnitrat ledsages af afkøling af opløsningen. I dette tilfælde bruges mere energi på den fysiske proces med ødelæggelse af krystalgitteret, end der genereres under produktionen af hydrater.
Ovenstående fakta indikerer, at opløsning bør betragtes som en fysisk-kemisk proces.
Lektier: afsnit 34, øvelse 2
lære definitioner
Elektrolytter og ikke-elektrolytter.
Elektrolytter– det er stoffer, hvis opløsninger eller smelter leder elektrisk strøm.
Ikke-elektrolytter– det er stoffer, hvis opløsninger eller smelter ikke leder elektrisk strøm.
Elektrolytisk dissociation- Dette er nedbrydningen af en elektrolyt til frit bevægende ioner, når den opløses i vand eller smeltes.
Elektrolytter når det er opløst i vand eller
smeltning gå i stykker (tage afstand) til ioner – positiv (kationer) og negativ (anioner) ladede partikler.
Ionerer mere stabile elektroniske tilstande end atomer. De kan bestå af ét atom - det er simple ioner(Na +, Mg 2+, Al 3+ osv.) - eller fra flere atomer - dette er komplekse ioner(NO 3 -, SO 2- 4, RO Z- 4 osv.).
I opløsninger og smelter elektrolytter leder elektricitet .
Under indflydelse elektrisk strøm ioner opnår retningsbestemt bevægelse: positivt ladede ioner bevæger sig mod katoden, negativt ladede bevæger sig mod anoden. Derfor kaldes førstnævnte kationer, sidstnævnte - anioner. Retningsbevægelsen af ioner opstår som et resultat af deres tiltrækning af modsat ladede elektroder.
Dissociation- reversibel proces: parallelt med desintegration af molekyler til ioner (dissociation) sker processen med at kombinere ioner (association).
Derfor bruges reversibilitetstegnet i ligningerne for elektrolytisk dissociation i stedet for lighedstegnet. For eksempel ligningen for dissociationen af elektrolytmolekylet KA i kationen K+ og anionen A-in generel opfattelse er optaget
KA ↔ K + + A -
Hjemmearbejde: paragraf 35, ex. 1,4,5,lær definitioner
Grundlæggende bestemmelser i TED.
1. Elektrolytter, når de er opløst i vand, opdeles (dissocieres) til ioner - positive og negative.
2. Under påvirkning af elektrisk strøm opnår ioner retningsbestemt bevægelse: positivt ladede partikler bevæger sig mod katoden, negativt ladede partikler bevæger sig mod anoden. Derfor kaldes positivt ladede partikler for kationer, og negativt ladede partikler kaldes anioner.
3. Rettet bevægelse opstår som et resultat af tiltrækning af deres modsat ladede elektroder (katoden er negativt ladet, og anoden er positivt ladet).
4. Ionisering er en reversibel proces: parallelt med opløsningen af molekyler til ioner (dissociation) sker processen med at kombinere ioner til molekyler (association).
Baseret på teorien om elektrolytisk dissociation, kan vi give følgende definitioner for hovedforbindelsesklasser:
Syrer er elektrolytter, hvis dissociation kun producerer hydrogenioner som kationer. For eksempel,
HCI → H+ + Cl-;
CH3COOH H+ + CH3COO-.
Basiciteten af en syre bestemmes af antallet af hydrogenkationer, der dannes under dissociation. HCl, HNO 3 er således monobasiske syrer, H 2 SO 4, H 2 CO 3 er dibasiske, H 3 PO 4, H 3 AsO 4 er tribasiske.
Baser er elektrolytter, hvis dissociation kun producerer hydroxidioner som anioner. For eksempel,
KOH → K + + OH - ,
NH4OH NH4+ + OH-.
Baser, der er opløselige i vand, kaldes alkalier.
Surhedsgraden af en base bestemmes af antallet af dens hydroxylgrupper. For eksempel er KOH, NaOH en-syre baser, Ca(OH)2 er to-syre, Sn(OH)4 er fire-syre osv.
Salte er elektrolytter, hvis dissociation producerer metalkationer (såvel som NH 4 + ionen) og anioner syrerester. For eksempel,
CaCl 2 → Ca 2+ + 2Cl - ,
NaF → Na + + F-.
Elektrolytter, under dissociationen af hvilke, afhængigt af forholdene, samtidig kan danne både hydrogenkationer og anioner - hydroxidioner kaldes amfotere. For eksempel,
H 2 O H + + OH - ,
Zn(OH)2Zn2+ +2OH-,
Zn(OH)2 2H+ +ZnO22- eller
Zn(OH)2 + 2H202- + 2H+.
Hjemmearbejde: paragraf 36, ex. 2-5, lær definitioner
