Kuvunjika kama kimwili mchakato wa kemikali
Suluhisho huundwa na mwingiliano wa kutengenezea na solute. Mchakato wa mwingiliano kati ya kutengenezea na solute inaitwa solvation (ikiwa kutengenezea ni maji - hydration).

Mtini. 1 Mchakato wa kufuta electrolytes.
Kufutwa kunaendelea na malezi ya bidhaa za maumbo na nguvu tofauti - hydrates. Hii inahusisha wote kimwili na asili ya kemikali. Mchakato wa kufuta kutokana na aina hii ya mwingiliano wa vipengele unaambatana na matukio mbalimbali ya joto.
Tabia za nishati kufutwa ni joto la malezi ya suluhisho, inayozingatiwa kama jumla ya algebra athari za joto za hatua zote za mwisho na za joto za mchakato. Muhimu zaidi kati yao ni:
- michakato ya kunyonya joto - uharibifu wa kimiani ya kioo, kuvunja vifungo vya kemikali katika molekuli;
- michakato ya kutengeneza joto - malezi ya bidhaa za mwingiliano wa dutu iliyoyeyushwa na kutengenezea (hydrates), nk.
Ikiwa nishati ya uharibifu kimiani kioo nishati ya chini ya hydration ya dutu kufutwa, basi kufutwa hutokea kwa kutolewa kwa joto (joto huzingatiwa). Kwa hivyo, kufutwa kwa NaOH ni mchakato wa exothermic: 884 kJ / mol hutumiwa kwa uharibifu wa kioo cha kioo, na wakati wa kuundwa kwa Na + na OH- ions hydrated, 422 na 510 kJ / mol hutolewa, kwa mtiririko huo.
Ikiwa nishati ya kimiani ya kioo ni kubwa zaidi kuliko nishati ya unyevu, basi kufuta hutokea kwa kunyonya joto (wakati wa kuandaa suluhisho la maji la NH 4 NO 3, kupungua kwa joto huzingatiwa).
Umumunyifu wa kuheshimiana wa vinywaji au yabisi katika vinywaji hutegemea idadi ya mali ya dutu hizi: asili ya kemikali, saizi na muundo wa chembe, malipo ya umeme(katika kesi ya ions), wakati wa dipole, nk.
Kinachojulikana umumunyifu usio na kikomo hujulikana, wakati maji mawili yanayeyuka kwa kila mmoja kwa uwiano wote, na mdogo, wakati umumunyifu wa kioevu kimoja kwa mwingine ni mdogo kwa mkusanyiko fulani.
Kwa umumunyifu mdogo wa kuheshimiana wa vinywaji viwili A na B, kila moja huyeyuka, na baada ya kutulia, tabaka mbili huundwa, ambazo ziko moja juu ya nyingine kwa utaratibu wa kupungua kwa msongamano na linajumuisha moja ya suluhisho la B katika A, na. lingine la suluhisho la A katika B.
Suluhisho huchukua nafasi ya kati kati ya misombo ya kemikali na mchanganyiko wa mitambo. Suluhisho hutofautiana na misombo ya kemikali kwa kutofautiana kwa muundo wao, na kutoka kwa mwisho kwa homogeneity yao. Ndiyo maana ufumbuzi huitwa mifumo ya awamu moja ya muundo wa kutofautiana, unaoundwa na angalau vipengele viwili vya kujitegemea.
DI. Mendeleev alikuwa wa kwanza kuzingatia kufutwa sio tu kama mchakato wa kimwili, lakini pia kama mchakato mwingiliano wa kemikali mumunyifu na kutengenezea. Hasa, wakati wa kufutwa, nishati (joto la suluhisho) daima huingizwa au kutolewa na kiasi cha mabadiliko ya kioevu.
Utafiti wa suluhisho kwa kutumia mbinu tofauti ilifanya iwezekane kuanzisha uwepo katika wengi wao wa kinachojulikana kama solvates au hydrates, ambayo huundwa kama matokeo ya michakato inayolingana ya suluhisho na uhamishaji.
Ugavi wa vitu katika miyeyusho ya maji ni kesi tofauti ya kutengenezea na kutengenezea chochote. Ikiwa kutengenezea ni maji, basi misombo hii inaitwa hydrates. Mchakato wa unyevu unapaswa kuzingatiwa kama mmenyuko wa kemikali wa kuongeza maji kwenye dutu. Hydration hutokea chini ya ushawishi wa nguvu za mwingiliano wa molekuli kati ya molekuli ya maji na dutu ya hidrati. Chumvi hutiwa maji na ioni ambazo zina muhimu mashamba ya umeme, ambayo huvutia molekuli za maji ya polar ya umeme. Vipi uwanja wenye nguvu zaidi ion, yaani, chaji yake kubwa na radius ndogo, ndivyo inavyotiwa maji kwa nguvu zaidi na ndivyo hidrati inavyoundwa. Uundaji wa solvates katika matukio mengi hubadilisha mali ya solute, ambayo ni rahisi kuamua na uchunguzi wa moja kwa moja.
Kwa mfano, iodini, ambayo inajumuisha molekuli ya mtu binafsi, ina rangi ya violet katika hali ya gesi. Coloring sawa huhifadhiwa wakati iodini inafutwa katika petroli. Ikiwa iodini hupasuka katika pombe, ufumbuzi wa rangi ya giza hupatikana. Mabadiliko haya ya rangi yanaonyesha uwepo wa mwingiliano kati ya molekuli ya iodini na pombe.
Hydrates ni misombo isiyo thabiti; katika hali nyingi hutengana wakati miyeyusho hutolewa. Lakini wakati mwingine maji ya hydration yanafungwa sana kwa molekuli za dutu iliyoyeyushwa kwamba wakati mwisho unapotenganishwa na suluhisho, inakuwa sehemu ya fuwele zake. Dutu kama hizo za dawa ni pamoja na glukosi, terpene hydrate, sulfate ya magnesiamu, sulfate ya shaba, alum, codeine, nk, ambayo ni hydrates ya fuwele na maudhui tofauti maji ya crystallization. Wakati maji yanapoondolewa kwenye hydrates ya fuwele, hubadilika mwonekano Na mali ya mtu binafsi(sulfate ya shaba, jasi, soda ya fuwele, nk).
Ioni za kibinafsi za chumvi iliyoyeyushwa katika maji pia hubaki katika hali ya maji, ambayo ni muhimu sana kwa mali nyingi za suluhisho la chumvi. Wazo la hydration ya ioni katika suluhisho lilionyeshwa kwanza na I.A. Kablukov na V.A. Kistyakovsky.
Umumunyifu wa kuzuia wa vitu vingi katika maji (au vimumunyisho vingine) ni thamani ya kudumu, sambamba na mkusanyiko wa ufumbuzi uliojaa kwa joto fulani. Ni sifa ya ubora wa umumunyifu na hutolewa katika vitabu vya kumbukumbu kwa gramu kwa 100 g ya kutengenezea (chini ya hali fulani).
Dawa ya kulevya inachukuliwa kufutwa ikiwa hakuna chembe za dutu zinazogunduliwa katika suluhisho wakati zinazingatiwa katika mwanga uliopitishwa. Kuhusu umumunyifu, kwa kiasi fulani zinaongozwa na kanuni ya zamani “kama huyeyuka katika kama” ( similia similibus solventa), yaani, katika nuru maoni ya kisasa Kulingana na muundo wa molekuli, inaonekana kama hii: katika vimumunyisho visivyo na polar (petroli, ether, nk) misombo mbalimbali na molekuli zisizo za polar au za chini za polar hupasuka vizuri na vitu vya aina nyingine hazipunguki. Kinyume chake, kutengenezea na tabia ya polar yenye nguvu ya molekuli (maji), kama sheria, huyeyusha vitu na molekuli ambazo ni za polar na kwa sehemu. aina za ionic na haina kuyeyusha vitu na molekuli zisizo za polar. Vimumunyisho vya polar ni pamoja na vinywaji ambavyo vinachanganya dielectric mara kwa mara, wakati mkubwa wa dipole, na uwepo vikundi vya kazi, kuhakikisha uundaji wa uratibu ( kwa sehemu kubwa hidrojeni) vifungo: maji, asidi, alkoholi za chini na glycols, amini, nk Uwepo wa vikundi vya polar katika molekuli ya dutu huathiri sana umumunyifu wake.
Kama sheria, vitu vinayeyuka sana katika maji na kwa kila mmoja ikiwa hakuna zaidi ya atomi tatu za hydrocarbon kwa kila kikundi cha polar. Kwa uwepo mkubwa wa radicals ya hidrokaboni, nguvu kubwa za utawanyiko huo hutokea kati ya molekuli ambazo huzuia kufutwa kwa vitu vile katika vimumunyisho vya polar.
Dutu za polar ni vitu vilivyo na ionic (fuwele za ionic) na dhamana ya polar(molekuli za polar), kwa mfano, kloridi ya sodiamu.
Vimumunyisho visivyo vya polar ni pamoja na vimiminiko vilivyo na wakati mdogo wa dipole ambao hawana vikundi vya kazi vilivyo hai, kwa mfano, hidrokaboni, halidi za alkili, nk. Dutu zisizo za polar- hizi ni vitu vya muundo madhubuti wa ulinganifu, bila miti ya umeme (kwa mfano, parafini, turpentine, camphor, thymol, nk).
Walakini, sheria iliyo hapo juu sio halali kila wakati, haswa inapotumika kwa ngumu misombo ya kikaboni, ambayo ina vikundi vya polar (-OH, -SO 3 H, -NH 2, -COOH, -COONA) na mashirika yasiyo ya polar (alkyl au aryl radicals). Misombo hii ni pamoja na wanga, alkoholi, ketoni, asidi za kikaboni, amini, nk. Umumunyifu wa vitu hivi hutegemea predominance ya vikundi vya polar au zisizo za polar. Kwa mfano, pombe ya ethyl C 2 H 5 OH inachanganyika na maji kwa uwiano wowote, pombe ya amyl C 5 H 11 OH - si zaidi ya 10%, na pombe ya cetyl C 16 H 33 OH haipatikani katika maji.
Umumunyifu hutegemea asili ya solute na kutengenezea, joto na shinikizo.
1) Asili ya dutu mumunyifu.

Mtini.2 Asili ya solute.
Dutu za fuwele zimegawanywa katika:
P - mumunyifu sana (zaidi ya 1.0 g kwa 100 g ya maji);
M - kidogo mumunyifu (0.1 g - 1.0 g kwa 100 g ya maji);
H - hakuna (chini ya 0.1 g kwa 100 g ya maji).
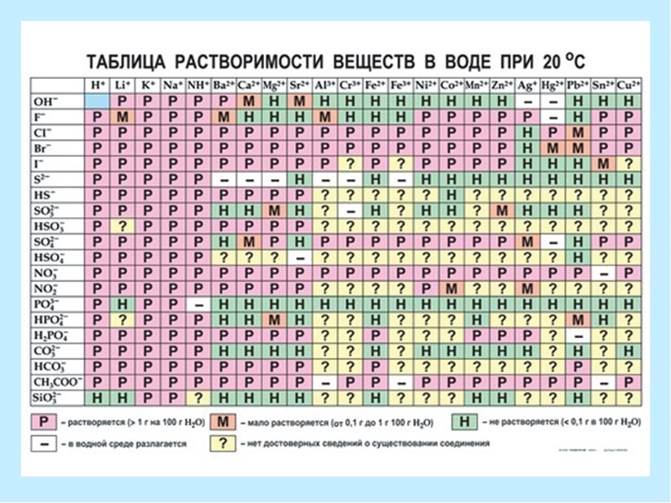
Mtini.3. Jedwali la umumunyifu.
2) asili ya kutengenezea. Wakati suluhisho linapoundwa, vifungo kati ya chembe za kila sehemu hubadilishwa na vifungo kati ya chembe. vipengele tofauti. Ili vifungo vipya vitengeneze, vipengele vya suluhisho lazima ziwe na aina moja ya vifungo, i.e. kuwa wa asili moja. Ndiyo maana vitu vya ionic kufuta katika vimumunyisho vya polar na vibaya katika zisizo za polar, na
vitu vya molekuli- kinyume chake.
Maji ni kutengenezea kipekee, kawaida na kupatikana. Suluhisho la maji ya isokaboni (chumvi, asidi, besi) na kikaboni (asidi za amino, besi za nitrojeni, asidi ya nucleic) vitu, chini - na misombo ya juu ya uzito wa Masi, electrolytes na zisizo za electrolytes, hufanya msingi wa muhimu zaidi maji ya kibaolojia, ambayo michakato yote ya kimwili na kemikali hufanyika ili kuhakikisha maisha ya mwili. Kwa mfano, katika dawa hutumia analogues za bandia za maji ya kibaiolojia - ufumbuzi wa uingizwaji wa damu ya colloidal na salini.

Mchele. 4. Utegemezi wa umumunyifu wa dutu kwenye asili ya umumunyifu.
3) Ushawishi wa joto. Ikiwa kufutwa kwa dutu ni mchakato wa exothermic, basi kwa joto la kuongezeka kwa umumunyifu wake hupungua (Kwa mfano, Ca (OH) 2 katika maji) na kinyume chake. Chumvi nyingi zina sifa ya kuongezeka kwa umumunyifu inapokanzwa. Karibu gesi zote hupasuka na kutolewa kwa joto. Umumunyifu wa gesi katika vinywaji hupungua kwa joto la kuongezeka na huongezeka kwa kupungua kwa joto.
4) Athari ya shinikizo. Kwa shinikizo la kuongezeka, umumunyifu wa gesi katika vinywaji huongezeka, na kwa shinikizo la kupungua hupungua.
Ufumbuzi wa dutu na molekuli ya molar chini ya 5000 g/mol huitwa miyeyusho ya misombo ya uzito wa chini wa Masi (LMC), na miyeyusho ya dutu yenye molekuli ya molar ya zaidi ya 5000 g/mol huitwa miyeyusho ya misombo ya uzani wa juu wa Masi (HMC).
Kwa uwepo au kutokuwepo kutengana kwa umeme Ufumbuzi wa NMS umegawanywa katika madarasa mawili - ufumbuzi wa electrolytes na yasiyo ya elektroliti.
Jedwali 1.
Jedwali la elektroliti na zisizo za elektroliti.
Suluhisho la elektroliti ni suluhisho la chumvi, asidi, besi, na ampholytes ambazo hujitenga na ioni. Kwa mfano, ufumbuzi wa KNO3, HCl, KOH, Al(OH)3, glycine. Conductivity ya umeme ya ufumbuzi wa electrolyte ni ya juu kuliko ile ya kutengenezea.
Suluhisho zisizo za elektroliti ni suluhisho la vitu ambavyo havijitenganishi katika maji. Kwa mfano, ufumbuzi wa sucrose, glucose, urea. Conductivity ya umeme ya ufumbuzi wa nonelectrolyte hutofautiana kidogo na ile ya kutengenezea.
Ufumbuzi wa NMS (elektroliti na zisizo elektroliti) huitwa kweli tofauti na ufumbuzi wa colloidal. Ufumbuzi wa kweli inayojulikana na homogeneity ya utungaji na kutokuwepo kwa kiolesura kati ya solute na kutengenezea. Ukubwa wa chembe zilizoyeyushwa (ions na molekuli) ni chini ya 10 -9 m.
IUD nyingi ni polima, molekuli ambazo (macromolecules) zinajumuisha idadi kubwa vikundi vya kurudia au vitengo vya monoma vilivyounganishwa kwa kila mmoja vifungo vya kemikali. Suluhisho la IUD huitwa suluhisho la polyelectrolyte.
Polyelectrolytes ni pamoja na polyacids (heparini, asidi polyadenylic, asidi polyaspartic, nk), polybases (polylysine), polyampholytes (protini, asidi nucleic).
Sifa za suluhu za IUD hutofautiana sana na sifa za suluhu za NMS.
Tayari unajua kwamba mabadiliko mbalimbali hutokea kwa miili na vitu, ambayo huitwa matukio, na kumbuka kwamba imegawanywa katika kimwili na kemikali. Katika matukio ya kimwili, muundo wa safi vitu vya mtu binafsi bado haijabadilika, lakini yake tu hali ya mkusanyiko au sura na ukubwa wa miili.
Matukio ya kimwili, iliyoonyeshwa katika mabadiliko katika hali ya jumla ya suala au sura na ukubwa wa miili, huamua maeneo muhimu zaidi ya matumizi yao katika uchumi wa taifa. Kwa hivyo, plastiki ya alumini inaruhusu kuvutwa kwenye waya au kuvingirwa kwenye foil nyembamba; conductivity ya umeme na mwanga wa kulinganisha wa alumini hufanya iwezekanavyo kuitumia kama waya za maambukizi ya nguvu, na aloi - katika ujenzi wa ndege; conductivity ya mafuta, plastiki na yasiyo ya sumu - katika utengenezaji wa sahani, nk.
Njia nyingi za kusafisha vitu vya kemikali kimsingi ni matukio ya kimwili. Hizi ni pamoja na kunereka, crystallization, filtration, usablimishaji, nk Kwa mfano, njia ya kunereka (Mchoro 84), au kunereka, inategemea tofauti katika pointi kuchemsha ya dutu.
Mchele. 84.
kunereka
Njia hii hutoa maji yaliyotakaswa kutoka kwa vitu vilivyofutwa ndani yake. Maji haya yanaitwa distilled. Inatumika kwa ajili ya kuandaa ufumbuzi wa dawa na kwa kumwaga katika mfumo wa baridi wa magari.
Kunereka kama njia ya kutenganisha mchanganyiko wa kioevu hutumiwa kupata kutoka mafuta ya asili bidhaa za mafuta ya kibinafsi. Ufungaji wa viwanda kwa ajili ya kunereka kuendelea ya mafuta, lina tanuru tubular (Kielelezo 85, 1) kwa ajili ya joto mafuta na kujitenga, au kurekebisha, safu (Mchoro 85, 2), ambapo mafuta imegawanywa katika sehemu (distillates) - bidhaa za mafuta ya mtu binafsi.
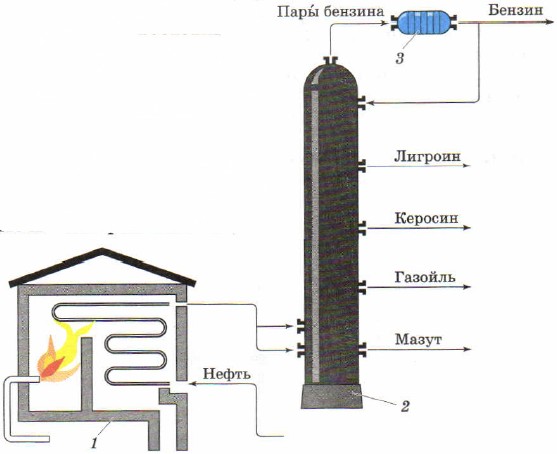
Mchele. 85.
Mchoro wa ufungaji wa tubular kwa kunereka kwa mafuta kwa kuendelea:
1 - tanuru ya tubular; 2 - safu ya kunereka; 3 - jokofu
Bomba la muda mrefu liko kwenye tanuru ya bomba yenye umbo la coil. Jiko huwashwa kwa kuchoma mafuta ya mafuta au gesi. Mafuta hutolewa mara kwa mara kupitia bomba, ambapo huwashwa hadi 320-350 ° C na huingia kwenye safu ya kunereka kwa namna ya mchanganyiko wa kioevu na mvuke.
Safu ya kunereka ni vifaa vya silinda vya chuma vya urefu wa mita 40. Ina ndani ya sehemu kadhaa za usawa na mashimo, kinachojulikana sahani. Mvuke wa mafuta unaoingia kwenye safu huinuka na kupita kwenye mashimo kwenye sahani. Hupoa taratibu kadri zinavyosonga juu, huyeyusha kwenye sahani fulani kulingana na kiwango chao cha kuchemsha na msongamano. Hydrocarbons ni tete kidogo na ni kioevu tayari kwenye sahani za kwanza, na kutengeneza sehemu ya mafuta ya gesi, hidrokaboni tete zaidi hukusanywa juu na kuunda sehemu ya mafuta ya taa, sehemu ya naphtha inakusanywa hata zaidi, hidrokaboni tete zaidi huacha safu kwa namna ya mvuke na kuunda petroli. Kioevu nene nyeusi hukusanya chini - mafuta ya mafuta. Inatumika kama mafuta, na pia kupata mafuta ya kulainisha kupitia kunereka kwa ziada.
Mbinu ya kunereka hewa kioevu iko kwenye msingi wa kupata kutoka kwa mtu binafsi vipengele- nitrojeni (inachemka kwanza), oksijeni, nk.

Mchele. 86.
Uchujaji
Ili kusafisha chumvi, njia ya crystallization hutumiwa. Katika kesi hii, kwa mfano, chumvi ya asili hupasuka katika maji na kisha kuchujwa (Mchoro 86). Matokeo yake ni suluhisho la chumvi la meza, lililotakaswa kutoka kwa mchanga, udongo na uchafu mwingine usio na maji. Kisha chumvi hutenganishwa na suluhisho kwa uvukizi (Mchoro 87), maji hupuka, na fuwele za chumvi hubakia katika kikombe cha porcelaini.
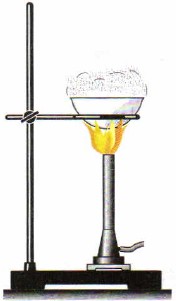
Mchele. 87.
Uvukizi
Njia ya kuchuja inategemea tofauti kipimo data nyenzo za porous - chujio kuhusiana na chembe zinazounda mchanganyiko. Kichujio cha kusafisha Maji ya kunywa Katika mimea ya matibabu ya maji kuna safu ya mchanga. Katika safi ya utupu ambayo husafisha hewa kutoka kwa vumbi vilivyosimamishwa ndani yake, vichungi vya karatasi au kitambaa hutumiwa; katika dawa, wakati wa kutunza wagonjwa au wakati wa upasuaji, mavazi ya chachi ya multilayer hutumiwa kama chujio.
Ili kupata iodini safi na sulfuri, jambo la kimwili kama vile usablimishaji hutumiwa, yaani, mpito wa dutu kutoka hali imara katika fomu ya gesi, kupitisha awamu ya kioevu (Mchoro 88). Wakati wa usablimishaji, dutu ya fuwele huvukiza katika sehemu yenye joto ya kifaa, na katika sehemu iliyopozwa inaunganishwa tena ili kuunda fuwele. Barafu ina uwezo wa kupunguza joto; sio bure kwamba nguo zenye unyevu hukauka hata kwenye baridi.
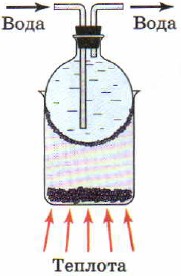
Mchele. 88.
Sublimation ya iodini
Usablimishaji uliamua matumizi ya imara kaboni dioksidi CO 2 (kama unavyojua, inaitwa barafu kavu) kwa kuhifadhi chakula, haswa aiskrimu.
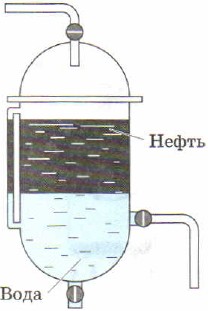
Mchele. 89.
Safu ya kutenganisha mafuta
Msongamano tofauti wa dutu ndio msingi wa njia hii ya kutenganisha michanganyiko, kama vile kutulia. Kwa mfano, mchanganyiko wa mafuta na maji, mafuta ya mboga na maji hutengana haraka na kwa hiyo ni rahisi kutenganisha kutoka kwa kila mmoja kwa kutumia funnel ya kutenganisha (Mchoro 89, 90).

Mchele. 90.
Funnel ya kutenganisha
Ili kuharakisha mchakato wa kutenganisha mchanganyiko, badala ya kutulia mazoezi ya maabara Centrifugation hutumiwa mara nyingi, ambayo ilipata jina hili kwa sababu ya kifaa maalum - centrifuge. Mirija ya majaribio yenye mchanganyiko wa vitu huwekwa kwenye centrifuge. Wanawasha kifaa, ambacho huanza, kama jukwa, kuzunguka kwa nguvu mirija ya majaribio iliyowekwa ndani yake. Chini ya ushawishi wa nguvu ya centrifugal ya chembe vitu mbalimbali kupokea kasi tofauti, kwa kuwa wamepokea msongamano tofauti, na mchanganyiko hutenganishwa (Mchoro 91).
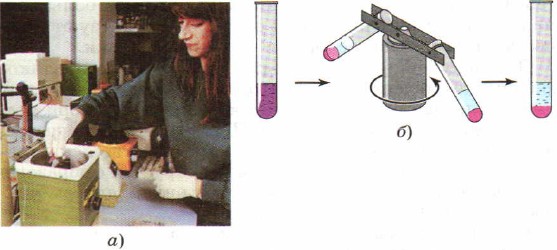
Mchele. 91.
Centrifugation:
a - picha ya centrifuge; b - mchoro wa operesheni ya centrifuge
Maneno na misemo muhimu
- Kunereka au kunereka.
- Maji yaliyosafishwa.
- Crystallization na uvukizi.
- Uchujaji.
- Usablimishaji.
- Utetezi.
- Funnel ya kutenganisha.
- Centrifugation.
Fanya kazi na kompyuta
- Rejelea programu ya kielektroniki. Soma nyenzo za somo na ukamilishe kazi ulizopewa.
- Tafuta kwenye Mtandao barua pepe, ambayo inaweza kutumika vyanzo vya ziada, kufichua maudhui ya maneno muhimu na vishazi katika aya. Toa msaada wako kwa mwalimu katika kuandaa somo jipya - tuma ujumbe kwa maneno muhimu na vishazi katika aya inayofuata.
Maswali na kazi
- Ni njia gani ya kutenganisha mchanganyiko iliyoelezwa katika kazi ya uongo ya A. Belyaev "Muuzaji wa Air"?
- Je, imani inatoka wapi kwamba chumvi iliyomwagika husababisha ugomvi? Jinsi ya kupatanisha watu ambao waligombana juu ya chumvi iliyomwagika?
- Onyesha njia za kutenganisha mchanganyiko wafuatayo: a) poda ya jino na chumvi; b) pombe na maji; c) petroli na maji.
- Jinsi ya kusafisha na kuua vijidudu wakati wa kusafiri maji ya mto na kuifanya ifae kwa kunywa na kupika?
- Kwa nini wafanyikazi wa lifti (ghala) huvaa kinyago maalum wakati wa kupepeta na kuchagua nafaka?
- Je! unatumia njia gani kusafisha majani ya chai kutoka kwa majani ya chai wakati wa kumwaga kutoka kwa buli kupitia kichujio?
Mkuu: Boger Natalya Vladimirovna, mwalimu wa kemia
Mada: "Kutengana - mchakato wa kimwili au wa kemikali?"
Taasisi ya elimu: MBOU Kargasokskaya Secondary School No. 2, kijiji cha Kargasok, mkoa wa Tomsk
Rasilimali za media zinazotumika: kihariri maandishi cha WORD, rasilimali za mtandao
1) Umuhimu wa utafiti (kwa nini mada hii iliyochukuliwa na mwandishi kwa utafiti)
Tumekuwa tukisoma fizikia kwa miaka miwili sasa, tuna shauku juu ya sayansi hii, tunasoma sheria za kimsingi na matukio ya mwili. Na daima imekuwa wazi kwetu kwamba mchakato wa kufuta sukari, chumvi na nyingine dutu mumunyifu katika maji - jambo la kimwili. Mwaka huu tulianza kusoma sayansi mpya- kemia. Na ilikuwa mshangao gani kwetu kwamba mchakato wa kufutwa ni jambo la kemikali. Kemia ni sayansi ya vitu, mali na mabadiliko yao. Lakini katika mchakato wa kuyeyusha sukari katika maji, hatukupata asidi, alkali, au dutu nyingine yoyote. Sukari inabaki kuwa sukari.
2) Ufafanuzi wa somo la utafiti (Ni nini cha kujifunza?)
Tulivutiwa na swali la jinsi wanatofautiana mabadiliko ya kimwili kutoka kwa kemikali? Hili si swali rahisi sana.
3) Uundaji wa shida. Shida ni nini? Ni maswali gani yanapaswa kujibiwa?
Jua ikiwa mchakato wa kuyeyusha vitu kwenye maji ni wa kimwili au wa kemikali.
4) Kupendekeza hypothesis. Jibu linaweza kuwa nini?
Tunaweka mbele dhana : Inawezekana kwamba mstari kati ya mabadiliko ya kimwili na kemikali ni ya kiholela na ya kiholela.
5) Upimaji wa nadharia.
Washa katika hatua hii kazi hufanyika katika pande tatu:
- Uchambuzi wa kinadharia wa fasihi ya kisayansi;
- majaribio ya kimwili na kemikali;
- Uchambuzi wa data ya majaribio.
Kazi ndani ya mwelekeo wa kwanza ilifanya iwezekane kuzingatia masuala ya kinadharia mchakato wa kufuta vitu katika maji. Tatizo la kufutwa limekuwa la manufaa kwa mwanadamu kwa muda mrefu. Wanaalchemists, na kisha wanakemia wa karne zilizofuata, walijaribu kufunua kiini cha mchakato wa kufutwa. Kwa hiyo, duka la dawa la Kiingereza R. Boyle (1627-1691) alidhani kuwa chembe za kutengenezea zina spikes, ndoano na vifaa vingine kwa msaada wa kuzingatia chembe za dutu iliyoharibiwa, ndiyo sababu kufuta hutokea.
Alionyesha maoni ya kisayansi zaidi juu ya kufutwa kwa M.V. Lomonosov (1711-1765): "chembe za chumvi hutenganishwa kutoka kwa kila mmoja kwa hatua ya chembe za maji ..." na, kwa kuzingatia chembe za maji, kwa pamoja huanza kusonga mbele na kuenea katika kutengenezea."
Katika karne ya 19, utafiti wa suluhu uliendelea na D.I. Mendeleev (1834-1907). Umuhimu mkubwa aliweka umuhimu kwa utafiti wa athari za joto wakati wa kufutwa. Inajulikana kuwa wakati vitu vingine vinapasuka, joto hutolewa, wakati wengine huingizwa.
Nadharia ya kufutwa ilitengenezwa katika kazi za mwanasayansi wa Uswidi Svante Arrhenius (1859-1927). Alipendekeza kuwa dutu iliyo katika suluhisho hugawanyika katika ioni. Baadaye, mwanasayansi wa Urusi I.A. Kablukov (1857-1942) alichanganya nadharia ya kutengana kwa kielektroniki ya S. Arrhenius na nadharia ya hidrati ya D.I. Mendeleev. Aliweka mbele dhana ya hydration (mwingiliano na maji) ya ioni zilizoundwa katika suluhisho, ambayo ilithibitishwa kwa majaribio.
Wafuasi wa nadharia ya kimwili ya ufumbuzi, ambayo ilitengenezwa na Van't Hoff, Arrhenius na Oswald, waliamini kuwa mchakato wa kufuta ni matokeo ya kuenea, i.e. kupenya kwa solute katika nafasi kati ya molekuli za maji, i.e. jambo la kimwili.
Wafuasi wa nadharia ya kemikali ya suluhisho, ambayo ilitengenezwa na D.I. Mendeleev, I.A. Kablukov, V.A. Kistyakovsky, aliamini kuwa mchakato wa kufuta ni mwingiliano wa kemikali kati ya dutu iliyoyeyuka na maji.
Baada ya kuzingatia masuala ya kinadharia, tulianza sehemu ya majaribio ya kazi yetu.
Wacha tufanye jaribio, lengo ambayo itaonyesha hilo linimchakato wa kufuta hutokea usambazaji sare dutu moja katika nyingine, ambayo solute hupita katika hali ya jumla ya kutengenezea, i.e. jambo la kimwili hutokea.
Uzoefu nambari 1. Hali ya uenezi kwa kutumia mfano wa pamanganeti ya potasiamu
Ikiwa tunaweka granules kadhaa za permanganate ya potasiamu kwenye glasi iliyo na maji, tunaweza kuona jinsi kiasi imara hatua kwa hatua hupungua. Wakati huo huo, maji ambayo fuwele zimeongezwa hupata mali mpya. Rangi nyekundu inaonekana.
Hitimisho : Tunazingatia mchakato wa uenezaji – Huu ni kupenya kwa kuheshimiana kwa hiari kwa molekuli za dutu moja kwenye nafasi kati ya molekuli za nyingine. Inatokea kwa sababu molekuli za dutu moja na nyingine hupenya kila mmoja.
Uzoefu nambari 2. Athari ya joto kwenye mchakato wa kueneza
Inatokea kwamba kiwango cha kuenea kwa vitu fulani kinaweza kuathiriwa na mabadiliko ya joto. Ili kuhakikisha hili, tulichukua glasi mbili, moja na moto na nyingine maji baridi. Kiasi sawa cha permanganate ya potasiamu hutiwa. Katika moja ya glasi, uenezi utaenda kwa kasi zaidi. Kama inavyotuambia uzoefu wa maisha, kuenea hutokea kwa kasi ya juu ya joto la vitu vinavyoenea.
Hitimisho: Ya juu ya joto la vitu, kuenea kwa kasi hutokea.
Mwingiliano wa kemikali wa dutu yenye kutengenezea huhukumiwa na ishara fulani. Hebu tuorodheshe ishara athari za kemikali:
- mabadiliko ya rangi;
- kuonekana kwa harufu;
- malezi na kufutwa kwa sediment;
- kutolewa kwa gesi;
- kutolewa au kufyonzwa kwa joto.
Wacha tufanye jaribio, lengo ambayo inaonyesha kwamba wakati ufumbuzi hutengenezwa, joto linaweza kutolewa.
Uzoefu nambari 3. Kutolewa kwa joto wakati asidi inapoyeyuka katika maji.
Kwa jaribio hili tulichukua vifaa vifuatavyo: asidi ya sulfuriki(98%), maji, sensor ya joto, beaker ya ml 100. Wakati wa majaribio, wakati kiasi kidogo (5 ml) cha asidi ya sulfuriki kilipasuka katika maji katika sehemu 1 ml, ongezeko kubwa la joto lilionekana.
Mchakato wa mmenyuko wa kemikali:
Hitimisho: Wakati asidi ya sulfuriki ilipasuka katika maji, tuliona ongezeko kubwa la joto, na hii ni ishara ya mmenyuko wa kemikali.
Jaribio namba 4. Kunyonya kwa joto wakati chumvi inapoyeyuka katika maji.
Kusudi: kuonyesha kuwa joto linaweza kufyonzwa wakati wa kuunda suluhisho.
Mwitikio wa kemikali:
Kwa jaribio, tulichukua 5g ya nitrati ya potasiamu na kuifuta katika 10ml ya maji.
Hitimisho : Tuliona kupungua kwa joto wakati nitrati ya potasiamu iliyeyushwa katika maji, na hii ni ishara ya mwingiliano wa kemikali.
Ugumu wa mchakato wa kufutwa unathibitishwa sio tu na athari za joto, lakini pia ishara kama hiyo ya athari za kemikali kama mabadiliko ya rangi.
Uzoefu nambari 5 .Kubadilisha rangi wakati wa kuyeyuka kwa chumvi.
Hebu tuchukue Poda nyeupe sulfate ya shaba na kufuta ndani ya maji. Hii inaunda suluhisho rangi ya bluu. Hii inathibitisha kwamba wakati wa kufutwa, mchakato wa kemikali hutokea - hydration ya ions:
Ikiwa suluhisho limevukizwa, fuwele za bluu huanguka nje. Uhifadhi wa rangi ya fuwele unaonyesha kwamba wakati wa crystallization ya chumvi kutoka kwa ufumbuzi, ioni za hidrati haziharibiwa, lakini zimehifadhiwa.
Hitimisho: Dutu ambazo kimiani za fuwele zina ioni za hidrati huitwa hidrati za fuwele, na maji yaliyojumuishwa katika hidrati ya fuwele huitwa maji ya fuwele.
Uzoefu nambari 6 Mabadiliko ya rangi wakati wa kufutwa kwa iodini.
Tulifanya jaribio kwa kufuta iodini katika vimumunyisho mbalimbali. Mvuke wa iodini una zambarau. Rangi sawa hupatikana katika suluhisho la iodini katika petroli. Katika maji, suluhisho la iodini ni njano, katika benzini au pombe ni kahawia (hii ni rangi ya tincture inayojulikana ya iodini), katika suluhisho la pombe ya polyvinyl iodini ni bluu (hii ni rangi ya iodinol ya madawa ya kulevya). Na sio tu mabadiliko ya rangi katika vimumunyisho tofauti, pia hufanya kemikali tofauti.
Hitimisho: Molekuli sote huungana na molekuli za kutengenezea, na hivyo kusababisha kuundwa kwa mpya. misombo ya kemikali.
6 ) Ufafanuzi wa matokeo. Hitimisho linalowezekana.
Tuligundua mchakato wa kufutwa ni nini - kimwili au kemikali. Tulisoma maswala ya kinadharia ya mchakato wa kufutwa. Tulichunguza ishara za matukio ya kimwili na kemikali wakati wa kufutwa. Tabia na michakato yote iliyozingatiwa ilithibitishwa kwa majaribio. Kama matokeo ya utafiti, tuligundua kuwa mchakato wa kufutwa ni mchakato wa mwili na kemikali, na suluhisho ni mfumo wa sare (homogeneous) unaojumuisha chembe za dutu iliyoyeyushwa, kutengenezea na bidhaa za mwingiliano wao - hydrates. Tuligundua kuwa mstari kati ya kimwili na matukio ya kemikali kwa kiasi kikubwa masharti. Ilifanyika kwa nasibu na wanasayansi. Mchakato wa kufutwa unaweza kuainishwa kuwa wa kimwili kwa njia fulani, na kemikali kwa wengine. Kwa hiyo, taratibu hizo zilianza kuitwa matukio ya physico-kemikali.
Hitimisho lililoundwa huturuhusu kuhukumu kuwa madhumuni ya utafiti yamefikiwa. Walakini, huu sio mwisho wa utafiti wetu; inatukabili kazi mpya- Kwa nini ufumbuzi wa maji Dutu zingine hufanya sasa umeme, pata sababu ya jambo hili. Lakini huo utakuwa utafiti tofauti.
- Kujitayarisha kwa uwasilishaji nyenzo za utafiti. Kuandika ripoti.
Fursa zilitumika kuandika ripoti mhariri wa maandishi WORD. Nyenzo ya mwisho pia imewasilishwa katika mfumo wa wasilisho lililofanywa katika kihariri cha POWER POINT.
Kama matokeo ya kazi hiyo, fasihi ifuatayo ilitumiwa:
- Alikbekov L.Yu. Kazi za kuburudisha na majaribio katika kemia M. Drofa, 2006.
- Gorev L.A. Majaribio ya kufurahisha katika fizikia. M. Elimu, 1985
- Jarida "Sayansi na Uzima", No. 5 2004.
- Kuznetsova L.M. Kemia darasa la 9. M. Mnemosyne, 2003.
- Encyclopedia ya Olma. Mabadiliko ya jambo. Kemia. M. Olma Media Group, 2013.
- Rasilimali ya mtandao.
Muyeyusho ni mchakato wa usambazaji sare wa dutu moja hadi nyingine, ambayo solute hupita katika hali ya jumla ya kutengenezea.
Suluhisho ni mfumo wa kemikali, iliyoundwa na vitu kadhaa, kati ya ambayo hakuna interfaces.
Nadharia ya kimwili ufumbuzi:
Kufutwa ni mchakato wa kueneza, ufumbuzi ni mchanganyiko wa homogeneous
Nadharia ya kemikali ufumbuzi:
Kufutwa ni mchakato wa mwingiliano wa kemikali wa solute na maji - unyevu, suluhisho - misombo ya hydrate.
Hebu fikiria mchakato wa kufuta vitu.
Kwa mfano, ikiwa tunaongeza sukari kwa chai, tunaweza kuona jinsi kiasi cha dutu imara hupungua hatua kwa hatua. Ikiwa chai ni baridi, sukari hupasuka polepole. Kinyume chake, ikiwa chai ni moto na kuchochewa na kijiko, basi kufutwa hutokea haraka. Mara moja ndani ya maji, molekuli za sukari ziko juu ya uso wa fuwele za sukari ya granulated huunda vifungo na molekuli za maji. Katika kesi hii, molekuli kadhaa za maji hufunga kwa molekuli moja ya sukari. Mwendo wa joto wa molekuli za maji husababisha molekuli za sukari zinazohusishwa nazo kutengana na kioo na kuingia kwenye unene wa molekuli za kutengenezea. Molekuli za sukari ambazo zimepita kutoka kwa fuwele hadi kwenye suluhisho zinaweza kusonga kwa kiasi kizima cha suluhisho pamoja na molekuli za maji kwa sababu ya kueneza. Ikiwa suluhisho linapokanzwa au limechochewa, kuenea hutokea kwa ukali zaidi na sukari hupasuka kwa kasi. Molekuli za sukari husambazwa sawasawa na suluhisho inakuwa tamu sawa kwa kiasi.
Dutu haibadiliki inapoyeyushwa, baada ya uvukizi wa miyeyusho, tunaweza kupata dutu iliyoyeyushwa katika hali ngumu. Wakati wa kufutwa, kimiani cha kioo cha solute kinaharibiwa na chembe zake huhamia kwenye suluhisho, kwa hiyo, kufuta ni mchakato wa kimwili. Ili kutekeleza mchakato kama huo, ni muhimu kutumia nishati.
Lakini wakati molekuli za solute zinaunganishwa na molekuli za maji, misombo mpya ya kemikali huundwa. Washirika hawa wa molekuli hawana utungaji wa mara kwa mara. Yao jina la kawaida- huweka maji. Mchakato wa kuunganisha vitu na maji huitwa hydration. Wakati ufumbuzi ni evaporated, hydrates ni kuharibiwa na sumu dutu ya fuwele. Hata hivyo, vitu vingine vina uwezo wa kutengeneza hydrates imara, ambayo inaweza kuwa na maji hata katika hali ya fuwele. Dutu kama hizo huitwa hidrati za fuwele. Wanaweza kutengwa na suluhisho kwa kuyeyusha maji kwa uangalifu. Katika fomula za vitu kama hivyo, maji ya crystallization yanaonyeshwa baada ya fomula ya kiwanja na ishara ya kuzidisha. Kwa mfano: CuSO 4 5H 2 O - sulfate ya shaba, FeSO 4 7H 2 O - sulfate ya chuma. Uundaji wa majimaji, i.e. dutu mpya, inaonyesha kuwa kufutwa ni mchakato wa kemikali.
Utafiti wa matukio ya joto yanayotokea wakati wa mchakato huu husaidia kuelewa kiini cha mchakato wa kufuta. Inajulikana kuwa moja ya ishara za athari za kemikali ni kutolewa kwa joto, na kwa matukio ya kimwili ni muhimu kutumia nishati. Kufutwa kwa asidi ya sulfuriki kunafuatana na joto kali la suluhisho. Hii ni matokeo ya mwingiliano wa kemikali kati ya maji na molekuli za solute - hydration inaambatana na kutolewa kwa nishati. Na kufutwa kwa nitrati ya ammoniamu kunafuatana na baridi ya suluhisho. Katika kesi hii, nishati zaidi hutumiwa kwenye mchakato wa kimwili wa uharibifu wa kimiani ya kioo kuliko inayozalishwa wakati wa uzalishaji wa hydrates.
Ukweli hapo juu unaonyesha kuwa kufutwa kunapaswa kuzingatiwa mchakato wa physicochemical.
Kazi ya nyumbani: aya ya 34, zoezi la 2
jifunze ufafanuzi
Electrolytes na zisizo za elektroliti.
Electrolytes- hizi ni dutu ambazo miyeyusho yake au kuyeyuka hufanya mkondo wa umeme.
Yasiyo ya elektroliti- hizi ni dutu ambazo miyeyusho au kuyeyuka kwake hafanyi mkondo wa umeme.
Kutengana kwa umeme- Huu ni mgawanyiko wa elektroliti katika ioni zinazosonga kwa uhuru wakati inapoyeyuka katika maji au inapoyeyuka.
Electrolytes wakati kufutwa katika maji au
kuyeyuka kutengana (tenganisha) kwa ions - chanya (mikusanyiko) na hasi (anions) chembe za kushtakiwa.
Ioniziko katika utulivu zaidi majimbo ya kielektroniki kuliko atomi. Wanaweza kuwa na atomi moja - hii ni ions rahisi(Na +, Mg 2+, Al 3+, nk) - au kutoka kwa atomi kadhaa - hii ni ions ngumu(NO 3 -, SO 2- 4, RO Z- 4, nk).
Katika suluhisho na kuyeyuka elektroliti hufanya umeme .
Chini ya ushawishi mkondo wa umeme ioni hupata mwendo wa mwelekeo: ioni zenye chaji chanya husogea kuelekea kathodi, zenye chaji hasi husogea kuelekea anode. Kwa hiyo, wa kwanza huitwa cations, mwisho - anions. Mwendo wa mwelekeo wa ioni hutokea kama matokeo ya mvuto wao na elektroni zilizochajiwa kinyume.
Kutengana- mchakato wa kurekebishwa: sambamba na kutengana kwa molekuli katika ions (kujitenga), mchakato wa kuchanganya ions (chama) hutokea.
Kwa hiyo, katika equations ya kutengana kwa electrolytic, badala ya ishara sawa, ishara ya reversibility hutumiwa. Kwa mfano, equation ya kutenganisha molekuli ya elektroliti KA ndani ya cation K + na anion A - ndani. mtazamo wa jumla imerekodiwa
KA ↔ K + + A -
Kazi ya nyumbani: aya ya 35, mfano. 1,4,5,jifunze ufafanuzi
Masharti ya msingi ya TED.
1. Electrolytes, wakati kufutwa katika maji, kuvunja (dissociate) katika ions - chanya na hasi.
2. Chini ya ushawishi wa sasa wa umeme, ions hupata harakati za mwelekeo: chembe za kushtakiwa vyema huelekea kwenye cathode, chembe za kushtakiwa vibaya huenda kuelekea anode. Kwa hiyo, chembe za kushtakiwa vyema huitwa cations, na chembe za kushtakiwa vibaya huitwa anions.
3. Harakati iliyoelekezwa hutokea kutokana na kuvutia kwa electrodes yao ya kinyume (cathode ni chaji hasi, na anode ni chaji chanya).
4. Ionization ni mchakato wa kugeuka: sambamba na kutengana kwa molekuli ndani ya ions (dissociation), mchakato wa kuchanganya ions katika molekuli (chama) hutokea.
Kulingana na nadharia ya kutengana kwa elektroliti, tunaweza kutoa zifuatazo ufafanuzi kwa madarasa kuu ya uunganisho:
Asidi ni elektroliti ambazo utengano wake hutoa ioni za hidrojeni tu kama cations. Kwa mfano,
HCl → H + + Cl - ;
CH 3 COOH H + + CH 3 COO -.
Msingi wa asidi imedhamiriwa na idadi ya cations ya hidrojeni ambayo huundwa wakati wa kutengana. Kwa hivyo, HCl, HNO 3 ni asidi ya monobasic, H 2 SO 4, H 2 CO 3 ni dibasic, H 3 PO 4, H 3 AsO 4 ni ya kikabila.
Misingi ni elektroliti ambazo mtengano wake hutoa ioni za hidroksidi tu kama anions. Kwa mfano,
KOH → K + + OH - ,
NH 4 OH NH 4 + + OH -.
Besi zinazoyeyuka katika maji huitwa alkali.
Asidi ya msingi imedhamiriwa na idadi ya vikundi vyake vya hidroksili. Kwa mfano, KOH, NaOH ni besi za asidi moja, Ca(OH) 2 ni asidi mbili, Sn(OH) 4 ni asidi nne, nk.
Chumvi ni elektroliti, mgawanyiko ambao hutoa cations za chuma (pamoja na NH 4 + ion) na anions. mabaki ya asidi. Kwa mfano,
CaCl 2 → Ca 2+ + 2Cl - ,
NaF → Na + + F - .
Electrolytes, wakati wa kujitenga ambayo, kulingana na hali, inaweza wakati huo huo kuunda cations zote za hidrojeni na anions - ions hidroksidi huitwa amphoteric. Kwa mfano,
H 2 O H + +OH - ,
Zn(OH) 2 Zn 2+ +2OH - ,
Zn(OH) 2 2H + +ZnO 2 2- au
Zn(OH) 2 + 2H 2 O 2- + 2H + .
Kazi ya nyumbani: aya ya 36, mfano. 2-5, jifunze ufafanuzi
