ಸಾಮಾನ್ಯ ಮಾಹಿತಿ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲದುರ್ಬಲ ಡೈಬಾಸಿಕ್ ಆಮ್ಲ. IN ಶುದ್ಧ ರೂಪಹೈಲೈಟ್ ಮಾಡಲಾಗಿಲ್ಲ. ಕರಗಿದ ನಂತರ ಸಣ್ಣ ಪ್ರಮಾಣದಲ್ಲಿ ರೂಪುಗೊಳ್ಳುತ್ತದೆ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ಗಾಳಿಯಿಂದ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಸೇರಿದಂತೆ ನೀರಿನಲ್ಲಿ. ಹಲವಾರು ಸ್ಥಿರ ಅಜೈವಿಕ ಮತ್ತು ಸಾವಯವ ಉತ್ಪನ್ನಗಳನ್ನು ರೂಪಿಸುತ್ತದೆ: ಲವಣಗಳು (ಕಾರ್ಬೊನೇಟ್ಗಳು ಮತ್ತು ಬೈಕಾರ್ಬನೇಟ್ಗಳು), ಎಸ್ಟರ್ಗಳು, ಅಮೈಡ್ಸ್, ಇತ್ಯಾದಿ.



ಕೊಳೆಯುವಿಕೆ ದ್ರಾವಣದ ಉಷ್ಣತೆಯು ಹೆಚ್ಚಾದಾಗ ಮತ್ತು/ಅಥವಾ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ನ ಆಂಶಿಕ ಒತ್ತಡ ಕಡಿಮೆಯಾದಾಗ, ವ್ಯವಸ್ಥೆಯಲ್ಲಿನ ಸಮತೋಲನವು ಎಡಕ್ಕೆ ಬದಲಾಗುತ್ತದೆ, ಇದು ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲದ ಭಾಗವನ್ನು ನೀರು ಮತ್ತು ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ಗೆ ವಿಭಜಿಸಲು ಕಾರಣವಾಗುತ್ತದೆ. ದ್ರಾವಣವು ಕುದಿಯುವಾಗ, ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲವು ಸಂಪೂರ್ಣವಾಗಿ ಕೊಳೆಯುತ್ತದೆ:

ತಯಾರಿ ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ನೀರಿನಲ್ಲಿ ಕರಗಿದಾಗ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲವು ರೂಪುಗೊಳ್ಳುತ್ತದೆ. ದ್ರಾವಣದಲ್ಲಿನ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲದ ಅಂಶವು ದ್ರಾವಣದ ತಾಪಮಾನವನ್ನು ಕಡಿಮೆ ಮಾಡುವುದರೊಂದಿಗೆ ಮತ್ತು ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಒತ್ತಡವನ್ನು ಹೆಚ್ಚಿಸುವುದರೊಂದಿಗೆ ಹೆಚ್ಚಾಗುತ್ತದೆ. ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲವು ಅದರ ಲವಣಗಳ (ಕಾರ್ಬೊನೇಟ್ಗಳು ಮತ್ತು ಬೈಕಾರ್ಬನೇಟ್ಗಳು) ಬಲವಾದ ಆಮ್ಲದೊಂದಿಗೆ ಪರಸ್ಪರ ಕ್ರಿಯೆಯಿಂದ ಕೂಡ ರೂಪುಗೊಳ್ಳುತ್ತದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ರೂಪುಗೊಂಡ ಹೆಚ್ಚಿನ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲ, ನಿಯಮದಂತೆ, ನೀರು ಮತ್ತು ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಆಗಿ ವಿಭಜನೆಯಾಗುತ್ತದೆ.

ಅಪ್ಲಿಕೇಶನ್ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲ ಯಾವಾಗಲೂ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ (ಕಾರ್ಬೊನೇಟೆಡ್ ನೀರು) ಜಲೀಯ ದ್ರಾವಣಗಳಲ್ಲಿ ಇರುತ್ತದೆ. ಸ್ಥಿರ ತಾಪಮಾನದಲ್ಲಿ ಆಕ್ಸೋನಿಯಮ್ ಅಯಾನುಗಳ (ಆಮ್ಲತೆ) ವಿಷಯದಲ್ಲಿನ ಬದಲಾವಣೆಗೆ ಅನುಗುಣವಾಗಿ ಅನಿಲ ಒತ್ತಡವನ್ನು ಬದಲಾಯಿಸಲು ಜೈವಿಕ ರಸಾಯನಶಾಸ್ತ್ರವು ಸಮತೋಲನ ವ್ಯವಸ್ಥೆಯ ಆಸ್ತಿಯನ್ನು ಬಳಸುತ್ತದೆ. ನೈಜ ಸಮಯದಲ್ಲಿ ಪ್ರಗತಿಯನ್ನು ದಾಖಲಿಸಲು ಇದು ನಿಮ್ಮನ್ನು ಅನುಮತಿಸುತ್ತದೆ ಕಿಣ್ವಕ ಪ್ರತಿಕ್ರಿಯೆಗಳು, ದ್ರಾವಣದ pH ನಲ್ಲಿನ ಬದಲಾವಣೆಗಳೊಂದಿಗೆ ಸಂಭವಿಸುತ್ತದೆ

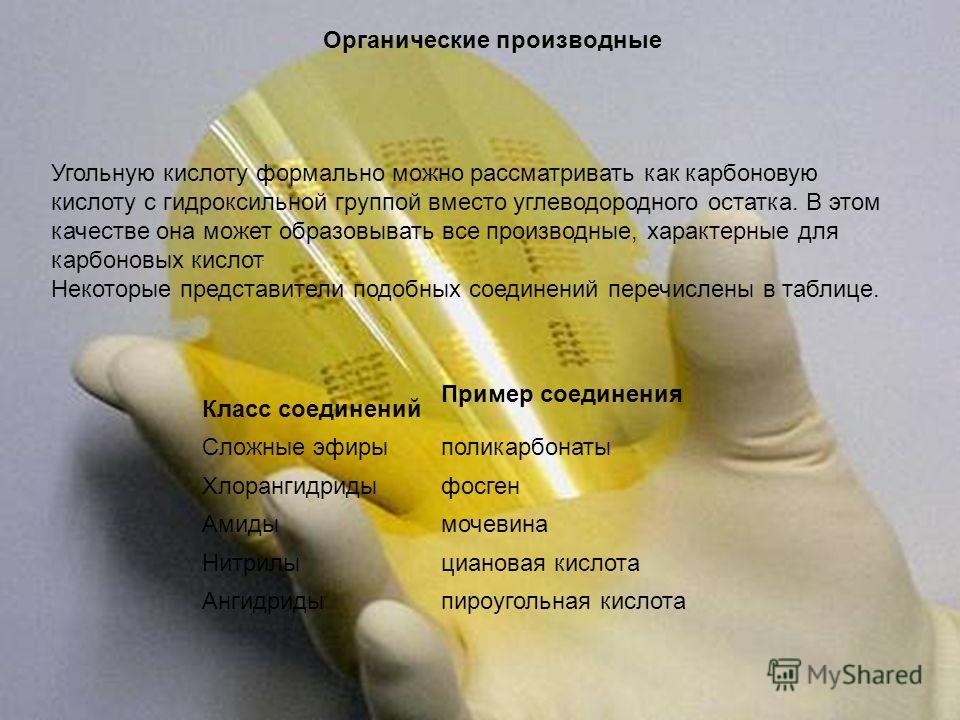
ಸಾವಯವ ಉತ್ಪನ್ನಗಳು ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲವನ್ನು ಹೈಡ್ರೋಕಾರ್ಬನ್ ಶೇಷದ ಬದಲಿಗೆ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪಿನೊಂದಿಗೆ ಕಾರ್ಬಾಕ್ಸಿಲಿಕ್ ಆಮ್ಲ ಎಂದು ಔಪಚಾರಿಕವಾಗಿ ಪರಿಗಣಿಸಬಹುದು. ಈ ಸಾಮರ್ಥ್ಯದಲ್ಲಿ, ಇದು ಎಲ್ಲಾ ಉತ್ಪನ್ನಗಳ ಗುಣಲಕ್ಷಣಗಳನ್ನು ರೂಪಿಸಬಹುದು ಕಾರ್ಬಾಕ್ಸಿಲಿಕ್ ಆಮ್ಲಗಳು. ಅಂತಹ ಸಂಯುಕ್ತಗಳ ಕೆಲವು ಪ್ರತಿನಿಧಿಗಳನ್ನು ಕೋಷ್ಟಕದಲ್ಲಿ ಪಟ್ಟಿ ಮಾಡಲಾಗಿದೆ. ಸಂಯುಕ್ತಗಳ ವರ್ಗ ಸಂಯುಕ್ತ ಎಸ್ಟರ್ ಪಾಲಿಕಾರ್ಬೊನೇಟ್ಗಳ ಉದಾಹರಣೆ ಆಸಿಡ್ ಕ್ಲೋರೈಡ್ಗಳು ಫಾಸ್ಜೀನ್ ಅಮೈಡ್ಸ್ ಯೂರಿಯಾ ನೈಟ್ರಿಲಿಸೈಯಾನೋಯಿಕ್ ಆಮ್ಲ ಅನ್ಹೈಡ್ರೈಡ್ಸ್ ಪೈರೋಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲ
2011 ರ ಹೊತ್ತಿಗೆ ಭೂಮಿಯ ವಾತಾವರಣದಲ್ಲಿ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಅನ್ನು 392 ppm ಅಥವಾ 0.0392% ನಲ್ಲಿ ಪ್ರತಿನಿಧಿಸಲಾಗುತ್ತದೆ, ಜೀವಗೋಳದ ಜೀವನದಲ್ಲಿ ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ (CO2, ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ಅಥವಾ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್) ಪಾತ್ರವು ಪ್ರಾಥಮಿಕವಾಗಿ ಪ್ರಕ್ರಿಯೆಯನ್ನು ಬೆಂಬಲಿಸುತ್ತದೆ. ದ್ಯುತಿಸಂಶ್ಲೇಷಣೆ, ಇದು ಸಸ್ಯಗಳಿಂದ ನಡೆಸಲ್ಪಡುತ್ತದೆ. ಹಸಿರುಮನೆ ಅನಿಲವಾಗಿ, ಗಾಳಿಯಲ್ಲಿರುವ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಸುತ್ತಮುತ್ತಲಿನ ಜಾಗದೊಂದಿಗೆ ಗ್ರಹದ ಶಾಖ ವಿನಿಮಯದ ಮೇಲೆ ಪರಿಣಾಮ ಬೀರುತ್ತದೆ, ಹಲವಾರು ಆವರ್ತನಗಳಲ್ಲಿ ಮರು-ವಿಕಿರಣಗೊಂಡ ಶಾಖವನ್ನು ಪರಿಣಾಮಕಾರಿಯಾಗಿ ತಡೆಯುತ್ತದೆ ಮತ್ತು ಹೀಗಾಗಿ ಗ್ರಹದ ಹವಾಮಾನವನ್ನು ರೂಪಿಸುವಲ್ಲಿ ಭಾಗವಹಿಸುತ್ತದೆ.
ಕಾರಣ ಸಕ್ರಿಯ ಬಳಕೆಮಾನವೀಯತೆಯು ಪಳೆಯುಳಿಕೆ ಇಂಧನಗಳನ್ನು ಇಂಧನವಾಗಿ ಬಳಸುತ್ತದೆ, ಇದರಿಂದಾಗಿ ವಾತಾವರಣದಲ್ಲಿ ಈ ಅನಿಲದ ಸಾಂದ್ರತೆಯು ಶೀಘ್ರವಾಗಿ ಹೆಚ್ಚಾಗುತ್ತದೆ. ಪ್ರಥಮ ಮಾನವಜನ್ಯ ಪ್ರಭಾವಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಸಾಂದ್ರತೆಯ ಮೇಲೆ 19 ನೇ ಶತಮಾನದ ಮಧ್ಯಭಾಗದಿಂದ ಗುರುತಿಸಲಾಗಿದೆ. ಆ ಸಮಯದಿಂದ, ಅದರ ಬೆಳವಣಿಗೆಯ ದರವು ಹೆಚ್ಚಾಗಿದೆ ಮತ್ತು 2000 ರ ದಶಕದ ಕೊನೆಯಲ್ಲಿ ಇದು 2.20 ± 0.01 ppm/ವರ್ಷ ಅಥವಾ ವರ್ಷಕ್ಕೆ 1.7% ದರದಲ್ಲಿ ಸಂಭವಿಸಿದೆ. ಈ ಪ್ರಕಾರ ವೈಯಕ್ತಿಕ ಅಧ್ಯಯನಗಳು, ಆಧುನಿಕ ಮಟ್ಟವಾತಾವರಣದಲ್ಲಿನ CO2 ಕಳೆದ 800 ಸಾವಿರ ವರ್ಷಗಳಲ್ಲಿ ಮತ್ತು ಬಹುಶಃ ಕಳೆದ 20 ದಶಲಕ್ಷ ವರ್ಷಗಳಲ್ಲಿ ಅತ್ಯಧಿಕವಾಗಿದೆ.
ಹಸಿರುಮನೆ ಪರಿಣಾಮದಲ್ಲಿ ಪಾತ್ರ
ಹಸಿರುಮನೆ ಅನಿಲವಾಗಿ ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ಅನ್ನು ಇತರ ಅನಿಲಗಳಿಂದ ಪ್ರತ್ಯೇಕಿಸುವುದು ಹವಾಮಾನದ ಮೇಲೆ ಅದರ ದೀರ್ಘಾವಧಿಯ ಪ್ರಭಾವವಾಗಿದೆ, ಇದು ಹೊರಸೂಸುವಿಕೆಯನ್ನು ನಿಲ್ಲಿಸಿದ ನಂತರ ಸಾವಿರ ವರ್ಷಗಳವರೆಗೆ ಸ್ಥಿರವಾಗಿರುತ್ತದೆ. ಇತರೆ ಹಸಿರುಮನೆ ಅನಿಲಗಳುಮೀಥೇನ್ ಮತ್ತು ನೈಟ್ರಿಕ್ ಆಕ್ಸೈಡ್ನಂತಹ ಆಕ್ಸೈಡ್ಗಳು ಕಡಿಮೆ ಸಮಯದವರೆಗೆ ವಾತಾವರಣದಲ್ಲಿ ಮುಕ್ತ ಸ್ಥಿತಿಯಲ್ಲಿ ಅಸ್ತಿತ್ವದಲ್ಲಿರುತ್ತವೆ.
ಗಾಳಿಯಲ್ಲಿ ತುಲನಾತ್ಮಕವಾಗಿ ಕಡಿಮೆ ಸಾಂದ್ರತೆಯ ಹೊರತಾಗಿಯೂ, CO2 ಆಗಿದೆ ಒಂದು ಪ್ರಮುಖ ಅಂಶಭೂಮಿಯ ವಾತಾವರಣ, ಅದು ಹೀರಿಕೊಳ್ಳುತ್ತದೆ ಮತ್ತು ಮರು-ಹೊರಸೂಸುತ್ತದೆ ಅತಿಗೆಂಪು ವಿಕಿರಣ 4.26 μm (ಕಂಪನ ಮೋಡ್ - ಅಣುವಿನ ಅಸಮವಾದ ವಿಸ್ತರಣೆ) ಮತ್ತು 14.99 μm (ಬಾಗುವ ಕಂಪನಗಳು) ಸೇರಿದಂತೆ ವಿವಿಧ ತರಂಗಾಂತರಗಳಲ್ಲಿ. ಈ ಪ್ರಕ್ರಿಯೆಯು ಈ ತರಂಗಾಂತರಗಳಲ್ಲಿ ಭೂಮಿಯಿಂದ ಬಾಹ್ಯಾಕಾಶಕ್ಕೆ ವಿಕಿರಣವನ್ನು ತೆಗೆದುಹಾಕುತ್ತದೆ ಅಥವಾ ಕಡಿಮೆ ಮಾಡುತ್ತದೆ, ಇದು ಹಸಿರುಮನೆ ಪರಿಣಾಮಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ.
ವಾತಾವರಣದ CO2 ಸಾಂದ್ರತೆಯಲ್ಲಿನ ಪ್ರಸ್ತುತ ಬದಲಾವಣೆಯು ಹೀರಿಕೊಳ್ಳುವ ಬ್ಯಾಂಡ್ಗಳಲ್ಲಿ ಪ್ರತಿಫಲಿಸುತ್ತದೆ ಆಧುನಿಕ ಪ್ರಭಾವಭೂಮಿಯ ಮರು-ಹೊರಸೂಸುವಿಕೆ ಸ್ಪೆಕ್ಟ್ರಮ್ನಲ್ಲಿ ಕೇವಲ ಭಾಗಶಃ ಹೀರಿಕೊಳ್ಳುವಿಕೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ.
ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ನ ಹಸಿರುಮನೆ ಗುಣಲಕ್ಷಣಗಳ ಜೊತೆಗೆ, ಇದು ಹೆಚ್ಚು ಮುಖ್ಯವಾಗಿದೆ ಭಾರೀ ಅನಿಲಗಾಳಿಗೆ ಹೋಲಿಸಿದರೆ. ಗಾಳಿಯ ಸರಾಸರಿ ಸಾಪೇಕ್ಷ ಮೋಲಾರ್ ದ್ರವ್ಯರಾಶಿ 28.98 g/mol ಆಗಿರುವುದರಿಂದ ಮತ್ತು CO2 ನ ಮೋಲಾರ್ ದ್ರವ್ಯರಾಶಿ 44.01 g/mol ಆಗಿರುವುದರಿಂದ, ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ನ ಅನುಪಾತದಲ್ಲಿನ ಹೆಚ್ಚಳವು ಗಾಳಿಯ ಸಾಂದ್ರತೆಯ ಹೆಚ್ಚಳಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ ಮತ್ತು ಅದರ ಪ್ರಕಾರ, ಅದರ ಬದಲಾವಣೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ. ಎತ್ತರವನ್ನು ಅವಲಂಬಿಸಿ ಒತ್ತಡದ ಪ್ರೊಫೈಲ್. ಸದ್ಗುಣದಿಂದ ಭೌತಿಕ ಸ್ವಭಾವ ಹಸಿರುಮನೆ ಪರಿಣಾಮ, ವಾತಾವರಣದ ಗುಣಲಕ್ಷಣಗಳಲ್ಲಿನ ಇಂತಹ ಬದಲಾವಣೆಯು ಮೇಲ್ಮೈಯಲ್ಲಿ ಸರಾಸರಿ ತಾಪಮಾನದಲ್ಲಿ ಹೆಚ್ಚಳಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ.
ಭೂಮಿಯ ವಾತಾವರಣದಲ್ಲಿ ಹಸಿರುಮನೆ ಪರಿಣಾಮದ ಮುಖ್ಯ ಮೂಲವೆಂದರೆ ಅನಿಲ ನೀರು ಅಥವಾ ಗಾಳಿಯ ಆರ್ದ್ರತೆ. ಹಸಿರುಮನೆ ಅನಿಲಗಳುವಾತಾವರಣದಲ್ಲಿ ಮತ್ತು ಸೌರ ಸ್ಥಿರಾಂಕದ ಮೌಲ್ಯವು 1368 W m2 ಗೆ ಸಮಾನವಾಗಿರುತ್ತದೆ, ಸರಾಸರಿ ತಾಪಮಾನಮೇಲ್ಮೈಯಲ್ಲಿ -15 ° C ಆಗಿರಬೇಕು. ವಾಸ್ತವವಾಗಿ, ಭೂಮಿಯ ಮೇಲ್ಮೈಯ ಸರಾಸರಿ ತಾಪಮಾನವು +15 ° C ಆಗಿದೆ, ಅಂದರೆ, ಹಸಿರುಮನೆ ಪರಿಣಾಮವು 30 ° C ಹೆಚ್ಚಳಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ, ಅದರಲ್ಲಿ 20.6 ° C ಗಾಳಿಯಲ್ಲಿ ನೀರಿನ ಆವಿಯ ಉಪಸ್ಥಿತಿಯಿಂದ ವಿವರಿಸಲಾಗಿದೆ, ಅದರಲ್ಲಿರುವ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಇರುವಿಕೆಯು ತಾಪಮಾನದಲ್ಲಿ 7.2 ಡಿಗ್ರಿ ಸೆಲ್ಸಿಯಸ್ ಹೆಚ್ಚಳಕ್ಕೆ ಕಾರಣವಾಗಿದೆ ಎಂದು ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ. ವಾತಾವರಣದಲ್ಲಿ ಈ ಅನಿಲದ ಪ್ರಮಾಣದಲ್ಲಿ ಹೆಚ್ಚಳದೊಂದಿಗೆ, ಅದರ ದೊಡ್ಡ ಮೋಲಾರ್ ದ್ರವ್ಯರಾಶಿಯು ಸಾಂದ್ರತೆ ಮತ್ತು ಒತ್ತಡದಲ್ಲಿ ಹೆಚ್ಚಳಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ, ನಂತರ ಅದೇ ತಾಪಮಾನದಲ್ಲಿ, CO2 ಸಾಂದ್ರತೆಯ ಹೆಚ್ಚಳವು ಗಾಳಿಯ ತೇವಾಂಶದ ಸಾಮರ್ಥ್ಯದ ಹೆಚ್ಚಳಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ ಮತ್ತು ವಾತಾವರಣದಲ್ಲಿನ ಹೆಚ್ಚಿನ ನೀರಿನ ಕಾರಣದಿಂದಾಗಿ ಹಸಿರುಮನೆ ಪರಿಣಾಮದ ಹೆಚ್ಚಳಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ. ಅದೇ ಮಟ್ಟದ ಸಾಪೇಕ್ಷ ಆರ್ದ್ರತೆಯನ್ನು ಸಾಧಿಸಲು ಗಾಳಿಯಲ್ಲಿ ನೀರಿನ ಪ್ರಮಾಣವನ್ನು ಹೆಚ್ಚಿಸುವುದು - ಕಡಿಮೆ ಕಾರಣ ಮೋಲಾರ್ ದ್ರವ್ಯರಾಶಿನೀರು (18 ಗ್ರಾಂ ಮೋಲ್) - ಗಾಳಿಯ ಸಾಂದ್ರತೆಯನ್ನು ಕಡಿಮೆ ಮಾಡುತ್ತದೆ, ಇದು ಉಪಸ್ಥಿತಿಯಿಂದ ಉಂಟಾಗುವ ಸಾಂದ್ರತೆಯ ಹೆಚ್ಚಳವನ್ನು ಸರಿದೂಗಿಸುತ್ತದೆ ಉನ್ನತ ಹಂತವಾತಾವರಣದಲ್ಲಿ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್.
ಸಂಯೋಜನೆ ಪಟ್ಟಿ ಮಾಡಲಾದ ಅಂಶಗಳುಒಟ್ಟಾರೆಯಾಗಿ, 280 ppm ನ ಪೂರ್ವ ಕೈಗಾರಿಕಾ ಮಟ್ಟದಿಂದ 392 ppm ನ ಆಧುನಿಕ ಮಟ್ಟಕ್ಕೆ ಸಾಂದ್ರತೆಯ ಹೆಚ್ಚಳವು ಪ್ರತಿ ಹೆಚ್ಚುವರಿ 1.8 W ಗೆ ಸಮನಾಗಿರುತ್ತದೆ ಚದರ ಮೀಟರ್ಗ್ರಹದ ಮೇಲ್ಮೈ.
ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಮೂಲಗಳು
ವಾತಾವರಣದಲ್ಲಿ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ನ ನೈಸರ್ಗಿಕ ಮೂಲಗಳು ಜ್ವಾಲಾಮುಖಿ ಸ್ಫೋಟಗಳು, ದಹನವನ್ನು ಒಳಗೊಂಡಿವೆ ಸಾವಯವ ವಸ್ತುಪ್ರಾಣಿ ಪ್ರಪಂಚದ ಪ್ರತಿನಿಧಿಗಳ ಗಾಳಿ ಮತ್ತು ಉಸಿರಾಟದಲ್ಲಿ (ಏರೋಬಿಕ್ ಜೀವಿಗಳು). ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ಅನ್ನು ಕೆಲವು ಸೂಕ್ಷ್ಮಾಣುಜೀವಿಗಳು ಹುದುಗುವಿಕೆ ಪ್ರಕ್ರಿಯೆಯ ಪರಿಣಾಮವಾಗಿ, ಸೆಲ್ಯುಲಾರ್ ಉಸಿರಾಟ ಮತ್ತು ಗಾಳಿಯಲ್ಲಿ ಸಾವಯವ ಅವಶೇಷಗಳ ಕೊಳೆಯುವಿಕೆಯ ಪ್ರಕ್ರಿಯೆಯಲ್ಲಿ ಉತ್ಪಾದಿಸಲಾಗುತ್ತದೆ. TO ಮಾನವಜನ್ಯ ಮೂಲಗಳುವಾತಾವರಣಕ್ಕೆ CO2 ಹೊರಸೂಸುವಿಕೆಗಳು ಸೇರಿವೆ: ಶಾಖವನ್ನು ಉತ್ಪಾದಿಸಲು, ವಿದ್ಯುತ್ ಉತ್ಪಾದಿಸಲು ಮತ್ತು ಜನರು ಮತ್ತು ಸರಕುಗಳನ್ನು ಸಾಗಿಸಲು ಪಳೆಯುಳಿಕೆ ಮತ್ತು ಪಳೆಯುಳಿಕೆಯಲ್ಲದ ಶಕ್ತಿಯ ಮೂಲಗಳ ದಹನ. ಸಿಮೆಂಟ್ ಉತ್ಪಾದನೆ ಮತ್ತು ಅನಿಲ ಉರಿಯುವಿಕೆಯಂತಹ ಕೆಲವು ಕೈಗಾರಿಕಾ ಚಟುವಟಿಕೆಗಳು ಗಮನಾರ್ಹ CO2 ಹೊರಸೂಸುವಿಕೆಗೆ ಕಾರಣವಾಗುತ್ತವೆ.
ಸಸ್ಯಗಳು ದ್ಯುತಿಸಂಶ್ಲೇಷಣೆಯ ಮೂಲಕ ಪರಿಣಾಮವಾಗಿ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಅನ್ನು ಕಾರ್ಬೋಹೈಡ್ರೇಟ್ಗಳಾಗಿ ಪರಿವರ್ತಿಸುತ್ತವೆ, ಇದನ್ನು ಶಕ್ತಿಯನ್ನು ಬಳಸುವ ವರ್ಣದ್ರವ್ಯ ಕ್ಲೋರೊಫಿಲ್ ಮೂಲಕ ನಡೆಸಲಾಗುತ್ತದೆ. ಸೌರ ವಿಕಿರಣಗಳು. ಪರಿಣಾಮವಾಗಿ ಅನಿಲ, ಆಮ್ಲಜನಕವು ಭೂಮಿಯ ವಾತಾವರಣಕ್ಕೆ ಬಿಡುಗಡೆಯಾಗುತ್ತದೆ ಮತ್ತು ಹೆಟೆರೊಟ್ರೋಫಿಕ್ ಜೀವಿಗಳು ಮತ್ತು ಇತರ ಸಸ್ಯಗಳಿಂದ ಉಸಿರಾಟಕ್ಕೆ ಬಳಸಲ್ಪಡುತ್ತದೆ, ಹೀಗಾಗಿ ಇಂಗಾಲದ ಚಕ್ರವನ್ನು ರೂಪಿಸುತ್ತದೆ.
ನೈಸರ್ಗಿಕ ಮೂಲಗಳು
CO2 ಹೊರಸೂಸುವಿಕೆಯ ಹೆಚ್ಚಿನ ಮೂಲಗಳು ನೈಸರ್ಗಿಕವಾಗಿವೆ. ಸತ್ತ ಮರಗಳು ಮತ್ತು ಹುಲ್ಲುಗಳಂತಹ ಕೊಳೆಯುವ ಸಾವಯವ ವಸ್ತುವು ಪ್ರತಿ ವರ್ಷ 220 ಶತಕೋಟಿ ಟನ್ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಅನ್ನು ಬಿಡುಗಡೆ ಮಾಡುತ್ತದೆ. ಭೂಮಿಯ ಸಾಗರಗಳು 330 ಶತಕೋಟಿ ಹೊರಸೂಸುತ್ತವೆ.1997 ರ ಇಂಡೋನೇಷಿಯಾದ ಅರಣ್ಯ ಮತ್ತು ಪೀಟ್ ಬೆಂಕಿಯು ಪಳೆಯುಳಿಕೆ ಇಂಧನ ದಹನದಿಂದ ಸರಾಸರಿ ವಾರ್ಷಿಕ CO2 ಹೊರಸೂಸುವಿಕೆಯ 13-40% ಅನ್ನು ಹೊರಸೂಸುತ್ತದೆ.ಆದರೂ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಅನ್ನು ಆರಂಭದಲ್ಲಿ ಯುವ ಭೂಮಿಯ ವಾತಾವರಣಕ್ಕೆ ಪರಿಚಯಿಸಲಾಯಿತು ಜ್ವಾಲಾಮುಖಿ ಚಟುವಟಿಕೆ, ಆಧುನಿಕ ಜ್ವಾಲಾಮುಖಿಗಳು ಪ್ರತಿ ವರ್ಷ ಸರಾಸರಿ 130-230 ಮಿಲಿಯನ್ ಟನ್ CO2 ಅನ್ನು ಹೊರಸೂಸುತ್ತವೆ, ಇದು ಮಾನವಜನ್ಯ ಹೊರಸೂಸುವಿಕೆಯ 1% ಕ್ಕಿಂತ ಕಡಿಮೆಯಾಗಿದೆ.
ಸಾಮಾನ್ಯ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ, ಈ ನೈಸರ್ಗಿಕ ಮೂಲಗಳು ವಾತಾವರಣದಿಂದ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಅನ್ನು ತೆಗೆದುಹಾಕುವ ಭೌತಿಕ ಮತ್ತು ಜೈವಿಕ ಪ್ರಕ್ರಿಯೆಗಳೊಂದಿಗೆ ಸಮತೋಲನದಲ್ಲಿರುತ್ತವೆ - ಕೆಲವು CO2 ಕರಗುತ್ತದೆ ಸಮುದ್ರ ನೀರುಮತ್ತು ಕೆಲವನ್ನು ದ್ಯುತಿಸಂಶ್ಲೇಷಣೆಯ ಪ್ರಕ್ರಿಯೆಯ ಮೂಲಕ ಗಾಳಿಯಿಂದ ತೆಗೆದುಹಾಕಲಾಗುತ್ತದೆ. ಸಾಮಾನ್ಯವಾಗಿ ಸಮಯದಲ್ಲಿ ರಿಂದ ಈ ಪ್ರಕ್ರಿಯೆ 5.5 10×11 ಡಿಗ್ರಿ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಹೀರಲ್ಪಡುತ್ತದೆ, ಮತ್ತು ಅದರ ಒಟ್ಟು ತೂಕವಿ ಭೂಮಿಯ ವಾತಾವರಣ 3.03 1012 ಟನ್ಗಳು, ನಂತರ ಸರಾಸರಿ ಎಲ್ಲಾ ವಾತಾವರಣದ CO2 ಪ್ರತಿ ಆರು ವರ್ಷಗಳಿಗೊಮ್ಮೆ ಇಂಗಾಲದ ಚಕ್ರದಲ್ಲಿ ಭಾಗವಹಿಸುತ್ತದೆ, ಮಾನವಜನ್ಯ ಹೊರಸೂಸುವಿಕೆಗಳ ಉಪಸ್ಥಿತಿಯಿಂದಾಗಿ, ಜೀವಗೋಳದಿಂದ CO2 ಹೀರಿಕೊಳ್ಳುವಿಕೆಯು 2000 ರ ದಶಕದ ಮಧ್ಯಭಾಗದಲ್ಲಿ 17 ಶತಕೋಟಿ ಟನ್ಗಳಷ್ಟು ಅದರ ಹೊರಸೂಸುವಿಕೆಯನ್ನು ಮೀರಿದೆ. ಅದರ ಹೀರಿಕೊಳ್ಳುವಿಕೆಯ ದರವನ್ನು ಹೊಂದಿದೆ ಸ್ಥಿರ ಪ್ರವೃತ್ತಿಹೆಚ್ಚುತ್ತಿರುವ ವಾತಾವರಣದ ಸಾಂದ್ರತೆಯೊಂದಿಗೆ ಹೆಚ್ಚಿಸಲು.
ಮಾನವಜನ್ಯ ಹೊರಸೂಸುವಿಕೆ
ಬರುವುದರೊಂದಿಗೆ ಕೈಗಾರಿಕಾ ಕ್ರಾಂತಿ 19 ನೇ ಶತಮಾನದ ಮಧ್ಯಭಾಗದಲ್ಲಿ, ವಾತಾವರಣಕ್ಕೆ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ನ ಮಾನವಜನ್ಯ ಹೊರಸೂಸುವಿಕೆಯಲ್ಲಿ ಪ್ರಗತಿಪರ ಹೆಚ್ಚಳ ಕಂಡುಬಂದಿದೆ, ಇದು ಇಂಗಾಲದ ಚಕ್ರದಲ್ಲಿ ಅಸಮತೋಲನಕ್ಕೆ ಕಾರಣವಾಯಿತು ಮತ್ತು CO2 ಸಾಂದ್ರತೆಯ ಹೆಚ್ಚಳಕ್ಕೆ ಕಾರಣವಾಯಿತು. ಪ್ರಸ್ತುತ, ಮಾನವಕುಲವು ಉತ್ಪಾದಿಸುವ ಸುಮಾರು 57% ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಅನ್ನು ಸಸ್ಯಗಳು ಮತ್ತು ಸಾಗರಗಳಿಂದ ವಾತಾವರಣದಿಂದ ತೆಗೆದುಹಾಕಲಾಗುತ್ತದೆ.ವಾತಾವರಣದಲ್ಲಿನ CO2 ಪ್ರಮಾಣದಲ್ಲಿನ ಹೆಚ್ಚಳದ ಅನುಪಾತವು ಬಿಡುಗಡೆಯಾದ ಒಟ್ಟು CO2 ಗೆ ಸ್ಥಿರ ಮೌಲ್ಯಸುಮಾರು 45% ಮತ್ತು ಐದು ವರ್ಷಗಳ ಅವಧಿಯೊಂದಿಗೆ ಅಲ್ಪಾವಧಿಯ ಏರಿಳಿತಗಳು ಮತ್ತು ಏರಿಳಿತಗಳಿಗೆ ಒಳಗಾಗುತ್ತದೆ.
ಕಲ್ಲಿದ್ದಲು, ತೈಲ ಮತ್ತು ಪಳೆಯುಳಿಕೆ ಇಂಧನಗಳನ್ನು ಸುಡುವುದು ನೈಸರ್ಗಿಕ ಅನಿಲ, ಮಾನವಜನ್ಯ CO2 ಹೊರಸೂಸುವಿಕೆಗೆ ಮುಖ್ಯ ಕಾರಣವಾಗಿದೆ, ಅರಣ್ಯನಾಶವು ಎರಡನೇ ಪ್ರಮುಖ ಕಾರಣವಾಗಿದೆ. 2008 ರಲ್ಲಿ, ಸುಡುವ ಪಳೆಯುಳಿಕೆ ಇಂಧನಗಳು 8.67 ಶತಕೋಟಿ ಟನ್ ಇಂಗಾಲವನ್ನು ವಾತಾವರಣಕ್ಕೆ ಬಿಡುಗಡೆ ಮಾಡಿತು (31.8 ಶತಕೋಟಿ ಟನ್ CO2), 1990 ರಲ್ಲಿ 6.14 ಶತಕೋಟಿ ಟನ್ಗಳಷ್ಟು ವಾರ್ಷಿಕ ಇಂಗಾಲದ ಹೊರಸೂಸುವಿಕೆಯಿಂದ. ಭೂ ಬಳಕೆಗಾಗಿ ಅರಣ್ಯನಾಶವು 2008 ರಲ್ಲಿ 1.2 ಶತಕೋಟಿ ಟನ್ ಕಲ್ಲಿದ್ದಲನ್ನು ಸುಡುವುದಕ್ಕೆ ಸಮಾನವಾದ ವಾತಾವರಣದ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ನಲ್ಲಿ ಹೆಚ್ಚಳವಾಗಿದೆ (1990 ರಲ್ಲಿ 1.64 ಶತಕೋಟಿ ಟನ್). 18 ವರ್ಷಗಳಲ್ಲಿ ಸಂಚಿತ ಹೆಚ್ಚಳವು ವಾರ್ಷಿಕ ನೈಸರ್ಗಿಕ CO2 ಚಕ್ರದ 3% ಆಗಿದೆ, ಸಾಕಷ್ಟು ವ್ಯವಸ್ಥೆಗಳನ್ನು ಸಮತೋಲನದಿಂದ ಹೊರಹಾಕಲು ಮತ್ತು CO2 ಮಟ್ಟದಲ್ಲಿನ ವೇಗವರ್ಧಿತ ಹೆಚ್ಚಳಕ್ಕೆ ಪರಿಣಾಮವಾಗಿ, ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ಕ್ರಮೇಣ ವಾತಾವರಣದಲ್ಲಿ ಸಂಗ್ರಹವಾಯಿತು ಮತ್ತು 2009 ರಲ್ಲಿ ಅದರ ಸಾಂದ್ರತೆಯು ಕೈಗಾರಿಕಾ ಪೂರ್ವದ ಮೌಲ್ಯಕ್ಕಿಂತ 39% ಹೆಚ್ಚಾಗಿದೆ.
ಹೀಗಾಗಿ, (2011 ರ ಹೊತ್ತಿಗೆ) CO2 ನ ಒಟ್ಟು ಮಾನವಜನ್ಯ ಹೊರಸೂಸುವಿಕೆಯು ಅದರ ನೈಸರ್ಗಿಕ ವಾರ್ಷಿಕ ಚಕ್ರದ 8% ಅನ್ನು ಮೀರುವುದಿಲ್ಲ ಎಂಬ ವಾಸ್ತವದ ಹೊರತಾಗಿಯೂ, ಮಾನವಜನ್ಯ ಹೊರಸೂಸುವಿಕೆಯ ಮಟ್ಟದಿಂದ ಮಾತ್ರವಲ್ಲದೆ ಸಾಂದ್ರತೆಯ ಹೆಚ್ಚಳವೂ ಕಂಡುಬರುತ್ತದೆ. ನಿರಂತರ ಬೆಳವಣಿಗೆಕಾಲಾನಂತರದಲ್ಲಿ ಹೊರಸೂಸುವಿಕೆಯ ಮಟ್ಟಗಳು.
ತಾಪಮಾನ ಬದಲಾವಣೆ ಮತ್ತು ಕಾರ್ಬನ್ ಸೈಕಲ್
ವಾತಾವರಣದಲ್ಲಿ CO2 ಅಂಶವನ್ನು ಹೆಚ್ಚಿಸುವ ಇತರ ಅಂಶಗಳು 20 ನೇ ಶತಮಾನದಲ್ಲಿ ಸರಾಸರಿ ತಾಪಮಾನದಲ್ಲಿನ ಹೆಚ್ಚಳವನ್ನು ಒಳಗೊಂಡಿವೆ, ಇದು ಸಾವಯವ ಅವಶೇಷಗಳ ಕೊಳೆಯುವಿಕೆಯ ವೇಗವರ್ಧನೆಯಲ್ಲಿ ಪ್ರತಿಫಲಿಸಿರಬೇಕು ಮತ್ತು ಸಾಗರಗಳ ಉಷ್ಣತೆಯಿಂದಾಗಿ ಒಟ್ಟು ಪ್ರಮಾಣದಲ್ಲಿ ಇಳಿಕೆ ಕಂಡುಬರುತ್ತದೆ. ನೀರಿನಲ್ಲಿ ಕರಗಿದ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್. ತಾಪಮಾನದ ಹೆಚ್ಚಳವು ಅಸಾಧಾರಣವಾದ ಹೆಚ್ಚಿನ ಕಾರಣದಿಂದ ಕೂಡಿದೆ ಸೌರ ಚಟುವಟಿಕೆಈ ಅವಧಿಯಲ್ಲಿ ಮತ್ತು 19 ನೇ ಶತಮಾನದಲ್ಲಿ (ನೋಡಿ, ಉದಾಹರಣೆಗೆ, ಕ್ಯಾರಿಂಗ್ಟನ್ ಈವೆಂಟ್, 1859).
ಕಳೆದ ಮಿಲಿಯನ್ ವರ್ಷಗಳಲ್ಲಿ ಶೀತದಿಂದ ಬೆಚ್ಚಗಿನ ಹವಾಮಾನಕ್ಕೆ ಪರಿವರ್ತನೆಯ ಸಮಯದಲ್ಲಿ, ವಾತಾವರಣದ CO2 ಸಾಂದ್ರತೆಗಳಲ್ಲಿ ನೈಸರ್ಗಿಕ ಬದಲಾವಣೆಯು 100 ppm ಒಳಗೆ ಉಳಿಯಿತು, ಅಂದರೆ ಒಟ್ಟು ಹೆಚ್ಚಳವು 40% ಕ್ಕಿಂತ ಕಡಿಮೆಯಾಗಿದೆ. ಇದಲ್ಲದೆ, ಉದಾಹರಣೆಗೆ, ಹವಾಮಾನ ಗರಿಷ್ಠ 9000-5000 ವರ್ಷಗಳ BC ಅವಧಿಯಲ್ಲಿ ಗ್ರಹದ ಸರಾಸರಿ ತಾಪಮಾನ. ಇಂದಿಗಿಂತ ಸರಿಸುಮಾರು 1 - 2 °C ಹೆಚ್ಚಿತ್ತು, ಮತ್ತು ಬೆಚ್ಚಗಿನ ವಾತಾವರಣದಲ್ಲಿ ಹೆಚ್ಚು ಸ್ಪಷ್ಟವಾದ ಹಸಿರುಮನೆ ಪರಿಣಾಮದಿಂದಾಗಿ, ಸಬಾರ್ಕ್ಟಿಕ್ ಅಕ್ಷಾಂಶಗಳಲ್ಲಿ ಸರಾಸರಿ ವಾರ್ಷಿಕ ತಾಪಮಾನದ ವೈಪರೀತ್ಯವು 9 °C ತಲುಪಿತು.
ಕಾರ್ಬನ್ ಮಾನಾಕ್ಸೈಡ್ (IV), ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲ ಮತ್ತು ಅದರ ಲವಣಗಳು
ಡಿ ಕಾರ್ಬನ್ ಮಾನಾಕ್ಸೈಡ್ CO 2 (ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್) - ನಲ್ಲಿ ಸಾಮಾನ್ಯ ಪರಿಸ್ಥಿತಿಗಳುಇದು ಬಣ್ಣರಹಿತ ಮತ್ತು ವಾಸನೆಯಿಲ್ಲದ ಅನಿಲವಾಗಿದೆ, ಸ್ವಲ್ಪ ಹುಳಿ ರುಚಿ, ಗಾಳಿಗಿಂತ ಸುಮಾರು 1.5 ಪಟ್ಟು ಭಾರವಾಗಿರುತ್ತದೆ, ನೀರಿನಲ್ಲಿ ಕರಗುತ್ತದೆ, ಸುಲಭವಾಗಿ ದ್ರವೀಕರಿಸಲಾಗುತ್ತದೆ. ಕೊಠಡಿಯ ತಾಪಮಾನಸುಮಾರು 60 ∙ 10 5 Pa ಒತ್ತಡದಲ್ಲಿ ಅದನ್ನು ದ್ರವವಾಗಿ ಪರಿವರ್ತಿಸಬಹುದು). −56.2ºС ಗೆ ತಂಪಾಗಿಸಿದಾಗ, ದ್ರವ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಘನೀಕರಿಸುತ್ತದೆ ಮತ್ತು ಹಿಮದಂತಹ ದ್ರವ್ಯರಾಶಿಯಾಗಿ ಬದಲಾಗುತ್ತದೆ.
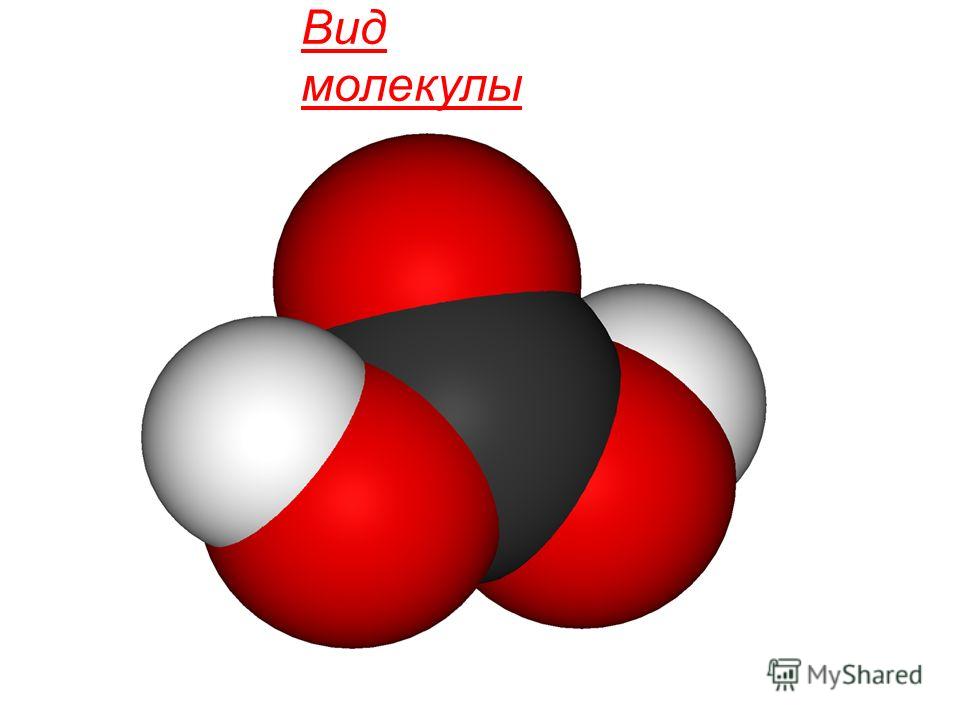
ಎಲ್ಲದರಲ್ಲಿ ಒಟ್ಟುಗೂಡಿಸುವಿಕೆಯ ರಾಜ್ಯಗಳುಧ್ರುವೀಯವಲ್ಲದ ರೇಖೀಯ ಅಣುಗಳನ್ನು ಒಳಗೊಂಡಿದೆ. ರಾಸಾಯನಿಕ ರಚನೆ CO 2 ಅಣುವನ್ನು ಕೇಂದ್ರ ಇಂಗಾಲದ ಪರಮಾಣುವಿನ sp-ಹೈಬ್ರಿಡೈಸೇಶನ್ ಮತ್ತು ಹೆಚ್ಚುವರಿ π ರಚನೆಯಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ ಆರ್-ಆರ್-ಸಂಪರ್ಕಗಳು: O = C = O.
ವಿಲ್ನಲ್ಲಿ ಕರಗಿದ ಕೆಲವು CO 2 ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲವನ್ನು ರೂಪಿಸಲು ಅದರೊಂದಿಗೆ ಸಂವಹನ ನಡೆಸುತ್ತದೆ:
CO 2 + H 2 O ↔ CO 2 ∙ H 2 O ↔ H 2 CO 3.
ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ಅನ್ನು ಕಾರ್ಬೋನೇಟ್ಗಳು ಮತ್ತು ಬೈಕಾರ್ಬನೇಟ್ಗಳನ್ನು ರೂಪಿಸಲು ಕ್ಷಾರ ದ್ರಾವಣಗಳಿಂದ ಸುಲಭವಾಗಿ ಹೀರಿಕೊಳ್ಳಲಾಗುತ್ತದೆ:
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O; CO 2 + NaOH = NaHCO 3.
CO 2 ಅಣುಗಳು ಅತ್ಯಂತ ಉಷ್ಣವಾಗಿ ಸ್ಥಿರವಾಗಿರುತ್ತವೆ; ವಿಭಜನೆಯು 2000ºC ತಾಪಮಾನದಲ್ಲಿ ಮಾತ್ರ ಪ್ರಾರಂಭವಾಗುತ್ತದೆ. ಈ ಕಾರಣಕ್ಕಾಗಿ, ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ಸುಡುವುದಿಲ್ಲ ಮತ್ತು ಸಾಂಪ್ರದಾಯಿಕ ಇಂಧನಗಳ ದಹನವನ್ನು ಬೆಂಬಲಿಸುವುದಿಲ್ಲ. ಆದರೆ ಅದರ ವಾತಾವರಣದಲ್ಲಿ ಕೆಲವು ಉರಿಯುತ್ತಿವೆ ಸರಳ ಪದಾರ್ಥಗಳು, ಇವುಗಳ ಪರಮಾಣುಗಳು ಆಮ್ಲಜನಕಕ್ಕೆ ಹೆಚ್ಚಿನ ಸಂಬಂಧವನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತವೆ, ಉದಾಹರಣೆಗೆ, ಮೆಗ್ನೀಸಿಯಮ್, ಬಿಸಿ ಮಾಡಿದಾಗ, CO 2 ವಾತಾವರಣದಲ್ಲಿ ಉರಿಯುತ್ತದೆ.
ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲ H 2 CO 3 ದುರ್ಬಲ ಸಂಯುಕ್ತವಾಗಿದೆ ಮತ್ತು ಜಲೀಯ ದ್ರಾವಣಗಳಲ್ಲಿ ಮಾತ್ರ ಅಸ್ತಿತ್ವದಲ್ಲಿದೆ. ಹೆಚ್ಚಿನವುನೀರಿನಲ್ಲಿ ಕರಗಿದ ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ಹೈಡ್ರೀಕರಿಸಿದ CO 2 ಅಣುಗಳ ರೂಪದಲ್ಲಿರುತ್ತದೆ, ಚಿಕ್ಕದು ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲವನ್ನು ರೂಪಿಸುತ್ತದೆ.
ವಾಯುಮಂಡಲದ CO2 ನೊಂದಿಗೆ ಸಮತೋಲನದಲ್ಲಿರುವ ಜಲೀಯ ದ್ರಾವಣಗಳು ಆಮ್ಲೀಯವಾಗಿವೆ: = 0.04 M ಮತ್ತು pH ≈ 4.
ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲ ಡೈಬಾಸಿಕ್ ಮತ್ತು ಸೇರಿದೆ ದುರ್ಬಲ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳು, ಹಂತ ಹಂತವಾಗಿ ವಿಯೋಜಿಸುತ್ತದೆ (K 1 = 4, 4 ∙ 10 -7; K 2 = 4, 8 ∙ 10 -11). CO 2 ಅನ್ನು ನೀರಿನಲ್ಲಿ ಕರಗಿಸಿದಾಗ, ಈ ಕೆಳಗಿನ ಡೈನಾಮಿಕ್ ಸಮತೋಲನವನ್ನು ಸ್ಥಾಪಿಸಲಾಗಿದೆ:
H 2 O + CO 2 ↔ CO 2 ∙ H 2 O ↔ H 2 CO 3 ↔ H + + HCO 3 −
ಬಿಸಿ ಮಾಡಿದಾಗ ಜಲೀಯ ದ್ರಾವಣಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್, ಅನಿಲದ ಕರಗುವಿಕೆ ಕಡಿಮೆಯಾಗುತ್ತದೆ, CO 2 ದ್ರಾವಣದಿಂದ ಬಿಡುಗಡೆಯಾಗುತ್ತದೆ ಮತ್ತು ಸಮತೋಲನವು ಎಡಕ್ಕೆ ಬದಲಾಗುತ್ತದೆ.
ಡೈಬಾಸಿಕ್ ಆಗಿರುವುದರಿಂದ, ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲವು ಎರಡು ಲವಣಗಳ ಸರಣಿಯನ್ನು ರೂಪಿಸುತ್ತದೆ: ಮಧ್ಯಮ ಲವಣಗಳು (ಕಾರ್ಬೊನೇಟ್ಗಳು) ಮತ್ತು ಆಮ್ಲೀಯ ಲವಣಗಳು (ಬೈಕಾರ್ಬನೇಟ್ಗಳು). ಹೆಚ್ಚಿನ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲದ ಲವಣಗಳು ಬಣ್ಣರಹಿತವಾಗಿವೆ. ಕಾರ್ಬೋನೇಟ್ಗಳಲ್ಲಿ, ಲವಣಗಳು ಮಾತ್ರ ನೀರಿನಲ್ಲಿ ಕರಗುತ್ತವೆ. ಕ್ಷಾರ ಲೋಹಗಳುಮತ್ತು ಅಮೋನಿಯಂ.
ನೀರಿನಲ್ಲಿ, ಕಾರ್ಬೋನೇಟ್ಗಳು ಜಲವಿಚ್ಛೇದನಕ್ಕೆ ಒಳಗಾಗುತ್ತವೆ ಮತ್ತು ಆದ್ದರಿಂದ ಅವುಗಳ ಪರಿಹಾರಗಳು ಹೊಂದಿರುತ್ತವೆ ಕ್ಷಾರೀಯ ಪ್ರತಿಕ್ರಿಯೆ:
Na 2 CO 3 + H 2 O ↔ NaHCO 3 + NaOH.
ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲದ ರಚನೆಯೊಂದಿಗೆ ಮತ್ತಷ್ಟು ಜಲವಿಚ್ಛೇದನೆಯು ಪ್ರಾಯೋಗಿಕವಾಗಿ ಸಾಮಾನ್ಯ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ ಸಂಭವಿಸುವುದಿಲ್ಲ.
ನೀರಿನಲ್ಲಿ ಹೈಡ್ರೋಕಾರ್ಬೊನೇಟ್ಗಳ ವಿಸರ್ಜನೆಯು ಜಲವಿಚ್ಛೇದನೆಯೊಂದಿಗೆ ಇರುತ್ತದೆ, ಆದರೆ ಸ್ವಲ್ಪ ಮಟ್ಟಿಗೆ, ಮತ್ತು ಪರಿಸರವು ಸ್ವಲ್ಪ ಕ್ಷಾರೀಯವಾಗಿ (pH ≈ 8) ರಚಿಸಲ್ಪಡುತ್ತದೆ.
ಅಮೋನಿಯಂ ಕಾರ್ಬೋನೇಟ್ (NH 4) 2 CO 3 ಎತ್ತರದಲ್ಲಿ ಮತ್ತು ಸಾಮಾನ್ಯ ತಾಪಮಾನದಲ್ಲಿ ಹೆಚ್ಚು ಬಾಷ್ಪಶೀಲವಾಗಿರುತ್ತದೆ, ವಿಶೇಷವಾಗಿ ನೀರಿನ ಆವಿಯ ಉಪಸ್ಥಿತಿಯಲ್ಲಿ, ಇದು ತೀವ್ರವಾದ ಜಲವಿಚ್ಛೇದನವನ್ನು ಉಂಟುಮಾಡುತ್ತದೆ.
ಬಲವಾದ ಆಮ್ಲಗಳು ಮತ್ತು ದುರ್ಬಲ ಅಸಿಟಿಕ್ ಆಮ್ಲವು ಕಾರ್ಬೋನೇಟ್ಗಳಿಂದ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲವನ್ನು ಸ್ಥಳಾಂತರಿಸುತ್ತದೆ:
K 2 CO 3 + H 2 SO 4 = K 2 SO 4 + H 2 O + CO 2.
ಹೆಚ್ಚಿನ ಕಾರ್ಬೋನೇಟ್ಗಳಿಗಿಂತ ಭಿನ್ನವಾಗಿ, ಎಲ್ಲಾ ಬೈಕಾರ್ಬನೇಟ್ಗಳು ನೀರಿನಲ್ಲಿ ಕರಗುತ್ತವೆ. Οʜᴎ ಒಂದೇ ಲೋಹಗಳ ಕಾರ್ಬೋನೇಟ್ಗಳಿಗಿಂತ ಕಡಿಮೆ ಸ್ಥಿರವಾಗಿರುತ್ತದೆ ಮತ್ತು ಬಿಸಿ ಮಾಡಿದಾಗ, ಸುಲಭವಾಗಿ ಕೊಳೆಯುತ್ತದೆ, ಅನುಗುಣವಾದ ಕಾರ್ಬೋನೇಟ್ಗಳಾಗಿ ಬದಲಾಗುತ್ತದೆ:
2KHCO 3 = K 2 CO 3 + H 2 O + CO 2;
Ca(HCO 3) 2 = CaCO 3 + H 2 O + CO 2.
ಬಲವಾದ ಆಮ್ಲಗಳುಹೈಡ್ರೋಕಾರ್ಬೊನೇಟ್ಗಳು ಕಾರ್ಬೋನೇಟ್ಗಳಂತೆ ಕೊಳೆಯುತ್ತವೆ:
KHCO 3 + H 2 SO 4 = KHSO 4 + H 2 O + CO 2
ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲದ ಲವಣಗಳಿಂದ ಅತ್ಯಧಿಕ ಮೌಲ್ಯಸೋಡಿಯಂ ಕಾರ್ಬೋನೇಟ್ (ಸೋಡಾ), ಪೊಟ್ಯಾಸಿಯಮ್ ಕಾರ್ಬೋನೇಟ್ (ಪೊಟ್ಯಾಷ್), ಕ್ಯಾಲ್ಸಿಯಂ ಕಾರ್ಬೋನೇಟ್ (ಚಾಕ್, ಮಾರ್ಬಲ್, ಸುಣ್ಣದ ಕಲ್ಲು), ಸೋಡಿಯಂ ಬೈಕಾರ್ಬನೇಟ್ (ಅಡಿಗೆ ಸೋಡಾ) ಮತ್ತು ಮೂಲ ತಾಮ್ರದ ಕಾರ್ಬೋನೇಟ್ (CuOH) 2 CO 3 (ಮಲಾಕೈಟ್) ಅನ್ನು ಹೊಂದಿರುತ್ತದೆ.
ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲದ ಮೂಲ ಲವಣಗಳು ಪ್ರಾಯೋಗಿಕವಾಗಿ ನೀರಿನಲ್ಲಿ ಕರಗುವುದಿಲ್ಲ ಮತ್ತು ಬಿಸಿ ಮಾಡಿದಾಗ ಸುಲಭವಾಗಿ ಕೊಳೆಯುತ್ತವೆ:
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O.
ಕಾರ್ಬೋನೇಟ್ಗಳ ಉಷ್ಣ ಸ್ಥಿರತೆಯು ಕಾರ್ಬೋನೇಟ್ ಅನ್ನು ರೂಪಿಸುವ ಅಯಾನುಗಳ ಧ್ರುವೀಕರಣದ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ. ಕಾರ್ಬೋನೇಟ್ ಅಯಾನಿನ ಮೇಲೆ ಕ್ಯಾಷನ್ ಹೆಚ್ಚು ಧ್ರುವೀಕರಣವನ್ನು ಹೊಂದಿದೆ, ಉಪ್ಪಿನ ವಿಘಟನೆಯ ಉಷ್ಣತೆಯು ಕಡಿಮೆಯಾಗುತ್ತದೆ. ಕ್ಯಾಷನ್ ಅನ್ನು ಸುಲಭವಾಗಿ ವಿರೂಪಗೊಳಿಸಬಹುದಾದರೆ, ಕಾರ್ಬೋನೇಟ್ ಅಯಾನು ಸ್ವತಃ ಕ್ಯಾಷನ್ ಮೇಲೆ ಧ್ರುವೀಕರಣ ಪರಿಣಾಮವನ್ನು ಹೊಂದಿರುತ್ತದೆ, ಇದು ಉಪ್ಪಿನ ವಿಭಜನೆಯ ತಾಪಮಾನದಲ್ಲಿ ತೀಕ್ಷ್ಣವಾದ ಇಳಿಕೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ.
ಸೋಡಿಯಂ ಮತ್ತು ಪೊಟ್ಯಾಸಿಯಮ್ ಕಾರ್ಬೋನೇಟ್ಗಳು ವಿಭಜನೆಯಾಗದೆ ಕರಗುತ್ತವೆ ಮತ್ತು ಇತರ ಕಾರ್ಬೋನೇಟ್ಗಳು ಬಿಸಿಯಾದಾಗ ಲೋಹದ ಆಕ್ಸೈಡ್ ಮತ್ತು ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ಗಳಾಗಿ ವಿಭಜನೆಯಾಗುತ್ತವೆ:
MgCO 3 = MgO + CO 2.
ಕಾರ್ಬನ್ ಮಾನಾಕ್ಸೈಡ್
CO ಅಣುವು ಈ ಕೆಳಗಿನ ರಚನೆಯನ್ನು ಹೊಂದಿದೆ
: ಇದರೊಂದಿಗೆ ≡ ಬಗ್ಗೆ :
ಕಾರ್ಬನ್ ಮತ್ತು ಆಮ್ಲಜನಕ ಪರಮಾಣುಗಳ 2p ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಜೋಡಣೆಯಿಂದಾಗಿ ಎರಡು ಬಂಧಗಳು ರೂಪುಗೊಳ್ಳುತ್ತವೆ, ಇಂಗಾಲದ ಮುಕ್ತ 2p ಕಕ್ಷೆ ಮತ್ತು ಆಮ್ಲಜನಕದ ಪರಮಾಣುವಿನ 2p ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯಿಂದಾಗಿ ದಾನಿ-ಸ್ವೀಕರಿಸುವ ಕಾರ್ಯವಿಧಾನದಿಂದ ಮೂರನೇ ಬಂಧವು ರೂಪುಗೊಳ್ಳುತ್ತದೆ. ಅಣುವಿನ ದ್ವಿಧ್ರುವಿ ಕ್ಷಣವು ಅತ್ಯಲ್ಪವಾಗಿದೆ, ಆದರೆ ಇಂಗಾಲದ ಪರಮಾಣುವಿನ ಮೇಲೆ ಪರಿಣಾಮಕಾರಿ ಚಾರ್ಜ್ ಋಣಾತ್ಮಕವಾಗಿರುತ್ತದೆ ಮತ್ತು ಆಮ್ಲಜನಕದ ಪರಮಾಣುವಿನ ಮೇಲೆ ಅದು ಧನಾತ್ಮಕವಾಗಿರುತ್ತದೆ.
CO ಅಣುವಿನ ರಚನೆಯು ಸಾರಜನಕ ಅಣುವಿನ ರಚನೆಯನ್ನು ಹೋಲುವುದರಿಂದ, ಅವು ಹೋಲುತ್ತವೆ ಭೌತಿಕ ಗುಣಲಕ್ಷಣಗಳು. CO ಬಹಳ ಹೊಂದಿದೆ ಕಡಿಮೆ ತಾಪಮಾನಕರಗುವಿಕೆ (- 204ºС) ಮತ್ತು ಕುದಿಯುವ (- 191.5ºС), ಇದು ಬಣ್ಣರಹಿತವಾಗಿರುತ್ತದೆ, ತುಂಬಾ ವಿಷಕಾರಿ ಅನಿಲ, ವಾಸನೆಯಿಲ್ಲದ, ಗಾಳಿಗಿಂತ ಸ್ವಲ್ಪ ಹಗುರ. ಇದು ನೀರಿನಲ್ಲಿ ಕಳಪೆಯಾಗಿ ಕರಗುತ್ತದೆ ಮತ್ತು ಅದರೊಂದಿಗೆ ಸಂವಹನ ಮಾಡುವುದಿಲ್ಲ.
CO ಅನ್ನು ಉಪ್ಪು-ರೂಪಿಸದ ಆಕ್ಸೈಡ್ ಎಂದು ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ, ಏಕೆಂದರೆ ಸಾಮಾನ್ಯ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ ಇದು ಆಮ್ಲಗಳು ಅಥವಾ ಕ್ಷಾರಗಳೊಂದಿಗೆ ಸಂವಹನ ನಡೆಸುವುದಿಲ್ಲ. ಆಮ್ಲಜನಕಕ್ಕೆ ಸೀಮಿತ ಪ್ರವೇಶದೊಂದಿಗೆ ಕಲ್ಲಿದ್ದಲು ಮತ್ತು ಇಂಗಾಲದ ಸಂಯುಕ್ತಗಳ ದಹನದ ಸಮಯದಲ್ಲಿ, ಹಾಗೆಯೇ ಬಿಸಿ ಕಲ್ಲಿದ್ದಲಿನೊಂದಿಗೆ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ನ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಸಮಯದಲ್ಲಿ ಇದು ರೂಪುಗೊಳ್ಳುತ್ತದೆ: CO 2 + C = 2CO.
ಪ್ರಯೋಗಾಲಯದಲ್ಲಿ, ಬಿಸಿಮಾಡಿದಾಗ ಅದರ ಮೇಲೆ ಕೇಂದ್ರೀಕೃತ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದ ಕ್ರಿಯೆಯಿಂದ ಫಾರ್ಮಿಕ್ ಆಮ್ಲದಿಂದ ಪಡೆಯಲಾಗುತ್ತದೆ:
HCOOH + H 2 SO 4 (conc.) = CO + H 2 SO 4 ∙ H 2 O.
ನೀವು ಆಕ್ಸಲಿಕ್ ಆಮ್ಲವನ್ನು ಸಹ ಬಳಸಬಹುದು. ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲಈ ಪ್ರತಿಕ್ರಿಯೆಗಳಲ್ಲಿ ಇದು ನೀರು ತೆಗೆಯುವ ಏಜೆಂಟ್ ಆಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತದೆ.
ಸಾಮಾನ್ಯ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ, CO ರಾಸಾಯನಿಕವಾಗಿ ಸಾಕಷ್ಟು ಜಡವಾಗಿರುತ್ತದೆ, ಆದರೆ ಬಿಸಿ ಮಾಡಿದಾಗ ಅದು ಪ್ರದರ್ಶಿಸುತ್ತದೆ ಪುನಶ್ಚೈತನ್ಯಕಾರಿ ಗುಣಲಕ್ಷಣಗಳು, ಕೆಲವು ಲೋಹಗಳನ್ನು ಪಡೆಯಲು ಪೈರೋಮೆಟಲರ್ಜಿಯಲ್ಲಿ ವ್ಯಾಪಕವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ: Fe 2 O 3 + 3CO = 2Fe + 3CO 2.
ಗಾಳಿಯಲ್ಲಿ, CO ಒಂದು ನೀಲಿ ಜ್ವಾಲೆಯೊಂದಿಗೆ ಉರಿಯುತ್ತದೆ, ಬಿಡುಗಡೆಯಾಗುತ್ತದೆ ದೊಡ್ಡ ಪ್ರಮಾಣದಲ್ಲಿಶಾಖ: 2CO + O 2 = 2CO 2 + 569 kJ.
ಸಾಲಿನಲ್ಲಿ ಆಮ್ಲಜನಕದ ಜೊತೆಗೆ ಸೂರ್ಯನ ಬೆಳಕುಅಥವಾ ವೇಗವರ್ಧಕದ (ಸಕ್ರಿಯ ಇಂಗಾಲ) ಉಪಸ್ಥಿತಿಯಲ್ಲಿ, CO ಕ್ಲೋರಿನ್ನೊಂದಿಗೆ ಸೇರಿಕೊಂಡು ಫಾಸ್ಜೀನ್ ಅನ್ನು ರೂಪಿಸುತ್ತದೆ:
CO + Cl 2 = COCl 2.
ಫಾಸ್ಜೀನ್ ಒಂದು ವಿಶಿಷ್ಟವಾದ ವಾಸನೆಯೊಂದಿಗೆ ಬಣ್ಣರಹಿತ ಅನಿಲವಾಗಿದೆ. ಇದು ನೀರಿನಲ್ಲಿ ಸ್ವಲ್ಪ ಕರಗುತ್ತದೆ, ಆದರೆ ಕಾರ್ಬೊನಿಕ್ ಆಸಿಡ್ ಕ್ಲೋರೈಡ್ ಆಗಿ ಈ ಕೆಳಗಿನ ಯೋಜನೆಯ ಪ್ರಕಾರ ಕ್ರಮೇಣ ಹೈಡ್ರೊಲೈಸ್ ಆಗುತ್ತದೆ: COCl 2 + 2H 2 O = 2HCl + H 2 CO 3. ಅದರ ಹೆಚ್ಚಿನ ವಿಷತ್ವದಿಂದಾಗಿ, ಫಾಸ್ಜೀನ್ ಅನ್ನು ಮೊದಲು ರಾಸಾಯನಿಕ ಯುದ್ಧ ಏಜೆಂಟ್ ಆಗಿ ಬಳಸಲಾಯಿತು. ವಿಶ್ವ ಯುದ್ಧ. ಸ್ಲ್ಯಾಕ್ಡ್ ಸುಣ್ಣವನ್ನು ಬಳಸಿ ಅದನ್ನು ತಟಸ್ಥಗೊಳಿಸಬಹುದು.
ಬಿಸಿ ಮಾಡಿದಾಗ, CO ಸಲ್ಫರ್ನಿಂದ ಆಕ್ಸಿಡೀಕರಣಗೊಳ್ಳುತ್ತದೆ: CO + S = COS.
CO ಅಣುವು ವಿವಿಧ ಸಂಕೀರ್ಣ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಲಿಗಂಡ್ ಆಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತದೆ. ಇಂಗಾಲದ ಬಂಧವಿಲ್ಲದ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಯಿಂದಾಗಿ, ಇದು σ-ದಾನಿ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತದೆ ಮತ್ತು ಉಚಿತ π-ಆಂಟಿಬಾಂಡಿಂಗ್ ಆರ್ಬಿಟಲ್ಗಳಿಂದಾಗಿ, ಇದು π-ಸ್ವೀಕರಿಸುವ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತದೆ. ವಿಶೇಷ ಆಸಕ್ತಿಡಿ-ಲೋಹಗಳ ಕಾರ್ಬೊನಿಲ್ ಸಂಕೀರ್ಣಗಳನ್ನು ಪ್ರತಿನಿಧಿಸುತ್ತದೆ, ಏಕೆಂದರೆ ಉಷ್ಣ ವಿಘಟನೆಕಾರ್ಬೊನಿಲ್ಗಳು ಹೆಚ್ಚಿನ ಶುದ್ಧತೆಯ ಲೋಹಗಳನ್ನು ಉತ್ಪಾದಿಸುತ್ತವೆ.
ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲ (ಸೂತ್ರ H2CO3) ದುರ್ಬಲ ಡೈಬಾಸಿಕ್ ಆಮ್ಲವಾಗಿದೆ. ದ್ರಾವಣಗಳನ್ನು ಬಿಸಿ ಮಾಡಿದಾಗ, ಅದು ನೀರಿನಲ್ಲಿ ಕೊಳೆಯುತ್ತದೆ. ಈ ಆಮ್ಲ ಹೊಂದಿದೆ ಶ್ರೆಷ್ಠ ಮೌಲ್ಯಪ್ರಾಣಿಗಳಿಗೆ ಮಾತ್ರವಲ್ಲ, ಸಸ್ಯಗಳಿಗೂ ಸಹ. ಮಾನವ ದೇಹದಲ್ಲಿ, H2CO3, ಹಾಗೆಯೇ ಅದರ ಲವಣಗಳು ರಕ್ತದ ಭಾಗವಾಗಿದೆ. ಬೆಂಬಲವನ್ನು ಬಳಸುವುದು ಆಮ್ಲ-ಬೇಸ್ ಸಮತೋಲನದೇಹದಲ್ಲಿ, ಇದು ಸಾಮಾನ್ಯ ಕಾರ್ಯಚಟುವಟಿಕೆಗೆ ಅವಶ್ಯಕವಾಗಿದೆ. ರಲ್ಲಿ ಆಮ್ಲಗಳ ವಿಘಟನೆ ಜಲ ಪರಿಸರಅಯಾನುಗಳು ಮತ್ತು ಕ್ಯಾಟಯಾನುಗಳ ರಚನೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ. ಅನೇಕರ ಹರಿವಿಗೆ ಅಯಾನು ಸಾಂದ್ರತೆಯು ಹೆಚ್ಚಿನ ಪ್ರಾಮುಖ್ಯತೆಯನ್ನು ಹೊಂದಿದೆ ಜೀವರಾಸಾಯನಿಕ ಪ್ರಕ್ರಿಯೆಗಳುಪ್ರಾಣಿಗಳು ಮತ್ತು ಸಸ್ಯಗಳ ದೇಹದಲ್ಲಿ. ಕೆಲವು ರೋಗಗಳಿಗೆ ಸಕ್ರಿಯ ಪ್ರತಿಕ್ರಿಯೆರಕ್ತವು ಆಮ್ಲೀಯಕ್ಕೆ ಬದಲಾಗುತ್ತದೆ (ಹುಣ್ಣಿನೊಂದಿಗೆ ಡ್ಯುವೋಡೆನಮ್ಮತ್ತು ಹೊಟ್ಟೆ) ಅಥವಾ ಕ್ಷಾರೀಯ (ಸೆಪ್ಸಿಸ್, ನ್ಯುಮೋನಿಯಾಕ್ಕೆ) ಕಡೆ. ಆಮ್ಲವ್ಯಾಧಿಯೊಂದಿಗೆ, ಹೈಡ್ರೋಜನ್ ಅಯಾನುಗಳ ಸಾಂದ್ರತೆಯು ಹೆಚ್ಚಾಗುತ್ತದೆ. ಅಂತಹ ಬದಲಾವಣೆಗಳು, ಪ್ರತಿಯಾಗಿ, ಅಭಿವೃದ್ಧಿಯನ್ನು ಪ್ರಚೋದಿಸುತ್ತವೆ ಅಂತಿಮ ಫಲಿತಾಂಶಪ್ರಾಣಿಯ ಸಾವಿಗೆ ಕಾರಣವಾಗುತ್ತದೆ. ಆಲ್ಕಲೋಸಿಸ್ನೊಂದಿಗೆ, ರಕ್ತದಲ್ಲಿನ ಕ್ಯಾಟಯಾನುಗಳ ಸಾಂದ್ರತೆಯು ಹೆಚ್ಚಾಗುತ್ತದೆ, ಇದು ಟೆಟನಸ್ ಮತ್ತು ಪ್ರಾಣಿಗಳ ಸಾವಿಗೆ ಕಾರಣವಾಗುತ್ತದೆ.
H2O ನೊಂದಿಗೆ CO2 ನ ಪ್ರತಿಕ್ರಿಯೆಯ ಸಮಯದಲ್ಲಿ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲವು ರೂಪುಗೊಳ್ಳುತ್ತದೆ. ಪ್ರಾಚೀನ ಜಗತ್ತಿನಲ್ಲಿ ಸಸ್ಯವರ್ಗದ ನಂಬಲಾಗದ ಬೆಳವಣಿಗೆಯು ವಾತಾವರಣದಲ್ಲಿ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲದ ಗಮನಾರ್ಹ ಸಾಂದ್ರತೆಯೊಂದಿಗೆ ಸಂಬಂಧಿಸಿದೆ ಎಂದು ಹೆಚ್ಚಿನ ಸಂಶೋಧಕರು ನಂಬುತ್ತಾರೆ. ವಾತಾವರಣದಲ್ಲಿ ಹೆಚ್ಚಿದ (5-10%) ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲದ ಸಾಂದ್ರತೆಯೊಂದಿಗೆ ಬೆಳೆದ ಸಸ್ಯಗಳಲ್ಲಿ ಅತ್ಯಂತ ತೀವ್ರವಾದ ಬೆಳವಣಿಗೆಯನ್ನು ಗಮನಿಸಲಾಗಿದೆ.
ಸಸ್ಯಗಳು ಅರ್ಧ ಕಾರ್ಬನ್ ಎಂದು ಗಮನಿಸಬೇಕು. ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲವು ಸಸ್ಯವನ್ನು ಪೋಷಿಸುತ್ತದೆ, ಆದರೆ ಮಣ್ಣಿನ ಖನಿಜ ಘಟಕಗಳ ಕರಗುವಿಕೆಯನ್ನು ಉತ್ತೇಜಿಸುತ್ತದೆ. ಆದ್ದರಿಂದ ರಲ್ಲಿ ಈ ವಿಷಯದಲ್ಲಿಈ ಅಗತ್ಯ ಘಟಕಮಣ್ಣು. ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲವು ನೈಟ್ರಿಫೈಯಿಂಗ್ ಸೂಕ್ಷ್ಮಾಣುಜೀವಿಗಳನ್ನು ಪ್ರತಿಬಂಧಿಸುತ್ತದೆಯಾದ್ದರಿಂದ, ಮಣ್ಣು ಅದರ ಕನಿಷ್ಠ ಸಾಂದ್ರತೆಯನ್ನು ಹೊಂದಿರಬೇಕು.
ಆದ್ದರಿಂದ, ಹೆಚ್ಚಿನ ಇಳುವರಿಯನ್ನು ಪಡೆಯಲು, ಈ ಆಮ್ಲದ ಸಾಂದ್ರತೆಯನ್ನು ಸಮತೋಲನಗೊಳಿಸುವುದು ಅವಶ್ಯಕ. ಮಣ್ಣಿಗೆ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲ (400 cm3) ಮತ್ತು ಗಾಳಿ (1200 cm3) ದೈನಂದಿನ ಪರಿಚಯದೊಂದಿಗೆ, ಈ ಸಂಯುಕ್ತಗಳನ್ನು ಹೊಂದಿರದ ಮಣ್ಣಿಗೆ ಹೋಲಿಸಿದರೆ ಇದು ಎರಡು ಪಟ್ಟು ಹೆಚ್ಚು ಸಸ್ಯಗಳನ್ನು ಉತ್ಪಾದಿಸುತ್ತದೆ ಎಂದು ವಿಜ್ಞಾನಿಗಳು ತಮ್ಮ ಪ್ರಯೋಗಗಳಲ್ಲಿ ಸ್ಥಾಪಿಸಿದ್ದಾರೆ.
ಗ್ರಾಮೀಣ ಮಣ್ಣು ಗಾಳಿಯ ಸಮೃದ್ಧತೆಯಿಂದ ನಿರೂಪಿಸಲ್ಪಟ್ಟಿದೆ, ಆದ್ದರಿಂದ ನೈಟ್ರಿಫಿಕೇಶನ್ ಮತ್ತು ಕೊಳೆಯುವಿಕೆಯ ಪ್ರಕ್ರಿಯೆಗಳು ಬಹಳ ತೀವ್ರವಾಗಿ ನಡೆಯುತ್ತವೆ. ಕಾಡಿನಲ್ಲಿರುವ ಎಲೆಗಳು ಒಂದು ವರ್ಷದೊಳಗೆ ಸಂಪೂರ್ಣವಾಗಿ ಕೊಳೆಯುತ್ತವೆ ಎಂದು ಸ್ಥಾಪಿಸಲಾಗಿದೆ. ಅಂತಹ ಹುರುಪಿನ ನೈಟ್ರಿಫಿಕೇಶನ್ ಸ್ಟೆಪ್ಪೆಸ್ನಲ್ಲಿಯೂ ಸಂಭವಿಸುತ್ತದೆ. ವಿಭಜನೆಯ ಪ್ರಕ್ರಿಯೆಯಲ್ಲಿ, ಗಮನಾರ್ಹ ಪ್ರಮಾಣದ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲ ಬಿಡುಗಡೆಯಾಗುತ್ತದೆ. ಎರಡನೆಯದು ಗಾಳಿಗಿಂತ ಒಂದೂವರೆ ಪಟ್ಟು ಭಾರವಾಗಿರುತ್ತದೆ, ಆದ್ದರಿಂದ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲವು ಗಾಳಿಗಿಂತ ಮಣ್ಣಿನಲ್ಲಿ ಆಳವಾಗಿ ತೂರಿಕೊಳ್ಳುತ್ತದೆ ಮತ್ತು ಅಲ್ಲಿ ಪರಿಣಾಮ ಬೀರುತ್ತದೆ. ಪ್ರಯೋಜನಕಾರಿ ಪ್ರಭಾವಖನಿಜ ಘಟಕಗಳ ಮೇಲೆ.
ಆಳವಾದ ಉಳುಮೆಯೊಂದಿಗೆ, ಸಾವಯವ ಅವಶೇಷಗಳು ಮಣ್ಣಿನ ಆಳವಾದ ಪದರಗಳಲ್ಲಿ ಬೀಳುತ್ತವೆ, ಅಲ್ಲಿ O2 ಇಲ್ಲ, ಆದರೆ ಕಾರ್ಬೊನಿಕ್ ಆಮ್ಲದ ಸಮೃದ್ಧವಾಗಿದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ನೈಟ್ರಿಫಿಕೇಶನ್ ಅತ್ಯಂತ ನಿಧಾನವಾಗಿ ಸಂಭವಿಸುತ್ತದೆ. ಈ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ, ಖನಿಜ ಘಟಕಗಳು ಕೊಳೆಯುವುದಿಲ್ಲ ಮತ್ತು ಸಾರಜನಕ ಸಂಯುಕ್ತಗಳು ರೂಪುಗೊಳ್ಳುವುದಿಲ್ಲ. ಗೊಬ್ಬರದ ಬೃಹತ್ ತುಂಡುಗಳು ಕೊಳೆಯದೆ ವರ್ಷಗಳವರೆಗೆ ನೆಲದಲ್ಲಿ ಬಿದ್ದಿವೆ. ಭೂಮಾಲೀಕರು ಕೃತಕ ರಸಗೊಬ್ಬರಗಳನ್ನು ಖರೀದಿಸಲು ಒತ್ತಾಯಿಸಲಾಗುತ್ತದೆ (ಕೈನೈಟ್, ಸೂಪರ್ಫಾಸ್ಫೇಟ್, ನವೀನ ತಂತ್ರಜ್ಞಾನಗಳುಬೇಸಾಯದಿಂದ ಸಸ್ಯ ಉತ್ಪಾದಕತೆಯನ್ನು ಹೆಚ್ಚಿಸಬಹುದು. ಇದು ಪ್ರಾಥಮಿಕವಾಗಿ ಭೂಮಿಯನ್ನು ಬೆಳೆಸುವ ಪ್ರಕ್ರಿಯೆಯಲ್ಲಿ ಸಾವಯವ ಅವಶೇಷಗಳು ಉಳಿಯುತ್ತದೆ ಎಂಬ ಅಂಶದಿಂದಾಗಿ. ರಚಿಸಲಾಗುತ್ತಿದೆ ಸೂಕ್ತ ಪರಿಸ್ಥಿತಿಗಳುನೈಟ್ರಿಫೈಯಿಂಗ್ ಸೂಕ್ಷ್ಮಜೀವಿಗಳ ಅಭಿವೃದ್ಧಿ ಮತ್ತು ಸಂತಾನೋತ್ಪತ್ತಿಗಾಗಿ.
ಮಣ್ಣಿನಲ್ಲಿರುವ ರಂಜಕವು ಯಾವಾಗಲೂ ಸಸ್ಯಗಳಿಂದ ಹೀರಲ್ಪಡುವುದಿಲ್ಲ. ಟ್ರೈಬಾಸಿಕ್ ಕ್ಯಾಲ್ಸಿಯಂ ಫಾಸ್ಫೇಟ್ ಮಿತವಾಗಿ ಕರಗುವ ಸಂಯುಕ್ತವಾಗಿದೆ. ಆದ್ದರಿಂದ, ಫಾಸ್ಪರಿಕ್ ಆಮ್ಲ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಸಮೃದ್ಧವಾಗಿರುವ ಮಣ್ಣು ಬಂಜೆತನವಾಗುತ್ತದೆ.
