ទំនាក់ទំនងរវាងការដាក់ធាតុនៅក្នុងតារាងតាមកាលកំណត់ និងលក្ខណៈសម្បត្តិនៃធាតុគីមី សារធាតុសាមញ្ញ, សមាសធាតុនៃធាតុដែលមានអ៊ីដ្រូសែននិងអុកស៊ីសែន។ គំនិតនៃកាំអាតូម និងអេឡិចត្រូនិនៃធាតុ
ចូរយើងពិចារណាពីទំនាក់ទំនងរវាងទីតាំងនៃធាតុនៅក្នុងតារាងតាមកាលកំណត់ និងលក្ខណៈសម្បត្តិនៃធាតុគីមីដូចជាកាំអាតូម ធាតុអេឡិចត្រូនិ លក្ខណៈលោហធាតុ និងមិនមែនលោហធាតុ។
កាំអាតូម គឺជាតម្លៃដែលបង្ហាញពីទំហំនៃសែលអេឡិចត្រុងនៃអាតូមមួយ។ នេះគឺជាបរិមាណដ៏សំខាន់ដែលលក្ខណៈសម្បត្តិនៃអាតូមនៃធាតុគីមីអាស្រ័យ។ នៅក្នុងក្រុមរងសំខាន់ៗនៅពេលដែលបន្ទុកនៃស្នូលអាតូមកើនឡើងចំនួននៃ កម្រិតអេឡិចត្រូនិចដូច្នេះ កាំអាតូមកើនឡើងជាមួយនឹងការកើនឡើងចំនួនអាតូមនៅក្នុងក្រុមរងសំខាន់ៗ។ ក្នុងអំឡុងពេលមានការកើនឡើងនៃបន្ទុកនៃស្នូលអាតូមិច ធាតុគីមីដែលនាំឱ្យមានការទាក់ទាញកាន់តែខ្លាំងនៃអេឡិចត្រុងខាងក្រៅទៅកាន់ស្នូល។ លើសពីនេះទៀតនៅពេលដែលបន្ទុកនៃស្នូលកើនឡើងចំនួនអេឡិចត្រុងកើនឡើងដោយ កម្រិតខាងក្រៅទោះយ៉ាងណាក៏ដោយចំនួននៃកម្រិតអេឡិចត្រូនិចមិនកើនឡើងទេ។ ភាពទៀងទាត់ទាំងនេះនាំឱ្យមានការរឹតបន្តឹងនៃសែលអេឡិចត្រុងជុំវិញស្នូល។ ដូច្នេះកាំអាតូមថយចុះជាមួយនឹងការកើនឡើងចំនួនអាតូមក្នុងកំឡុងពេល។
ជាឧទាហរណ៍ អនុញ្ញាតឱ្យយើងរៀបចំធាតុគីមី O (អុកស៊ីសែន), C (កាបូន), Li (លីចូម), F (ហ្វ្លុយអូរី), N (អាសូត) ក្នុងលំដាប់កាត់បន្ថយរ៉ាឌីអាតូមិច។ ធាតុគីមីដែលបានផ្តល់ឱ្យគឺស្ថិតនៅក្នុងដំណាក់កាលទីពីរ។ ក្នុងរយៈពេលមួយ កាំអាតូមិកថយចុះ ជាមួយនឹងចំនួនអាតូមិកកើនឡើង។ ដូច្នេះ ធាតុគីមីដែលបានចង្អុលបង្ហាញត្រូវតែសរសេរតាមលំដាប់លំដោយនៃលេខសៀរៀលរបស់វា៖ Li, C, N, O, F (លីចូម កាបូន អាសូត អុកស៊ីហ្សែន ហ្វ្លុយអូរីន)
Electronegativity គឺជាសមត្ថភាពរបស់អាតូមនៅក្នុងសមាសធាតុដើម្បីទាក់ទាញ valence electrons ពោលគឺឧ។ អេឡិចត្រុងទាំងនោះដោយមានជំនួយពីចំណងគីមីត្រូវបានបង្កើតឡើងរវាងអាតូម។ Electronegativity អាស្រ័យលើសមត្ថភាពរបស់ស្នូលអាតូមក្នុងការទាក់ទាញអេឡិចត្រុងពីខាងក្រៅ កម្រិតថាមពល. ភាពទាក់ទាញកាន់តែខ្លាំង ភាពទាក់ទាញកាន់តែខ្លាំង។ កាំអាតូមតូចជាង កម្លាំងទាក់ទាញរវាងអេឡិចត្រុងនៃកម្រិតថាមពលខាងក្រៅកាន់តែធំ។ អាស្រ័យហេតុនេះ ការផ្លាស់ប្តូរនៃ electronegativity ក្នុងសម័យកាល និងក្រុមរងសំខាន់ៗនឹងផ្ទុយពីការផ្លាស់ប្តូរនៃរ៉ាឌីអាតូមិច។ ដូច្នេះនៅក្នុងក្រុមរងសំខាន់ៗ អេឡិចត្រូនិមានការថយចុះជាមួយនឹងចំនួនអាតូមិកកើនឡើង។ នៅក្នុងរយៈពេលដែលមានចំនួនអាតូមកើនឡើង ភាពធន់នឹងអេឡិចត្រុងកើនឡើង។
ជាឧទាហរណ៍ អនុញ្ញាតឱ្យយើងរៀបចំធាតុគីមី Br (Bromine), F (fluorine), I (Iodine), Cl (Chlorine) ក្នុងលំដាប់បង្កើន electronegativity ។ ធាតុគីមីដែលបានផ្តល់ឱ្យគឺនៅក្នុង ក្រុមរងសំខាន់ក្រុមទីប្រាំពីរ។ នៅក្នុងក្រុមរងសំខាន់ៗ អេឡិចត្រូនិមានការថយចុះជាមួយនឹងចំនួនអាតូមិកកើនឡើង។ ដូច្នេះធាតុគីមីដែលបានបង្ហាញត្រូវតែសរសេរតាមលំដាប់លេខរៀងដែលមានការថយចុះ៖ I, Br, Cl, F (Iodine, Bromine, Chlorine, fluorine)។
លក្ខណៈសម្បត្តិលោហធាតុគឺជាលក្ខណៈសម្បត្តិនៃអាតូមនៃធាតុគីមីដើម្បីបោះបង់ចោលអេឡិចត្រុង។ ធាតុគីមីដែលបង្ហាញពីលក្ខណៈសម្បត្តិលោហធាតុ ជាធម្មតាមានអេឡិចត្រុងពីមួយទៅបីនៅក្នុងសំបកខាងក្រៅរបស់វា។ លក្ខណៈសម្បត្តិមិនមែនលោហធាតុគឺជាលក្ខណៈសម្បត្តិនៃអាតូមនៃធាតុគីមីដើម្បីទទួលយកអេឡិចត្រុង។ ធាតុគីមីដែលបង្ហាញពីលក្ខណៈសម្បត្តិមិនមែនលោហធាតុ ជាធម្មតាមានអេឡិចត្រុងពីបួនទៅប្រាំបីនៅក្នុងសំបកខាងក្រៅរបស់វា។ អេឡិចត្រុងត្រូវបានបោះបង់ចោលយ៉ាងងាយស្រួលពីកម្រិតថាមពលខាងក្រៅ លក្ខណៈសម្បត្តិលោហធាតុកាន់តែធំ ហើយតាមនោះ លក្ខណៈសម្បត្តិដែលមិនមែនជាលោហធាតុកាន់តែតិច។ វាកាន់តែងាយស្រួលក្នុងការបោះបង់ចោលអេឡិចត្រុងពីកម្រិតថាមពលខាងក្រៅ កាំអាតូមកាន់តែធំ ដោយសារតែកម្លាំងនៃការទាក់ទាញរវាងស្នូល និងអេឡិចត្រុងថយចុះ ជាមួយនឹងការកើនឡើងចម្ងាយរវាងពួកវា។ អាស្រ័យហេតុនេះ ការផ្លាស់ប្តូរលក្ខណៈលោហធាតុនៃធាតុគីមីនឹងស្រដៀងទៅនឹងការផ្លាស់ប្តូរនៃកាំអាតូមិក។ ដូច្នេះនៅក្នុងក្រុមរងសំខាន់ៗ លក្ខណៈសម្បត្តិលោហធាតុកើនឡើងជាមួយនឹងការកើនឡើងចំនួនសៀរៀល ហើយនៅក្នុងរយៈពេលដែលមានចំនួនសៀរៀលកើនឡើង លក្ខណៈសម្បត្តិលោហធាតុមានការថយចុះ។ ផ្ទុយទៅវិញ លក្ខណៈសម្បត្តិដែលមិនមែនជាលោហធាតុ នៅក្នុងក្រុមរងសំខាន់ៗមានការថយចុះជាមួយនឹងការកើនឡើងចំនួនសៀរៀល ហើយក្នុងរយៈពេលដែលមានចំនួនសៀរៀលកើនឡើង ពួកគេកើនឡើង។
ជាឧទាហរណ៍ អនុញ្ញាតឱ្យយើងរៀបចំធាតុគីមី Al, S, Mg, Cl, Na ក្នុងលំដាប់នៃការកើនឡើងនូវលក្ខណៈសម្បត្តិមិនមែនលោហធាតុ។ ធាតុគីមីដែលបានផ្តល់ឱ្យគឺស្ថិតនៅក្នុងដំណាក់កាលទីបី។ នៅក្នុងរយៈពេល លក្ខណៈសម្បត្តិមិនមែនលោហធាតុកើនឡើងជាមួយនឹងចំនួនអាតូមិកកើនឡើង។ ដូច្នេះ ធាតុគីមីដែលបានចង្អុលបង្ហាញត្រូវតែសរសេរតាមលំដាប់លំដោយនៃលេខសៀរៀលរបស់វា៖ Na, Mg, Al, S, Cl ចូរយើងពិចារណាពីទំនាក់ទំនងរវាងទីតាំងនៃធាតុគីមីនៅក្នុងតារាងតាមកាលកំណត់ និងលក្ខណៈសម្បត្តិនៃអុកស៊ីដ និងអ៊ីដ្រូសែនដែលត្រូវគ្នា។ ដែលបង្កើតជាធាតុគីមីទាំងនេះ ដោយប្រើធាតុនៃសម័យកាលទីបីជាឧទាហរណ៍។ រយៈពេលទីបីរួមមានធាតុគីមី: Na, Mg, Al, Si, P, S, Cl, Ar
ធាតុទាំងនេះបង្កើតជាអុកស៊ីដខ្ពស់នៃសមាសធាតុដូចខាងក្រោម (ធាតុគីមីអសកម្ម Argon មិនបង្កើតជាអុកស៊ីតទេ): Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7 ។
សូដ្យូមអុកស៊ីដនិងម៉ាញ៉េស្យូមអុកស៊ីតបង្ហាញលក្ខណៈសម្បត្តិ អុកស៊ីដមូលដ្ឋាន, អុកស៊ីដអាលុយមីញ៉ូមគឺជាអុកស៊ីដ amphoteric, អុកស៊ីដទាំងអស់ (ស៊ីលីកុន (IV) អុកស៊ីដ, ផូស្វ័រ (V) អុកស៊ីដ, ស្ពាន់ធ័រ (VI) អុកស៊ីដ, ក្លរីន (VII) អុកស៊ីដ) បង្ហាញពីលក្ខណៈសម្បត្តិនៃអុកស៊ីដអាស៊ីត។ លើសពីនេះទៀតនៅក្នុងស៊េរី Na2O - MgO លក្ខណៈសម្បត្តិមូលដ្ឋានចុះខ្សោយហើយនៅក្នុងស៊េរី SiO2 - P2O5 - SO3 - Cl2O7 ។ លក្ខណៈសម្បត្តិអាស៊ីតកំពុងកាន់តែខ្លាំង។
វាក៏អាចធ្វើទៅបានដើម្បីវិភាគលក្ខណៈនៃការផ្លាស់ប្តូរនៅក្នុងលក្ខណៈសម្បត្តិនៃ hydroxides ក្នុងអំឡុងពេលដែលត្រូវគ្នាទៅនឹង អុកស៊ីដខ្ពស់ជាង៖ NaOH, Mg (OH)2, Al (OH)3, H2SiO3, H3PO4, H2SO4, HClO4 ។
សូដ្យូម អ៊ីដ្រូស៊ីត និងម៉ាញ៉េស្យូម អ៊ីដ្រូស៊ីត បង្ហាញលក្ខណៈសម្បត្តិនៃមូលដ្ឋាន, អ៊ីដ្រូអុកស៊ីតអាលុយមីញ៉ូម amphoteric hydroxideអ៊ីដ្រូសែនផ្សេងទៀតទាំងអស់បង្ហាញពីលក្ខណៈសម្បត្តិរបស់អាស៊ីត៖ អាស៊ីតស៊ីលីត អាស៊ីតអ័រធូផូស្វាត។ អាស៊ីតស៊ុលហ្វួរី, អាស៊ីត chloric ។ លើសពីនេះទៀតនៅក្នុងស៊េរី NaOH - Mg (OH)2 លក្ខណៈសម្បត្តិមូលដ្ឋានចុះខ្សោយហើយនៅក្នុងស៊េរី H2SiO3 - H3PO4 - H2SO4 - HClO4 លក្ខណៈសម្បត្តិអាស៊ីតកើនឡើង។
ដូច្នេះនៅក្នុងស៊េរីនៃធាតុមួយចំនួន លក្ខណៈសម្បត្តិនៃអុកស៊ីដមូលដ្ឋាន និងអ៊ីដ្រូសែនដែលត្រូវគ្នារបស់វាត្រូវបានចុះខ្សោយ ហើយលក្ខណៈសម្បត្តិអាស៊ីតក្នុងទិសដៅដូចគ្នាត្រូវបានពង្រឹង។ ការផ្លាស់ប្តូរពីមូលដ្ឋានទៅ អុកស៊ីដអាស៊ីតហើយអាស្រ័យហេតុនេះ ពីមូលដ្ឋានទៅអាស៊ីតត្រូវបានអនុវត្តក្នុងកំឡុងពេលមួយដោយសារអុកស៊ីដ amphoteric ឬ hydroxide ។ គំរូនេះមានសុពលភាពសម្រាប់រយៈពេលទីពីរ និងទីបី តារាងតាមកាលកំណត់. សម្រាប់ធាតុនៃរយៈពេលយូរ, លំនាំស្មុគស្មាញត្រូវបានអង្កេត។
នៅក្រោម កាំ អាតូមសំដៅទៅលើចំងាយរវាងស្នូលនៃវត្ថុដែលបានផ្តល់ឱ្យ អាតូមនិងគន្លងអេឡិចត្រុងឆ្ងាយបំផុតរបស់វា។ សព្វថ្ងៃនេះ ឯកតារង្វាស់ដែលទទួលយកជាទូទៅសម្រាប់កាំអាតូមគឺ picometer (pm)។ កំណត់កាំ អាតូមងាយស្រួលណាស់។
អ្នកនឹងត្រូវការ
- តារាងតាមកាលកំណត់របស់ Mendeleev
សេចក្តីណែនាំ
ជាដំបូង អ្នកគួរតែមានតារាងតាមកាលកំណត់ធម្មតានៅក្នុងដៃ ដែលអ្វីៗត្រូវបានរៀបចំតាមលំដាប់លំដោយ ស្គាល់មនុស្សជាតិធាតុគីមី។ វាងាយស្រួលណាស់ក្នុងការស្វែងរកតារាងនេះនៅក្នុងសៀវភៅយោងគីមីវិទ្យាណាមួយ សៀវភៅសិក្សាសាលាឬវាអាចត្រូវបានទិញដោយឡែកនៅបណ្ណាគារក្នុងស្រុករបស់អ្នក។
នៅខាងស្តាំ ជ្រុងកំពូលធាតុគីមីនីមួយៗមានរបស់វា។ លេខសម្គាល់. លេខនេះស្របគ្នាទាំងស្រុងជាមួយនឹងលេខអាតូមិច កាំបានផ្តល់ឱ្យ អាតូម.
ឧទាហរណ៍ លេខអាតូមនៃក្លរីន (Cl) គឺ 17។ មានន័យថា ចម្ងាយពីស្នូល អាតូមក្លរីនទៅគន្លងឆ្ងាយបំផុតរបស់វា ចលនានៃអេឡិចត្រុងមានស្ថេរភាពគឺម៉ោង 17 យប់។ ប្រសិនបើអ្នកត្រូវការស្វែងរកមិនត្រឹមតែកាំអាតូមប៉ុណ្ណោះទេប៉ុន្តែថែមទាំងការបែងចែកអេឡិចត្រុងផងដែរ។ គន្លងអេឡិចត្រុងបន្ទាប់មកទិន្នន័យនេះអាចត្រូវបានសង្កត់ធ្ងន់ពីជួរឈរនៃលេខដែលមានទីតាំងនៅខាងស្តាំនៃឈ្មោះធាតុគីមី។
រចនាសម្ព័ន្ធនៃភពផែនដីត្រូវបានបែងចែកទៅជាស្នូល អាវធំ និងសំបក។ ស្នូល - ផ្នែកកណ្តាលដែលមានទីតាំងស្ថិតនៅឆ្ងាយបំផុតពីផ្ទៃ។ អាវទ្រនាប់មានទីតាំងនៅខាងក្រោមសំបកនិងខាងលើ ខឺណែល. ទីបំផុត Cortex គឺជាផ្នែកខាងក្រៅ សំបករឹងភព។

សេចក្តីណែនាំ
មួយក្នុងចំណោមអ្នកដំបូងដែលណែនាំពីអត្ថិភាព ខឺណែលអ្នកគីមីវិទ្យា និងរូបវិទ្យាជនជាតិអង់គ្លេស Henry Cavendish នៅសតវត្សទី 18 ។ គាត់បានគ្រប់គ្រងដើម្បីគណនាម៉ាស់និង ដង់ស៊ីតេមធ្យមផែនដី។ គាត់បានប្រៀបធៀបដង់ស៊ីតេនៃផែនដីជាមួយនឹងដង់ស៊ីតេនៃថ្មនៅលើផ្ទៃ។ វាត្រូវបានគេរកឃើញថា ដង់ស៊ីតេផ្ទៃទាបជាងមធ្យមភាគយ៉ាងសំខាន់។
អ្នកជំនាញខាងរញ្ជួយដីអាល្លឺម៉ង់ E. Wichert បានបង្ហាញអំពីអត្ថិភាព ខឺណែលដីនៅឆ្នាំ 1897 ។ ភូគព្ភវិទូអាមេរិក B. Guttenberg ក្នុងឆ្នាំ 1910 បានកំណត់ជម្រៅនៃផែនដី ខឺណែល- ២៩០០ គីឡូម៉ែត្រ។ យោងតាមអ្នកវិទ្យាសាស្ត្រ ស្នូលមានជាតិនីកែល និងធាតុផ្សេងទៀតដែលមានទំនាក់ទំនងនឹងជាតិដែក៖ មាស កាបូន cobalt germanium និងផ្សេងទៀត។
មធ្យម កាំ ខឺណែលគឺ 3500 គីឡូម៉ែត្រ។ លើសពីនេះទៀតនៅក្នុងអាគារ ខឺណែលផែនដីបញ្ចេញរឹង ស្នូលខាងក្នុង, មាន កាំប្រហែល 1300 គីឡូម៉ែត្រ និងរាវខាងក្រៅ កាំ ohm ប្រហែល 2200 គីឡូម៉ែត្រ។ នៅកណ្តាល ខឺណែលសីតុណ្ហភាពឡើងដល់ ៥០០០ អង្សាសេ។ អភិបូជា ខឺណែលប៉ាន់ស្មានប្រហែល 2 10^24 គីឡូក្រាម។
ភាពស្រដៀងគ្នាអាចត្រូវបានគូររវាងរចនាសម្ព័ន្ធនៃភព និងរចនាសម្ព័ន្ធនៃអាតូម។ អាតូមក៏មានផ្នែកកណ្តាលដែរ គឺស្នូល ដោយមានម៉ាសប្រមូលផ្តុំនៅក្នុងស្នូល។ វិមាត្រ នុយក្លេអ៊ែរអាតូមិចបង្កើត femtometers ជាច្រើន (ពីឡាតាំង femto - 15) ។ បុព្វបទ "femto" មានន័យថាគុណនឹងដប់ទៅដកដប់ប្រាំអំណាច។ ដូច្នេះ ស្នូលនៃអាតូមមួយគឺតូចជាងអាតូមខ្លួនឯង ១០ ពាន់ដង និង ១០ ^ ២១ ដង។ ទំហំតូចជាង ខឺណែលផែនដី។
ដើម្បីវាយតម្លៃ កាំភព, ប្រើវិធីសាស្រ្តភូគព្ភសាស្ត្រនិងភូមិសាស្ត្រដោយប្រយោល។ ក្នុងករណីអាតូម ការបំបែកនៃស្នូលធ្ងន់ត្រូវបានវិភាគ ដោយគិតគូរពីធរណីមាត្រមិនច្រើនទេ។ កាំ, ប៉ុន្មាន កាំសកម្មភាព កម្លាំងនុយក្លេអ៊ែរ. គំនិតនៃរចនាសម្ព័ន្ធភពនៃអាតូមត្រូវបានដាក់ទៅមុខដោយ Rutherford ។ ការពឹងផ្អែកដ៏ធំ ខឺណែលពី កាំប៉ុន្តែមិនមែនជាលីនេអ៊ែរទេ។
ចំណាំ
សូមអរគុណដល់តារាងតាមកាលកំណត់វាងាយស្រួលណាស់ក្នុងការស្វែងរកមិនត្រឹមតែកាំអាតូមប៉ុណ្ណោះទេប៉ុន្តែក៏មានផងដែរ។ ម៉ាស់អាតូម, ទម្ងន់ម៉ូលេគុល, រយៈពេល និងស៊េរីនៃធាតុជាក់លាក់មួយ ក៏ដូចជាការចែកចាយអេឡិចត្រុងនៅក្នុងគន្លងអេឡិចត្រុង រួមជាមួយនឹងចំនួនគន្លង។
គំរូអាតូមដែលពេញនិយមបំផុតគឺជាគំរូដែលត្រូវបានអនុម័តនៅឆ្នាំ 1913 ដោយ Niels Bohr ។ វាត្រូវបានគេស្គាល់ផងដែរថាជាគំរូភព។ នេះគឺដោយសារតែការពិតដែលថាអេឡិចត្រុងដូចជាភព ប្រព័ន្ធព្រះអាទិត្យផ្លាស់ទីជុំវិញព្រះអាទិត្យ - ស្នូលនៃអាតូមមួយ។ គន្លងនៃចលនាអេឡិចត្រុងគឺថេរ។ ការអភិវឌ្ឍនៃគំរូនេះបានផ្តល់នូវកម្លាំងរុញច្រានដល់ការអភិវឌ្ឍនៃទិសដៅថ្មីមួយនៅក្នុង រូបវិទ្យាទ្រឹស្តី - មេកានិចកង់ទិច.
កាំទីមួយនៃគន្លងនៃចលនាអេឡិចត្រុងត្រូវបានគេហៅថាកាំ Bohr ហើយថាមពលនៃអេឡិចត្រុងនៅក្នុងគន្លងទីមួយត្រូវបានគេហៅថាថាមពលអ៊ីយ៉ូដនៃអាតូម។
ដំបូន្មានមានប្រយោជន៍
គួរកត់សម្គាល់ថាកាំនៃអាតូមណាមួយគឺសមាមាត្រច្រាសទៅនឹងចំនួនប្រូតុងនៅក្នុងស្នូលរបស់វា ក៏ដូចជា ស្មើនឹងការគិតថ្លៃស្នូលរបស់វា។
ការកំណត់រ៉ាឌីអាតូមិកក៏បង្កបញ្ហាខ្លះដែរ។ទីមួយ អាតូមមិនមែនជាស្វ៊ែរដែលមានផ្ទៃ និងកាំដែលបានកំណត់យ៉ាងតឹងរ៉ឹងនោះទេ។ សូមចាំថា អាតូមគឺជាស្នូលដែលព័ទ្ធជុំវិញដោយពពកអេឡិចត្រុង។ ប្រូបាប៊ីលីតេនៃការរកឃើញអេឡិចត្រុងនៅពេលដែលវាផ្លាស់ទីឆ្ងាយពីស្នូលកើនឡើងបន្តិចម្តងៗដល់អតិបរមាជាក់លាក់មួយ ហើយបន្ទាប់មកថយចុះបន្តិចម្តងៗ ប៉ុន្តែក្លាយជា ស្មើនឹងសូន្យតែនៅចម្ងាយដ៏ធំគ្មានកំណត់។ ទីពីរ ប្រសិនបើយើងជ្រើសរើសលក្ខខណ្ឌមួយចំនួនសម្រាប់កំណត់កាំនោះ កាំបែបនេះនៅតែមិនអាចវាស់វែងដោយពិសោធន៍បានទេ។
ការពិសោធន៍អនុញ្ញាតឱ្យយើងកំណត់ត្រឹមតែចម្ងាយអន្តរនុយក្លេអ៊ែរ ម្យ៉ាងទៀត ប្រវែងចំណង (ហើយបន្ទាប់មកជាមួយការកក់ទុកមួយចំនួនដែលបានផ្តល់ឱ្យនៅក្នុងចំណងជើងទៅរូបភាព 2.21) ។ ដើម្បីកំណត់ពួកវា ការវិភាគការសាយភាយកាំរស្មីអ៊ិច ឬវិធីសាស្ត្របំភាយអេឡិចត្រុង (ផ្អែកលើការសាយភាយអេឡិចត្រុង) ត្រូវបានប្រើ។ កាំនៃអាតូមមួយត្រូវបានសន្មត់ថាជា ស្មើនឹងពាក់កណ្តាលចម្ងាយអន្តរនុយក្លេអ៊ែរតូចបំផុតរវាងអាតូមដូចគ្នា។
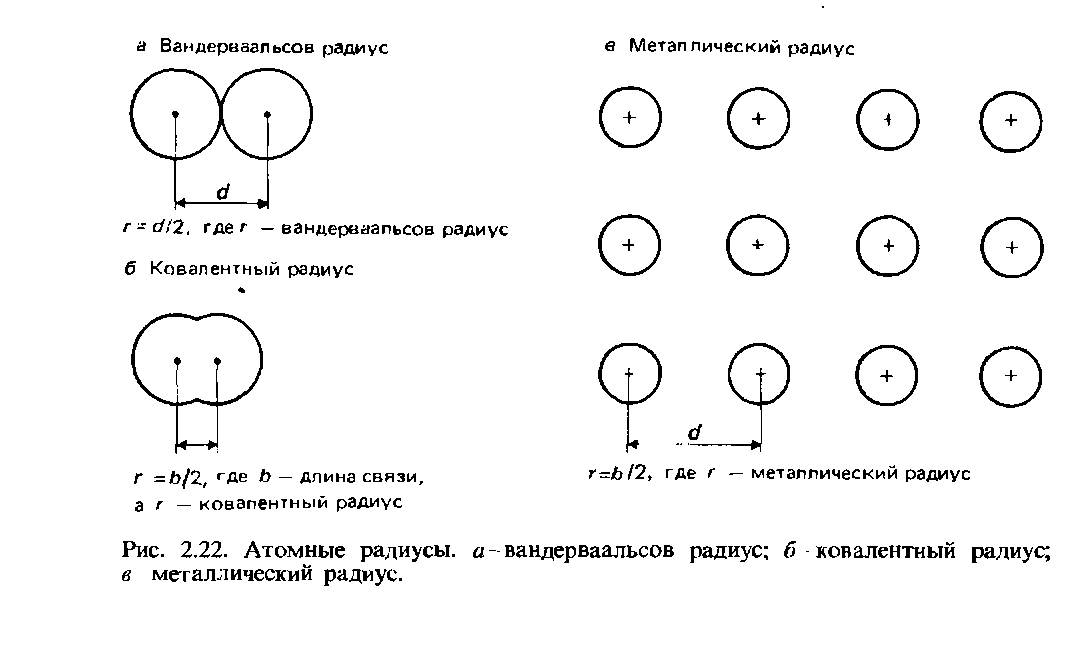
រ៉ាឌី Vander Waals. សម្រាប់អាតូមដែលមិនជាប់ចំណង ពាក់កណ្តាលនៃចម្ងាយអន្តរនុយក្លេអ៊ែរតូចបំផុតត្រូវបានគេហៅថា កាំវ៉ាន ដឺ វ៉ាល់។ និយមន័យនេះត្រូវបានបង្ហាញដោយរូបភព។ ២.២២.
អង្ករ។ ២.២១. ប្រវែងតំណភ្ជាប់។ ដោយសារម៉ូលេគុលញ័រជាបន្តបន្ទាប់ ចម្ងាយអន្តរនុយក្លេអ៊ែរ ឬប្រវែងចំណង មិនមានតម្លៃថេរទេ។ គំនូរនេះតំណាងឱ្យរំញ័រលីនេអ៊ែរនៃម៉ូលេគុលឌីអាតូមធម្មតា។ ការរំញ័រមិនអនុញ្ញាតឱ្យកំណត់ប្រវែងចំណងដោយសាមញ្ញថាជាចម្ងាយរវាងចំណុចកណ្តាលនៃអាតូមដែលជាប់ចំណងពីរនោះទេ។ ច្រើនទៀត និយមន័យច្បាស់លាស់មើលទៅដូចនេះ៖ ប្រវែងចំណង គឺជាចម្ងាយរវាងអាតូមដែលជាប់ចំណង វាស់រវាងចំណុចកណ្តាលនៃម៉ាស់អាតូមពីរ ហើយត្រូវគ្នាទៅនឹងថាមពលចំណងអប្បបរមា។ ថាមពលអប្បបរមាត្រូវបានបង្ហាញនៅលើខ្សែកោង Morse (សូមមើលរូប 2.1)។

តារាង 2.6 ។ ដង់ស៊ីតេនៃកាបូន និងស្ពាន់ធ័រ allotropes តារាង 2.7 ។ ប្រវែងនៃចំណងកាបូន - កាបូន
រ៉ាឌីកូវ៉ាឡេន។កាំ Covalent ត្រូវបានកំណត់ថាជាពាក់កណ្តាលនៃចម្ងាយអន្តរនុយក្លេអ៊ែរ (ប្រវែងចំណង) រវាងអាតូមដូចគ្នាបេះបិទពីរដែលភ្ជាប់គ្នាទៅវិញទៅមក។ សម្ព័ន្ធកូវ៉ាឡង់ (រូបភាព 2.22, ខ) ។ ជាឧទាហរណ៍ ចូរយើងយកម៉ូលេគុលក្លរីន Cl2 ដែលប្រវែងចំណងគឺ 0.1988 nm ។ កាំកូវ៉ាលេននៃក្លរីនត្រូវបានគេសន្មត់ថា 0.0944 nm ។
ដោយដឹងពីកាំ covalent នៃអាតូមនៃធាតុមួយ អ្នកអាចគណនាកាំ covalent នៃអាតូមនៃធាតុមួយទៀត។ ឧទាហរណ៍ដោយពិសោធន៍ កំណត់តម្លៃប្រវែងចំណង C-Cl ក្នុង CH3Cl គឺ 0.1767 nm ។ ការដកកាំ covalent នៃក្លរីន (0.0994 nm) ពីតម្លៃនេះ យើងឃើញថាកាំ covalent នៃកាបូនគឺ 0.0773 nm ។ វិធីសាស្រ្តគណនានេះគឺផ្អែកលើគោលការណ៍នៃការបន្ថែម ដែលយោងទៅតាមអាតូមិករ៉ាឌី គោរពតាម ច្បាប់សាមញ្ញបន្ថែម។ ដូច្នេះប្រវែងចំណង C-Cl គឺជាផលបូកនៃកាំ covalent នៃកាបូន និងក្លរីន។ គោលការណ៍នៃការបន្ថែមនេះអនុវត្តតែចំពោះចំណង covalent សាមញ្ញប៉ុណ្ណោះ។ ចំណងទ្វេរដង និងបីដងគឺខ្លីជាង (តារាង 2.7)។
ប្រវែងនៃចំណង covalent សាមញ្ញក៏អាស្រ័យលើបរិយាកាសរបស់វានៅក្នុងម៉ូលេគុលដែរ។ ឧទាហរណ៍ប្រវែង មូលបត្របំណុល C-Hប្រែប្រួលពី 0.1070 nm នៅអាតូមកាបូន trisubstituted ទៅ 0.115 nm នៅក្នុងបរិវេណ CH3CN ។
កាំដែក។ កាំលោហធាតុត្រូវបានគេសន្មត់ថាស្មើនឹងពាក់កណ្តាលនៃចម្ងាយអន្តរនុយក្លេអ៊ែររវាងអ៊ីយ៉ុងជិតខាងនៅក្នុង បន្ទះឈើគ្រីស្តាល់លោហៈ (រូបភាព 2.22, គ) ។ ពាក្យ កាំអាតូម ជាធម្មតាសំដៅលើកាំកូវ៉ាលេននៃអាតូមនៃធាតុមិនមែនលោហធាតុ និងពាក្យកាំលោហធាតុទៅអាតូមនៃធាតុលោហធាតុ។
វិទ្យុសកម្មអ៊ីយ៉ុង។ កាំអ៊ីយ៉ុងគឺជាផ្នែកមួយក្នុងចំណោមពីរផ្នែកនៃចម្ងាយអន្តរនុយក្លេអ៊ែររវាងអ៊ីយ៉ុង monoatomic (សាមញ្ញ) ដែលនៅជាប់គ្នានៅក្នុងសមាសធាតុអ៊ីយ៉ុងគ្រីស្តាល់ (អំបិល) ។ការកំណត់កាំអ៊ីយ៉ុងក៏មានបញ្ហាច្រើនដែរ ដោយសារចម្ងាយអន្តរកម្មត្រូវបានវាស់ដោយពិសោធន៍ មិនមែនកាំអ៊ីយ៉ុងខ្លួនឯងទេ។ ចម្ងាយរវាងអ៊ីយ៉ុងអាស្រ័យលើការវេចខ្ចប់អ៊ីយ៉ុងនៅក្នុងបន្ទះឈើគ្រីស្តាល់។ នៅក្នុងរូបភព។ 2.23 បង្ហាញបី វិធីដែលអាចធ្វើបានការវេចខ្ចប់អ៊ីយ៉ុងនៅក្នុងបន្ទះឈើគ្រីស្តាល់។ ជាអកុសល ការពិសោធន៍បានវាស់ចម្ងាយអន្តរកម្ម
អង្ករ។ ២.២៣. វិទ្យុសកម្មអ៊ីយ៉ុង, c-anions ប៉ះគ្នាទៅវិញទៅមក, ប៉ុន្តែ cations មិនប៉ះ anions; b-cations មានទំនាក់ទំនងជាមួយ anions ប៉ុន្តែ anions មិនទាក់ទងគ្នាទៅវិញទៅមក; ចូលទៅក្នុងការរៀបចំដែលទទួលយកតាមធម្មតានៃអ៊ីយ៉ុង ដែល cations មានទំនាក់ទំនងជាមួយ anions ហើយ anions មានទំនាក់ទំនងគ្នាទៅវិញទៅមក។ ចម្ងាយ A ត្រូវបានកំណត់ដោយពិសោធន៍។ វាត្រូវបានគេយកទៅជាពីរដងនៃកាំនៃ anion ។ នេះអនុញ្ញាតឱ្យយើងគណនាចម្ងាយ interionic b ដែលជាផលបូកនៃ radii នៃ anion និង cation ។ ដោយដឹងពីចម្ងាយអន្តរ b យើងអាចគណនាកាំនៃ cation ។
មិនអនុញ្ញាតឱ្យយើងវិនិច្ឆ័យថាតើវិធីសាស្រ្តវេចខ្ចប់ទាំងបីនេះមួយណាដែលត្រូវបានអនុវត្តយ៉ាងពិតប្រាកដនៅក្នុងនីមួយៗ ករណីជាក់លាក់. បញ្ហាគឺត្រូវស្វែងរកសមាមាត្រដែលត្រូវបែងចែកចម្ងាយអន្តរកម្មជាពីរផ្នែកដែលត្រូវគ្នានឹងរ៉ាឌីនៃអ៊ីយ៉ុងទាំងពីរ ម្យ៉ាងវិញទៀត ដើម្បីសម្រេចថាតើអ៊ីយ៉ុងមួយបញ្ចប់នៅទីណា និងកន្លែងដែលមួយទៀតចាប់ផ្តើម។ ដូចដែលបានបង្ហាញឧទាហរណ៍នៅក្នុងរូបភព។ 2.12 សំណួរនេះមិនអាចត្រូវបានដោះស្រាយសូម្បីតែដោយកាត ដង់ស៊ីតេអេឡិចត្រុងអំបិល ដើម្បីជម្នះភាពលំបាកនេះ ជាធម្មតាគេសន្មត់ថា 1) ចម្ងាយអន្តរកម្មគឺជាផលបូកនៃកាំអ៊ីយ៉ុងពីរ 2) អ៊ីយ៉ុងមានរាងស្វ៊ែរ និង 3) លំហនៅជាប់គ្នាមានទំនាក់ទំនងគ្នាទៅវិញទៅមក។ ការសន្មត់ចុងក្រោយត្រូវគ្នាទៅនឹងវិធីសាស្ត្រវេចខ្ចប់អ៊ីយ៉ុងដែលបង្ហាញក្នុងរូប។ 2.23, f ប្រសិនបើកាំអ៊ីយ៉ុងមួយត្រូវបានគេស្គាល់ រ៉ាឌីអ៊ីយ៉ុងផ្សេងទៀតអាចត្រូវបានគណនាដោយផ្អែកលើគោលការណ៍នៃការបន្ថែម។
កាំដែលត្រូវគ្នា។ ប្រភេទផ្សេងៗ. នៅក្នុងតារាង 2.8 បង្ហាញតម្លៃនៃរ៉ាឌីនៃប្រភេទផ្សេងៗសម្រាប់ធាតុបីនៃដំណាក់កាលទី 3 ។ វាងាយមើលឃើញថាច្រើនបំផុត តម្លៃធំជាកម្មសិទ្ធិរបស់ anionic និង van der Waals radii ។នៅក្នុងរូបភព។ 11.9 ប្រៀបធៀបទំហំនៃអ៊ីយ៉ុង និងអាតូមសម្រាប់ធាតុទាំងអស់នៃដំណាក់កាលទី 3 លើកលែងតែ argon ។ ទំហំនៃអាតូមត្រូវបានកំណត់ដោយកាំ covalent របស់វា។ គួរកត់សំគាល់ថា cations មានទំហំតូចជាងអាតូម ហើយ anions គឺ ទំហំធំជាងអាតូមនៃធាតុដូចគ្នា។ សម្រាប់ធាតុនីមួយៗពីគ្រប់ប្រភេទនៃរ៉ាឌី តម្លៃតូចបំផុត។តែងតែជាកម្មសិទ្ធិរបស់កាំ cation ។
តារាង 2.8 ។ ការប្រៀបធៀបកាំអាតូមនៃប្រភេទផ្សេងៗគ្នា


ការប្តេជ្ញាចិត្តសាកល្បង។ដើម្បីកំណត់រូបរាងនៃម៉ូលេគុលសាមញ្ញ និងអ៊ីយ៉ុងប៉ូលីអាតូមិច ឬកាន់តែច្បាស់លាស់ ប្រវែងចំណង និងមុំចំណង (មុំរវាងចំណង) ភាពខុសគ្នានៃ វិធីសាស្រ្តពិសោធន៍. ទាំងនេះរួមបញ្ចូលទាំងមីក្រូវ៉េវ spectroscopy ក៏ដូចជាវិធីសាស្រ្តសម្រាប់សិក្សាការឌីផេរ៉ង់ស្យែល កាំរស្មីអ៊ិច(ការសាយភាយកាំរស្មីអ៊ិច) នឺត្រុង (ការបំភាយនឺត្រុង) ឬអេឡិចត្រុង (ការបំភាយអេឡិចត្រុង) ។ ជំពូកបន្ទាប់រៀបរាប់លម្អិតអំពីរបៀបដែលកាំរស្មី X-ray diffraction អាចត្រូវបានប្រើដើម្បីកំណត់ រចនាសម្ព័ន្ធគ្រីស្តាល់. ទោះយ៉ាងណាក៏ដោយ ការបំភាយអេឡិចត្រុង (វិធីសាស្រ្តសម្រាប់សិក្សាការបំភាយអេឡិចត្រុង) ជាធម្មតាត្រូវបានប្រើដើម្បីកំណត់រូបរាងរបស់ម៉ូលេគុលសាមញ្ញក្នុងដំណាក់កាលឧស្ម័ន។ វិធីសាស្រ្តនេះគឺផ្អែកលើការប្រើប្រាស់ លក្ខណៈសម្បត្តិរលកអេឡិចត្រុង។ ធ្នឹមនៃអេឡិចត្រុងត្រូវបានឆ្លងកាត់គំរូនៃឧស្ម័នដែលកំពុងសិក្សា។ ម៉ូលេគុលឧស្ម័នខ្ចាត់ខ្ចាយអេឡិចត្រុង ដែលបណ្តាលឱ្យមានលំនាំបំភាយ។ តាមរយៈការវិភាគ វាអាចកំណត់ប្រវែងចំណង និងមុំនៃចំណងនៅក្នុងម៉ូលេគុល។ វិធីសាស្រ្តនេះគឺស្រដៀងគ្នាទៅនឹងអ្វីដែលបានប្រើក្នុងការវិភាគនៃលំនាំនៃការសាយភាយដែលបង្កើតឡើងដោយការបែកខ្ចាត់ខ្ចាយនៃកាំរស្មីអ៊ិច។
កាំអាតូមិច កាំអាតូមិច
លក្ខណៈដែលធ្វើឱ្យវាអាចធ្វើទៅបានដើម្បីប៉ាន់ស្មានចម្ងាយអន្តរអាតូមិក (អន្តរនុយក្លេអ៊ែរ) នៅក្នុងម៉ូលេគុល និងគ្រីស្តាល់។ រ៉ាឌីអាតូមិកស្ថិតនៅលើលំដាប់នៃ 0.1 nm ។ កំណត់ជាចម្បងពីទិន្នន័យកាំរស្មីអ៊ិច ការវិភាគរចនាសម្ព័ន្ធ.
កាំអាតូមិចកាំអាតូមិក លក្ខណៈដែលអនុញ្ញាតឱ្យមនុស្សម្នាក់ប៉ាន់ស្មានចម្ងាយអន្តរអាតូមិក (អន្តរនុយក្លេអ៊ែរ) នៅក្នុងម៉ូលេគុល និងគ្រីស្តាល់។
កាំដែលមានប្រសិទ្ធភាពនៃអាតូម ឬអ៊ីយ៉ុងត្រូវបានគេយល់ថាជាកាំនៃរង្វង់នៃសកម្មភាពរបស់វា ហើយអាតូម (អ៊ីយ៉ុង) ត្រូវបានចាត់ទុកថាជាបាល់ដែលមិនអាចបង្រួមបាន។ ដោយប្រើគំរូភពនៃអាតូម វាត្រូវបានតំណាងថាជាស្នូលជុំវិញដែលនៅក្នុងគន្លង (សង់ទីម៉ែត។ ORBITALS)អេឡិចត្រុងបង្វិល។ លំដាប់នៃធាតុនៅក្នុងតារាងតាមកាលកំណត់ Mendeleev ត្រូវគ្នាទៅនឹងលំដាប់នៃការបំពេញ សែលអេឡិចត្រូនិច. កាំដែលមានប្រសិទ្ធភាពនៃអ៊ីយ៉ុងអាស្រ័យទៅលើការបំពេញសំបកអេឡិចត្រុង ប៉ុន្តែវាមិនស្មើនឹងកាំនៃគន្លងខាងក្រៅនោះទេ។ ដើម្បីកំណត់កាំដែលមានប្រសិទ្ធភាព អាតូម (អ៊ីយ៉ុង) នៅក្នុងរចនាសម្ព័ន្ធគ្រីស្តាល់ត្រូវបានតំណាងថាជាបាល់រឹងនៅក្នុងទំនាក់ទំនង ដូច្នេះចម្ងាយរវាងចំណុចកណ្តាលរបស់វាស្មើនឹងផលបូកនៃរ៉ាឌី។ រ៉ាឌីអាតូមិច និងអ៊ីយ៉ុង ត្រូវបានកំណត់ដោយពិសោធន៍ពីការវាស់កាំរស្មីអ៊ិចនៃចម្ងាយអន្តរអាតូម ហើយគណនាតាមទ្រឹស្ដីដោយផ្អែកលើគោលគំនិតមេកានិចកង់ទិច។
ទំហំនៃរ៉ាឌីអ៊ីយ៉ុង គោរពតាមច្បាប់ដូចខាងក្រោមៈ
1. ក្នុងជួរបញ្ឈរមួយនៃតារាងតាមកាលកំណត់ កាំនៃអ៊ីយ៉ុងគឺ គ បន្ទុកស្មើគ្នាកើនឡើងជាមួយនឹងការកើនឡើង លេខអាតូមិចចាប់តាំងពីចំនួនសែលអេឡិចត្រុងកើនឡើង ដូច្នេះហើយទំហំអាតូម។
2. សម្រាប់ធាតុដូចគ្នា កាំអ៊ីយ៉ុងកើនឡើងជាមួយនឹងការកើនឡើង បន្ទុកអវិជ្ជមាននិងថយចុះជាមួយនឹងការកើនឡើង បន្ទុកវិជ្ជមាន. កាំអ៊ីយ៉ុង ធំជាងកាំ cation ចាប់តាំងពី anion មានអេឡិចត្រុងលើស ហើយ cation មានកង្វះខាត។ ឧទាហរណ៍ សម្រាប់ Fe, Fe 2+, Fe 3+ កាំដែលមានប្រសិទ្ធភាពគឺ 0.126, 0.080 និង 0.067 nm រៀងគ្នាសម្រាប់ Si 4-, Si, Si 4+ កាំដែលមានប្រសិទ្ធភាពគឺ 0.198, 0.118 និង 0.040 nm ។
3. ទំហំនៃអាតូម និងអ៊ីយ៉ុងតាមកាលកំណត់នៃប្រព័ន្ធ Mendeleev; ករណីលើកលែងគឺជាធាតុពីលេខ 57 (lanthanum) ដល់លេខ 71 (lutetium) ដែលកាំនៃអាតូមមិនកើនឡើងទេ ប៉ុន្តែមានការថយចុះស្មើៗគ្នា (ដែលគេហៅថាការកន្ត្រាក់ lanthanide) និងធាតុចាប់ពីលេខ 89 (actinium) តទៅ។ (ការកន្ត្រាក់ actinide) ។
កាំអាតូមនៃធាតុគីមីអាស្រ័យលើលេខសំរបសំរួល (សង់ទីម៉ែត។លេខសំរបសំរួល). ការកើនឡើងនៃចំនួនសំរបសំរួលគឺតែងតែអមដោយការកើនឡើងនៃចម្ងាយអន្តរអាតូមិច។ ក្នុងករណីនេះ ភាពខុសគ្នាដែលទាក់ទងនៅក្នុងតម្លៃនៃកាំអាតូមិកដែលត្រូវគ្នានឹងលេខសំរបសំរួលពីរផ្សេងគ្នាមិនអាស្រ័យលើប្រភេទនៃចំណងគីមី (ផ្តល់ថាប្រភេទនៃចំណងនៅក្នុងរចនាសម្ព័ន្ធដែលមានលេខសំរបសំរួលប្រៀបធៀបគឺដូចគ្នា)។ ការផ្លាស់ប្តូរនៃរ៉ាឌីអាតូមិចជាមួយនឹងការផ្លាស់ប្តូរលេខសំរបសំរួលប៉ះពាល់យ៉ាងខ្លាំងដល់ទំហំនៃការផ្លាស់ប្តូរបរិមាណកំឡុងពេលបំលែងពហុម៉ូហ្វីក។ ឧទាហរណ៍ នៅពេលដែកត្រជាក់ ការបំប្លែងរបស់វាពីការកែប្រែជាមួយនឹងបន្ទះគូបដែលផ្តោតលើមុខទៅជាការកែប្រែជាមួយនឹងបន្ទះគូបដែលផ្តោតលើរាងកាយដែលកើតឡើងនៅ 906 o C គួរតែត្រូវបានអមដោយការកើនឡើងនៃបរិមាណ 9% ។ តាមពិតការកើនឡើងនៃបរិមាណគឺ 0.8% ។ នេះគឺដោយសារតែការពិតដែលថាដោយសារតែការផ្លាស់ប្តូរលេខសំរបសំរួលពី 12 ទៅ 8 កាំអាតូមនៃជាតិដែកថយចុះ 3% ។ នោះគឺជា ការផ្លាស់ប្តូរនៃកាំអាតូមកំឡុងពេលបំលែងពហុម៉ូហ្វីក ភាគច្រើនផ្តល់សំណងដល់ការផ្លាស់ប្តូរបរិមាណដែលគួរតែកើតឡើង ប្រសិនបើកាំអាតូមមិនផ្លាស់ប្តូរ។ កាំអាតូមិចនៃធាតុអាចប្រៀបធៀបបានលុះត្រាតែពួកវាមានលេខសំរបសំរួលដូចគ្នា។
អាតូមិក (អ៊ីយ៉ុង) រ៉ាឌី ក៏អាស្រ័យលើប្រភេទនៃចំណងគីមី។
នៅក្នុងគ្រីស្តាល់ជាមួយ ចំណងលោហៈ (សង់ទីម៉ែត។តំណភ្ជាប់លោហៈ)កាំអាតូមត្រូវបានកំណត់ថាជាពាក់កណ្តាលនៃចម្ងាយអន្តរអាតូមរវាងអាតូមដែលនៅជិតបំផុត។ ក្នុងករណីដំណោះស្រាយរឹង (សង់ទីម៉ែត។ដំណោះស្រាយរឹង)កាំអាតូមលោហធាតុ ប្រែប្រួលតាមវិធីស្មុគស្មាញ។
កាំនៃ covalent នៃធាតុដែលមានចំណង covalent ត្រូវបានយល់ថាជាពាក់កណ្តាលចម្ងាយអន្តរអាតូមរវាងអាតូមដែលនៅជិតបំផុតដែលតភ្ជាប់ដោយចំណង covalent តែមួយ។ លក្ខណៈពិសេសនៃ radii covalent គឺភាពស្ថិតស្ថេររបស់ពួកគេនៅក្នុងរចនាសម្ព័ន្ធ covalent ផ្សេងគ្នាដែលមានលេខសំរបសំរួលដូចគ្នា។ ដូច្នេះចម្ងាយនៅក្នុង ចំណងតែមួយ S-S ក្នុងពេជ្រនិង អ៊ីដ្រូកាបូនឆ្អែតគឺដូចគ្នាបេះបិទ និងស្មើនឹង 0.154 nm ។
វិទ្យុសកម្មអ៊ីយ៉ុងនៅក្នុងសារធាតុដែលមានចំណងអ៊ីយ៉ុង (សង់ទីម៉ែត។ប័ណ្ណបំណុល IONIC)មិនអាចកំណត់ថាជាពាក់កណ្តាលនៃផលបូកនៃចម្ងាយរវាងអ៊ីយ៉ុងនៅក្បែរនោះទេ។ តាមក្បួនមួយទំហំនៃ cations និង anions ខុសគ្នាយ៉ាងខ្លាំង។ លើសពីនេះទៀតស៊ីមេទ្រីនៃអ៊ីយ៉ុងខុសគ្នាពីស្វ៊ែរ។ មានវិធីសាស្រ្តជាច្រើនក្នុងការប៉ាន់ប្រមាណរ៉ាឌីអ៊ីយ៉ុង។ ដោយផ្អែកលើវិធីសាស្រ្តទាំងនេះ កាំអ៊ីយ៉ុងនៃធាតុត្រូវបានប៉ាន់ប្រមាណ ហើយបន្ទាប់មកកាំអ៊ីយ៉ុងនៃធាតុផ្សេងទៀតត្រូវបានកំណត់ពីចម្ងាយអន្តរអាតូមដែលបានកំណត់ដោយពិសោធន៍។
Van der Waals radii កំណត់ទំហំអាតូមដែលមានប្រសិទ្ធភាព ឧស្ម័នដ៏ថ្លៃថ្នូ. លើសពីនេះ កាំអាតូម van der Waals ត្រូវបានចាត់ទុកថាជាចម្ងាយពាក់កណ្តាលនៃចម្ងាយនុយក្លេអ៊ែររវាងអាតូមដូចគ្នាបេះបិទជិតបំផុត ដែលមិនមានទំនាក់ទំនងគ្នាទៅវិញទៅមក។ ចំណងគីមី, i.e. ជាកម្មសិទ្ធិរបស់ម៉ូលេគុលផ្សេងៗគ្នា (ឧទាហរណ៍នៅក្នុងគ្រីស្តាល់ម៉ូលេគុល) ។
នៅពេលប្រើអាតូមិក (អ៊ីយ៉ុង) រ៉ាឌីក្នុងការគណនា និងសំណង់ តម្លៃរបស់វាគួរតែត្រូវបានយកចេញពីតារាងដែលបានសាងសង់តាមប្រព័ន្ធមួយ។
វចនានុក្រមសព្វវចនាធិប្បាយ. 2009 .
សូមមើលអ្វីដែល "រ៉ាឌីអាតូមិក" មាននៅក្នុងវចនានុក្រមផ្សេងទៀត៖
លក្ខណៈនៃអាតូមដែលធ្វើឱ្យវាអាចប៉ាន់ប្រមាណចម្ងាយអន្តរអាតូមិក (អន្តរនុយក្លេអ៊ែរ) ក្នុងម៉ូលេគុល និងគ្រីស្តាល់។ អាតូមមិនមានព្រំដែនច្បាស់លាស់ទេ យោងទៅតាមគោលគំនិតនៃ quantum ។ មេកានិច, ប្រូបាប៊ីលីតេនៃការស្វែងរកអេឡិចត្រុងសម្រាប់ជាក់លាក់មួយ។ ចម្ងាយពីស្នូល ...... សព្វវចនាធិប្បាយរូបវិទ្យា
លក្ខណៈដែលធ្វើឱ្យវាអាចធ្វើទៅបានដើម្បីប៉ាន់ប្រមាណចម្ងាយអន្តរអាតូមិក (អន្តរនុយក្លេអ៊ែរ) នៅក្នុងម៉ូលេគុល និងគ្រីស្តាល់។ កំណត់ជាចម្បងពីទិន្នន័យការវិភាគរចនាសម្ព័ន្ធ កាំរស្មីអ៊ិច... វចនានុក្រមសព្វវចនាធិប្បាយធំ
លក្ខណៈប្រកបដោយប្រសិទ្ធភាពនៃអាតូម ដែលអនុញ្ញាតឱ្យប៉ាន់ស្មានចម្ងាយអន្តរអាតូមិក (អន្តរនុយក្លេអ៊ែរ) ក្នុងម៉ូលេគុល និងគ្រីស្តាល់។ យោងតាមគោលគំនិតនៃមេកានិចកង់ទិច អាតូមមិនមានព្រំដែនច្បាស់លាស់ទេ ប៉ុន្តែប្រូបាប៊ីលីតេនៃការស្វែងរកអេឡិចត្រុង...... សព្វវចនាធិប្បាយគីមី
លក្ខណៈនៃអាតូមដែលធ្វើឱ្យវាអាចប៉ាន់ប្រមាណចម្ងាយអន្តរអាតូមនៅក្នុងសារធាតុ។ យោងតាម quantum mechanics អាតូមមួយមិនមានព្រំដែនច្បាស់លាស់ទេ ប៉ុន្តែប្រូបាប៊ីលីតេនៃការស្វែងរកអេឡិចត្រុងនៅ ចម្ងាយដែលបានផ្តល់ឱ្យពីស្នូលនៃអាតូម ចាប់ផ្តើមពី ...... សព្វវចនាធិប្បាយសូវៀតដ៏អស្ចារ្យ
