ដំណោះស្រាយចំពោះការជាប់គាំងត្រូវបានរកឃើញដោយអ្នកវិទ្យាសាស្ត្រជនជាតិដាណឺម៉ាក Niels Bohr ក្នុងឆ្នាំ 1913 ដែលបានទទួលរង្វាន់ណូបែលនៅឆ្នាំ 1922 ។
Bohr បានធ្វើការសន្មត់ដែលត្រូវបានគេហៅថា ការណែនាំរបស់ Bohr.
· ប្រកាសដំបូង (postulate រដ្ឋស្ថានី):អេឡិចត្រុងផ្លាស់ទីតែនៅតាមបណ្តោយជាក់លាក់(ស្ថានី)គន្លង។ ក្នុងពេលជាមួយគ្នា, សូម្បីតែនៅពេលផ្លាស់ទីក្នុងល្បឿន,ពួកគេមិនបញ្ចេញថាមពលទេ។
· postulate ទីពីរ (ច្បាប់ប្រេកង់):ការបំភាយ និងការស្រូបថាមពលក្នុងទម្រង់ជាបរិមាណនៃពន្លឺ (ម៉ោងន) កើតឡើងតែនៅពេលដែលអេឡិចត្រុងផ្លាស់ប្តូរពីស្ថានភាពស្ថានីមួយទៅស្ថានភាពមួយទៀត។ ទំហំនៃបរិមាណពន្លឺគឺស្មើនឹងភាពខុសគ្នានៃថាមពលនៃស្ថានភាពស្ថានីទាំងនោះ,រវាងអេឡិចត្រុងលោត៖ .
វាដូចខាងក្រោមថាការផ្លាស់ប្តូរនៃថាមពលអាតូមិចដែលទាក់ទងនឹងវិទ្យុសកម្មនៅពេលដែល photon ត្រូវបានស្រូបយកគឺសមាមាត្រទៅនឹងប្រេកង់ ν:
ច្បាប់បរិមាណគន្លង : ក្នុងចំណោមគន្លងអេឡិចត្រូនិកទាំងអស់ មានតែគន្លងដែលអាចធ្វើទៅបាន។,ដែលសន្ទុះមុំស្មើនឹងពហុគុណនៃថេររបស់ Planck៖
| , | (6.3.2) |
កន្លែងណា ន= 1, 2, 3, ... – លេខ quantum សំខាន់។
អនុញ្ញាតឱ្យយើងទទួលបានកន្សោមសម្រាប់ថាមពលនៃអេឡិចត្រុងនៅក្នុងអាតូមមួយ។
ពិចារណាអំពីអេឡិចត្រុង (រូបភាព 6.6a) ដែលកំពុងផ្លាស់ទីក្នុងល្បឿនក្នុងវាលនៃស្នូលអាតូមិចជាមួយនឹងបន្ទុក ហ្សេ(នៅ Z= 1 - អាតូមអ៊ីដ្រូសែន) ។
 | |||
| ក | ខ |
សមីការនៃចលនាអេឡិចត្រុងមានទម្រង់៖
|
|
(6.3.3) |
ពីរូបមន្ត (6.3.3) វាច្បាស់ណាស់ថាកម្លាំង centrifugal គឺស្មើនឹងកម្លាំង Coulomb ដែល .
ចូរយើងជំនួសតម្លៃនៃ υ ពី (6.3.2) ទៅជា (6.3.3) ហើយទទួលបានកន្សោមសម្រាប់កាំនៃគន្លងស្ថានី (រូបភាព 6.6, ខ)៖
| . | (6.3.4) |
កាំនៃគន្លងទីមួយនៃអាតូមអ៊ីដ្រូសែនត្រូវបានគេហៅថា កាំ Bohr . នៅ ន =1, Z= 1 សម្រាប់អ៊ីដ្រូសែនយើងមាន:
![]() Å = 0.529·10–10 m ។
Å = 0.529·10–10 m ។
ថាមពលខាងក្នុងនៃអាតូមត្រូវបានផ្សំឡើងដោយថាមពល kinetic នៃអេឡិចត្រុង (ស្នូលមិនមានចលនា) និងថាមពលសក្តានុពលនៃអន្តរកម្មនៃអេឡិចត្រុងជាមួយស្នូល៖
![]() .
.
ពីសមីការនៃចលនាអេឡិចត្រុង វាធ្វើតាមនោះ i.e. ថាមពល kinetic គឺស្មើនឹងថាមពលសក្តានុពល។ បន្ទាប់មកយើងអាចសរសេរ៖
![]() .
.
ចូរយើងជំនួសកន្សោមនៅទីនេះសម្រាប់កាំនៃគន្លងទីមួយ ហើយទទួលបាន៖
|
|
(6.3.5) |
វាត្រូវបានគេយកទៅក្នុងគណនីនៅទីនេះថាថេររបស់ Planck, i.e. .
សម្រាប់អាតូមអ៊ីដ្រូសែននៅ Z= 1 យើងមាន៖
|
|
(6.3.6) |
ពីរូបមន្ត (6.3.6) វាច្បាស់ណាស់ថាវាត្រូវការតែតម្លៃថាមពលដាច់ដោយឡែកប៉ុណ្ណោះ ពីព្រោះ ន = 1, 2, 3….
ដ្យាក្រាមនៃកម្រិតថាមពលដែលកំណត់ដោយសមីការ (6.3.6) ត្រូវបានបង្ហាញក្នុងរូប។ ៦.១ និង ៦.៧។


នៅពេលដែលអេឡិចត្រុងនៅក្នុងអាតូមអ៊ីដ្រូសែនឆ្លងកាត់ពីរដ្ឋ ននៅក្នុងរដ្ឋមួយ។ kហ្វូតូនដែលមានថាមពលត្រូវបានបញ្ចេញ៖
![]() .
.
ភាពញឹកញាប់នៃការបំភាយ៖
![]() .
.
រូបមន្ត Balmer ទូទៅត្រូវបានទទួល ដែលយល់ស្របនឹងការពិសោធន៍។ កន្សោមនៅពីមុខតង្កៀប ដូចបានបញ្ជាក់រួចហើយត្រូវបានហៅថា Rydberg ថេរ :
![]() .
.
ជោគជ័យដ៏សំខាន់នៃទ្រឹស្តីរបស់ Bohr គឺការគណនាថេរ Rydberg សម្រាប់ប្រព័ន្ធដូចអ៊ីដ្រូសែន និងការពន្យល់អំពីរចនាសម្ព័ន្ធនៃខ្សែបន្ទាត់របស់ពួកគេ។ Bohr អាចពន្យល់ពីបន្ទាត់នៃវិសាលគម អ៊ីយ៉ូដអេលីយ៉ូម គាត់បានគណនាតាមទ្រឹស្ដីសមាមាត្រនៃម៉ាស់ប្រូតុងទៅនឹងម៉ាស់អេឡិចត្រុង ដែលស្របតាមការពិសោធន៍ ដែលជាការបញ្ជាក់ដ៏សំខាន់នៃគំនិតសំខាន់ៗដែលមាននៅក្នុងទ្រឹស្តីរបស់គាត់។ ទ្រឹស្តីរបស់ Bohr បានដើរតួនាទីយ៉ាងធំក្នុងការបង្កើតរូបវិទ្យាអាតូមិច។ កំឡុងពេលនៃការអភិវឌ្ឍន៍របស់វា (1913-1925) ការរកឃើញសំខាន់ៗត្រូវបានធ្វើឡើង ដែលត្រូវបានរួមបញ្ចូលជារៀងរហូតនៅក្នុងរតនាគារនៃវិទ្យាសាស្ត្រពិភពលោក។
ទោះជាយ៉ាងណាក៏ដោយ រួមជាមួយនឹងភាពជោគជ័យ ចំណុចខ្វះខាតសំខាន់ៗត្រូវបានរកឃើញនៅក្នុងទ្រឹស្ដីរបស់ Bohr តាំងពីដើមដំបូងមក។ សំខាន់បំផុតក្នុងចំណោមពួកគេ។ ភាពមិនស៊ីសង្វាក់ផ្ទៃក្នុងទ្រឹស្ដី៖ ការភ្ជាប់មេកានិកនៃរូបវិទ្យាបុរាណជាមួយ quantum postulates ។ ទ្រឹស្ដីមិនអាចពន្យល់ពីសំណួរនៃ អាំងតង់ស៊ីតេបន្ទាត់ spectral ។ ការបរាជ័យដ៏ធ្ងន់ធ្ងរមួយគឺភាពមិនអាចទៅរួចទាំងស្រុងនៃការអនុវត្តទ្រឹស្តីដើម្បីពន្យល់ពីវិសាលគមនៃអាតូមអេលីយ៉ូមដែលមានអេឡិចត្រុងពីរនៅក្នុងគន្លងរបស់វា ហើយសូម្បីតែច្រើនដូច្នេះសម្រាប់អាតូមពហុអេឡិចត្រុង (រូបភាព 6.8) ។

វាច្បាស់ណាស់ថាទ្រឹស្តីរបស់ Bohr គ្រាន់តែជាដំណាក់កាលអន្តរកាលមួយនៅលើផ្លូវឆ្ពោះទៅរកការបង្កើតទ្រឹស្តីទូទៅ និងត្រឹមត្រូវជាង។ មេកានិច Quantum គឺជាទ្រឹស្តីមួយ។
ដើម្បីមើលការបង្ហាញ សូមចុចលើតំណខ្ពស់ដែលសមស្រប៖
អាតូម (មកពីភាសាក្រិចបុរាណ ἄτομος - មិនអាចបំបែកបាន) គឺជាផ្នែកតូចបំផុតនៃធាតុគីមីដែលមិនអាចបំបែកបាននៃធាតុគីមី ដែលជាអ្នកកាន់លក្ខណៈសម្បត្តិរបស់វា។ អាតូមមួយមានស្នូលអាតូម និងអេឡិចត្រុង។ ស្នូលនៃអាតូមមួយមានប្រូតុងដែលមានបន្ទុកវិជ្ជមាន និងនឺត្រុងមិនបញ្ចេញថាមពល។ ប្រសិនបើចំនួនប្រូតុងនៅក្នុងស្នូលស្របគ្នានឹងចំនួនអេឡិចត្រុង នោះអាតូមទាំងមូលប្រែទៅជាអព្យាក្រឹតអគ្គិសនី។ បើមិនដូច្នោះទេ វាមានបន្ទុកវិជ្ជមាន ឬអវិជ្ជមាន ហើយត្រូវបានគេហៅថាអ៊ីយ៉ុង។ អាតូមត្រូវបានចាត់ថ្នាក់តាមចំនួនប្រូតុង និងនឺត្រុងនៅក្នុងស្នូល៖ ចំនួនប្រូតុងកំណត់ថាតើអាតូមជារបស់ធាតុគីមីជាក់លាក់មួយ ហើយចំនួននឺត្រុងកំណត់អ៊ីសូតូបនៃធាតុនេះ។
ទោះបីជាពាក្យថា អាតូម ពីដើមមានន័យថា ភាគល្អិតដែលមិនត្រូវបានបែងចែកទៅជាផ្នែកតូចៗក៏ដោយ យោងទៅតាមគំនិតវិទ្យាសាស្ត្រ វាត្រូវបានផ្សំឡើងដោយភាគល្អិតតូចៗ ហៅថា ភាគល្អិត subatomic ។ អាតូមមួយមានអេឡិចត្រុង ប្រូតុង អាតូមទាំងអស់លើកលែងតែអ៊ីដ្រូសែន-១ ក៏មាននឺត្រុងដែរ។
អេឡិចត្រុងគឺជាភាគល្អិតស្រាលបំផុតដែលបង្កើតបានជាអាតូម ដែលមានម៉ាស់ 9.11·10−31 គីឡូក្រាម ជាបន្ទុកអវិជ្ជមាន និងទំហំតូចពេកមិនអាចវាស់បានដោយវិធីសាស្ត្រទំនើប។ ប្រូតុងមានបន្ទុកវិជ្ជមាន និងមានទម្ងន់ធ្ងន់ជាងអេឡិចត្រុង 1836 ដង (1.6726 · 10-27 គីឡូក្រាម) ។ នឺត្រុងមិនមានបន្ទុកអគ្គិសនីទេ ហើយមានទម្ងន់ធ្ងន់ជាងអេឡិចត្រុង 1839 ដង (1.6929 · 10-27 គីឡូក្រាម) ។ ក្នុងករណីនេះ ម៉ាស់របស់នឺត្រុងគឺតិចជាងផលបូកនៃម៉ាស់នៃប្រូតុង និងនឺត្រុងដែលមានធាតុផ្សំរបស់វា ដោយសារឥទ្ធិពលម៉ាស។ នឺត្រុង និងប្រូតុងមានទំហំប្រៀបធៀបប្រហែល 2.5·10−15 ម ទោះបីទំហំនៃភាគល្អិតទាំងនេះត្រូវបានកំណត់តិចតួចក៏ដោយ។
ការសន្មត់របស់ Bohr គឺជាការសន្មតជាមូលដ្ឋានដែលបង្កើតឡើងដោយ Niels Bohr ក្នុងឆ្នាំ 1913 ដើម្បីពន្យល់ពីគំរូនៃវិសាលគមបន្ទាត់នៃអាតូមអ៊ីដ្រូសែន និងអ៊ីយ៉ុងដូចអ៊ីដ្រូសែន (រូបមន្ត Balmer-Rydberg) និងធម្មជាតិនៃបរិមាណនៃការបំភាយ និងការស្រូបយកពន្លឺ។ Bohr បានបន្តពីគំរូភពរបស់ Rutherford នៃអាតូម។
អាតូមអាចស្ថិតនៅក្នុងស្ថានីពិសេស ឬ quantum ប៉ុណ្ណោះ ដែលនីមួយៗមានថាមពលជាក់លាក់។ នៅក្នុងស្ថានភាពស្ថានី អាតូមមិនបញ្ចេញរលកអេឡិចត្រូម៉ាញ៉េទិចទេ។
អេឡិចត្រុងនៅក្នុងអាតូម ដោយមិនបាត់បង់ថាមពល ផ្លាស់ទីតាមគន្លងរាងជារង្វង់ដាច់ដោយឡែកមួយចំនួន ដែលសន្ទុះមុំត្រូវបានគណនាជាបរិមាណ៖ លេខធម្មជាតិ និងជាចំនួនថេររបស់ Planck ។ វត្តមានរបស់អេឡិចត្រុងនៅក្នុងគន្លងគោចរកំណត់ថាមពលនៃស្ថានភាពស្ថានីទាំងនេះ។
នៅពេលដែលអេឡិចត្រុងផ្លាស់ទីពីគន្លងមួយ (កម្រិតថាមពល) ទៅគន្លងមួយ បរិមាណថាមពលមួយត្រូវបានបញ្ចេញ ឬស្រូបចូល តើកម្រិតថាមពលរវាងការផ្លាស់ប្តូរកើតឡើងនៅឯណា។ នៅពេលផ្លាស់ប្តូរពីកម្រិតខាងលើទៅកម្រិតទាប ថាមពលត្រូវបានបញ្ចេញនៅពេលផ្លាស់ប្តូរពីកម្រិតទាបទៅកម្រិតខាងលើ វាត្រូវបានស្រូបយក។
ដោយប្រើ postulates ទាំងនេះនិងច្បាប់នៃមេកានិចបុរាណ Bohr បានស្នើគំរូនៃអាតូមដែលឥឡូវនេះត្រូវបានគេហៅថាគំរូ Bohr នៃអាតូម។ ក្រោយមក Sommerfeld បានពង្រីកទ្រឹស្តីរបស់ Bohr ទៅនឹងករណីនៃគន្លងរាងអេលីប។ វាត្រូវបានគេហៅថាគំរូ Bohr-Sommerfeld ។
អាតូមអ៊ីដ្រូសែន គឺជាប្រព័ន្ធរូបវន្តដែលមានស្នូលអាតូមដែលផ្ទុកបន្ទុកអគ្គិសនីវិជ្ជមានបឋម និងអេឡិចត្រុងដែលផ្ទុកបន្ទុកអគ្គិសនីអវិជ្ជមានបឋម។ ស្នូលអាតូមអាចមានប្រូតុង ឬប្រូតុងដែលមាននឺត្រុងមួយ ឬច្រើនបង្កើតជាអ៊ីសូតូបនៃអ៊ីដ្រូសែន។ អេឡិចត្រុងមានទីតាំងនៅលើស្រទាប់ស្វ៊ែរប្រមូលផ្តុំស្តើងជុំវិញស្នូលអាតូម បង្កើតជាសំបកអេឡិចត្រុងនៃអាតូម។ កាំដែលទំនងបំផុតនៃសែលអេឡិចត្រុងនៃអាតូមអ៊ីដ្រូសែននៅក្នុងស្ថានភាពស្ថិរភាពគឺស្មើនឹងកាំ Bohr a0 = 0.529 Å។
អាតូមអ៊ីដ្រូសែនមានសារៈសំខាន់ពិសេសនៅក្នុងមេកានិចកង់ទិច និងមេកានិចកង់ទិចដែលពឹងផ្អែក ពីព្រោះសម្រាប់វា បញ្ហារាងកាយពីរមានដំណោះស្រាយវិភាគជាក់លាក់ ឬប្រហាក់ប្រហែល។ ដំណោះស្រាយទាំងនេះអាចអនុវត្តបានសម្រាប់អ៊ីសូតូបអ៊ីដ្រូសែនផ្សេងៗគ្នា ដោយមានការកែតម្រូវសមស្រប។
នៅក្នុងមេកានិចកង់ទិច អាតូមអ៊ីដ្រូសែនត្រូវបានពិពណ៌នាដោយម៉ាទ្រីសដង់ស៊ីតេភាគល្អិតពីរ ឬមុខងាររលកភាគល្អិតពីរ។ វាក៏ត្រូវបានចាត់ទុកយ៉ាងសាមញ្ញថាជាអេឡិចត្រុងនៅក្នុងវាលអេឡិចត្រូស្ទិកនៃស្នូលអាតូមិកដ៏ធ្ងន់គ្មានដែនកំណត់ដែលមិនចូលរួមក្នុងចលនា (ឬជាធម្មតានៅក្នុងសក្តានុពលអេឡិចត្រូស្ទិច Coulomb នៃទម្រង់ 1/r)។ ក្នុងករណីនេះអាតូមអ៊ីដ្រូសែនត្រូវបានពិពណ៌នាដោយម៉ាទ្រីសដង់ស៊ីតេភាគល្អិតតែមួយដែលកាត់បន្ថយ ឬមុខងាររលក។
នៅឆ្នាំ 1913 Niels Bohr បានស្នើគំរូនៃអាតូមអ៊ីដ្រូសែនដែលមានការសន្មត់ និងភាពសាមញ្ញជាច្រើន ហើយបានមកពីវានូវវិសាលគមនៃការបំភាយអ៊ីដ្រូសែន។ ការសន្មត់របស់ម៉ូដែលនេះគឺមិនត្រឹមត្រូវទាំងស្រុងនោះទេ ប៉ុន្តែទោះជាយ៉ាងណាក៏ដោយបាននាំឱ្យមានតម្លៃត្រឹមត្រូវសម្រាប់កម្រិតថាមពលនៃអាតូម។
លទ្ធផលនៃការគណនារបស់ Bohr ត្រូវបានបញ្ជាក់នៅឆ្នាំ 1925-1926 ដោយការវិភាគមេកានិចកង់ទិចយ៉ាងម៉ត់ចត់ដោយផ្អែកលើសមីការ Schrödinger ។ ដំណោះស្រាយចំពោះសមីការ Schrödinger សម្រាប់អេឡិចត្រុងនៅក្នុងវាលអេឡិចត្រូស្ទិកនៃស្នូលអាតូមមួយត្រូវបានចេញជាទម្រង់វិភាគ។ វាពិពណ៌នាមិនត្រឹមតែកម្រិតថាមពលអេឡិចត្រុង និងវិសាលគមនៃការបំភាយឧស្ម័នប៉ុណ្ណោះទេ។
បរិមាណនៃថាមពលអេឡិចត្រុងនៅក្នុងអាតូមបរិមាណរូបវន្តមួយចំនួនដែលទាក់ទងនឹងមីក្រូវត្ថុផ្លាស់ប្តូរមិនបន្តទេប៉ុន្តែភ្លាមៗ។ បរិមាណដែលអាចទទួលយកបានតែលើការកំណត់ត្រឹមត្រូវ ពោលគឺតម្លៃដាច់ពីគ្នា (ភាសាឡាតាំង "discretus" មានន័យថា បែងចែក មិនបន្ត) ត្រូវបាននិយាយថាជាបរិមាណ។
នៅឆ្នាំ 1900 រូបវិទូជនជាតិអាឡឺម៉ង់ M. Planck ដែលបានសិក្សាពីវិទ្យុសកម្មកម្ដៅនៃអង្គធាតុរឹងបានសន្និដ្ឋានថាវិទ្យុសកម្មអេឡិចត្រូម៉ាញ៉េទិចត្រូវបានបញ្ចេញក្នុងទម្រង់នៃផ្នែកដាច់ដោយឡែក - quanta - នៃថាមពល។ តម្លៃនៃបរិមាណថាមពលមួយគឺ ΔE = hν,
ដែល ΔE គឺជាថាមពលកង់ទិច, J; ν - ប្រេកង់, s-1; h គឺជាថេររបស់ Planck (មួយនៃថេរជាមូលដ្ឋាននៃធម្មជាតិ) ស្មើនឹង 6.626·10−34 J·s ។
ថាមពល quanta ក្រោយមកត្រូវបានគេហៅថា photons ។
គំនិតនៃបរិមាណថាមពលបានធ្វើឱ្យវាអាចធ្វើទៅបានដើម្បីពន្យល់ពីប្រភពដើមនៃវិសាលគមអាតូមិកបន្ទាត់ដែលមានសំណុំនៃបន្ទាត់រួមបញ្ចូលគ្នានៅក្នុងស៊េរីមួយ។
ចូរយើងត្រលប់ទៅឆ្នាំ 1911 ។ មកដល់ពេលនេះ ភាពមិនច្បាស់លាស់នៃអតិសុខុមប្រាណត្រូវបានបង្ហាញយ៉ាងច្បាស់បំផុតនៅក្នុងវិសាលគមអាតូមិច។ វាបានប្រែក្លាយថាអាតូមស្រូប និងបញ្ចេញពន្លឺនៃរលកពន្លឺជាក់លាក់មួយ ហើយខ្សែវិសាលគមត្រូវបានដាក់ជាក្រុមទៅជាស៊េរីដែលគេហៅថា (រូបភាព 3.1) ។
អង្ករ។ ៣.១. រលកដែលបញ្ចេញដោយអាតូមអ៊ីដ្រូសែន៖ វិសាលគមមានស៊េរី (បីដំបូងត្រូវបានបង្ហាញ)-
លំដាប់នៃបន្ទាត់ condensing ទៅជាក់លាក់មួយ (ផ្សេងគ្នាសម្រាប់ស៊េរីនីមួយៗ) កម្រិតអប្បបរមា
តម្លៃ; មានតែបួនជួរនៃស៊េរី Balmer ស្ថិតនៅក្នុងជួរដែលអាចមើលឃើញ

អង្ករ។ ៣.២. (ក) វិសាលគមនៃការបញ្ចេញអ៊ីដ្រូសែន បារត និងឧស្ម័នអេលីយ៉ូម៖ (ខ) វិសាលគមស្រូបយកអ៊ីដ្រូសែន

អង្ករ។ ៣.៣. វិសាលគមការបំភាយជាបន្តបន្ទាប់ផ្តល់នូវសារធាតុរឹង និងរាវដែលគេឱ្យឈ្មោះថា ឧស្ម័នដែលបានបង្ហាប់ខ្ពស់ ប្លាស្មាសីតុណ្ហភាពខ្ពស់
សម្រាប់វិសាលគមនៃអ៊ីដ្រូសែន ដែលជាអាតូមសាមញ្ញបំផុត រូបមន្តសាមញ្ញមួយត្រូវបានបង្កើតឡើង (មិនមែនបានមកពីទេ ប៉ុន្តែទាយ!)
|
|
នៅទីនេះ -
រលកនៃវិទ្យុសកម្មអាតូមអ៊ីដ្រូសែន, ននិង k > ន -
ចំនួនគត់, រ -
ដែលគេហៅថា Rydberg ថេរ (![]() , កន្លែងណា -
ឯកតាថាមពលក្រៅប្រព័ន្ធ "Rydberg" ស្មើនឹងពាក់កណ្តាលនៃអង្គភាពថាមពលអាតូមិច) .
វាប្រែថាស៊េរី Lyman ត្រូវបានពិពណ៌នាដោយរូបមន្តនេះសម្រាប់តម្លៃ ,
ស៊េរី Balmer -
នៅ, ស៊េរី Paschen -
at ។ល។ តម្លៃកំណត់ (អប្បបរមា) សម្រាប់ប្រវែងរលកត្រូវបានទទួលពី (3.1) នៅ៖
, កន្លែងណា -
ឯកតាថាមពលក្រៅប្រព័ន្ធ "Rydberg" ស្មើនឹងពាក់កណ្តាលនៃអង្គភាពថាមពលអាតូមិច) .
វាប្រែថាស៊េរី Lyman ត្រូវបានពិពណ៌នាដោយរូបមន្តនេះសម្រាប់តម្លៃ ,
ស៊េរី Balmer -
នៅ, ស៊េរី Paschen -
at ។ល។ តម្លៃកំណត់ (អប្បបរមា) សម្រាប់ប្រវែងរលកត្រូវបានទទួលពី (3.1) នៅ៖
![]()

អង្ករ។ ៣.៤. Johannes Robert Rydberg (1854-1919)

អង្ករ។ ៣.៥. Theodore Lyman (1874-1954)

អង្ករ។ ៣.៦. ស៊េរី Lyman Spectral

អង្ករ។ ៣.៧. Johann Jacob Balmer (1825-1898)
អង្ករ។ ៣.៨. ខ្សែការបំភាយអ៊ីដ្រូសែនដែលអាចមើលឃើញនៅក្នុងស៊េរី Balmer ។ Hα គឺជាបន្ទាត់ក្រហមនៅខាងស្តាំដែលមានរលកប្រវែង 656.3 nm ។ បន្ទាត់ខាងឆ្វេងបំផុត - Hε ដែលត្រូវគ្នានឹងវិទ្យុសកម្មរួចហើយនៅក្នុងតំបន់អ៊ុលត្រាវីយូឡេនៃវិសាលគមនៅរលកប្រវែង 397.0 nm

អង្ករ។ ៣.៩. Louis Karl Heinrich Friedrich Paschen (1865-1947)
អង្ករ។ ៣.១០. ខ្សែទាំងអស់នៃស៊េរី Paschen ស្ថិតនៅក្នុងជួរអ៊ីនហ្វ្រារ៉េដ
លើសពីនេះទៀត ជាលទ្ធផលនៃការសិក្សាអំពីលក្ខណៈសម្បត្តិនៃឧស្ម័ន វាត្រូវបានគេដឹងនៅពេលនោះថា ទំហំអាតូមគឺប្រហែល
ស្មើ ដូច្នេះទ្រឹស្តីដែលពន្យល់អំពីវិសាលគម និងទំហំនៃអាតូមត្រូវរួមបញ្ចូលប៉ារ៉ាម៉ែត្រមួយចំនួនដែលអាចអនុញ្ញាតឱ្យបង្កើតបរិមាណជាមួយនឹងវិមាត្រនៃប្រវែង (ថេរ។ អ៊ីនិង ម -
បន្ទុកអេឡិចត្រុង និងម៉ាស់ -
មិនគ្រប់គ្រាន់សម្រាប់រឿងនេះ) ។ មិនមានប៉ារ៉ាម៉ែត្របែបនេះនៅក្នុងទ្រឹស្តីបុរាណទេ។ វាអាចជាអថេរ Rydberg ប៉ុន្តែប្រភពដើមរបស់វាគឺងងឹត និងអាថ៌កំបាំង។
នៅឆ្នាំ 1911 E. Rutherford បានបោះពុម្ពការងារទ្រឹស្តី ( Rutherford E., ទស្សនាវដ្តីទស្សនវិជ្ជា, v. 21, ទំ។ 669–688 , 1911) ដែលក្នុងនោះផ្អែកលើការវិភាគនៃការពិសោធន៍ដែលបានអនុវត្តនៅក្នុង 1908–1909 ឆ្នាំដោយនិស្សិតរបស់គាត់ - អ្នកហាត់ការ Hans Geiger និងនិស្សិតបញ្ចប់ការសិក្សា Ernst Marsden - ( Geiger H., Marsden T., Proceedings of the Royal Society of London, Series A, v. 82, ទំ។ 495–499 , 1909) បានអះអាងវត្តមាននៅក្នុងអាតូមនៃស្នូលដែលមានបន្ទុកវិជ្ជមាន ដែលម៉ាស់ស្ទើរតែទាំងមូលនៃអាតូមត្រូវបានប្រមូលផ្តុំ។

អង្ករ។ ៣.១១. Ernest Rutherford (1871–1937)
វីដេអូ 3.2 ។ ប្រវត្តិបន្តិច។ មួកខ្មៅនិងគំរូខ្ចាត់ខ្ចាយ។ក្រោយមក នៅក្នុងការបង្រៀនមួយរបស់គាត់ អ៊ី រូធើហ្វដ ខ្លួនឯងបានរំលឹកពីពេលវេលាទាំងនោះដូចតទៅ (ដកស្រង់ចេញពីសៀវភៅដោយ ជេ. ទ្រីក, ការពិសោធន៍សំខាន់ក្នុងរូបវិទ្យាទំនើប, ម៉ូស្គូ, MIR, 1974, ទំព័រ 77): “... ខ្ញុំចាំថា ... Geiger រំភើបចិត្តយ៉ាងខ្លាំងបានមករកខ្ញុំហើយនិយាយថា: "យើងហាក់ដូចជាបានទទួលករណីជាច្រើននៃការខ្ចាត់ខ្ចាយ - ភាគល្អិតត្រឡប់មកវិញ ... " ។ នេះជាព្រឹត្តិការណ៍មិនគួរឲ្យជឿបំផុតដែលបានកើតឡើងក្នុងជីវិតរបស់ខ្ញុំ។ វាស្ទើរតែមិនគួរឱ្យជឿដូចជាអ្នកបាញ់សំបកទំហំ 15 អ៊ីងដាក់ក្រដាស់ជូតមាត់ ហើយវាលោតចេញពីវាមកបុកអ្នក។ ក្នុងការវិភាគនេះ ខ្ញុំបានដឹងថា ការខ្ចាត់ខ្ចាយថយក្រោយបែបនេះត្រូវតែជាលទ្ធផលនៃការប៉ះទង្គិចគ្នាតែមួយ ហើយបន្ទាប់ពីធ្វើការគណនា ខ្ញុំបានឃើញថា វាមិនអាចទៅរួចនោះទេ លុះត្រាតែគេសន្មត់ថា ម៉ាស់អាតូមភាគច្រើនលើសលប់ត្រូវបានប្រមូលផ្តុំនៅក្នុង ស្នូលតូចមួយ។ នោះហើយជាពេលដែលខ្ញុំបានបង្កើតគំនិតអំពីអាតូមមួយដែលមានមជ្ឈមណ្ឌលដ៏តូចមួយដែលបន្ទុកត្រូវបានប្រមូលផ្តុំ»។ ចូរយើងបន្ថែមដោយខ្លួនឯងថាពាក្យ "ការខ្ចាត់ខ្ចាយថយក្រោយ" ពិតជាមានន័យថាការខ្ចាត់ខ្ចាយដោយ 150 ដឺក្រេ ការខ្ចាត់ខ្ចាយនៅមុំធំមិនអនុញ្ញាតឱ្យមានការសង្កេតដោយការរចនានៃការដំឡើងដែលបានប្រើនៅពេលនោះទេ។
ដ្យាក្រាមគំនូសតាងនៃការពិសោធន៍របស់ Rutherford ត្រូវបានបង្ហាញនៅក្នុងរូបភព។ ៣.១២. ដ្យាក្រាមនៃការដំឡើងពិតប្រាកដអាចត្រូវបានរកឃើញនៅក្នុងសៀវភៅដោយ J. Trigg ដែលបានលើកឡើងខាងលើ។

អង្ករ។ ៣.១២. គ្រោងការណ៍នៃការពិសោធន៍បំបែករបស់ Rutherford - ភាគល្អិត
វីដេអូ 3.3 ។ ការពិសោធន៍ពេញលក្ខណៈរបស់ Rutherford ក្នុងការរៀបចំមន្ទីរពិសោធន៍។វីដេអូ 3.4 ។ បទពិសោធន៍របស់ Rutherford "ពីខាងក្នុង" (ការរៀបចំមន្ទីរពិសោធន៍)។ វីដេអូ 3.5 ។ គំរូកុំព្យូទ័រនៃបទពិសោធន៍របស់ Rutherford ។ពីប្រភពវិទ្យុសកម្មដែលរុំព័ទ្ធក្នុងធុងសំណ ភាគល្អិតត្រូវបានតម្រង់ទៅលើក្រដាសស្តើង ចពីលោហៈដែលត្រូវបានសាកល្បង។ ភាគល្អិតដែលខ្ចាត់ខ្ចាយបានធ្លាក់លើអេក្រង់ដែលគ្របដណ្ដប់ដោយស្រទាប់គ្រីស្តាល់ស័ង្កសីស៊ុលហ្វីត ដែលមានសមត្ថភាពបញ្ចេញពន្លឺនៅពេលប៉ះដោយភាគល្អិតដែលសាកលឿន។ ពន្លឺ (ពន្លឺ) នៅលើអេក្រង់ត្រូវបានសង្កេតដោយភ្នែកដោយប្រើមីក្រូទស្សន៍។ ការសង្កេតនៃភាគល្អិតដែលនៅរាយប៉ាយនៅក្នុងការពិសោធន៍របស់ Rutherford អាចត្រូវបានអនុវត្តនៅមុំផ្សេងគ្នាទៅនឹងទិសដៅដើមនៃធ្នឹម។ វាត្រូវបានគេរកឃើញថាភាគល្អិតភាគច្រើនបានឆ្លងកាត់ស្រទាប់ស្តើងនៃលោហៈជាមួយនឹងការផ្លាតតិចតួចឬគ្មាន។ ទោះជាយ៉ាងណាក៏ដោយផ្នែកតូចមួយនៃភាគល្អិតត្រូវបានផ្លាតនៅមុំសំខាន់លើសពី 30°- តួនៃទំហំតូច បើប្រៀបធៀបទៅនឹងអាតូម ដែលបន្ទុកវិជ្ជមានទាំងអស់ និងស្ទើរតែទាំងអស់នៃម៉ាស់របស់វាត្រូវបានប្រមូលផ្តុំ។ វិមាត្រនៃស្នូលត្រូវបានប៉ាន់ប្រមាណដោយ E. Rutherford ក្នុងឆ្នាំ 1911 ការប៉ាន់ស្មានគឺតិចជាង ឬតាមលំដាប់នៃ .
វីដេអូ 3.6 ។ ប៉ារ៉ាម៉ែត្រផលប៉ះពាល់ និងរូបរាងគន្លង។
វីដេអូ 3.7 ។ បន្ទុកនៃភាគល្អិតដែលខ្ចាត់ខ្ចាយ និងរូបរាងនៃគន្លង។

វីដេអូ 3.8 ។ ថាមពលនៃភាគល្អិតដែលខ្ចាត់ខ្ចាយ និងរូបរាងនៃគន្លង។
វីដេអូ 3.9 ។ បន្ទុកនុយក្លេអ៊ែរ និងរូបរាងគន្លង។

អង្ករ។ ៣.១៣. ដ្យាក្រាមនៃភាគល្អិតអាល់ហ្វាដែលខ្ចាត់ខ្ចាយនៅលើស្នូលនៃអាតូមមាស
អង្ករ។ ៣.១៤. គ្រោងការណ៍នៃការខ្ចាត់ខ្ចាយនៃភាគល្អិតអាល់ហ្វានៅក្នុងក្រដាសមាសស្តើង គំរូភពនៃអាតូមអ៊ីដ្រូសែនបានលេចចេញមក៖ ប្រូតុងដែលមានអេឡិចត្រុងនៅក្នុងគន្លង។ អ្នករូបវិទ្យាចូលចិត្តគំរូបង្រួបបង្រួម ប៉ុន្តែនៅទីនេះ ធំត្រូវបានធ្វើម្តងទៀតយ៉ាងស្រស់ស្អាតនៅក្នុងអាតូមតូច - ប្រព័ន្ធព្រះអាទិត្យ។អង្ករ។ ៣.១៥. ដ្យាក្រាមនៃគំរូនុយក្លេអ៊ែររបស់ Rutherford (ភព) នៃអាតូម


បញ្ហាគឺថា អេឡិចត្រុងដំណើរការកម្រិតកំណត់ ហើយដូច្នេះបង្កើនល្បឿន ចលនានៅជិតស្នូលត្រូវតែធ្លាក់មកលើស្នូល។ ការពិតគឺថាអេឡិចត្រុងត្រូវបានចោទប្រកាន់ហើយជាមួយនឹងចលនាបង្កើនល្បឿនត្រូវតែបញ្ចេញវិទ្យុសកម្មអេឡិចត្រូម៉ាញ៉េទិច ពោលគឺចលនាស្ថានីគឺមិនអាចទៅរួចទេ។ អេឡិចត្រូឌីណាមិកបុរាណព្យាករណ៍ថា ដោយបាត់បង់ថាមពល និងសន្ទុះមុំនៃចលនាគន្លងយ៉ាងលឿន អេឡិចត្រុងគួរតែធ្លាក់ទៅលើស្នូលក្នុងរយៈពេលប្រហែល . ក្នុងអំឡុងពេលនេះពន្លឺធ្វើដំណើរជុំវិញ
1.5 សង់ទីម៉ែត្រ
(វាប្រែថាយើងឃើញតែអាតូម "ស្លាប់" ប៉ុន្តែនេះមិនមែនដូច្នោះទេ!) Rutherford បានយល់ពីបញ្ហានេះ ប៉ុន្តែដោយចេតនាផ្តោតទៅលើការពិតនៃអត្ថិភាពនៃស្នូល ដោយជឿថាសំណួរនៃស្ថេរភាពនៃអាតូមនឹងត្រូវបានដោះស្រាយដោយការសិក្សាអំពីអាកប្បកិរិយារបស់អេឡិចត្រុងអាតូម។ នេះត្រូវបានកំណត់ថាត្រូវធ្វើនៅក្នុងឆ្នាំ 1913 ដោយ N. Bohr ដែលបានស្នើទ្រឹស្តីថ្មីនៃអាតូម។
អង្ករ។ ៣.១៦. អស្ថិរភាពនៃគំរូ Rutherford នៃអាតូម

ការណែនាំរបស់ Bohr
សេចក្តីថ្លែងការណ៍ដំបូងរបស់ Bohr
នៅទីនេះយើងអាចមើលឃើញការណែនាំ "បង្ខំ" នៃភាពមិនច្បាស់លាស់ (មិនមែនគ្រប់គន្លងទាំងអស់ត្រូវបានអនុញ្ញាតទេ) ក៏ដូចជារូបវិទ្យាធម្មតា "ការបោសសំអាតបញ្ហានៅក្រោមកម្រាលព្រំ"៖ ប្រសិនបើគ្មានការពន្យល់សម្រាប់អ្វីមួយទេ ពួកគេយកវាទៅសិក្សា។ លទ្ធផលដោយសង្ឃឹមថាថ្ងៃណាមួយពួកគេនឹងយល់ និងហេតុផល។

អង្ករ។ ៣.១៧. រូបភាពនៃ postulate ដំបូងរបស់ Bohr
ប្រកាសទីពីររបស់ Bohr
postulate នេះឆ្លុះបញ្ចាំងពីការអភិរក្សថាមពល និងទំនាក់ទំនង Planck-Einstein ។
អង្ករ។ ៣.១៨. រូបភាពសម្រាប់ប្រកាសទីពីររបស់ Bohr
ប្រកាសទីបីរបស់ Bohr ħ មានវិមាត្រនៃសន្ទុះមុំ និងរួមជាមួយនឹងបន្ទុកនៃអេឡិចត្រុង អ៊ីនិងម៉ាសរបស់វា។ មអនុញ្ញាតឱ្យអ្នកបង្កើតប៉ារ៉ាម៉ែត្រវិមាត្រប្រវែង។ នេះនាំឱ្យមានសមត្ថភាពក្នុងការគណនាទំហំនៃអាតូមមួយ។

អង្ករ។ ៣.១៩. Niels Henrik David Bohr (១៨៨៥-១៩៦២)
ការអនុវត្តនៃ postulates របស់ Bohr
មេកានិចបុរាណសម្រាប់អេឡិចត្រុងដែលបង្វិលក្នុងគន្លងរាងជារង្វង់នៃកាំ រក្នុងល្បឿន vជុំវិញស្នូលមួយដែលមានបន្ទុក ហ្សេ, ផ្តល់សមីការនៃចលនា


ដូច្នេះថាមពល អ៊ីនិងសន្ទុះមុំ អិលអេឡិចត្រុងត្រូវបានបង្ហាញក្នុងន័យនៃកាំគន្លង រ:

ប្រសិនបើលក្ខខណ្ឌបរិមាណរបស់ Bohr ត្រូវបានអនុវត្តចំពោះកន្សោមចុងក្រោយ L=nħ (n=1, 2, 3, …) បន្ទាប់មកលទ្ធផលខាងក្រោមនឹងទទួលបាន។

អង្ករ។ ៣.២០. គំរូអាតូម Bohr
លក្ខណៈនៃអាតូមដូចអ៊ីដ្រូសែន
រ៉ាឌីនៃគន្លងដែលអនុញ្ញាត
|
|
ថាមពលនៃអេឡិចត្រុងនៅក្នុងគន្លងស្ថានី
ថេរ កIN,
មានវិមាត្រនៃប្រវែងត្រូវបានគេហៅថា កាំ Bohr៖ ![]() . អត្ថន័យនៃលេខ -
ចំនួនគន្លងដែលត្រូវបានអនុញ្ញាត។ កាំ Bohr -
កាំនៃគន្លងទាបបំផុតនៅក្នុងអាតូមអ៊ីដ្រូសែន។
. អត្ថន័យនៃលេខ -
ចំនួនគន្លងដែលត្រូវបានអនុញ្ញាត។ កាំ Bohr -
កាំនៃគន្លងទាបបំផុតនៅក្នុងអាតូមអ៊ីដ្រូសែន។
រូបមន្ត (3.3) កំណត់ ដាច់ តម្លៃថាមពលដែលអេឡិចត្រុងអាចមាននៅក្នុងអាតូមអ៊ីដ្រូសែន ឬដូចដែលពួកគេនិយាយ កម្រិតថាមពល។ តម្លៃអវិជ្ជមានត្រូវគ្នាទៅនឹងស្ថានភាពចងនៃអេឡិចត្រុងនៅក្នុងអាតូម ពោលគឺចលនានៅក្នុងតំបន់ដែលមានកំណត់នៃលំហ (អាណាឡូកក្នុងរូបវិទ្យាបុរាណ - ចលនានៃភពនៅតាមរាងអេលីប ដែលផ្ទុយទៅនឹងគន្លងអ៊ីពែរបូល និងប៉ារ៉ាបូល ដែលឈានទៅរកភាពគ្មានកំណត់)។
នៅពេលដោះស្រាយបញ្ហាអំពីឥរិយាបទរបស់អេឡិចត្រុងនៅក្នុងអាតូម កន្សោមជាធម្មតាកើតឡើងដែលរួមបញ្ចូលការ៉េនៃបន្ទុកអគ្គីសនីរបស់អេឡិចត្រុងនៅក្នុងការរួមបញ្ចូលគ្នាជាមួយថេរអគ្គិសនី។ វាមានសារៈប្រយោជន៍ណាស់ក្នុងការណែនាំការរួមផ្សំគ្នាដែលគ្មានវិមាត្រនៃថេរពិភពលោកជាមូលដ្ឋាន - អ្វីដែលគេហៅថា រចនាសម្ព័ន្ធល្អថេរ:
|
|
ដែលរួមជាមួយនឹងចំនួនអាតូមិក និងចំនួនគន្លង កំណត់មាត្រដ្ឋាននៃឥទ្ធិពលពឹងផ្អែកនៅក្នុងអាតូម។ ដើម្បីឱ្យកាន់តែច្បាស់ អនុញ្ញាតឱ្យយើងសរសេររូបមន្ត (3.3) ឡើងវិញដើម្បីឱ្យផ្នែកខាងស្តាំរបស់វារួមបញ្ចូលរចនាសម្ព័ន្ធដ៏ល្អថេរ៖
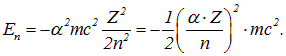
ដោយសារតែមេគុណ ថាមពលលក្ខណៈនៃអាតូមមួយប្រែទៅជាលំដាប់បួននៃរ៉ិចទ័រតិចជាងថាមពលដែលនៅសល់របស់អេឡិចត្រុង។ នេះគឺជាការបង្ហាញពីភាពមិនទាក់ទងគ្នានៃប្រព័ន្ធអាតូមិចពន្លឺ។ ដូចដែលអាចត្រូវបានគេមើលឃើញពីកន្សោមចុងក្រោយនៅក្នុងរូបមន្តខាងលើ ឥទ្ធិពលដែលទាក់ទងគ្នាឈប់ជាការកែតម្រូវតិចតួចសម្រាប់អេឡិចត្រុងដែលនៅជិតបំផុតទៅនឹងស្នូលនៅក្នុងអាតូមធ្ងន់។
ឧទាហរណ៍ ១.អនុញ្ញាតឱ្យយើងកំណត់ល្បឿននៃអេឡិចត្រុងដោយ នគន្លងនៃអាតូម Bohr ។ កាំ ទីគន្លងត្រូវបានកំណត់ដោយរូបមន្ត
កន្លែងណា មួយ ខ- កាំ Bohr ។ ល្បឿនអេឡិចត្រុង vអាចត្រូវបានបញ្ជាក់នៅក្នុងលក្ខខណ្ឌនៃសន្ទុះមុំ L=nħ៖

អនុញ្ញាតឱ្យយើងសម្រួលកន្សោមសម្រាប់កាំ Bohr ដោយប្រើថេររចនាសម្ព័ន្ធដ៏ល្អដែលបានណែនាំ៖
|
|
ការជំនួសកន្សោមនេះទៅក្នុងរូបមន្តខាងលើសម្រាប់ល្បឿនអេឡិចត្រុង យើងទទួលបានសម្រាប់ នទី គន្លង
អង្ករ។ ៣.២១. ដ្យាក្រាមនៃកម្រិតថាមពល និងការផ្លាស់ប្តូរនៅក្នុងអាតូមអ៊ីដ្រូសែន យោងតាមទ្រឹស្តីរបស់ Bohr៖
បន្ទាត់រឹង (ការផ្លាស់ប្តូរពីកំពូលទៅបាត) - ការបំភាយ, បន្ទាត់ចំនុច (ការផ្លាស់ប្តូរពីបាតទៅកំពូល) - ការស្រូបយក។
ព្រំដែន (ដែនកំណត់) នៃស៊េរីត្រូវបានបង្ហាញ ![]() ដែលត្រូវនឹងការផ្លាស់ប្តូរពីកម្រិត គ
ដែលត្រូវនឹងការផ្លាស់ប្តូរពីកម្រិត គ
- ព្រំដែនរវាងវិសាលគមបន្ត និងវិសាលគមដាច់ពីគ្នា។
សេចក្តីថ្លែងការណ៍របស់ Bohr អំពីភាពមិនច្បាស់លាស់នៃវិសាលគមថាមពលនៃអាតូមត្រូវបានបញ្ជាក់ដោយពិសោធន៍នៅក្នុងការពិសោធន៍ Frank-Hertz ដែលមានការបំផ្ទុះចំហាយបារតជាមួយអេឡិចត្រុងនៅក្នុងបំពង់ខ្វះចន្លោះ និងការវាស់ស្ទង់ភាពអាស្រ័យនៃចរន្ត anode លើភាពខុសគ្នាសក្តានុពលដែលបង្កើនល្បឿន។ ដ្យាក្រាមពិសោធន៍ត្រូវបានបង្ហាញក្នុងរូប។ ៣.២២.

អង្ករ។ ៣.២២. គ្រោងការណ៍ពិសោធន៍របស់ Frank - ហឺត
នៅក្នុងបំពង់មួយដែលពោរពេញទៅដោយចំហាយបារតនៅក្រោមសម្ពាធទាប (ប្រហែល 1 mm Hg) មានអេឡិចត្រូតបីគឺ anode មួយ cathode និងក្រឡាចត្រង្គមួយ។ អេឡិចត្រុងដែលគេចចេញពីផ្ទៃនៃ cathode ដែលគេឱ្យឈ្មោះថា ដោយសារតែការបំភាយកំដៅត្រូវបានបង្កើនល្បឿនដោយវ៉ុល។ យូ, បានអនុវត្តរវាង cathode និងក្រឡាចត្រង្គ។ វ៉ុលនេះអាចត្រូវបានផ្លាស់ប្តូរដោយប្រើ potentiometer ទំ. វាលបញ្ច្រាសខ្សោយជាមួយនឹងភាពខុសគ្នាសក្តានុពលនៃលំដាប់នៃរ៉ិចទ័រត្រូវបានអនុវត្តរវាង anode និងក្រឡាចត្រង្គ 0.5BBរារាំងចលនារបស់អេឡិចត្រុងទៅ anode ។ ភាពអាស្រ័យនៃចរន្តត្រូវបានកំណត់ ខ្ញុំនៅក្នុងសៀគ្វី anode ពីវ៉ុលដែលបានអនុវត្ត យូ. លទ្ធផលដែលទទួលបានត្រូវបានបង្ហាញនៅក្នុងរូបភព។ ៣.២៣.

អង្ករ។ ៣.២៣. ការពឹងផ្អែកនៃចរន្ត I នៅក្នុងសៀគ្វី anode លើវ៉ុលដែលបានអនុវត្ត U នៅក្នុងការពិសោធន៍ Frank-Hertz
ចរន្តចាប់ផ្តើមកើនឡើងដោយឯកឯង និងឈានដល់អតិបរមានៅវ៉ុល ៤.៩ វបន្ទាប់ពីនោះជាមួយនឹងការលូតលាស់ យូធ្លាក់ចុះយ៉ាងខ្លាំង ឈានដល់កម្រិតអប្បបរមា ហើយចាប់ផ្តើមកើនឡើងម្តងទៀត។ អតិបរមាបច្ចុប្បន្នត្រូវបានធ្វើម្តងទៀតនៅវ៉ុល ៩.៨ វ, ១៤.៧ វល. ការឆ្លាស់គ្នានៃ maxima នៅចម្ងាយស្មើគ្នាពីគ្នាទៅវិញទៅមកបានបង្ហាញពីលក្ខណៈដាច់ពីគ្នានៃការផ្លាស់ប្តូរថាមពលនៃអាតូម។
វីដេអូ 3.10 ។ បទពិសោធន៍របស់ Frank និង Hertz ។ ការដំឡើងការបង្ហាញ។
វីដេអូ 3.11 ។ បទពិសោធន៍របស់ Frank និង Hertz ។ ការប្រៀបធៀបលក្ខណៈនៃចរន្ត - វ៉ុលសម្រាប់អ៊ីយូតានិងអេលីយ៉ូម។ វីដេអូ 3.12 ។ បទពិសោធន៍របស់ Frank និង Hertz ។ ការរៀបចំមន្ទីរពិសោធន៍ 1. វីដេអូ 3.12 ។ បទពិសោធន៍របស់ Frank និង Hertz ។ ការរៀបចំមន្ទីរពិសោធន៍ ២.ចំនួនអាតូមនៃធាតុគឺជាចំនួនគត់ ដូច្នេះបន្ទាប់ពីបង្គត់យើងទទួលបាន
Z=2 ននិង kដែលត្រូវនឹងអេលីយ៉ូម។ ន និង kនៅតែត្រូវតែជាចំនួនគត់ ហើយតម្លៃពាក់កណ្តាលចំនួនគត់ជាក់ស្តែងអាចពន្យល់ខុសគ្នា។ ជាការពិតពីរូបមន្ត (3.6) សម្រាប់ប្រេកង់ដែលបញ្ចេញដោយអាតូមដូចអ៊ីដ្រូសែន វាធ្វើតាមថា

នោះគឺបន្ទាត់ដែលបានសង្កេតជាកម្មសិទ្ធិរបស់អ៊ីយ៉ុងនៃធាតុជាមួយ វីដេអូ 3.12 ។ បទពិសោធន៍របស់ Frank និង Hertz ។ ការរៀបចំមន្ទីរពិសោធន៍ 1. វីដេអូ 3.12 ។ បទពិសោធន៍របស់ Frank និង Hertz ។ ការរៀបចំមន្ទីរពិសោធន៍ ២.. ដូចដែលអ្នកបានដឹងហើយថាធាតុនេះមានឈ្មោះ "ព្រះអាទិត្យ" - អេលីយ៉ូម។
អត្ថិភាពនៃកម្រិតថាមពលដាច់ពីគ្នា គឺជាទ្រព្យសម្បត្តិមូលដ្ឋាននៃអាតូម (ក៏ដូចជាម៉ូលេគុល និងស្នូលអាតូម)។
ចូរយើងព្យាយាមអនុវត្តច្បាប់នៃរូបវិទ្យាដែលយើងស្គាល់ ដើម្បីស្រមៃមើលរចនាសម្ព័ន្ធនៃអាតូម ដែលពន្យល់ពីភាពមិនច្បាស់លាស់នៃកម្រិតថាមពលរបស់វា។
តោះពិចារណាអាតូមសាមញ្ញបំផុត - អាតូមអ៊ីដ្រូសែន។ ចំនួនអាតូមនៃអ៊ីដ្រូសែននៅក្នុងតារាងតាមកាលកំណត់នៃធាតុគឺស្មើនឹងមួយ ដូច្នេះអាតូមអ៊ីដ្រូសែនមានស្នូលវិជ្ជមាន បន្ទុកដែលស្មើនឹង , និងអេឡិចត្រុងមួយ។ រវាងស្នូល និងអេឡិចត្រុង មានកម្លាំងទាក់ទាញរវាងការចោទប្រកាន់។ វត្តមានរបស់កម្លាំងនេះផ្តល់នូវការបង្កើនល្បឿន radial (centripetal) ដោយសារតែអេឡិចត្រុងពន្លឺមួយបង្វិលជុំវិញស្នូលធ្ងន់ក្នុងគន្លងរាងជារង្វង់ ឬរាងអេលីប ក្នុងវិធីដូចគ្នានឹងភពមួយដែលបង្វិលជុំវិញព្រះអាទិត្យក្រោមឥទ្ធិពលនៃទំនាញផែនដី។ ដូច្នេះ ស្ថានភាពផ្សេងគ្នានៃអាតូមត្រូវគ្នាទៅនឹងភាពខុសគ្នានៃទំហំ (និងរូបរាង) នៃគន្លងនៃអេឡិចត្រុងដែលបង្វិលជុំវិញស្នូល។
ថាមពលនៃអេឡិចត្រុងនៅក្នុងអាតូមមួយត្រូវបានផ្សំឡើងដោយថាមពល kinetic នៃចលនានៅក្នុងគន្លងរបស់វា និងថាមពលសក្តានុពលនៅក្នុងវាលអគ្គិសនីនៃស្នូល។ វាអាចត្រូវបានបង្ហាញ (សូមមើលនៅចុងបញ្ចប់នៃកថាខណ្ឌ) ថាថាមពលនៃអេឡិចត្រុងនៅក្នុងគន្លងរាងជារង្វង់ ហើយដូច្នេះថាមពលនៃអាតូមទាំងមូលគឺអាស្រ័យលើកាំនៃគន្លង៖ កាំតូចជាងនៃគន្លងត្រូវគ្នា ទៅថាមពលតូចជាងនៃអាតូម។ ប៉ុន្តែដូចដែលយើងបានឃើញនៅក្នុង§ 204 ថាមពលនៃអាតូមមួយមិនអាចទទួលយកបានឡើយ ប៉ុន្តែមានតែតម្លៃមួយចំនួនដែលបានជ្រើសរើសប៉ុណ្ណោះ។ ដោយសារថាមពលត្រូវបានកំណត់ដោយកាំនៃគន្លង កម្រិតថាមពលនីមួយៗនៃអាតូមត្រូវគ្នាទៅនឹងគន្លងនៃកាំដែលបានជ្រើសរើសជាក់លាក់មួយ។
រូបភាពនៃគន្លងរាងជារង្វង់ដែលអាចធ្វើទៅបាននៃអេឡិចត្រុងនៅក្នុងអាតូមអ៊ីដ្រូសែនត្រូវបានបង្ហាញនៅក្នុងរូបភព។ 367. កម្រិតថាមពលសំខាន់នៃអាតូមមួយត្រូវគ្នាទៅនឹងគន្លងនៃកាំតូចបំផុត។

អង្ករ។ 367. គន្លងដែលអាចធ្វើបាននៃអេឡិចត្រុងនៅក្នុងអាតូមអ៊ីដ្រូសែន: កាំនៃគន្លងកើនឡើងក្នុងសមាមាត្រទៅនឹង , i.e. នៅក្នុងទំនាក់ទំនង។ល។
ជាធម្មតាអេឡិចត្រុងស្ថិតនៅក្នុងគន្លងនេះ។ នៅពេលដែលផ្នែកធំគ្រប់គ្រាន់នៃថាមពលត្រូវបានចែកចាយ អេឡិចត្រុងផ្លាស់ទីទៅកម្រិតថាមពលមួយផ្សេងទៀត ពោលគឺ "លោត" ទៅកាន់គន្លងខាងក្រៅមួយ។ ដូចដែលបានបង្ហាញ នោះអាតូមមិនស្ថិតស្ថេរក្នុងស្ថានភាពរំភើប។ បន្ទាប់ពីពេលខ្លះ អេឡិចត្រុងផ្លាស់ទីទៅកម្រិតទាប ពោលគឺ "លោត" ទៅគន្លងនៃកាំតូចជាង។ ការផ្លាស់ប្តូរនៃអេឡិចត្រុងពីគន្លងឆ្ងាយមួយទៅជិតមួយត្រូវបានអមដោយការបំភាយនៃពន្លឺ quantum ។
ដូច្នេះ ពីគំរូនុយក្លេអ៊ែរនៃអាតូម និងភាពមិនច្បាស់លាស់នៃកម្រិតថាមពលរបស់វា អត្ថិភាពនៃគន្លងអេឡិចត្រុងដែលបានជ្រើសរើស "អនុញ្ញាត" នៅក្នុងអាតូមដូចខាងក្រោម។ សំណួរកើតឡើងថាហេតុអ្វីបានជាអេឡិចត្រុងមិនអាចបង្វិលជុំវិញស្នូលក្នុងគន្លងនៃកាំដែលបំពាន។ តើអ្វីជាភាពខុសគ្នារវាងគន្លងដែលអនុញ្ញាត និងគ្មានការអនុញ្ញាត?
ច្បាប់នៃមេកានិច និងអគ្គិសនី ដែលធ្លាប់ស្គាល់យើងពីផ្នែកមុននៃសៀវភៅសិក្សា (សូមមើលភាគ I, II) មិនផ្តល់ចម្លើយចំពោះសំណួរទាំងនេះទេ។ តាមទស្សនៈនៃច្បាប់ទាំងនេះ គន្លងទាំងអស់គឺស្មើគ្នាទាំងស្រុង។ អត្ថិភាពនៃគន្លងឧទ្ទិសផ្ទុយនឹងច្បាប់ទាំងនេះ។
ភាពផ្ទុយគ្នាដ៏គួរឱ្យចាប់អារម្មណ៍ស្មើភាពគ្នាទៅនឹងច្បាប់នៃរូបវិទ្យាដែលគេស្គាល់យើងគឺស្ថេរភាពនៃអាតូម (នៅក្នុងស្ថានភាពដី) ។ យើងដឹងថាបន្ទុកណាមួយដែលផ្លាស់ទីជាមួយនឹងការបង្កើនល្បឿនបញ្ចេញរលកអេឡិចត្រូម៉ាញ៉េទិច។ វិទ្យុសកម្មអេឡិចត្រូម៉ាញេទិកដកថាមពល។ នៅក្នុងអាតូមមួយ អេឡិចត្រុងមួយផ្លាស់ទីក្នុងល្បឿនលឿនក្នុងគន្លងនៃកាំតូចមួយ ហើយដូច្នេះវាមានល្បឿនកណ្តាលដ៏ធំ។ យោងទៅតាមច្បាប់ដែលយើងដឹង អេឡិចត្រុងត្រូវតែបាត់បង់ថាមពលដោយបញ្ចេញវាក្នុងទម្រង់ជារលកអេឡិចត្រូម៉ាញេទិច។ ប៉ុន្តែ ដូចដែលបានបញ្ជាក់ខាងលើ ប្រសិនបើអេឡិចត្រុងបាត់បង់ថាមពល កាំនៃគន្លងរបស់វាថយចុះ។ អាស្រ័យហេតុនេះ អេឡិចត្រុងមិនអាចបង្វិលក្នុងគន្លងនៃកាំថេរបានទេ។ ការគណនាបង្ហាញថា ជាលទ្ធផលនៃការថយចុះនៃកាំនៃគន្លងដោយសារវិទ្យុសកម្ម អេឡិចត្រុងនឹងត្រូវធ្លាក់ទៅលើស្នូលក្នុងរយៈពេលមួយរយលានវិនាទី។ ការសន្និដ្ឋាននេះផ្ទុយស្រឡះពីបទពិសោធន៍ប្រចាំថ្ងៃរបស់យើង ដែលបង្ហាញពីស្ថេរភាពនៃអាតូម។
ដូច្នេះ មានភាពផ្ទុយគ្នារវាងទិន្នន័យស្តីពីរចនាសម្ព័ន្ធនៃអាតូមដែលទទួលបានពីការពិសោធន៍ និងរវាងច្បាប់ជាមូលដ្ឋាននៃមេកានិច និងអគ្គិសនី ត្រូវបានរកឃើញដោយពិសោធន៍ផងដែរ។
ប៉ុន្តែយើងមិនគួរភ្លេចថាច្បាប់ដែលបានរៀបរាប់ត្រូវបានរកឃើញ និងសាកល្បងនៅក្នុងការពិសោធន៍ជាមួយសាកសពដែលមានចំនួនអេឡិចត្រុងច្រើន និងអាតូមមួយចំនួនធំ។ យើងមិនមានហេតុផលដើម្បីជឿថាច្បាប់ទាំងនេះអនុវត្តចំពោះចលនានៃអេឡិចត្រុងបុគ្គលនៅក្នុងអាតូមមួយ។ លើសពីនេះទៅទៀត ភាពខុសគ្នារវាងឥរិយាបទរបស់អេឡិចត្រុងនៅក្នុងអាតូម និងច្បាប់នៃរូបវិទ្យាបុរាណបង្ហាញពីភាពមិនអាចអនុវត្តបាននៃច្បាប់ទាំងនេះចំពោះបាតុភូតអាតូម (សូមមើលផងដែរ § 210) ។
ខាងលើយើងបានគូសបញ្ជាក់នូវអ្វីដែលហៅថា គំរូភពនៃអាតូម ពោលគឺឧ។ គំនិតនៃអេឡិចត្រុងបង្វិលក្នុងគន្លងដែលត្រូវបានអនុញ្ញាតជុំវិញស្នូលអាតូមិច។ នៅពេលដែលបង្ហាញពីភាពត្រឹមត្រូវនៃគំរូភព យើងបានប្រើច្បាប់នៃរូបវិទ្យាបុរាណ។ ប៉ុន្តែ ដូចដែលបានកត់សម្គាល់រួចហើយ និងដូចដែលយើងនឹងឃើញលម្អិតនៅក្នុង§ 210 ចលនានៃអេឡិចត្រុងនៅក្នុងអាតូមមួយ ជាកម្មសិទ្ធិរបស់វាលនៃបាតុភូតដែលមេកានិចបុរាណមិនអាចអនុវត្តបាន។ ដូច្នេះហើយ វាមិនមែនជារឿងគួរឱ្យភ្ញាក់ផ្អើលទេដែលការសិក្សាស៊ីជម្រៅអំពី "មីក្រូវើល" បានបង្ហាញភាពមិនពេញលេញ និងការប៉ាន់ស្មានរដុបនៃគំរូភព។ រូបភាពពិតនៃអាតូមគឺស្មុគស្មាញជាង។ ទោះជាយ៉ាងណាក៏ដោយ គំរូនេះឆ្លុះបញ្ចាំងយ៉ាងត្រឹមត្រូវនូវលក្ខណៈសម្បត្តិជាមូលដ្ឋានជាច្រើនរបស់អាតូម ដូច្នេះហើយ ទោះបីជាមានការប្រហាក់ប្រហែលរបស់វាក៏ដោយ ពេលខ្លះវាត្រូវបានគេប្រើ។
ចូរយើងពិចារណាពីការពឹងផ្អែកនៃថាមពលនៃអាតូមអ៊ីដ្រូសែននៅលើកាំនៃគន្លងអេឡិចត្រុង។ យើងកំណត់ថាមពល kinetic នៃចលនាអេឡិចត្រុងតាមគន្លងនៃកាំពីលក្ខខណ្ឌដែលការបង្កើនល្បឿននៅកណ្តាលត្រូវបានផ្តល់ដោយកម្លាំងនៃការទាក់ទាញ coulomb នៃការចោទប្រកាន់ (នៅក្នុងប្រព័ន្ធ SI) ។ ស្មើនឹងការបង្កើនល្បឿនដែលបង្កើតឡើងដោយកម្លាំងនេះទៅនឹងការបង្កើនល្បឿន centripetal យើងឃើញថាថាមពល kinetic នៃអេឡិចត្រុងគឺសមាមាត្រច្រាសទៅនឹងកាំនៃគន្លងពោលគឺឧ។ ![]() .
.
ចូរយើងជ្រើសរើសគន្លងពីរនៃកាំ និង . ថាមពល kinetic នៃការបង្វិលអេឡិចត្រុងនៅក្នុងគន្លងទីពីរគឺធំជាងនៅក្នុងទីមួយដោយបរិមាណមួយ។  .
.
ប្រសិនបើគន្លងមិនឆ្ងាយពីគ្នានោះទេ។ ដូច្នេះបរិមាណនៅក្នុងភាគបែងអាចត្រូវបានគេមិនយកចិត្តទុកដាក់ ហើយភាពខុសគ្នានៃថាមពល kinetic នឹងមានចំនួនប្រហាក់ប្រហែល។
ថាមពលសក្តានុពលនៃអេឡិចត្រុងផ្ទុយទៅវិញគឺធំជាងនៅក្នុងគន្លងឆ្ងាយដំបូងព្រោះដើម្បីដកអេឡិចត្រុងចេញពីស៊េរីការងារត្រូវធ្វើប្រឆាំងនឹងកម្លាំងនៃការទាក់ទាញអគ្គិសនីដែលធ្វើសកម្មភាពរវាងអេឡិចត្រុងនិងស្នូល។ ការងារនេះឆ្ពោះទៅរកការបង្កើនថាមពលសក្តានុពល។
អនុញ្ញាតឱ្យអេឡិចត្រុងមួយត្រូវបានផ្ទេរពីគន្លងជិតមួយទៅចម្ងាយមួយតាមបណ្តោយផ្លូវរ៉ាឌីកាល់។ ប្រវែងផ្លូវគឺ ![]() . កម្លាំងអគ្គិសនីនៅតាមបណ្តោយផ្លូវនេះមិនស្ថិតស្ថេរក្នុងទំហំទេ។ ប៉ុន្តែចាប់តាំងពីគន្លងគឺនៅជិតគ្នាទៅវិញទៅមកសម្រាប់ការគណនាប្រហាក់ប្រហែលនៃការងារវាអាចធ្វើទៅបានដើម្បីប្រើតម្លៃនៃកម្លាំងនៅចម្ងាយមធ្យមនៃអេឡិចត្រុងពីស្នូលដែលស្មើនឹង
. កម្លាំងអគ្គិសនីនៅតាមបណ្តោយផ្លូវនេះមិនស្ថិតស្ថេរក្នុងទំហំទេ។ ប៉ុន្តែចាប់តាំងពីគន្លងគឺនៅជិតគ្នាទៅវិញទៅមកសម្រាប់ការគណនាប្រហាក់ប្រហែលនៃការងារវាអាចធ្វើទៅបានដើម្បីប្រើតម្លៃនៃកម្លាំងនៅចម្ងាយមធ្យមនៃអេឡិចត្រុងពីស្នូលដែលស្មើនឹង ![]() .
យោងតាមច្បាប់របស់ Coulomb កម្លាំងគឺ ហើយការងារនៅលើផ្លូវស្មើនឹងការកើនឡើងនៃថាមពលសក្តានុពលនឹងស្មើនឹង .
.
យោងតាមច្បាប់របស់ Coulomb កម្លាំងគឺ ហើយការងារនៅលើផ្លូវស្មើនឹងការកើនឡើងនៃថាមពលសក្តានុពលនឹងស្មើនឹង .
ដូច្នេះនៅពេលដែលអេឡិចត្រុងផ្លាស់ទីពីគន្លងឆ្ងាយទៅជិតមួយ ការថយចុះនៃថាមពលសក្តានុពលរបស់វាគឺស្មើនឹងការកើនឡើងទ្វេដងនៃថាមពល kinetic ។ យើងបានបង្ហាញទ្រឹស្ដីនេះសម្រាប់គន្លងជិត ចម្ងាយរវាងដែលបំពេញលក្ខខណ្ឌ។ ដោយការសង្ខេបការផ្លាស់ប្តូរនៃថាមពលអេឡិចត្រុងកំឡុងពេលអន្តរកាលរវាងគន្លងជិតៗជាបន្តបន្ទាប់ យើងជឿជាក់ថាទ្រឹស្តីបទនេះក៏មានសុពលភាពសម្រាប់គន្លងឆ្ងាយៗតាមអំពើចិត្តផងដែរ។
ឥឡូវនេះ ចូរយើងពិចារណាពីគន្លងដ៏ឆ្ងាយគ្មានកំណត់ ពោលគឺ អនុញ្ញាតឱ្យយើងយកថាមពលសក្តានុពលនៃអេឡិចត្រុងនៅលើវាជាការចាប់ផ្តើមនៃការរាប់ថាមពលសក្តានុពល ពោលគឺយើងដាក់ ![]() . ថាមពល Kinetic
. ថាមពល Kinetic ![]() ទៅសូន្យនៅ; នៅពេលដែលផ្លាស់ទីពីគន្លងមួយទៅគន្លងចុងក្រោយនៃកាំ វានឹងកើនឡើងដោយបរិមាណមួយ។ ថាមពលសក្តានុពលនឹងថយចុះ 2 ដងនៃបរិមាណ i.e.
ទៅសូន្យនៅ; នៅពេលដែលផ្លាស់ទីពីគន្លងមួយទៅគន្លងចុងក្រោយនៃកាំ វានឹងកើនឡើងដោយបរិមាណមួយ។ ថាមពលសក្តានុពលនឹងថយចុះ 2 ដងនៃបរិមាណ i.e.
 .(206.1)
.(206.1)
ដូច្នេះថាមពលសរុបរបស់អេឡិចត្រុងគឺស្មើនឹង ![]() ; កាំនៃគន្លងតូចជាង វាកាន់តែតូច (សញ្ញាដក!)។
; កាំនៃគន្លងតូចជាង វាកាន់តែតូច (សញ្ញាដក!)។
១៣.៧. អាតូមអ៊ីដ្រូសែន (អាតូមដូចអ៊ីដ្រូសែន) យោងតាមទ្រឹស្តីរបស់ Bohr
១៣.៧.៣. អេឡិចត្រុងវិលជុំវិញអាតូម
នេះបើយោងតាម ច្បាប់បរិមាណគន្លង ( គោលការណ៍របស់ Sommerfeld) ទំនាក់ទំនងរវាងថាមពលនៃស្ថានីនៃអេឡិចត្រុងនៅក្នុងអាតូម កាំនៃគន្លងរបស់វា និងល្បឿនក្នុងគន្លងនេះត្រូវបានផ្តល់ដោយរូបមន្ត
mvr = nℏ,
ដែល m ជាម៉ាស់អេឡិចត្រុង m = 9.11 ⋅ 10 −31 គីឡូក្រាម; v - ល្បឿនអេឡិចត្រុង; r គឺជាកាំនៃគន្លងអេឡិចត្រុង; ℏ - កាត់បន្ថយថេរ Planck, ℏ = h /2π ≈ 1.055 ⋅ 10 −34 J ⋅ s; h គឺជាថេររបស់ Planck, h = 6.626 ⋅ 10 −34 J ⋅ s; n គឺជាលេខ quantum សំខាន់។
ពីច្បាប់នៃបរិមាណនៃគន្លង វាកើតឡើងថាស្ថានភាពស្ថានីនៃអេឡិចត្រុងនៅក្នុងអាតូមមួយត្រូវគ្នាទៅនឹងគន្លងអេឡិចត្រុងដែលលក្ខខណ្ឌត្រូវបានពេញចិត្ត។
mv n r n = n ℏ,
ដែល r n គឺជាកាំនៃអេឡិចត្រុងនៅក្នុងគន្លងដែលមានលេខ n; v n - ល្បឿនអេឡិចត្រុងក្នុងគន្លងដែលមានលេខ n; m គឺជាម៉ាស់អេឡិចត្រុង m = 9.11 ⋅ 10 −31 គីឡូក្រាម; ℏ - កាត់បន្ថយថេរ Planck, ℏ = h /2π ≈ 1.055 ⋅ 10 −34 J ⋅ s; h គឺជាថេររបស់ Planck, h = 6.626 ⋅ 10 −34 J ⋅ s; n គឺជាលេខ quantum សំខាន់។
កាំនៃគន្លងអេឡិចត្រុងស្ថានី
r n = ℏ 2 n 2 k Z e 2 m ,
ដែល k = 1/4πε 0 ≈ 9 ⋅ 10 9 N ⋅ m 2 /Cl 2; ε 0 - ថេរអគ្គិសនី, ε 0 = 8.85 ⋅ 10 −12 F / m; Z - លេខស៊េរីនៃធាតុ; e ជាបន្ទុកអេឡិចត្រុង e = −1.6 ⋅ 10 −19 C; m គឺជាម៉ាស់អេឡិចត្រុង m = 9.11 ⋅ 10 −31 គីឡូក្រាម; ℏ - កាត់បន្ថយថេរ Planck, ℏ = h /2π ≈ 1.055 ⋅ 10 −34 J ⋅ s; h គឺជាថេររបស់ Planck, h = 6.626 ⋅ 10 −34 J ⋅ s; n គឺជាលេខ quantum សំខាន់។
កាំគន្លងទីមួយអេឡិចត្រុងនៅក្នុងអាតូមអ៊ីដ្រូសែន (Z = 1 និង n = 1) គឺស្មើនឹង
r 1 = ℏ 2 k e 2 m = 0.53 ⋅ 10 − 10 m
ហើយត្រូវបានគេហៅថា កាំ Bohr ដំបូង.
ដើម្បីធ្វើឱ្យការគណនាសាមញ្ញ កាំនៃគន្លងទី nអេឡិចត្រុងនៅក្នុងអាតូមដូចអ៊ីដ្រូសែន ប្រើរូបមន្ត
r (Å) = 0.53 ⋅ n 2 Z,
ដែល r (Å) ជាកាំក្នុង angstroms (1 Å = 1.0 ⋅ 10 −10 m); Z គឺជាលេខសៀរៀលនៃធាតុគីមីនៅក្នុងតារាងតាមកាលកំណត់នៃធាតុ D.I. Mendeleev; n = 1, 2, 3, … គឺជាលេខ quantum សំខាន់។
ល្បឿននៃអេឡិចត្រុងនៅក្នុងគន្លងស្ថានីនៅក្នុងអាតូមដូចអ៊ីដ្រូសែនត្រូវបានកំណត់ដោយរូបមន្ត
v n = k Z e 2 n ℏ ,
ដែល k = 1/4πε 0 ≈ 9 ⋅ 10 9 N ⋅ m 2 /Cl 2; ε 0 - ថេរអគ្គិសនី, ε 0 = 8.85 ⋅ 10 −12 F / m; Z - លេខស៊េរីនៃធាតុ; e ជាបន្ទុកអេឡិចត្រុង e = −1.6 ⋅ 10 −19 C; ℏ - កាត់បន្ថយថេរ Planck, ℏ = = h /2π ≈ 1.055 ⋅ 10 −34 J ⋅ s; h គឺជាថេររបស់ Planck, h = 6.626 ⋅ 10 −34 J ⋅ s; n គឺជាលេខ quantum សំខាន់។
ល្បឿនអេឡិចត្រុងក្នុងគន្លងទីមួយនៅក្នុងអាតូមអ៊ីដ្រូសែន (Z = 1 និង n = 1) គឺស្មើនឹង
v n = k e 2 ℏ = 2.2 ⋅ 10 6 m/s ។
ដើម្បីងាយស្រួលក្នុងការគណនាតម្លៃ ល្បឿនអេឡិចត្រុងនៅក្នុងគន្លងទី nនៅក្នុងអាតូមដូចអ៊ីដ្រូសែន រូបមន្តត្រូវបានប្រើ
v (m/s) = 2.2 ⋅ 10 6 ⋅ Z n ,
ដែល v (m/s) - ម៉ូឌុលល្បឿនក្នុង m/s; Z គឺជាលេខសៀរៀលនៃធាតុគីមីនៅក្នុងតារាងតាមកាលកំណត់នៃធាតុ D.I. Mendeleev; n = 1, 2, 3, … គឺជាលេខ quantum សំខាន់។
ឧទាហរណ៍ 21. អេឡិចត្រុងនៅក្នុងអាតូមអេលីយ៉ូមផ្លាស់ទីពីគន្លងទីមួយទៅកាន់គន្លងដែលកាំរបស់វាធំជាង 9 ដង។ ស្វែងរកថាមពលដែលស្រូបយកដោយអាតូម។
ដំណោះស្រាយ។ ថាមពលដែលស្រូបដោយអាតូមអេលីយ៉ូម គឺស្មើនឹងភាពខុសគ្នានៃថាមពល៖
∆E = E 2 − E 1 ,
ដែល E 1 គឺជាថាមពលអេឡិចត្រុងដែលត្រូវគ្នានឹងកាំគន្លង r 1 ; E 2 គឺជាថាមពលអេឡិចត្រុងដែលត្រូវនឹងកាំគន្លងគន្លង r 2 ។
ថាមពលអេឡិចត្រុងនៅក្នុងអាតូមអេលីយ៉ូម (Z = 2) ត្រូវបានកំណត់ដោយរូបមន្តដូចខាងក្រោមៈ
- នៅក្នុងស្ថានភាពដែលមានលេខ quantum សំខាន់ n 1 = 1 -
E 1 (eV) = − 13.6 Z 2 n 1 2 = − 54.4 eV;
- រដ្ឋដែលមានលេខ quantum សំខាន់ n 2 -
E 2 (eV) = − 54.4 n 2 2 .
ដើម្បីកំណត់ថាមពល E 2 យើងប្រើកន្សោមសម្រាប់កាំនៃគន្លងដែលត្រូវគ្នា៖
- សម្រាប់គន្លងដែលមានលេខ quantum សំខាន់ n 1 = 1 -
r 1 (Å) ≈ 0.53 n 1 2 Z = 0.265 Å ;
- គន្លងជាមួយលេខ quantum សំខាន់ n 2 -
r 2 (Å) ≈ 0.265 n 2 ២ .
សមាមាត្រកាំ
r 2 (Å) r 1 (Å) = 0.265 n 2 2 0.265 = n 2 2
អនុញ្ញាតឱ្យយើងកំណត់លេខ quantum សំខាន់នៃរដ្ឋទីពីរ:
n 2 = r 2 (Å) r 1 (Å) = 9 = 3,
ដែល r 2 / r 1 គឺជាសមាមាត្រនៃកាំគន្លងដែលបានបញ្ជាក់នៅក្នុងលក្ខខណ្ឌ r 2 / r 1 = 9 ។
ពីសមាមាត្រថាមពល
E 2 E 1 = 1 n 2 ២
វាធ្វើតាមថាថាមពលនៃអេឡិចត្រុងនៅក្នុងអាតូមអេលីយ៉ូមនៅក្នុងរដ្ឋទីពីរគឺ
E 2 = E 1 n 2 2 = − 54.4 eV 3 2 = − 6.04 eV ។
ថាមពលដែលស្រូបដោយអាតូមកំឡុងពេលការផ្លាស់ប្តូរដែលបានចង្អុលបង្ហាញគឺជាភាពខុសគ្នា
∆E = E 2 − E 1 = −6.04 − (−54.4) = 48.4 eV ។
អាស្រ័យហេតុនេះ ក្នុងអំឡុងពេលនៃការផ្លាស់ប្តូរដែលបានចង្អុលបង្ហាញ អាតូមបានស្រូបយកថាមពលស្មើនឹង 48.4 eV ។




