زيمونينا ليودميلا بافلوفنا
موضوع الدرس " الخصائص العامةغير المعادن" أهداف الدرس:- خذ بعين الاعتبار موقع العناصر غير المعدنية في PS لـ D.I Mendeleev وخصائصها الهيكل الإلكتروني. مراجعة مفاهيم السالبية الكهربية (EO) والتآصل.
تقدم الدرس.
أنا اللحظة التنظيمية مقدمة للموضوع. على الرغم من أن عدد اللافلزات أقل بكثير من عدد المعادن، إلا أنه يتم تخصيص وقت أطول لدراسة كيمياءها أكثر من المعادن. خطة الدرس.- موقف اللافلزات في PS D.I Mendeleev. ملامح التركيب الذري للعناصر غير المعدنية. مميزة مواد بسيطة-غير المعادن. التآصل.
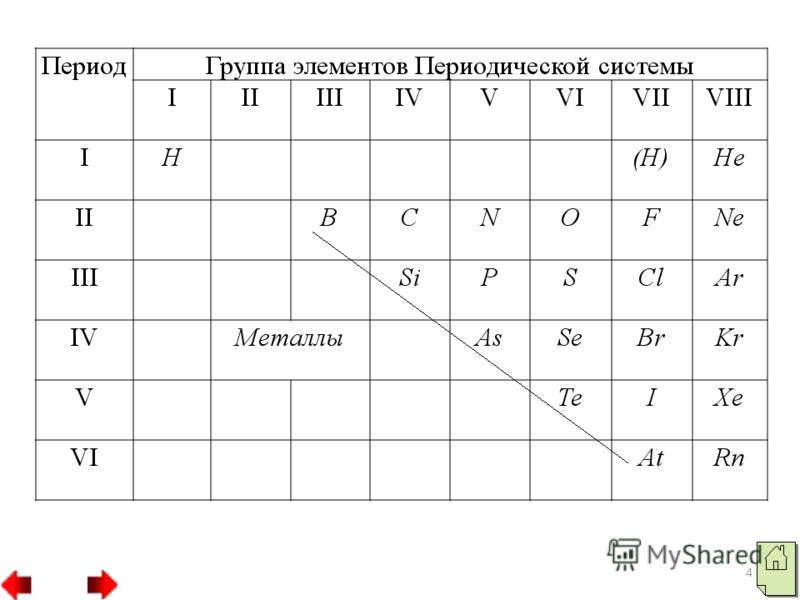
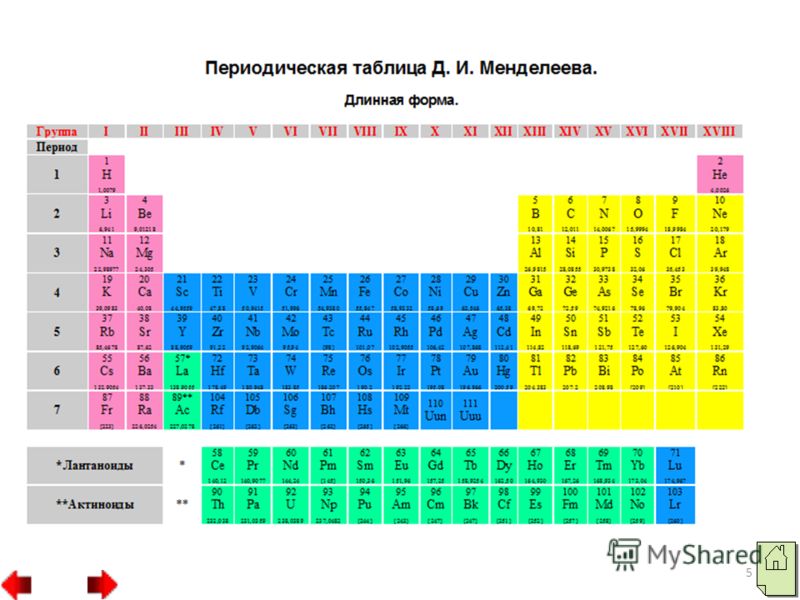
- موقف اللافلزات في PS D.I Mendeleev.
- ملامح التركيب الذري للعناصر غير المعدنية.
- صغير نصف القطر الذري(بالمقارنة مع نصف قطر ذرات المعدن في نفس الفترة). عدد أكبرإلكترونات لكل المستوى الخارجي(4-8)، استثناءات H، He، V. فقط الخارجي مملوء بالإلكترونات مستوى الطاقة. تتميز العناصر غير المعدنية بـ قيم عاليةالسالبية الكهربية.
- مميزة المواد البسيطة - غير المعادن.
- تتميز اللافلزات (المواد البسيطة) بجميع حالات التجميع الثلاث الظروف العادية(قارن - جميع المعادن ما عدا الزئبق في الظروف العادية المواد الصلبة).
- المواد الصلبة: تعديلات مختلفة من الكبريت واليود البلوري والجرافيت والفوسفور والكربون المنشط والسيليكون البلوري أو غير المتبلور والبورون.
- تتميز اللافلزات بمجموعة متنوعة من الألوان: الأبيض - الفوسفور، الأسود - الفوسفور، الجرافيت، الأحمر - الفوسفور، البروم، الأصفر - الكبريت، البنفسجي - اليود، عديم اللون - الأكسجين، النيتروجين، الهيدروجين. (جميع المعادن تقريبًا ذات لون أبيض فضي.) نقاط الانصهار: من 3800 درجة مئوية (الجرافيت) إلى -210 درجة مئوية (النيتروجين). للمقارنة، المعادن: من 3380 درجة مئوية (التنغستن) إلى -38.9 درجة مئوية (الزئبق). بعض اللافلزات موصلة للكهرباء (الجرافيت والسيليكون). تألق معدني(اليود، الجرافيت، السيليكون). تشبه هذه الخصائص المعادن، لكنها كلها مواد هشة.
- التآصل.
- أنواع مختلفةالشبكات البلورية (الفوسفور الأبيض P4 - الجزيئي، الفسفور الأحمر P - الذري). هيكل مختلفالشبكة البلورية (الماس – رباعي السطوح، الجرافيت – الطبقات). تكوين مختلف لجزيئات التعديلات المتآصلة (O 2 و O 3).
| الأكسجين | ||
| تكوين الجزيء | ||
| الخصائص الفيزيائية | غاز، عديم اللون، لا طعم له ولا رائحة، قليل الذوبان في الماء، في الحالة السائلةأزرق فاتح، أزرق صلب. نقطة الانصهار -218.7 0 درجة مئوية نقطة الغليان -183 0 درجة مئوية | غاز أزرق فاتح، سائل أزرق غامق، أرجواني غامق في الحالة الصلبة، رائحة قوية، أفضل 10 مرات من الأكسجين، قابل للذوبان في الماء. نقطة الانصهار -193 0 درجة مئوية نقطة الغليان -112 0 درجة مئوية |
| الخصائص الكيميائية | عامل مؤكسد قوي 2Cu + O 2 = 2CuO 2PbS + 3O 2 = 2PbO + 2SO 2 | عامل مؤكسد أقوى، لأنه يحتوي على جزيء غير مستقر 3PbS + 4O 3 = 3PbSO 4 2Ag + O 3 = Ag 2 O + O 2 2KI + O 3 + H 2 O = I 2 + 2KOH + O 2 |
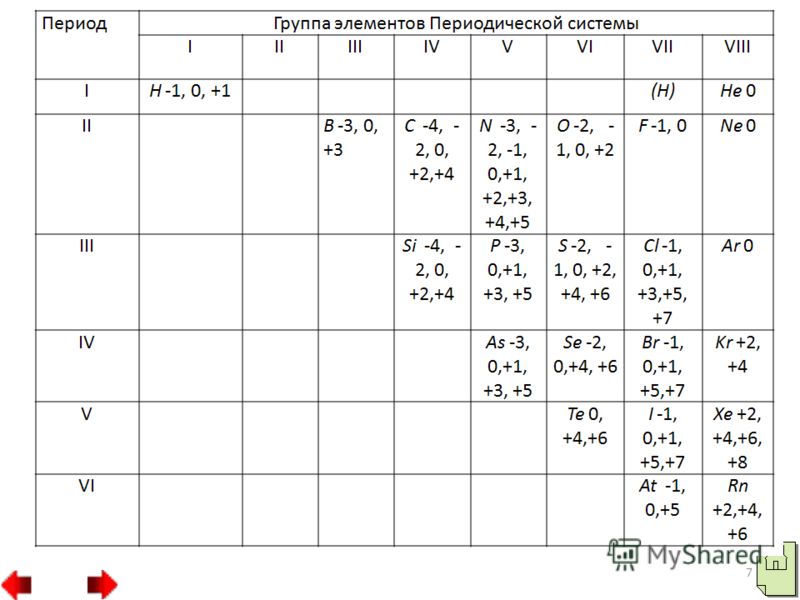
- الخواص الكيميائية للمواد غير المعدنية
هيكل وخصائص المواد البسيطة من اللافلزات.
اللافلزات الأكثر شيوعًا لها التركيب الجزيئي، وأقل نموذجية غير جزيئية. وهذا ما يفسر الفرق في خصائصها. ينعكس هذا بوضوح في المخطط 2. مواد بسيطة ذات بنية غير جزيئية ذات بنية جزيئية C، B، SiF2، O2، Cl2، Br2، N2، I2، S8 هذه اللافلزات لها شبكات بلورية ذرية، لذا فهي تتمتع بشبكات بلورية ذرية كبيرة. صلابة ونقاط انصهار عالية جدا. تحتوي هذه اللافلزات على شبكات بلورية جزيئية في حالتها الصلبة.
في الظروف العادية، تكون هذه غازات أو سوائل أو مواد صلبة ذات نقاط انصهار منخفضة. الجدول 2: البورون البلوري B، مثل السيليكون البلوري، لديه نقطة انصهار عالية جدًا تبلغ 2075 درجة مئوية وصلابة عالية. تزداد الموصلية الكهربائية للبورون بشكل كبير مع زيادة درجة الحرارة، مما يجعل من الممكن استخدامه على نطاق واسع في تكنولوجيا أشباه الموصلات. تؤدي إضافة البورون إلى الفولاذ وسبائك الألومنيوم والنحاس والنيكل وغيرها إلى تحسين خواصها الميكانيكية.
مركبات البوريدات من البورون مع بعض المعادن، مثل التيتانيوم TiB، TiB2، ضرورية في صناعة الأجزاء المحركات النفاثة,شفرات توربينات الغاز. كما يتبين من المخطط 2، فإن الكربون C والسيليكون Si والبورون B لها بنية مماثلة ولها بعض الخصائص العامة. كمواد بسيطة، فهي توجد في شكلين: بلورية وغير متبلورة. والأشكال البلورية لهذه العناصر شديدة الصلابة، ولها نقاط انصهار عالية. السيليكون البلوري له خصائص شبه موصلة.
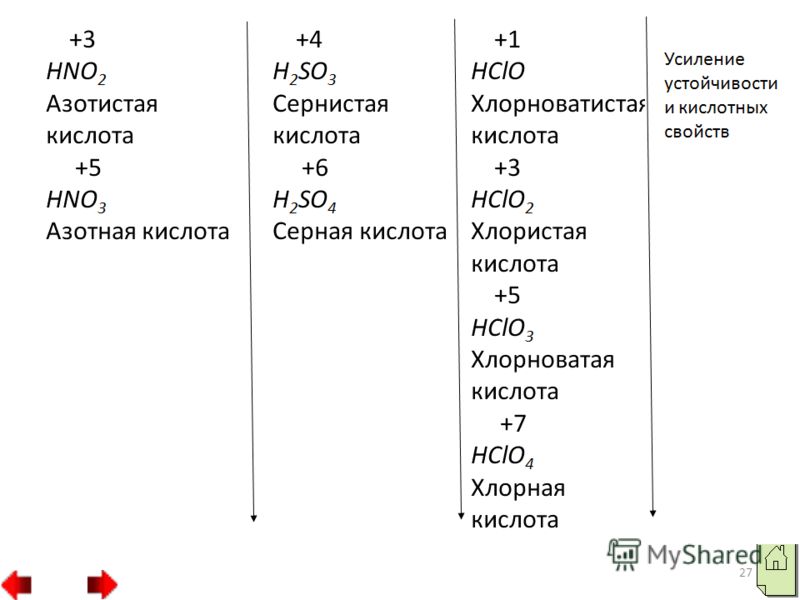
كل هذه العناصر تشكل مركبات مع المعادن: الكربيدات ومبيدات السيليكات والبوريدس CaC2، Al4C3، Fe3C، Mg2Si، TiB، TiB2. بعضها لديه صلابة أكبر، على سبيل المثال Fe3C، TiB. يستخدم كربيد الكالسيوم لإنتاج الأسيتيلين. إذا قارنا ترتيب الإلكترونات في المدارات في ذرات الفلور والكلور والهالوجينات الأخرى، فيمكننا الحكم على ترتيبها خصائص مميزة. لا تحتوي ذرة الفلور على مدارات حرة. لذلك، يمكن لذرات الفلور أن تظهر فقط التكافؤ I وحالة الأكسدة 1. في ذرات الهالوجينات الأخرى، على سبيل المثال، في ذرة الكلور، توجد مدارات d مجانية عند نفس مستوى الطاقة.
ونتيجة لهذا، يمكن أن يحدث الاقتران الإلكتروني في ثلاثة بطرق مختلفة. في الحالة الأولى، يمكن أن يظهر الكلور حالة الأكسدة 3 والشكل حمض الكلوروس HClO2، وهو ما يقابل أملاح الكلوريت، مثل كلوريت البوتاسيوم KClO2. وفي الحالة الثانية، يمكن أن يشكل الكلور مركبات تكون فيها حالة أكسدة الكلور 5. وتشمل هذه المركبات حمض الكلورونيك HClO3 وأملاحه الكلورية، على سبيل المثال كلورات البوتاسيوم KClO3 ملح بيرثوليت. في الحالة الثالثة، يظهر الكلور حالة أكسدة 7، على سبيل المثال في حمض البيركلوريك HClO4 وأملاح بيركلوراته، على سبيل المثال في بيركلورات البوتاسيوم KClO4. 4. مركبات الأكسجين والهيدروجين من اللافلزات.
وصف موجز لممتلكاتهم. تتشكل اللافلزات مع الأكسجين أكاسيد الحمض. في بعض الأكاسيد تظهر أقصى درجةالأكسدة تساوي رقم المجموعة مثلا SO2, N2O5 وأخرى أقل منها مثلا SO2, N2O3. أكاسيد حمضية تتوافق مع الأحماض، ومن الاثنين أحماض الأكسجينأحد اللافلزات أقوى من الذي يظهر فيه حالة أكسدة أعلى.
على سبيل المثال، حمض النيتريك HNO3 أقوى من HNO2 النيتروجيني حمض الكبريتيك H2SO4 أقوى من H2SO3 الكبريتي. صفات مركبات الأكسجيناللافلزات 1. الخصائص أكاسيد أعلىأولئك. الأكاسيد التي تحتوي على عنصر من هذه المجموعة ذو أعلى حالة أكسدة في الفترات من اليسار إلى اليمين تتغير تدريجياً من القاعدة إلى الحمضية. 2. في المجموعات من الأعلى إلى الأسفل، تضعف تدريجياً الخواص الحمضية للأكاسيد الأعلى.
يمكن الحكم على ذلك من خلال خصائص الأحماض المقابلة لهذه الأكاسيد. 3. زيادة الخصائص الحمضيةيتم تفسير ارتفاع أكاسيد العناصر المقابلة في الفترات من اليسار إلى اليمين بالزيادة التدريجية شحنة موجبةأيونات هذه العناصر. 4. في المجموعات الفرعية الرئيسية الجدول الدوري العناصر الكيميائيةفي الاتجاه من الأعلى إلى الأسفل، تنخفض الخواص الحمضية للأكاسيد الأعلى من اللافلزات.
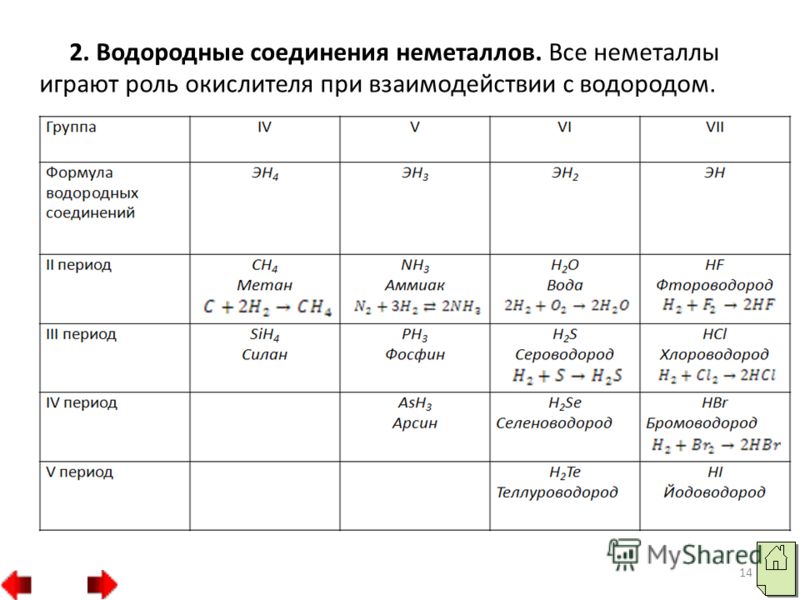
الصيغ العامةترد في الجدول 3 مركبات الهيدروجين حسب مجموعة النظام الدوري للعناصر الكيميائية. الصيغ العامة للمركبات حسب المجموعة IVVVIVIIRHRH2RH3RH4RH3H2RHR مركبات الهيدروجين غير المتطايرة مركبات الهيدروجين المتطايرة الجدول 3. مع المعادن، يتشكل الهيدروجين، مع بعض الاستثناءات، مركبات غير متطايرة، وهي مواد صلبة ذات بنية غير جزيئية. ولذلك، فإن نقاط انصهارها مرتفعة نسبيا.
مع اللافلزات، يشكل الهيدروجين مركبات متطايرة ذات بنية جزيئية. في الظروف العادية، هذه هي الغازات أو السوائل المتطايرة. في الفترات من اليسار إلى اليمين، تظهر الخواص الحمضية لمركبات الهيدروجين المتطايرة من اللافلزات المحاليل المائيةيكثف. ويفسر ذلك أن أيونات الأكسجين لها أزواج إلكترونات حرة، وأيونات الهيدروجين لها مدار حر، ثم تحدث عملية تشبه على النحو التالي H2O HF H3O F فلوريد الهيدروجين في محلول مائي يزيل أيونات الهيدروجين الموجبة، أي. يظهر خصائص حمضية.
يتم تسهيل هذه العملية أيضًا بواسطة ظرف آخر: يحتوي أيون الأكسجين على زوج إلكترون وحيد، بينما يحتوي أيون الهيدروجين على مدار حر، مما يؤدي إلى رابطة المانحين والمتقبلين. عندما تذوب الأمونيا في الماء، تحدث العملية المعاكسة. وبما أن أيونات النيتروجين لها زوج إلكترون وحيد، وأيونات الهيدروجين لها مدار حر، تنشأ رابطة إضافية وتتشكل أيونات الأمونيوم NH4 وأيونات الهيدروكسيد OH، ونتيجة لذلك، يكتسب المحلول الخصائص الأساسية.
يمكن التعبير عن هذه العملية بالصيغة H2O NH3 NH4 OH تعلق جزيئات الأمونيا في محلول مائي بأيونات الهيدروجين الموجبة، أي. الأمونيا يعرض الخصائص الأساسية. الآن دعونا نلقي نظرة على سبب كون مركب هيدروجين الفلور، فلوريد الهيدروجين HF، الموجود في محلول مائي حمضًا، ولكنه أضعف من حمض الهيدروكلوريك. ويفسر ذلك حقيقة أن نصف قطر أيونات الفلور أصغر بكثير من نصف قطر أيونات الكلور. ولذلك، فإن أيونات الفلور تجذب أيونات الهيدروجين بقوة أكبر بكثير من أيونات الكلور.
وفي هذا الصدد، فإن درجة تفكك حمض الهيدروفلوريك أقل بكثير من حمض الهيدروكلوريك، أي. حمض الهيدروفلوريك أضعف من حمض الهيدروكلوريك. ومن الأمثلة المقدمة يمكن استخلاص الاستنتاجات العامة التالية:
نهاية العمل -
هذا الموضوع ينتمي إلى القسم:
اللافلزات
في مختلف العصور التاريخيةكان لمفهوم العنصر معاني مختلفة. اعتبر فلاسفة اليونان القدماء أن العناصر الأربعة هي عناصر... وفي العصور الوسطى أضيف الملح والكبريت والزئبق إلى هذه المبادئ. في القرن السابع عشر ر.... تبين فيما بعد أن الجدول يتضمن أيضًا بعض المواد المعقدة. حاليا مفهوم الكيمياء...
إذا كنت بحاجة مواد إضافيةحول هذا الموضوع، أو لم تجد ما كنت تبحث عنه، ننصحك باستخدام البحث في قاعدة بيانات الأعمال لدينا:
ماذا سنفعل بالمواد المستلمة:
إذا كانت هذه المادة مفيدة لك، فيمكنك حفظها على صفحتك على الشبكات الاجتماعية:
2 اللافلزات هي عناصر كيميائية تستقبل ذراتها الإلكترونات بسهولة لإكمال مستوى الطاقة الخارجي، وبالتالي تشكل أيونات سالبة الشحنة. توجد العناصر غير المعدنية في نهاية الفترات ولها التكوين الإلكترونيالطبقة الخارجية، قريبة أو مساوية لتكوين أقرب غاز خامل. تحتوي جميع اللافلزات تقريبًا على أنصاف أقطار صغيرة نسبيًا وتتميز بقيم كهربية عالية وخصائص مؤكسدة.
3 من بين العناصر غير المعدنية، ينتمي عنصران الهيدروجين والهيليوم إلى عائلة s، بينما تنتمي جميع العناصر الأخرى إلى عائلة p. يوجد على الطبقة الإلكترونية الخارجية للذرات غير المعدنية رقم مختلفالإلكترونات: تحتوي ذرة الهيدروجين على إلكترون واحد (1s)، وذرة الهيليوم بها إلكترونين، وذرة البورون بها ثلاثة إلكترونات. ومع ذلك، فإن ذرات معظم اللافلزات، على عكس ذرات الفلزات، لها عدد كبيرالإلكترونات من 4 إلى 8. تتكون جميع المواد غير المعدنية من ذرات مرتبطة ببعضها البعض بواسطة تساهمية الرابطة غير القطبية. يمكن أن يكون لها بنية جزيئية، مثل جزيئات الهيدروجين والأكسجين والنيتروجين وما إلى ذلك التركيب الذريمثل بلورات الماس أو البورون.

4
5
6

7
8. دور اللافلزات ومركباتها في الطبيعة عظيم جداً. تشكل اللافلزات أكثر من 84% من كتلة التربة، و98.5% من كتلة النباتات، و97.6% من كتلة جسم الإنسان. ستة عناصر غير معدنية هي الكربون والهيدروجين والأكسجين والنيتروجين والفوسفور والكبريت وهي عناصر عضوية، حيث أنها جزء من جزيئات البروتينات والدهون والكربوهيدرات و الأحماض النووية. الهواء الذي نتنفسه عبارة عن خليط من مواد بسيطة ومعقدة متكونة غير المعادن(الأكسجين، النيتروجين، ثاني أكسيد الكربون).

9

10 يمكن أن تكون المواد غير المعدنية ذات التركيب الجزيئي في حالة غازية أو سائلة أو صلبة. كلهم، بسبب ضعف القوى الجزيئية، لديهم درجات حرارة منخفضةالغليان والذوبان. توجد المواد غير المعدنية ذات التركيب الذري فقط في المواد الصلبة. حالة التجميع، ترتبط ذراتها ببعضها البعض بقوة الروابط التساهميةوتشكل جزيئات كبيرة، على سبيل المثال، C n، S n، Si n. عادة ما يكون لديهم صلابة عالية، درجات حرارة عاليةذوبان وغليان. العديد من اللافلزات قادرة على التشكيل تعديلات تآصلية: O 2, O 3. جميع اللافلزات موصلة للحرارة بشكل سيء و التيار الكهربائي. البلورات غير المعدنية غير قابلة للسحب وهشة. معظم اللافلزات ليس لها بريق معدني.

11


13

15 تتميز مركبات الهيدروجين من اللافلزات موقف مختلفإلى الماء. الميثان والسيلان قابلان للذوبان بشكل سيئ في الماء. الأمونيا والفوسفين عندما يذوبان في الماء أسباب ضعيفة– هيدروكسيد الأمونيوم NH 4 OH وهيدروكسيد الفوسفونيوم РH 4 OH. عندما يذوب كبريتيد الهيدروجين وسيلينيد الهيدروجين وتيلوريد الهيدروجين وكذلك هاليدات الهيدروجين في الماء، تتشكل أحماض لها نفس صيغة مركبات الهيدروجين نفسها.

16 في الفترات من اليسار إلى اليمين، تزداد الخواص الحمضية لمركبات الهيدروجين المتطايرة من اللافلزات في المحاليل المائية، وتضعف في المجموعات. يتناقص النشاط التأكسدي لمركبات الهيدروجين من اللافلزات في مجموعات من الأعلى إلى الأسفل بشكل كبير. HF حمض الهيدروكلوريك HBr مرحبا



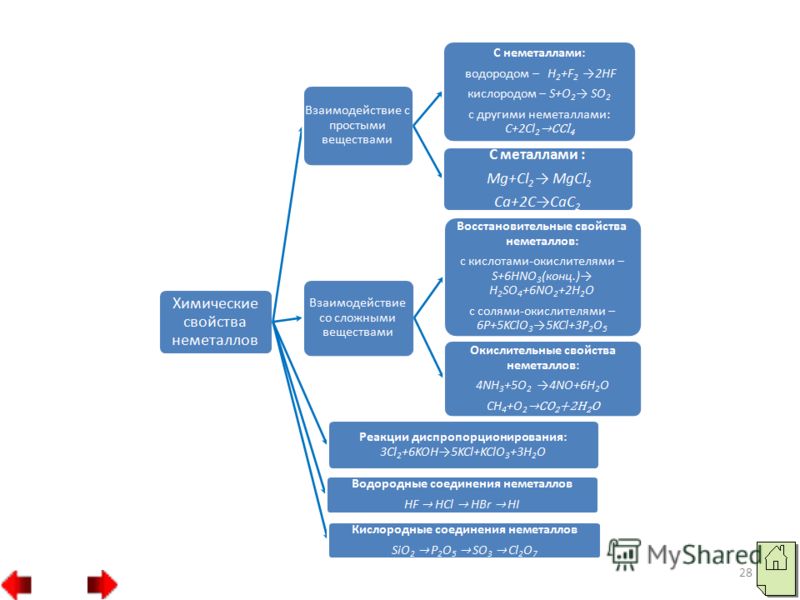
19 5. ليس فقط الأكسجين، ولكن أيضًا غير المعادن الأخرى (الفلور واليود والبروم وغيرها) يمكن أن تلعب أيضًا دور العامل المؤكسد في التفاعلات مع مواد معقدة. على سبيل المثال، يقوم عامل مؤكسد قوي، وهو الكلور، بأكسدة كلوريد الحديد (II) إلى كلوريد الحديد (III): تعتمد قدرة بعض اللافلزات على إزاحة غيرها من محاليل أملاحها على نشاط مؤكسد مختلف:

20 يجب التأكيد على أن المواد غير المعدنية (باستثناء الفلور) يمكن أن تظهر أيضًا الخصائص التصالحية. وفي هذه الحالة تختلط إلكترونات الذرات غير المعدنية مع ذرات العناصر المؤكسدة. وفي المركبات الناتجة، تكون للذرات اللافلزية حالات أكسدة موجبة. أعلى درجة إيجابيةأكسدة اللافلزات عادة ما تكون مساوية لرقم المجموعة. الحد من نشاط اللافلزات:



23 3. يتمتع الكربون والهيدروجين غير المعدنيين بأقوى خصائص الاختزال: وبالتالي، يمكن لجميع المواد غير المعدنية تقريبًا أن تعمل كعوامل مؤكسدة وكعوامل اختزال. يعتمد ذلك على المادة التي يتفاعل معها اللافلز.

24 تفاعلات الأكسدة الذاتية-الشفاء الذاتي (عدم التناسب) هي تفاعلات يكون فيها نفس اللافلز عاملًا مؤكسدًا وعامل اختزال. هذا لا يتناسب مع الفوسفور والكبريت والسيلينيوم والكلور البيئات القلوية: اللافلزات، وهي مركبات صلبة غير قابلة للذوبان في الماء مع شبكة بلورية قوية (الكربون والسيليكون) أو ضعيفة الذوبان في الماء (الأكسجين والهيدروجين)، لا تشارك في تفاعلات عدم التناسب.

25 تنقسم الأكاسيد غير المعدنية إلى مجموعتين: أكاسيد غير مكونة للملح وأكاسيد مكونة للملح. تشمل الأكاسيد غير المكونة للملح: N 2 O، NO، CO. جميع الأكاسيد غير المعدنية الأخرى تشكل الملح. تصنف أكاسيد اللافلزات المكونة للملح على أنها أكاسيد حمضية. ومن بينها الغازات (CO 2، SO 2، NO 2)، المواد السائلة(SO 3، N 2 O 3) والصلبة (P 2 O 5، SiO 2). الأكاسيد الحمضية هي أنهيدريدات الحمض. على سبيل المثال: ثاني أكسيد الكربون 2 – أنهيدريد حمض الكربونيك H2CO3؛ ف 2 O 5 – أنهيدريد حامض الفوسفوريك H 3 PO 4.

26 في المجموعات الفرعية الرئيسية من الأعلى إلى الأسفل، تضعف الخواص الحمضية للأكاسيد الأعلى من اللافلزات، وفي فترات - من اليسار إلى اليمين تزيد: SiO 2 P 2 O 5 SO 3 Cl 2 O 7 تقوية الخواص الحمضية الكل الأكاسيد الحمضية، باستثناء أكسيد السيليكون (II) SiO 2، تذوب في الماء لتشكل هيدرات الأكسيد، وهي حمضية بطبيعتها:

27
28


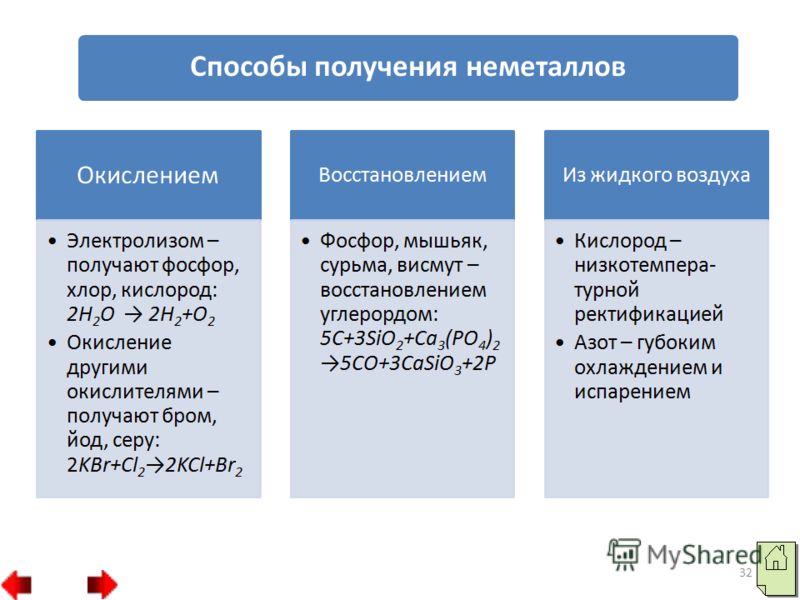
31 2. يمكن الحصول على بعض اللافلزات عن طريق الاختزال. على سبيل المثال، يتم الحصول على الفوسفور والزرنيخ والأنتيمون والبزموت عن طريق الاختزال بالكربون: 3. الطرق الفيزيائية: أ) تصحيح درجات الحرارة المنخفضة - هكذا يتم الحصول على الأكسجين من الهواء؛ ب) التبريد العميق والتبخر - هكذا يتم الحصول على النيتروجين من الهواء

32
33 سؤال 1. في أي مجموعات وفترات الجدول الدوري للعناصر الكيميائية لـ D.I Mendeleev تتركز العناصر غير المعدنية؟ 2. ما هي اللافلزات التي تشكل شبكة بلورية ذرية، والتي تشكل شبكة جزيئية، وأيها تكون على شكل ذرات فردية؟ 3. ما هي اللافلزات التي تكون سائلة عند 20 درجة مئوية، وما هي اللافلزات التي تكون غازات، وأيها تكون صلبة؟ 4. كيف تتغير الخصائص غير المعدنية للعناصر في جدول D.I Mendeleev في الفترات من اليسار إلى اليمين وفي المجموعات الفرعية الرئيسية من الأعلى إلى الأسفل؟

34 5. حدد العناصر التي تتأكسد والتي يتم تقليلها في تفاعلات المواد البسيطة: أ) S + O 2 = SO 2؛ ب) S + 2Cl 2 = SCl 4؛ ج) Cl 2 + H 2 = 2HCl؛ د) 2P + 3Br 2 = 2PBr تتفاعل بعض اللافلزات مع الأحماض المؤكسدة وتتحول إلى أحماض أو أكاسيد حمضية مع درجات أعلىأكسدة. اكتب معادلات التفاعلات التالية: أ) C + H 2 SO 4 (conc.) = ب) C + HNO 3 (conc.) = ج) S + HNO 3 (conc.) =

