7.11. هيكل المواد ذات الروابط التساهمية
المواد التي، من بين جميع أنواع الروابط الكيميائية، لا توجد سوى رابطة تساهمية، تنقسم إلى مجموعتين غير متساويتين: جزيئية (كثيرة جدًا) وغير جزيئية (أقل بكثير).
بلورات صلبة المواد الجزيئيةتتكون من جزيئات مترابطة بشكل ضعيف بواسطة قوى التفاعل بين الجزيئات. هذه البلورات لا تتمتع بقوة وصلابة عالية (مثل الثلج أو السكر). كما أن درجات انصهارها وغليانها منخفضة أيضًا (انظر الجدول 22).
الجدول 22. درجات الانصهار والغليان لبعض المواد الجزيئية
مادة |
مادة |
||||
| ح 2 | – 259 | – 253 | بي آر 2 | – 7 | 58 |
| ن 2 | – 210 | – 196 | ماء | 0 | 100 |
| حمض الهيدروكلوريك | – 112 | – 85 | ص 4 | 44 | 257 |
| نه 3 | – 78 | – 33 | C10H8 (نفثالين) | 80 | 218 |
| SO 2 | – 75 | – 10 | س 8 | 119 |
على عكس نظيراتها الجزيئية، تشكل المواد غير الجزيئية ذات الروابط التساهمية بلورات صلبة جدًا. وتنتمي بلورات الألماس (أصلب مادة) إلى هذا النوع.
في بلورة الماس (الشكل 7.5)، ترتبط كل ذرة كربون بأربع ذرات كربون أخرى عن طريق روابط تساهمية بسيطة (تهجين sp3). تشكل ذرات الكربون إطارًا ثلاثي الأبعاد. في الأساس، إن بلورة الماس بأكملها عبارة عن جزيء ضخم وقوي جدًا.
بلورات السيليكون، المستخدمة على نطاق واسع في الإلكترونيات الراديوية والهندسة الإلكترونية، لها نفس البنية.
إذا استبدلت نصف ذرات الكربون الموجودة في الماس بذرات السيليكون دون الإخلال ببنية إطار البلورة، فستحصل على بلورة من كربيد السيليكون SiC - وهي أيضًا مادة صلبة جدًا تستخدم كمادة كاشطة. ينتمي أيضًا رمل الكوارتز العادي (ثاني أكسيد السيليكون) إلى هذا النوع المواد البلورية. الكوارتز جدا صلب; تحت اسم "الصنفرة" يتم استخدامه أيضًا كمادة كاشطة. يتم الحصول على بنية الكوارتز بسهولة عن طريق إدخال ذرات الأكسجين بين كل ذرتين من ذرات السيليكون في بلورة السيليكون. في هذه الحالة، سترتبط كل ذرة سيليكون بأربع ذرات أكسجين، وكل ذرة أكسجين مع ذرتي سيليكون.
تسمى بلورات الماس والسيليكون والكوارتز والهياكل المماثلة بالبلورات الذرية.
البلورة الذرية هي بلورة تتكون من ذرات عنصر واحد أو أكثر مرتبطة بروابط كيميائية.
الرابطة الكيميائية في البلورة الذرية يمكن أن تكون تساهمية أو معدنية.
كما تعلمون بالفعل، فإن أي بلورة ذرية، مثل البلورة الأيونية، هي "جزيء فائق" ضخم. لا يمكن تدوين الصيغة الهيكلية لمثل هذا "الجزيء الفائق" - يمكنك فقط إظهار شظيته، على سبيل المثال:

على عكس المواد الجزيئية، فإن المواد التي تشكل بلورات ذرية هي من بين أكثر المواد مقاومة للحرارة (انظر الجدول 23).
الجدول 23. درجات الانصهار والغليان لبعض المواد غير الجزيئيةمع الروابط التساهمية
تعتبر درجات حرارة الانصهار المرتفعة هذه مفهومة تمامًا إذا تذكرنا أنه عندما تذوب هذه المواد، لا يتم كسر الروابط الجزيئية الضعيفة، بل الروابط الكيميائية القوية. لنفس السبب، فإن العديد من المواد التي تشكل بلورات ذرية لا تذوب عند تسخينها، ولكنها تتحلل أو تتحول على الفور إلى حالة بخار (تسامى)، على سبيل المثال، يتسامي الجرافيت عند 3700 درجة مئوية.
| السيليكون - سي.تبدو بلورات السيليكون الصلبة جدًا والهشة وكأنها معدنية، ولكنها مع ذلك ليست معدنية. وبناء على نوع الموصلية الكهربائية، تصنف هذه المادة على أنها مادة شبه موصلة، مما يحدد أهميتها الهائلة في العالم الحديث. السيليكون هو أهم مادة أشباه الموصلات. أجهزة الراديو والتلفزيون والكمبيوتر والهواتف الحديثة والساعات الإلكترونية، الألواح الشمسيةوالعديد من الأجهزة المنزلية والصناعية الأخرى تحتوي على العناصر الأساسيةتصميمات الترانزستورات والدوائر الدقيقة والخلايا الضوئية المصنوعة من بلورات مفردة من السيليكون عالي النقاء. يستخدم السيليكون التقني في إنتاج الصلب والمعادن غير الحديدية. من حيث الخصائص الكيميائية، يعتبر السيليكون مادة خاملة إلى حد ما؛ فهو يتفاعل فقط عند درجات حرارة عالية.ثاني أكسيد السيليكون – SiO2 . اسم آخر لهذه المادة هو السيليكا.درجة حرارة. وفقا لخاصتهم الخصائص الكيميائيةثاني أكسيد السيليكون – أكسيد الحمضولكنه يتفاعل مع القلويات فقط عند الانصهار. في درجات حرارة عاليةيتم استخدام ثاني أكسيد السيليكون والجرافيت لإنتاج كربيد السيليكون - الكاربورندوم. الكاربورندوم هو ثاني أصلب مادة بعد الماس، كما أنه يستخدم في صناعة عجلات الطحن و"ورق الصنفرة". |
7.12. قطبية الرابطة التساهمية. السالبية الكهربية
تذكر أن الذرات المعزولة للعناصر المختلفة لها ميول مختلفة للتخلي عن الإلكترونات وقبولها. تستمر هذه الاختلافات بعد تكوين الرابطة التساهمية. أي أن ذرات بعض العناصر تميل إلى جذب زوج الإلكترونات من الرابطة التساهمية إلى نفسها بقوة أكبر من ذرات العناصر الأخرى.
خذ بعين الاعتبار الجزيء حمض الهيدروكلوريك.
باستخدام هذا المثال، دعونا نرى كيف يمكننا تقدير إزاحة سحابة الاتصالات الإلكترونية باستخدام طاقات ووسائل التأين المولية للإلكترون. 1312 كيلوجول/مول، و1251 كيلوجول/مول - الفرق ضئيل، حوالي 5%. 73 كيلوجول/مول، و349 كيلوجول/مول - هنا الفرق أكبر بكثير: طاقة الألفة الإلكترونية لذرة الكلور أكبر بخمس مرات تقريبًا من طاقة ذرة الهيدروجين. من هذا يمكننا أن نستنتج أن زوج الإلكترون من الرابطة التساهمية في جزيء كلوريد الهيدروجين ينزاح بشكل كبير نحو ذرة الكلور. بمعنى آخر، تقضي إلكترونات الترابط وقتًا أطول بالقرب من ذرة الكلور مقارنةً بذرة الهيدروجين. ويؤدي هذا التوزيع غير المتكافئ لكثافة الإلكترون إلى إعادة توزيع الشحنات الكهربائية داخل الجزيء، حيث تنشأ شحنات جزئية (زائدة) على الذرات؛ على ذرة الهيدروجين تكون موجبة، وعلى ذرة الكلور تكون سالبة.
في هذه الحالة، يقال أن الرابطة مستقطبة، والرابطة نفسها تسمى رابطة تساهمية قطبية.
إذا لم يتم إزاحة زوج الإلكترونات في الرابطة التساهمية إلى أي من الذرات المرتبطة، أي أن إلكترونات الرابطة تنتمي بالتساوي إلى الذرات المرتبطة، فإن هذه الرابطة تسمى رابطة تساهمية غير قطبية.
ينطبق أيضًا مفهوم "الرسوم الرسمية" في حالة الرابطة التساهمية. فقط في التعريف لا ينبغي أن نتحدث عن الأيونات، بل عن الذرات. في حالة عامةيمكن إعطاء التعريف التالي.
في الجزيئات التي تتشكل فيها الروابط التساهمية فقط من خلال آلية التبادل، تكون الشحنات الرسمية للذرات تساوي الصفر. وهكذا، في جزيء حمض الهيدروكلوريك، تكون الشحنات الرسمية على ذرات الكلور والهيدروجين صفرًا. وبالتالي فإن الشحنات الحقيقية (الفعالة) الموجودة على ذرات الكلور والهيدروجين في هذا الجزيء تساوي الشحنات الجزئية (الزائدة).
ليس من السهل دائمًا تحديد علامة الشحنة الجزئية على ذرة عنصر أو آخر في الجزيء بناءً على طاقات التأين المولية والألفة للقطب الكهربائي، أي تقدير الاتجاه الذي تكون فيه أزواج الروابط الإلكترونية تحولت. عادة لهذه الأغراض، يتم استخدام خاصية طاقة أخرى للذرة - الكهربية.
في الوقت الحالي، لا يوجد تسمية واحدة مقبولة عمومًا للسالبية الكهربية. يمكن الإشارة إليه بالحرفين E/O. لا توجد أيضًا طريقة واحدة مقبولة عمومًا لحساب السالبية الكهربية. وبطريقة مبسطة، يمكن تمثيلها على أنها نصف مجموع طاقات التأين المولية والألفة الإلكترونية - وكانت هذه إحدى الطرق الأولى لحسابها.
القيم المطلقة للسالبية الكهربية للذرات عناصر مختلفةتستخدم نادرا جدا. والأكثر استخدامًا هو السالبية الكهربية النسبية، والتي يُشار إليها بالرمز c. في البداية، تم تعريف هذه القيمة على أنها نسبة السالبية الكهربية لذرة عنصر معين إلى السالبية الكهربية لذرة الليثيوم. وفي وقت لاحق، تغيرت طرق حسابه إلى حد ما.
السالبية الكهربية النسبية هي كمية بلا أبعاد. وترد قيمها في الملحق 10.
نظرًا لأن السالبية الكهربية النسبية تعتمد في المقام الأول على طاقة التأين للذرة (طاقة تقارب الإلكترون تكون دائمًا أقل بكثير)، ثم في النظام العناصر الكيميائيةفهو يتغير تقريبًا بنفس طاقة التأين، أي أنه يزيد قطريًا من السيزيوم (0.86) إلى الفلور (4.10). إن قيم السالبية الكهربية النسبية للهيليوم والنيون الواردة في الجدول ليس لها أي أهمية عملية، لأن هذه العناصر لا تشكل مركبات.
باستخدام جدول السالبية الكهربية، يمكنك بسهولة تحديد أي من الذرتين تنزاح الإلكترونات التي تربط هذه الذرات، وبالتالي، علامات الشحنات الجزئية التي تنشأ على هذه الذرات.
| ماء | الاتصال قطبي | |||
| ح 2 | الذرات هي نفسها | ح--ح | الاتصال غير قطبي | |
| ثاني أكسيد الكربون | الاتصال قطبي | |||
| Cl2 | الذرات هي نفسها | الكلورين--الكلورين | الاتصال غير قطبي | |
| كبريتيد الهيدروجين | الاتصال قطبي |
وهكذا، في حالة تكوين رابطة تساهمية بين ذرات العناصر المختلفة، فإن مثل هذا الرابط سيكون دائمًا قطبيًا، وفي حالة تكوين رابطة تساهمية بين ذرات نفس العنصر (في المواد البسيطة)، يكون الترابط قطبيًا. السندات في معظم الحالات غير القطبية.
كلما زاد الفرق في السالبية الكهربية للذرات المرتبطة، كلما أصبحت الرابطة التساهمية بين هذه الذرات أكثر قطبية.
| كبريتيد الهيدروجين H2S- غاز عديم اللون ذو رائحة مميزة للبيض الفاسد؛ سامة. وهو غير مستقر حرارياً ويتحلل عند تسخينه. كبريتيد الهيدروجين قابل للذوبان بشكل طفيف في الماء محلول مائييسمى حمض كبريتيد الهيدروجين. يثير كبريتيد الهيدروجين (يحفز) تآكل المعادن؛ وهذا الغاز هو "المسؤول" عن تغميق الفضة. ويوجد بشكل طبيعي في بعض المياه المعدنية. في عملية الحياة، يتم تشكيلها بواسطة بعض البكتيريا. كبريتيد الهيدروجين مدمر لجميع الكائنات الحية. تم اكتشاف طبقة كبريتيد الهيدروجين في أعماق البحر الأسود وتسبب قلق العلماء: حياة سكان البحار هناك تتعرض لتهديد مستمر. |
الرابطة التساهمية القطبية، الرابطة التساهمية غير القطبية، السالبية الكهربية المطلقة، السالبية الكهربية النسبية.
1. أظهرت التجارب والحسابات اللاحقة أن الشحنة الفعالة للسيليكون في رباعي فلوريد السيليكون هي +1.64e، وللزينون في سداسي فلوريد الزينون +2.3e تحديد قيم الشحنات الجزئية على ذرات الفلور في هذه المركبات. 2. قم بتكوين الصيغ الهيكلية للمواد التالية، وباستخدام الرموز "" و" "، قم بتمييز قطبية الروابط التساهمية في جزيئات هذه المركبات: أ) CH 4، CCl 4، SiCl 4؛ ب) H 2 O، H 2 S، H 2 Se، H 2 Te؛ ج) NH 3، NF 3، NCl 3؛ د) SO 2، Cl 2 O، OF 2.
3.باستخدام جدول السالبية الكهربية، حدد أي المركبات التي تكون الرابطة فيها أكثر قطبية: أ) CCl 4 أو SiCl 4 ؛ ب) H 2 S أو H 2 O؛ ج) NF 3 أو NCl 3؛ د) Cl 2 O أو 2.
7.13. آلية المانحين والمتقبلينالاتصالات التعليمية
تعرفت في الفقرات السابقة بالتفصيل على نوعين من الروابط: الأيونية والتساهمية. دعونا نتذكر ذلك الرابطة الأيونيةتتشكل عندما ينتقل الإلكترون بالكامل من ذرة إلى أخرى. تساهمي - عند مشاركة الإلكترونات غير المتزاوجة من الذرات المرتبطة.
وبالإضافة إلى ذلك، هناك آلية أخرى لتكوين السندات. لنفكر في الأمر باستخدام مثال تفاعل جزيء الأمونيا مع جزيء ثلاثي فلوريد البورون:

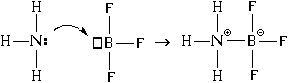
ونتيجة لذلك، تنشأ الروابط التساهمية والأيونية بين ذرات النيتروجين والبورون. في هذه الحالة، ذرة النيتروجين المانحةزوج الإلكترون ("يعطيه" لتكوين الرابطة)، وذرة البورون - متقبل("يقبلها" عند تكوين اتصال). ومن هنا اسم آلية تكوين مثل هذا الاتصال - " المانح المتقبل".
عندما يتم تكوين رابطة باستخدام آلية المانح والمستقبل، يتم تشكيل كل من الرابطة التساهمية والرابطة الأيونية في وقت واحد.
بالطبع، بعد تكوين الرابطة، بسبب الاختلاف في السالبية الكهربية للذرات المرتبطة، يحدث استقطاب الرابطة، وتنشأ شحنات جزئية، مما يقلل من الشحنات الفعالة (الحقيقية) للذرات.
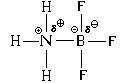
دعونا نلقي نظرة على أمثلة أخرى.
إذا كان هناك جزيء كلوريد الهيدروجين شديد القطبية بجوار جزيء الأمونيا، حيث توجد شحنة جزئية كبيرة على ذرة الهيدروجين، ففي هذه الحالة ستلعب ذرة الهيدروجين دور متقبل زوج الإلكترون. انها 1 ق-AO، على الرغم من أنها ليست فارغة تمامًا، مثل ذرة البورون في المثال السابق، إلا أن كثافة الإلكترونات في سحابة هذا المدار تقل بشكل كبير.

الهيكل المكاني للكاتيونات الناتجة هو أيون الأمونيوميشبه NH 4 بنية جزيء الميثان، أي أن جميع روابط N-H الأربعة متماثلة تمامًا.
يمكن ملاحظة تكوين البلورات الأيونية من كلوريد الأمونيوم NH 4 Cl عن طريق خلط غاز الأمونيا مع غاز كلوريد الهيدروجين:
NH 3 (ز) + حمض الهيدروكلوريك (ز) = NH 4 Cl (كر)
ليس فقط ذرة النيتروجين يمكن أن تكون مانحة لزوج الإلكترون. يمكن أن تكون، على سبيل المثال، ذرة الأكسجين في جزيء الماء. سوف يتفاعل جزيء الماء مع نفس كلوريد الهيدروجين كما يلي:
ويسمى الكاتيون الناتج H3O أيون الأوكسونيوموكما ستتعلم قريبًا، فهو ذو أهمية كبيرة في الكيمياء.
وفي الختام، دعونا ننظر في التركيب الإلكتروني للجزيء أول أكسيد الكربون(أول أكسيد الكربون) CO:
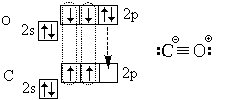
بالإضافة إلى الروابط التساهمية الثلاث (الرابطة الثلاثية)، فهي تحتوي أيضًا على رابطة أيونية.
شروط تكوين السندات وفق آلية المانح والمتقبل:
1) وجود زوج وحيد من إلكترونات التكافؤ في إحدى الذرات.
2) وجود مدار حر على مستوى التكافؤ لذرة أخرى.
إن آلية تكوين السندات بين المانحين والمتقبلين واسعة الانتشار. يحدث هذا غالبًا بشكل خاص أثناء تكوين المركبات د-عناصر. ذرات الجميع تقريبًا د- تحتوي العناصر على العديد من مدارات التكافؤ الفارغة. لذلك، فهي متقبلة نشطة لأزواج الإلكترون.
آلية تكوين السندات بين المانحين والمتقبلين، أيون الأمونيوم، أيون الأوكسونيوم، شروط تكوين السندات من خلال آلية المانحين والمتقبلين.
1. عمل معادلات التفاعل ومخططات التكوين
أ) بروميد الأمونيوم NH 4 Br من الأمونيا وبروميد الهيدروجين؛
ب) كبريتات الأمونيوم (NH 4) 2 SO 4 من الأمونيا وحمض الكبريتيك.
2. إنشاء معادلات التفاعل ومخططات التفاعل لـ أ) الماء مع بروميد الهيدروجين؛ ب) الماء مع حامض الكبريتيك.
3. ما هي الذرات في التفاعلات الأربعة السابقة المانحة لزوج الإلكترونات، وأيها المستقبلة؟ لماذا؟ اشرح إجابتك باستخدام الرسوم البيانية لمستويات التكافؤ الفرعية.
4. الصيغة الهيكلية حمض النيتريكالزوايا بين روابط O-N-O تقترب من 120 درجة. يُعرِّف:
أ) نوع تهجين ذرة النيتروجين؛
ب) أي AO من ذرة النيتروجين يشارك في تكوين الرابطة.
ج) التي تشارك AO من ذرة النيتروجين في تكوين الرابطة وفقًا لآلية المانح والمتقبل.
ما رأيك الزاوية متساويةبين روابط H–O–N في هذا الجزيء؟ 5. إنشاء الصيغة الهيكلية لأيون السيانيد CN (شحنة سالبة على ذرة الكربون). ومن المعروف أن السيانيد (المركبات التي تحتوي على مثل هذا الأيون) وأول أكسيد الكربون هي سموم قوية، و التأثير البيولوجيإنهم قريبون جدًا. قدم شرحًا لقرب تأثيرها البيولوجي.
7.14. اتصال معدني. المعادن
وتتكون الرابطة التساهمية بين الذرات المتشابهة في قابليتها للتخلي عن الإلكترونات واكتسابها فقط عندما تكون أحجام الذرات المرتبطة صغيرة. في هذه الحالة كثافة الإلكترونفي منطقة تداخل السحب الإلكترونية أمر مهم، وتبين أن الذرات مرتبطة بإحكام، كما هو الحال، على سبيل المثال، في جزيء HF. إذا كان لواحدة على الأقل من الذرات المرتبطة نصف قطر كبير، يصبح تكوين الرابطة التساهمية أقل فائدة، لأن كثافة الإلكترون في منطقة السحب الإلكترونية المتداخلة للذرات الكبيرة أقل بكثير من تلك الصغيرة. مثال على هذا الجزيء ذو الرابطة الأضعف هو جزيء HI (باستخدام الجدول 21، قارن طاقات الانحلال لجزيئات HF وHI).
ومع ذلك بين الذرات الكبيرة ( ص o > 1.1) يحدث رابطة كيميائية، ولكنها في هذه الحالة تتشكل بسبب مشاركة كل (أو جزء) من إلكترونات التكافؤ لجميع الذرات المرتبطة. على سبيل المثال، في حالة ذرات الصوديوم، كل 3 ق- إلكترونات هذه الذرات، وتتكون سحابة إلكترونية واحدة:
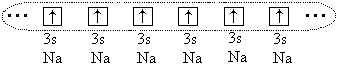
تشكل الذرات بلورة مع معدنتواصل
وبهذه الطريقة، يتم تكوين كل من ذرات العنصر الواحد وذرات العنصر عناصر مختلفة. في الحالة الأولى، تسمى المواد البسيطة المعادنوفي الثانية - المواد المعقدة تسمى المركبات بين الفلزات.
من جميع المواد مع السندات المعدنيةبين الذرات في المدرسة لن تنشر إلا المعادن. ما هو التركيب المكاني للمعادن؟ تتكون البلورة المعدنية من الهياكل العظمية الذرية، المتبقية بعد التنشئة الاجتماعية لإلكترونات التكافؤ، والسحابة الإلكترونية للإلكترونات الاجتماعية. تشكل النوى الذرية عادة تعبئة متقاربة للغاية، وتحتل السحابة الإلكترونية كامل الحجم الحر المتبقي من البلورة.
الأنواع الرئيسية للتغليف الكثيف هي أقرب التعبئة مكعب(كي بي يو) و تعبئة قريبة سداسية(وحدة معالجة الرسومات). ترتبط أسماء هذه العبوات بتماثل البلورات التي تتحقق فيها. تشكل بعض المعادن بلورات فضفاضة - مكعب متمركز حول الجسم(أوتسك). يتم عرض نماذج الحجم والكرة والعصا لهذه الحزم في الشكل 7.6.
تتكون التعبئة المغلقة المكعبة من ذرات Cu وAl وPb وAu وبعض العناصر الأخرى. تعبئة متقاربة سداسية - ذرات Be وZn وCd وSc وعدد من الذرات الأخرى. التعبئة المكعبة للذرات المتمركزة حول الجسم موجودة في البلورات المعادن القلويةعناصر مجموعات VB و VIB. قد يكون لدى بعض المعادن درجات حرارة مختلفة هيكل مختلف. لا تزال أسباب هذه الاختلافات والسمات الهيكلية للمعادن غير مفهومة بالكامل.
عند ذوبانها تتحول إلى بلورات معدنية السوائل المعدنية. لا يتغير نوع الرابطة الكيميائية بين الذرات.
الرابطة المعدنية ليس لها اتجاهية وتشبع. وفي هذا الصدد فهو يشبه الرابطة الأيونية.
في حالة المركبات بين الفلزية، يمكننا أيضًا التحدث عن قابلية استقطاب الرابطة المعدنية.
مميزة الخصائص الفيزيائيةالمعادن:
1) الموصلية الكهربائية العالية.
2) الموصلية الحرارية العالية.
3) ليونة عالية.

تختلف درجات انصهار المعادن المختلفة اختلافًا كبيرًا عن بعضها البعض: أدنى نقطة انصهار للزئبق (- 39 درجة مئوية)، والأعلى للتنغستن (3410 درجة مئوية).
| البيريليوم بي- رمادي فاتح، خفيف الوزن، صلب إلى حد ما، ولكنه معدن هش عادة. نقطة الانصهار 1287 درجة مئوية. في الهواء تصبح مغطاة بفيلم أكسيد. البريليوم - بما فيه الكفايةمعدن نادر ، لم يكن للكائنات الحية في عملية تطورها أي اتصال بها عمليًا، لذلك ليس من المستغرب أنها سامة لعالم الحيوان. يتم استخدامه في التكنولوجيا النووية. الزنك الزنك - أبيض مع لون مزرقمعدن ناعم . نقطة الانصهار 420 درجة مئوية. في الهواء وفي الماء مغطاة بطبقة رقيقة كثيفةأكسيد الزنك النحاس، ويستخدم على نطاق واسع في الهندسة الميكانيكية. تستخدم السبائك التي تحتوي على الزنك في صب الخطوط المطبعية.ولفرام دبليو. وهو الأكثر صهرًا بين جميع المعادن: درجة انصهار التنغستن هي 3387 درجة مئوية. عادةً ما يكون التنغستن هشًا للغاية، ولكن بعد التنظيف الدقيق يصبح قابلاً للسحب، مما يجعل من الممكن سحب سلك رفيع منه، يمكن منه سحب خيوط تصنع المصابيح الكهربائية.يتم استخدام التنغستن الناتج لإنتاج سبائك صلبة ومقاومة للتآكل يمكنها الاحتفاظ بهذه الخصائص عند تسخينها حتى 1000 درجة مئوية. |
معدن، مركب بين المعادن، رابطة معدنية، التعبئة الأكثر إحكامًا.
1. لتوصيف الحزم المختلفة، يتم استخدام مفهوم "معامل ملء الفراغ"، أي نسبة حجم الذرات إلى حجم البلورة
أين الخامس أ -حجم الذرة,
Z هو عدد الذرات في خلية الوحدة،
الخامس ط- حجم خلية الوحدة .
يتم تمثيل الذرات في هذه الحالة بكرات صلبة نصف قطرها ر، لمس بعضهم البعض. حجم الكرة Vث = (4/3) ر 3 .
تحديد عامل ملء المساحة للتغليف السائب والتعبئة المخفية.
2. باستخدام قيم أنصاف أقطار المعدن (الملحق 9)، احسب حجم خلية الوحدة من أ) النحاس (CPU)، ب) الألومنيوم (CPU) و ج) السيزيوم (BCC).
الرابطة التساهمية –التواصل عبر الأزواج الإلكترونية.
آلية المانحين والمتقبلين لتكوين السندات- آلية تكوين الرابطة حيث تكون إحدى الذرات المرتبطة مانحًا لزوج من الإلكترونات والأخرى متقبلة.
وفقا لآلية المانح والمتلقي:
1) تتوفر المدارات الجزيئية غير الرابطة (LUMO):
في الجزيئات التي تحتوي على ذرات ذات أزواج وحيدة من الإلكترونات (على سبيل المثال، في كحولات ROH، تحتوي ذرة الأكسجين على زوجين وحيدين من الإلكترونات يشغلان اثنين من LUMOs)؛
في الجذور الحرة التي تحتوي على إلكترونات غير متزاوجة (على سبيل المثال، في جذر الميثيل CH 3، يوجد الإلكترون غير المقترن في LUMO)؛
في الكاربوكاتيونات من النوع + CH 3، حيث يكون LUMO مجانيًا.
يمكن للجزيئات والأيونات التي تحتوي على LUMO أن تشارك في تكوين روابط تساهمية من خلال آلية المانح والمتقبل.
2) عندما تتشكل الرابطة وفقا لآلية المانح والمستقبل، يتم تكوين كل من الرابطة التساهمية والرابطة الأيونية في وقت واحد.
بالطبع، بعد تكوين الرابطة، بسبب اختلاف السالبية الكهربية للذرات المرتبطة، يحدث استقطاب الرابطة وتنشأ شحنات جزئية، مما يقلل من الشحنات الفعالة (الحقيقية) للذرات.
3) يمكن تكوين رابطة تساهمية بين ذرتين، تحتوي إحداهما على زوج وحيد من الإلكترونات والأخرى تحتوي على مدار حر. على سبيل المثال، عندما تتفاعل الأمونيا NH3 مع كلوريد الهيدروجين HC1، يصبح زوج الإلكترون الوحيد من النيتروجين مشتركًا بين الهيدروجين والنيتروجين، مما ينتج عنه أيون الأمونيوم NH4 +؛ 8. تسمى هذه الآلية لتكوين الرابطة التساهمية المتبرع المتقبل. في مثالنا، زوج الإلكترون المتبرع هو ذرة نيتروجين، والمستقبل هو أيون هيدروجين (له مدار حر). يتم ملاحظة آلية المانح والمتقبل لتكوين الرابطة التساهمية في المركبات المعقدة OH، K4.
آلية الصرف- تشارك المدارات الذرية ذات الإلكترون الواحد في تكوين الروابط، أي. توفر كل من الذرات الاستخدام الشائعإلكترون واحد لكل منهما
2. ما هي الصيغة المستخدمة لحساب عيار محلول المادة؟ ما هي الأشكال الأخرى للتعبير عن تركيز المادة في المحلول؟
عيار(من العيار الفرنسي - الجودة، الخاصية)، في الكيمياء التحليلية، تركيز المحلول، معبرًا عنه بالكمية (بالجرام) من المادة المذابة في 1 ملمحلول أو كمية من أي مادة تتفاعل مع 1 ملمن هذا الحل. وبناء على ذلك، يتم تمييز T. وفقا للمادة المذابة (على سبيل المثال، T. من المحلول حمض الهيدروكلوريك- T HCl) أو T. حسب المادة التي يتم تحديدها (على سبيل المثال، T. محلول حمض الهيدروكلوريك حسب الصودا الكاوية- T حمض الهيدروكلوريك / هيدروكسيد الصوديوم). يتم حساب T. بالصيغة: ت= ف / فأين ت -عيار الحل في جم / مل، ف -وزن العينة في ز، ف- حجم الدورق الحجمي مل.
طرق التعبير عن التركيزات المواد الكيميائيةفي الحلول.
التركيز الموليالمواد ( مع) بالمول/لتر - نسبة كمية المادة المذابة بالمول ( ن) إلى حجم الحل ( V):
التركيز المولي يساوي عددياً عدد مولات المادة الموجودة في 1 لتر (1000 مل، 1 دسم3) من المحلول.
يعادل التركيز المولي ** ق[(1/ض)Х]هو نتاج التركيز المولي ج(X)الى رقم المعادلة ض من هذه المادة، أي. ق[(1/ض)Х] = ص(خ)×ض. يُظهر التركيز المولي للمكافئ كمية مكافئات المادة الموجودة في 1 لتر من المحلول.
التركيز المولي (في)بالمول/كجم - نسبة كمية المادة المذابة بالمول ( ن) إلى كتلة المذيب ( م):
غالبًا ما توجد أيضًا اشتقاقات من وحدات التركيز: على سبيل المثال، ملغم / لتر، ملغم / دي إم 3، ملغم / سم 3، ملغم / مل، مليمول / لتر، جم / مل(العنوان)، وما إلى ذلك. الوحدات الأكثر استخدامًا في الكتب المرجعيةفيما يتعلق بتقييم محتوى الشوائب في الماء (على سبيل المثال، قيم MPC). ملغم/لترو مليمول / لتر مكافئ..
3. اكتب صيغة التفاعل للحصول على ملح عن طريق استبدال الهيدروجين أو المعدن.
الحديد + CuSO4 = FeSO4 + النحاس
Ca + NaNO3 = Ca(NO3)2 + Na
نا + بوكل = كلوريد الصوديوم + ك
المنغنيز + NaSO4 = MnSO4 + 2Na
الكروم + K3PO4 = CrPO4 + 3K
التذكرة رقم 23
1. ماذا تدرس الديناميكا الحرارية الكيميائية ("الكيمياء الحرارية")، ما هي الأنظمة الديناميكية الحرارية وخصائصها ومعلماتها ووظائف حالتها؟
التفاعلات الكيميائية مصحوبة بإطلاق أو امتصاص الطاقة. إذا تم إطلاق الطاقة أو امتصاصها على شكل حرارة، تتم كتابة هذه التفاعلات باستخدام معادلات التفاعل الكيميائي التي تشير إلى التأثيرات الحرارية، ومن الضروري الإشارة إلى التركيبة الطورية للمواد المتفاعلة.
تسمى التفاعلات الكيميائية التي تحدث مع إطلاق الحرارة بالتفاعلات الطاردة للحرارة، وتلك التي تحدث مع امتصاص الحرارة تسمى تفاعلات ماصة للحرارة. تدرس الكيمياء الحرارية التأثيرات الحرارية للتفاعلات. في الكيمياء الحرارية، يتم الإشارة إلى التأثير الحراري للتفاعل بواسطة Q ويتم التعبير عنه بـ kJ. الكيمياء الحرارية هي أحد فروع الديناميكا الحرارية الكيميائية، التي تدرس تحولات الطاقة من شكل إلى آخر ومن مجموعة من الأجسام إلى أخرى، وكذلك إمكانية واتجاه وعمق العمليات الكيميائية والطورية في ظل ظروف معينة. كل مادة على حدة أو مجموعتها هي نظام ديناميكي حراري. لو النظام الديناميكي الحراريلا يتبادل مع بيئةلا مادة ولا طاقة، ويسمى معزولا. يتم استخدام مثل هذا النظام المثالي كتجريد مادي عند النظر في العمليات التي تستبعد التأثير البيئة الخارجية. يسمى النظام الذي يتبادل الطاقة مع البيئة فقط بنظام مغلق. إذا كان تبادل الطاقة والمواد ممكنًا، يكون النظام مفتوحًا.
يتم تحديد حالة النظام المعلمات الديناميكية الحراريةالحالات - درجة الحرارة والضغط والتركيز والحجم وما إلى ذلك. ويتميز النظام أيضًا بخصائص مثل الطاقة الداخلية U، المحتوى الحراري H، الإنتروبيا S، طاقة جيبس G. من التغيير أثناء التفاعلات الكيميائيةتميز نظام الطاقة الخاص بها. العقارات المدرجةتعتمد الأنظمة على درجة الحرارة والضغط والتركيز، لذلك تسمى وظائف الحالة، ولا تعتمد على مسار العملية ويتم تحديدها فقط من خلال الحالات النهائية والمبدئية للنظام.
2. صيغة قانون دالتون للحلول المثالية. ما هي الحلول الأخرى هناك؟.
إن ضغط خليط الغازات التي لا تتفاعل كيميائيا مع بعضها البعض يساوي مجموع جزئياتها
ضغط.
وفقا لقانون دالتون، يتم تحديد الضغط الجزئي للغاز Pr بالصيغة:
حيث Pabs هو الضغط المطلق خليط الغاز، ن- نسبة مئويةالغاز في الخليط.
بمعنى آخر، الكل يساوي مجموع أجزائه. يوجد حوالي 21 جزيء أكسجين في الهواء لكل 100 جزيء من جميع الغازات. وبالتالي فإن الأكسجين يمارس ضغطًا يساوي خمس الضغط الكلي. يُعرف هذا الجزء من الضغط الكلي بالضغط الجزئي للأكسجين وهو عامل مهمفي رياضة الغوص، حيث أن جسم الإنسان يتأثر بشكل مباشر بالضغوط الجزئية للغازات التي يتكون منها الهواء بدرجة أكبر من ضغوطها المطلقة.
ما هي الحلول الأخرى هناك؟ - راجع السؤال 1، التذكرة 28
3. اكتب نسخة من التفاعل لإنتاج ملح من خلال الجمع بين ملحين.
KCr(SO4)2 + 3KOH = Cr(OH)3 + 2K2SO4
مع آلية المانح والمتقبل لتشكيل الرابطة التساهمية، يتم تشكيل الرابطة أيضًا باستخدام أزواج الإلكترون. ومع ذلك، في هذه الحالة، توفر ذرة واحدة (المانحة) زوج الإلكترون الخاص بها، وتشارك الذرة الأخرى (المستقبلة) في تكوين الرابطة بمدارها الحر. مثال على تنفيذ رابطة المانحين والمتقبل هو تكوين أيون الأمونيوم NH 4 + أثناء تفاعل الأمونيا NH 3 مع كاتيون الهيدروجين H +. في جزيء NH 3، تشكل ثلاثة أزواج من الإلكترونات ثلاث روابط N-H، ويكون زوج الإلكترون الرابع الذي ينتمي إلى ذرة النيتروجين وحيدًا. يمكن لزوج الإلكترون هذا أن يشكل رابطة مع أيون هيدروجين له مدار شاغر. والنتيجة هي أيون الأمونيوم NH4+، الشكل 1. 5.2.
أرز. 5.2. ظهور رابطة بين المانح والمتقبل أثناء تكوين أيون الأمونيوم
تجدر الإشارة إلى أن الروابط التساهمية الأربعة N – H الموجودة في أيون NH 4 + متكافئة. من المستحيل في أيون الأمونيوم تحديد الرابطة التي تشكلها آلية المانح والمتقبل.
الرابطة التساهمية القطبية وغير القطبية
إذا تم تشكيل رابطة تساهمية من ذرات متطابقة، فإن زوج الإلكترون يقع على نفس المسافة بين نوى هذه الذرات. مثل هذه الرابطة التساهمية تسمى غير قطبية. من أمثلة الجزيئات ذات الرابطة التساهمية غير القطبية H2، Cl2، O2، N2، إلخ.
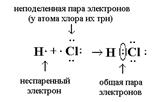 في حالة تساهمية قطبيةالرابطة، ينتقل زوج الإلكترون المشترك إلى الذرة ذات السالبية الكهربية الأعلى. ويتحقق هذا النوع من الروابط في الجزيئات المتكونة ذرات مختلفة. تحدث الرابطة التساهمية القطبية في جزيئات HCl وHBr وCO وNO وما إلى ذلك. على سبيل المثال، يمكن تمثيل تكوين الرابطة التساهمية القطبية في جزيء HCl من خلال رسم تخطيطي، الشكل 1. 5.3:
في حالة تساهمية قطبيةالرابطة، ينتقل زوج الإلكترون المشترك إلى الذرة ذات السالبية الكهربية الأعلى. ويتحقق هذا النوع من الروابط في الجزيئات المتكونة ذرات مختلفة. تحدث الرابطة التساهمية القطبية في جزيئات HCl وHBr وCO وNO وما إلى ذلك. على سبيل المثال، يمكن تمثيل تكوين الرابطة التساهمية القطبية في جزيء HCl من خلال رسم تخطيطي، الشكل 1. 5.3:
أرز. 5.3. تشكيل تساهمية اتصال قطبيفي جزيء HC1
في الجزيء قيد النظر، يتم إزاحة زوج الإلكترون إلى ذرة الكلور، حيث أن السالبية الكهربية (2.83) أكبر من السالبية الكهربية لذرة الهيدروجين (2.1).
1. رابطة تساهمية غير قطبيةتشكل ذرات غير معدنية متطابقة وذرات الهيدروجين.
2. مادة كيميائية قطبية تساهميةتتكون الرابطة من ذرات مختلفة من اللافلزات واللافلزات مع الهيدروجين.
الرابطة التساهمية –يحدث بين الذرات نتيجة لتكوين أزواج الإلكترونات المشتركة.
المبادئ الأساسية لطريقة رابطة التكافؤ:
1) فقط الإلكترونات الخارجية غير المتزاوجة قذيفة الإلكترون.
اتصالات B20 سيجما σ، pi π ودلتا ɓ
روابط سيجما وباي ودلتا.رابطة سيجما (رابطة سيجما): يحدث تداخل مدارات التكافؤ على طول خط الرابطة، أي. الخط الذي يربط بين نوى الذرات المتفاعلة. رابطة باي (p-bond): يحدث تداخل المدارات في اتجاه عمودي على خط الرابطة (التداخل الجانبي). رابطة دلتا (d-bond): تقع المدارات المتداخلة في قسمين طائرات متوازية، عمودي على خط الاتصال.
رابطة كيميائية يتصل بها الخط النوى الذرية، هو محور التماثل للسحابة الإلكترونية المتصلة، ويسمى سيجما (σ) -بوند. يحدث عندما يكون هناك تداخل "أمامي". المدارات الذرية. ترتبط عندما تتداخل مدارات s-s في جزيء H 2؛ مدارات p-p في جزيء Cl 2 ومدارات sp في جزيء HCl هي روابط سيجما. من الممكن حدوث تداخل "جانبي" للمدارات الذرية. عندما تكون سحب الإلكترون المتداخلة موجهة بشكل عمودي على محور الرابطة، أي. على طول المحورين y وz، يتم تشكيل منطقتين متداخلتين، تقعان على جانبي هذا المحور. تسمى هذه الرابطة التساهمية رابطة pi (p). هناك تداخل أقل للسحب الإلكترونية أثناء تكوين الرابطة π. بالإضافة إلى ذلك، تقع مناطق التداخل بعيدًا عن النوى عما كانت عليه أثناء تكوين الرابطة σ. لهذه الأسباب، تتمتع الرابطة π بقوة أقل مقارنة بالرابطة σ. وبالتالي الطاقة رابطة مزدوجةأقل من ضعف طاقة رابطة واحدة، والتي تكون دائمًا رابطة σ. بالإضافة إلى ذلك، فإن الرابطة σ لها تناظر أسطواني محوري وهي عبارة عن جسم دوران حول الخط الذي يربط بين النوى الذرية. على العكس من ذلك، فإن الرابطة π ليس لها تناظر أسطواني.
الرابطة الفردية تكون دائمًا رابطة σ نقية أو هجينة. تتكون الرابطة المزدوجة من رابطة σ واحدة ورابطة π واحدة، متعامدة مع بعضها البعض. الرابطة σ أقوى من الرابطة π. في المركبات ذات الروابط المتعددة، يوجد دائمًا رابطة σ واحدة ورابطة واحدة أو اثنتين.
عندما تقترب ذرتان تحتويان على إلكترونات ذات دورانات عكسية من مسافة معينة (r1)، ينشأ بينهما تفاعل تبادلي قوي: تبدأ نواة الذرة الأولى في جذب إلكترون الثانية والعكس - نواة الثانية تجذب الإلكترون من الأول. تأتي لحظة يبدأ فيها الإلكترونان بالتحرك في مجال النواتين. من المنظور ميكانيكا الكموتعتبر هذه اللحظة بمثابة لحظة تكوين الرابطة التساهمية. ويتميز بأقصى عمق تداخل للمدارات الذرية والحد الأقصى لإطلاق الطاقة (الشكل 13). الآن الإلكترونات موجودة في المدار الجزيئي. إن انتقال إلكترون واحد من أي ذرة إلى رابطة تساهمية لا يصاحبه تغير في شحنة أي من الذرات المكونة لهذه الرابطة، لأن يقوم الشريك بتعويض هذه الخسائر.
عندما تقترب الذرات من بعضها البعض لمسافة صغيرة معينة (ro)، تبدأ القوة التنافرية لنواتين في لعب دور، وتزداد طاقة النظام. المسافة التي تعوض فيها هذه القوى بعضها البعض تتوافق مع طول الرابطة الكيميائية، أي. المسافة بين الذرات الموجودة في الجزيء، والطاقة المنطلقة هي طاقة الربط (الشكل 14).
 إذا كانت الذرات المتفاعلة تحتوي على إلكترونات ذات دوران متوازي، فإن مداراتها تتنافر مع بعضها البعض، وتزداد طاقة النظام، ولا تتشكل رابطة كيميائية. لأول مرة، تم طرح الافتراض بأن الروابط الكيميائية ذات طبيعة تساهمية ويتم تنفيذها من خلال أزواج معممة من الإلكترونات، تم طرحها من قبل G. Lewis و W. Kossel. أعرب لويس عن فكرة أن كل ذرة تميل إلى ملء غلاف إلكتروني مستقر من غاز خامل حول نفسها. بالنسبة لذرة الهيدروجين فهي طبقة من الهيليوم ذات إلكترونين، أما بالنسبة لذرات عناصر الفترة الثانية فهي عبارة عن غلاف من ثمانية إلكترونات من النيون. اتصل بها I. Langmuir الثماني الإلكترونية
.
إذا كانت الذرات المتفاعلة تحتوي على إلكترونات ذات دوران متوازي، فإن مداراتها تتنافر مع بعضها البعض، وتزداد طاقة النظام، ولا تتشكل رابطة كيميائية. لأول مرة، تم طرح الافتراض بأن الروابط الكيميائية ذات طبيعة تساهمية ويتم تنفيذها من خلال أزواج معممة من الإلكترونات، تم طرحها من قبل G. Lewis و W. Kossel. أعرب لويس عن فكرة أن كل ذرة تميل إلى ملء غلاف إلكتروني مستقر من غاز خامل حول نفسها. بالنسبة لذرة الهيدروجين فهي طبقة من الهيليوم ذات إلكترونين، أما بالنسبة لذرات عناصر الفترة الثانية فهي عبارة عن غلاف من ثمانية إلكترونات من النيون. اتصل بها I. Langmuir الثماني الإلكترونية
.
 تسمى الصيغ التي توضح عدد الإلكترونات في الروابط وأزواج الإلكترون الوحيدة في الذرات غير المتجانسة صيغ لويس
. في هذه الصيغ، يتم تمثيل كل اتصال بنقطتين: ب الصيغ الهيكليةيتم تمثيل زوج الإلكترون المشترك بخط يربط بين ذرتين:
تسمى الصيغ التي توضح عدد الإلكترونات في الروابط وأزواج الإلكترون الوحيدة في الذرات غير المتجانسة صيغ لويس
. في هذه الصيغ، يتم تمثيل كل اتصال بنقطتين: ب الصيغ الهيكليةيتم تمثيل زوج الإلكترون المشترك بخط يربط بين ذرتين: | المواد السابقة: |
