الوزن الجزيئي(موالفة. الوزن الجزيئي) - كتلة جزيء المادة، معبرًا عنها بوحدات الكربون من الكتلة الذرية (وحدة الكربون من الكتلة الذرية هي 1/12 من كتلة ذرة نظير الكربون 12 C)؛ إلى جانب الكتل الذرية، فهو بمثابة الأساس لجميع أنواع الحسابات التي يتم إجراؤها باستخدام الكيمياء. الصيغ والمعادلات، بما في ذلك الحسابات التي تتم في الكيمياء الحيوية. ومختبرات التشخيص السريري.
إذا كان الكيميائي. صيغة المادة، ثم M. v. يمكن حسابها كمجموع الأوزان الذرية (الكتلة) للذرات الكيميائية. العناصر (انظر الوزن الذري) التي يتكون منها الجزيء من هذه المادة. على سبيل المثال، م. ثاني أكسيد الكربون(CO2) يساوي:
12,011 + 2 * 15,9994 = 44,0098.
بالنسبة للمواد في الحالة الغازية أو المذابة، الأساليب التجريبيةتعريفات M. القرن. الأكثر تبريرا. م. عادة ما يتم تحديد (M1) للغاز عن طريق قياسه الكثافة النسبيةد للغاز، م.ف. والذي (م٢) معروف؛ ثم M1 = M2*D. م. يمكن أيضًا تحديد الغاز إذا كانت كثافته الطبيعية d معروفة، أي كتلة 1 لتر من الغاز بالجرام عند ضغط 760 ملم زئبق. فن. و 0 درجة مئوية. وفي هذه الحالة، م. الغاز يساوي M = 22.42*d.
لتحديد م. القرن. مادة مذابة في مثل هذا المذيب، حيث لا تخضع هذه المادة للتفكك أو الارتباط، يتم في أغلب الأحيان قياس الانخفاض في نقطة تجمد المحلول Δt (انظر قياس التبريد) أثناء الذوبان أز من مادة الاختبار في ب g من المذيب: M = (K*a*1000)/(Δt*b)، حيث K هو ثابت التبريد (التبريدي) للمذيب.
م. ويمكن أيضًا تحديد المادة المذابة عن طريق قياس الضغط الأسموزي للمحلول (انظر الضغط الأسموزي). في هذه الحالة، M = (m*R*T)/p، حيث m هي كتلة المادة المذابة بالجرام الموجودة في 1 لتر من المحلول، وp هو الضغط الأسموزي بوحدة atm، وT هي درجة الحرارة بالدرجات كلفن و R هو ثابت درجة حرارة الغاز بوحدة l*atm/mol*deg. تم استخدام هذه الطريقة بنجاح لتحديد القرن M.. البروتينات والسكريات والمركبات النووية وغيرها من المركبات عالية الجزيئية (انظر). م. يمكن تحديد البروتينات والبوليمرات الحيوية الأخرى عن طريق الطرد المركزي الفائق (انظر).
في الممارسة العملية، الكيمياء الحيوية، إسفين، والنظافة الصحية. مختبرات لأداء أنواع مختلفةفي الحسابات، يتم أيضًا استخدام وحدة كمية من مادة تسمى المول على نطاق واسع.
المول هو كمية من المادة تحتوي على عدد كبير من الجزيئات أو الذرات أو الأيونات أو الإلكترونات أو غيرها الوحدات الهيكلية، كم عدد الذرات الموجودة في 12 جم من نظير الكربون 12 C. يتم تحديد عدد الجزيئات أو الذرات أو الوحدات الهيكلية الأخرى الموجودة في مول واحد من أي مادة، والتي تسمى رقم أفوجادرو، بدقة كبيرة. بالنسبة للحسابات العملية، يتم أخذها على قدم المساواة
6.023*10 23 مول -1.
كتلة المول الواحد من المادة، معبرًا عنها بالجرام، تساوي عدديًا M.v. تسمى المادة الكتلة المولية، أو جزيء جرام.
فهرس:بيلكي، أد. G. نيوراث وسي. بيلي، عبر. من اللغة الإنجليزية، المجلد 2، ص. 276, M., 195 6: Gaurowitz F. الكيمياء ووظيفة البروتينات، العابرة. من الإنجليزية، م.، 1965؛ أوستفالد لوثر – دراكر، القياسات الفيزيائية والكيميائية، ترانس. مع الألمانية، الجزء 1، €. 294، ل.، 1935.
نرى أن وزنًا واحدًا يفوق بشكل كبير سبع كرات بلاستيكية. الخبرة مع الموازين تعطينا الإجابة - هناك مادة أكثر في وزن الحديد، وهذا إذا قارنا الكتل - مقاييس القصور الذاتي للحديد والبلاستيك.
لكن ماذا لو قارنا ليس الكتل، بل كمية المادة التي دخلت في صنع الكرات والأوزان، وفي الواقع عدد الجزيئات التي تتكون منها؟ بأخذ الكرات والوزن في أيدينا، سنرى أن الوزن قد فقد بالفعل على خلفية هذه الكرات. إذا تمكنا من إحصاء عدد الجزيئات الموجودة في الحديد والبلاستيك، فسنرى أن عدد ذرات الحديد سيكون كبيرا كمية أقلالجزيئات في جميع الكرات البلاستيكية. وهذا يعني أن هناك المزيد من المادة في البلاستيك.
كلا الإجابتين صحيحة.
الأمر هو أننا في الحالة الأولى قارنا الكتلة، أي مقياس القصور الذاتي للأجسام، وفي الحالة الثانية قارنا عدد الجزيئات، وكمية المادة.
يمكننا أن نرسم تشبيهًا بسيطًا بالسكر في كوب القياس. يمكن الإجابة على سؤال مقدار السكر الموجود من خلال النظر إلى تقسيم الزجاج ومعرفة عدد جرامات السكر الموجودة تقريبًا. يمكنك عد كل حبة في الكوب والإجابة عن عدد الحبوب التي يحتوي عليها الكوب. ستكون الإجابتان الأولى والثانية صحيحتين. متى يكون أكثر ملاءمة للحديث عن كتلة الجزيئات، ومتى يكون أكثر ملاءمة للحديث عن كمية المادة؟ هذا هو بالضبط موضوع الدرس: "كتلة الجزيئات، كمية المادة".
وفي القرن التاسع عشر، أنشأ العالم الإيطالي أفوجادرو حقيقة مثيرة للاهتمام: إذا كان هناك غازان مختلفان، على سبيل المثال الهيدروجين والأكسجين، في نفس الأوعية، عند نفس الضغوط ودرجات الحرارة، فسيكون في كل وعاء نفس عدد الجزيئات، على الرغم من أن كتل الغازات يمكن أن تختلف كثيرًا، في مثالنا - 16 مرة (الشكل 2 ).
أرز. 2. تجربة أفوجادرو ()
كل هذا يعني أن بعض خصائص الجسم يتم تحديدها بدقة بعدد الجزيئات، وليس فقط بالكتلة.
ماذا نعني بمصطلح "كمية المادة"؟ تتكون أي مادة من جزيئات وذرات وأيونات - مما يعني أنه من خلال كمية المادة نفهم عدد الجزيئات.
الكمية الفيزيائية التي تحدد عدد الجزيئات الموجودة فيها هذه الهيئة، مُسَمًّى كمية المادة. معين الرسالة اليونانيةν - عارية.
اتفقنا على أن نأخذ كوحدة كمية من المادة الكمية التي تحتوي على عدد من الجزيئات (الذرات والجزيئات) يساوي عدد الذرات في 0.012 كجم (12 جرامًا) من نظير الكربون الذي كتلته الذرية 12.
تسمى هذه الوحدة الخلد.
ويترتب على هذا التعريف أنه في مول واحد من أي مادة سيكون هناك نفس العدد من الجزيئات. يحتوي المول الواحد من أي مادة على 6.02 10 23جزيئات أو جزيئات. تسمى هذه الكمية ثابت أفوجادرو.

أرز. 3. تحديد العدد الإجمالي للجزيئات ()
هذه الصيغة تسمح لك بمعرفة ذلك العدد الكاملجزيئات عند الكمية المعروفةالمواد.
كتلة الجزيء صغيرة للغاية. وقد حدد الفيزيائيون ذلك باستخدام ما يسمى بمطياف الكتلة. على سبيل المثال، قيمة كتلة جزيء الماء (الشكل 4):

أرز. 4. تحديد كتلة جزيء الماء ()
كما نرى، تمامًا كما هو الحال في الحالات المتعلقة بكمية المادة، فإن مقارنة كتلة جزيء واحد بمعيار الكتلة، وهو الكيلوجرام، ليس أمرًا مريحًا للغاية. إذا كانت الأعداد كبيرة في الحالات التي تحتوي على كمية المادة، فإن الأعداد صغيرة جدًا في الحالات التي تحتوي على كتلة الجزيئات. ولهذا السبب تم اختيار وحدة خاصة خارج النظام كوحدة قياس لكتلة الجزيء أو الذرة - وحدة الكتلة الذرية. لن نقارن وحدة الكتلة بالمعيار، بل بكتلة جزيء مادة ما.
أصبحت هذه المادة العنصر الأكثر شيوعا في الطبيعة - الكربون، الذي يدخل في كل شيء. المركبات العضوية. وحدة الكتلة الذرية تساوي:
1 أمو = 1/12 كتلة الكربون - 12 (نظير يحتوي على 12 نيوكليون)
1 أمو = 1.66·10 -27 كجم
وبما أننا سوف نقيس كتلة الجزيئات في الوحدات الذريةالجماهير، ثم نأتي إلى الجديد الكمية المادية- الوزن الجزيئي النسبي.
تسمى نسبة كتلة الجزيء (الذرة) من مادة معينة إلى 1/12 من كتلة ذرة الكربون الوزن الجزيئي النسبي(أو الكتلة الذرية النسبية) في حالة التركيب الذري للمادة.
الصيغ التي تعبر عن هذا التعريف:
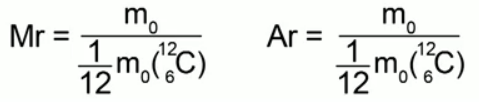
الوزن الجزيئي النسبي هو كمية لا أبعاد لها، ولا يتم قياسها بأي شيء. لا شيء يمنعنا من الاستمرار في قياس كتل الذرات والجزيئات بالكيلوجرامات كلما كان ذلك مناسبًا لنا. نعلم من مقرر الكيمياء أن: الكتلة الجزيئية النسبية للمادة تساوي مجموع الكتل الذرية النسبية للعناصر الموجودة فيها. على سبيل المثال، بالنسبة للماء H2O فإن الوزن الجزيئي النسبي سيكون:
السيد = 1 2 + 16 = 18
مجموع نسبي الوزن الجزيئيالأكسجين (16) واثنين من الهيدروجين (2.1) سيعطيان 18
كيف تجد القواسم المشتركة بين الكتلة بالكيلوجرام وكمية المادة بالشامات؟ هذه الكمية هي الكتلة المولية.
الكتلة الموليةهي كتلة مول واحد من المادة.
المعينة [M]، تقاس بالكيلوجرام/مول.
الكتلة المولية تساوي نسبة الكتلة إلى كمية المادة:
نحصل على الصيغ التي تربط الخصائص المختلفة للجزيئات.
لتحديد الكتلة المولية عنصر كيميائيدعونا ننتقل إلى الجدول الدوريالعناصر الكيميائية لمندليف - نحن نأخذها ببساطة الكتلة الذرية A (عدد نويات العنصر المطلوب) - ستكون كتلته المولية، معبرًا عنها بوحدة جرام/مول.
على سبيل المثال، بالنسبة للألمنيوم (الشكل 5):

أرز. 5. تحديد الكتلة المولية للمادة ( )
ستكون الكتلة الذرية للألمنيوم 27 والكتلة المولية 0.027 كجم/مول.
ويفسر ذلك حقيقة أن الكتلة المولية للكربون هي 12 جم/مول حسب التعريف، بينما تحتوي نواة ذرة الكربون على 12 نيوكليون - 6 بروتونات و6 نيوترونات، وتبين أن كل نيوكليون يساهم بـ 1 جم/مول في الكتلة المولية للكربون. الكتلة المولية، وبالتالي فإن الكتلة المولية لعنصر كيميائي له كتلة ذرية A ستكون مساوية لـ A g/mol.
يتم الحصول على الكتلة المولية للمادة التي يتكون جزيئها من عدة ذرات ببساطة عن طريق جمع الكتل المولية، على سبيل المثال (الشكل 6):

أرز. 6. الكتلة المولية لثاني أكسيد الكربون ()
عليك أن تكون حذرًا بشكل خاص مع الكتل المولية لبعض الغازات، مثل غاز الهيدروجينوالنيتروجين والأكسجين - يتكون جزيئها من ذرتين - H 2، N 2، O 2، والهيليوم، الذي يوجد غالبًا في المشاكل، أحادي الذرة ويبلغ وزنه الجزيئي 4 جم / مول، كما هو محدد في الجدول الدوري (الشكل 1). 7).

أرز. 7. الكتل المولية لبعض الغازات ()
يحتوي المول الواحد من أي مادة على عدد أفوجادرو من الجزيئات، مما يعني أننا إذا ضربنا عدد أفوجادرو (عدد الجزيئات في المول الواحد) في كتلة الجزيء الواحد m0، فإننا نحصل على الكتلة المولية للمادة، أي - كتلة مول واحد من المادة :
م = م 0 ن أ
إذا كان 25 طالبًا يدرسون في فصل دراسي بمساحة 50 م2، فإن لكل طالب 2 م2. عندما يذهبون إلى صالة الألعاب الرياضية بمساحة 500 متر مربع، سيكون لدى كل طالب بالفعل 20 مترًا مربعًا. ولم يتغير عدد الطلاب، بل أصبحوا أقل توزيعا، وفي هذه الحالة يقولون: انخفض تركيز الناس. وبنفس الطريقة، تم تقديم مفهوم التركيز للجزيئات في نظرية الحركية الجزيئية.
تركيز(ن) هو عدد الجزيئات لكل وحدة حجم من المادة. وهي تساوي نسبة عدد الجزيئات إلى الحجم:
الصيغ المتعلقة بالتركيز بالخصائص الأخرى للجزيئات:

باستخدام هذه الصيغ، يمكننا مقارنة المواد من حيث عدد الجزيئات والكتلة.
لقد حصلنا على كل ما نحتاجه لبناء نظرية الحركية الجزيئية، وهو ما سنفعله في الدروس القادمة.
مراجع
- تيخوميروفا إس إيه، يافورسكي بي إم. فيزياء ( المستوى الأساسي) - م: منيموسين، 2012.
- جيندنشتاين إل إي، ديك يو.آي. الفيزياء الصف العاشر. - م: منيموسين، 2014.
- كيكوين آي كيه، كيكوين إيه كيه. الفيزياء - 9، موسكو، التعليم، 1990.
- Lib.podelise.ru ().
- Class-fizika.spb.ru ().
- Bolshoyvopros.ru ().
العمل في المنزل
- تحديد كمية المادة.
- قم بتسمية وحدة قياس كتلة الجزيء أو الذرة.
- تحديد الوزن الجزيئي النسبي.


الأحكام الأساسية لتكنولوجيا المعلومات والاتصالات. كتلة وحجم الجزيئات. كمية المادة. الفيزياء الجزيئية
MKT سهل!
"لا يوجد شيء إلا الذرات والفضاء الفارغ..." - ديموقريطس
"يمكن لأي جسم أن ينقسم إلى ما لا نهاية" - أرسطو
المبادئ الأساسية للنظرية الحركية الجزيئية (MKT)
الغرض من تكنولوجيا المعلومات والاتصالات- وهذا شرح لتركيب وخصائص الأجسام العيانية المختلفة والظواهر الحرارية التي تحدث فيها، وذلك من خلال حركة وتفاعل الجزيئات التي تتكون منها الأجسام.
الأجسام العيانية- هذا أجساد كبيرةتتكون من عدد كبير من الجزيئات.
الظواهر الحرارية- الظواهر المرتبطة بتسخين وتبريد الأجسام.
البيانات الرئيسية لتكنولوجيا المعلومات والاتصالات
1. تتكون المادة من جزيئات (جزيئات وذرات).
2. وجود فجوات بين الجزيئات.
3. تتحرك الجزيئات بشكل عشوائي ومستمر.
4. تتفاعل الجزيئات مع بعضها البعض (تجذب وتتنافر).
تأكيد ام كي تي:
1. تجريبي
- التكسير الميكانيكي للمادة؛ إذابة مادة في الماء؛ ضغط وتوسيع الغازات. تبخر؛ تشوه الهيئات. انتشار؛ تجربة بريجمان: يُسكب الزيت في وعاء، ويضغط مكبس فوق الزيت، عند ضغط 10000 ضغط جوي، يبدأ الزيت بالتسرب عبر جدران الوعاء الفولاذي؛
انتشار؛ الحركة البراونية للجزيئات في السائل تحت تأثير الجزيئات؛
ضعف الانضغاط للمواد الصلبة و الأجسام السائلة; جهد كبير لكسر المواد الصلبة; دمج القطرات السائلة.
2. مباشر
- التصوير وتحديد أحجام الجسيمات. 
الحركة البراونية
الحركة البراونية هي الحركة الحرارية للجزيئات العالقة في السائل (أو الغاز).
لقد أصبحت الحركة البراونية دليلاً على الحركة المستمرة والفوضوية (الحرارية) لجزيئات المادة.
- اكتشفه عالم النبات الإنجليزي ر. براون عام 1827
- شرح نظري يعتمد على MCT قدمه أ. أينشتاين في عام 1905.
- أكده تجريبيا الفيزيائي الفرنسي جي بيرين.
كتلة وحجم الجزيئات
أحجام الجسيمات
قطر أي ذرة حوالي سم.

عدد الجزيئات في المادة
حيث V هو حجم المادة، Vo هو حجم جزيء واحد
كتلة جزيء واحد
حيث m هي كتلة المادة،
ن - عدد الجزيئات في المادة
وحدة الكتلة في النظام الدولي للوحدات: [m]= 1 كجم
في الفيزياء الذريةتقاس الكتلة عادة بوحدات الكتلة الذرية (amu).
تقليديا، يعتبر 1 أمو. :
الوزن الجزيئي النسبي للمادة
لتسهيل الحسابات، يتم تقديم الكمية - الكتلة الجزيئية النسبية للمادة.
يمكن مقارنة كتلة جزيء أي مادة بـ 1/12 من كتلة جزيء الكربون.
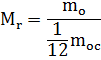
حيث البسط هو كتلة الجزيء والمقام هو 1/12 كتلة ذرة الكربون
هذه كمية لا أبعاد لها، أي. لا يوجد لديه وحدات القياس
الكتلة الذرية النسبية للعنصر الكيميائي
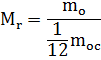
حيث البسط هو كتلة الذرة والمقام هو 1/12 كتلة ذرة الكربون
الكمية بلا أبعاد، أي. لا يوجد لديه وحدات القياس
يتم إعطاء الكتلة الذرية النسبية لكل عنصر كيميائي في الجدول الدوري.
طريقة أخرى لتحديد الكتلة الجزيئية النسبية للمادة
الكتلة الجزيئية النسبية للمادة تساوي مجموع الكتل الذرية النسبية للعناصر الكيميائية التي تشكل جزيء المادة.
نحن نأخذ الكتلة الذرية النسبية لأي عنصر كيميائي من الجدول الدوري!)
كمية المادة
تحدد كمية المادة (ν) العدد النسبي للجزيئات في الجسم.
حيث N هو عدد الجزيئات في الجسم، وNa هو ثابت أفوجادرو
وحدة قياس كمية المادة في نظام SI: [ν]= 1 مول
1 مول- هذه هي كمية المادة التي تحتوي على عدد من الجزيئات (أو الذرات) يساوي عدد ذرات الكربون التي يبلغ وزنها 0.012 كجم.
يتذكر!
1 مول من أي مادة تحتوي على نفس العددالذرات أو الجزيئات!
لكن!
نفس الكميات من المادة مواد مختلفةلها كتل مختلفة!
ثابت أفوجادرو
يسمى عدد الذرات الموجودة في 1 مول من أي مادة برقم أفوجادرو أو ثابت أفوجادرو:
الكتلة المولية
الكتلة المولية (M) هي كتلة المادة المأخوذة في مول واحد، أو بخلاف ذلك فهي كتلة مول واحد من المادة.
الكتلة الجزيئية
- ثابت أفوجادرو
وحدة الكتلة المولية: [M]=1 كجم/مول.
صيغ لحل المشكلات
يتم الحصول على هذه الصيغ عن طريق استبدال الصيغ المذكورة أعلاه.
كتلة أي كمية من المادة
الطريقة الأكثر أهمية لتحديد الأوزان الجزيئية للمواد الغازية تعتمد على قانون أفوجادرو. ولكن قبل الحديث عن هذه الطريقة، ينبغي أن نتذكر ما هي الوحدات الجزيئية و الأوزان الذرية.
عند حساب الأوزان الذرية، تم في البداية اعتبار وزن ذرة الهيدروجين، كأخف عنصر، واحدًا، وتم حساب الأوزان الذرية للعناصر الأخرى بالنسبة إليه. ولكن بما أن معظم العناصر يتم تحديد الأوزان الذرية منها مركبات الأكسجينفي الواقع، تم إجراء الحسابات فيما يتعلق بالوزن الذري للأكسجين، والذي اعتبر مساوياً لـ 16. وكان من المفترض أن تكون النسبة بين الأوزان الذرية للأكسجين والهيدروجين هي 16:1. بعد ذلك أكثر بحث دقيقوأظهر أن هذه النسبة هي 15.88:1، أو 16:1.008. ولذلك، إذا افترضنا أن الوزن الذري للهيدروجين هو 1، فإن الوزن الذري للأكسجين سيكون 15.88. ولأسباب عملية، تقرر ترك الوزن الذري للأكسجين عند 16، مع أخذ الوزن الذري 1.008 للهيدروجين.
وبالتالي، فإن الوحدة الحالية للوزن الذري هي 1/16 من وزن ذرة الأكسجين. تسمى هذه الوحدة "وحدة الأكسجين". وزن ذرة الهيدروجينيساوي 1.008 وحدة أكسجين، ووزن ذرة الكبريت 32.06 وحدة أكسجين، وهكذا.
الذري وزن عنصر مُسَمًّى وزن له ذرة, ارتفاعمتزوج V الأكسجين وحدات.
منذ وزن جزيء أي يساوي المبلغأوزان الذرات التي تتكون منها، فمن الواضح أنه يجب التعبير عن الأوزان الجزيئية بنفس وحدات الأوزان الذرية. على سبيل المثال، وزن جزيء الهيدروجين المكون من ذرتين يساوي 2.016 وحدة أكسجين؛ وزن جزيء الأكسجين، الذي يتكون أيضًا من ذرتين، يساوي 32 وحدة أكسجين؛ وزن جزيء الماء الذي يحتوي على ذرتي هيدروجين وذرة أكسجين واحدة هو 16 + 2.016 = 18.016 وحدة أكسجين وهكذا.
جزيئي وزن بسيط أو معقد أسماءيختلف وزن له جزيئات, أعرب V الأكسجين وحدات.
دعونا نرى الآن كيف يتم تحديد الأوزان الجزيئية للمواد الغازية.
وفقًا لقانون أفوجادرو، تحتوي الحجوم المتساوية من الغازات المأخوذة عند نفس الضغط ونفس درجة الحرارة على عدد متساوجزيئات. ويترتب على ذلك الأوزان أحجام متساويةيجب أن يرتبط الغازان ببعضهما البعض كأوزانهما الجزيئية.
لنأخذ، على سبيل المثال، لترًا واحدًا من غازين مختلفين. دع كل واحد منهم يحتوي على ن جزيئات. دعونا نشير إلى وزن لتر من الغاز الأول ز، والثاني من خلال ز 1. دعونا نشير إلى الأوزان الجزيئية للغازات، على التوالي، بواسطة م و م 1.
وبما أن وزن لتر من الغاز يساوي مجموع أوزان الجزيئات الموجودة فيه، = ن ز م و ز 1 = ن م 1
وبقسمة المساواة الأولى على الثانية نحصل على: (1) تسمى نسبة وزن غاز معين إلى وزن نفس الحجم من غاز آخر عند نفس درجة الحرارة ونفس الضغط كثافة الغاز الأول بالنسبة إلى الثاني. على سبيل المثال، 1ل تسمى نسبة وزن غاز معين إلى وزن نفس الحجم من غاز آخر عند نفس درجة الحرارة ونفس الضغط كثافة الغاز الأول بالنسبة إلى الثاني. على سبيل المثال، 1 يزن ثاني أكسيد الكربون 1.98 جم، و1
الهيدروجين في نفس الظروف هو 0.09 جم، حيث ستكون كثافة ثاني أكسيد الكربون بالنسبة للهيدروجين 1.98: 0.09 = 22. تدل على كثافة الغاز بالحرف د،
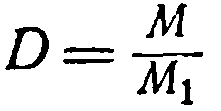
لنعيد كتابة المعادلة (1):
ز = أين ز 1 = ن (2)
د وزن جزيئي غاز له يساوي كثافة بواسطة سلوك إلى آخر غاز, مضروبة على وزن جزيئي ثانية
غاز.
م في كثير من الأحيان، يتم تحديد كثافة الغازات المختلفة فيما يتعلق بالهيدروجين باعتباره الأخف وزنًا بين جميع العلب. بما أن الوزن الجزيئي للهيدروجين نفسه هو 2.016، ففي هذه الحالة تأخذ صيغة حساب الأوزان الجزيئية الشكل:
= 2.016 د
م = 2 أين
أو إذا قمنا بتقريب الوزن الجزيئي للهيدروجين إلى 2:
م = 2 22 = 44
بحساب، على سبيل المثال، باستخدام هذه الصيغة الوزن الجزيئي لثاني أكسيد الكربون، الذي تبلغ كثافته للهيدروجين، كما هو موضح أعلاه، 22، نجد:
غالبًا ما يتم حساب الوزن الجزيئي للغاز أيضًا بناءً على كثافته في الهواء. على الرغم من أن الهواء عبارة عن خليط من عدة غازات، إلا أنه لا يزال بإمكاننا التحدث عن متوسط الوزن الجزيئي للهواء، والذي يتم تحديده من كثافة الهواء بدلالة الهيدروجين. الوزن الجزيئي للهواء الموجود بهذه الطريقة هو 29. تدل على كثافة الغاز قيد الدراسة في الهواء من خلال D 1، نحصل عليهاالصيغة التالية
لحساب الأوزان الجزيئية:
م = 29 د 1
ومن الناحية العملية، فإن تحديد الوزن الجزيئي يتلخص في قياس وزن وحجم كمية معينة من الغاز قيد الدراسة وحساب كثافته، وبعد ذلك يتم العثور على الوزن الجزيئي مباشرة من الصيغة. يمكن حساب كثافة الغاز بالنسبة لأي غاز آخر يكون وزنه الجزيئي ووزنه لكل وحدة حجم معروفة. ولكن بما أن الكتب المرجعية تشير إلى أوزان الغازات في الظروف العادية، ومن خلال التجربة عادة ما يكون من الضروري قياس وزن وحجم الغاز قيد الدراسة في ظروف أخرى، فمن أجل حساب كثافة الغاز من الضروري أولاً إحضار الحجم المقاس للغاز في الظروف العادية (0 درجة و 760 مم ضغط).
يتم التخفيض إلى الظروف العادية على أساس معادلة الجمع قوانين الغازبويل ماريوت وجاي لوساك:

أين صو υ - ضغط وحجم الغاز في ظل الظروف التجريبية، على التوالي؛ ف 0 — ضغط الدم الطبيعي υ 0 - حجم الغاز في الظروف العادية؛ ت - درجة الحرارة المطلقةغاز.
