1. Bazơ tác dụng với axit tạo thành muối và nước:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O
2. C oxit axit, tạo thành muối và nước:
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
3. Chất kiềm phản ứng với oxit và hydroxit lưỡng tính tạo thành muối và nước:
2NaOH + Cr 2 O 3 = 2NaCrO 2 + H 2 O
KOH + Cr(OH) 3 = KCrO 2 + 2H 2 O
4. Chất kiềm phản ứng với muối hòa tan, tạo thành bazơ yếu, kết tủa hoặc khí:
2NaOH + NiCl 2 = Ni(OH) 2 ¯ + 2NaCl
căn cứ
2KOH + (NH 4) 2 SO 4 = 2NH 3 + 2H 2 O + K 2 SO 4
Ba(OH) 2 + Na 2 CO 3 = BaCO 3 ¯ + 2NaOH
5. Chất kiềm phản ứng với một số kim loại tạo thành oxit lưỡng tính:
2NaOH + 2Al + 6H 2 O = 2Na + 3H 2
6. Ảnh hưởng của kiềm đến chất chỉ thị:
Ồ - + phenolphtalein® màu đỏ thẫm
Ồ - + quỳ ® màu xanh da trời
7. Sự phân hủy của một số bazơ khi đun nóng:
Сu(OH) 2 ® CuO + H 2 O
Hydroxit lưỡng tính – hợp chất hóa học, thể hiện tính chất của cả bazơ và axit. Hydroxit lưỡng tính tương ứng với oxit lưỡng tính (xem đoạn 3.1).
Hydroxit lưỡng tính thường được viết dưới dạng bazơ, nhưng chúng cũng có thể được biểu diễn dưới dạng axit:
Zn(OH) 2 Û H 2 ZnO 2
sự thành lập
Tính chất hóa học hydroxit lưỡng tính
1. Hiđroxit lưỡng tính tác dụng với axit và oxit axit:
Be(OH) 2 + 2HCl = BeCl 2 + 2H 2 O
Be(OH) 2 + SO 3 = BeSO 4 + H 2 O
2. Tương tác với chất kiềm và oxit cơ bản kiềm và kim loại kiềm thổ:
Al(OH) 3 + NaOH = NaAlO 2 + 2H 2 O;
Axit natri metaaluminat H 3 AlO 3
(H 3 AlO 3 ® HAlO 2 + H 2 O)
2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Mọi hiđroxit lưỡng tính đều là chất điện li yếu
muối
muối- Cái này chất phức tạp, bao gồm các ion kim loại và dư lượng axit. Muối là sản phẩm của sự thay thế hoàn toàn hoặc một phần ion hydro bằng ion kim loại (hoặc amoni) trong axit. Các loại muối: trung bình (bình thường), axit và bazơ.
Muối trung bình- đây là sản phẩm của sự thay thế hoàn toàn các cation hydro trong axit bằng các ion kim loại (hoặc amoni): Na 2 CO 3, NiSO 4, NH 4 Cl, v.v.
Tính chất hóa học của muối trung bình
1. Muối tương tác với axit, kiềm và các muối khác, tạo thành chất điện ly yếu hoặc kết tủa; hoặc khí:
Ba(NO 3) 2 + H 2 SO 4 = BaSO 4 ¯ + 2HNO 3
Na 2 SO 4 + Ba(OH) 2 = BaSO 4 ¯ + 2NaOH
CaCl 2 + 2AgNO 3 = 2AgCl¯ + Ca(NO 3) 2
2CH 3 COONa + H 2 SO 4 = Na 2 SO 4 + 2CH 3 COOH
NiSO 4 + 2KOH = Ni(OH) 2 ¯ + K 2 SO 4
căn cứ
NH 4 NO 3 + NaOH = NH 3 + H 2 O + NaNO 3
2. Muối tương tác với kim loại hoạt động mạnh hơn. Hơn kim loại hoạt động thay thế chất kém hoạt động hơn khỏi dung dịch muối (Phụ lục 3).
Zn + CuSO 4 = ZnSO 4 + Cu
Muối axit - đây là những sản phẩm của sự thay thế không hoàn toàn các cation hydro trong axit bằng các ion kim loại (hoặc amoni): NaHCO 3, NaH 2 PO 4, Na 2 HPO 4, v.v. Muối axit chỉ có thể được tạo thành bởi axit đa bazơ. Hầu như tất cả các muối axit đều hòa tan cao trong nước.
Thu được muối axit và chuyển chúng thành muối trung bình
1. Muối axit thu được bằng cách cho axit dư hoặc oxit axit phản ứng với bazơ:
H 2 CO 3 + NaOH = NaHCO 3 + H 2 O
CO 2 + NaOH = NaHCO 3
2. Khi axit dư tác dụng với oxit bazơ:
2H 2 CO 3 + CaO = Ca(HCO 3) 2 + H 2 O
3. Muối axit thu được từ muối trung bình bằng cách thêm axit:
· cùng tên
Na 2 SO 3 + H 2 SO 3 = 2NaHSO 3;
Na 2 SO 3 + HCl = NaHSO 3 + NaCl
4. Muối axit được chuyển thành muối trung bình bằng chất kiềm:
NaHCO 3 + NaOH = Na 2 CO 3 + H 2 O
muối cơ bản– đây là sản phẩm của sự thay thế không hoàn toàn các nhóm hydroxo (OH - ) căn cứ dư lượng axit: MgOHCl, AlOHSO4, v.v. Muối bazơ chỉ có thể được tạo thành bởi bazơ yếu của kim loại có hóa trị nhiều. Các muối này thường ít tan.
Thu được muối cơ bản và chuyển chúng thành muối trung bình
1. Muối bazơ thu được bằng cách cho bazơ dư phản ứng với axit hoặc oxit axit:
Mg(OH) 2 + HCl = MgOHCl¯ + H 2 O
hydroxo-
magiê clorua
Fe(OH) 3 + SO 3 = FeOHSO 4 ¯ + H 2 O
hydroxo-
sắt(III) sunfat
2. Muối bazơ được hình thành từ muối trung bình bằng cách thêm chất kiềm:
Fe 2 (SO 4) 3 + 2NaOH = 2FeOHSO 4 + Na 2 SO 4
3. Muối cơ bản được chuyển thành muối trung bình bằng cách thêm axit (tốt nhất là axit tương ứng với muối):
MgOHCl + HCl = MgCl2 + H 2 O
2MgOHCl + H 2 SO 4 = MgCl 2 + MgSO 4 + 2H 2 O
ĐIỆN GIẢI
Chất điện giải- là những chất phân hủy thành ion trong dung dịch dưới tác dụng của các phân tử dung môi phân cực (H 2 O). Dựa trên khả năng phân ly (phân hủy thành các ion), chất điện giải thường được chia thành mạnh và yếu. Chất điện ly mạnh phân ly gần như hoàn toàn (trong dung dịch loãng), trong khi chất điện ly yếu chỉ phân ly một phần thành ion.
ĐẾN chất điện giải mạnh bao gồm:
· axit mạnh(xem trang 20);
· lý do mạnh mẽ– chất kiềm (xem trang 22);
· Hầu hết các muối hòa tan.
Chất điện li yếu bao gồm:
axit yếu (xem trang 20);
· Bazơ không có tính kiềm;
Một trong những đặc điểm chính của chất điện ly yếu là hằng số phân ly – ĐẾN . Ví dụ, đối với axit monobasic,
HA Û H + +A - ,
trong đó là nồng độ cân bằng của ion H+;
– nồng độ cân bằng của anion axit A - ;
- nồng độ cân bằng của các phân tử axit,
Hoặc cho nền móng yếu,
MOH Û M + +Ôi - ,
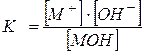 ,
,
trong đó là nồng độ cân bằng của cation M +;
– nồng độ cân bằng của ion hydroxit OH - ;
- nồng độ cân bằng của các phân tử bazơ yếu.
Hằng số phân ly của một số chất điện ly yếu(tại t = 25°С)
| Chất | ĐẾN | Chất | ĐẾN |
| HCOOH | K = 1,8×10 -4 | H3PO4 | K 1 = 7,5×10 -3 |
| CH3COOH | K = 1,8×10 -5 | K 2 = 6,3×10 -8 | |
| HN | K = 7,9×10 -10 | K 3 = 1,3×10 -12 | |
| H2CO3 | K 1 = 4,4×10 -7 | HClO | K = 2,9×10 -8 |
| K2 = 4,8×10 -11 | H3BO3 | K 1 = 5,8×10 -10 | |
| HF | K = 6,6×10 -4 | K2 = 1,8×10 -13 | |
| HNO2 | K = 4,0×10 -4 | K 3 = 1,6×10 -14 | |
| H2SO3 | K 1 = 1,7×10 -2 | H2O | K = 1,8×10 -16 |
| K 2 = 6,3×10 -8 | NH 3 × H 2 O | K = 1,8×10 -5 | |
| H2S | K 1 = 1,1×10 -7 | Al(OH) 3 | K 3 = 1,4×10 -9 |
| K2 = 1,0×10 -14 | Zn(OH)2 | K 1 = 4,4×10 -5 | |
| H2SiO3 | K 1 = 1,3×10 -10 | K 2 = 1,5×10 -9 | |
| K2 = 1,6×10 -12 | Cd(OH)2 | K 2 = 5,0×10 -3 | |
| Fe(OH)2 | K 2 = 1,3×10 -4 | Cr(OH)3 | K3 = 1,0×10 -10 |
| Fe(OH) 3 | K2 = 1,8×10 -11 | Ag(OH) | K = 1,1×10 -4 |
| K 3 = 1,3×10 -12 | Pb(OH)2 | K 1 = 9,6×10 -4 | |
| Cu(OH)2 | K 2 = 3,4×10 -7 | K 2 = 3,0×10 -8 | |
| Ni(OH)2 | K 2 = 2,5×10 -5 |
4.4 Phân hủy nhiệt bazơ không tan trong nước.
Nhiều bazơ không tan trong nước bị phân hủy khi đun nóng. Sản phẩm phân hủy sẽ là oxit của kim loại tương ứng và nước. Nhiệt độ gia nhiệt phụ thuộc vào kim loại là một phần của đế và dao động từ 200°C trở lên.
Chúng ta hãy viết các phản ứng phân hủy kẽm, đồng và nhôm hydroxit:
Sản phẩm của các phản ứng trên là nước và oxit kim loại: , và .
4.5 Tương tác với muối kim loại.
Phản ứng này là đặc trưng của chất kiềm. Kali hydroxit. natri Liti tương tác với muối kim loại, kết quả là các hydroxit không hòa tan của các kim loại này kết tủa:
Sử dụng các phản ứng này, người ta thu được hydroxit không tan trong nước của nhiều kim loại, sau đó được sử dụng trong tổng hợp hóa học, y học, v.v.
Chương 5. Ứng dụng bazơ trong hóa học và công nghiệp.
Bazơ được sử dụng rộng rãi trong phòng thí nghiệm hóa học và công nghiệp hóa chất, họ tìm thấy ứng dụng của mình trong cuộc sống hàng ngày.
Chúng ta hãy xem xét các ứng dụng của các căn cứ được sử dụng rộng rãi nhất.
Trong các phòng thí nghiệm hóa học và trong công nghiệp, natri hydroxit là một trong những thuốc thử phổ biến nhất.
Natri hiđroxit, .
Dùng để sản xuất các loại muối natri: sunfat, nitrat, nitrit, cromat, silicat hoặc nước thủy tinh, muối Florida axit hữu cơ. Nó được sử dụng trong sản xuất bột giấy từ gỗ trong quá trình nấu giấy kraft, sợi nhân tạo, xà phòng và chất tẩy rửa, chất làm ướt và chất nhũ hóa, thuốc nhuộm, oxit nhôm từ bauxite, phenol. Bao gồm trong chất điện phân để làm xanh thép, oxy hóa kim loại, đặc biệt là nhôm, dùng cho quá trình điện phân trong công nghệ thiếc và kẽm.
Kali hydroxit, .
Dùng làm nguyên liệu ban đầu để sản xuất nhiều muối kali, xà phòng lỏng và một số thuốc nhuộm. Nó được sử dụng làm chất điện phân, cùng với lithium hydroxit, trong pin niken-cadmium, dưới dạng dung dịch cồn để sản xuất xanthate - chất trung gian trong sản xuất chất tuyển nổi.
Amoni hydroxit, .
Sản lượng của nó trên thế giới vào khoảng 10 - 12 triệu tấn. Nó được sử dụng làm phân bón trong sản xuất thức ăn chăn nuôi để tăng giá trị dinh dưỡng và làm chất bảo quản trong sản xuất soda, thuốc nhuộm, trong sản xuất điện phân các hợp chất mangan, trong thực hành thí nghiệm.
Canxi hiđroxit, .
Canxi hydroxit (vôi tôi) được sử dụng trong sản xuất vật liệu xây dựng; vữa vôi được làm từ nó. Nó được sử dụng để làm thuốc tẩy (hỗn hợp) và các hợp chất canxi khác, phân bón vôi và chất bảo vệ thực vật. Canxi hydroxit được dùng để làm mềm nước, thuộc da và trung hòa nước thải, cô lập muối của axit hữu cơ từ nước ép thực vật.
Liti hydroxit, .
Nó được sử dụng để làm đầy pin kiềm, giúp tăng tuổi thọ của chúng và được sử dụng để sản xuất men và thủy tinh.
Magiê hydroxit, .
Được sử dụng trong ngành xây dựng, như một thành phần của vật liệu kết cấu chống cháy, để sản xuất đồ gốm sứ hóa học. Được sử dụng trong y học như một chất trung hòa nhẹ (đối với độ axit cao nước dạ dày).
Các ứng dụng cho các hydroxit khác ít phổ biến hơn được liệt kê trong Bảng 3
Bảng 3. Ứng dụng của hydroxit kim loại.
| № | Tên hydroxit | Hóa chất | Ứng dụng |
| 1. | đồng hydroxit | Được sử dụng làm chất màu cho thủy tinh, men và men, chất gắn màu để nhuộm vải và làm thuốc diệt nấm. Chất ổn định nylon để điều chế thuốc thử Schweitzer. | |
| 2. | kẽm hydroxit | Chất độn cao su, thành phần sơn, trong thú y là thành phần của thuốc mỡ. | |
| 3. | Coban hydroxit | Dùng để sản xuất chất xúc tác, chất màu,... |
|
| 4. | Cadimi hydroxit | Được sử dụng để điều chế các hợp chất cadmium, làm thuốc thử phân tích, để tạo ra khối lượng hoạt động trong các nguồn dòng cadmium. | |
| 5. | Nhôm hydroxit | Nó được sử dụng để sản xuất các hợp chất nhôm, làm chất chống cháy trong sơn và nhựa, thành phần của kem đánh răng, chất bao bọc và chất hấp phụ trong y học. | |
| 6. | berili hydroxit | Dùng để sản xuất gốm sứ chịu lửa. nồi nấu kim loại, một bộ phận của kính có khả năng truyền tia UV tốt. | |
| 7. | Thiếc hydroxit | Để khắc vải, đặc biệt là lụa. | |
| 8. | Chì hydroxit | Dùng để khắc vải, làm kính, chất độn pin. | |
| 9. | Bismut hydroxit | Được sử dụng trong sản xuất men và gốm sứ, pha lê và các sản phẩm đặc biệt. thủy tinh, để sản xuất vật liệu siêu âm | |
| 10. | crom hydroxit | Được sử dụng trong hóa học phân tích. | |
| 11. | Mangan hydroxit | Được sử dụng để thu được các hợp chất mangan. | |
| 12. | Hydroxit sắt | Cơ sở sản xuất sắt kim loại, bột màu |
Phần kết luận.
Nền tảng là một trong những lớp chất vô cơ, cùng với axit, oxit và muối, tạo thành nền tảng của hóa học vô cơ. Chúng được sử dụng rộng rãi trong khu vực khác nhau hóa học và công nghiệp hóa chất. Với sự giúp đỡ của họ, người ta thu được phân bón, vật liệu xây dựng, kính màu. Không có chúng, chúng ta sẽ mất đi những loại pin kiềm nhẹ và tiết kiệm cũng như nhiều vật tư y tế.
Nhiệm vụ của công việc này là hệ thống hóa kiến thức về lớp chất vô cơ này. hóa chất làm nền tảng, cần phải tập hợp các chất hóa học và tính chất vật lý sản xuất và sử dụng chúng trong công nghiệp.
Đang tiến hành đặc biệt chú ýđược dành để làm nổi bật khái niệm bazơ, là một trong những loại chất vô cơ dựa trên lý thuyết axit-bazơ hiện đại của Brønsted, Lewis, Izmailov. Usanovich. Cũng được xem xét phương pháp công nghiệp thu được chất kiềm bằng cách sử dụng ví dụ về natri hydroxit [3, art. 36 – 42 ]. Nhiều sự chú ý trả tiền cho các phương pháp sử dụng bazơ cả trong cuộc sống hàng ngày và trong các ngành công nghiệp hóa chất, y tế và xây dựng, nơi họ tìm thấy ứng dụng của mình. Các lĩnh vực ứng dụng chính của các chất cụ thể được liệt kê trong bảng tham khảo đặc biệt để dễ sử dụng.
Việc nghiên cứu tính chất của bazơ đã giá trị lớn trong nghiên cứu hóa học, cũng như phát triển thế giới quan khoa học.
Danh sách tài liệu được sử dụng
1. Glinka N. L. Hóa học đại cương. – L.: Hóa học, 1988. – 702 tr.
2. Kreshkov A.P., Yaroslavtsev A.A. Khóa học về hóa phân tích. – M.: Hóa học, 1964. – 430 tr.
3. Podobaev N. I. Điện phân. – M.: Giáo dục, 1989, 100 tr.
4. Polees M.E. Hóa phân tích. – M.: Y học, 1981. – 286 tr.
5. Rabinovich V. A., Khavin Z. Ya. sách tham khảo hóa học. – L.: Hóa học, 1978. – 331 tr.
6. Hóa học: Công bố tham khảo/ biên tập. W. Schröter, K.-H, Lautenschläger, H. Bibrak và cộng sự: Trans. với anh ấy. – M.: Hóa học, 1989. – 648 tr.
7. Bách khoa toàn thư hóa học trong 5 tập / ed. I. L. Knunyants. – M.: bách khoa toàn thư Liên Xô, 1990.
8. Shchukarev S. A. Hóa vô cơ. – M.: trường sau đại học, 1970. – 437 tr.
Ở Hà Lan, nơi cả hai nước đều bán len và là nơi người Anh giúp đỡ Gueuze, người nổi dậy chống lại ách thống trị của Tây Ban Nha. Dưới những điều kiện này, khi đó phát triển nhanh chóng quan hệ tư sản ở Anh Thế giới mới- hậu phương của Tây Ban Nha, kho bạc giàu có nhất và thị trường rộng lớn nhất - đã trở thành mục tiêu và miếng mồi ngon cho các nhà thám hiểm người Anh, những người tháo vát. thương gia người Anh và các quý ông. Cướp biển ở vùng biển...
Cây. Không có ích gì khi thổi phồng một cách giả tạo những mâu thuẫn giữa chủ nghĩa lấy sinh thái và sinh học làm trung tâm. Sẽ tốt hơn nhiều khi nói về những gì gắn kết họ, những điểm chung của họ, những gì có thể làm cơ sở cho nền tảng chungđạo đức môi trường. Đây là những điều sau đây điểm quan trọng: 1) mọi thứ, cả cá thể, loài sinh vật và hệ sinh thái, đều có lợi ích, quyền lợi, giá trị nội tại của riêng mình, bởi vì chúng đều có giá trị...
Đối với 1,5% dân số của họ. Vì vậy, tôi tránh xa vấn đề cái gì mạnh và cái gì yếu xã hội dân sự, Tôi chuyển sang câu hỏi thứ tư trong lịch trình của mình - về xã hội dân sự và tăng trưởng kinh tế. Cùng tác giả của lý thuyết về hành động tập thể mà tôi đã đề cập, Mansur Olson, đã hỏi rất câu hỏi thú vị– nhân tiện, về đất nước của chúng tôi. Bạn không thể nhìn thấy mặt đối mặt. Chúng ta...
Nghiên cứu địa chất và khoa học đất, chúng ta phải chấp nhận rằng nhiệm vụ của địa mạo chỉ là nghiên cứu các tính chất hình học chứ không nghiên cứu các tính chất vật chất. bề mặt trái đất. Trong công thức toán học, điều này có nghĩa là đối tượng nghiên cứu của địa mạo không nên được coi là ranh giới của chính tập L mà là ánh xạ của nó vào không gian P, tức là. bề mặt trong không gian Euclide ba chiều, nguyên mẫu...
Thể chất và tính chất hóa học căn cứ. Biện pháp phòng ngừa an toàn khi làm việc với chất kiềm. Khái niệm hiđroxit lưỡng tính
Các bazơ tan trong nước (kiềm) là chất rắn trắng, tan nhiều trong nước. Tại nhiệt độ phòng Ca (OH)2 và Sr (OH)2 có độ hòa tan thấp. Bazơ không tan trong nước là chất rắn, ví dụ Al (OH)3 có màu trắng, Cu (OH)2 màu xanh, Fe(OH)3 có màu nâu.
Các bazơ hòa tan và không hòa tan thể hiện một số tính chất hóa học phổ biến và đặc biệt.
1. Ảnh hưởng của dung dịch kiềm đến dung dịch chỉ thị (chỉ điển hình cho chất kiềm). Trong dung dịch kiềm, giấy quỳ và giấy chỉ thị phổ thông có màu xanh, metyl da cam có màu vàng cam, còn phenolphtalein có màu đỏ thẫm.
2. Sự tương tác của bazơ với axit tạo thành phản ứng trung hòa muối và nước (đặc điểm của cả hai bazơ hòa tan, và không hòa tan):
KOH + HCl = KCl + H2O
3. Sự tương tác của bazơ với oxit axit tạo thành muối và nước (chỉ điển hình cho chất kiềm):
2NaOH + CO2 = Na2CO3 + H2O
4. Sự tương tác của bazơ với dung dịch muối để tạo thành bazơ khác và muối khác (chỉ điển hình cho chất kiềm):
2KOH + CuSO4 = K2SO4 + Cu(OH)2 ¯
Thành phần muối phản ứng với dung dịch kiềm phải có kim loại có khả năng tạo thành bazơ không tan.
5. Phân hủy bazơ không hòa tan khi đun nóng tạo thành oxit và nước (chỉ đặc trưng cho các bazơ không tan):
2Fe(OH)3 Fe2O3 + 3H2O
Khi làm việc với chất kiềm, bạn nên hết sức cẩn thận vì đồng cỏ có chứa các chất rất hung hãn. Nếu dung dịch kiềm dính vào da, bạn phải rửa ngay bằng nước chảy cho đến khi mất cảm giác ngọt ngào thì rửa sạch (trung hòa) bằng dung dịch. axit yếu(acetic hoặc boric) và đến trạm sơ cứu.
Chúng ta đã phát hiện ra rằng bazơ phản ứng với axit trong phản ứng trung hòa, tạo thành muối. Các bazơ với bazơ, cũng như axit với axit, không tham gia phản ứng trung hòa. Nhưng có những hydroxit phản ứng với cả axit và bazơ, tạo thành muối. Các hydroxit như vậy được gọi là chất lưỡng tính. Hydroxit lưỡng tính thể hiện tính chất của bazơ trong phản ứng với axit và tính chất của axit trong phản ứng với bazơ. Tất cả các hiđroxit lưỡng tính đều tan kém trong nước. Chúng bao gồm kẽm hydroxit Zn (OH)2, nhôm hydroxit Al (OH)3, berili hydroxit Be (OH)2, crom (III) hydroxit Cr (OH)3, ferrum (III) hydroxit Fe (OH)3 và các loại khác. Chúng ta hãy xem xét các tính chất hóa học của hydroxit lưỡng tính sử dụng kẽm hydroxit làm ví dụ.
1. Phản ứng với axit tạo thành muối và nước:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2. Tác dụng với kiềm tạo thành muối và nước:
Zn(OH)2 + 2NaOH Na2ZnO2 + 2H2O
