Hubungan antara penempatan unsur dalam Jadual Berkala dan sifat unsur kimia, bahan mudah, sebatian unsur dengan hidrogen dan oksigen. Konsep jejari atom dan keelektronegatifan unsur
Mari kita pertimbangkan hubungan antara kedudukan unsur dalam Jadual Berkala dan sifat unsur kimia seperti jejari atom, keelektronegatifan, sifat logam dan bukan logam.
Jejari atom ialah nilai yang menunjukkan saiz kulit elektron atom. Ini adalah kuantiti yang sangat penting di mana sifat atom unsur kimia bergantung. Dalam subkumpulan utama, apabila cas nukleus atom meningkat, bilangan tahap elektronik, oleh itu, jejari atom bertambah dengan peningkatan nombor atom dalam subkumpulan utama. Dalam tempoh terdapat peningkatan dalam cas nukleus atom unsur kimia, yang membawa kepada peningkatan daya tarikan elektron luar ke nukleus. Di samping itu, apabila cas nukleus bertambah, bilangan elektron bertambah sebanyak peringkat luaran, bagaimanapun, bilangan tahap elektronik tidak meningkat. Keteraturan ini membawa kepada pengetatan kulit elektron di sekeliling nukleus. Oleh itu, jejari atom berkurangan dengan peningkatan nombor atom dalam tempoh.
Sebagai contoh, mari kita susun unsur kimia O (oksigen), C (Karbon), Li (lithium), F (fluorin), N (nitrogen) mengikut urutan jejari atom yang berkurangan. Unsur kimia yang diberikan berada dalam tempoh kedua. Dalam satu tempoh, jejari atom berkurangan dengan peningkatan nombor atom. Oleh itu, unsur kimia yang ditunjukkan mesti ditulis dalam susunan nombor siri yang semakin meningkat: Li, C, N, O, F (Litium, Karbon, nitrogen, oksigen, fluorin)
Keelektronegatifan ialah keupayaan atom dalam sebatian untuk menarik elektron valens, i.e. elektron yang membantu membentuk ikatan kimia antara atom. Keelektronegatifan bergantung kepada keupayaan nukleus atom untuk menarik elektron dari luar tahap tenaga. Semakin kuat daya tarikan, semakin besar keelektronegatifan. Semakin kecil jejari atom, semakin besar daya tarikan antara elektron tahap tenaga luar. Akibatnya, perubahan dalam elektronegativiti dalam tempoh dan subkumpulan utama akan bertentangan dengan perubahan dalam jejari atom. Oleh itu, dalam subkumpulan utama, keelektronegatifan berkurangan dengan peningkatan nombor atom. Dalam tempoh dengan peningkatan nombor atom, keelektronegatifan meningkat.
Sebagai contoh, mari kita susun unsur kimia Br (Bromin), F (fluorin), I (Iodin), Cl (Klorin) mengikut urutan peningkatan elektronegativiti. Unsur kimia yang diberikan adalah dalam subkumpulan utama kumpulan ketujuh. Dalam subkumpulan utama, keelektronegatifan berkurangan dengan peningkatan nombor atom. Oleh itu, unsur kimia yang ditunjukkan mesti ditulis dalam susunan menurun nombor sirinya: I, Br, Cl, F (Iodin, Bromin, Klorin, fluorin).
Sifat logam ialah sifat atom unsur kimia untuk melepaskan elektron. Unsur kimia yang mempamerkan sifat logam biasanya mempunyai satu hingga tiga elektron dalam kulit luarnya. Sifat bukan logam ialah sifat atom unsur kimia untuk menerima elektron. Unsur kimia yang menunjukkan sifat bukan logam biasanya mempunyai empat hingga lapan elektron dalam kulit luarnya. Lebih mudah elektron dilepaskan daripada tahap tenaga luaran, lebih besar sifat logam dan, oleh itu, semakin kecil sifat bukan logam. Lebih mudah untuk melepaskan elektron dari tahap tenaga luaran, lebih besar jejari atom disebabkan oleh fakta bahawa daya tarikan antara nukleus dan elektron berkurangan dengan peningkatan jarak antara mereka. Akibatnya, perubahan dalam sifat logam unsur kimia akan serupa dengan perubahan dalam jejari atomnya. Oleh itu, dalam subkumpulan utama, sifat logam meningkat dengan peningkatan nombor siri, dan dalam tempoh dengan peningkatan nombor siri, sifat logam berkurangan. Sifat bukan logam, sebaliknya, dalam subkumpulan utama berkurangan dengan peningkatan nombor siri, dan dalam tempoh dengan peningkatan nombor siri mereka meningkat.
Sebagai contoh, mari kita susun unsur kimia Al, S, Mg, Cl, Na mengikut urutan meningkatkan sifat bukan logam. Unsur kimia yang diberikan berada dalam tempoh ketiga. Dalam tempoh, sifat bukan logam meningkat dengan peningkatan nombor atom. Oleh itu, unsur kimia yang ditunjukkan mesti ditulis dalam susunan nombor siri yang semakin meningkat: Na, Mg, Al, S, Cl Mari kita pertimbangkan hubungan antara kedudukan unsur kimia dalam Jadual Berkala dan sifat oksida dan hidroksida yang sepadan. yang membentuk unsur-unsur kimia ini, menggunakan unsur-unsur zaman ketiga sebagai contoh. Tempoh ketiga termasuk unsur kimia: Na, Mg, Al, Si, P, S, Cl, Ar
Unsur-unsur ini membentuk oksida yang lebih tinggi daripada komposisi berikut (unsur kimia lengai Argon tidak membentuk oksida): Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
Natrium oksida dan magnesium oksida mempamerkan sifat oksida asas, aluminium oksida ialah oksida amfoterik, semua oksida (silikon (IV) oksida, fosforus (V) oksida, sulfur (VI) oksida, klorin (VII) oksida) mempamerkan sifat oksida berasid. Di samping itu, dalam siri Na2O - MgO sifat asas melemahkan, dan dalam siri SiO2 - P2O5 - SO3 - Cl2O7 sifat asid semakin giat.
Ia juga mungkin untuk menganalisis sifat perubahan sifat hidroksida semasa tempoh, yang sepadan dengan oksida yang lebih tinggi: NaOH, Mg (OH)2, Al (OH)3, H2SiO3, H3PO4, H2SO4, HClO4.
Natrium hidroksida dan magnesium hidroksida mempamerkan sifat bes, aluminium hidroksida ialah amfoterik hidroksida, semua hidroksida lain mempamerkan sifat asid: asid silikat, asid ortofosfat, asid sulfurik, asid klorik. Di samping itu, dalam siri NaOH - Mg (OH)2 sifat asas melemahkan, dan dalam siri H2SiO3 - H3PO4 - H2SO4 - HClO4 sifat berasid meningkat.
Oleh itu, dalam satu siri unsur tertentu, sifat oksida asas dan hidroksida yang sepadan dengannya dilemahkan, manakala sifat berasid dalam arah yang sama dipertingkatkan. Peralihan daripada asas kepada asid oksida, dan, dengan itu, daripada bes kepada asid dijalankan dalam tempoh disebabkan oleh oksida amfoterik atau hidroksida. Corak ini sah untuk tempoh kedua dan ketiga jadual berkala. Untuk unsur tempoh yang lama, corak kompleks diperhatikan.
Di bawah jejari atom merujuk kepada jarak antara teras yang diberikan atom dan orbit elektronnya yang paling jauh. Hari ini, unit ukuran yang diterima umum untuk jejari atom ialah picometer (pm). Tentukan jejari atom sangat mudah.
Anda akan perlukan
- Jadual berkala Mendeleev
Arahan
Pertama sekali, anda harus mempunyai jadual berkala biasa, di mana segala-galanya disusun mengikut urutan diketahui oleh manusia unsur kimia. Sangat mudah untuk mencari jadual ini dalam mana-mana buku rujukan kimia, buku teks sekolah, atau ia boleh dibeli secara berasingan di kedai buku tempatan anda.
Di sebelah kanan sudut atas Setiap unsur kimia mempunyainya nombor siri. Nombor ini bertepatan sepenuhnya dengan nombor atom jejari diberi atom.
Sebagai contoh, nombor atom klorin (Cl) ialah 17. Ini bermakna jarak dari nukleus atom klorin ke orbit terjauhnya, pergerakan elektron stabil ialah 17 petang. Jika anda perlu mencari bukan sahaja jejari atom, tetapi juga pengagihan elektron ke atas orbit elektron, maka data ini boleh ditekankan daripada lajur nombor yang terletak di sebelah kanan nama unsur kimia.
Struktur planet Bumi dibahagikan kepada teras, mantel dan kerak. Teras – bahagian tengah, terletak paling jauh dari permukaan. Mantel terletak di bawah kerak dan di atas biji. Akhirnya, korteks adalah yang luar cangkang keras planet.

Arahan
Salah satu yang pertama mencadangkan kewujudan biji Ahli kimia dan fizik British Henry Cavendish pada abad ke-18. Dia berjaya mengira jisim dan ketumpatan purata Bumi. Beliau membandingkan ketumpatan Bumi dengan ketumpatan batuan di permukaan. Ia didapati bahawa ketumpatan permukaan jauh di bawah purata.
Ahli seismologi Jerman E. Wichert membuktikan kewujudan biji Tanah pada tahun 1897. Ahli geofizik Amerika B. Guttenberg pada tahun 1910 menentukan kedalaman biji– 2900 km. Menurut saintis, teras terdiri daripada nikel dan unsur-unsur lain dengan pertalian untuk besi: emas, karbon, kobalt, germanium dan lain-lain.
Purata jejari biji ialah 3500 kilometer. Di samping itu, di dalam bangunan biji Bumi membebaskan pepejal teras dalam, mempunyai jejari kira-kira 1300 kilometer, dan cecair di luar jejari ohm kira-kira 2200 kilometer. Di tengah biji suhu mencecah 5000°C. Mass biji dianggarkan hampir 2 10^24 kg.
Analogi boleh dibuat antara struktur planet dan struktur atom. Atom juga mempunyai bahagian tengah, nukleus, dengan sebahagian besar jisim tertumpu dalam nukleus. Dimensi nukleus atom membentuk beberapa femtometer (dari bahasa Latin femto - 15). Awalan "femto" bermaksud mendarab dengan sepuluh hingga tolak kuasa kelima belas. Oleh itu, nukleus atom adalah 10 ribu kali lebih kecil daripada atom itu sendiri, dan 10^21 kali saiz yang lebih kecil biji Bumi.
Untuk menilai jejari planet, gunakan kaedah geokimia dan geofizik tidak langsung. Dalam kes atom, pereputan nukleus berat dianalisis, tidak mengambil kira geometri jejari, Berapa banyak jejari tindakan kuasa nuklear. Idea struktur planet atom dikemukakan oleh Rutherford. Pergantungan besar-besaran biji daripada jejari tetapi tidak linear.
Sila ambil perhatian
Terima kasih kepada jadual berkala, sangat mudah untuk mencari bukan sahaja jejari atom, tetapi juga jisim atom, berat molekul, tempoh dan siri unsur tertentu, serta taburan elektron dalam orbit elektron bersama dengan bilangan orbit.
Model atom yang paling popular adalah yang diterima pakai pada tahun 1913 oleh Niels Bohr. Ia juga dikenali sebagai model planet. Ini disebabkan oleh fakta bahawa elektron, seperti planet sistem suria, bergerak mengelilingi Matahari - nukleus atom. Orbit pergerakan elektron adalah malar. Pembangunan model ini memberi dorongan kepada pembangunan hala tuju baharu dalam fizik teori - mekanik kuantum.
Jejari pertama orbit pergerakan elektron dipanggil jejari Bohr, dan tenaga elektron dalam orbit pertama dipanggil tenaga pengionan atom.
Nasihat yang berguna
Perlu diingat bahawa jejari mana-mana atom adalah berkadar songsang dengan bilangan proton dalam nukleusnya, serta sama dengan caj terasnya.
Menentukan jejari atom juga menimbulkan beberapa masalah. Pertama, atom bukanlah sfera dengan permukaan dan jejari yang ditentukan dengan ketat. Ingat bahawa atom ialah nukleus yang dikelilingi oleh awan elektron. Kebarangkalian untuk mengesan elektron semasa ia bergerak menjauhi nukleus secara beransur-ansur meningkat kepada maksimum tertentu, dan kemudian secara beransur-ansur berkurangan, tetapi menjadi sama dengan sifar hanya pada jarak yang tidak terhingga jauh. Kedua, jika kita tetap memilih beberapa syarat untuk menentukan jejari, jejari sedemikian masih tidak boleh diukur secara eksperimen.
Percubaan membenarkan kami untuk menentukan hanya jarak internuklear, dengan kata lain, panjang ikatan (dan kemudian dengan tempahan tertentu yang diberikan dalam kapsyen kepada Rajah 2.21). Untuk menentukannya, analisis difraksi sinar-X atau kaedah pembelauan elektron (berdasarkan pembelauan elektron) digunakan. Jejari atom diandaikan sebagai sama dengan separuh jarak internuklear terkecil antara atom yang sama.
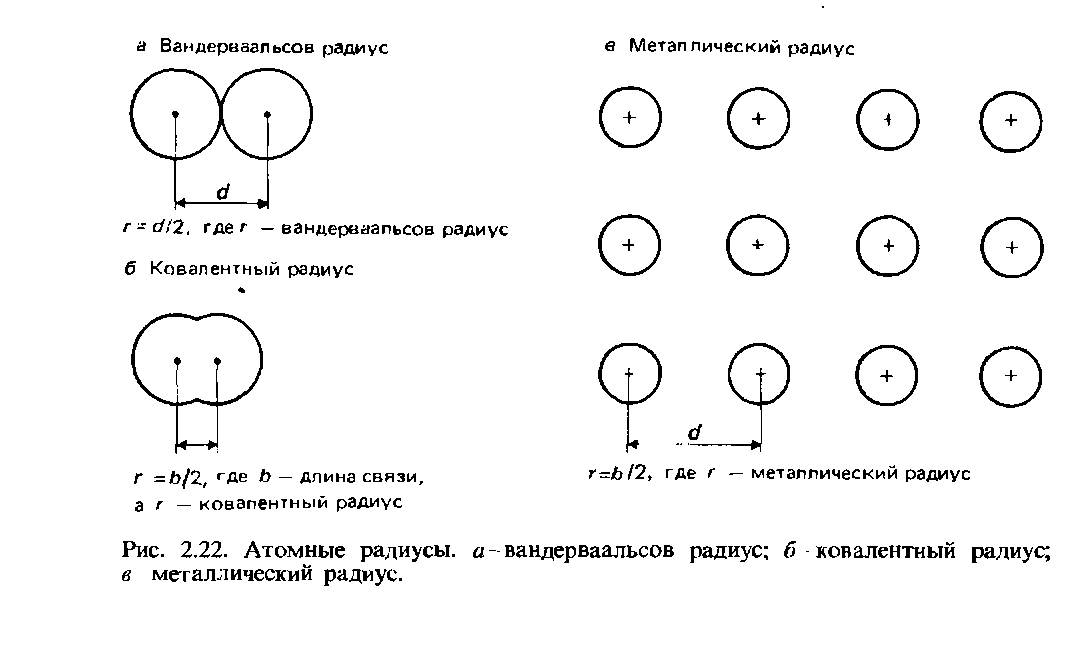
Jejari Vander Waals. Bagi atom yang tidak terikat, separuh daripada jarak internuklear terkecil dipanggil jejari van der Waals. Takrifan ini digambarkan oleh Rajah. 2.22.
nasi. 2.21. Panjang pautan. Oleh kerana molekul sentiasa bergetar, jarak internuklear, atau panjang ikatan, tidak mempunyai nilai tetap. Lukisan ini secara skematik mewakili getaran linear molekul diatomik ringkas. Getaran tidak membenarkan panjang ikatan ditakrifkan hanya sebagai jarak antara pusat dua atom terikat. Lagi definisi yang tepat kelihatan seperti ini: panjang ikatan ialah jarak antara atom terikat, diukur antara pusat jisim dua atom dan sepadan dengan tenaga ikatan minimum. Tenaga minimum ditunjukkan pada lengkung Morse (lihat Rajah 2.1).

Jadual 2.6. Ketumpatan alotrop karbon dan sulfur Jadual 2.7. Panjang ikatan karbon-karbon
Jejari kovalen.Jejari kovalen ditakrifkan sebagai separuh jarak internuklear (panjang ikatan) antara dua atom yang sama terikat antara satu sama lain ikatan kovalen (Gamb. 2.22, b). Sebagai contoh, mari kita ambil molekul klorin Cl2, panjang ikatannya ialah 0.1988 nm. Jejari kovalen klorin diandaikan 0.0944 nm.
Mengetahui jejari kovalen atom satu unsur, anda boleh mengira jejari kovalen atom unsur lain. Sebagai contoh, secara eksperimen tetapkan nilai Panjang ikatan C-Cl dalam CH3Cl ialah 0.1767 nm. Menolak jejari kovalen klorin (0.0994 nm) daripada nilai ini, kita dapati jejari kovalen karbon ialah 0.0773 nm. Kaedah pengiraan ini adalah berdasarkan prinsip aditiviti, mengikut mana jejari atom mematuhi undang-undang mudah tambahan. Oleh itu, panjang ikatan C-Cl ialah jumlah jejari kovalen karbon dan klorin. Prinsip aditiviti hanya digunakan untuk ikatan kovalen ringkas. Ikatan kovalen berganda dan rangkap tiga adalah lebih pendek (Jadual 2.7).
Panjang ikatan kovalen ringkas juga bergantung pada persekitarannya dalam molekul. Contohnya, panjang Ikatan C-H berbeza daripada 0.1070 nm pada atom karbon tersubstitusi kepada 0.115 nm dalam sebatian CH3CN.
Jejari logam. Jejari logam diandaikan sama dengan separuh jarak internuklear antara ion jiran dalam kekisi kristal logam (Rajah 2.22, c). Istilah jejari atom biasanya merujuk kepada jejari kovalen atom unsur bukan logam, dan istilah jejari logam kepada atom unsur logam.
Jejari ionik. Jejari ionik ialah satu daripada dua bahagian jarak internuklear antara ion monoatomik (mudah) bersebelahan dalam sebatian ionik kristal (garam). Menentukan jejari ionik juga penuh dengan masalah yang besar, kerana jarak antara ionik diukur secara eksperimen, dan bukan jejari ionik itu sendiri. Jarak interion bergantung pada pembungkusan ion dalam kekisi kristal. Dalam Rajah. 2.23 menunjukkan tiga cara yang mungkin pembungkusan ion dalam kekisi kristal. Malangnya, jarak interionik yang diukur secara eksperimen
nasi. 2.23. Jejari ionik, c-anion bersentuhan antara satu sama lain, tetapi kation tidak menyentuh anion; b-kation bersentuhan dengan anion, tetapi anion tidak bersentuhan antara satu sama lain; ke dalam susunan ion yang diterima secara konvensional, di mana kation bersentuhan dengan anion dan anion bersentuhan antara satu sama lain. Jarak a ditentukan secara eksperimen. Ia diambil sebagai dua kali jejari anion. Ini membolehkan kita mengira jarak interion b, iaitu jumlah jejari anion dan kation. Mengetahui jarak interion b, kita boleh mengira jejari kation itu.
jangan benarkan kami menilai yang mana antara tiga kaedah pembungkusan ini sebenarnya dijalankan dalam setiap satu kes tertentu. Masalahnya ialah untuk mencari perkadaran untuk membahagikan jarak interion kepada dua bahagian yang sepadan dengan jejari dua ion, dengan kata lain, untuk memutuskan di mana satu ion sebenarnya berakhir dan di mana yang lain bermula. Seperti yang ditunjukkan, sebagai contoh, dalam Rajah. 2.12, soalan ini tidak dapat diselesaikan walaupun dengan kad ketumpatan elektron garam Untuk mengatasi kesukaran ini, biasanya diandaikan bahawa: 1) jarak interion ialah hasil tambah dua jejari ionik, 2) ion berbentuk sfera, dan 3) sfera bersebelahan bersentuhan antara satu sama lain. Andaian terakhir sepadan dengan kaedah pembungkusan ion yang ditunjukkan dalam Rajah. 2.23, f Jika satu jejari ion diketahui, jejari ion lain boleh dikira berdasarkan prinsip ketambahan.
Padanan jejari pelbagai jenis. Dalam jadual 2.8 menunjukkan nilai jejari pelbagai jenis untuk tiga unsur tempoh ke-3. Ia adalah mudah untuk melihat bahawa yang paling nilai yang besar tergolong dalam jejari anionik dan van der Waals. Dalam Rajah. 11.9 membandingkan saiz ion dan atom untuk semua unsur tempoh ke-3, kecuali argon. Saiz atom ditentukan oleh jejari kovalennya. Perlu diingatkan bahawa kation lebih kecil daripada atom, dan anion adalah saiz besar daripada atom unsur yang sama. Bagi setiap unsur daripada semua jenis jejari nilai terkecil sentiasa tergolong dalam jejari kation.
Jadual 2.8. Perbandingan jejari atom pelbagai jenis


Penentuan eksperimen. Untuk menentukan bentuk molekul ringkas dan ion poliatomik, atau lebih tepat lagi, panjang ikatan dan sudut ikatan (sudut antara ikatan), pelbagai kaedah eksperimen. Ini termasuk spektroskopi gelombang mikro, serta kaedah untuk mengkaji pembelauan x-ray(pembelauan sinar-x), neutron (pembelauan neutron) atau elektron (pembelauan elektron). Bab seterusnya memperincikan bagaimana pembelauan sinar-X boleh digunakan untuk menentukan struktur kristal. Walau bagaimanapun, pembelauan elektron (kaedah untuk mengkaji pembelauan elektron) biasanya digunakan untuk menentukan bentuk molekul ringkas dalam fasa gas. Kaedah ini berdasarkan penggunaan sifat gelombang elektron. Pancaran elektron dialirkan melalui sampel gas yang dikaji. Molekul gas menyerakkan elektron, menghasilkan corak difraksi. Dengan menganalisisnya, adalah mungkin untuk menentukan panjang ikatan dan sudut ikatan dalam molekul. Kaedah ini adalah serupa dengan yang digunakan dalam analisis corak pembelauan yang dibentuk oleh penyerakan sinar-X.
Jejari atom jejari atom
ciri-ciri yang memungkinkan untuk menganggarkan jarak interatom (internuklear) dalam molekul dan kristal. Jejari atom berada pada urutan 0.1 nm. Ditentukan terutamanya daripada data X-ray analisis struktur.
JARIUS ATOMJARIUS ATOM, ciri-ciri yang membolehkan seseorang menganggarkan jarak interatom (internuklear) dalam molekul dan kristal.
Jejari berkesan atom atau ion difahami sebagai jejari sfera tindakannya, dan atom (ion) dianggap sebagai bola tak boleh mampat. Menggunakan model planet atom, ia diwakili sebagai nukleus di sekelilingnya dalam orbit (cm. ORBITALS) elektron berputar. Urutan unsur dalam Jadual Berkala Mendeleev sepadan dengan jujukan pengisian cengkerang elektronik. Jejari berkesan ion bergantung pada pengisian kulit elektron, tetapi ia tidak sama dengan jejari orbit luar. Untuk menentukan jejari berkesan, atom (ion) dalam struktur kristal diwakili sebagai bola tegar yang bersentuhan, supaya jarak antara pusatnya adalah sama dengan jumlah jejari. Jejari atom dan ionik ditentukan secara eksperimen daripada pengukuran sinar-X jarak antara atom dan dikira secara teori berdasarkan konsep mekanik kuantum.
Saiz jejari ionik mematuhi undang-undang berikut:
1. Dalam satu baris menegak jadual berkala, jejari ion ialah c caj yang sama bertambah dengan bertambah nombor atom, kerana bilangan kulit elektron bertambah, dan dengan itu saiz atom.
2. Untuk unsur yang sama, jejari ion bertambah dengan bertambahnya cas negatif dan berkurangan dengan peningkatan caj positif. Jejari anion lebih besar daripada jejari kation, kerana anion mempunyai lebihan elektron, dan kation mempunyai kekurangan. Sebagai contoh, untuk Fe, Fe 2+, Fe 3+ jejari berkesan ialah 0.126, 0.080 dan 0.067 nm, masing-masing, untuk Si 4-, Si, Si 4+ jejari berkesan ialah 0.198, 0.118 dan 0.040 nm.
3. Saiz atom dan ion mengikut periodicity sistem Mendeleev; pengecualian ialah unsur dari No. 57 (lanthanum) hingga No. 71 (lutetium), di mana jejari atom tidak bertambah, tetapi berkurangan secara seragam (yang dipanggil penguncupan lantanida), dan unsur dari No. 89 (actinium) dan seterusnya (penguncupan aktinida yang dipanggil).
Jejari atom unsur kimia bergantung pada nombor koordinasi (cm. NOMBOR PENYELARASAN). Peningkatan dalam nombor koordinasi sentiasa disertai dengan peningkatan dalam jarak interatomik. Dalam kes ini, perbezaan relatif dalam nilai jejari atom yang sepadan dengan dua nombor koordinasi yang berbeza tidak bergantung pada jenis ikatan kimia (dengan syarat jenis ikatan dalam struktur dengan nombor koordinasi yang dibandingkan adalah sama). Perubahan dalam jejari atom dengan perubahan dalam nombor koordinasi dengan ketara mempengaruhi magnitud perubahan isipadu semasa transformasi polimorfik. Sebagai contoh, apabila menyejukkan seterika, transformasinya daripada pengubahsuaian dengan kekisi padu berpusat muka kepada pengubahsuaian dengan kekisi padu berpusat badan, yang berlaku pada 906 o C, harus disertai dengan peningkatan jumlah sebanyak 9%, sebenarnya peningkatan dalam volum ialah 0.8%. Ini disebabkan oleh fakta bahawa disebabkan oleh perubahan dalam nombor koordinasi dari 12 kepada 8, jejari atom besi berkurangan sebanyak 3%. Iaitu, perubahan dalam jejari atom semasa transformasi polimorfik sebahagian besarnya mengimbangi perubahan isipadu yang sepatutnya berlaku jika jejari atom tidak berubah. Jejari atom unsur hanya boleh dibandingkan jika mereka mempunyai nombor koordinasi yang sama.
Jejari atom (ion) juga bergantung kepada jenis ikatan kimia.
Dalam kristal dengan ikatan logam (cm. PAUTAN LOGAM) jejari atom ditakrifkan sebagai separuh jarak antara atom antara atom terdekat. Dalam kes penyelesaian pepejal (cm. PENYELESAIAN PADAT) jejari atom logam berbeza dalam cara yang kompleks.
Jejari kovalen unsur dengan ikatan kovalen difahami sebagai separuh jarak interatomik antara atom terdekat yang disambungkan oleh ikatan kovalen tunggal. Ciri jejari kovalen ialah ketekalannya dalam struktur kovalen yang berbeza dengan nombor koordinasi yang sama. Jadi, jarak masuk ikatan tunggal S-S dalam berlian dan hidrokarbon tepu adalah sama dan sama dengan 0.154 nm.
Jejari ionik dalam bahan dengan ikatan ionik (cm. Ikatan IONIK) tidak boleh ditentukan sebagai separuh daripada jumlah jarak antara ion berdekatan. Sebagai peraturan, saiz kation dan anion berbeza dengan ketara. Di samping itu, simetri ion berbeza daripada sfera. Terdapat beberapa pendekatan untuk menganggar jejari ionik. Berdasarkan pendekatan ini, jejari ionik unsur dianggarkan, dan kemudian jejari ionik unsur lain ditentukan daripada jarak interatomik yang ditentukan secara eksperimen.
Jejari Van der Waals menentukan saiz atom yang berkesan gas mulia. Selain itu, jejari atom van der Waals dianggap separuh jarak antara nuklear antara atom serupa terdekat yang tidak bersambung antara satu sama lain. ikatan kimia, iaitu kepunyaan molekul yang berbeza (contohnya, dalam kristal molekul).
Apabila menggunakan jejari atom (ionik) dalam pengiraan dan pembinaan, nilainya hendaklah diambil daripada jadual yang dibina mengikut satu sistem.
Kamus Ensiklopedia. 2009 .
Lihat apakah "jejari atom" dalam kamus lain:
Ciri-ciri atom yang memungkinkan untuk menganggarkan jarak interatomik (internuklear) dalam molekul dan kristal. Atom tidak mempunyai sempadan yang jelas, bagaimanapun, mengikut konsep kuantum. mekanik, kebarangkalian mencari elektron untuk sesuatu tertentu jarak dari inti... ... Ensiklopedia fizikal
Ciri-ciri yang membolehkan seseorang menganggarkan jarak antara atom (internuklear) dalam molekul dan kristal. Ditentukan terutamanya daripada data analisis struktur sinar-X... Kamus Ensiklopedia Besar
Ciri-ciri berkesan atom, membolehkan anggaran jarak interatom (internuklear) dalam molekul dan kristal. Menurut konsep mekanik kuantum, atom tidak mempunyai sempadan yang jelas, tetapi kebarangkalian untuk mencari elektron... ... Ensiklopedia kimia
Ciri-ciri atom yang memungkinkan untuk menganggarkan jarak interatomik dalam bahan. Menurut mekanik kuantum, atom tidak mempunyai sempadan yang pasti, tetapi kebarangkalian untuk mencari elektron pada jarak yang diberi daripada nukleus atom, bermula dari... ... Ensiklopedia Soviet yang Hebat
