Lad os huske: 1. Grundloven, der beskriver gassernes tilstand, kaldes loven om _______. 2. Et mol af enhver gas optager et volumen på _____. 3.Atmosfærisk luft består hovedsageligt af __ og ____. 4. En allotrop modifikation af oxygen er ____. 5.Den letteste gas -______ opnås i Kip-apparatet. 6. Kuldioxid produceres i industrien ved at riste _______. 7. Ammoniak genkendes af farveændringen på vådt lakmuspapir fra rød til ______.


Prøv at løse: mulighed 1. Opgave 1. Hvilket volumen (ved normale forhold) vil 2 mol kuldioxid optage? Opgave 2. En person udånder 1300 g kuldioxid om dagen. Bestem dens volumen ved jordoverfladen. Mulighed 2 Opgave 1. Hvor meget nitrogen er der i 6,72 liter af denne gas? Opgave 2. Ved vejrtrækning forbruger en person omkring 56 liter ilt (n.o.) i timen. Hvor meget ilt indtager en person om dagen?



Funktioner af den flydende tilstand af stof. 1. Molekyler er placeret direkte ved siden af hinanden, derfor er væsker dårligt komprimerbare, i modsætning til gasser; 2. Væske, dvs. har ingen form, men tager formen af det kar, hvori de er placeret; 3. I en tilstand af vægtløshed tager de form af en bold eller et rundt drop.

Vand i naturen. Den vigtigste flydende stof er vand, der dækker 2/3 af jordens overflade. 97,2 % samlet lager falder på verdenshavets vande. Lager ferskvand på Jorden kun 2,8 %, men hvoraf kun 0,3 % er egnet til brug vandressourcer. Dyr, planter og mennesker består af % vand tab af % kropsvægt som følge af dehydrering fører til kroppens død. Takket være vandets kredsløb i naturen er dets reserver praktisk talt uudtømmelige. Vandets kredsløb består af 2 processer: fordampning og kondensering.

Hvad gør vandet unikt? Fysiske egenskaber vand bestemmes af strukturen af dets molekyler, samt intermolekylære bindinger. Vandmolekyler har en vinkelform, vinklen HOH er lig med Dette fører til fremkomsten af 2 poler i molekylet. Elektrondensitet bevæger sig mod iltatomet. Vandmolekylets polaritet gør det til et universelt opløsningsmiddel.

Vand har et unormalt højt smelte- og kogepunkt. Sammenlign molekylvægtene af vand og andre hydrider af gruppe 6 A grundstoffer med deres kogepunkter. H2O – M(H2O) = 18 g/mol Væske! H2S- M(H2S) = 34 g/ mol Gas H2Se- M (H2Se) = 81 g/ mol Gas H2Te- M(H2Te) = 130 g/ mol 0 0 Gas Konklusion: I grupper med stigende molekylær vægt forbindelser øges stoffernes koge- og smeltepunkter. Årsag unormal høj temperatur kogende vand, tilstedeværelsen af intermolekylære hydrogenbindinger.


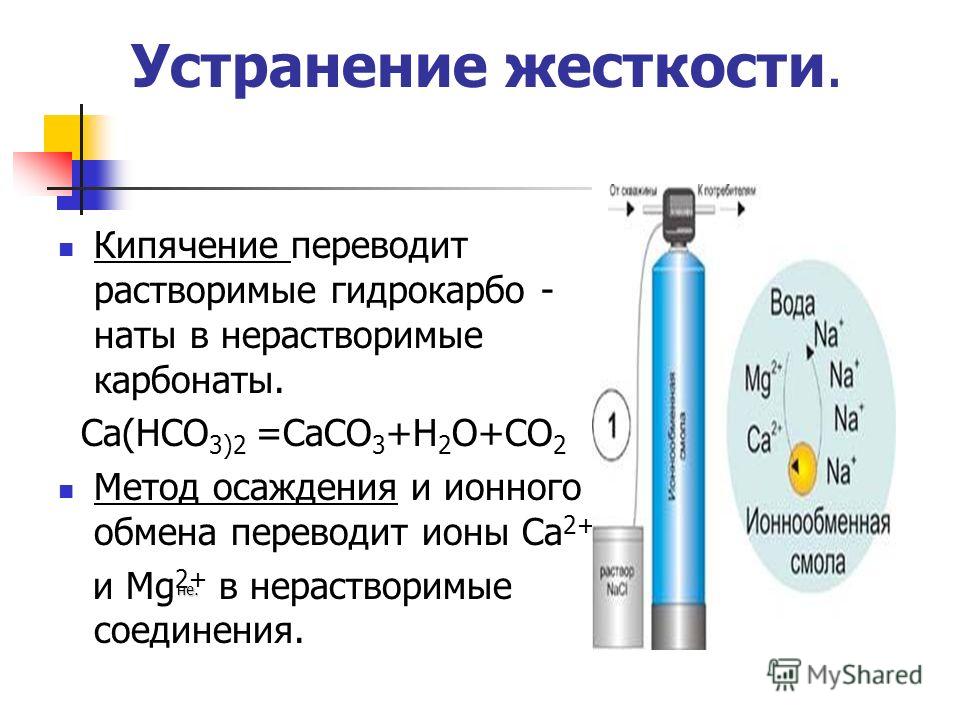
Kan vand være "hårdt"? Hårdheden af naturlige farvande kan variere afhængigt af året: den falder om vinteren og stiger om sommeren. Hårdheden af naturlige farvande kan variere afhængigt af året: den falder om vinteren og stiger om sommeren. Naturligt vand, indeholdende i opløsning et stort antal af calcium- og magnesiumsalte kaldes hårdt vand. Naturligt vand, der indeholder en stor mængde calcium- og magnesiumsalte i opløsning, kaldes hårdt vand. Indholdet af calcium- og magnesiumsalte i vand afhænger også af sammensætningen af jorden i grundvandsmagasinerne. Indholdet af calcium- og magnesiumsalte i vand afhænger også af sammensætningen af jorden i grundvandsmagasinerne.


TYPER HÅRDHED. KARBONATHårdhed afhænger af indholdet af calcium- og magnesiumbikarbonater i vand Ca(HCO 3) 2, Mg(HCO 3) 2. Ikke-karbonat-hårdhed er forårsaget af tilstedeværelsen af andre salte i vand, for eksempel calcium- og magnesiumsulfater CaSO 4 MgS04 surt salt produkt ufuldstændig udskiftning af brintatomer i en syre.

Hvad er "hårdt" vand? Hårdt vand er kalk på dele af husholdningsapparater, væggene i kedler og radiatorer. Hårdt vand er kalk på dele af husholdningsapparater, væggene i kedler og radiatorer. Det er dårligt i hårdt vand. Kød koger ikke godt i hårdt vand. kødet er kogt. Sæbe skummer ikke i hårdt vand. Sæbe skummer ikke i hårdt vand.

 Lad os opsummere. Beregn dine point (hvert korrekt testsvar er 1 point) Giv dig selv en score: point - "fem" 10-9 point - "fire" 8-6 point - "tre" mindre end 6 point - "to"!
Lad os opsummere. Beregn dine point (hvert korrekt testsvar er 1 point) Giv dig selv en score: point - "fem" 10-9 point - "fire" 8-6 point - "tre" mindre end 6 point - "to"!


UNDERVISNINGS- OG VIDENSKABSMINISTERIET
DONETSK FOLKEREPUBLIK
Statsprofessionel uddannelsesinstitution
"Donetsk College of Industrial Automation"
Kollektion undervisningsmaterialer Til
Uafhængigt arbejde af studerende (SWS)
Ved disciplin "kemi"
For førsteårsstuderende
Uddannelsens tekniske profil
(samlet volumen-68 timer, heraf 22 timer. -srs)
Opfundet
Specialist
Poplavskaya E.F.
Indsamling af undervisningsmateriale til selvstændigt arbejde af studerende i disciplinen "Kemi" for studerende teknisk profil 1. års studier, GPOU "Donetsk College of Industrial Automation" - 2015
Samlingen kan bruges af elever til at forberede og teste elevernes viden GPOU. Samlingen anbefales også til lærernes arbejde som forberedelse til undervisning i disciplinen "Kemi". Samlet af: Poplavskaya E.F. .- lærer kvalifikationskategori"specialist højeste kategori» GPOU"Donetsk College of Industrial Automation" - 2015
Anmelder: Pugachova O.M. - lærer i kvalifikationskategorien "specialist i den højeste kategori" fra statens uddannelsesinstitution "Donetsk Technical School of Industrial Automation" - lærer i kvalifikationskategorien "specialist i højeste kategori". GPOU"Donetsk College of Industrial Automation" - 2015
Gennemgået og godkendt på et møde i cykluskommissionen for fysiske og kemiske discipliner (protokol nr. 1 dateret 30. september 2015) af O.M.
(Срс 1)
Emne: Gasformig tilstand af stof : Tre tilstande af aggregering af vand. Funktioner af strukturen af gasser. Molært volumen gasformige stoffer. Eksempler på gasformige naturlige blandinger: luft, naturgas. Luftforurening (syreregn, Drivhuseffekt) og kampen mod det. Repræsentanter for gasformige stoffer: brint, oxygen, carbondioxid ammoniak, methan, ethylen. Deres modtagelse, indsamling og anerkendelse.
Materiens flydende tilstand: Vand. Vandets hårdhed og måder at fjerne det på. Mineralvand , deres anvendelse i kantiner og medicinske formål. Flydende krystaller og deres anvendelse.
Fast tilstand stoffer: Amorfe faste stoffer i naturen og i menneskelivet, deres betydning og anvendelse. Krystal struktur stoffer.
Dispergerede systemer: Begrebet spredte systemer. Dispergeret fase og dispersionsmedium. Klassificering af dispergerede systemer afhængig af det dispergerede mediums aggregeringstilstand og dispersionsfasen. Grove systemer: emulsioner, suspensioner, aerosoler. Finfordelte systemer: geler og soler. Sammensætning af stoffer og blandinger. Stoffer med molekylær og ikke-molekylær struktur . Loven om konstanthed af sammensætningen af stoffer. Begrebet "fraktion" og dets varianter: masse (andelen af elementer i en forbindelse, andelen af en komponent i en blanding - andelen af urenheder, andelen af et opløst stof i en opløsning) og volumen. Procentdelen af reaktionsproduktudbyttet sammenlignet med det teoretisk mulige.
Grundlæggende begreber og udtryk om emnet: tre samlede tilstande af vand, flydende tilstand af stof. Fysiske egenskaber. Vandets hårdhed og metoder til dets eliminering, dispergerede systemer, fase, medium, klassificering, grove systemer, fine systemer, kolloide opløsninger, sammensætning af stof og blandinger loven om konstans af sammensætningen af stoffer, begrebet "andel" og dets varianter.
Emne studieplan
(liste over spørgsmål, der kræves for at studere):
1. Tre tilstande af aggregering af vand.
2. Molært volumen af gasformige stoffer.
3. Eksempler på gasformige naturlige blandinger: luft, naturgas.
4. Atmosfærisk forurening (sur regn, drivhuseffekt) og kampen mod den.
5. Materiens flydende tilstand.
6. Vandforbrug i hjemmet og på arbejdet.
7. Vandets hårdhed og måder at fjerne det på.
8. Mineralvand, deres anvendelse til spisning og medicinske formål .
9. Materiens faste tilstand.
10. Begrebet spredte systemer. Klassifikation.
11. Loven om konstanthed af sammensætningen af stoffer. Begrebet "andel" og dets varianter.
Kemikere studerer omdannelsen af stoffer, der findes i tre aggregeringstilstande – gasformig (gasser), væske (væsker) og hårdt (solid amorfe kroppe eller krystaller)
Egenskaber af gasser, væsker, faste stoffer
Gasser. Mest karakteristisk egenskab er komprimerbarhed og evne til at udvide.
Gasser har ikke deres egen form, de udvider sig, indtil de fylder hele beholderen jævnt, hvor de er placeret. Det betyder at gasser ikke har eget bind, de der. Volumenet af en gas bestemmes af volumen af beholderen, hvori den er placeret. Gassen udøver et tryk på beholderens vægge, der er ens i alle retninger. En anden egenskab ved gasser er deres evne til at blande sig med hinanden i ethvert forhold. Gaspartikler er lokaliseret tilfældigt, de er så langt fra hinanden, at der ikke kan opstå nogen tiltrækningskraft mellem dem.
Gasformig tilstand der er to ejendommeligheder:
1) afstanden mellem molekyler er normalt flere gange større end deres størrelser;
2) gasser er i stand til at optage hele rumfanget til dem.
Strukturen af gasformige, flydende og faste stoffer kendetegnet ved forskellige afstande imellem små partikler disse stoffer. Partiklerne i en gas er meget længere fra hinanden end i et fast stof el flydende tilstand. I luft, for eksempel, er den gennemsnitlige afstand mellem partikler omkring ti gange diameteren af hver partikel. Således fylder volumenet af molekyler kun omkring 0,1% af det totale volumen. De resterende 99,9% er tom plads. I modsætning hertil fylder væskepartikler omkring 70 % af det samlede væskevolumen.
Gasser i modsætning til væsker og faste stoffer kan forholdsvis let at krympe. For at forstå de strukturelle egenskaber af et gasformigt stof, skal du vide, hvad det molære volumen af en gas er, hvad er forholdet mellem volumenet optaget af en gas og mængden af stof, temperatur og tryk, hvordan man bestemmer den gennemsnitlige afstand mellem gasmolekyler og hvordan den afhænger af dets tryk, med hvilken hastighed molekyler af et gasformigt stof bevæger sig og hvad denne hastighed afhænger af.
Avogadros lov: I lige store volumener forskellige gasser under samme forhold (temperatur og tryk) indeholder samme nummer molekyler.
Det følger af Avogadros lov vigtig konsekvens:
under de samme forhold optager 1 mol af enhver gas det samme volumen. Dette volumen kan beregnes, hvis massen af 1 liter gas er kendt. På normale forhold, dvs. temperatur 273 K (0 ° C) og tryk 101325 Pa, massen af 1 liter brint er 0,09 g, dens molære masse er 1,008 2 = 2,016 g/mol. Så er volumenet optaget af 1 mol brint lig med
2,016 g/mol
(2,016 g/mol)/0,09 g/l=22,4 l/mol.
Under de samme forhold er massen af 1 liter oxygen 1,429 g; molær masse 32 g/mol.
Så er volumen ens
32 g/mol/1,429 g/l = 22,4 l/mol.
Derfor,
Under normale forhold optager 1 mol af forskellige gasser et volumen svarende til 22,4 liter.
Under normale forhold optager 1 mol af forskellige gasser et volumen svarende til 22,4 liter. Dette volumen kaldes gassens molære volumen.
Molært volumen af gas er forholdet mellem et stofs volumen og mængden af det pågældende stof.
Molært volumen af gas – konstant, da det kun afhænger lidt af stoffets beskaffenhed. Det molære volumen ved et tryk på 1 atm (101,3 kPa) og en temperatur på 0 °C (273 K) ifølge Avogadros lov er 22,4 l. En gas, der strengt overholder Avogadros lov, kaldes normalt Perfekt.
De valgte betingelser (1 atm, 0 °C) er navngivet normal (n.s.)
Naturligvis afhænger det molære volumen af en gas af temperatur og tryk. Ved 25 °C og et tryk på 1 atm (disse forhold kaldes standard) molært volumen ideel gas er allerede lig med 24,4 liter.
De molære volumener af reelle gasser under de samme forhold adskiller sig noget fra det molære volumen af en ideel gas.
Molære volumener af nogle gasser ved 0 °C og 1 atm.
Baseret på Avogadros lov udføres forskellige beregninger - beregning af volumen, masse, densitet af gasser under normale forhold, Molar masse gasformige stoffer, samt relativ tæthed gasser
Stoffer har en tendens til at tage det ene eller det andet aggregeringstilstand. Mange stoffer er i form af gasser eller væsker. Desuden har de karakteristiske egenskaber, der er iboende i den tilsvarende aggregeringstilstand.
Definition
I det store hele gasser – kovalente forbindelser(undtagelsen er gruppen ædelgasser) eller simple stoffer. Kompressibilitet og udvidelseskapacitet – karakteristiske egenskaber gasser Gasser er iboende svage bånd mellem de partikler, der udgør dem. Gaspartikler har stor mobilitet, fri kaotisk bevægelse, der opstår i intervallerne mellem deres kollisioner, hvor de kraftigt ændrer karakteren af deres bevægelse.
Væske– stoffernes aggregeringstilstand. Dens vigtigste egenskab er evnen til ubegrænset at ændre form, som transformeres på grund af påvirkningen af mekaniske tangentielle bevægelser, selvom deres kraft er ubetydelig. I dette tilfælde bevarer væsken praktisk talt sit oprindelige volumen. Kovalent (vand) såvel som ioniske forbindelser ( Salpetersyre) og metaller (kviksølv) kan være i flydende tilstand.
Sammenligning
Gasser har ikke egen form og volumen. Når de placeres i et kar, udvider de sig og fordeles jævnt i det, indtil de optager hele volumen. Volumenet af beholderen, hvor gassen er placeret, bestemmer dens volumen. Gas er i stand til at udøve konstant tryk på blodkarvæggene, hvilket er ens i alle retninger. Gasser kan blandes med hinanden i alle forhold.
Væsker, ligesom gasser, er ikke udstyret visse former. De, der har etableret sig under påvirkning af tyngdekraften på et vist niveau, tage form af det kar, som de hældes i. Men i modsætning til gasser har enhver væske et vist volumen. Deres kompressibilitet er ubetydelig. Væsker komprimeres kun mærkbart, når de udsættes for ekstreme højt tryk. Derudover koger, fordamper og kondenserer de.
Konklusioner hjemmeside
- Gasser har ikke et fast volumen, men væsker har. De er ude af stand til at danne frie overflader. Gasser har en tendens til at optage hele det volumen, der er tilgængeligt for dem.
- Væsker er ekstremt svære at komprimere, fordi der er meget lidt ledig plads mellem deres molekyler.
- Der dannes væsker overfladespænding, frie overflader.

