7.11. Strukturen af stoffer med kovalente bindinger
Stoffer, hvori af alle typer kemiske bindinger kun er en kovalent til stede, er opdelt i to ulige grupper: molekylære (meget mange) og ikke-molekylære (meget færre).
Krystaller af faste molekylære stoffer består af molekyler, der er svagt forbundet af kræfterne fra intermolekylær interaktion mellem molekyler. Sådanne krystaller har ikke høj styrke og hårdhed (tænk is eller sukker). Deres smelte- og kogepunkter er også lave (se tabel 22).
Tabel 22. Smelte- og kogepunkter for nogle molekylære stoffer
Stof |
Stof |
||||
| H 2 | – 259 | – 253 | BR 2 | – 7 | 58 |
| N 2 | – 210 | – 196 | H2O | 0 | 100 |
| HCl | – 112 | – 85 | P 4 | 44 | 257 |
| NH 3 | – 78 | – 33 | C10H8 (naphthalen) | 80 | 218 |
| SO 2 | – 75 | – 10 | S 8 | 119 |
I modsætning til deres molekylære modstykker danner ikke-molekylære stoffer med kovalente bindinger meget hårde krystaller. Diamantkrystaller (det hårdeste stof) hører til denne type.
I en diamantkrystal (fig. 7.5) er hvert kulstofatom forbundet med fire andre kulstofatomer ved simple kovalente bindinger (sp 3 hybridisering). Kulstofatomerne danner en tredimensionel ramme. I det væsentlige er hele diamantkrystallen ét enormt og meget stærkt molekyle.
Siliciumkrystaller, der er meget udbredt i radioelektronik og elektronisk teknik, har samme struktur.
Hvis man erstatter halvdelen af kulstofatomerne i diamant med siliciumatomer uden at forstyrre krystallens rammestruktur, får man en krystal af siliciumcarbid SiC - også et meget hårdt stof, der bruges som slibende materiale. Til denne type krystallinske stoffer hører også almindeligt kvartssand (siliciumdioxid). Kvarts er et meget hårdt stof; Under navnet "emery" bruges det også som slibende materiale. Kvartsstrukturen opnås let ved at indsætte oxygenatomer mellem hver to siliciumatomer i en siliciumkrystal. I dette tilfælde vil hvert siliciumatom være forbundet med fire oxygenatomer, og hvert oxygenatom med to siliciumatomer.
Krystaller af diamant, silicium, kvarts og lignende strukturer kaldes atomkrystaller.
En atomisk krystal er en krystal, der består af atomer af et eller flere grundstoffer forbundet med kemiske bindinger.
En kemisk binding i en atomisk krystal kan være kovalent eller metallisk.
Som du allerede ved, er enhver atomisk krystal, ligesom en ionisk krystal, et enormt "supermolekyle". Strukturformlen for et sådant "supermolekyle" kan ikke skrives ned - du kan kun vise dets fragment, for eksempel:

I modsætning til molekylære stoffer er stoffer, der danner atomkrystaller, blandt de mest ildfaste (se tabel 23.).
Tabel 23. Smelte- og kogepunkter for nogle ikke-molekylære stoffer Med kovalente bindinger
Så høje smeltetemperaturer er ganske forståelige, hvis vi husker, at når disse stoffer smelter, er det ikke svage intermolekylære bindinger, der brydes, men stærke kemiske bindinger. Af samme grund smelter mange stoffer, der danner atomkrystaller, ikke ved opvarmning, men nedbrydes eller omdannes straks til en damptilstand (sublimerer), for eksempel sublimerer grafit ved 3700 o C.
| Silicium – Si. Meget hårde, sprøde siliciumkrystaller ligner metal, men det er ikke desto mindre et ikke-metal. Baseret på typen af elektrisk ledningsevne er dette stof klassificeret som en halvleder, hvilket bestemmer dets enorme betydning i den moderne verden. Silicium er det vigtigste halvledermateriale. Radioer, fjernsyn, computere, moderne telefoner, elektroniske ure, solpaneler og mange andre husholdnings- og industrienheder indeholder transistorer, mikrokredsløb og fotoceller lavet af enkeltkrystaller af højrent silicium som de vigtigste strukturelle elementer. Teknisk silicium bruges i stålproduktion og non-ferro metallurgi. Med hensyn til dets kemiske egenskaber er silicium et ret inert stof, det reagerer kun ved høje temperaturer. Siliciumdioxid – SiO 2 . Et andet navn for dette stof er silica. Siliciumdioxid forekommer i naturen i to former: krystallinsk og amorf. Mange halvædelsten og prydsten er sorter af krystallinsk siliciumdioxid (kvarts): bjergkrystal, jaspis, kalcedon, agat. og opal er en amorf form for silica. Kvarts er meget udbredt i naturen, fordi klitter i ørkener og sandbanker af floder og hav er alle kvartssand. Kvarts er et farveløst krystallinsk, meget hårdt og ildfast stof. Det er ringere i hårdhed end diamant og korund, men er ikke desto mindre udbredt som et slibende materiale. Kvartssand er meget udbredt i byggeri og byggematerialeindustrien. Kvartsglas bruges til fremstilling af laboratorieglasvarer og videnskabelige instrumenter, fordi det ikke revner under pludselige temperaturændringer. Med hensyn til dets kemiske egenskaber er siliciumdioxid et surt oxid, men det reagerer kun med alkalier, når det er smeltet. Ved høje temperaturer bruges siliciumdioxid og grafit til at fremstille siliciumcarbid - carborundum. Carborundum er det næsthårdeste stof efter diamant, det bruges også til at lave slibeskiver og "sandpapir". |
7.12. Polariteten af en kovalent binding. Elektronegativitet
Husk på, at isolerede atomer af forskellige grundstoffer har forskellige tilbøjeligheder til både at opgive og acceptere elektroner. Disse forskelle fortsætter efter dannelsen af en kovalent binding. Det vil sige, at atomer af nogle grundstoffer har en tendens til at tiltrække elektronparret af en kovalent binding til sig selv stærkere end atomer af andre grundstoffer.
Overvej et molekyle HCl.
Lad os ved hjælp af dette eksempel se, hvordan vi kan estimere forskydningen af elektronkommunikationsskyen ved hjælp af molære ioniseringsenergier og midler til elektronen. 1312 kJ/mol, og 1251 kJ/mol - forskellen er ubetydelig, omkring 5%. 73 kJ/mol og 349 kJ/mol - her er forskellen meget større: Kloratomets elektronaffinitetsenergi er næsten fem gange større end brintatomets. Ud fra dette kan vi konkludere, at elektronparret af den kovalente binding i hydrogenchloridmolekylet stort set er forskudt mod chloratomet. Med andre ord bruger bindingselektronerne mere tid i nærheden af chloratomet end nær hydrogenatomet. Denne ujævne fordeling af elektrontæthed fører til en omfordeling af elektriske ladninger inde i molekylet. Partielle (overskydende) ladninger opstår på atomerne. på brintatomet er det positivt, og på kloratomet er det negativt.
I dette tilfælde siges bindingen at være polariseret, og selve bindingen kaldes en polær kovalent binding.
Hvis elektronparret i en kovalent binding ikke forskydes til nogen af de bundne atomer, det vil sige, at bindingselektronerne ligeligt hører til de bundne atomer, så kaldes en sådan binding en ikke-polær kovalent binding.
Begrebet "formel ladning" i tilfælde af en kovalent binding er også anvendeligt. Kun i definitionen skal vi ikke tale om ioner, men om atomer. Generelt kan følgende definition gives.
I molekyler, hvor kovalente bindinger kun dannes ved en udvekslingsmekanisme, er atomernes formelle ladninger lig med nul. I HCl-molekylet er de formelle ladninger på både chlor- og hydrogenatomerne således nul. I dette molekyle er de reelle (effektive) ladninger på klor- og brintatomerne derfor lig med de partielle (overskydende) ladninger.
Det er ikke altid let at bestemme fortegnet for den partielle ladning på et atom af et eller andet grundstof i et molekyle baseret på de molære ioniseringsenergier og affinitet for elektroden, det vil sige at estimere i hvilken retning elektronparrene af bindinger er forskudt. Normalt bruges en anden energikarakteristik for et atom til disse formål - elektronegativitet.
I øjeblikket er der ingen enkelt, generelt accepteret betegnelse for elektronegativitet. Det kan betegnes med bogstaverne E/O. Der findes heller ikke en enkelt, generelt accepteret metode til beregning af elektronegativitet. På en forenklet måde kan det repræsenteres som halvdelen af summen af de molære ioniseringsenergier og elektronaffinitet - dette var en af de første måder at beregne det på.
De absolutte værdier af elektronegativitet af atomer af forskellige elementer bruges meget sjældent. Den mest brugte er relativ elektronegativitet, betegnet med c. Oprindeligt blev denne værdi defineret som forholdet mellem elektronegativiteten af et atom af et givet grundstof og elektronegativiteten af et lithiumatom. Efterfølgende ændrede beregningsmetoderne sig noget.
Relativ elektronegativitet er en dimensionsløs størrelse. Dens værdier er angivet i bilag 10.
Da relativ elektronegativitet primært afhænger af atomets ioniseringsenergi (elektronaffinitetsenergien er altid meget lavere), så ændres den i et system af kemiske elementer omtrent det samme som ioniseringsenergien, dvs. den stiger diagonalt fra cæsium (0,86) til fluor (4.10). Værdierne for den relative elektronegativitet af helium og neon angivet i tabellen har ingen praktisk betydning, da disse elementer ikke danner forbindelser.
Ved hjælp af elektronegativitetstabellen kan du nemt bestemme, mod hvilket af de to atomer elektronerne, der forbinder disse atomer, er forskudt, og derfor tegnene på de partielle ladninger, der opstår på disse atomer.
| H2O | Forbindelsen er polær | |||
| H 2 | Atomer er de samme | H-H | Forbindelsen er ikke-polær | |
| CO2 | Forbindelsen er polær | |||
| Cl2 | Atomer er de samme | Cl-Cl | Forbindelsen er ikke-polær | |
| H2S | Forbindelsen er polær |
I tilfælde af dannelse af en kovalent binding mellem atomer af forskellige grundstoffer, vil en sådan binding således altid være polær, og i tilfælde af dannelse af en kovalent binding mellem atomer af samme grundstof (i simple stoffer), binding er i de fleste tilfælde ikke-polær.
Jo større forskellen er i de bundne atomers elektronegativitet, jo mere polær viser den kovalente binding mellem disse atomer sig at være.
| Svovlbrinte H 2 S– en farveløs gas med en karakteristisk lugt, der er karakteristisk for rådne æg; giftig. Det er termisk ustabilt og nedbrydes ved opvarmning. Hydrogensulfid er let opløseligt i vand, dets vandige opløsning kaldes hydrosulfidsyre. Svovlbrinte fremkalder (katalyserer) korrosion af metaller, det er denne gas, der er "skyld" for mørkfarvningen af sølv. Det findes naturligt i nogle mineralvand. I løbet af livet dannes det af nogle bakterier. Svovlbrinte er ødelæggende for alt levende. Et svovlbrintelag blev opdaget i dybet af Sortehavet og vækker bekymring hos forskere: livet for havbeboere der er under konstant trussel. |
POLAR COVALENT BOND, IKKE-POLAR COVALENT BOND, ABSOLUT ELEKTRONEGATIVITET, RELATIV ELEKTRONEGATIVITET.
1. Eksperimenter og efterfølgende beregninger viste, at den effektive ladning af silicium i siliciumtetrafluorid er +1,64 e, og af xenon i xenonhexafluorid +2,3 e. Bestem værdierne af de partielle ladninger på fluoratomerne i disse forbindelser. 2. Opstil strukturformlerne for følgende stoffer og karakteriser polariteten af kovalente bindinger i disse forbindelsers molekyler ved hjælp af notationerne " " og " ": a) CH 4, CCl 4, SiCl 4; b) H20, H2S, H2Se, H2Te; c) NH3, NF3, NCI3; d) SO 2, Cl 2 O, AF 2.
3. Angiv ved hjælp af elektronegativitetstabellen, i hvilken af forbindelserne bindingen er mere polær: a) CCl 4 eller SiCl 4; b) H2S eller H20; c) NF3 eller NCI3; d) Cl 2 O eller OF 2.
7.13. Donor-acceptor-mekanisme for bindingsdannelse
I de foregående afsnit lærte du detaljeret om to typer bindinger: ioniske og kovalente. Husk, at en ionbinding dannes, når en elektron er fuldstændigt overført fra et atom til et andet. Kovalent - når de deler uparrede elektroner af bundne atomer.
Derudover er der en anden mekanisme til bindingsdannelse. Lad os overveje det ved at bruge eksemplet på interaktionen mellem et ammoniakmolekyle og et bortrifluoridmolekyle:

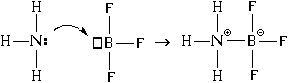
Som et resultat opstår både kovalente og ioniske bindinger mellem nitrogen- og boratomerne. I dette tilfælde er nitrogenatomet donor elektronpar ("giver" det til dannelse af en binding), og boratomet - acceptor("accepterer" det, når der dannes en forbindelse). Deraf navnet på mekanismen til dannelsen af en sådan forbindelse - " donor-acceptor".
Når en binding dannes ved hjælp af donor-acceptor-mekanismen, dannes både en kovalent binding og en ionbinding samtidigt.
Selvfølgelig, efter dannelsen af en binding, på grund af forskellen i elektronegativiteten af de bundne atomer, opstår polarisering af bindingen, og der opstår partielle ladninger, hvilket reducerer de effektive (virkelige) ladninger af atomerne.
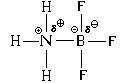
Lad os se på andre eksempler.
Hvis der er et meget polært hydrogenchloridmolekyle ved siden af ammoniakmolekylet, hvori der er en betydelig partiel ladning på brintatomet, så vil i dette tilfælde rollen som elektronparacceptoren spilles af brintatomet. Det er 1 s-AO, selvom det ikke er helt tomt, ligesom boratomet i det foregående eksempel, er elektrontætheden i skyen af denne orbital betydeligt reduceret.

Den rumlige struktur af den resulterende kation er ammoniumion NH 4 ligner strukturen af metanmolekylet, det vil sige, at alle fire N-H-bindinger er nøjagtig ens.
Dannelsen af ioniske krystaller af ammoniumchlorid NH 4 Cl kan observeres ved at blande ammoniakgas med hydrogenchloridgas:
NH3 (g) + HCl (g) = NH4Cl (cr)
Ikke kun nitrogenatomet kan være en elektronpardonor. Det kunne for eksempel være iltatomet i et vandmolekyle. Et vandmolekyle vil interagere med det samme hydrogenchlorid som følger:
Den resulterende H3O-kation kaldes oxoniumion og, som du snart vil lære, er det af stor betydning i kemi.
Afslutningsvis, lad os overveje den elektroniske struktur af carbonmonoxid (carbonmonoxid) CO-molekylet:
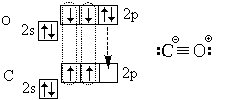
Ud over tre kovalente bindinger (tripelbinding) indeholder den også en ionbinding.
Betingelser for bindingsdannelse i henhold til donor-acceptor-mekanismen:
1) tilstedeværelsen af et ensomt par valenselektroner i et af atomerne;
2) tilstedeværelsen af en fri orbital på valensunderniveauet af et andet atom.
Donor-acceptor-mekanismen for bindingsdannelse er ret udbredt. Det forekommer især ofte under dannelsen af forbindelser d-elementer. Næsten alles atomer d-elementer har mange tomme valensorbitaler. Derfor er de aktive acceptorer af elektronpar.
DONOR-ACCEPTORMEKANISME FOR BINDINGSDANNING, AMMONIUMION, OXONIUMION, BETINGELSER FOR BINDINGSDANNING VED DONOR-ACCEPTORMEKANISME.
1. Lav reaktionsligninger og dannelsesskemaer
a) ammoniumbromid NH4Br fra ammoniak og hydrogenbromid;
b) ammoniumsulfat (NH 4) 2 SO 4 fra ammoniak og svovlsyre.
2. Lav reaktionsligninger og interaktionsskemaer for a) vand med hydrogenbromid; b) vand med svovlsyre.
3.Hvilke atomer i de fire foregående reaktioner er donorer af et elektronpar, og hvilke er acceptorer? Hvorfor? Forklar dit svar med diagrammer over valensunderniveauer.
4.Strukturformel for salpetersyre Vinklerne mellem O–N–O-bindinger er tæt på 120 o. Definere:
a) type hybridisering af nitrogenatomet;
b) hvilken AO af nitrogenatomet, der deltager i dannelsen af -bindingen;
c) hvilken AO af nitrogenatomet, der deltager i dannelsen af en -binding ifølge donor-acceptor-mekanismen.
Hvad tror du, vinklen mellem H–O–N-bindingerne i dette molekyle er omtrent lig? 5. Opret strukturformlen for cyanidionen CN (negativ ladning på carbonatomet). Det er kendt, at cyanider (forbindelser indeholdende en sådan ion) og carbonmonoxid CO er stærke gifte, og deres biologiske virkning er meget ens. Giv din forklaring på nærheden af deres biologiske virkning.
7.14. Metalforbindelse. Metaller
En kovalent binding dannes mellem atomer, der er ens i deres tilbøjelighed til at give op og kun få elektroner, når størrelsen af de bundne atomer er små. I dette tilfælde er elektrontætheden i området af overlappende elektronskyer signifikant, og atomerne viser sig at være tæt bundet, som for eksempel i HF-molekylet. Hvis mindst et af de bundne atomer har en stor radius, bliver dannelsen af en kovalent binding mindre fordelagtig, da elektrontætheden i området for overlappende elektronskyer for store atomer er meget mindre end for små. Et eksempel på et sådant molekyle med en svagere binding er HI-molekylet (sammenlign forstøvningsenergierne for HF- og HI-molekyler ved hjælp af tabel 21).
Og dog mellem store atomer ( r o > 1.1) opstår en kemisk binding, men i dette tilfælde dannes den på grund af deling af alle (eller dele) af valenselektronerne for alle bundne atomer. For eksempel, i tilfælde af natriumatomer, alle 3 s-elektroner af disse atomer, og der dannes en enkelt elektronsky:
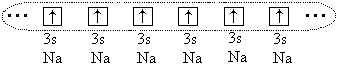
Atomer danner en krystal med metal meddelelse
På denne måde kan både atomer af det samme grundstof og atomer af forskellige grundstoffer binde sig til hinanden. I det første tilfælde kaldes simple stoffer metaller, og i den anden - komplekse stoffer kaldet intermetalliske forbindelser.
Af alle stoffer med metalliske bindinger mellem atomer lærer du kun om metaller i skolen. Hvad er den rumlige struktur af metaller? Metalkrystallen består af atomskeletter, tilbage efter socialiseringen af valenselektroner og elektronskyen af socialiserede elektroner. Atomkernerne danner normalt en meget tæt pakning, og elektronskyen optager hele det resterende frie volumen af krystallen.
De vigtigste typer af tæt emballage er kubik nærmeste pakning(KPU) og sekskantet tæt pakning(GPU). Navnene på disse pakker er forbundet med symmetrien af de krystaller, hvori de er realiseret. Nogle metaller danner løst pakkede krystaller - kropscentreret kubisk(OTSK). Volumen- og ball-and-stick-modeller af disse pakker er vist i figur 7.6.
Kubisk tæt pakning dannes af atomer af Cu, Al, Pb, Au og nogle andre grundstoffer. Sekskantet tæt pakning - atomer af Be, Zn, Cd, Sc og en række andre. Kropscentreret kubisk pakning af atomer er til stede i krystaller af alkalimetaller, elementer af VB- og VIB-grupper. Nogle metaller kan have forskellige strukturer ved forskellige temperaturer. Årsagerne til sådanne forskelle og strukturelle træk ved metaller er stadig ikke fuldt ud forstået.
Når smeltet bliver metalkrystaller til metal væsker. Typen af kemisk binding mellem atomer ændres ikke.
Metalbindingen har ikke retningsbestemthed og mætning. I denne henseende ligner det en ionbinding.
I tilfælde af intermetalliske forbindelser kan vi også tale om polariserbarheden af den metalliske binding.
Karakteristiske fysiske egenskaber af metaller:
1) høj elektrisk ledningsevne;
2) høj varmeledningsevne;
3) høj duktilitet.

Smeltepunkterne for forskellige metaller er meget forskellige fra hinanden: Det laveste smeltepunkt er for kviksølv (- 39 o C), og det højeste er for wolfram (3410 o C).
| Beryllium Be- lysegrå, let, ret hårdt, men normalt sprødt metal. Smeltepunkt 1287 o C. I luft bliver den dækket af en oxidfilm. Beryllium er et ret sjældent metal levende organismer i deres udvikling havde praktisk talt ingen kontakt med det, så det er ikke overraskende, at det er giftigt for dyreverdenen. Det bruges i nuklear teknologi. Zink Zn er et hvidt blødt metal med en blålig nuance. Smeltepunkt 420 o C. I luft og vand er den dækket af en tynd tæt film af zinkoxid, som forhindrer yderligere oxidation. I produktionen bruges det til galvanisering af plader, rør, ledninger, beskyttelse af jern mod korrosion. Wolfram W. Det er det mest ildfaste af alle metaller: wolframs smeltepunkt er 3387 o C. Typisk er wolfram ret skørt, men efter omhyggelig rengøring bliver det duktilt, hvilket gør det muligt at trække tynd tråd fra det, hvorfra filamenterne af der laves pærer. Det meste af det producerede wolfram bruges dog til fremstilling af hårde og slidstærke legeringer, der kan bevare disse egenskaber, når de opvarmes selv til 1000 o C. |
METAL, INTERMETALLISK FORBINDELSE, METALLISK BIND, TÆT PAKNING.
1. For at karakterisere forskellige pakker bruges begrebet "rumfyldningskoefficient", det vil sige forholdet mellem volumen af atomer og volumen af krystallen
Hvor V a - volumen af et atom,
Z er antallet af atomer i en enhedscelle,
V i- volumen af enhedscellen.
Atomer i dette tilfælde er repræsenteret af stive kugler med radius R, rører ved hinanden. Kuglevolumen V w = (4/3) R 3 .
Bestem pladsfyldningsfaktoren for bulk- og bcc-emballage.
2. Ved hjælp af værdierne for metalradier (bilag 9) beregnes enhedscellestørrelsen for a) kobber (CPU), b) aluminium (CPU) og c) cæsium (BCC).
Vanderwaals styrker
Van der Waals kræfter (Van der Waals, hollandsk videnskabsmand, 1873) bestemmer interaktionen mellem molekyler. De omfatter
dipol-dipol, induktion og dispersion interaktioner.
Dipol-dipol interaktion sker mellem modsatte poler af permanente dipoler. Induktion interaktioner forekommer mellem dipoler og ikke-polære molekyler. En dipol virker på et upolært molekyle og gør det til en induceret dipol. En tiltrækning opstår mellem de permanente og inducerede dipoler, hvis energi er proportional med afstanden mellem molekylernes centre. Energien af induktiv interaktion stiger med stigende polariserbarhed af molekyler (et molekyles evne til at danne en dipol).
Dispersiv interaktion forekommer mellem øjeblikkelige dipoler af upolære molekyler. Elektriske tæthedssvingninger forekommer i ethvert molekyle, hvilket resulterer i fremkomsten af øjeblikkelige dipoler, som igen inducerer øjeblikkelige dipoler i nabomolekyler.
Energien af alle typer af interaktioner, der tages i betragtning, er omvendt proportional med afstanden mellem molekylernes centre til sjette potens.
3.2. Hydrogenbinding
En brintbinding opstår som et resultat af interaktionen mellem positivt polariseret brint fra et molekyle og et negativt polariseret atom i et andet molekyle. For eksempel ...H + ─F - ...H + ─F - ... Hvis der dannes en hydrogenbinding inde i et molekyle, kaldes det intramolekylært.
Når der opstår hydrogenbindinger, dannes dimerer, trimmere eller polymerstrukturer. Dette fører til en stigning i viskositet, dielektrisk konstant, koge- og smeltepunkter, smeltevarme og fordampning.
Rumlig konfiguration af molekyler
Molekylernes rumlige struktur er bestemt af antallet af atomer i molekylet og retningen af kemiske bindinger.
Diatomiske molekyler (H 2), triatomiske molekyler CaCl 2, C 2 H 2) har en lineær struktur.
Triatomiske molekyler kan have en vinkelstruktur (H 2 S, H 2 O); pyramideformet (NH3); flad trekant (AlCl 3, BF 3).
Polyatomiske molekyler har mere komplekse konfigurationer - tetraedriske (CH 4), oktaedriske (SF 6); cyklisk (C4H8, C6H6), etc.
Hydrogenfluorid
svovlbrinte
Borfluorid
Test opgaver
1. I hvilke molekyler er den kemiske binding polær F2, CO, N2, HBr?
2. Bestem valensen af fluor og fosfor i jorden og exciterede tilstande.
3. Angiv mekanismen for dannelse af kemiske bindinger i molekyler af CO, vand, ammoniumhydroxid, ammoniumkation.
4. Hvilken proazo, magnesiumchlorid, aluminiumbromid, hydrogenselenid, acetylen, ppen, pentan?
5. Angiv de elektroniske konfigurationer af oxygen- og hydrogenchloridmolekyler ved hjælp af MO-metoden.
6. Bestem ved hjælp af MS-metoden, om dannelsen af ioner er mulig
H2+, He2+, O2-.
7. Tegn energidiagrammer over nitrogen- og fluormolekyler ved hjælp af MO-metoden.
8. Hvilke typer van der Waals-kræfter er til stede i molekylerne af hydrogenperoxid, vand, hydrogenbromid, ethylalkohol, methanal?
9. Hvilke parametre afhænger længden af en kemisk binding af?
10. Hvordan ændres energien af en kemisk binding i hydrogenhalogenid-serien fra hydrogenfluorid til hydrogeniodid?
11. Hvordan ændres energien af den kemiske binding mellem kulstoffer i serien: enkelt, dobbelt, tredobbelt, aromatisk?
Dannelse og egenskaber af kemiske bindinger
En kemisk binding dannes kun, hvis systemets samlede energi falder, når atomer nærmer sig hinanden.
Kemisk binding opstår, når skyer af uparrede elektroner med antiparallelle spin overlapper på grund af den elektrostatiske interaktion af atomkerner med øget elektrontæthed mellem dem.
Lad os for eksempel overveje dannelsen af en binding i et brintmolekyle. Når brintatomer samles, trænger deres elektronskyer ind i hinanden, hvilket kaldes elektronskyoverlap (fig. 4.1).
Ris. 4.1.Overlapning af elektronskyer under dannelsen af et brintmolekyle.
Elektrondensiteten mellem kerner stiger. Kernerne tiltrækker hinanden. Som et resultat falder systemets energi (fig. 4.2). Men når atomerne er meget tæt på hinanden, øges frastødningen af kerner kraftigt. Optimal afstand mellem kerner – kommunikationslængde (l sv), hvor systemet har minimal energi. Når atomer overgår til denne tilstand, frigives energi, kaldet bindende energi (E St).
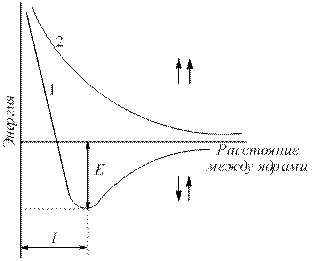
Ris. 4.2 .
Afhængighed af energien i systemer med to brintatomer med parallelle (1) og antiparallelle (2) spins på afstanden mellem kernerne (E – bindingsenergi).
Hvis bindingen er dannet af identiske atomer, for eksempel H–H, Cl–Cl, NºN, så er de delte elektroner jævnt fordelt mellem dem. Denne forbindelse kaldes kovalent upolær meddelelse.
Hvis et af atomerne tiltrækker elektroner stærkere, så skifter elektronparret mod dette atom. I dette tilfælde er der polær kovalent forbindelse. Elektronegativitet (EO) kan tjene som et kriterium for et atoms evne til at tiltrække en elektron. Jo højere EO af et atom, jo mere sandsynligt er det, at et elektronpar vil skifte mod kernen af det atom. Derfor kendetegner forskellen i atomers elektronegativitet kommunikationspolaritet.
I tilfælde af en stor forskel i EO af atomer, for eksempel mellem s-metaller i den første og anden gruppe af det periodiske system og ikke-metaller i grupperne VI, VII (LiF, CsCl, K 2 O, etc. ), ikke kun et skift i elektrontætheden, men også en fuldstændig overgang kan ske elektron til et mere elektronegativt atom for at danne en positiv og en negativ ion. Ionisk kemisk binding er den elektrostatiske vekselvirkning af negativt og positivt ladede ioner i en kemisk forbindelse.
Således adskiller bindingerne sig i polaritet.
Kommunikationspolaritet
Kommunikationspolaritet skyldes atomernes forskellige elektronegativitet, mellem hvilke der dannes en kemisk binding.
På grund af forskydningen af elektronbindingsparret til et mere elektronegativt atom får det en delvis (effektiv) negativ ladning (δ–). Det andet atom får en delvis positiv ladning (δ+). Sådan opstår en dipol, som er et elektrisk neutralt system med to lige store positive og negative ladninger placeret i en vis afstand l d fra hinanden (dipollængde). Et mål for bindingspolaritet er det elektriske moment af dipolen (μm), lig med produktet af den effektive ladning og længden af dipolen l d.
| . | (4.1) |
Det elektriske moment af en dipol har måleenheden coulomb pr. meter (C×m). Den ikke-systemmæssige måleenhed debye – D, svarende til 3,3 × 10 –30 C × m (tabel 4.1) bruges også som måleenhed.
Som det kan ses af tabel. 4.1, øges det elektriske dipolmoment med stigende EO-forskel.
Tabel 4.1
Elektrisk dipolmoment af en kemisk binding i molekyler
| Forbindelse | EO forskel | μ St, D | Forbindelse | EO forskel | μ St, D |
| H–F | 1,9 | 1,98 | MEN | 1,4 | 1,53 |
| Н–Сl | 0,9 | 1,03 | N-N | 0,9 | 1,3 |
| H-Br | 0,74 | 0,78 | H–S | 0,4 | 0,7 |
| Н–I | 0,4 | 0,38 | N-S | 0,4 | 0,3 |
En polær kovalent binding med δ nærmer sig 1 kan betragtes som en ionbinding. Men selv for ioniske forbindelser er δ under enhed. Derfor har enhver ionbinding en vis mængde kovalens. Den kemiske binding i de fleste kemiske forbindelser kombinerer egenskaberne af kovalente og ioniske bindinger. Forbindelsens polaritet kan ændre sig.
Under interaktionen mellem atomer, hvis elektronegativitetsværdier er forskellige, men ikke skarpt, skifter det fælles elektronpar til et mere elektronegativt atom. Dette er den mest almindelige type kemisk binding, der findes i både uorganiske og organiske forbindelser. Kovalente bindinger omfatter fuldt ud de bindinger, der dannes i henhold til donor-acceptor-mekanismen. dannelse af ammoniumion ved hjælp af en donor-acceptor-mekanisme.
9 Valensbindingsmetode.
Valensbindingsmetoden blev første gang brugt i 1927 af de tyske videnskabsmænd W. Heitler og F. London, som udførte en kvantemekanisk beregning af brintatomet. BC-metoden antager, at atomerne i et molekyle bevarer deres individualitet. Et elektronpar befolker det ene eller det andet atoms orbital. Heitler og London viste, at når to brintatomer med antiparallelle spin nærmer sig hinanden, falder systemets energi, hvilket skyldes en stigning i elektrontætheden i rummet mellem kernerne i de interagerende atomer. Når atomer med parallelle spin kommer tættere på hinanden, øges systemets energi og i dette tilfælde dannes der ikke et molekyle. BC-metoden er baseret på følgende grundprincipper: 1) en kemisk binding mellem to atomer opstår som følge af overlapning af AO'er med dannelse af elektronpar. 2) atomer, der indgår i en kemisk binding, udveksler elektroner med hinanden, som danner bindingspar. Kun uparrede elektroner af atomer kan deltage i dannelsen af fælles elektronpar. Energien af elektronudveksling mellem atomer yder hovedbidraget til energien i en kemisk binding. Et yderligere bidrag ydes af Coulomb-kræfterne af partikelinteraktion. 3) i overensstemmelse med Pauli-princippet dannes en kemisk binding kun, når elektroner med antiparallelle spin interagerer. 4) den kemiske bindings egenskaber bestemmes af typen af AO-overlap
Kurve for bindingsenergi mellem molekyler versus afstand
10 Valence – et atoms evne til at danne kemiske bindinger. Et mål for valens er antallet af kemiske bindinger. Et atoms valensegenskaber bestemmes af antallet af uparrede (valens)elektroner på det ydre lag og antallet af bindinger, der kan dannes af donor-acceptor-mekanismen. Oxidationstilstand - den konventionelle ladning af et atom i et molekyle, beregnet under den antagelse, at alle bindinger er ioniske i naturen. Det betyder, at et mere elektronegativt atom, der forskyder ét elektronpar mod sig selv, får en ladning på -1, og to elektronpar får en ladning på -2. Bindingen mellem identiske atomer bidrager ikke til oxidationstilstanden. Således svarer bindingen mellem C-C atomer til deres nul oxidationstilstand. I C-H-bindingen har carbon, som et mere elektronegativt atom, en ladning på -1, og i en C-O-binding er ladningen af carbon (mindre elektronegativ) +1. Oxidationstilstanden for et atom i et molekyle beregnes som den algebraiske sum af de ladninger, som alle bindinger af et givet atom giver. I CH 3 Cl-molekylet giver tre C-H-bindinger en samlet ladning på C-atomet lig med -. 3, og C-Cl-bindingen giver en ladning på +1. Derfor er oxidationstilstanden for carbonatomet i denne forbindelse:
I en ophidset tilstand stiger atomernes valens. Dette skyldes fænomenet dampning og forfremmelse( overgang til en fri orbital) af elektroner i det ydre lag.
11 .
Kemisk binding- interatomisk interaktion forårsaget af overlapning af atomernes ydre elektronskaller, ledsaget af et fald i den samlede energi af det resulterende system. En kemisk binding kan dannes ved at donere en eller flere uparrede elektroner fra hvert atom (flere bindinger) for at danne elektronpar (kovalent binding), eller ved at et atom dominerer et elektronpar og det andet atom optager en ledig elektronorbital (donor-acceptor). bånd). Kun elektroner fra den ydre elektronskal deltager i dannelsen af en kemisk binding, og de indre elektronniveauer påvirkes ikke. Som et resultat, når en kemisk binding dannes, danner hvert atom en fyldt elektronskal af det ydre elektroniske niveau, bestående af to (dublet) eller otte (oktet) elektroner. En kemisk binding er karakteriseret ved længde og energi. Længden af en kemisk binding er afstanden mellem kernerne af bundne atomer. Energien af en kemisk binding viser, hvor meget energi der skal bruges på at adskille to atomer, mellem hvilke der eksisterer en kemisk binding, til den afstand, hvor denne kemiske binding vil blive brudt. Hovedtyper af kemisk binding- kovalent, ionisk, hydrogen, metallisk.
Kommunikationsmætning giver en konstant sammensætning af molekyler og definerer begrebet valens. Hvis et atom har n uparrede elektroner, så kan dette atom danne n kemiske bindinger med andre atomer, der hver har en uparret elektron. Derfor er valensen af et grundstof lig med antallet af uparrede elektroner i atomet eller antallet af dannede kovalente bindinger. Mætningsprincippet er afledt af Pauli-princippet og betyder, at hver elektron kun kan deltage i dannelsen af én kovalent binding. Polaritet af kemiske bindinger - karakteristisk for en kemisk binding, der viser en ændring i fordelingen af elektrontæthed i rummet omkring kernerne i sammenligning med fordelingen af elektrontæthed i de neutrale atomer, der danner denne binding.
De såkaldte effektive ladninger på atomer bruges som et kvantitativt mål for bindingspolaritet.
Den effektive ladning er defineret som forskellen mellem ladningen af elektroner placeret i et område i rummet nær kernen og ladningen af kernen. Dette mål har dog kun en betinget og tilnærmet betydning, da det er umuligt entydigt at identificere en region i et molekyle, der udelukkende relaterer sig til et individuelt atom, og i tilfælde af flere bindinger til en specifik binding.
Tilstedeværelsen af en effektiv ladning kan angives med symboler for ladninger på atomer (for eksempel H + δ - Cl − δ, hvor δ er en vis brøkdel af den elementære ladning).
12 Hydrogenbinding. Denne type binding kan kun betinget kaldes kemisk og tilskrives mere korrekt til intermolekylære og intramolekylære interaktioner. En hydrogenbinding opstår mellem et bundet brintatom i et molekyle og et elektronegativt atom i et andet molekyle. Hydrogenbindingen er dels elektrostatisk og dels donor-acceptor i naturen. Et klart eksempel på implementeringen af en sådan forbindelse kan være kombinationen af flere vandmolekyler i klynger. I et vandmolekyle flytter oxygenatomet dets elektrontæthed til sig selv og erhverver en delvis negativ ladning, og brinten er derfor delvist positiv og kan interagere med det enlige elektronpar af oxygen i nabomolekylet. En brintbinding kan forekomme ikke kun mellem forskellige molekyler, men også inden for molekylet selv, sker interaktion på grund af forekomsten af inducerede dipolmomenter. Denne type interaktion kan forekomme både mellem forskellige molekyler og inden for et molekyle mellem naboatomer på grund af forekomsten af et dipolmoment i atomerne under elektronernes bevægelse. Van der Waals interaktion kan være attraktiv eller frastødende. Intermolekylær interaktion har karakter af tiltrækning, og intramolekylær interaktion er af frastødning. Intramolekylære van der Waals-interaktioner har et væsentligt bidrag til molekylets geometri. Dannelsen af intermolekylære hydrogenbindinger fører til en betydelig ændring i stoffernes egenskaber: en stigning i viskositet, dielektrisk konstant, smelte- og kogepunkter, fordampnings- og smeltevarme. For eksempel, vand , hydrogenfluorid og ammoniak har unormalt høje koge- og smeltepunkter. Under påvirkning af brintbindinger ændres kemiske egenskaber også. Da mange forbindelser indeholder kovalente polære H-O- og H-N-bindinger, er hydrogenbindinger meget almindelige. De optræder ikke kun i vand, men også i forskellige krystallinske stoffer, polymerer, proteiner, levende organismer... På grund af deres lave værdier energi hydrogenbindinger brydes relativt let og omdannes. Energien af en brintbinding stiger med stigende elektronegativitet (EO) og faldende størrelser af B-atomer. Derfor opstår de stærkeste hydrogenbindinger, når B-atomerne er F, O eller N
13-14 Afhængig af afstanden mellem de partikler, der udgør stoffet, og af arten og energien intermolekylær interaktion (IMI) mellem dem kan et stof være i en af tre aggregeringstilstande: fast, flydende og gasformig.
I gas tilstand er interaktionsenergien mellem partikler meget mindre end deres kinetiske energi:
E MMV<< Е кин .
Derfor holdes gasmolekyler (atomer) ikke sammen, men bevæger sig frit i et volumen, der er væsentligt større end selve partiklernes volumen. Intermolekylære interaktionskræfter opstår, når molekyler kommer tæt nok på hinanden. Svag intermolekylær interaktion bestemmer gassens lave tæthed, ønsket om grænseløs ekspansion og evnen til at udøve tryk på karrets vægge, hvilket hæmmer dette ønske. Gasmolekyler er i tilfældig, kaotisk bevægelse, og der er ingen orden i gassen med hensyn til arrangementet af molekyler.
En gass tilstand er karakteriseret ved: temperatur - T, tryk - p og volumen - V. Ved lave tryk og høje temperaturer opfører alle typiske gasser sig nogenlunde ens. Men allerede ved almindelige og især lave temperaturer og høje tryk begynder gassernes individualitet at vise sig. En stigning i det ydre tryk og et fald i temperaturen bringer gaspartikler tættere på hinanden, så intermolekylær interaktion begynder at manifestere sig i højere grad. For sådanne gasser er det ikke længere muligt at anvende Mendeleev-Clapeyron-ligningen, men van der Waals-ligningen bør bruges:
hvor a og b er konstante led, der tager hensyn til tilstedeværelsen af tiltrækningskræfter mellem henholdsvis molekyler og molekylernes eget volumen MMV blive mere og mere mærkbar, hvilket fører til skabelsen af betingelser for dannelsen af forskellige associerede fra molekyler. Associates er relativt ustabile grupper af molekyler. Fra komponenternes natur MMV det følger heraf, at de universelle vekselvirkningskræfter stiger med stigende atomstørrelser (polariserbarheden øges kraftigt, derfor, jo tungere den samme type partikler (atomer eller molekyler) af et stof, jo normalt højere grad af deres association ved en given temperatur, jo lavere temperaturer et sådant stof går fra gas til væske.
I væsker MMW-kræfter står i forhold til den kinetiske energi af molekylær bevægelse:
E MMV » E kin.
Derfor har væsken egenskaben flydende, tager form af den beholder, den er placeret i. Det særlige ved den flydende struktur er det der er ingen lang rækkefølge, men der er kort rækkefølge i arrangementet af molekyler . Manifestationen af kortrækkende orden er, at molekyler placeret i den 1. sfære af miljøet af et givet molekyle i højere grad dvæler i nærheden af det og dermed bestemmer en eller anden rækkefølge. Endnu større orden med et langtrækkende ordreelement kan dog forekomme i væsker. Dette sker i tilfælde, hvor IMV'ens universelle kræfter suppleres af IMV'ens specifikke kræfter (brintbinding).
Til solid tilstand, er energiforholdet gyldigt:
E MMV > E kin.
Stoffets faste tilstand findes hovedsageligt i form af krystaller. Krystaller består af partikler (atomer, molekyler, ioner) af stof orienteret på en bestemt måde i forhold til hinanden. Arten af denne orientering er sådan, at stoffer, der er tilstrækkeligt langt fra den valgte partikel, er i en strengt defineret position og i en fast afstand. Denne egenskab kaldes tilstedeværelse lang rækkefølge i krystaller. Krystalformer kan være forskellige.
15 Et karakteristisk træk ved den krystallinske tilstand er tilstedeværelsen systemer af strengt ordnede partikler, som kaldes krystalgitter. Et krystalgitter kan opnås ved en vis bevægelse (oversættelse) i rummet af en mindste gruppe af partikler kaldet enhedscelle.
Egenskaberne ved krystaller er: en høj grad af orden (tilstedeværelsen af kort- og langrækkende orden), en vis symmetri af de elementære celler, de danner, og som en konsekvens anisotropi (dvs. afhængighed af retning) af egenskaber.
Afhængigt af hvilke partikler, der ligger ved krystalgitterets noder, skelnes ioniske, atomare, molekylære og metalgitter.
Ionisk gitter består af ioner med modsat fortegn vekslende ved knuderne. I dette tilfælde kan ionerne være simple (Na +, Cl - ..) og komplekse (NH 4 +, NO 3 - ...). På grund af det faktum, at ionbindingen er umættet og ikke-retningsbestemt, er iongitteret karakteriseret ved høj koordinationsnumre(c.f. = 6,8) . Koordinationsnummer - antallet af nærmeste partikler, der omgiver den valgte . På grund af den høje ioniske bindingsstyrke er ioniske krystalgitre stærke, og deres krystaller har høje smeltepunkter. Eksempler på forbindelser med ioniske krystalgitre: NaCl, NH 4 NO 3 mv.
Atomgitter består af atomer forbundet med kovalente bindinger, for eksempel i diamant, grafit. Koordinationstallene her bestemmes af antallet af s-bindinger af det centrale atom med omgivende atomer og når ikke store værdier (ofte omkring 4). På grund af den kovalente bindings høje styrke er sådanne gitter meget stærke, og stofferne er karakteriseret ved høje smeltepunkter. Det er kendt, at diamant er det hårdeste naturlige stof.
Molekylært gitter indeholder molekyler i knob, der er forbundet med hinanden på grund af intermolekylære kræfter. Molekylære gitter er lavstyrke, og stoffer med sådanne gitter (fast H 2, O 2, N 2, CO 2, H 2 O) har normalt lave smeltepunkter.
Metalrist kan konventionelt afbildes i form af positivt ladede ioner placeret ved noder og elektroner, der bevæger sig i mellemrum. Koordinationstallet når her store værdier (8-12). Styrken af metalgitteret varierer meget og afhænger stærkt af tilstedeværelsen af fremmede urenheder. I metaller er der en kemisk binding kaldet metalbinding. I bund og grund, En metalbinding er en speciel type kovalent binding. Det opstår som et resultat af den "massive" overlapning af skyer af ydre (valens) elektroner af metalatomer.
16
En af de mest essentielle egenskaber ved grundstoffers atomer, som bestemmer, hvilken slags binding der dannes mellem dem - ionisk eller kovalent, er Elektronegativitet
, dvs. atomernes evne i en forbindelse til at tiltrække elektroner. En betinget kvantitativ vurdering af elektronegativitet er givet af den relative elektronegativitetsskala. I perioder er der en generel tendens til, at elementernes elektronegativitet stiger, og i grupper - til deres fald. Elementer er arrangeret i en serie i henhold til deres elektronegativitet, på grundlag af hvilken elektronegativiteten af elementer placeret i forskellige perioder kan sammenlignes. Typen af kemisk binding afhænger af, hvor stor forskellen i elektronegativitetsværdierne for de forbindende atomer i grundstofferne er. Jo mere atomerne i de grundstoffer, der danner bindingen, adskiller sig i elektronegativitet, jo mere polær er den kemiske binding. Tegn en skarp linje mellem typerne
kemiske bindinger er ikke mulige. I de fleste forbindelser er typen af kemisk binding mellemliggende; for eksempel meget polær kovalent
den kemiske binding er tæt på en ionbinding. Afhængigt af hvilket af de begrænsende tilfælde en kemisk binding er tættere i naturen, klassificeres den som enten en ionisk eller en kovalent polær binding. Ionisk binding
er et ekstremt tilfælde af en polariseret kovalent binding, når det delte elektronpar udelukkende tilhører et af atomerne. I dette tilfælde realiseres en fuldstændig positiv ladning på et af atomerne og en fuldstændig negativ ladning på den anden. Denne type binding er karakteristisk for salte. For eksempel er natriumchlorid NaCl. Hvert af atomerne bidrager med en elektron til at danne et fælles elektronpar. Cl forskyder dog fuldstændigt det resulterende elektronpar mod sig selv og får derved en fuldstændig negativ ladning, og Na, som i dette tilfælde ikke har en enkelt elektron på det ydre elektroniske niveau, har en fuldstændig positiv ladning. De vigtigste forskelle mellem ionbindinger og andre typer kemiske bindinger er manglende retning Og umættethed. Det er grunden til, at krystaller dannet på grund af ionbindinger trækker mod forskellige tætte pakninger af de tilsvarende ioner.
17 Rumlig struktur af molekyler afhænger af arten af den kemiske binding, der opstår mellem atomer, og derfor strukturen af deres elektroniske skal. Da elektroner af s-, p-, d- og f-typen fra hvert af de interagerende atomer kan deltage i en kemisk binding, afhænger molekylernes struktur af typen og antallet af elektroner, samt af muligheden for at danne hybrid obligationer. Ofte dannes kemiske bindinger af elektroner placeret i forskellige atomare orbitaler (for eksempel s - og p - orbitaler). På trods af dette viser forbindelserne sig at være af samme værdi og er placeret symmetrisk, hvilket er sikret hybridisering af atomare orbitaler . Orbital hybridisering er en ændring i formen af nogle orbitaler under dannelsen af en kovalent binding for at opnå mere effektiv overlapning af orbitaler. med orbitaler af andre atomer, er de resulterende elektronpar så langt fra hinanden som muligt fra hinanden ven. Dette minimerer frastødningsenergien mellem elektroner i molekylet. Hybridisering er ikke en reel proces. Dette koncept blev introduceret for at beskrive den geometriske struktur af et molekyle. Formen af partikler som følge af dannelsen af kovalente bindinger, der involverer hybride atomorbitaler, afhænger af antallet og typen af disse orbitaler. I dette tilfælde skaber σ-bindinger et stift "skelet" af partiklen:
Orbitaler involveret i hybridisering. Hybridiseringstype Rumlig form af molekylet Eksempler
S,P sp – hybridisering Lineær BeCl2
s, p, p sp 2 – hybridisering Trekantet (flad trigonal) AlCl 3
s, p, p, p sp 3 – hybridisering Tetraedrisk CH 4
Hvis elektronskyer overlapper hinanden langs en linje, der forbinder atomcentrene, kaldes en sådan kovalent binding sigma( )-forbindelse
Kovalent binding dannet ved lateral overlapning R-orbitaler af nabokulstofatomer kaldes pi( )-forbindelse.
