Зимонина Людмила Павловна
Тема урока «Общая характеристика неметаллов» Цели урока:- Рассмотреть положение неметаллов в ПС Д.И.Менделеева и особенности их электронного строения. Повторить понятие электроотрицательности (ЭО) и аллотропии.
Ход урока.
I Организационный момент Вступление в тему. Хотя неметаллов намного меньше, чем металлов, на изучение их химии отводится гораздо больше времени, чем для металлов. План урока.- Положение неметаллов в ПС Д.И.Менделеева. Особенности атомного строения элементов-неметаллов. Характеристика простых веществ-неметаллов. Аллотропия.
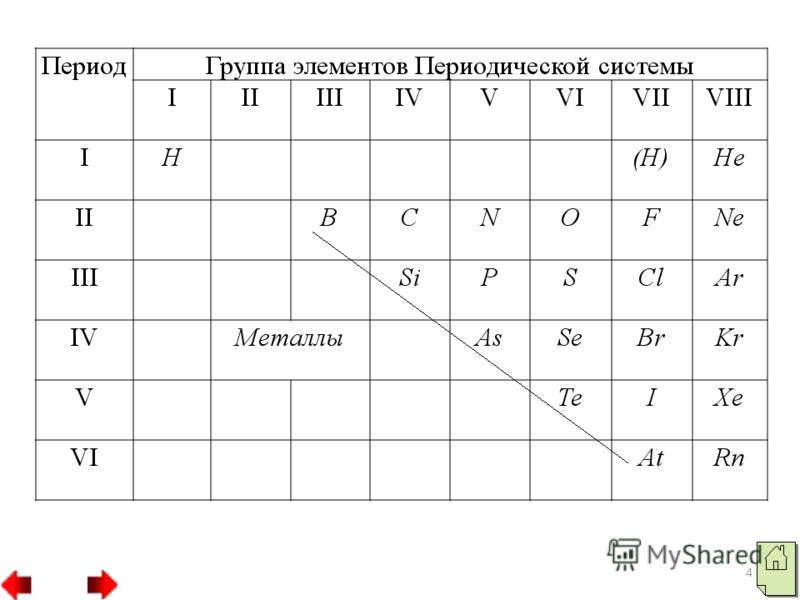
- Положение неметаллов в ПС Д.И.Менделеева.
- Особенности атомного строения элементов-неметаллов.
- Небольшой атомный радиус (в сравнении с радиусами атомов-металлов одного с ними периода). Большее число электронов на внешнем уровне (4-8), исключения Н, Не, В. Происходит заполнение электронами только внешнего энергетического уровня. Для элементов-неметаллов характерны высокие значения электроотрицательности.
- Характеристика простых веществ-неметаллов.
- Для неметаллов (простых веществ) характерны все 3 агрегатных состояния при обычных условиях (сравнить – все металлы, кроме ртути, в обычных условиях твердые вещества).
- Твердые вещества: различные модификации серы, йод кристаллический, графит, фосфор, уголь активированный, кристаллический или аморфный кремний, бор.
- Для неметаллов характерна разнообразная цветовая гамма: белый - фосфор, черный - фосфор, графит, красный - фосфор, бром, желтый – сера, фиолетовый – йод, бесцветный – кислород, азот, водород. (Почти все металлы имеют серебристо-белый цвет). Температуры плавления: от 3800 0 С (графит) до -210 0 С (азот). Для сравнения – металлы: от 3380 0 С (вольфрам) до -38,9 0 С (ртуть). Некоторые неметаллы электропроводны (графит, кремний), имеют металлический блеск (йод, графит, кремний). По этим признакам напоминают металлы, но все они – хрупкие вещества.
- Аллотропия.
- Разные типы кристаллических решеток (белый фосфор Р 4 – молекулярная, красный фосфор Р – атомная). Разная структура кристаллической решетки (алмаз – тетраэдрическая, графит – слоистая). Разный состав молекул аллотропных модификаций (О 2 и О 3).
| Кислород | ||
| Состав молекулы | ||
| Физические свойства | Газ, без цвета, вкуса и запаха, плохо растворим в воде, в жидком состоянии светло-голубой, в твердом – синий. Температура плавления -218,7 0 С Температура кипения -183 0 С | Светло-синий газ, темно-голубая жидкость, в твердом состоянии темно-фиолетовый, имеет сильный запах, в 10 раз лучше, чем кислород, растворим в воде. Температура плавления -193 0 С Температура кипения -112 0 С |
| Химические свойства | Сильный окислитель 2Cu + O 2 = 2CuO 2PbS + 3O 2 = 2PbO + 2SO 2 | Еще более сильный окислитель, так как имеет неустойчивую молекулу 3PbS + 4O 3 = 3PbSO 4 2Ag + O 3 = Ag 2 O + O 2 2KI + O 3 + H 2 O = I 2 + 2KOH + O 2 |
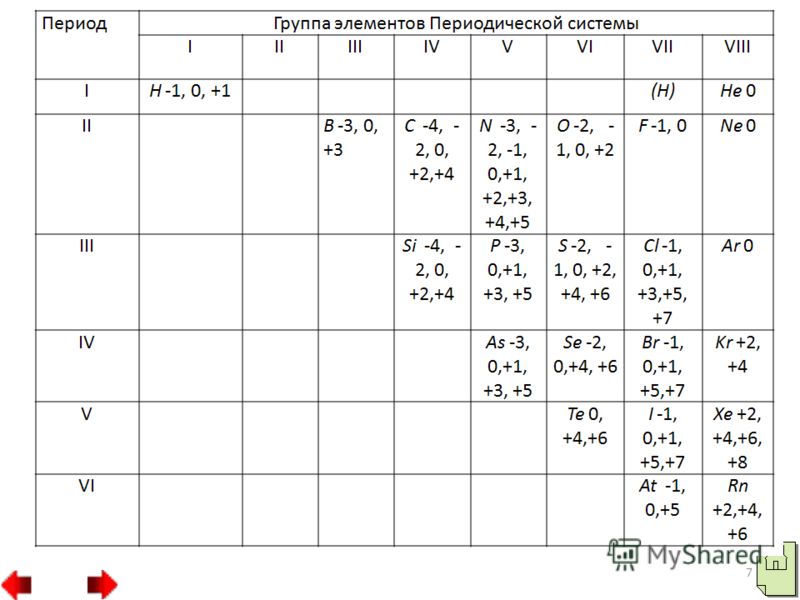
- Химические свойства неметаллов
Строение и свойства простых веществ неметаллов.
Самые типичные неметаллы имеют молекулярное строение, а менее типичные немолекулярное. Этим и объясняется отличие их свойств. Наглядно это отражено в схеме 2. Простые веществаС немолекулярным строениемС молекулярным строениемC, B, SiF2, O2, Cl2, Br2, N2, I2, S8У этих неметаллов атомные кристаллические решетки, поэтому они обладают большой твердостью и очень высокими температурами плавления. У этих неметаллов в твердом состоянии молекулярные кристаллические решетки.
При обычных условиях это газы, жидкости или твердые вещества с низкими температурами плавления. Таблица 2 Кристаллический бор В как и кристаллический кремний обладает очень высокой температурой плавления 2075С и большой твердостью. Электрическая проводимость бора с повышением температуры сильно увеличивается, что дает возможность широко применять его в полупроводниковой технике. Добавка бора к стали и к сплавам алюминия, меди, никеля и др. улучшает их механические свойства.
Бориды соединения бора с некоторыми металлами, например с титаном TiB, TiB2 необходимы при изготовлении деталей реактивных двигателей, лопаток газовых турбин. Как видно из схемы 2, углерод С, кремний Si, бор В имеют сходное строение и обладают некоторыми общими свойствами. Как простые вещества они встречаются в двух видоизменениях в кристаллическом и аморфном. Кристаллические видоизменения этих элементов очень твердые, с высокими температурами плавления. Кристаллический кремний обладает полупроводниковыми свойствами.
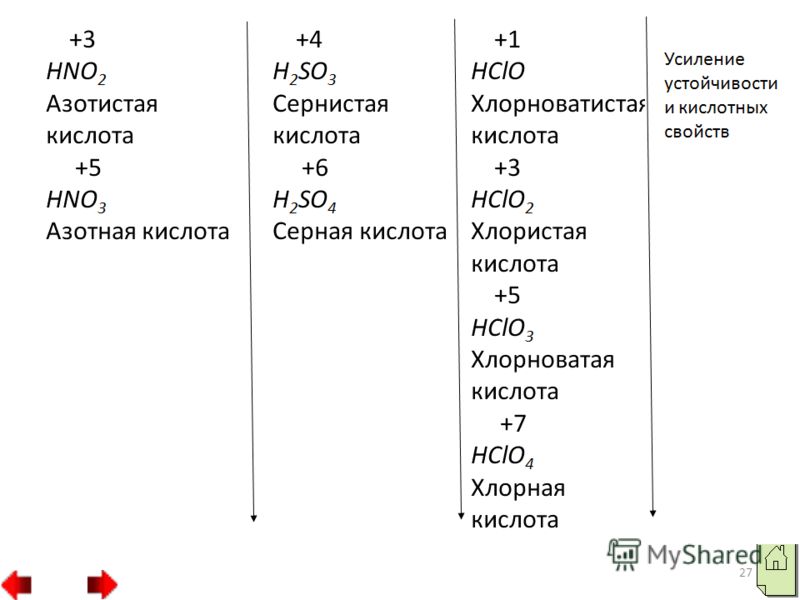
Все эти элементы образуют соединения с металлами карбиды, силициды и бориды CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2. Некоторые из них обладают большей твердостью, например Fe3C, TiB. Карбид кальция используется для получения ацетилена. Если сравнить расположение электронов по орбиталям ф атомах фтора, хлора и других галогенов, то можно судить и об их отличительных свойствах. У атома фтора свободных орбиталей нет. Поэтому атомы фтора могут проявить только валентность I и степень окисления 1. В атомах других галогенов, например в атоме хлора, на том же энергетическом уровне имеются свободные d-орбитали.
Благодаря этому распаривание электронов может произойти тремя разными путями. В первом случае хлор может проявить степень окисления 3 и образовать хлористую кислоту HClO2, которой соответствуют соли хлориты, например хлорит калия KClO2. Во втором случае хлор может образовать соединения, в которых степень окисления хлора 5. К таким соединениям относятся хлороноватая кислота HClO3 и ее соли хлораты, например хлорат калия КClO3 бертолетова соль. В третьем случае хлор проявляет степень окисления 7, например в хлорной кислоте HClO4 и в ее солях перхлоратах, например в перхлорате калия КClO4. 4. Кислородные и водородные соединения неметаллов.
Краткая характеристика их свойств. С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы например, SO2, N2O5, а других более низкую например, SO2, N2O3. Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления.
Например, азотная кислота HNO3 сильнее азотистой HNO2, а серная кислота H2SO4 сильнее сернистой H2SO3. Характеристики кислородных соединений неметалов 1. Свойства высших оксидов т.е. оксидов, в состав которых входит элемент данной группы с высшей степенью окисления в периодах слева направо постепенно изменяются от основных к кислотным. 2. В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают.
Об этом можно судить по свойствам кислот, соответствующих этим оксидам. 3. Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов. 4. В главных подгруппах периодической системы химических элементов в направлении сверху вниз кислотные свойства высших оксидов неметаллов уменьшаются.
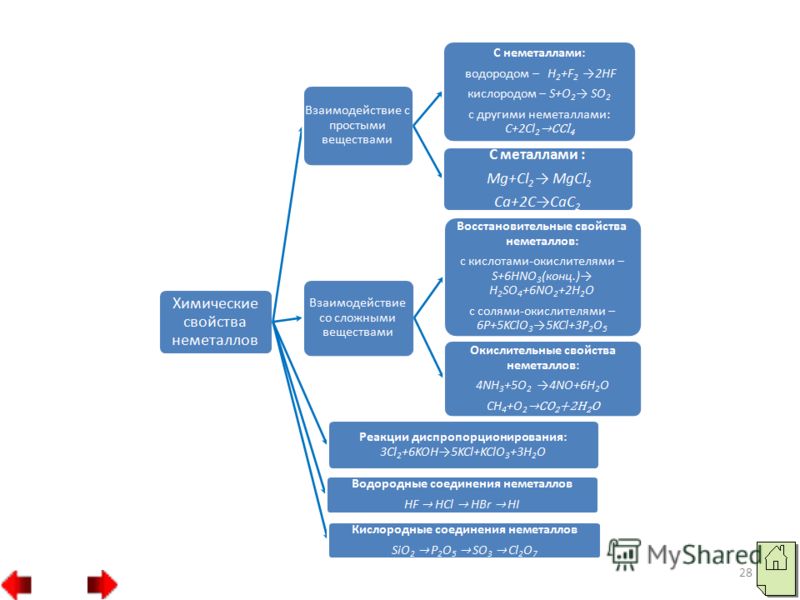
Общие формулы водородных соединений по группам периодической системы химических элементов приведены в таблице 3. Общие формулы соединений по группамIVVVIVIIRHRH2RH3RH4RH3H2RHRНелету чие водородные соединенияЛетучие водородные соединенияТаблица 3. С металлами водород образует за некоторым исключением нелетучие соединения, которые являются твердыми веществами немолекулярного строения. Поэтому их температуры плавления сравнительно высоки.
С неметаллами водород образует летучие соединения молекулярного строения. В обычных условиях это газы или летучие жидкости. В периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливается. Это объясняется тем, что ионы кислорода имеют свободные электронные пары, а ионы водорода свободную орбиталь, то происходит процесс, котроый выглядит следующим образом H2O HF H3O F Фтороводород в водном растворе отщепляет положительные ионы водорода, т.е. проявляет кислотные свойства.
Этому процессу способствует и другое обстоятельство ион кислорода имеет неподеленную электронную пару, а ион водорода свободную орбиталь, благодаря чему образуется донорно-акцепторная связь. При растворении аммиака в воде происходит противоположный процесс. А так как ионы азота имеют неподеленную электронную пару, а ионы водорода свободную орбиталь, возникает дополнительная связь и образуются ионы аммония NH4 и гидроксид-ионы ОН В результате раствор приобретает основные свойства.
Этот процесс можно выразить формулой H2O NH3 NH4 OH Молекулы аммиака в водном растворе присоединяют положительные ионы водорода, т.е. аммиак проявляет основные свойства. Теперь рассмотрим, почему водородное соединение фтора фтороводород HF в водном растворе является кислотой, но более слабой, чем хлороводородная. Это объясняется тем, что радиусы ионов фтора значительно меньше, чем ионов хлора. Поэтому ионы фтора гораздо сильнее притягивают к себе ионы водорода, чем ионы хлора.
В связи с этим степень диссоциации фтороводородной кислоты значительно меньше, чем соляной кислоты, т.е. фтороводородная кислота слабее соляной кислоты. Из приведенных примеров можно сделать следующие общие
Конец работы -
Эта тема принадлежит разделу:
Неметаллы
В различные исторические эпохи в понятие элемент вкладывался различный смысл. Древнегреческие философы в качестве элементов рассматривали четыре… В средние века к этим началам добавились соль, сера и ртуть. В XVII веке Р.… Впоследствии выяснилось, что в таблицу вошли и некоторые сложные вещества. В настоящее время понятие химический…
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
2 Неметаллы – это химические элементы, атомы которых легко принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы. Элементы-неметаллы расположены в конце периодов и имеют электронную конфигурацию внешнего слоя, близкую к конфигурации ближайшего инертного газа или равную ей. Практически все неметаллы имеют сравнительно малые радиусы, для них характерны высокие значения электроотрицательности и окислительные свойства.
3 Среди неметаллов два элемента водород и гелий относятся к s-семейству, все остальные принадлежат к р-семейству. На внешнем электронном слое у атомов неметаллов находится различное число электронов: у атома водорода- один электрон (1s"), у атома гелия - два электрона, у атома бора три электрона. Однако атомы большинства неметаллов, в отличие от атомов металлов, на внешнем электронном слое имеют большое число электров от 4 до 8. Все вещества-неметаллы образованы атомами, связанными между собой ковалентной неполярной связью. Они могут иметь молекулярное строение, как молекулы водорода, кислорода, азота и др. или атомное строение, как кристаллы алмаза или бора.

4
5
6

7
8 Роль неметаллов и их соединений в природе очень велика. Неметаллы составляют более 84% от массы почвы, 98,5% от массы растений и 97,6% от массы тела человека. Шесть неметаллов углерод, водород, кислород, азот, фос- фор и сера являются органогенными элементами, так как входят в состав молекул белков, жиров, углеводов и нуклеиновых кислот. Воздух, которым мы дышим, представляет собой смесь простых и сложных веществ, образуемых не- металлами (кислород, азот, углекислый газ).

9

10 Вещества-неметаллы, имеющие молекулярное строение, могут находиться в газообразном, жидком или твердом состоянии. Все они из-за слабых межмолекулярных сил имеют низкие температуры кипения и плавления. Вещества-неметаллы, имеющие атомное строение, находятся только в твердом агрегатном состоянии, их атомы связаны между собой прочными ковалентными связями и образуют макромолекулы, например, С n, S n, Si n. Обычно они имеют высокую твердость, высокие температуры плавления и кипения. Многие неметаллы способны образовывать аллотропные модификации: O 2, O 3. Все неметаллы плохо проводят тепло и электрический ток. Кристаллы неметаллов непластичные и хрупкие. Большинство из неметаллов не имеют металлического блеска.

11


13

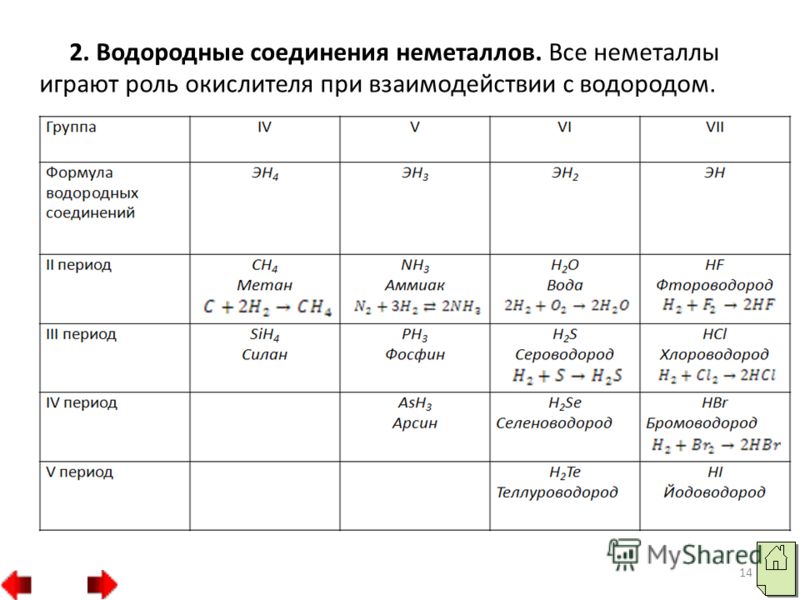
15 Водородные соединения неметаллов характеризуются различным отношением к воде. Метан и силан в воде плохо растворимы. Аммиак и фосфин при растворении в воде образуют слабые основания – гидроксид аммония NH 4 OH и гидроксид фосфония РH 4 OH. При растворении в воде сероводорода, селеноводорода и теллуроводорода, а также галогенводородов образуются кислоты той же формулы, что и сами водородные соединения.

16 В периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливаются, а в группах ослабевают. Окислительная активность водородных соединения неметаллов в группах сверху вниз сильно уменьшается. HF HCl HBr HI



19 5. Не только кислород, но и другие неметаллы (фтор, йод, бром и другие) также могут играть роль окислителя в реакциях со сложными веществами. Например, сильный окислитель хлор, окисляет хлорид железа (II) в хлорид железа (III): На разной окислительной активности основана способность одних неметаллов вытеснять другие из растворов их солей:

20 Следует подчеркнуть, что неметаллы (кроме фтора) могут проявлять и восстановительные свойства. При этом электроны атомов неметаллов смешаются к атомам элементов-окислителей. В образующихся соединениях атомы неметаллов имеют положительные степени окисления. Высшая положительная степень окисления неметалла обычно равна номеру группы. Восстановительная активность неметаллов:



23 3. Наиболее сильные восстановительные свойства имеют неметаллы углерод и водород: Таким образом, практически все неметаллы могут выступать как в роли окислителей, так и роли восстановителей. Это зависит от того, с каким веществом взаимодействует неметалл.

24 Реакции самоокисления–самовосстановления (диспропорционирования) – это такие реакции, в которых один и тот неметалл является одновременно и окислителем, и восстановителем. Так диспропорционирует фосфор, сера, селен, хлор в щелочных средах: Неметаллы, представляющие собой нерастворимые в воде твердые соединения с прочной кристаллической решеткой (углерод, кремний) или плохо растворимые в воде (кислород, водород), в реакциях диспропорционирования не участвуют.

25 Оксиды неметаллов делятся на две группы: несолеобразующие и солеобразующие оксиды. К несолеобразующим оксидам относятся: N 2 O, NO, CO. Все остальные оксиды неметаллов являются солеобразующими. Солеобразующие оксиды неметаллов относятся к кислотным оксидам. Среди них есть газообразные (CO 2, SO 2,NO 2), жидкие вещества (SO 3, N 2 O 3) и твердые (P 2 O 5, SiO 2). Кислотные оксиды – это ангидриды кислот. Например: CO 2 – ангидрид угольной кислоты H 2 CO 3 ; P 2 O 5 – ангидрид фосфорной кислоты H 3 PO 4.

26 В главных подгруппах сверху вниз кислотные свойства высших оксидов неметаллов ослабевают, а в периодах – слева направо усиливаются: SiO 2 P 2 O 5 SO 3 Cl 2 O 7 Усиление кислотных свойств Все кислотные оксиды, кроме оксида кремния (II) SiO 2, растворяются в воде, образуя гидраты оксидов, которые по своему характеру являются кислотами:

27
28


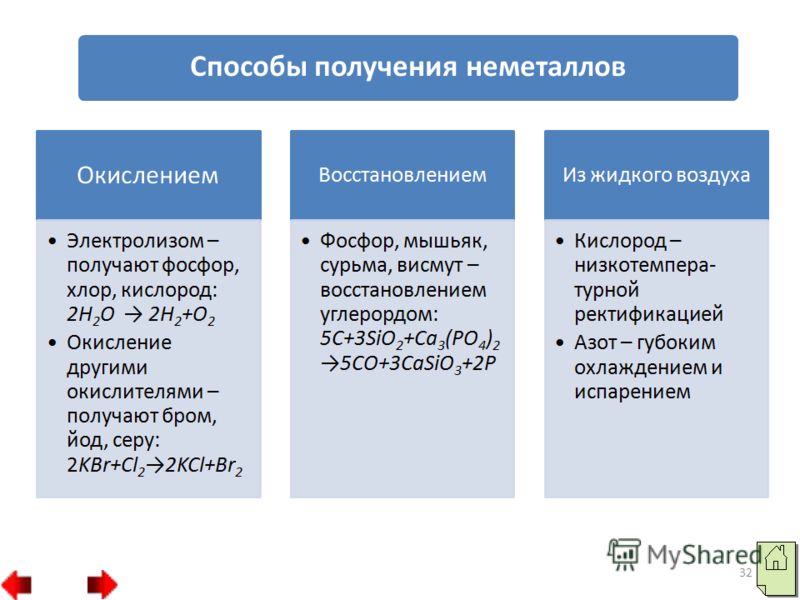
31 2. Некоторые неметаллы можно получить восстановлением. Например, фосфор, мышьяк, сурьму и висмут получают восстановлением углеродом: 3. Физические методы: а) низкотемпературная ректификация – так получают кислород из воздуха; б) глубокое охлаждение и испарение – так получают азот из воздуха

32
33 Вопросы 1.В каких группах и периодах периодической системы химических элементов Д.И.Менделеева сосредоточены элементы-неметаллы? 2. Какие неметаллы образуют атомную кристаллическую решетку, какие – молекулярную и какие находятся в виде отдельных атомов? 3. Какой из неметаллов – жидкий при 20 °С, какие неметаллы – газы и какие – твердые вещества? 4. Как изменяются неметаллические свойства элементов в таблице Д.И.Менделеева в периодах слева направо и в главных подгруппах сверху вниз?

34 5. Укажите, какие элементы окисляются и какие восстанавливаются в реакциях простых веществ: а) S + O 2 = SO 2 ; б) S + 2Cl 2 = SCl 4 ; в) Cl 2 + H 2 = 2HCl; г) 2P + 3Br 2 = 2PBr Некоторые неметаллы взаимодействуют с кислотами- окислителями, превращаясь в кислоты или в кислотные оксиды с высшими степенями окисления. Составьте уравнения следующих реакций: а) С + Н 2 SО 4 (конц.) = б) С + НNО 3 (конц.) = в) S + НNО 3 (конц.) =

