7.11. Строение веществ с ковалентной связью
Вещества, в которых из всех типов химической
связи присутствует только ковалентная, делятся
на две неравные группы: молекулярные (очень
много) и немолекулярные (значительно меньше).
Кристаллы твердых молекулярных веществ состоят
из слабо связанных между собой силами
межмолекулярного взаимодействия молекул. Такие
кристаллы не обладают высокой прочностью и
твердостью (вспомните лед или сахар). Невысоки у
них также температуры плавления и кипения (см.
таблицу 22).
Таблица 22. Температуры плавления и кипения некоторых молекулярных веществ
Вещество |
Вещество |
||||
| H 2 | – 259 | – 253 | Br 2 | – 7 | 58 |
| N 2 | – 210 | – 196 | H 2 O | 0 | 100 |
| HCl | – 112 | – 85 | P 4 | 44 | 257 |
| NH 3 | – 78 | – 33 | C 10 H 8 (нафталин) | 80 | 218 |
| SO 2 | – 75 | – 10 | S 8 | 119 |
В отличие от своих молекулярных
собратьев немолекулярные вещества с ковалентной
связью образуют очень твердые кристаллы.
Кристаллы алмаза (самого твердого вещества)
относятся именно к этому типу.
В кристалле алмаза (рис. 7.5) каждый атом углерода
связан с четырьмя другими атомами углерода
простыми ковалентными связями (sр 3 -гибридизация).
Атомы углерода образуют трехмерный каркас. По
существу весь кристалл алмаза представляет
собой одну огромную и очень прочную молекулу.
Такое же строение имеют и кристаллы кремния,
широко применяемые в радиоэлектронике и
электронной технике.
Если заменить половину атомов углерода в алмазе
на атомы кремния, не нарушая каркасную структуру
кристалла, то получится кристалл карбида кремния
SiC – также очень твердого вещества,
используемого как абразивный материал. Обычный
кварцевый песок (диоксид кремния) тоже относится
к этому типу кристаллических веществ. Кварц –
очень твердое вещество; под названием "
наждак" он также используется как абразивный
материал. Структуру кварца легко получить, если в
кристалле кремния между каждыми двумя атомами
кремния вставит атомы кислорода. При этом каждый
атом кремния окажется связанным с четырьмя
атомами кислорода, а каждый атом кислорода – с
двумя атомами кремния.
Кристаллы алмаза, кремния, кварца и подобные им
по структуре называют атомными кристаллами.
Атомный кристалл – кристалл, состоящий из атомов
одного или нескольких элементов, связанных
химическими связями.
Химическая связь в атомном кристалле может быть
ковалентной или металлической.
Как вы уже знаете, любой атомный кристалл, как и
ионный, представляет собой огромную "
супермолекулу" . Структурную формулу такой "
супермолекулы" записать нельзя – можно только
показать ее фрагмент, например:

В отличие от молекулярных веществ, вещества, образующие атомные кристаллы, – одни из самых тугоплавких (см. таблицу 23.).
Таблица 23. Температуры плавления и кипения некоторых немолекулярных веществ с ковалентными связями
Такие высокие температуры плавления вполне понятны, если вспомнить, что при плавлении этих веществ рвутся не слабые межмолекулярные, а прочные химические связи. По этой же причине многие вещества, образующие атомные кристаллы, при нагревании не плавятся, а разлагаются или сразу переходят в парообразное состояние (возгоняются), например, графит возгоняется при 3700 o С.
| Кремний – Si.
Очень
твердые, хрупкие кристаллы кремния по виду
похожи на металлические, тем не менее он –
неметалл. По типу электропроводности это
вещество относится к полупроводникам, что и
определяет его громадное значение в современном
мире. Кремний – важнейший полупроводниковый
материал. Радиоприемники, телевизоры,
компьютеры, современные телефоны, электронные
часы, солнечные батареи и многие другие бытовые и
промышленные приборы содержат в качестве
важнейших элементов конструкции транзисторы,
микросхемы и фотоэлементы, изготовленные из
монокристаллов особочистого кремния.
Технический кремний используется в производстве
сталей и в цветной металлургии. По химическим
свойствам кремний – довольно инертное вещество,
вступает в реакции только при высокой
температуре Диоксид кремния – SiO 2 . Другое название этого вещества – кремнезем. Диоксид кремния встречается в природе в двух видах: кристаллическом и аморфном. Многие полудрагоценные и поделочные камни являются разновидностями кристаллического диоксида кремния (кварца): горный хрусталь, яшма, халцедон, агат. а опал – аморфная форма кремнезема. Кварц очень широко распространен в природе, ведь и барханы в пустынях, и песчаные отмели рек и морей – все это кварцевый песок. Кварц – бесцветное кристаллическое очень твердое и тугоплавкое вещество. По твердости он уступает алмазу и корунду, но, тем не менее, широко используется как абразивный материал. Кварцевый песок широко применяется в строительстве и промышленности стройматериалов. Кварцевое стекло используется для изготовления лабораторной посуды и научных приборов, так как оно не растрескивается при резком изменении температуры. По своим химическим свойствам диоксид кремния – кислотный оксид, но со щелочами реагирует только при сплавлении. При высоких температурах из диоксида кремния и графита получают карбид кремния – карборунд. Карборунд – второе по твердости после алмаза вещество, его тоже используют для изготовления шлифовальных кругов и " наждачной" бумаги. |
7.12. Полярность ковалентной связи. Электроотрицательность
Вспомним, что изолированные атомы разных элементов имеют разную склонность как отдавать, так и принимать электроны. Эти различия сохраняется и после образования ковалентной связи. То есть, атомы одних элементов стремятся притянуть к себе электронную пару ковалентной связи сильнее, чем атомы других элементов.
Рассмотрим молекулу HCl.
На этом примере посмотрим, как можно оценить
смещение электронного облака связи, используя
молярные энергии ионизации и средства к
электрону. 1312 кДж/моль, а 1251 кДж/моль – различие
незначительно, примерно 5%. 73 кДж/моль, а 349 кДж/моль – здесь
различие куда больше: энергия сродства к
электрону атома хлора почти в пять раз больше
таковой для атома водорода. Отсюда можно сделать
вывод, что электронная пара ковалентной связи в
молекуле хлороводорода в значительной степени
смещена в сторону атома хлора. Иными словами,
электроны связи больше времени проводят вблизи
атома хлора, чем вблизи атома водорода. Такая
неравномерность распределения электронной
плотности приводит к перераспределению
электрических зарядов внутри молекулы.На атомах
возникают частичные (избыточные) заряды; на атоме
водорода – положительный, а на атоме хлора –
отрицательный.
В этом случае говорят, что связь поляризуется, а
сама связь называется полярной ковалентной
связью.
Если же электронная пара ковалентной связи не
смещена ни к какому из связываемых атомов, то
есть, электроны связи в равной степени
принадлежат связываемым атомам, то такая связь
называется неполярной ковалентной связью.
Понятие " формальный заряд" в случае
ковалентной связи также применимо. Только в
определении речь должна идти не об ионах, а об
атомах. В общем случае может быть дано следующее
определение.
В молекулах, ковалентные связи в которых
образовались только по обменному механизму,
формальные заряды атомов равны нулю. Так, в
молекуле HCl формальные заряды на атомах как
хлора, так и водорода равны нулю. Следовательно, в
этой молекуле реальные (эффективные) заряды на
атомах хлора и водорода равны частичным
(избыточным) зарядам.
Далеко не всегда по молярным энергиям ионизации
и сродства к электрод легко определить знак
частичного заряда на атоме того или другого
элемента в молекуле, то есть оценить, в какую
сторону смещены электронные пары связей. Обычно
для этих целей используют еще одну
энергетическую характеристику атома –
электроотрицательность.
В настоящее время единого, общепринятого
обозначения для электроотрицательности нет.
Можно обозначать ее буквами Э/О. Также пока нет и
единого, общепринятого метода расчета
электроотрицательности. Упрощенно ее можно
представить как полусумму молярных энергий
ионизации и сродства к электрону – таким и был
один из первых способов ее расчета.
Абсолютные значения электроотрицательностей
атомов различных элементов используются очень
редко. Чаще используют относительную
электроотрицательность, обозначаемую буквой c .
Первоначально эта величина определялась как
отношение электроотрицательности атома данного
элемента к электроотрицательности атома лития. В
дальнейшем методы ее расчета несколько
изменились.
Относительная электроотрицательность –
величина безразмерная. Ее значения приведены в
приложении 10.
Так как относительная электроотрицательность зависит прежде всего от энергии ионизации атома (энергия сродства к электрону всегда намного меньше), то в системе химических элементов она изменяется примерно также, как и энергия ионизации, то есть возрастает по диагонали от цезия (0,86) ко фтору (4,10). Приведенные в таблице значения относительной электроотрицательности гелия и неона не имеют практического значения, так как эти элементы не образуют соединений.
Используя таблицу электроотрицательности, можно легко определить в сторону какого из двух атомов смещены электроны, связывающие эти атомы, и, следовательно, знаки частичных зарядов, возникающих на этих атомах.
| H 2 O | Связь полярная | |||
| H 2 | Атомы одинаковые | H--H | Связь неполярная | |
| CO 2 | Связь полярная | |||
| Cl 2 | Атомы одинаковые | Cl--Cl | Связь неполярная | |
| H 2 S | Связь полярная |
Таким образом, в случае образования ковалентной связи между атомами разных элементов такая связь всегда будет полярной, а в случае образования ковалентной связи между атомами одного элемента (в простых веществах) связь в большинстве случаев неполярна.
Чем больше разность электроотрицательностей связываемых атомов, тем более полярной оказывается ковалентная связь между этими атомами.
| Сероводород H 2 S
–
бесцветный газ с характерным запахом, присущим
тухлым яйцам; ядовит. Он термически неустойчив,
при нагревании разлагается. Сероводород мало
растворим в воде, его водный раствор называют
сероводородной кислотой. Сероводород
провоцирует (катализирует) коррозию металлов,
именно этот газ " повинен" в потемнении
серебра. В природе он содержится в некоторых минеральных водах. В процессе жизнедеятельности его образуют некоторые бактерии. Сероводород губителен для всего живого. Сероводородный слой обнаружен в глубинах Черного моря и внушает опасения ученым: жизнь морских обитателей там находится под постоянной угрозой. |
ПОЛЯРНАЯ
КОВАЛЕНТНАЯ СВЯЗЬ,НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ,
АБСОЛЮТНАЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ,
ОТНОСИТЕЛЬНАЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ.
1.Эксперименты
и последующие расчеты показали, что эффективный
заряд кремния в тетрафториде кремния равен +1,64 е,
а ксенона в гексафториде ксенона +2,3 е. Определите
значения частичных зарядов на атомах фтора в
этих соединениях. 2. Составьте структурные
формулы следующих веществ и, используя
обозначения " " и " " ,
охарактеризуйте полярность ковалентных связей в
молекулах этих соединений: а) CH 4 , CCl 4 ,
SiCl 4 ; б) H 2 O, H 2 S, H 2 Se, H 2 Te;
в) NH 3 , NF 3 , NCl 3 ; г) SO 2 , Cl 2 O,
OF 2 .
3.Пользуясь таблицей электроотрицательностей,
укажите, в каком из соединений связь более
полярна: а) CCl 4 или SiCl 4 ; б) H 2 S или H 2 O;
в) NF 3 или NCl 3 ; г) Cl 2 O или OF 2 .
7.13. Донорно-акцепторный механизм образования связи
В предыдущих параграфах вы подробно познакомились с двумя типами связи: ионной и ковалентной. Вспомним, что ионная связь образуется при полной передаче электрона от одного атома другому. Ковалентная – при обобществлении неспаренных электронов связываемых атомов.
Кроме этого, существует еще один механизм образования связи. Рассмотрим его на примере взаимодействия молекулы аммиака с молекулой трифторида бора:

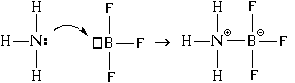
В результате между атомами азота и бора возникает и ковалентная, и ионная связь. При этом атом азота является донором электронной пары (" дает" ее для образования связи), а атом бора – акцептором (" принимает" ее при образовании связи). Отсюда и название механизма образования такой связи – " донорно-акцепторный" .
При образовании связи по донорно-акцепторному
механизму образуются одновременно и ковалентная
связь, и ионная.
Конечно, после образования связи за счет разницы
в электроотрицательности связываемых атомов
происходит поляризация связи, возникают
частичные заряды, снижающие эффективные
(реальные) заряды атомов.
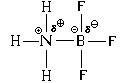
Рассмотрим другие примеры.
Если рядом с молекулой аммиака окажется сильно полярная молекула хлороводорода, в которой на атоме водорода имеется значительный частичный заряд , то в этом случае роль акцептора электронной пары будет выполнять атом водорода. Его 1s -АО хоть и не совсем пустая, как у атома бора в предыдущем примере, но электронная плотность в облаке этой орбитали существенно понижена.
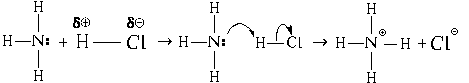
Пространственное строение получившегося
катиона, иона аммония
NH 4 , подобно строению
молекулы метана, то есть все четыре связи N-H
совершенно одинаковы.
Образование ионных кристаллов хлорида аммония NH 4 Cl
можно наблюдать, смешав газообразный аммиак с
газообразным хлороводородом:
NH 3(г) + HCl (г) = NH 4 Cl (кр)
Донором электронной пары может быть не только атом азота. Им может быть, например, атом кислорода молекулы воды. С тем же хлороводородом молекула воды будет взаимодействовать следующим образом:
Образующийся катион H 3 O называется ионом
оксония
и, как вы скоро узнаете, имеет огромное
значение в химии.
В заключение рассмотрим электронное строение
молекулы угарного газа (монооксида углерода) СО:
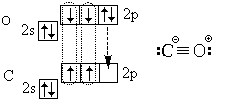
В ней, кроме трех ковалентных связей (тройной
связи), есть еще и ионная связь.
Условия образования связи по
донорно-акцепторному механизму:
1) наличие у одного из атомов неподеленной пары
валентных электронов;
2) наличие у другого атома свободной орбитали на
валентном подуровне.
Донорно-акцепторный механизм образования связи
распространен довольно широко. Особенно часто он
встречается при образовании соединений d
-элементов.
Атомы почти всех d
-элементов имеют много
свободных валентных орбиталей. Поэтому они
являются активными акцепторами электронных пар.
ДОНОРНО-АКЦЕПТОРНЫЙ
МЕХАНИЗМ ОБРАЗОВАНИЯ СВЯЗИ, ИОН АММОНИЯ,
ИОН ОКСОНИЯ, УСЛОВИЯ ОБРАЗОВАНИЯ СВЯЗИ ПО
ДОНОРНО-АКЦЕПТОРНОМУ МЕХАНИЗМУ.
1.Составьте
уравнения реакций и схемы образования
а) бромида аммония NH 4 Br из аммиака и
бромоводорода;
б) сульфата аммония (NH 4) 2 SO 4 из
аммиака и серной кислоты.
2.Составьте уравнения реакций и схемы
взаимодействия а) воды с бромоводородом; б) воды с
серной кислотой.
3.Какие атомы в четырех предыдущих реакциях
являются донорами электронной пары, а какие
акцепторами? Почему? Ответ поясните диаграммами
валентных подуровней.
4.Структурная формула азотной кислоты Углы
между связями O– N– O близки к 120 o .
Определите:
а) тип гибридизации атома азота;
б) какая АО атома азота принимает участие в
образовании -связи;
в) какая АО атома азота принимает участие в
образовании -связи по
донорно-акцепторному механизму.
Как вы думаете, чему примерно равен угол между
связями H– O– N в этой молекуле? 5.Составьте
структурную формулу цианид-иона CN (отрицательный
заряд – на атоме углерода). Известно, что цианиды
(соединения, содержащие такой ион) и угарный газ
СО – сильные яды, и биологическое действие их
очень близко. Предложите свое объяснение
близости их биологического действия.
7.14. Металлическая связь. Металлы
Ковалентная связь образуется между атомами, близкими по склонности к отдаче и присоединению электронов, только тогда, когда размеры связываемых атомов невелики. В этом случае электронная плотность в области перекрывания электронных облаков значительна, и атомы оказываются прочно связанными, как, например, в молекуле HF. Если хотя бы один из связываемых атомов имеет большой радиус, образование ковалентной связи становится менее выгодным, так как электронная плотность в области перекрывания электронных облаков у больших атомов значительно меньше, чем у маленьких. Пример такой молекулы с менее прочной связью – молекула HI (пользуясь таблицей 21, сравните энергии атомизации молекул HF и HI).
И все-таки между большими атомами (r o > 1,1) возникает химическая связь, но в этом случае она образуется за счет обобществления всех (или части) валентных электронов всех связываемых атомов. Например, в случае атомов натрия обобществляются все 3s -электроны этих атомов, при этом образуется единое электронное облако:
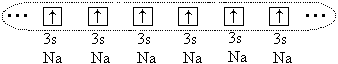
Атомы образуют кристалл с металлической
связью.
Так могут связываться между собой как атомы
одного элемента, так и атомы разных элементов. В
первом случае образуются простые вещества,
называемые металлами
, а во втором – сложные
вещества, называемые интерметаллическими
соединениями
.
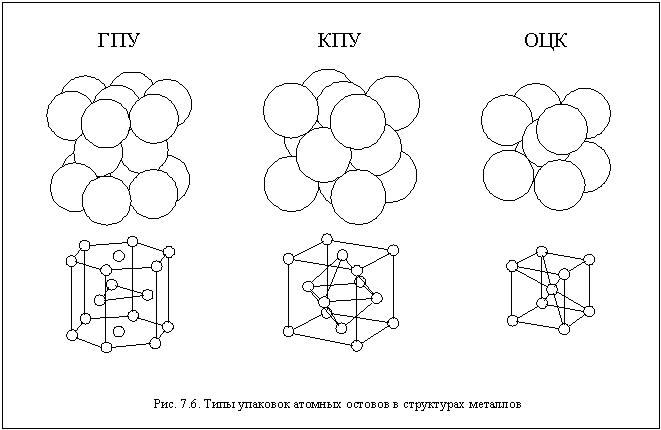
Из всех веществ с металлической связью между атомами в школе вы будете издать только металлы. Каково же пространственное строение металлов? Металлический кристалл состоит из атомных остовов , оставшихся после обобществления валентных электронов, и электронного облака обобществленных электронов. Атомные остовы обычно образуют плотнейшую упаковку, а электронное облако занимает весь оставшийся свободным объем кристалла.
Основными видами плотнейших упаковок являются кубическая
плотнейшая упаковка
(КПУ) и гексагональная
плотнейшая упаковка
(ГПУ). Названия этих
упаковок связаны с симметрией кристаллов, в
которых они реализуются. Некоторые металлы
образуют кристаллы с неплотнейшей упаковкой – объемноцентрированной
кубической
(ОЦК). Объемные и шаростержневые
модели этих упаковок показаны на рисунке 7.6.
Кубическую плотнейшую упаковку образуют атомы Cu,
Al, Pb, Au и некоторых других элементов.
Гексагональную плотнейшую упаковку – атомы Be, Zn,
Cd, Sc и ряд других. Объемноцентрированная
кубическая упаковка атомов присутствует в
кристаллах щелочных металлов, элементов VB и VIB
групп. Некоторые металлы при разных температурах
могут иметь разную структуру. Причины таких
отличий и особенностей строения металлов до сих
пор до конца не выяснены.
При плавлении металлические кристаллы
превращаются в металлические жидкости
. Тип
химической связи между атомами при этом не
изменяется.
Металлическая связь не обладает направленностью
и насыщаемостью. В этом отношении она похожа на
ионную связь.
В случае интерметаллических соединений можно
говорить и о поляризуемости металлической связи.
Характерные физические свойства металлов:
1) высокая электропроводность;
2) высокая теплопроводность;
3) высокая пластичность.
Температуры плавления разных металлов очень сильно отличаются друг от друга: наименьшая температура плавления у ртути (- 39 o С), а наибольшая - у вольфрама (3410 o С).
| Бериллий Be
- светло-серый
легкий достаточно твердый, но обычно хрупкий
металл. Температура плавления 1287 o С. На
воздухе он покрывается оксидной пленкой.
Бериллий - достаточно редкий металл, живые
организмы в процессе своей эволюции практически
не контактировали с ним, поэтому и неудивительно,
что он ядовит для животного мира. Применяется он
в ядерной технике. Цинк Zn - белый с
голубоватым оттенком мягкий металл. Температура
плавления 420 o С. На воздухе и в воде
покрывается тонкой плотной пленкой оксида цинка,
препятствующей дальнейшему окислению. В
производстве используется для оцинковки листов,
труб, проволоки, защищая железо от коррозии. Вольфрам W. Это самый тугоплавкий из всех металлов: температура плавления вольфрама 3387 o С. Обычно вольфрам довольно хрупкий, но после тщательной очистки становится пластичным, что позволяет вытягивать из него тонкую проволоку, из которой делают нити электрических лампочек. Однако большая часть получаемого вольфрама идет на производство твердых и износостойких сплавов, способных сохранять эти свойства при нагревании даже до 1000 o С. |
МЕТАЛЛ,
ИНТЕРМЕТАЛЛИЧЕСКОЕ СОЕДИНЕНИЕ, МЕТАЛЛИЧЕСКАЯ
СВЯЗЬ, ПЛОТНЕЙШАЯ УПАКОВКА.
1.Для
характеристики различных упаковок используется
понятие " коэффициент заполнения
пространства" , то есть отношение объема
атомов к объему кристалла
где V a -
объем атома,
Z - число атомов в элементарной ячейке,
V я
- объём элементарной ячейки.
Атомы в этом случае представляются жесткими
шарами радиуса R
, соприкасающимися друг с
другом. Объем шара V
ш = (4/3)R
3 .
Определяйте коэффициент заполнения
пространства для КПУ и ОЦК упаковки.
2.Используя значения металлических радиусов
(приложение 9), рассчитайте размер элементарной
ячейки а) меди (КПУ), б) алюминия (КПУ) и в) цезия
(ОЦК).
Ковалентная связь – связь по средством электронных пар.
Донорно-акцепторный механизм образования связи – механизм образования связи, при котором один из связываемых атомов является донором электронной пары, а другой – акцептором.
По донорно-акцепторному механизму:
1)Несвязывающие молекулярные орбитали (НСМО) имеются:
в молекулах, содержащих атомы с неподеленными электронными парами (например, в спиртах ROH атом кислорода имеет две неподеленные пары электронов, которые занимают две НСМО);
в свободных радикалах, имеющих неспаренные электроны (так, в метильном радикале СН 3 неспаренный электрон находится на НСМО);
в карбокатионах типа + СН 3 , где НСМО свободна.
Молекулы и ионы, имеющие НСМО, могут участвовать в образовании ковалентной связи по донорно-акцепторному механизму.
2) При образовании связи по донорно-акцепторному механизму образуются одновременно и ковалентная связь, и ионная.
Конечно, после образования связи за счет разницы в электроотрицательности связываемых атомов происходит поляризация связи, возникают частичные заряды, снижающие эффективные (реальные) заряды атомов.
3) Ковалентная связь может образоваться между двумя атомами, из которых один имеет неподеленную пару электронов, а другой - свободную орбиталь. Например, при взаимодействии аммиака NH3 и хлороводорода HC1 неподеленная электронная пара азота становится общей для водорода и азота, получается ион аммония NH4 + ; 8. Такой механизм образования ковалентной связи называется донорно-акцепторным. В нашем примере донором электронной пары является атом азота, а акцептором - ион водорода (он имеет свободную орбиталь). Донорно-акцепторный механизм образования ковалентной связи наблюдается в комплексных соединениях OH, K4.
ОБМЕННЫЙ МЕХАНИЗМ - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону
2. По какой формуле рассчитывается титр раствора вещества. Какие еще бывают формы выражения концентрации вещества в растворе?
Титр (от франц. titre - качество, характеристика), в аналитической химииконцентрация раствора, выраженная количеством (в граммах) растворённого вещества в 1 мл раствора или количеством какого-либо вещества, реагирующего с 1 мл данного раствора. Соответственно различают Т. по растворённому веществу (например, Т. раствора соляной кислоты - T HCl) или Т. по определяемому веществу (например, Т. раствора соляной кислоты по едкому натру - T HCl/NaOH). Т. рассчитывается по формуле: T = P/V, где Т - титр раствора в г/мл, Р - масса навески в г, V - объём мерной колбы в мл.
Способы выражения концентраций химических веществ в растворах.
Молярная концентрация вещества (с ) в моль/л – отношение количества растворенного вещества в молях (n ) к объему раствора (V ):
Молярная концентрация численно равна количеству молей вещества, содержащихся в 1 литре (1000 мл, 1 дм 3) раствора.
Молярная концентрация эквивалента ** с[(1/z)Х] есть произведение молярной концентрации с(Х) на число эквивалентности z данного вещества, т.е. с[(1/z)Х] = с(Х)×z . Молярная концентрация эквивалента показывает количество вещества эквивалентов, содержащееся в 1 л раствора.
Моляльная концентрация (В) в моль/кг – отношение количества растворенного вещества в молях (n ) к массе растворителя (m ):
Часто встречаются также производные от единиц измерения концентраций: например, мг/л, мг/дм3, мг/см3, мг/мл, ммоль/л, г/мл (титр) и др. Наиболее употребимыми единицами в справочной литературе применительно к оценке содержания примесей в воде (например, значения ПДК) являются мг/л и ммоль/л экв .
3. Напишите вариант реакции получения соли путем замещения водорода или металла .
Fe + CuSO4 = FeSO4 + Cu
Ca + NaNO3 = Ca(NO3)2 + Na
Na + KCl = NaCl + K
Mn + NaSO4 = MnSO4 + 2Na
Cr + K3PO4 = CrPO4 + 3K
Билет № 23
1. Что изучает химическая термодинамика («теплохимия»), какие бывают термодинамические системы, их свойства, параметры и функции состояния ?
Химические реакции сопровождаются выделением или поглощением энергии. Если энергия выделяется или поглощается в виде теплоты, то такие реакции записываются посредством уравнений химической реакций с указанием тепловых эффектов, при этом необходимо указывать фазовый состав реагирующих веществ.
Химические реакции, протекающие с выделением тепла, называются экзотермическими, а с поглощением тепла - эндотермическими. Изучением тепловых эффектов реакций занимается термохимия. В термохимии тепловой эффект реакции обозначается Q и выражается в кДж. Термохимия составляет один из разделов химической термодинамики, изучающей переходы энергии из одной формы в другие и от одной совокупности тел к другим, а также возможность, направление и глубину осуществления химических и фазовых процессов в данных условиях. Каждое отдельное вещество или их совокупность представляет собой термодинамическую систему. Если термодинамическая система не обменивается с окружающей средой ни веществом, ни энергией, ее называют изолированной. Такая идеализированная система используется как физическая абстракция при рассмотрении процессов, исключающих влияние внешней среды. Система, обменивающаяся с окружающей средой только энергией, называется закрытой. Если же возможен энергетический и материальный обмен - система открытая.
Состояние системы определяется термодинамическими параметрами состояния - температурой, давлением, концентрацией, объемом и т. д. Система характеризуется, кроме того, такими свойствами как внутренняя энергия U, энтальпия Н, энтропия S, энергия Гиббса G. Из изменение в ходе химических реакций характеризуют ее энергетику системы. Перечисленные свойства системы зависят от температуры, давления, концентрации, поэтому они называются функциями состояния, не зависят от пути процесса и определяются только конечным и начальным состояниеми системы.
2. Формула закона Дальтона для идеальных растворов. Какие еще бывают растворы? .
Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме их парциальных
давлений.
Согласно закону Дальтона, парциальное давление газа Рг определяется по формуле:
где Pabs - абсолютное давление газовой смеси, n - процентное содержание газа в смеси.
Другими словами, целое равно сумме его составляющих. В воздухе находятся около 21 молекулы кислорода на 100 молекул всех газов. Таким образом, кислород оказывает давление, равное одной пятой от общего давления. Эта часть общего давления известна как парциальное давление кислорода и является важным фактором в подводном плавании, поскольку на организм человека напрямую воздействуют в большей мере парциальные давления газов, входящих в состав воздуха, чем их абсолютные давления.
Какие еще бывают растворы? – смотри 1 вопрос 28 билета
3. Напишите вариант реакции получения соли путем соединения двух солей .
KCr(SO4)2 + 3KOH = Cr(OH)3 + 2K2SO4
При донорно – акцепторном механизме образования ковалентной связи связь также образуется с помощью электронных пар. Однако в этом случае однин атом (донор) предоставляет свою электронную пару, а другой атом (акцептор) участвует в образовании связи своей свободной орбиталью. Примером реализации донорно-акцепторной связи является образование иона аммония NH 4 + при взаимодействии аммиака NH 3 с катионом водорода H + . В молекуле NH 3 три электронные пары образуют три связи N – H, четвертая, принадлежащая атому азота электронная пара является неподеленной. Эта электронная пара может дать связь с ионом водорода, который имеет свободную орбиталь. В результате получается ион аммония NH 4 + , рис. 5.2.
Рис. 5.2. Возникновение донорно-акцепторной связи при образовании иона аммония
Необходимо отметить, что существующие в ионе NH 4 + четыре ковалентных связи N – H равноценны. В ионе аммония невозможно выделить связь, образованную по донорно-акцепторному механизму.
Полярная и неполярная ковалентная связь
Если ковалентная связь образуется одинаковыми атомами, то электронная пара располагается на одинаковом расстоянии между ядрами этих атомов. Такая ковалентная связь называется неполярной . Примером молекул с неполярной ковалентной связью являются Н 2 , Cl 2 , О 2 , N 2 и др.
 В случае полярной ковалентной
связи общая электронная пара смещена к атому с большей электроотрицательностью. Этот тип связи реализуется в молекулах, образованных различными атомами. Ковалентная полярная связь имеет место в молекулах HCl, HBr, CO, NO и др. Например, образование полярной ковалентной связи в молекуле HCl можно представить схемой, рис. 5.3:
В случае полярной ковалентной
связи общая электронная пара смещена к атому с большей электроотрицательностью. Этот тип связи реализуется в молекулах, образованных различными атомами. Ковалентная полярная связь имеет место в молекулах HCl, HBr, CO, NO и др. Например, образование полярной ковалентной связи в молекуле HCl можно представить схемой, рис. 5.3:
Рис. 5.3. Образование ковалентной полярной связи в молекуле НС1
В рассматриваемой молекуле электронная пара смещена к атому хлора, поскольку его электроотрицательность (2,83) больше, чем электроотрицательность атома водорода (2,1).
1. Ковалентную неполярную связь образуют одинаковые атомы неметаллов и атомы водорода;
2. Ковалентную полярную химическую связь образуют разные атомы неметаллов и неметаллы с водородом;
Ковалентная связь – возникает между атомами в результате образования общих электронных пар.
Основные положения метода валентных связей:
1) В образовании химической связи участвуют только неспаренные электроны внешней электронной оболочки.
В20 сигма σ, пи π и дельта ɓ связи
Сигма-, пи- и дельта-связь. Сигма-связь (s-связь): перекрывание валентных орбиталей происходит вдоль линии связи, т.е. линии, соединяющей ядра взаимодействующих атомов. Пи-связь (p-связь): перекрывание орбиталей происходит в направлении, перпендикулярном линии связи (боковое перекрывание). Дельта-связь (d-связь): перекрывающиеся орбитали расположены в двух параллельных плоскостях, перпендикулярных линии связи.
Химическая связь, для которой линия, соединяющая атомные ядра, является осью симметрии связывающего электронного облака, называется сигма (σ)-связью . Она возникает при «лобовом» перекрывании атомных орбиталей. Связи при перекрывании s-s-орбиталей в молекуле Н 2 ; р-р-орбиталей в молекуле Cl 2 и s-p-орбиталей в молекуле НСl являются сигма связями. Возможно «боковое» перекрывание атомных орбиталей. При перекрывании р-электронных облаков, ориентированных перпендикулярно оси связи, т.е. по оси у- и z-осям, образуются две области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется пи (p)-связью. Перекрывание электронных облаков при образовании π-связи меньше. Кроме того, области перекрывания лежат дальше от ядер, чем при образовании σ-связи. Вследствие этих причин π-связь обладает меньшей прочностью по сравнению с σ-связью. Поэтому энергия двойной связи меньше удвоенной энергии одинарной связи, которая всегда является σ-связью. Кроме того, σ-связь имеет осевую, цилиндрическую симметрию и представляет собой тело вращения вокруг линии, соединяющей атомные ядра. π-Связь, наоборот, не обладает цилиндрической симметрией.
Одинарная связь всегда является чистой или гибридной σ-связью. Двойная же связь состоит из одной σ- и одной π-связей, расположенных перпендикулярно друг относительно друга. σ-Связь прочнее π-связи. В соединениях с кратными связями обязательно присутствует одна σ-связь и одна или две π-связи.
При сближении на определённое расстояние (r1) двух атомов, содержащих электроны с антипараллельными спинами, между ними возникает сильное обменное взаимодействие: ядро первого атома начинает притягивать электрон второго и наоборот – ядро второго притягивает электрон первого. Наступает момент, когда оба электрона начинают двигаться в поле обоих ядер. С позиций квантовой механики, этот момент рассматривается как момент образования ковалентной связи. Он характеризуется наибольшей глубиной перекрывания атомных орбиталей и максимальным выделением энергии (рис. 13). Теперь электроны находятся на молекулярной орбитали. Передача одного электрона любого атома в ковалентную связь не сопровождается изменением заряда ни на одном из атомов, образующих эту связь, т.к. партнёр компенсирует эти потери.
При сближении атомов до некоторого малого расстояния (rо) начинают играть роль силы отталкивания двух ядер, энергия системы повышается. Расстояние rо, при котором эти силы компенсируют друг друга, соответствует длине химической связи, т.е. расстоянию между атомами в молекуле, а выделившаяся энергия - энергии связи (рис. 14).
 Если взаимодействующие атомы имеют электроны с параллельными спинами, то их орбитали отталкиваются друг от друга, энергия системы возрастает, химическая связь не образуется.
Впервые предположение о том, что химические связи имеют ковалентный характер и осуществляются за счёт обобщённых пар электронов было выдвинуто Г. Льюисом и В. Косселем. Льюис высказал мысль о том, что каждый атом стремится к заполнению вокруг себя устойчивой электронной оболочки инертного газа. Для атома водорода ею является двухэлектронный слой гелия, для атомов элементов второго периода - восьмиэлектронная оболочка неона. И. Лэнгмюр назвал её электронным октетом
.
Если взаимодействующие атомы имеют электроны с параллельными спинами, то их орбитали отталкиваются друг от друга, энергия системы возрастает, химическая связь не образуется.
Впервые предположение о том, что химические связи имеют ковалентный характер и осуществляются за счёт обобщённых пар электронов было выдвинуто Г. Льюисом и В. Косселем. Льюис высказал мысль о том, что каждый атом стремится к заполнению вокруг себя устойчивой электронной оболочки инертного газа. Для атома водорода ею является двухэлектронный слой гелия, для атомов элементов второго периода - восьмиэлектронная оболочка неона. И. Лэнгмюр назвал её электронным октетом
.
 Формулы, показывающие число электронов в связях и неподелённые электронные пары на гетероатомах, назваются формулами Льюиса
. В этих формулах каждая связь изображается двумя точками:
В структурных формулах общая электронная пара изображается черточкой, соединяющей два атома:
Формулы, показывающие число электронов в связях и неподелённые электронные пары на гетероатомах, назваются формулами Льюиса
. В этих формулах каждая связь изображается двумя точками:
В структурных формулах общая электронная пара изображается черточкой, соединяющей два атома:
| Предыдущие материалы: |
