МОЛЕКУЛЯРНЫЙ ВЕС (син. молекулярная масса ) - масса молекулы вещества, выраженная в углеродных единицах атомной массы (углеродная единица атомной массы - 1/12 массы атома изотопа углерода 12 C); наряду с атомными массами служит основой для всевозможных расчетов, выполняемых с помощью хим. формул и уравнений, в т. ч. расчетов, производимых в биохим. и клинико-диагностических лабораториях.
Если известна хим. формула вещества, то его М. в. может быть вычислен как сумма атомных весов (масс) атомов хим. элементов (см. Атомный вес), входящих в состав молекулы данного вещества. Напр., М. в. углекислого газа (CO 2) равен:
12,011 + 2 * 15,9994 = 44,0098.
Для веществ, находящихся в газообразном или растворенном состоянии, экспериментальные методы определения М. в. наиболее обоснованны. М. в. (М1) газа обычно определяют, измерив его относительную плотность D по газу, М. в. к-рого (М2) известен; тогда М1 = M2*D. М. в. газа можно также определить, если известна его нормальная плотность d, т. е. масса 1 л газа в граммах при давлении 760 мм рт. ст. и 0 °C. В этом случае М. в. газа равен M = 22,42*d.
Для определения М. в. растворенного вещества в таком растворителе, в к-ром это вещество не подвергается диссоциации или ассоциации, наиболее часто измеряют понижение температуры замерзания р-ра Δt (см. Криометрия), наблюдаемое при растворении а г исследуемого вещества в b г растворителя: М = (K*a*1000)/(Δt*b), где К - криометрическая (криоскопическая) постоянная растворителя.
М. в. растворенного вещества можно также определить, измерив осмотическое давление р-ра (см. Осмотическое давление). В этом случае M = (m*R*T)/p, где m - масса растворенного вещества в граммах, содержащаяся в 1 л р-ра, p - осмотическое давление в атм, T - температура в градусах по Кельвину и R - газовая постоянная в л*атм/моль*град. Этот метод с успехом применяется для определения М. в. белков, полисахаридов, нуклеиновых и других высокомолекулярных соединений (см.). М. в. белков и других биополимеров можно определить методом ультрацентрифугирования (см.).
В практике биохим., клин, и сан.-гиг. лабораторий для выполнения различного рода расчетов широко пользуются также единицей количества вещества, называемой молем.
Моль - это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12 C. Число молекул, атомов или других структурных единиц, содержащихся в одном моле любого вещества, называемое числом Авогадро, определено с большой точностью. Для практических расчетов его принимают равным
6,023*10 23 моль -1 .
Масса одного моля вещества, выраженная в граммах, численно равная М. в. вещества, называется мольной массой, или грамм-молекулой.
Библиография: Белки, под ред. Г. Нейрата и К. Бэйли, пер. с англ., т. 2, с. 276, М., 195 6: Гауровиц Ф. Химия и функция белков, пер. с англ., М., 1965; Ост-вальд-Лютер - Дру кер, Физикохимические измерения, пер. с нем., ч. 1, €. 294, Л., 1935.
Мы видим, что одна гирька значимо перевешивает семь пластмассовых шариков. Опыт с весами дает нам ответ - больше вещества в железной гирьке, это если мы сравниваем массы - меры инертности железа и пластмассы.
А что если мы сравним не массы, а количество вещества, которое пошло на изготовление шариков и гирьки, фактически количество частиц, из которых они состоят? Взяв в руки шарики и гирьку, мы увидим, что гирька фактически теряется на фоне этих шариков. Если бы мы умели считать количество частиц, которые входят в железо и пластмассу, то мы бы увидели, что количество атомов железа окажется значительно меньше количества молекул во всех пластмассовых шариках. Значит вещества больше в пластмассе.
Правильными являются оба ответа.
Все дело в том, что в первом случае мы сравнивали массу, то есть меру инертности тел, а во втором случае мы сравнивали количество молекул, количество вещества.
Простую аналогию мы можем провести с сахаром в мерном стаканчике. На вопрос, сколько там сахара, можно ответить, посмотрев на деление стаканчика и ориентировочно сказать, сколько там граммов сахара. Можно пересчитать каждую крупинку, находящуюся в стаканчике, и ответить, какое количество их содержит стаканчик. Правильными будут и первый, и второй ответы. Когда же удобнее говорить о массе молекул, а когда удобнее говорить о количестве вещества? Именно это и является темой урока: «Масса молекул, Количество вещества».
В XIX веке итальянский ученый Авогадро установил интересный факт: если два разных газа, например водород и кислород, находятся в одинаковых сосудах, при одинаковых давлениях и температурах, то в каждом сосуде будет одинаковое количество молекул, хотя массы газов могут отличаться очень сильно, в нашем примере - в 16 раз (рис. 2).
Рис. 2. Опыт Авогадро ()
Все это обозначает, что некоторые свойства тела определяются именно количеством молекул, а не только массой.
Что же мы понимаем под термином «количество вещества»? Любое вещество состоит из молекул, атом, ионов - значит, имеет смысл под количеством вещества понимать количество молекул.
Физическая величина, которая определяет количество молекул в данном теле, называется количеством вещества . Обозначается греческой буквой ν - ню.
Условились за единицу количества вещества принять такое его количество, в котором содержится столько частиц (атомов, молекул), сколько атомов содержится в 0,012 кг (12 граммах) изотопа углерода с атомной массой 12.
Называется эта единица моль.
Из этого определения выходит, что в одном моле любого вещества будет одинаковое количество молекул. В одном моле любого вещества содержится 6,02·10 23 молекул или частиц. Эта величина носит название постоянная Авогадро .

Рис. 3. Определение полного числа молекул ()
Эта формула позволяет узнать полное число молекул при известном количестве вещества.
Масса молекулы крайне мала. Определили это физики при помощи так называемого масс-спектрографа. К примеру, значение массы молекулы воды (рис. 4):

Рис. 4. Определение массы молекулы воды ()
Как мы видим, так же, как и в случаях с количеством вещества, сравнивать массу одной молекулы с эталоном массы, килограммом, не очень удобно. Если в случаях с количеством вещества числа огромны, то в случаях с массой молекул числа очень малы. Именно поэтому в качестве единицы измерения массы молекулы или атома была выбрана особая внесистемная единица - атомная единица массы . Мы будем сравнивать единицу массы не с эталоном, а с массой молекулы какого-то вещества.
Этим веществом стал самый распространенный в природе элемент - углерод, который входит во все органические соединения. Атомная единица массы равна:
1 а.е.м. = 1/12 массы углерода - 12 (изотоп, в котором 12 нуклонов)
1 а.е.м. = 1, 66·10 -27 кг
Так как мы будем измерять массу молекул в атомных единицах массы, то мы приходим к новой физической величине - относительная молекулярная масса.
Отношение массы молекулы (атома) данного вещества к 1/12 массы атома углерода называется относительной молекулярной массой (или относительной атомной массой) в случае атомарного строения вещества.
Формулы, выражающие это определение:
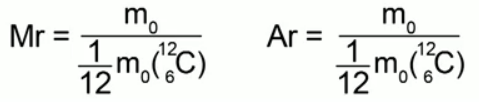
Относительная молекулярная масса - это безразмерная величина, она ни в чем не измеряется. Нам ничего не мешает по-прежнему измерять массы атомов и молекул в килограммах тогда, когда нам это будет удобно. Из курса химии мы знаем, что: относительная молекулярная масса вещества равна сумме относительных атомных масс элементов, входящих в него. Например, для воды Н 2 О относительная молекулярная масса будет:
Мr = 1·2 + 16 = 18
Сумма относительной молекулярной массы кислорода (16) и двух водородов (2.1) даст 18
Как же найти общее между массой в килограммах и количеством вещества в молях? Это величина - молярная масса.
Молярная масса - это масса одного моля вещества.
Обозначается [ М ], измеряется в кг/моль.
Молярная масса равна отношению массы к количеству вещества:
Получим формулы, которые связывают различные характеристики молекул.
Для определения молярной массы химического элемента обратимся к периодической таблице химических элементов Менделеева - берем просто атомную массу А (число нуклонов необходимого элемента) - это и будет его молярная масса, выраженная в г/моль.
Например, для алюминия (рис. 5):

Рис. 5. Определение молярной массы вещества ( )
Атомная масса алюминия будет равна 27, а молярная масса будет равна 0,027 кг/моль.
Это объясняется тем, что молярная масса углерода равна 12 г/моль по определению, в то же время ядро атома углерода содержит 12 нуклонов - 6 протонов и 6 нейтронов, выходит, что каждый нуклон вносит в молярную массу 1 г/моль, поэтому молярная масса химического элемента с атомной массой А окажется равной А г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием малярных масс, так например (рис. 6):

Рис. 6. Молярная масса углекислого газа ()
Нужно быть особо внимательными с молярными массами некоторых газов, таких как газообразный водород, азот, кислород - их молекула состоит из двух атомов - H 2 , N 2 , O 2 , а гелий, часто встречающийся в задачах, является одноатомным и имеет молекулярную массу 4 г/моль, предписанную таблицей Менделеева (рис. 7).

Рис. 7. Молярные массы некоторых газов ()
В одном моле любого вещества содержится число Авогадро молекул, значит, если умножить число Авогадро (число молекул в одном моле) на массу одной молекулы m 0 , то мы получим молярную массу вещества, то есть массу одного моля вещества:
М = m 0 · N А
Если 25 учеников занимаются в классе, площадь которого 50 м 2 , то на каждого ученика приходится 2 м 2 . При переходе их на занятие в спортзал, площадь которого 500 м 2 , на каждого ученика уже будет приходиться 20 м 2 . Число учеников не изменилось, но они стали реже расположенными, в этом случае говорят: уменьшилась концентрация людей. Точно так же для молекул вводится понятие концентрации в молекулярной кинетической теории.
Концентрацией (n) называется количество молекул, приходящихся на единицу объема вещества. Она равна отношению числа молекул к объему:
Формулы, связывающие концентрацию с другими характеристиками молекул:

Пользуясь этими формулами, мы можем сравнивать вещества как по количеству молекул, так и по массе.
Мы получили все необходимое для того, чтобы построить молекулярно-кинетическую теорию, чем мы займемся на следующих уроках.
Список литературы
- Тихомирова С.А., Яворский Б.М. Физика (базовый уровень) - М.: Мнемозина, 2012.
- Генденштейн Л.Э., Дик Ю.И. Физика 10 класс. - М.: Мнемозина, 2014.
- Кикоин И.К., Кикоин А.К. Физика - 9, Москва, Просвещение, 1990.
- Lib.podelise.ru ().
- Class-fizika.spb.ru ().
- Bolshoyvopros.ru ().
Домашнее задание
- Дать определение количества вещества.
- Назовите единицу измерения массы молекулы или атома.
- Дать определение относительной молекулярной массе.


Основные положения МКТ. Масса и размер молекул. Количество вещества. Молекулярная физика
МКТ - это просто!
«Ничто не существует, кроме атомов и пустого пространства …» - Демокрит
«Любое тело может делиться до бесконечности» - Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ
- это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела
- это большие тела, состоящие из огромного числа молекул.
Тепловые явления
- явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
- механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
Диффузия; броуновское движение частиц в жидкости под ударами молекул;
Плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
- фотографирование, определение размеров частиц.
Броуновское движение
Броуновское движение - это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
- открыто английским ботаником Р. Броуном в 1827 г.
- дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
- экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около см.

Число молекул в веществе
где V - объем вещества, Vo - объем одной молекулы
Масса одной молекулы
где m - масса вещества,
N - число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м. :
Относительная молекулярная масса вещества
Для удобства расчетов вводится величина - относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
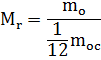
где числитель - это масса молекулы, а знаменатель - 1/12 массы атома углерода
Это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента
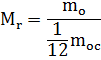
где числитель - это масса атома, а знаменатель - 1/12 массы атома углерода
Величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества
Количество вещества (ν) определяет относительное число молекул в теле.
где N - число молекул в теле, а Na - постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль - это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:
Молярная масса
Молярная масса (M) - это масса вещества, взятого в одном моле, или иначе - это масса одного моля вещества.
Масса молекулы
- постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества
На законе Авогадро основан важнейший метод определения молекулярных весов газообразных веществ. Но прежде чем говорить об этом методе, следует напомнить, в каких единицах выражаются молекулярные и атомные веса.
При вычислениях атомных весов первоначально принимали за единицу вес атома водорода, как самого легкого элемента, и по отношению к нему вычисляли атомные веса других элементов. Но так как для большинства элементов атомные веса определяются из их кислородных соединений, фактически вычисления производились по отношению к атомному весу кислорода, который считался равным 16. Отношение между атомными весами кислорода и водорода принималось равным 16:1. Впоследствии более точные исследования показали, что это отношение равно 15,88: 1, или 16: 1,008. Следовательно, если считать атомный вес водорода равным 1, атомный вес кислорода будет 15,88. Из практических соображений было решено оставить для кислорода атомный вес 16, приняв для водорода атомный вес 1,008.
Таким образом, в настоящее время единицей веса атомов является 1 / 16 часть веса атома кислорода. Эта единица получила название«кислородной един ицы». Вес атома водорода равен 1,008 кислородной единицы, вес атома серы - 32,06 кислородной единицы и т, д.
Атомным весом элемента называется вес его атома, выра женный в кислородных единицах.
Так как вес молекулы любого равен сумме весов образующих ее атомов, понятно, что молекулярные веса должны выражаться в тех же единицах, что и атомные веса. Например, вес молекулы водорода, состоящей из двух атомов, равен 2,016 кислородной единицы; вес молекулы кислорода, также состоящей из двух атомов, равен 32 кислородным единицам; вес молекулы воды, содержащей два атома водорода и один атом кислорода, равен 16 + 2,016=18,016 кислородной единицы и т. д.
Молекулярным весом простого или сложного назы вается вес его молекулы, выраженный в кислородных единицах.
Посмотрим теперь, как определяются молекулярные веса газообразных веществ.
По закону Авогадро, равные объемы газов, взятых при одинаковом давлении и одинаковой температуре, содержат равное число молекул. Отсюда следует, что веса равных объемов двух газов должны относиться друг к другу, как их молекулярные веса.
Возьмем например, по одному литру двух различных газов. Пусть в каждом из них содержится по N молекул. Обозначим вес литра первого газа через g, а второго через g 1 . Молекулярные веса газов обозначим соответственно через М и M 1 . Так как вес литра газа равен сумме весов находящихся в нем молекул,
g = N M и g 1 =N M 1 Разделив первое равенство на второе, получим:(1)
Отношение веса данного газа к весу того же объема другого газа, взятого при той же температуре и том же давлении, называется плотностью первого газа по второму. Например, 1 л углекислого газа весит 1,98 г, а 1 л водорода при тех же условиях 0,09 г, откуда плотность углекислого газа по водороду будет 1,98:0,09 = 22.
Обозначив плотность газа буквой D, перепишем уравнение (1):
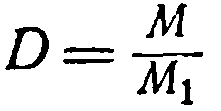
откуда
M = D M 1 (2)
Молекулярный вес газа равен его плотности по отношению к другому газу, умноженной на молекулярный вес второго газа.
Очень часто плотности различных газов определяют по отношению к водороду как самому легкому из всех тазов. Так как молекулярный вес самого водорода равен 2,016, то в этом случае формула для расчета молекулярных весов принимает вид:
М = 2,016 D
или, если округлить молекулярный вес водорода до 2:
М = 2 D
Вычисляя, например, по этой формуле молекулярный вес углекислого газа, плотность которого по водороду, как указано выше, равняется 22, находим:
М = 2 22 = 44
Нередко также вычисляют молекулярный вес газа, исходя из его плотности по воздуху. Хотя воздух представляет собой смесь нескольких газов, все же мы можем говорить о среднем молекулярномвесе воздуха, определяемом из плотности воздуха по водороду. Найденный таким путем молекулярный вес воздуха равен 29.
Обозначив плотность исследуемого газа по воздуху через D 1 получим следующую формулу для вычисления молекулярных весов:
М = 29 D 1
Число 29 полезно запомнить, так как его часто применяют при расчетах.
Практически определение молекулярного веса сводится к измерению веса и объема некоторого количества исследуемого газа и последующему вычислению его плотности, после чего молекулярный вес находят прямопо формуле. Плотность газа может быть вычислена по отношению к любому другому газу, молекулярный вес которого и вес единицы объема известны. Но так как в справочниках указываются веса газов при нормальных условиях, а на опыте обычно приходится измерять вес и объем исследуемого газа при других условиях, то для вычисления плотности газа нужно предварительно привести измеренный объем газа к нормальным условиям (0° и 760 мм давления).
Приведение к нормальным условиям производится на основании уравнения, объединяющего газовые законы Бойля-Мариотта и Геи-Люссака:

где р и υ - соответственно давление и объем газа в условиях опыта; Р 0 — нормальное давление; υ 0 - объем газа при нормальных условиях; Т - абсолютная температура газа.
