Thông tin chung Axit cacbonić axit dibasic yếu. TRONG dạng tinh khiết không được làm nổi bật. Được hình thành với số lượng nhỏ khi giải thể khí cacbonic trong nước, bao gồm cả carbon dioxide từ không khí. Tạo thành một số dẫn xuất vô cơ và hữu cơ ổn định: muối (cacbonat và bicarbonat), este, amit, v.v.



Sự phân hủy Khi nhiệt độ của dung dịch tăng và/hoặc áp suất riêng phần của carbon dioxide giảm, trạng thái cân bằng trong hệ thống sẽ dịch chuyển sang trái, dẫn đến sự phân hủy một phần axit carbonic thành nước và carbon dioxide. Khi dung dịch sôi, axit cacbonic phân hủy hoàn toàn:

Chuẩn bị Axit cacbonic được hình thành khi hòa tan cacbonic trong nước. Hàm lượng axit cacbonic trong dung dịch tăng khi nhiệt độ dung dịch giảm và áp suất cacbon dioxit tăng. Axit cacbonic cũng được hình thành do sự tương tác của muối của nó (cacbonat và bicarbonat) với một axit mạnh hơn. Trong trường hợp này, hầu hết axit cacbonic hình thành, theo quy luật, sẽ phân hủy thành nước và carbon dioxide

Ứng dụng Axit cacbonic luôn có mặt trong dung dịch nước chứa cacbon dioxit (nước có ga). Hóa sinh sử dụng tính chất của hệ cân bằng để thay đổi áp suất khí tỷ lệ với sự thay đổi hàm lượng ion oxonium (độ axit) ở nhiệt độ không đổi. Điều này cho phép bạn ghi lại tiến trình trong thời gian thực phản ứng enzyme, xảy ra khi pH của dung dịch thay đổi

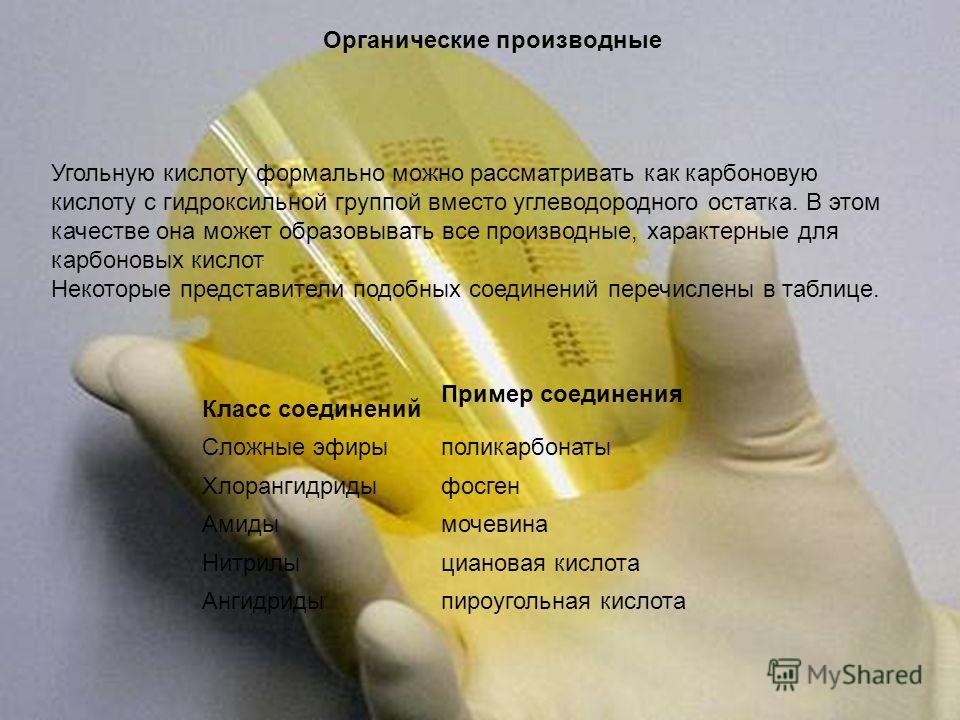
Các dẫn xuất hữu cơ Axit cacbonic có thể được coi chính thức là axit cacboxylic có nhóm hydroxyl thay vì gốc hydrocarbon. Với khả năng này, nó có thể hình thành tất cả các đặc tính phái sinh của axit cacboxylic. Một số đại diện của các hợp chất như vậy được liệt kê trong bảng. Loại hợp chất Ví dụ về hợp chất Este polycarbonat Axit clorua Phosgene amit Urê Axit nitrilycyanoic Anhydrit Axit pyrocarbonic
Carbon dioxide trong bầu khí quyển Trái đất, tính đến năm 2011, được thể hiện ở lượng 392 ppm hoặc 0,0392%. Vai trò của carbon dioxide (CO2, carbon dioxide hoặc carbon dioxide) trong đời sống của sinh quyển chủ yếu là hỗ trợ quá trình trao đổi chất. quang hợp, được thực hiện bởi thực vật. Là một loại khí nhà kính, carbon dioxide trong không khí ảnh hưởng đến sự trao đổi nhiệt của hành tinh với không gian xung quanh, ngăn chặn hiệu quả nhiệt tái bức xạ ở một số tần số và do đó tham gia vào việc hình thành khí hậu của hành tinh.
Bởi vì sử dụng tích cực Nhân loại sử dụng nhiên liệu hóa thạch làm nhiên liệu, khiến nồng độ của loại khí này trong khí quyển tăng lên nhanh chóng. Lần đầu tiên ảnh hưởng nhân tạo về nồng độ carbon dioxide đã được ghi nhận từ giữa thế kỷ 19. Kể từ thời điểm đó, tốc độ tăng trưởng của nó ngày càng tăng và vào cuối những năm 2000, nó đạt tốc độ 2,20 ± 0,01 ppm/năm hay 1,7% mỗi năm. Theo nghiên cứu cá nhân, trình độ hiện đại CO2 trong khí quyển ở mức cao nhất trong 800 nghìn năm qua và có thể trong 20 triệu năm qua.
Vai trò trong hiệu ứng nhà kính
Điều khiến carbon dioxide khác biệt với các loại khí khác như một loại khí nhà kính là tác động lâu dài của nó đối với khí hậu, phần lớn không thay đổi trong suốt một nghìn năm sau khi quá trình phát thải gây ra nó chấm dứt. Khác khí nhà kính các oxit, chẳng hạn như metan và oxit nitric, tồn tại ở trạng thái tự do trong khí quyển trong thời gian ngắn hơn.
Mặc dù nồng độ CO2 trong không khí tương đối thấp nhưng CO2 vẫn một thành phần quan trọng bầu khí quyển của trái đất, khi nó hấp thụ và tái bức xạ bức xạ hồng ngoạiở nhiều bước sóng khác nhau, bao gồm bước sóng 4,26 μm (chế độ rung - sự kéo giãn không đối xứng của phân tử) và 14,99 μm (dao động uốn cong). Quá trình này loại bỏ hoặc làm giảm bức xạ từ Trái đất vào không gian ở những bước sóng này, dẫn đến hiệu ứng nhà kính.
Sự thay đổi hiện nay về nồng độ CO2 trong khí quyển được phản ánh trong các dải hấp thụ nơi nó ảnh hưởng hiện đại trên phổ tái phát xạ của Trái đất dẫn đến sự hấp thụ chỉ một phần.
Ngoài các đặc tính nhà kính của carbon dioxide, điều quan trọng là nó còn có nhiều tác dụng hơn nữa. khí nặng so với không khí. Vì khối lượng mol tương đối trung bình của không khí là 28,98 g/mol và khối lượng mol của CO2 là 44,01 g/mol, nên sự gia tăng tỷ lệ carbon dioxide dẫn đến tăng mật độ không khí và do đó, dẫn đến thay đổi thành phần của nó. hồ sơ áp lực tùy thuộc vào độ cao. Có hiệu lực bản chất vật lý hiệu ứng nhà kính, sự thay đổi tính chất của khí quyển như vậy dẫn đến sự gia tăng nhiệt độ trung bình trên bề mặt.
Nguồn chính của hiệu ứng nhà kính trong bầu khí quyển Trái đất là nước ở dạng khí hoặc độ ẩm không khí khi không có. khí nhà kính trong khí quyển và giá trị của hằng số mặt trời bằng 1368 W m2, nhiệt độ trung bình trên bề mặt phải là -15°C. Trên thực tế, nhiệt độ trung bình của bề mặt Trái đất là +15°C, tức là hiệu ứng nhà kính dẫn đến tăng 30°C, trong đó 20,6°C được giải thích là do có hơi nước trong không khí, sự hiện diện của carbon dioxide trong nó được coi là nguyên nhân làm tăng nhiệt độ thêm 7,2°C. Vì khi tỷ lệ khí này trong khí quyển tăng lên, khối lượng mol lớn hơn của nó dẫn đến sự gia tăng mật độ và áp suất, do đó ở mức tối đa. Cùng một nhiệt độ, nồng độ CO2 tăng dẫn đến khả năng giữ ẩm của không khí tăng và làm tăng hiệu ứng nhà kính do có nhiều nước trong khí quyển. Tăng tỷ lệ nước trong không khí để đạt được cùng độ ẩm tương đối - do nhiệt độ thấp khối lượng mol nước (18 g mol) - làm giảm mật độ không khí, bù đắp cho sự gia tăng mật độ do sự hiện diện cấp độ cao hơn carbon dioxide trong khí quyển.
Sự kết hợp các yếu tố được liệt kê Nhìn chung, sự gia tăng nồng độ từ mức tiền công nghiệp là 280 ppm đến mức hiện đại là 392 ppm tương đương với việc tăng thêm 1,8 W mỗi năm. mét vuông bề mặt của hành tinh.
Nguồn carbon dioxide
Các nguồn carbon dioxide tự nhiên trong khí quyển bao gồm các vụ phun trào núi lửa, đốt cháy chất hữu cơ trong không khí và hơi thở của các đại diện của thế giới động vật (sinh vật hiếu khí). Carbon dioxide cũng được tạo ra bởi một số vi sinh vật do quá trình lên men, hô hấp tế bào và trong quá trình phân hủy các chất hữu cơ còn sót lại trong không khí. ĐẾN nguồn nhân tạo Khí thải CO2 vào khí quyển bao gồm: đốt các nguồn năng lượng hóa thạch và phi hóa thạch để tạo ra nhiệt, sản xuất điện và vận chuyển người và hàng hóa. Một số hoạt động công nghiệp như sản xuất xi măng và đốt khí đốt gây ra lượng khí thải CO2 đáng kể.
Thực vật chuyển đổi carbon dioxide thu được thành carbohydrate thông qua quá trình quang hợp, được thực hiện thông qua sắc tố diệp lục sử dụng năng lượng bức xạ mặt trời. Khí thu được, oxy, được giải phóng vào bầu khí quyển Trái đất và được sử dụng để hô hấp bởi các sinh vật dị dưỡng và các thực vật khác, do đó hình thành chu trình carbon.
Nguồn tự nhiên
Hầu hết các nguồn phát thải CO2 là tự nhiên. Các vật liệu hữu cơ mục nát như cây và cỏ chết sẽ thải ra 220 tỷ tấn carbon dioxide mỗi năm. các đại dương trên trái đất thải ra 330 tỷ đô la. Các vụ cháy rừng và than bùn ở Indonesia năm 1997 đã thải ra 13–40% lượng khí thải CO2 trung bình hàng năm từ quá trình đốt nhiên liệu hóa thạch, mặc dù kết quả là carbon dioxide ban đầu được đưa vào bầu khí quyển của Trái đất non trẻ. hoạt động núi lửa, các núi lửa hiện đại thải ra trung bình 130–230 triệu tấn CO2 mỗi năm, ít hơn 1% lượng khí thải do con người tạo ra.
Trong điều kiện bình thường, các nguồn tự nhiên này cân bằng với các quá trình vật lý và sinh học loại bỏ carbon dioxide khỏi khí quyển - một phần CO2 hòa tan trong nước biển và một số được loại bỏ khỏi không khí thông qua quá trình quang hợp. Vì thường trong thời gian quá trình này 5,5 10×11 độ carbon dioxide được hấp thụ, và nó tổng khối lượng V. bầu khí quyển trái đất là 3,03 1012 tấn, thì trung bình toàn bộ CO2 trong khí quyển tham gia vào chu trình carbon cứ sáu năm một lần. Do sự hiện diện của khí thải do con người tạo ra, sự hấp thụ CO2 của sinh quyển đã vượt quá lượng phát thải của nó là 17 tỷ tấn vào giữa những năm 2000. tốc độ hấp thụ của nó có xu hướng ổn định tăng khi nồng độ khí quyển tăng.
Khí thải nhân tạo
Với sự sắp tới cuộc cách mạng công nghiệp Vào giữa thế kỷ 19, lượng phát thải carbon dioxide do con người gây ra vào khí quyển đã tăng dần, dẫn đến sự mất cân bằng trong chu trình carbon và tăng nồng độ CO2. Hiện nay, khoảng 57% lượng khí carbon dioxide do con người tạo ra đã được thực vật và đại dương loại bỏ khỏi khí quyển. Tỷ lệ giữa lượng CO2 trong khí quyển tăng lên so với tổng lượng CO2 thải ra là. giá trị không đổi khoảng 45% và trải qua những biến động và biến động trong thời gian ngắn với thời gian 5 năm.
Việc đốt các nhiên liệu hóa thạch như than, dầu và khí tự nhiên, là nguyên nhân chính gây ra lượng khí thải CO2 do con người tạo ra, trong đó nạn phá rừng là nguyên nhân hàng đầu thứ hai. Năm 2008, việc đốt nhiên liệu hóa thạch đã thải ra 8,67 tỷ tấn carbon (31,8 tỷ tấn CO2) vào khí quyển, tăng từ mức 6,14 tỷ tấn khí thải carbon hàng năm vào năm 1990. Việc phá rừng để sử dụng làm đất đã làm tăng lượng khí carbon dioxide trong khí quyển tương đương với việc đốt 1,2 tỷ tấn than vào năm 2008 (1,64 tỷ tấn vào năm 1990). Mức tăng tích lũy trong 18 năm là 3% chu kỳ CO2 tự nhiên hàng năm, đủ lớn. để loại bỏ các hệ thống ra khỏi trạng thái cân bằng và làm tăng nhanh nồng độ CO2. Kết quả là, carbon dioxide dần dần tích tụ trong khí quyển và vào năm 2009, nồng độ của nó cao hơn 39% so với giá trị thời tiền công nghiệp.
Do đó, mặc dù thực tế là (tính đến năm 2011) tổng lượng phát thải CO2 do con người tạo ra không vượt quá 8% chu kỳ tự nhiên hàng năm của nó, nhưng vẫn có sự gia tăng nồng độ không chỉ do mức độ phát thải do con người tạo ra mà còn do tăng trưởng liên tục mức phát thải theo thời gian.
Thay đổi nhiệt độ và chu trình cacbon
Các yếu tố khác làm tăng hàm lượng CO2 trong khí quyển bao gồm sự gia tăng nhiệt độ trung bình trong thế kỷ 20, điều này lẽ ra được phản ánh qua sự gia tăng phân hủy các chất cặn bã hữu cơ và do sự nóng lên của đại dương, làm giảm tổng lượng CO2. lượng khí cacbonic hòa tan trong nước. Sự gia tăng nhiệt độ cũng là do nhiệt độ tăng cao đặc biệt hoạt động mặt trời trong thời kỳ này và trong thế kỷ 19 (ví dụ, xem Sự kiện Carrington, 1859).
Trong quá trình chuyển đổi từ khí hậu lạnh sang khí hậu ấm áp trong một triệu năm qua, sự thay đổi tự nhiên về nồng độ CO2 trong khí quyển vẫn nằm trong khoảng 100 ppm, nghĩa là tổng mức tăng chưa đến 40%. Hơn nữa, ví dụ, nhiệt độ trung bình của hành tinh trong thời kỳ khí hậu tối ưu là 9000-5000 năm trước Công nguyên. cao hơn ngày nay khoảng 1 - 2 °C, và do hiệu ứng nhà kính rõ rệt hơn ở vùng khí hậu ấm áp, sự bất thường về nhiệt độ trung bình hàng năm ở các vĩ độ cận Bắc Cực đạt tới 9 °C.
Cacbon monoxit (IV), axit cacbonic và muối của nó
D cacbon monoxit CO 2 (cacbon dioxit) - tại điều kiện bình thường là chất khí không màu, không mùi, vị hơi chua, nặng hơn không khí khoảng 1,5 lần, tan trong nước, hóa lỏng khá dễ (ở nhiệt độ phòng dưới áp suất khoảng 60 ∙ 10 5 Pa nó có thể chuyển thành chất lỏng). Khi được làm lạnh đến −56,2°С, carbon dioxide lỏng đông đặc lại và biến thành khối giống như tuyết.
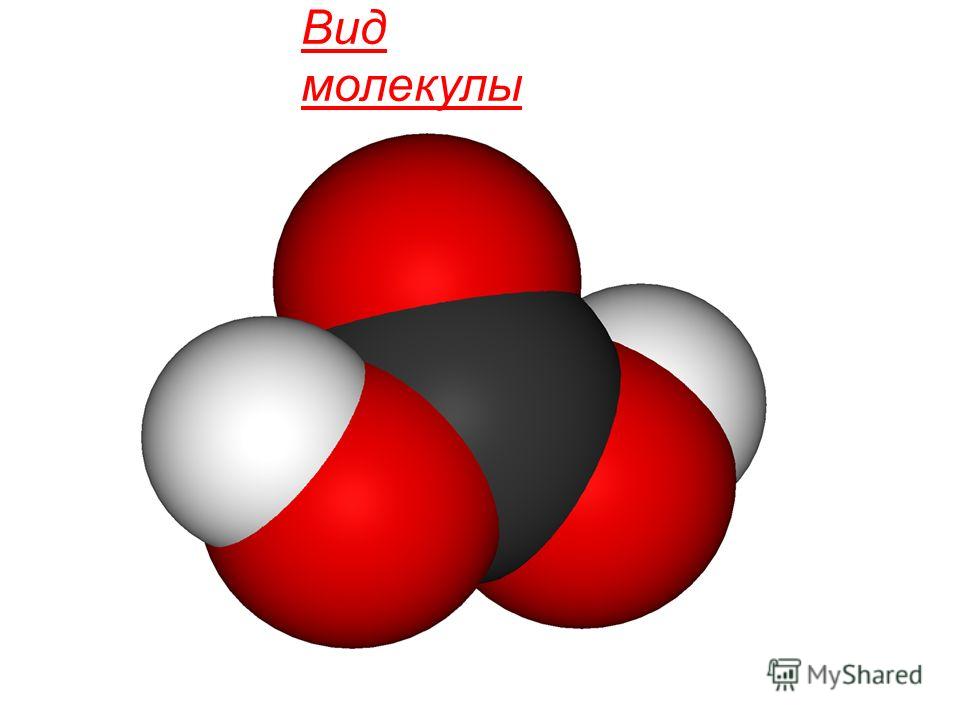
Trong tất cả trạng thái tập hợp bao gồm các phân tử tuyến tính không phân cực. Cấu trúc hóa học Phân tử CO 2 được xác định bằng quá trình lai hóa sp của nguyên tử cacbon trung tâm và hình thành thêm π kết nối r-r: O = C = O.
Một số CO2 hòa tan trong đó sẽ tương tác với nó tạo thành axit cacbonic:
CO 2 + H 2 O ↔ CO 2 ∙ H 2 O ↔ H 2 CO 3.
Carbon dioxide rất dễ bị hấp thụ bởi dung dịch kiềm để tạo thành cacbonat và bicarbonate:
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O; CO2 + NaOH = NaHCO3.
Các phân tử CO 2 rất ổn định về nhiệt; quá trình phân hủy chỉ bắt đầu ở nhiệt độ 2000°C. Vì lý do này, carbon dioxide không cháy và không hỗ trợ quá trình đốt cháy nhiên liệu thông thường. Nhưng trong bầu khí quyển của nó một số đang cháy chất đơn giản, các nguyên tử của chúng thể hiện ái lực cao với oxy, ví dụ, magie, khi đun nóng, sẽ bốc cháy trong khí quyển CO 2.
Axit cacbonic H 2 CO 3 là hợp chất yếu và chỉ tồn tại trong dung dịch nước. Hầu hết Carbon dioxide hòa tan trong nước ở dạng phân tử CO 2 ngậm nước, phân tử nhỏ hơn tạo thành axit carbonic.
Dung dịch nước cân bằng với CO2 trong khí quyển có tính axit: = 0,04 M và pH ≈ 4.
Axit cacbonic là chất lưỡng tính và thuộc nhóm chất điện ly yếu, phân ly từng bước (K 1 = 4, 4 ∙ 10 −7; K 2 = 4, 8 ∙ 10 −11). Khi CO 2 hòa tan trong nước, trạng thái cân bằng động sau đây được thiết lập:
H 2 O + CO 2 ↔ CO 2 ∙ H 2 O ↔ H 2 CO 3 ↔ H + + HCO 3 −
Khi đun nóng dung dịch nước carbon dioxide, độ hòa tan của khí giảm, CO 2 thoát ra khỏi dung dịch và trạng thái cân bằng dịch chuyển sang trái.
Là dibasic, axit cacbonic tạo thành hai loại muối: muối trung bình (cacbonat) và muối axit (bicarbonat). Hầu hết các muối axit cacbonic đều không màu. Trong số cacbonat, chỉ có muối hòa tan trong nước. kim loại kiềm và amoni.
Trong nước, cacbonat bị thủy phân nên dung dịch của chúng có phản ứng kiềm:
Na 2 CO 3 + H 2 O ↔ NaHCO 3 + NaOH.
Quá trình thủy phân tiếp theo với sự hình thành axit cacbonic thực tế không xảy ra trong điều kiện bình thường.
Sự hòa tan hydrocarbonat trong nước cũng đi kèm với quá trình thủy phân, nhưng ở mức độ thấp hơn nhiều và tạo ra môi trường có tính kiềm nhẹ (pH ≈ 8).
Amoni cacbonat (NH 4) 2 CO 3 rất dễ bay hơi ở nhiệt độ cao và thậm chí ở nhiệt độ bình thường, đặc biệt khi có hơi nước, gây ra sự thủy phân nghiêm trọng.
Axit mạnh và thậm chí axit axetic yếu đẩy axit cacbonic ra khỏi cacbonat:
K 2 CO 3 + H 2 SO 4 = K 2 SO 4 + H 2 O + CO 2.
Không giống như hầu hết cacbonat, tất cả bicarbonat đều hòa tan trong nước. Οʜᴎ kém ổn định hơn cacbonat của cùng kim loại và khi đun nóng, dễ bị phân hủy, biến thành cacbonat tương ứng:
2KHCO 3 = K 2 CO 3 + H 2 O + CO 2;
Ca(HCO 3) 2 = CaCO 3 + H 2 O + CO 2.
Axit mạnh hydrocarbonat bị phân hủy như cacbonat:
KHCO 3 + H 2 SO 4 = KHSO 4 + H 2 O + CO 2
Từ muối của axit cacbonic giá trị cao nhất có natri cacbonat (soda), kali cacbonat (kali), canxi cacbonat (phấn, đá cẩm thạch, đá vôi), natri bicarbonate (baking soda) và đồng cacbonat cơ bản (CuOH) 2 CO 3 (malachit).
Muối bazơ của axit cacbonic thực tế không tan trong nước và dễ bị phân hủy khi đun nóng:
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O.
Độ ổn định nhiệt của cacbonat phụ thuộc vào tính chất phân cực của các ion tạo nên cacbonat. Càng có nhiều cation phân cực trên ion cacbonat thì nhiệt độ phân hủy của muối càng thấp. Nếu cation dễ bị biến dạng thì bản thân ion cacbonat cũng sẽ có tác dụng phân cực đối với cation, dẫn đến nhiệt độ phân hủy của muối giảm mạnh.
Natri và kali cacbonat tan chảy mà không bị phân hủy và hầu hết các cacbonat khác khi đun nóng sẽ phân hủy thành oxit kim loại và carbon dioxide:
MgCO3 = MgO + CO2.
cacbon monoxit
Phân tử CO có cấu trúc như sau
: VỚI ≡ VỀ :
Hai liên kết được hình thành do sự ghép cặp của các electron 2p của nguyên tử carbon và oxy, liên kết thứ ba được hình thành theo cơ chế cho-chấp do quỹ đạo 2p tự do của carbon và cặp electron 2p của nguyên tử oxy. Momen lưỡng cực của phân tử không đáng kể, trong khi điện tích hiệu dụng trên nguyên tử cacbon là âm và trên nguyên tử oxy là điện tích dương.
Vì cấu trúc của phân tử CO giống với cấu trúc của phân tử nitơ nên chúng giống nhau tính chất vật lý. CO có rất nhiệt độ thấp nóng chảy (- 204°С) và sôi (- 191,5°С), nó không màu, rất khí độc, không mùi, nhẹ hơn không khí một chút. Nó hòa tan kém trong nước và không tương tác với nó.
CO được coi là oxit không tạo muối vì trong điều kiện bình thường nó không tương tác với axit hoặc kiềm. Nó được hình thành trong quá trình đốt cháy than và các hợp chất cacbon có khả năng tiếp cận oxy hạn chế, cũng như trong quá trình tương tác của carbon dioxide với than nóng: CO 2 + C = 2CO.
Trong phòng thí nghiệm, nó thu được từ axit formic bằng tác dụng của axit sulfuric đậm đặc với nó khi đun nóng:
HCOOH + H 2 SO 4 (kết luận) = CO + H 2 SO 4 ∙ H 2 O.
Bạn cũng có thể sử dụng axit oxalic. Axit sunfuric trong những phản ứng này, nó hoạt động như một chất loại bỏ nước.
Trong điều kiện bình thường, CO khá trơ về mặt hóa học, nhưng khi đun nóng nó thể hiện đặc tính phục hồi, được sử dụng rộng rãi trong luyện kim để thu được một số kim loại nhất định: Fe 2 O 3 + 3CO = 2Fe + 3CO 2.
Trong không khí, CO cháy với ngọn lửa xanh, giải phóng số lượng lớn nhiệt lượng: 2CO + O 2 = 2CO 2 + 569 kJ.
Ngoài oxy trên đường dây Ánh sáng mặt trời hoặc khi có mặt chất xúc tác (than hoạt tính), CO kết hợp với clo tạo thành phosgene:
CO + Cl 2 = COCl 2.
Phosgene là chất khí không màu, có mùi đặc trưng. Nó ít tan trong nước, nhưng ở dạng axit cacbonic clorua, nó bị thủy phân dần dần theo sơ đồ sau: COCl 2 + 2H 2 O = 2HCl + H 2 CO 3. Do độc tính cao, phosgene lần đầu tiên được sử dụng làm tác nhân chiến tranh hóa học. chiến tranh thế giới. Nó có thể được trung hòa bằng cách sử dụng vôi tôi.
Khi đun nóng, CO bị oxy hóa bởi lưu huỳnh: CO + S = COS.
Phân tử CO có thể hoạt động như một phối tử trong nhiều hợp chất phức tạp khác nhau. Do cặp electron carbon không liên kết, nó thể hiện tính chất σ-cho, và do các quỹ đạo phản liên kết π tự do, nó thể hiện tính chất chấp nhận π. Sở thích đặc biệtđại diện cho các phức cacbonyl của d-kim loại, bởi vì phân hủy nhiệt Carbonyl tạo ra kim loại có độ tinh khiết cao.
Axit cacbonic (công thức H2CO3) là axit hai bazơ yếu. Khi đun nóng dung dịch, nó phân hủy thành nước. Axit này có tầm quan trọng lớn không chỉ đối với động vật mà còn đối với thực vật. Trong cơ thể con người, H2CO3 cũng như muối của nó là một phần của máu. Sử dụng được hỗ trợ cân bằng axit-bazơ trong cơ thể, cần thiết cho cuộc sống bình thường. Sự phân ly của axit trong môi trường nước dẫn đến sự hình thành các anion và cation. Nồng độ ion có tầm quan trọng lớn đối với dòng chảy của nhiều quá trình sinh hóa trong cơ thể động vật và thực vật. Đối với một số bệnh phản ứng tích cực máu chuyển sang tính axit (với vết loét tá tràng và dạ dày) hoặc bên kiềm (đối với nhiễm trùng huyết, viêm phổi). Với tình trạng nhiễm toan, nồng độ của các ion hydro tăng lên. Những thay đổi đó lại kích thích sự phát triển của kết quả cuối cùng dẫn đến cái chết của chính con vật. Khi bị nhiễm kiềm, nồng độ cation trong máu tăng lên, dẫn đến uốn ván và tử vong ở động vật.
Axit cacbonic được hình thành trong quá trình phản ứng của CO2 với H2O. Hầu hết các nhà nghiên cứu tin rằng sự phát triển đáng kinh ngạc của thảm thực vật trong thế giới nguyên thủy có liên quan đến nồng độ axit cacbonic đáng kể trong khí quyển. Sự tăng trưởng mạnh mẽ nhất được quan sát thấy ở những cây được trồng với nồng độ axit cacbonic cao (5-10%) trong khí quyển.
Cần lưu ý rằng thực vật có một nửa carbon. Axit cacbonic nuôi dưỡng cây trồng, đồng thời thúc đẩy khả năng hòa tan của các thành phần khoáng chất trong đất. Vì thế ở trong trường hợp này Cái này thành phần cần thiếtđất. Vì axit cacbonic ức chế vi sinh vật nitrat hóa nên đất phải chứa nồng độ tối thiểu của nó.
Vì vậy, để thu được năng suất cao cần phải cân bằng nồng độ của axit này. Các nhà khoa học đã chứng minh trong các thí nghiệm của họ rằng với việc đưa axit carbonic (400 cm3) và không khí (1200 cm3) hàng ngày vào đất, nó sẽ tạo ra số lượng thực vật nhiều gấp đôi so với đất không chứa các hợp chất này.
Đất nông thôn có đặc điểm là có lượng không khí dồi dào nên quá trình nitrat hóa và phân hủy diễn ra rất mạnh mẽ. Người ta đã xác định rằng lá trong rừng sẽ phân hủy hoàn toàn trong vòng một năm. Quá trình nitrat hóa mạnh mẽ như vậy cũng xảy ra ở thảo nguyên. Trong quá trình phân hủy, một lượng đáng kể axit cacbonic được giải phóng. Loại thứ hai nặng hơn không khí gấp rưỡi, do đó axit cacbonic thấm sâu vào đất hơn không khí và có tác dụng ở đó. ảnh hưởng có lợi về thành phần khoáng sản.
Khi cày sâu, dư lượng hữu cơ sẽ rơi xuống các lớp đất sâu hơn, nơi không có O2 nhưng có rất nhiều axit cacbonic. Trong trường hợp này, quá trình nitrat hóa diễn ra cực kỳ chậm. Trong những điều kiện này, các thành phần khoáng chất không bị phân hủy và các hợp chất nitơ không được hình thành. Những khối phân khổng lồ nằm dưới đất nhiều năm mà không mục nát. Chủ đất buộc phải mua phân bón tổng hợp (kainite, supe lân, Công nghệ tiên tiến làm đất có thể làm tăng năng suất cây trồng. Điều này chủ yếu là do dư lượng hữu cơ vẫn còn trong quá trình canh tác. Đang được tạo điều kiện tối ưu cho sự phát triển và sinh sản của vi sinh vật nitrat hóa.
Phốt pho có trong đất không phải lúc nào cũng được thực vật hấp thụ. Canxi photphat bazơ là một hợp chất ít hòa tan. Vì vậy, đất giàu hợp chất axit photphoric trở nên bạc màu.
