MOLEKÜLER AĞIRLIK(sin. moleküler ağırlık) - atom kütlesinin karbon birimleriyle ifade edilen bir maddenin bir molekülünün kütlesi (atom kütlesinin bir karbon birimi, karbon izotopu 12 C'nin bir atomunun kütlesinin 1/12'sidir); atom kütleleriyle birlikte kimya kullanılarak yapılan her türlü hesaplamanın temelini oluşturur. Biyokimyada yapılan hesaplamalar da dahil olmak üzere formüller ve denklemler. ve klinik teşhis laboratuvarları.
Eğer kimya. bir maddenin formülü, o zaman M. v. kimyasal atomların atom ağırlıklarının (kütle) toplamı olarak hesaplanabilir. molekülü oluşturan elementler (atom ağırlığına bakın) bu maddenin. Örneğin, M.v. karbondioksit(CO2) şuna eşittir:
12,011 + 2 * 15,9994 = 44,0098.
Gaz halindeki veya çözünmüş haldeki maddeler için, deneysel yöntemler M. yüzyılın tanımları. en haklısı. M.v. Bir gazın (M1) değeri genellikle ölçülmesiyle belirlenir. bağıl yoğunluk Gaz için D, M.v. (M2) biliniyor; o zaman M1 = M2*D. M.v. gaz ayrıca normal yoğunluğu d biliniyorsa belirlenebilir, yani 760 mm Hg basınçta 1 litre gazın gram cinsinden kütlesi. Sanat. ve 0 °C. Bu durumda M.v. gaz M = 22,42*d'ye eşittir.
M. yüzyılı belirlemek. Bu maddenin ayrışmaya veya birleşmeye maruz kalmadığı böyle bir çözücü içindeki çözünmüş madde, çözünme sırasında gözlenen çözeltinin donma noktasındaki Δt (bkz. Kriyometri) azalma çoğunlukla ölçülür. A g test maddesi B g solvent: M = (K*a*1000)/(Δt*b), burada K, solventin kriyometrik (kriyoskopik) sabitidir.
M.v. çözünmüş madde, çözeltinin ozmotik basıncı ölçülerek de belirlenebilir (bkz. Ozmotik basınç). Bu durumda, M = (m*R*T)/p, burada m, 1 litre çözelti içinde bulunan çözünmüş maddenin gram cinsinden kütlesidir, p, atm cinsinden ozmotik basınçtır, T, Kelvin derece cinsinden sıcaklıktır ve R, 1*atm/mol*derece cinsinden gaz sıcaklığı sabitidir. Bu yöntem M. yüzyılın belirlenmesinde başarıyla kullanılmaktadır. proteinler, polisakaritler, nükleik ve diğer yüksek moleküler bileşikler (bkz.). M.v. proteinler ve diğer biyopolimerler ultrasantrifüjleme yoluyla belirlenebilir (bkz.).
Uygulamada biyokimya, kama ve sıhhi hijyen. gerçekleştirilecek laboratuvarlar çeşitli türler Hesaplamalarda, mol adı verilen bir maddenin miktar birimi de yaygın olarak kullanılmaktadır.
Bir mol, çok sayıda molekül, atom, iyon, elektron veya diğerlerini içeren bir madde miktarıdır. yapısal birimler, 12 g karbon izotopu 12 C'de kaç atom bulunur. Avogadro sayısı adı verilen herhangi bir maddenin bir molünde bulunan molekül, atom veya diğer yapısal birimlerin sayısı büyük bir doğrulukla belirlenir. Pratik hesaplamalar için şuna eşit alınır:
6,023*10 23 mol -1.
Bir maddenin bir molünün gram olarak ifade edilen kütlesi sayısal olarak M.v'ye eşittir. maddeye molar kütle veya gram molekül denir.
Kaynakça: Belki, ed. G. Neurath ve C. Bailey, çev. İngilizceden, cilt 2, s. 276, M., 195 6: Gaurowitz F. Proteinlerin kimyası ve işlevi, çev. İngilizce'den, M., 1965; Ostwald-Luther - Drucker, Fizikokimyasal ölçümler, çev. Almanca ile, bölüm 1, €. 294, L., 1935.
Bir ağırlığın yedi plastik topa önemli ölçüde ağır bastığını görüyoruz. Terazilerle ilgili deneyimler bize cevabı veriyor - demir ağırlıkta daha fazla madde var, eğer kütleleri karşılaştırırsak - demir ve plastiğin eylemsizlik ölçümleri.
Peki ya kütleleri değil de topların ve ağırlıkların yapımında kullanılan madde miktarını, aslında onları oluşturan parçacıkların sayısını karşılaştırırsak? Topları ve ağırlığı elimize aldığımızda, bu topların arka planında ağırlığın aslında kaybolduğunu göreceğiz. Demir ve plastiğin içerdiği parçacıkların sayısını sayabilseydik, demir atomlarının sayısının önemli ölçüde olacağını görürdük. daha az miktar tüm plastik toplardaki moleküller. Bu, plastikte daha fazla madde olduğu anlamına gelir.
Her iki cevap da doğrudur.
Mesele şu ki, ilk durumda kütleyi, yani cisimlerin eylemsizliğinin bir ölçüsünü, ikinci durumda ise molekül sayısını, madde miktarını karşılaştırdık.
Ölçü kabındaki şekerle basit bir benzetme yapabiliriz. Ne kadar şeker vardır sorusu bardağın bölmesine bakılarak yaklaşık olarak kaç gram şeker bulunduğunun söylenmesiyle cevaplanabilir. Bardaktaki her bir taneciği sayabilir ve bardağın kaç tanesini içerdiğini cevaplayabilirsiniz. Hem birinci hem de ikinci cevap doğru olacaktır. Moleküllerin kütlesinden bahsetmek ne zaman daha uygundur ve maddenin miktarından bahsetmek ne zaman daha uygundur? Dersin konusu da tam olarak bu: “Moleküllerin kütlesi, Madde miktarı.”
19. yüzyılda İtalyan bilim adamı Avogadro kurdu. ilginç gerçek: Eğer iki farklı gaz, örneğin hidrojen ve oksijen, aynı kaplarda, aynı basınç ve sıcaklıklarda bulunuyorsa, her ne kadar gazların kütleleri çok farklı olsa da, her kapta aynı sayıda molekül olacaktır. örneğimiz - 16 kez (Şekil 2).
Pirinç. 2. Avogadro'nun deneyi ()
Bütün bunlar, bir cismin bazı özelliklerinin yalnızca kütleyle değil, tam olarak molekül sayısıyla belirlendiği anlamına gelir.
“Madde miktarı” teriminden neyi kastediyoruz? Herhangi bir madde moleküllerden, atomlardan, iyonlardan oluşur; bu, bir maddenin miktarından molekül sayısını anladığımız anlamına gelir.
Molekül sayısını belirleyen fiziksel miktar bu vücut, isminde madde miktarı. Belirlenmiş Yunan mektubu v - çıplak.
Atom kütlesi 12 olan 0,012 kg (12 gram) karbon izotopunda bulunan atom sayısı kadar parçacık (atom, molekül) içeren miktarı bir maddenin birim miktarı olarak almayı kabul ettik.
Bu birime denir mol.
Bu tanımdan, herhangi bir maddenin bir molünde aynı sayıda molekül olacağı sonucu çıkar. Herhangi bir maddenin bir molü içerir 6,02 10 23 moleküller veya parçacıklar. Bu miktara denir Avogadro sabiti.

Pirinç. 3. Toplam molekül sayısının belirlenmesi ()
Bu formül öğrenmenizi sağlar tam sayı moleküller bilinen miktar maddeler.
Molekülün kütlesi son derece küçüktür. Fizikçiler bunu kütle spektrografı adı verilen bir cihaz kullanarak belirlediler. Örneğin, bir su molekülünün kütlesinin değeri (Şekil 4):

Pirinç. 4. Bir su molekülünün kütlesinin belirlenmesi ()
Görüldüğü gibi, tıpkı bir maddenin miktarında olduğu gibi, bir molekülün kütlesini bir kütle standardı olan kilogramla karşılaştırmak pek uygun değildir. Madde miktarının olduğu durumlarda sayılar çok büyükse, moleküllerin kütlesinin olduğu durumlarda sayılar çok küçüktür. Bu nedenle, bir molekülün veya atomun kütlesinin ölçüm birimi olarak özel bir sistem dışı birim seçilmiştir. atomik kütle birimi. Kütle birimini bir standartla değil, bir maddenin molekülünün kütlesiyle karşılaştıracağız.
Bu madde doğadaki en yaygın element haline geldi - her şeyin içinde bulunan karbon. organik bileşikler. Atomik kütle birimi şuna eşittir:
1 gün önce = 1/12 karbon kütlesi - 12 (12 nükleonlu izotop)
1 gün önce = 1,66·10 -27 kg
Moleküllerin kütlesini ölçeceğimiz için atom birimleri kitleler, sonra yeni bir şeye geliyoruz fiziksel miktar- bağıl moleküler ağırlık.
Belirli bir maddenin bir molekülünün (atomunun) kütlesinin, bir karbon atomunun kütlesinin 1/12'sine oranı denir. bağıl molekül ağırlığı(veya bağıl atom kütlesi), bir maddenin atomik yapısı durumunda.
Bu tanımı ifade eden formüller:
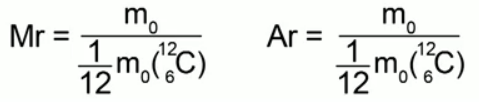
Bağıl molekül ağırlığı boyutsuz bir miktardır; hiçbir şeyle ölçülmez. Hiçbir şey bizim için uygun olduğunda atomların ve moleküllerin kütlelerini kilogram cinsinden ölçmeye devam etmemizi engelleyemez. Kimya dersinden şunu biliyoruz: Bir maddenin bağıl moleküler kütlesi, içinde bulunan elementlerin bağıl atom kütlelerinin toplamına eşittir. Örneğin su H2O için bağıl molekül ağırlığı şöyle olacaktır:
Bay = 1 2 + 16 = 18
Toplam göreceli moleküler ağırlık oksijen (16) ve iki hidrojen (2.1) 18'i verecektir
Kilogram cinsinden kütle ile mol cinsinden madde miktarı arasındaki ortak nokta nasıl bulunur? Bu miktar molar kütledir.
Molar kütle bir maddenin bir molünün kütlesidir.
Belirtilen [M], kg/mol cinsinden ölçülür.
Molar kütle, kütlenin madde miktarına oranına eşittir:
Moleküllerin çeşitli özelliklerini ilişkilendiren formüller elde ederiz.
Belirlemek için molar kütle kimyasal element hadi dönelim periyodik tablo Mendeleev'in kimyasal elementleri - basitçe alıyoruz atom kütlesi A (gerekli elementin nükleon sayısı) - bu, g/mol cinsinden ifade edilen molar kütlesi olacaktır.
Örneğin alüminyum için (Şekil 5):

Pirinç. 5. Bir maddenin molar kütlesinin belirlenmesi ( )
Alüminyumun atom kütlesi 27, molar kütlesi 0,027 kg/mol olacaktır.
Bu, karbonun molar kütlesinin tanım gereği 12 g/mol olmasıyla açıklanırken, bir karbon atomunun çekirdeği 12 nükleon (6 proton ve 6 nötron) içerirken, her nükleonun karbona 1 g/mol katkıda bulunduğu ortaya çıkar. molar kütle, dolayısıyla atom kütlesi A olan bir kimyasal elementin molar kütlesi A g/mol'e eşit olacaktır.
Molekülü birkaç atomdan oluşan bir maddenin molar kütlesi, molar kütlelerin basitçe toplanmasıyla elde edilir, örneğin (Şekil 6):

Pirinç. 6. Karbondioksitin molar kütlesi ()
Bazı gazların molar kütlelerine özellikle dikkat etmeniz gerekir. hidrojen gazı, nitrojen, oksijen - molekülleri iki atomdan oluşur - H2, N2, O2 ve helyum, genellikle problemlerde bulunur, tek atomludur ve periyodik tablo tarafından belirlenen 4 g/mol moleküler ağırlığa sahiptir (Şekil 1). 7).

Pirinç. 7. Bazı gazların molar kütleleri ()
Herhangi bir maddenin bir molü, Avogadro sayısı kadar molekül içerir; bu, Avogadro sayısını (bir moldeki molekül sayısı) bir molekülün m0 kütlesiyle çarparsak, maddenin molar kütlesini elde ettiğimiz anlamına gelir; , maddenin bir molünün kütlesi:
M = m 0 N Bir
Alanı 50 m2 olan bir sınıfta 25 öğrenci ders çalışıyorsa her öğrenci için 2 m2 vardır. 500 m2 alana sahip bir spor salonuna gittiklerinde her öğrencinin zaten 20 m2'si olacaktır. Öğrenci sayısı değişmedi ama daha az dağıldılar, bu durumda şöyle diyorlar: İnsanların konsantrasyonu azaldı. Aynı şekilde moleküler kinetik teorisinde moleküller için konsantrasyon kavramı tanıtılmıştır.
Konsantrasyon(n) bir maddenin birim hacmi başına molekül sayısıdır. Molekül sayısının hacme oranına eşittir:
Konsantrasyonu moleküllerin diğer özelliklerine bağlayan formüller:

Bu formülleri kullanarak maddeleri hem molekül sayısına hem de kütleye göre karşılaştırabiliriz.
Sonraki derslerde yapacağımız moleküler kinetik teorisini oluşturmak için ihtiyacımız olan her şeyi aldık.
Referanslar
- Tikhomirova S.A., Yavorsky B.M. Fizik ( temel seviye) - M.: Mnemosyne, 2012.
- Gendenshtein L.E., Dick Yu.I. Fizik 10. sınıf. - M.: Mnemosyne, 2014.
- Kikoin I.K., Kikoin A.K. Fizik - 9, Moskova, Eğitim, 1990.
- Lib.podelise.ru ().
- Class-fizika.spb.ru ().
- Bolshoyvopros.ru ().
Ev ödevi
- Bir maddenin miktarını tanımlayın.
- Bir molekül veya atomun kütlesinin ölçü birimini adlandırın.
- Bağıl molekül ağırlığını tanımlayın.


BİT'in temel hükümleri. Moleküllerin kütlesi ve boyutu. Madde miktarı. Moleküler fizik
MKT kolaydır!
“Atomlardan ve boşluktan başka hiçbir şey yoktur…” - Demokritos
"Herhangi bir cisim sonsuza kadar bölünebilir" - Aristoteles
Moleküler kinetik teorinin (MKT) temel prensipleri
BİT'in Amacı- bu, çeşitli makroskobik cisimlerin yapısı ve özelliklerinin ve cisimleri oluşturan parçacıkların hareketi ve etkileşimi yoluyla içlerinde meydana gelen termal olayların bir açıklamasıdır.
Makroskobik cisimler- Bu büyük bedenlerçok sayıda molekülden oluşur.
Termal olaylar- cisimlerin ısınması ve soğuması ile ilgili olaylar.
BİT'in ana beyanları
1. Madde parçacıklardan (moleküller ve atomlar) oluşur.
2. Parçacıklar arasında boşluklar var.
3. Parçacıklar rastgele ve sürekli hareket eder.
4. Parçacıklar birbirleriyle etkileşime girer (çeker ve iter).
MKT onayı:
1. deneysel
- bir maddenin mekanik olarak ezilmesi; bir maddenin suda çözülmesi; gazların sıkıştırılması ve genleştirilmesi; buharlaşma; cisimlerin deformasyonu; difüzyon; Brigman'ın deneyi: yağ bir kaba dökülür, 10.000 atm basınçta bir piston yağın üstüne bastırılır, yağ çelik kabın duvarlarından sızmaya başlar;
Difüzyon; Moleküllerin etkisi altında bir sıvı içindeki parçacıkların Brownian hareketi;
Katıların zayıf sıkıştırılabilirliği ve sıvı cisimler; kırmak için önemli bir çaba katılar; sıvı damlacıklarının birleştirilmesi;
2. doğrudan
- fotoğraf, parçacık boyutlarının belirlenmesi. 
Brown hareketi
Brownian hareketi, bir sıvı (veya gaz) içindeki asılı parçacıkların termal hareketidir.
Brown hareketi, madde moleküllerinin sürekli ve kaotik (termal) hareketinin kanıtı haline geldi.
- 1827'de İngiliz botanikçi R. Brown tarafından keşfedildi
- MCT'ye dayalı teorik bir açıklama 1905'te A. Einstein tarafından yapılmıştır.
- Fransız fizikçi J. Perrin tarafından deneysel olarak doğrulandı.
Moleküllerin kütlesi ve boyutu
Parçacık boyutları
Herhangi bir atomun çapı yaklaşık cm'dir.

Bir maddedeki molekül sayısı
burada V maddenin hacmidir, Vo bir molekülün hacmidir
Bir molekülün kütlesi
burada m maddenin kütlesidir,
N - bir maddedeki molekül sayısı
SI kütle birimi: [m]= 1 kg
İÇİNDE atom fiziği kütle genellikle atomik kütle birimleri (amu) cinsinden ölçülür.
Geleneksel olarak 1 amu olarak kabul edilir. :
Maddenin bağıl moleküler ağırlığı
Hesaplamaların kolaylığı için, maddenin bağıl moleküler kütlesi olan bir miktar eklenir.
Herhangi bir maddenin bir molekülünün kütlesi, bir karbon molekülünün kütlesinin 1/12'si ile karşılaştırılabilir.
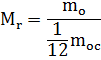
burada pay molekülün kütlesidir ve payda karbon atomunun kütlesinin 1/12'sidir
Bu boyutsuz bir miktardır, yani. ölçü birimi yoktur
Bir kimyasal elementin bağıl atom kütlesi
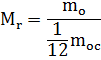
burada pay atomun kütlesidir ve payda karbon atomunun kütlesinin 1/12'sidir
Miktar boyutsuzdur, yani. ölçü birimi yoktur
Her kimyasal elementin bağıl atom kütlesi periyodik tabloda verilmiştir.
Bir maddenin bağıl moleküler kütlesini belirlemenin başka bir yolu
Bir maddenin bağıl moleküler kütlesi, maddenin molekülünü oluşturan kimyasal elementlerin bağıl atom kütlelerinin toplamına eşittir.
Periyodik tablodan herhangi bir kimyasal elementin bağıl atom kütlesini alıyoruz!)
Madde miktarı
Madde miktarı (ν), vücuttaki moleküllerin bağıl sayısını belirler.
burada N vücuttaki moleküllerin sayısıdır ve Na, Avogadro sabitidir
SI sistemindeki madde miktarının ölçü birimi: [ν]= 1 mol
1 mol- bu, 0,012 kg ağırlığındaki karbondaki atomların sayısı kadar molekül (veya atom) içeren madde miktarıdır.
Hatırlamak!
1 mol herhangi bir madde içerir aynı numara atomlar veya moleküller!
Ancak!
Aynı miktarda madde farklı maddeler farklı kitlelere sahip!
Avogadro sabiti
Herhangi bir maddenin 1 molündeki atom sayısına Avogadro sayısı veya Avogadro sabiti denir:
Molar kütle
Molar kütle (M), bir mol halinde alınan bir maddenin kütlesidir, aksi takdirde bir maddenin bir molünün kütlesidir.
Molekül kütlesi
- Avogadro sabiti
Molar kütle birimi: [M]=1 kg/mol.
Sorunları çözmek için formüller
Bu formüller yukarıdaki formüllerin yerine konulmasıyla elde edilir.
Herhangi bir miktardaki maddenin kütlesi
Gaz halindeki maddelerin moleküler ağırlıklarının belirlenmesinde en önemli yöntem Avogadro yasasına dayanmaktadır. Ancak bu yöntemden bahsetmeden önce moleküler ve hangi birimlerde olduğunu hatırlamak gerekir. atom ağırlıkları.
Atom ağırlıkları hesaplanırken başlangıçta en hafif element olan hidrojen atomunun ağırlığı bir olarak alınmış, diğer elementlerin atom ağırlıkları da buna göre hesaplanmıştır. Ancak çoğu element için atom ağırlıkları, atom ağırlıklarından belirlendiğinden oksijen bileşikleri Aslında hesaplamalar, 16'ya eşit olduğu kabul edilen oksijenin atom ağırlığına göre yapılmıştı. Oksijen ve hidrojenin atom ağırlıkları arasındaki oranın 16:1 olduğu varsayılmıştı. Daha sonra daha fazlası kesin araştırma bu oranın 15,88:1 veya 16:1,008 olduğunu gösterdi. Dolayısıyla hidrojenin atom ağırlığını 1 kabul edersek oksijenin atom ağırlığı 15,88 olacaktır. Pratik nedenlerden dolayı, hidrojenin atom ağırlığı 1,008 alınarak, oksijenin atom ağırlığının 16'da bırakılmasına karar verildi.
Dolayısıyla mevcut atom ağırlığı birimi oksijen atomunun ağırlığının 1/16'sıdır. Bu birime “oksijen ünitesi” denir. Hidrojen atomu ağırlığı1,008 oksijen birimine eşittir, bir kükürt atomunun ağırlığı 32,06 oksijen birimidir, vb.
atomik ağırlık eleman isminde ağırlık onun atom, yükseklikevli V oksijen birimler.
Herhangi bir molekülün ağırlığından beri toplamına eşit Onu oluşturan atomların ağırlıkları dikkate alındığında, moleküler ağırlıkların atom ağırlıklarıyla aynı birimlerle ifade edilmesi gerektiği açıktır. Örneğin iki atomdan oluşan bir hidrojen molekülünün ağırlığı 2.016 oksijen birimine eşittir; yine iki atomdan oluşan bir oksijen molekülünün ağırlığı 32 oksijen birimidir; iki hidrojen atomu ve bir oksijen atomu içeren bir su molekülünün ağırlığı 16 + 2.016 = 18.016 oksijen birimi vb.'dir.
Moleküler ağırlık basit veya karmaşık isimlerdeğişir ağırlık onun moleküller, ifade edildi V oksijen birimler.
Şimdi gaz halindeki maddelerin moleküler ağırlıklarının nasıl belirlendiğini görelim.
Avogadro kanununa göre aynı basınç ve sıcaklıkta alınan gazların eşit hacimleri eşit sayı moleküller. Şu halde ağırlıklar eşit hacimler iki gazın molekül ağırlıkları olarak birbiriyle ilişkili olması gerekir.
Örneğin bir litre iki farklı gazı ele alalım. Her birinin içermesine izin verin N moleküller. Birinci gazın bir litresinin ağırlığını şu şekilde gösterelim: G, ve ikinci geçiş g 1. Gazların moleküler ağırlıklarını sırasıyla şu şekilde gösterelim: M ve M 1.
Bir litre gazın ağırlığı, içindeki moleküllerin ağırlıklarının toplamına eşit olduğundan, = N G M Ve g1 =N M1
İlk eşitliği ikinciye bölerek şunu elde ederiz: (1) Belirli bir gazın ağırlığının, aynı sıcaklıkta ve aynı basınçta alınan aynı hacimdeki başka bir gazın ağırlığına oranına, birinci gazın ikinciye göre yoğunluğu denir. Örneğin, 1 ben Belirli bir gazın ağırlığının, aynı sıcaklıkta ve aynı basınçta alınan aynı hacimdeki başka bir gazın ağırlığına oranına, birinci gazın ikinciye göre yoğunluğu denir. Örneğin, 1 karbondioksitin ağırlığı 1,98 g ve 1
aynı koşullar altında hidrojen 0,09 g'dır ve hidrojene göre karbondioksitin yoğunluğu 1,98: 0,09 = 22 olacaktır. Gaz yoğunluğunun harfle gösterilmesi D,
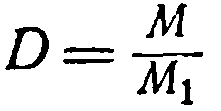
Denklemi (1) yeniden yazalım:
G = Neresi g1 =N (2)
D ağırlık Moleküler gaz onun eşittir yoğunluk İle davranış diğerine gaz, çarpılmış Açık ağırlık moleküler ikinci
gaz
M Çoğu zaman, çeşitli gazların yoğunlukları, tüm teneke kutular arasında en hafif olan hidrojene göre belirlenir. Hidrojenin moleküler ağırlığı 2,016 olduğundan, bu durumda moleküler ağırlıkların hesaplanmasına yönelik formül şu şekli alır:
= 2,016D
M = 2 Neresi
veya hidrojenin moleküler ağırlığını 2'ye yuvarlarsak:
M = 2 22 = 44
Örneğin, bu formülü kullanarak, yukarıda belirtildiği gibi hidrojenin yoğunluğu 22 olan karbondioksitin moleküler ağırlığını hesapladığımızda şunları buluruz:
Bir gazın moleküler ağırlığı genellikle havadaki yoğunluğuna göre de hesaplanır. Hava çeşitli gazların bir karışımı olmasına rağmen yine de havanın hidrojen cinsinden yoğunluğundan belirlenen havanın ortalama moleküler ağırlığından bahsedebiliriz. Bu şekilde bulunan havanın moleküler ağırlığı 29'dur. İncelenmekte olan gazın havadaki yoğunluğunu D 1 aracılığıyla belirterek, şunu elde ederiz: aşağıdaki formül
Molekül ağırlıklarını hesaplamak için:
E = 29 D 1
Uygulamada, moleküler ağırlığın belirlenmesi, incelenen gazın belirli bir miktarının ağırlığının ve hacminin ölçülmesine ve daha sonra yoğunluğunun hesaplanmasına, ardından moleküler ağırlığın doğrudan formülden bulunmasına indirgenir. Bir gazın yoğunluğu, molekül ağırlığı ve birim hacim başına ağırlığı bilinen diğer gazlara göre hesaplanabilir. Ancak referans kitapları normal koşullar altında gazların ağırlıklarını gösterdiğinden ve deneyimde genellikle başka koşullar altında incelenen gazın ağırlığını ve hacmini ölçmek gerektiğinden, gaz yoğunluğunu hesaplamak için ilk önce ölçülen değeri getirmek gerekir. gaz hacminin normal koşullara (0° ve 760°) mm basınç).
Normal koşullara indirgeme, birleştiren bir denklem temelinde gerçekleştirilir. gaz kanunları Boyle-Mariotte ve Gay-Lussac:

Nerede R ve υ - deney koşulları altında sırasıyla gazın basıncı ve hacmi; P 0 — normal kan basıncı; υ 0 - normal koşullar altında gazın hacmi; T - mutlak sıcaklık gaz
