4.4 థర్మల్ కుళ్ళిపోవడంనీటిలో కరగని స్థావరాలు.
వేడిచేసినప్పుడు అనేక నీటిలో కరగని స్థావరాలు కుళ్ళిపోతాయి. కుళ్ళిపోయే ఉత్పత్తులు సంబంధిత లోహాలు మరియు నీటి యొక్క ఆక్సైడ్లు. తాపన ఉష్ణోగ్రత బేస్ యొక్క భాగమైన లోహంపై ఆధారపడి ఉంటుంది మరియు 200 ° C మరియు అంతకంటే ఎక్కువ ఉంటుంది.
జింక్, రాగి మరియు అల్యూమినియం హైడ్రాక్సైడ్ల కోసం కుళ్ళిపోయే ప్రతిచర్యలను వ్రాస్దాం:
పై ప్రతిచర్యల ఉత్పత్తులు నీరు మరియు మెటల్ ఆక్సైడ్లు: , మరియు .
4.5 మెటల్ లవణాలతో పరస్పర చర్య.
ఈ ప్రతిచర్య ఆల్కాలిస్ యొక్క లక్షణం. పొటాషియం హైడ్రాక్సైడ్లు. సోడియం లిథియం లోహ లవణాలతో సంకర్షణ చెందుతుంది, ఫలితంగా అవపాతం ఏర్పడుతుంది కరగని హైడ్రాక్సైడ్లుమెటల్ డేటా:
ఈ ప్రతిచర్యలను ఉపయోగించి, అనేక లోహాల నీటిలో కరగని హైడ్రాక్సైడ్లు పొందబడతాయి, వీటిని రసాయన సంశ్లేషణ, ఔషధం మొదలైన వాటిలో ఉపయోగిస్తారు.
చాప్టర్ 5. కెమిస్ట్రీ మరియు పరిశ్రమలో స్థావరాల ఉపయోగం.
రసాయన శాస్త్ర ప్రయోగశాల మరియు రెండింటిలోనూ స్థావరాలు విస్తృతంగా ఉపయోగించబడుతున్నాయి రసాయన పరిశ్రమ, వారు రోజువారీ జీవితంలో తమ దరఖాస్తును కనుగొంటారు.
అత్యంత విస్తృతంగా ఉపయోగించే స్థావరాల అనువర్తనాన్ని పరిశీలిద్దాం.
రసాయన ప్రయోగశాలలలో మరియు పరిశ్రమలలో, సోడియం హైడ్రాక్సైడ్ అత్యంత ప్రజాదరణ పొందిన కారకాలలో ఒకటి.
సోడియం హైడ్రాక్సైడ్, .
వివిధ సోడియం లవణాలను ఉత్పత్తి చేయడానికి ఉపయోగిస్తారు: సల్ఫేట్, నైట్రేట్, నైట్రేట్, క్రోమేట్, సిలికేట్లు లేదా వాటర్ గ్లాస్, ఫ్లోరిడా, లవణాలు సేంద్రీయ ఆమ్లాలు. ఇది క్రాఫ్ట్ వంట, కృత్రిమ ఫైబర్స్, సబ్బు మరియు సమయంలో చెక్క నుండి పల్ప్ ఉత్పత్తిలో ఉపయోగిస్తారు డిటర్జెంట్లు, చెమ్మగిల్లడం ఏజెంట్లు మరియు ఎమల్సిఫైయర్లు, రంగులు, బాక్సైట్ నుండి అల్యూమినియం ఆక్సైడ్, ఫినాల్స్. బ్లూయింగ్ స్టీల్, ఆక్సీకరణ లోహాలు, ముఖ్యంగా అల్యూమినియం కోసం ఎలక్ట్రోలైట్లలో చేర్చబడింది విద్యుద్విశ్లేషణ ప్రక్రియలుటిన్ మరియు జింక్ టెక్నాలజీలో.
పొటాషియం హైడ్రాక్సైడ్, .
అనేక పొటాషియం లవణాలు, ద్రవ సబ్బులు మరియు కొన్ని రంగుల ఉత్పత్తికి ప్రారంభ పదార్థంగా పనిచేస్తుంది. ఇది నికెల్-కాడ్మియం బ్యాటరీలలో లిథియం హైడ్రాక్సైడ్తో కలిపి ఎలక్ట్రోలైట్గా ఉపయోగించబడుతుంది, xanthates ఉత్పత్తికి ఆల్కహాల్ ద్రావణం రూపంలో - ఫ్లోటేషన్ ఏజెంట్ల ఉత్పత్తిలో మధ్యవర్తులు.
అమ్మోనియం హైడ్రాక్సైడ్, .
ప్రపంచంలో దీని ఉత్పత్తి సుమారు 10 - 12 మిలియన్ టన్నులు. పశుగ్రాసం ఉత్పత్తిలో వాటి పోషక విలువలను పెంచడానికి మరియు సంరక్షణకారిగా, సోడా, రంగుల ఉత్పత్తిలో, మాంగనీస్ సమ్మేళనాల విద్యుద్విశ్లేషణ ఉత్పత్తిలో దీనిని ఎరువుగా ఉపయోగిస్తారు. ప్రయోగశాల అభ్యాసం.
కాల్షియం హైడ్రాక్సైడ్, .
కాల్షియం హైడ్రాక్సైడ్ (స్లాక్డ్ లైమ్) నిర్మాణ సామగ్రి ఉత్పత్తిలో ఉపయోగించబడుతుంది; సున్నం మోర్టార్ దాని నుండి తయారు చేయబడింది. ఇది బ్లీచ్ (మిశ్రమం) మరియు ఇతర కాల్షియం సమ్మేళనాలు, సున్నం ఎరువులు మరియు మొక్కల రక్షణ ఏజెంట్లను తయారు చేయడానికి ఉపయోగిస్తారు. కాల్షియం హైడ్రాక్సైడ్ నీటిని మృదువుగా చేయడానికి, చర్మాన్ని తాన్ చేయడానికి మరియు తటస్థీకరించడానికి ఉపయోగిస్తారు మురుగునీరు, మొక్కల రసాల నుండి సేంద్రీయ ఆమ్లాల లవణాలను వేరు చేయండి.
లిథియం హైడ్రాక్సైడ్, .
ఇది ఆల్కలీన్ బ్యాటరీలను పూరించడానికి ఉపయోగించబడుతుంది, ఇది వారి జీవితకాలాన్ని పెంచుతుంది మరియు ఎనామెల్స్ మరియు గాజు తయారీకి ఉపయోగించబడుతుంది.
మెగ్నీషియం హైడ్రాక్సైడ్, .
నిర్మాణ పరిశ్రమలో, సిరామిక్ రసాయన సామాను తయారీకి అగ్ని-నిరోధక నిర్మాణ పదార్థాలలో భాగంగా ఉపయోగిస్తారు. మెడిసిన్లో తేలికపాటి న్యూట్రలైజింగ్ ఏజెంట్గా ఉపయోగించబడుతుంది (అధిక ఆమ్లత్వం కోసం గ్యాస్ట్రిక్ రసం).
ఇతర తక్కువ సాధారణ హైడ్రాక్సైడ్ల కోసం అప్లికేషన్లు టేబుల్ 3లో ఇవ్వబడ్డాయి
టేబుల్ 3. మెటల్ హైడ్రాక్సైడ్ల అప్లికేషన్లు.
| № | హైడ్రాక్సైడ్ పేరు | రసాయన | అప్లికేషన్ |
| 1. | కాపర్ హైడ్రాక్సైడ్ | గాజు, ఎనామెల్స్ మరియు గ్లేజ్లకు వర్ణద్రవ్యం, బట్టలకు రంగు వేయడానికి మరియు శిలీంద్ర సంహారిణిగా ఉపయోగిస్తారు. Schweitzer యొక్క రియాజెంట్ తయారీకి నైలాన్ స్టెబిలైజర్. | |
| 2. | జింక్ హైడ్రాక్సైడ్ | రబ్బరు పూరకం, పెయింట్ భాగం, వెటర్నరీ మెడిసిన్లో లేపనాలలో ఒక భాగం. | |
| 3. | కోబాల్ట్ హైడ్రాక్సైడ్ | ఉత్ప్రేరకాలు, పిగ్మెంట్లు,... |
|
| 4. | కాడ్మియం హైడ్రాక్సైడ్ | కాడ్మియం కరెంట్ మూలాలలో క్రియాశీల ద్రవ్యరాశి ఉత్పత్తికి, విశ్లేషణాత్మక కారకంగా, కాడ్మియం సమ్మేళనాల తయారీకి ఉపయోగించబడుతుంది. | |
| 5. | అల్యూమినియం హైడ్రాక్సైడ్ | ఇది అల్యూమినియం సమ్మేళనాలను ఉత్పత్తి చేయడానికి, పెయింట్లు మరియు ప్లాస్టిక్లలో ఫైర్ రిటార్డెంట్గా, టూత్పేస్ట్లలో ఒక భాగం మరియు వైద్యంలో ఒక ఎన్వలపింగ్ మరియు యాడ్సోర్బెంట్ ఏజెంట్గా ఉపయోగించబడుతుంది. | |
| 6. | బెరీలియం హైడ్రాక్సైడ్ | వక్రీభవన సిరమిక్స్ ఉత్పత్తి చేయడానికి ఉపయోగిస్తారు. క్రూసిబుల్స్, UV కిరణాలను బాగా ప్రసారం చేసే అద్దాల భాగం. | |
| 7. | టిన్ హైడ్రాక్సైడ్ | బట్టలను చెక్కడం కోసం, ముఖ్యంగా పట్టు. | |
| 8. | లీడ్ హైడ్రాక్సైడ్ | ఎచింగ్ ఫ్యాబ్రిక్స్ కోసం, గాజు తయారీకి, బ్యాటరీ ఫిల్లర్. | |
| 9. | బిస్మత్ హైడ్రాక్సైడ్ | ఎనామెల్స్ మరియు సెరామిక్స్, క్రిస్టల్ మరియు స్పెషల్స్ తయారీలో ఉపయోగిస్తారు. గాజు, అల్ట్రాసోనిక్ పదార్థాల ఉత్పత్తికి | |
| 10. | క్రోమియం హైడ్రాక్సైడ్ | విశ్లేషణాత్మక రసాయన శాస్త్రంలో ఉపయోగించబడుతుంది. | |
| 11. | మాంగనీస్ హైడ్రాక్సైడ్ | మాంగనీస్ సమ్మేళనాలను పొందేందుకు ఉపయోగిస్తారు. | |
| 12. | ఐరన్ హైడ్రాక్సైడ్ | మెటాలిక్ ఐరన్, కలరింగ్ పిగ్మెంట్ల ఉత్పత్తికి ఆధారం |
ముగింపు.
తరగతులలో పునాదులు ఒకటి అకర్బన పదార్థాలు, ఇది ఆమ్లాలు, ఆక్సైడ్లు మరియు లవణాలతో పాటు, అకర్బన రసాయన శాస్త్రానికి ఆధారం. అవి విస్తృతంగా ఉపయోగించబడుతున్నాయి వివిధ ప్రాంతాలురసాయన శాస్త్రం మరియు రసాయన పరిశ్రమ. వారి సహాయంతో, ఎరువులు పొందబడతాయి, నిర్మాణ సామాగ్రి, రంగు గాజు. అవి లేకుండా, మేము కాంతి మరియు ఆర్థిక ఆల్కలీన్ బ్యాటరీలు మరియు అనేక వైద్య సామాగ్రిని కోల్పోతాము.
ఈ పని యొక్క పని ఈ తరగతి అకర్బన గురించి జ్ఞానాన్ని క్రమబద్ధీకరించడం రసాయన పదార్థాలుఫండమెంటల్స్గా, వాటి రసాయనాన్ని కలపడం అవసరం మరియు భౌతిక లక్షణాలు, పరిశ్రమలో వాటి ఉత్పత్తి మరియు ఉపయోగం.
పురోగతిలో ఉంది ప్రత్యేక శ్రద్ధబ్రన్స్టెడ్, లూయిస్, ఇజ్మైలోవ్ యొక్క ఆధునిక యాసిడ్-బేస్ సిద్ధాంతాల ఆధారంగా అకర్బన పదార్థాల తరగతులలో ఒకటిగా, స్థావరాల భావనను హైలైట్ చేయడానికి అంకితం చేయబడింది. ఉసనోవిచ్. కూడా పరిగణించబడుతుంది పారిశ్రామిక పద్ధతులుసోడియం హైడ్రాక్సైడ్ [3, కళ యొక్క ఉదాహరణను ఉపయోగించి క్షారాలను పొందడం. 36 – 42]. చాలా శ్రద్ధరోజువారీ జీవితంలో మరియు రసాయన, వైద్య మరియు నిర్మాణ పరిశ్రమలలో స్థావరాలు ఉపయోగించే పద్ధతులకు చెల్లించబడుతుంది, అక్కడ వారు తమ దరఖాస్తును కనుగొంటారు. నిర్దిష్ట పదార్ధాల అప్లికేషన్ యొక్క ప్రధాన ప్రాంతాలు వాడుకలో సౌలభ్యం కోసం ప్రత్యేక సూచన పట్టికలో ఇవ్వబడ్డాయి.
స్థావరాల లక్షణాల అధ్యయనం ఉంది గొప్ప ప్రాముఖ్యతకెమిస్ట్రీ అధ్యయనంలో, అలాగే శాస్త్రీయ ప్రపంచ దృష్టికోణం అభివృద్ధికి.
ఉపయోగించిన సాహిత్యం జాబితా.
1. గ్లింకా ఎన్.ఎల్. సాధారణ రసాయన శాస్త్రం. – L.: కెమిస్ట్రీ, 1988. – 702 p.
2. క్రేష్కోవ్ A.P., యారోస్లావ్ట్సేవ్ A.A. విశ్లేషణాత్మక కెమిస్ట్రీ కోర్సు. – M.: కెమిస్ట్రీ, 1964. – 430 p.
3. Podobaev N. I. విద్యుద్విశ్లేషణ. – M.: విద్య, 1989, 100 p.
4. పోలీస్ M.E. విశ్లేషణాత్మక రసాయన శాస్త్రం. – M.: మెడిసిన్, 1981. – 286 p.
5. రాబినోవిచ్ V. A., ఖవిన్ Z. యా. క్రాట్కీ రసాయన సూచన పుస్తకం. – L.: కెమిస్ట్రీ, 1978. – 331 p.
6. కెమిస్ట్రీ: సూచన ప్రచురణ/ ed. W. ష్రోటర్, K.-H, Lautenschläger, H. Bibrak et al.: Trans. అతనితో. – M.: కెమిస్ట్రీ, 1989. – 648 p.
7. కెమికల్ ఎన్సైక్లోపీడియా 5 సంపుటాలలో / ed. I. L. Knunyants. - ఎం.: సోవియట్ ఎన్సైక్లోపీడియా, 1990.
8. షుకరేవ్ S. A. అకర్బన రసాయన శాస్త్రం. - ఎం.: పట్టబద్రుల పాటశాల, 1970. – 437 పే.
నెదర్లాండ్స్లో, రెండు దేశాలు ఉన్నిని విక్రయించాయి మరియు స్పానిష్ యోక్కు వ్యతిరేకంగా తిరుగుబాటు చేసిన గ్యూజ్కు బ్రిటిష్ వారు సహాయం చేశారు. ఈ పరిస్థితుల్లో, అప్పటితో వేగవంతమైన అభివృద్ధిఇంగ్లాండ్లో బూర్జువా సంబంధాలు కొత్త ప్రపంచం- స్పెయిన్ వెనుక భాగం, అత్యంత ధనిక ఖజానా మరియు విశాలమైన మార్కెట్ - ఇంగ్లీష్ సాహసికుల కోసం ఒక లక్ష్యం మరియు ఎరగా మారింది ఆంగ్ల వ్యాపారులుమరియు పెద్దమనుషులు. నీళ్లలో పైరసీ...
చెట్టు. పర్యావరణం మరియు బయోసెంట్రిజం మధ్య వైరుధ్యాలను కృత్రిమంగా పెంచడంలో అర్థం లేదు. వాటిని ఏకం చేసే వాటి గురించి, వారికి ఉమ్మడిగా ఉన్న వాటి గురించి, దేనికి ప్రాతిపదికగా ఉపయోగపడుతుందనే దాని గురించి మాట్లాడటం చాలా మంచిది. సాధారణ వేదికపర్యావరణ నీతి. ఇవి క్రిందివి ముఖ్యమైన పాయింట్లు: 1) ప్రతిదీ, వ్యక్తులు, జీవుల జాతులు మరియు పర్యావరణ వ్యవస్థలు వాటి స్వంత మంచి, హక్కులు, వాటి స్వంత అంతర్గత విలువను కలిగి ఉంటాయి, ఎందుకంటే అవి విలువైనవి...
వారి 1.5% జనాభాకు. అందుచేత ఏది బలమో, ఏది బలహీనమో అనే ప్రశ్నకు దూరంగా ఉన్నాను పౌర సమాజం, నేను సేంద్రీయంగా నా షెడ్యూల్లోని నాల్గవ ప్రశ్నకు వెళ్తాను - పౌర సమాజం గురించి మరియు ఆర్థిక వృద్ధి. సామూహిక చర్యల సిద్ధాంతం యొక్క అదే రచయిత, నేను ఇప్పటికే పేర్కొన్న మన్సూర్ ఓల్సన్ చాలా అడిగాడు ఆసక్తి అడగండి- మన దేశం గురించి, మార్గం ద్వారా. మీరు ముఖాముఖి చూడలేరు. మాకు...
భూగర్భ శాస్త్రం మరియు నేల శాస్త్రాన్ని అధ్యయనం చేయడం ద్వారా, జియోమోర్ఫాలజీ యొక్క పని కేవలం రేఖాగణితాన్ని మాత్రమే అధ్యయనం చేయడం అని అంగీకరించాలి, కానీ భౌతిక లక్షణాలను కాదు. భూమి యొక్క ఉపరితలం. గణిత సూత్రీకరణలో, దీని అర్థం జియోమార్ఫాలజీని అధ్యయనం చేసే వస్తువు L సెట్ యొక్క సరిహద్దుగా పరిగణించబడదు, కానీ స్పేస్ P లోకి దాని మ్యాపింగ్, అనగా. త్రిమితీయ యూక్లిడియన్ అంతరిక్షంలో ఉపరితలం, నమూనా...
స్థావరాల యొక్క భౌతిక మరియు రసాయన లక్షణాలు. క్షారాలతో పనిచేసేటప్పుడు భద్రతా జాగ్రత్తలు. భావన యాంఫోటెరిక్ హైడ్రాక్సైడ్లు
నీటిలో కరిగే స్థావరాలు (క్షారాలు). ఘనపదార్థాలు తెలుపు, నీటిలో బాగా కరుగుతుంది. వద్ద గది ఉష్ణోగ్రత Ca (OH)2 మరియు Sr (OH)2 తక్కువ ద్రావణీయతను కలిగి ఉంటాయి. నీటిలో కరగని స్థావరాలు ఘనపదార్థాలు, ఉదాహరణకు, Al (OH)3 తెలుపు, Cu (OH)2 నీలి రంగు, Fe (OH)3 గోధుమ రంగులో ఉంటుంది.
కరిగే మరియు కరగని స్థావరాలుఅనేక సాధారణ మరియు విలక్షణమైన రసాయన లక్షణాలను ప్రదర్శిస్తాయి.
1. సూచిక పరిష్కారాలపై క్షార పరిష్కారాల ప్రభావం (క్షారాలకు మాత్రమే విలక్షణమైనది). క్షార ద్రావణంలో, లిట్మస్ మరియు సార్వత్రిక సూచిక కాగితం ఉంటుంది నీలి రంగు, మిథైల్ ఆరెంజ్ నారింజ-పసుపు, మరియు ఫినాల్ఫ్తలీన్ క్రిమ్సన్.
2. ఉప్పు మరియు నీటిని ఏర్పరచడానికి ఆమ్లాలతో స్థావరాల పరస్పర చర్య - తటస్థీకరణ ప్రతిచర్య (రెండింటి లక్షణం కరిగే స్థావరాలు, మరియు కరగనివి):
KOH + HCl = KCl + H2O
3. ఉప్పు మరియు నీటిని ఏర్పరచడానికి యాసిడ్ ఆక్సైడ్లతో బేస్ల పరస్పర చర్య (క్షారాలకు మాత్రమే సాధారణం):
2NaOH + CO2 = Na2CO3 + H2O
4. మరొక బేస్ మరియు మరొక ఉప్పు (క్షారాలకు మాత్రమే సాధారణం):
2KOH + CuSO4 = K2SO4 + Cu (OH)2 ¯
క్షార ద్రావణంతో ప్రతిస్పందించే ఉప్పు కూర్పు తప్పనిసరిగా కరగని ఆధారాన్ని ఏర్పరుచుకునే లోహాన్ని కలిగి ఉండాలి.
5. ఆక్సైడ్ మరియు నీరు ఏర్పడటంతో వేడిచేసినప్పుడు కరగని స్థావరాల కుళ్ళిపోవడం (కరగని స్థావరాల కోసం మాత్రమే లక్షణం):
2Fe (OH)3 Fe2O3 + 3H2O
ఆల్కాలిస్తో పనిచేసేటప్పుడు, మీరు చాలా జాగ్రత్తగా ఉండాలి, ఎందుకంటే పచ్చికభూములు చాలా దూకుడు పదార్థాలను కలిగి ఉంటాయి. మీ చర్మంపై క్షార ద్రావణం వస్తే, తీపి అనుభూతి మాయమయ్యే వరకు మీరు వెంటనే దానిని నడుస్తున్న నీటితో కడగాలి, ఆపై బలహీనమైన ఆమ్లం (ఎసిటిక్ లేదా బోరిక్) యొక్క ద్రావణంతో కడిగి (తటస్థీకరించండి) మరియు వైద్య కేంద్రానికి వెళ్లండి.
లవణాలను ఏర్పరచడానికి తటస్థీకరణ ప్రతిచర్యలో స్థావరాలు ఆమ్లాలతో చర్య జరుపుతాయని మేము ఇప్పటికే కనుగొన్నాము. స్థావరాలు, అలాగే ఆమ్లాలతో కూడిన ఆమ్లాలు, తటస్థీకరణ ప్రతిచర్యలోకి ప్రవేశించవు. కానీ ఆమ్లాలు మరియు స్థావరాలు రెండింటితో చర్య జరిపి లవణాలు ఏర్పడే హైడ్రాక్సైడ్లు ఉన్నాయి. ఇటువంటి హైడ్రాక్సైడ్లను యాంఫోటెరిక్ అంటారు. యాంఫోటెరిక్ హైడ్రాక్సైడ్లు ఆమ్లాలతో ప్రతిచర్యలలో స్థావరాల లక్షణాలను మరియు ధాతువులతో ప్రతిచర్యలలో ఆమ్లాల లక్షణాలను ప్రదర్శిస్తాయి. అన్ని యాంఫోటెరిక్ హైడ్రాక్సైడ్లు నీటిలో సరిగా కరుగవు. వీటిలో జింక్ హైడ్రాక్సైడ్ Zn (OH)2, అల్యూమినియం హైడ్రాక్సైడ్ Al (OH)3, బెరీలియం హైడ్రాక్సైడ్ బీ (OH)2, క్రోమియం (III) హైడ్రాక్సైడ్ Cr (OH)3, ఫెర్రం (III) హైడ్రాక్సైడ్ Fe (OH)3 మరియు ఇతరాలు ఉన్నాయి. జింక్ హైడ్రాక్సైడ్ను ఉపయోగించి యాంఫోటెరిక్ హైడ్రాక్సైడ్ల రసాయన లక్షణాలను ఉదాహరణగా పరిశీలిద్దాం.
1. ఉప్పు మరియు నీరు ఏర్పడటానికి ఆమ్లంతో చర్య:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2. ఉప్పు మరియు నీరు ఏర్పడటానికి క్షారముతో పరస్పర చర్య:
Zn(OH)2 + 2NaOH Na2ZnO2 + 2H2O
1. ఉప్పు మరియు నీటిని ఏర్పరచడానికి స్థావరాలు ఆమ్లాలతో చర్య జరుపుతాయి:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O
2. యాసిడ్ ఆక్సైడ్లతో, ఉప్పు మరియు నీటిని ఏర్పరుస్తుంది:
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
3. ఆల్కాలిస్ యాంఫోటెరిక్ ఆక్సైడ్లు మరియు హైడ్రాక్సైడ్లతో చర్య జరిపి, ఉప్పు మరియు నీటిని ఏర్పరుస్తుంది:
2NaOH + Cr 2 O 3 = 2NaCrO 2 + H 2 O
KOH + Cr(OH) 3 = KCrO 2 + 2H 2 O
4. క్షారాలు కరిగే లవణాలతో ప్రతిస్పందిస్తాయి, బలహీనమైన బేస్, అవక్షేపం లేదా వాయువును ఏర్పరుస్తాయి:
2NaOH + NiCl 2 = Ni(OH) 2 ¯ + 2NaCl
బేస్
2KOH + (NH 4) 2 SO 4 = 2NH 3 + 2H 2 O + K 2 SO 4
Ba(OH) 2 + Na 2 CO 3 = BaCO 3 ¯ + 2NaOH
5. ఆల్కాలిస్ కొన్ని లోహాలతో చర్య జరుపుతుంది, ఇవి యాంఫోటెరిక్ ఆక్సైడ్లకు అనుగుణంగా ఉంటాయి:
2NaOH + 2Al + 6H 2 O = 2Na + 3H 2
6. సూచికపై క్షార ప్రభావం:
ఓహ్ - + ఫినాల్ఫ్తలీన్ ® క్రిమ్సన్ కలర్
ఓహ్ - + లిట్మస్ ® నీలం రంగు
7. వేడి చేసినప్పుడు కొన్ని స్థావరాలు కుళ్ళిపోవడం:
Сu(OH) 2 ® CuO + H 2 O
యాంఫోటెరిక్ హైడ్రాక్సైడ్లు – రసాయన సమ్మేళనాలు, రెండు స్థావరాలు మరియు ఆమ్లాల లక్షణాలను ప్రదర్శిస్తుంది. యాంఫోటెరిక్ హైడ్రాక్సైడ్లు యాంఫోటెరిక్ ఆక్సైడ్లకు అనుగుణంగా ఉంటాయి (పేరా 3.1 చూడండి).
యాంఫోటెరిక్ హైడ్రాక్సైడ్లు సాధారణంగా బేస్ రూపంలో వ్రాయబడతాయి, కానీ అవి యాసిడ్ రూపంలో కూడా సూచించబడతాయి:
Zn(OH) 2 Û H 2 ZnO 2
పునాది
రసాయన లక్షణాలుయాంఫోటెరిక్ హైడ్రాక్సైడ్లు
1. యాంఫోటెరిక్ హైడ్రాక్సైడ్లు ఆమ్లాలు మరియు యాసిడ్ ఆక్సైడ్లతో సంకర్షణ చెందుతాయి:
Be(OH) 2 + 2HCl = BeCl 2 + 2H 2 O
Be(OH) 2 + SO 3 = BeSO 4 + H 2 O
2. క్షారాలతో సంకర్షణ మరియు ప్రాథమిక ఆక్సైడ్లుఆల్కలీన్ మరియు ఆల్కలీన్ ఎర్త్ లోహాలు:
Al(OH) 3 + NaOH = NaAlO 2 + 2H 2 O;
H 3 AlO 3 యాసిడ్ సోడియం మెటాలుమినేట్
(H 3 AlO 3 ® HAlO 2 + H 2 O)
2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
అన్ని యాంఫోటెరిక్ హైడ్రాక్సైడ్లు బలహీనమైన ఎలక్ట్రోలైట్లు
లవణాలు
లవణాలు- ఇది సంక్లిష్ట పదార్థాలు, లోహ అయాన్లు మరియు యాసిడ్ అవశేషాలను కలిగి ఉంటుంది. లవణాలు అనేది యాసిడ్లలోని లోహ (లేదా అమ్మోనియం) అయాన్లతో హైడ్రోజన్ అయాన్లను పూర్తిగా లేదా పాక్షికంగా భర్తీ చేసే ఉత్పత్తులు. లవణాల రకాలు: మధ్యస్థ (సాధారణ), ఆమ్ల మరియు ప్రాథమిక.
మధ్యస్థ లవణాలు- ఇవి లోహ (లేదా అమ్మోనియం) అయాన్లతో ఆమ్లాలలో హైడ్రోజన్ కాటయాన్లను పూర్తిగా భర్తీ చేసే ఉత్పత్తులు: Na 2 CO 3, NiSO 4, NH 4 Cl, మొదలైనవి.
మధ్యస్థ లవణాల రసాయన లక్షణాలు
1. లవణాలు ఆమ్లాలు, ఆల్కాలిస్ మరియు ఇతర లవణాలతో సంకర్షణ చెందుతాయి, బలహీనమైన ఎలక్ట్రోలైట్ లేదా అవక్షేపణను ఏర్పరుస్తాయి; లేదా గ్యాస్:
Ba(NO 3) 2 + H 2 SO 4 = BaSO 4 ¯ + 2HNO 3
Na 2 SO 4 + Ba(OH) 2 = BaSO 4 ¯ + 2NaOH
CaCl 2 + 2AgNO 3 = 2AgCl¯ + Ca(NO 3) 2
2CH 3 COONa + H 2 SO 4 = Na 2 SO 4 + 2CH 3 COOH
NiSO 4 + 2KOH = Ni(OH) 2 ¯ + K 2 SO 4
బేస్
NH 4 NO 3 + NaOH = NH 3 + H 2 O + NaNO 3
2. లవణాలు మరింత క్రియాశీల లోహాలతో సంకర్షణ చెందుతాయి. మరింత క్రియాశీల మెటల్ఉప్పు ద్రావణం నుండి తక్కువ చురుకైన దానిని స్థానభ్రంశం చేస్తుంది (అనుబంధం 3).
Zn + CuSO 4 = ZnSO 4 + Cu
యాసిడ్ లవణాలు - ఇవి మెటల్ (లేదా అమ్మోనియం) అయాన్లతో ఆమ్లాలలో హైడ్రోజన్ కాటయాన్లను అసంపూర్తిగా భర్తీ చేసే ఉత్పత్తులు: NaHCO 3, NaH 2 PO 4, Na 2 HPO 4, మొదలైనవి. యాసిడ్ లవణాలు పాలిబాసిక్ ఆమ్లాల ద్వారా మాత్రమే ఏర్పడతాయి. దాదాపు అన్ని యాసిడ్ లవణాలు నీటిలో బాగా కరుగుతాయి.
ఆమ్ల లవణాలను పొందడం మరియు వాటిని మధ్యస్థ లవణాలుగా మార్చడం
1. యాసిడ్ లవణాలు ఒక బేస్ తో అదనపు యాసిడ్ లేదా యాసిడ్ ఆక్సైడ్ చర్య ద్వారా పొందబడతాయి:
H 2 CO 3 + NaOH = NaHCO 3 + H 2 O
CO 2 + NaOH = NaHCO 3
2. అదనపు ఆమ్లం ప్రాథమిక ఆక్సైడ్తో సంకర్షణ చెందినప్పుడు:
2H 2 CO 3 + CaO = Ca(HCO 3) 2 + H 2 O
3. యాసిడ్ జోడించడం ద్వారా మధ్యస్థ లవణాల నుండి యాసిడ్ లవణాలు పొందబడతాయి:
· పేరులేని
Na 2 SO 3 + H 2 SO 3 = 2NaHSO 3;
Na 2 SO 3 + HCl = NaHSO 3 + NaCl
4. యాసిడ్ లవణాలు క్షారాన్ని ఉపయోగించి మధ్యస్థ లవణాలుగా మార్చబడతాయి:
NaHCO 3 + NaOH = Na 2 CO 3 + H 2 O
ప్రాథమిక లవణాలు- ఇవి హైడ్రాక్సో సమూహాల అసంపూర్ణ ప్రత్యామ్నాయం యొక్క ఉత్పత్తులు (OH - ) మైదానాలు యాసిడ్ అవశేషాలు: MgOHCl, AlOHSO 4, మొదలైనవి. ప్రాథమిక లవణాలు పాలివాలెంట్ లోహాల బలహీనమైన స్థావరాల ద్వారా మాత్రమే ఏర్పడతాయి. ఈ లవణాలు సాధారణంగా చాలా తక్కువగా కరుగుతాయి.
ప్రాథమిక లవణాలను పొందడం మరియు వాటిని మధ్యస్థ లవణాలుగా మార్చడం
1. ప్రాథమిక లవణాలు ఒక యాసిడ్ లేదా ఒక అదనపు బేస్ చర్య ద్వారా పొందబడతాయి యాసిడ్ ఆక్సైడ్:
Mg(OH) 2 + HCl = MgOHCl¯ + H 2 O
హైడ్రాక్సో-
మెగ్నీషియం క్లోరైడ్
Fe(OH) 3 + SO 3 = FeOHSO 4 ¯ + H 2 O
హైడ్రాక్సో-
ఇనుము (III) సల్ఫేట్
2. ఆల్కలీ లేకపోవడంతో మీడియం ఉప్పు నుండి ప్రాథమిక లవణాలు ఏర్పడతాయి:
Fe 2 (SO 4) 3 + 2NaOH = 2FeOHSO 4 + Na 2 SO 4
3. ప్రాథమిక లవణాలు ఆమ్లాన్ని జోడించడం ద్వారా మధ్యస్థ లవణాలుగా మార్చబడతాయి (ప్రాధాన్యంగా ఉప్పుకు అనుగుణంగా ఉండేవి):
MgOHCl + HCl = MgCl 2 + H 2 O
2MgOHCl + H 2 SO 4 = MgCl 2 + MgSO 4 + 2H 2 O
ఎలక్ట్రోలైట్స్
ఎలక్ట్రోలైట్స్- ఇవి ధ్రువ ద్రావణి అణువుల (H 2 O) ప్రభావంతో ద్రావణంలో అయాన్లుగా విడదీసే పదార్థాలు. విడదీయగల సామర్థ్యం ఆధారంగా (అయాన్లుగా విచ్ఛిన్నం), ఎలక్ట్రోలైట్లు సాంప్రదాయకంగా బలంగా మరియు బలహీనంగా విభజించబడ్డాయి. బలమైన ఎలక్ట్రోలైట్లు దాదాపు పూర్తిగా విడదీయబడతాయి (పలచన ద్రావణాలలో), బలహీనమైన ఎలక్ట్రోలైట్లు పాక్షికంగా మాత్రమే అయాన్లుగా విడిపోతాయి.
TO బలమైన ఎలక్ట్రోలైట్స్సంబంధిత:
· బలమైన ఆమ్లాలు(పేజి 20 చూడండి);
· బలమైన కారణాలు– ఆల్కాలిస్ (పేజి 22 చూడండి);
· దాదాపు అన్ని కరిగే లవణాలు.
బలహీనమైన ఎలక్ట్రోలైట్లు ఉన్నాయి:
· బలహీన ఆమ్లాలు(పేజి 20 చూడండి);
· స్థావరాలు క్షారమైనవి కావు;
బలహీనమైన ఎలక్ట్రోలైట్ యొక్క ప్రధాన లక్షణాలలో ఒకటి విచ్ఛేదనం స్థిరంగా – TO . ఉదాహరణకు, మోనోబాసిక్ ఆమ్లం కోసం,
హెచ్ఏ హెచ్ + +A - ,
ఇక్కడ, H + అయాన్ల సమతౌల్య సాంద్రత;
- యాసిడ్ అయాన్ల సమతౌల్య సాంద్రత A - ;
- యాసిడ్ అణువుల సమతౌల్య సాంద్రత,
లేదా కోసం బలహీనమైన పునాది,
MOH Û M + +ఓహ్ - ,
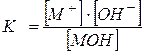 ,
,
ఇక్కడ, M + కాటయాన్ల సమతౌల్య సాంద్రత;
- హైడ్రాక్సైడ్ అయాన్ల సమతౌల్య సాంద్రత OH - ;
- బలహీనమైన మూల అణువుల సమతౌల్య సాంద్రత.
కొన్ని విచ్ఛేదన స్థిరాంకాలు బలహీన ఎలక్ట్రోలైట్స్(t = 25°С వద్ద)
| పదార్ధం | TO | పదార్ధం | TO |
| HCOOH | K = 1.8×10 -4 | H3PO4 | K 1 = 7.5×10 -3 |
| CH3COOH | K = 1.8×10 -5 | K 2 = 6.3×10 -8 | |
| HCN | K = 7.9×10 -10 | K 3 = 1.3×10 -12 | |
| H2CO3 | K 1 = 4.4×10 -7 | HClO | K = 2.9×10 -8 |
| K2 = 4.8×10 -11 | H3BO3 | K 1 = 5.8×10 -10 | |
| HF | K = 6.6×10 -4 | K2 = 1.8×10 -13 | |
| HNO2 | K = 4.0×10 -4 | K 3 = 1.6×10 -14 | |
| H2SO3 | K 1 = 1.7×10 -2 | H2O | K = 1.8×10 -16 |
| K 2 = 6.3×10 -8 | NH 3 × H 2 O | K = 1.8×10 -5 | |
| H2S | K 1 = 1.1×10 -7 | అల్(ఓహెచ్) 3 | K 3 = 1.4×10 -9 |
| K2 = 1.0×10 -14 | Zn(OH)2 | K 1 = 4.4×10 -5 | |
| H2SiO3 | K 1 = 1.3×10 -10 | K 2 = 1.5×10 -9 | |
| K2 = 1.6×10 -12 | Cd(OH)2 | K 2 = 5.0×10 -3 | |
| Fe(OH)2 | K 2 = 1.3×10 -4 | Cr(OH)3 | K 3 = 1.0×10 -10 |
| Fe(OH) 3 | K2 = 1.8×10 -11 | Ag(OH) | K = 1.1×10 -4 |
| K 3 = 1.3×10 -12 | Pb(OH)2 | K 1 = 9.6×10 -4 | |
| Cu(OH)2 | K 2 = 3.4×10 -7 | K 2 = 3.0×10 -8 | |
| ని(OH)2 | K 2 = 2.5×10 -5 |
