4.4 Termiline lagunemine vees lahustumatud alused.
Paljud vees lahustumatud alused lagunevad kuumutamisel. Laguproduktid on vastavate metallide oksiidid ja vesi. Küttetemperatuur sõltub aluse osaks olevast metallist ja on vahemikus 200°C ja üle selle.
Paneme kirja tsingi-, vase- ja alumiiniumhüdroksiidi lagunemisreaktsioonid:
Ülaltoodud reaktsioonide produktid on vesi ja metallioksiidid: , ja .
4.5 Koostoime metallisooladega.
See reaktsioon on iseloomulik leelistele. Kaaliumhüdroksiidid. naatrium Liitium interakteerub metallisooladega, mille tulemuseks on sade lahustumatud hüdroksiidid metalli andmed:
Neid reaktsioone kasutades saadakse paljude metallide vees lahustumatud hüdroksiidid, mida seejärel kasutatakse keemilises sünteesis, meditsiinis jne.
Peatükk 5. Aluste kasutamine keemias ja tööstuses.
Aluseid kasutatakse laialdaselt nii keemialaboris kui keemiatööstus, leiavad nad oma rakenduse igapäevaelus.
Vaatleme kõige laialdasemalt kasutatavate aluste kasutamist.
Keemialaborites ja tööstuses on naatriumhüdroksiid üks populaarsemaid reaktiive.
Naatriumhüdroksiid, .
Kasutatakse mitmesuguste naatriumsoolade tootmiseks: sulfaat, nitraat, nitrit, kromaat, silikaadid või vesiklaas, Florida, soolad orgaanilised happed. Seda kasutatakse tselluloosi tootmisel puidust jõutöötlemisel, tehiskiudude, seebi ja pesuvahendid, märgavad ained ja emulgaatorid, värvained, boksiidist saadud alumiiniumoksiid, fenoolid. Sisaldub elektrolüütide koostises terase siniseks muutmiseks, metallide, eriti alumiiniumi oksüdeerimiseks elektrolüütilised protsessid tina- ja tsingitehnoloogias.
Kaaliumhüdroksiid, .
Kasutatakse lähteainena paljude kaaliumisoolade, vedelseepide ja mõnede värvainete tootmisel. Seda kasutatakse elektrolüüdina koos liitiumhüdroksiidiga nikkel-kaadmiumpatareides alkoholilahusena ksantaatide tootmiseks – flotatsiooniainete tootmise vaheühendid.
Ammooniumhüdroksiid,.
Selle toodang maailmas on umbes 10-12 miljonit tonni. Kasutatakse väetisena loomasööda tootmisel nende toiteväärtuse tõstmiseks ning säilitusainena sooda, värvainete tootmisel, mangaaniühendite elektrolüütilisel tootmisel, laboripraktika.
Kaltsiumhüdroksiid,.
Kaltsiumhüdroksiidi (kustutatud lubi) kasutatakse ehitusmaterjalide tootmisel, sellest valmistatakse lubimörti. Seda kasutatakse valgendi (segu) ja muude kaltsiumiühendite, lubiväetiste ja taimekaitsevahendite valmistamiseks. Kaltsiumhüdroksiidi kasutatakse vee pehmendamiseks, naha pruunistamiseks ja neutraliseerimiseks reovesi, isoleerida taimemahladest orgaaniliste hapete soolad.
Liitiumhüdroksiid,.
Seda kasutatakse leelispatareide täitmiseks, mis pikendab nende eluiga, ning seda kasutatakse emailide ja klaasi valmistamiseks.
Magneesiumhüdroksiid,.
Kasutatakse ehitustööstuses tulekindlate konstruktsioonimaterjalide komponendina, keraamiliste keemiatoodete valmistamisel. Kasutatakse meditsiinis nõrga neutraliseeriva ainena (kõrge happesuse korral maomahl).
Muude vähem levinud hüdroksiidide rakendused on loetletud tabelis 3
Tabel 3. Metallhüdroksiidide kasutusalad.
| № | Hüdroksiidi nimi | Keemiline | Rakendus |
| 1. | Vaskhüdroksiid | Kasutatakse klaasi, emailide ja glasuuride pigmendina, peitsina kangaste värvimisel ning fungitsiidina. Nailonist stabilisaator Schweitzeri reaktiivi valmistamiseks. | |
| 2. | Tsinkhüdroksiid | Kummist täiteaine, värvikomponent, veterinaarias salvide komponendina. | |
| 3. | Koobalthüdroksiid | Kasutatakse katalüsaatorite, pigmentide, ... |
|
| 4. | Kaadmiumhüdroksiid | Kasutatakse kaadmiumiühendite valmistamiseks analüütilise reagendina aktiivse massi tootmiseks kaadmiumivooluallikates. | |
| 5. | Alumiiniumhüdroksiid | Seda kasutatakse alumiiniumiühendite tootmiseks, tuleaeglustina värvides ja plastides, hambapastade komponendina ning ümbris- ja adsorbendina meditsiinis. | |
| 6. | Berülliumhüdroksiid | Kasutatakse tulekindla keraamika tootmiseks. tiiglid, klaaside komponent, mis laseb hästi UV-kiirgust läbi. | |
| 7. | Tina hüdroksiid | Kangaste, eriti siidi söövitamiseks. | |
| 8. | Pliihüdroksiid | Kangaste söövitamiseks, klaasi valmistamiseks, akutäiteks. | |
| 9. | Vismuthüdroksiid | Kasutatakse emailide ja keraamika, kristalli ja eritoodete valmistamisel. klaas, ultraheli materjalide tootmiseks | |
| 10. | Kroomhüdroksiid | Kasutatakse analüütilises keemias. | |
| 11. | Mangaanhüdroksiid | Kasutatakse mangaaniühendite saamiseks. | |
| 12. | Raudhüdroksiid | Metallraua tootmise alused, värvipigmendid |
Järeldus.
Vundamendid on üks klassidest anorgaanilised ained, mis koos hapete, oksiidide ja sooladega moodustab anorgaanilise keemia aluse. Neid kasutatakse laialdaselt erinevad valdkonnad keemia ja keemiatööstus. Nende abiga saadakse väetisi, Ehitusmaterjalid, värviline klaas. Ilma nendeta kaotaksime kerged ja ökonoomsed leelispatareid ning paljud meditsiinitarbed.
Selle töö ülesandeks oli süstematiseerida teadmisi selle anorgaanilise klassi kohta keemilised ained põhialustena oli vaja kokku viia nende keemiline ja füüsikalised omadused, nende tootmine ja kasutamine tööstuses.
Pooleli Erilist tähelepanu oli pühendatud Brønstedi, Lewise ja Izmailovi tänapäevastel happe-aluse teooriatel põhineva aluste mõiste esiletõstmisele, kui üks anorgaaniliste ainete klassidest. Usanovitš. Samuti peetakse silmas tööstuslikud meetodid leeliste saamine naatriumhüdroksiidi näitel [3, art. 36–42]. Palju tähelepanu makstakse aluste kasutamise meetoditele nii igapäevaelus kui ka keemia-, meditsiini- ja ehitustööstuses, kus need rakendust leiavad. Konkreetsete ainete peamised kasutusvaldkonnad on kasutusmugavuse huvides ära toodud spetsiaalses viitetabelis.
Aluste omaduste uurimisel on suur tähtsus keemiaõppes, samuti teadusliku maailmapildi kujundamiseks.
Kasutatud kirjanduse loetelu.
1. Glinka N. L. üldine keemia. – L.: Keemia, 1988. – 702 lk.
2. Kreshkov A.P., Jaroslavtsev A.A. Analüütilise keemia kursus. – M.: Keemia, 1964. – 430 lk.
3. Podobaev N. I. Elektrolüüs. – M.: Haridus, 1989, 100 lk.
4. Poolakad M. E. Analüütiline keemia. – M.: Meditsiin, 1981. – 286 lk.
5. Rabinovitš V. A., Khavin Z. Ya. Kratky keemia teatmeteos. – L.: Keemia, 1978. – 331 lk.
6. Keemia: Viiteväljaanne/ toim. W. Schröter, K.-H, Lautenschläger, H. Bibrak jt: Trans. temaga. – M.: Keemia, 1989. – 648 lk.
7. Keemia entsüklopeedia 5 köites / toim. I. L. Knunyants. – M.: Nõukogude entsüklopeedia, 1990.
8. Shchukarev S. A. Anorgaaniline keemia. – M.: lõpetanud kool, 1970. – 437 lk.
Hollandis, kus mõlemad riigid müüsid villa ja kus britid aitasid Hispaania ikke vastu mässanud Gueuze'i. Nendel tingimustel koos siis kiire areng kodanlikud suhted Inglismaal Uus Maailm- Hispaania tagaosa, rikkaim riigikassa ja kõige laiem turg - sai sihtmärgiks ja söödaks inglise seiklejatele, leidlikele Inglise kaupmehed ja härrased. Piraatlus vetes...
Puu. Pole mõtet kunstlikult üles puhuda öko- ja biotsentrismi vastuolusid. Palju otstarbekam on rääkida sellest, mis neid ühendab, mis on ühist, mis võib olla aluseks ühine platvorm keskkonnaeetika. Need on järgmised olulised punktid: 1) kõigel, indiviididel, elusolendiliikidel ja ökosüsteemidel on oma hüve, õigused, oma olemuslik väärtus, sest nad on väärtuslikud...
Nende 1,5% elanikkonnast. Seetõttu olen ma eemal küsimusest, mis on tugev ja mis nõrk kodanikuühiskond, liigun orgaaniliselt oma ajakavas neljanda küsimuse juurde - kodanikuühiskonnast ja majanduskasv. Seesama minu poolt juba mainitud kollektiivsete tegude teooria autor Mansur Olson küsis väga huvi Küsi– muide meie riigi kohta. Näost näkku ei näe. Meie...
Geoloogiat ja mullateadust õppides peame leppima sellega, et geomorfoloogia ülesanne on uurida ainult geomeetrilisi, kuid mitte materjali omadusi. maa pind. Matemaatilises sõnastuses tähendab see, et geomorfoloogia uurimisobjektiks tuleks pidada mitte hulga L piiri enda, vaid selle kaardistamist ruumi P, s.o. pind kolmemõõtmelises eukleidilises ruumis, prototüüp...
Aluste füüsikalised ja keemilised omadused. Ettevaatusabinõud leelistega töötamisel. Kontseptsioon amfoteersed hüdroksiidid
Vees lahustuvad alused (leelised) on tahked ained valge, vees hästi lahustuv. Kell toatemperatuuril Ca (OH)2 ja Sr (OH)2 lahustuvad halvasti. Vees lahustumatud alused on tahked ained, näiteks Al (OH)3 on valge, Cu (OH)2 sinine värv, Fe (OH)3 on pruuni värvi.
Lahustuvad ja lahustumatud alused neil on mitmeid ühiseid ja eristavaid keemilisi omadusi.
1. Leeliselahuste mõju indikaatorlahustele (tüüpiline ainult leeliste puhul). Leelislahuses on lakmusel ja universaalsel indikaatorpaberil sinine värv, metüüloranž on oranžikaskollane ja fenoolftaleiin karmiinpunane.
2. Aluste interaktsioon hapetega, moodustades soola ja vee - neutraliseerimisreaktsioon (iseloomulik mõlemale lahustuvad alused, ja lahustumatud):
KOH + HCl = KCl + H2O
3. Aluste koostoime happeoksiididega soola ja vee moodustumisel (tüüpiline ainult leeliste puhul):
2NaOH + CO2 = Na2CO3 + H2O
4. Aluste interaktsioon soolalahustega teise aluse ja teise soola moodustamiseks (tüüpiline ainult leeliste puhul):
2KOH + CuSO4 = K2SO4 + Cu (OH)2¯
Leeliselahusega reageeriva soola koostis peab sisaldama metalli, mis on võimeline moodustama lahustumatut alust.
5. Lahustumatute aluste lagunemine kuumutamisel oksiidi ja vee moodustumisega (iseloomulik ainult lahustumatutele alustele):
2Fe (OH)3 Fe2O3 + 3H2O
Leelistega töötades peaksite olema väga ettevaatlik, kuna heinamaad sisaldavad väga agressiivseid aineid. Kui leeliselahus satub nahale, tuleb see koheselt maha pesta jooksva veega, kuni magusaisu tunne kaob, seejärel loputada (neutraliseerida) nõrga happe (äädik- või boorhappe) lahusega ja pöörduda meditsiinikeskusesse.
Oleme juba avastanud, et alused reageerivad hapetega neutraliseerimisreaktsioonis, moodustades soolasid. Alused alustega, samuti happed hapetega, ei osale neutraliseerimisreaktsioonis. Kuid on hüdroksiide, mis reageerivad nii hapete kui ka alustega, moodustades sooli. Selliseid hüdroksiide nimetatakse amfoteerseteks. Amfoteersed hüdroksiidid avaldavad aluste omadusi reaktsioonides hapetega ja hapete omadusi reaktsioonides alustega. Kõik amfoteersed hüdroksiidid lahustuvad vees halvasti. Nende hulka kuuluvad tsinkhüdroksiid Zn (OH) 2, alumiiniumhüdroksiid Al (OH) 3, berülliumhüdroksiid Be (OH) 2, kroom (III) hüdroksiid Cr (OH) 3, raud (III) hüdroksiid Fe (OH) 3 ja teised. Vaatleme amfoteersete hüdroksiidide keemilisi omadusi, kasutades näitena tsinkhüdroksiidi.
1. Reaktsioon happega soola ja vee moodustumiseks:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2. Koostoime leelisega soola ja vee moodustumisel:
Zn(OH)2 + 2NaOH Na2ZnO2 + 2H2O
1. Alused reageerivad hapetega, moodustades soola ja vett:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
2. Happeoksiididega, moodustades soola ja vett:
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
3. Leelised reageerivad amfoteersete oksiidide ja hüdroksiididega, moodustades soola ja vee:
2NaOH + Cr2O3 = 2NaCrO2 + H2O
KOH + Cr(OH) 3 = KCrO 2 + 2H 2 O
4. Leelised reageerivad lahustuvate sooladega, moodustades nõrga aluse, sademe või gaasi:
2NaOH + NiCl2 = Ni(OH)2¯ + 2NaCl
alus
2KOH + (NH4)2SO4 = 2NH3 + 2H2O + K2SO4
Ba(OH)2 + Na2CO3 = BaCO3¯ + 2NaOH
5. Leelised reageerivad mõne metalliga, mis vastavad amfoteersetele oksiididele:
2NaOH + 2Al + 6H2O = 2Na + 3H2
6. Leelise mõju indikaatorile:
Oh - + fenoolftaleiin ® karmiinpunane värv
Oh - + lakmus ® Sinine värv
7. Mõnede aluste lagunemine kuumutamisel:
Сu(OH)2® CuO + H2O
Amfoteersed hüdroksiidid – keemilised ühendid, millel on nii aluste kui hapete omadused. Amfoteersed hüdroksiidid vastavad amfoteersetele oksiididele (vt punkt 3.1).
Amfoteersed hüdroksiidid on tavaliselt kirjutatud aluse kujul, kuid neid võib esitada ka happe kujul:
Zn(OH)2Û H2ZnO2
sihtasutus
Keemilised omadused amfoteersed hüdroksiidid
1. Amfoteersed hüdroksiidid interakteeruvad hapete ja happeoksiididega:
Be(OH)2 + 2HCl = BeCl2 + 2H2O
Be(OH)2 + SO3 = BeSO4 + H2O
2. Suhelge leeliste ja aluselised oksiidid aluseline ja leelismuldmetallid:
Al(OH)3 + NaOH = NaAlO2 + 2H2O;
H 3 AlO 3 happeline naatriummetaluminaat
(H 3 AlO 3 ® HAlO 2 + H 2 O)
2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
Kõik amfoteersed hüdroksiidid on nõrgad elektrolüüdid
soolad
soolad- See komplekssed ained, mis koosneb metalliioonidest ja happejäägist. Soolad on vesinikuioonide täieliku või osalise asendamise saadused metalli- (või ammooniumi-) ioonidega hapetes. Soolade tüübid: keskmised (normaalsed), happelised ja aluselised.
Keskmised soolad- need on vesiniku katioonide täieliku asendamise tooted hapetes metalli- (või ammooniumi) ioonidega: Na 2 CO 3, NiSO 4, NH 4 Cl jne.
Keskmiste soolade keemilised omadused
1. Soolad interakteeruvad hapete, leeliste ja muude sooladega, moodustades nõrga elektrolüüdi või sademe; või gaas:
Ba(NO 3) 2 + H 2 SO 4 = BaSO 4 ¯ + 2HNO 3
Na2SO4 + Ba(OH)2 = BaSO 4¯ + 2NaOH
CaCl 2 + 2AgNO 3 = 2AgCl¯ + Ca(NO 3) 2
2CH 3 COONa + H 2 SO 4 = Na 2 SO 4 + 2 CH 3 COOH
NiSO4 + 2KOH = Ni(OH)2¯ + K2SO4
alus
NH 4 NO 3 + NaOH = NH 3 + H 2 O + NaNO 3
2. Soolad suhtlevad aktiivsemate metallidega. Rohkem aktiivne metall tõrjub soolalahusest välja vähemaktiivse (lisa 3).
Zn + CuSO 4 = ZnSO 4 + Cu
Happe soolad - need on vesiniku katioonide mittetäieliku asendamise tooted hapetes metalli- (või ammooniumi) ioonidega: NaHCO 3, NaH 2 PO 4, Na 2 HPO 4 jne. Happesooli saavad moodustada ainult mitmealuselised happed. Peaaegu kõik happesoolad lahustuvad vees hästi.
Happeliste soolade saamine ja nende muutmine keskmisteks sooladeks
1. Happesoolad saadakse happe või happeoksiidi liia reageerimisel alusega:
H 2 CO 3 + NaOH = NaHCO 3 + H 2 O
CO 2 + NaOH = NaHCO 3
2. Kui liigne hape interakteerub aluselise oksiidiga:
2H 2CO 3 + CaO = Ca(HCO 3) 2 + H 2 O
3. Happesoolad saadakse keskmistest sooladest happe lisamisega:
· samanimeline
Na2S03 + H2S03 = 2NaHS03;
Na2SO3 + HCl = NaHS03 + NaCl
4. Happesoolad muundatakse leelise abil keskmisteks sooladeks:
NaHCO 3 + NaOH = Na 2 CO 3 + H 2 O
Aluselised soolad– need on hüdroksorühmade mittetäieliku asendusproduktid (OH - ) põhjustel happejääk: MgOHCl, AlOHSO 4 jne. Aluselisi sooli saab moodustada ainult mitmevalentsete metallide nõrkadest alustest. Need soolad on üldiselt halvasti lahustuvad.
Aluseliste soolade saamine ja nende muutmine keskmisteks sooladeks
1. Aluselised soolad saadakse aluse liia reageerimisel happega või happe oksiid:
Mg(OH)2 + HCl = MgOHCl¯ + H2O
hüdrokso-
magneesiumkloriid
Fe(OH)3 + SO3 = FeOHSO4¯ + H2O
hüdrokso-
raud(III)sulfaat
2. Aluselised soolad moodustuvad keskmisest soolast leelisepuuduse lisamisega:
Fe 2 (SO 4) 3 + 2NaOH = 2FeOHSO 4 + Na 2 SO 4
3. Aluselised soolad muudetakse keskmisteks sooladeks happe (eelistatavalt soolale vastava) lisamisega:
MgOHCl + HCl = MgCl 2 + H 2 O
2MgOHCl + H2SO4 = MgCl2 + MgSO4 + 2H2O
ELEKTROLÜIDID
Elektrolüüdid- need on ained, mis lahuses lagunevad ioonideks polaarsete lahustimolekulide (H 2 O) mõjul. Elektrolüüdid jagunevad dissotsieerumisvõime (ioonideks lagunemise) alusel tinglikult tugevateks ja nõrkadeks. Tugevad elektrolüüdid dissotsieeruvad peaaegu täielikult (lahjendatud lahustes), samas kui nõrgad elektrolüüdid dissotsieeruvad ioonideks ainult osaliselt.
TO tugevad elektrolüüdid seotud:
· tugevad happed(vt lk 20);
· tugevad põhjused– leelised (vt lk 22);
· peaaegu kõik lahustuvad soolad.
Nõrgad elektrolüüdid hõlmavad järgmist:
· nõrgad happed(vt lk 20);
· alused ei ole leelised;
Nõrga elektrolüüdi üks peamisi omadusi on dissotsiatsioonikonstant – TO . Näiteks ühealuselise happe puhul
HA Û H + +A - ,
kus on H + ioonide tasakaalukontsentratsioon;
– happeanioonide tasakaalukontsentratsioon A - ;
– happemolekulide tasakaalukontsentratsioon,
Või eest nõrk vundament,
MOH ja M + +OH - ,
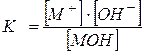 ,
,
kus M + katioonide tasakaalukontsentratsioon;
– hüdroksiidioonide tasakaalukontsentratsioon OH - ;
– nõrkade alusmolekulide tasakaalukontsentratsioon.
Mõne dissotsiatsioonikonstandid nõrgad elektrolüüdid(temperatuuril t = 25 °С)
| Aine | TO | Aine | TO |
| HCOOH | K = 1,8 × 10 -4 | H3PO4 | K 1 = 7,5 × 10 -3 |
| CH3COOH | K = 1,8 × 10 -5 | K 2 = 6,3 × 10 -8 | |
| HCN | K = 7,9 × 10 -10 | K 3 = 1,3 × 10 -12 | |
| H2CO3 | K 1 = 4,4 × 10 -7 | HClO | K = 2,9 × 10 -8 |
| K2 = 4,8 × 10 -11 | H3BO3 | K 1 = 5,8 × 10 -10 | |
| HF | K = 6,6 × 10 -4 | K2 = 1,8 × 10 -13 | |
| HNO2 | K = 4,0 × 10 -4 | K 3 = 1,6 × 10 -14 | |
| H2SO3 | K 1 = 1,7 × 10 -2 | H2O | K = 1,8 × 10 -16 |
| K 2 = 6,3 × 10 -8 | NH3 × H2O | K = 1,8 × 10 -5 | |
| H2S | K 1 = 1,1 × 10 -7 | Al(OH)3 | K 3 = 1,4 × 10 -9 |
| K2 = 1,0 × 10 -14 | Zn(OH)2 | K 1 = 4,4 × 10 -5 | |
| H2SiO3 | K 1 = 1,3 × 10 -10 | K 2 = 1,5 × 10 -9 | |
| K2 = 1,6 × 10 -12 | Cd(OH)2 | K 2 = 5,0 × 10 -3 | |
| Fe(OH)2 | K 2 = 1,3 × 10 -4 | Cr(OH)3 | K 3 = 1,0 × 10 -10 |
| Fe(OH)3 | K2 = 1,8 × 10 -11 | Ag(OH) | K = 1,1 × 10 -4 |
| K 3 = 1,3 × 10 -12 | Pb(OH)2 | K 1 = 9,6 × 10 -4 | |
| Cu(OH)2 | K 2 = 3,4 × 10 -7 | K 2 = 3,0 × 10 -8 | |
| Ni(OH)2 | K 2 = 2,5 × 10 -5 |
