II.1. អនុលោមភាព (អ៊ីសូមេរនិយមបង្វិល)
ការផ្លាស់ប្តូរពីអ៊ីដ្រូកាបូនសរីរាង្គសាមញ្ញបំផុត - មេតាន ទៅជាភាពស្រដៀងគ្នាជិតបំផុតរបស់វា - អេតាន - បង្កបញ្ហានៃរចនាសម្ព័ន្ធលំហ សម្រាប់ដំណោះស្រាយដែលវាមិនគ្រប់គ្រាន់ដើម្បីដឹងពីប៉ារ៉ាម៉ែត្រដែលបានពិភាក្សានៅក្នុងផ្នែក។ ជាការពិត ដោយគ្មានការផ្លាស់ប្តូរទាំងមុំចំណង ឬប្រវែងចំណង មនុស្សម្នាក់អាចស្រមៃមើលទម្រង់ធរណីមាត្រជាច្រើននៃម៉ូលេគុលអេតាន ដែលខុសគ្នាពីគ្នាទៅវិញទៅមកក្នុងការបង្វិលគ្នាទៅវិញទៅមកនៃកាបូន tetrahedra ជុំវិញចំណង C-C ដែលភ្ជាប់ពួកវា។ ជាលទ្ធផលនៃការបង្វិលនេះ, អ៊ីសូម័ររ៉ូតារីស (Conformers) . ថាមពលនៃ conformers ផ្សេងគ្នាគឺមិនដូចគ្នាទេប៉ុន្តែរបាំងថាមពលបំបែក isomers បង្វិលផ្សេងគ្នាសម្រាប់ភាគច្រើន សមាសធាតុសរីរាង្គតូច។ ដូច្នេះនៅពេល លក្ខខណ្ឌធម្មតា។តាមក្បួនវាមិនអាចទៅរួចទេក្នុងការជួសជុលម៉ូលេគុលនៅក្នុងការអនុលោមតាមដែលបានកំណត់យ៉ាងតឹងរ៉ឹងមួយ: ជាធម្មតាទម្រង់បង្វិលជាច្រើនដែលងាយស្រួលបំលែងទៅជាគ្នាទៅវិញទៅមករួមរស់ក្នុងលំនឹង។
វិធីសាស្ត្រសម្រាប់បង្ហាញការអនុលោមតាមក្រាហ្វិក និងនាមត្រកូលមានដូចខាងក្រោម។ ចូរចាប់ផ្តើមជាមួយនឹងម៉ូលេគុលអេតាន។ សម្រាប់វា មនុស្សម្នាក់អាចព្យាករណ៍ពីអត្ថិភាពនៃការអនុលោមតាមពីរដែលខុសគ្នាខ្លាំងបំផុតនៅក្នុងថាមពល។ ពួកគេត្រូវបានបង្ហាញដូចខាងក្រោម ការព្យាករណ៍ទស្សនវិស័យ (1) ("ពពែ sawmill"), ការព្យាករណ៍នៅពេលក្រោយ (2) និង រូបមន្តរបស់ Newman (3).
នៅក្នុងការព្យាករទស្សនវិស័យ (1a, 1b) ការតភ្ជាប់ C-C ត្រូវតែត្រូវបានស្រមៃចូលទៅក្នុងចម្ងាយ; អាតូមកាបូននៅខាងឆ្វេងគឺនៅជិតអ្នកសង្កេត ហើយអាតូមកាបូននៅខាងស្តាំគឺឆ្ងាយពីគាត់។
នៅក្នុងការព្យាករក្រោយ (2a, 2b) អាតូម H បួនស្ថិតនៅក្នុងយន្តហោះនៃគំនូរ។ អាតូមកាបូនពិតជាលាតសន្ធឹងបន្តិចចេញពីយន្តហោះនេះ ប៉ុន្តែជាធម្មតាពួកវាត្រូវបានចាត់ទុកថាសាមញ្ញនៅក្នុងយន្តហោះនៃគំនូរផងដែរ។ ចំណងរាងក្រូចឆ្មារ "ដិត" ដោយការឡើងក្រាស់នៃក្រូចឆ្មារ បង្ហាញពីការចាកចេញពីយន្តហោះឆ្ពោះទៅរកអ្នកសង្កេតមើលអាតូមដែលការឡើងក្រាស់កំពុងប្រឈមមុខ។ ការតភ្ជាប់រាងជាក្រូចឆ្មារដែលមានសញ្ញាដាច់ ៗ សម្គាល់ចម្ងាយពីអ្នកសង្កេត។
នៅក្នុងការព្យាកររបស់ Newman (3a, 3b) ម៉ូលេគុលត្រូវបានពិចារណាតាមចំណង C-C (ក្នុងទិសដៅដែលបង្ហាញដោយព្រួញក្នុងរូបមន្ត 1a, b)។ បន្ទាត់បីដែលបង្វែរនៅមុំ 120° ពីកណ្តាលរង្វង់បង្ហាញពីចំណងនៃអាតូមកាបូនដែលនៅជិតអ្នកសង្កេត។ បន្ទាត់ "លេចចេញ" ពីខាងក្រោយរង្វង់គឺជាចំណងនៃអាតូមកាបូនឆ្ងាយ។
ទម្រង់ដែលបង្ហាញនៅខាងឆ្វេងត្រូវបានគេហៅថា បិទបាំង ៖ ឈ្មោះនេះរំលឹកយើងថា អាតូមអ៊ីដ្រូសែននៃក្រុម CH 3 ទាំងពីរគឺទល់មុខគ្នា។ ការអនុលោមតាមសូរ្យគ្រាសបានបង្កើនថាមពលខាងក្នុងហើយដូច្នេះវាមិនអំណោយផល។ ការអនុលោមតាមដែលបានបង្ហាញនៅខាងស្តាំត្រូវបានគេហៅថា រារាំង ដោយបង្កប់ន័យថាការបង្វិលដោយឥតគិតថ្លៃជុំវិញចំណង C-C ត្រូវបាន "ហាមឃាត់" នៅក្នុងទីតាំងនេះ i.e. ម៉ូលេគុលមានភាគច្រើននៅក្នុងការអនុលោមតាមនេះ។
ថាមពលអប្បបរមាដែលត្រូវការដើម្បីបង្វិលម៉ូលេគុលទាំងស្រុងជុំវិញចំណងជាក់លាក់មួយត្រូវបានគេហៅថា របាំងបង្វិល សម្រាប់ការតភ្ជាប់នេះ។ របាំងបង្វិលនៅក្នុងម៉ូលេគុលដូចជាអេតានអាចត្រូវបានបញ្ជាក់នៅក្នុងលក្ខខណ្ឌនៃការផ្លាស់ប្តូរ ថាមពលសក្តានុពលម៉ូលេគុលជាមុខងារនៃការផ្លាស់ប្តូរ dihedral (torsion) មុំ ប្រព័ន្ធ។ មុំ dihedral (បញ្ជាក់ tau) ត្រូវបានបង្ហាញក្នុងរូបភាពខាងក្រោម៖

ទម្រង់ថាមពលនៃការបង្វិលជុំវិញ C-C bond នៅក្នុង ethane ត្រូវបានបង្ហាញក្នុងរូបខាងក្រោម។ ការបង្វិលនៃអាតូមកាបូន "ត្រឡប់មកវិញ" ត្រូវបានបង្ហាញដោយការផ្លាស់ប្តូរ មុំ dihedralរវាងអាតូមអ៊ីដ្រូសែនពីរដែលបានបង្ហាញ។ សម្រាប់ភាពសាមញ្ញ អាតូមអ៊ីដ្រូសែនដែលនៅសល់ត្រូវបានលុបចោល។ របាំងបង្វិលដែលបំបែកទម្រង់ទាំងពីរនៃអេតានគឺត្រឹមតែ 3 kcal/mol (12.6 kJ/mol) ប៉ុណ្ណោះ។ អប្បបរមានៃខ្សែកោងថាមពលដែលមានសក្តានុពលត្រូវគ្នាទៅនឹងការអនុលោមតាមដែលរារាំង ហើយអតិបរមាត្រូវគ្នាទៅនឹងការអនុលោមភាពដែលបិទ។ ដោយសារនៅសីតុណ្ហភាពបន្ទប់ ថាមពលនៃការប៉ះទង្គិចម៉ូលេគុលខ្លះអាចឡើងដល់ 20 kcal/mol (ប្រហែល 80 kJ/mol) របាំងនៃ 12.6 kJ/mol នេះត្រូវបានយកឈ្នះយ៉ាងងាយស្រួល ហើយការបង្វិលនៅក្នុង ethane ត្រូវបានគេចាត់ទុកថាមិនគិតថ្លៃ។
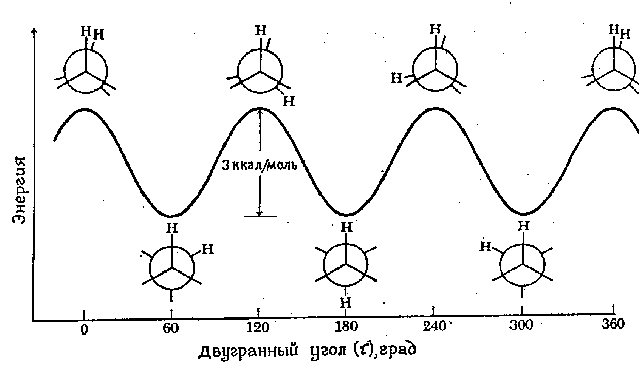
យើងសង្កត់ធ្ងន់ថាចំណុចនីមួយៗនៅលើខ្សែកោងថាមពលសក្តានុពលត្រូវគ្នាទៅនឹងការអនុលោមតាមជាក់លាក់មួយ។ ចំនុចដែលត្រូវគ្នានឹង minima ត្រូវគ្នាទៅនឹង isomers conformational នោះគឺ សមាសធាតុលេចធ្លោនៅក្នុងល្បាយនៃទម្រង់ដែលអាចកើតមានទាំងអស់។ .
នៅពេលដែលម៉ូលេគុលកាន់តែស្មុគ្រស្មាញ ចំនួននៃការអនុលោមតាមដែលអាចកើតមានដែលខុសគ្នាខ្លាំងនៅក្នុងថាមពលកើនឡើង។ បាទ សម្រាប់ ន-butane អាចត្រូវបានបង្ហាញជាទម្រង់ប្រាំមួយផ្សេងគ្នា ទីតាំងដែលទាក់ទងក្រុម CH 3, i.e. ការបង្វិលជុំវិញការតភ្ជាប់កណ្តាល C-C ។ ខាងក្រោមនេះ ការអនុលោមតាម n-butane ត្រូវបានបង្ហាញជាការព្យាករណ៍របស់ Newman ។ ការអនុលោមតាមដែលបានបង្ហាញនៅខាងឆ្វេង (ស្រមោល) គឺមានភាពស្វាហាប់មិនអំណោយផលទេមានតែការរារាំងប៉ុណ្ណោះដែលត្រូវបានអនុវត្តជាក់ស្តែង។
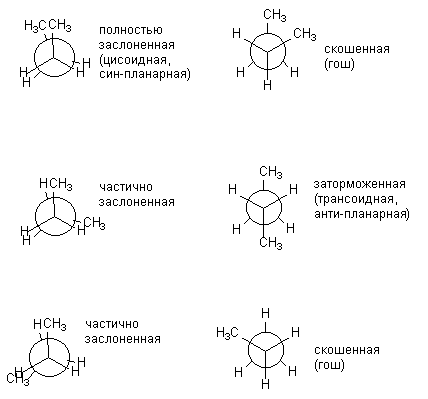
ការអនុលោមតាម eclipsed និង inhibited ផ្សេងៗនៃ butane មិនដូចគ្នានៅក្នុងថាមពលទេ។ ថាមពលដែលត្រូវគ្នានៃការអនុលោមភាពទាំងអស់ដែលបានបង្កើតឡើងកំឡុងពេលបង្វិលជុំវិញចំណង C-C កណ្តាលត្រូវបានបង្ហាញដូចខាងក្រោម:
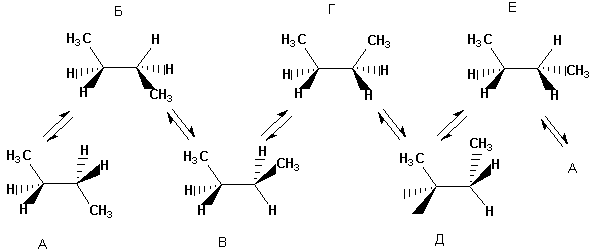


នៅពេលដែលម៉ូលេគុលកាន់តែស្មុគស្មាញ ចំនួននៃការអនុលោមតាមដែលអាចកើតមានកើនឡើង។
ដូច្នេះការអនុលោមភាពគឺខុសគ្នាមិនដូចគ្នា។ ទម្រង់លំហម៉ូលេគុលដែលមានការកំណត់រចនាសម្ព័ន្ធជាក់លាក់។ Conformers គឺជារចនាសម្ព័ន្ធស្តេរ៉េអូអ៊ីសូមិច ដែលស្ថិតនៅក្នុងលំនឹងចល័ត និងមានសមត្ថភាពបំប្លែងអន្តរកម្មដោយការបង្វិលជុំវិញចំណងសាមញ្ញ។
ជួនកាល ឧបសគ្គចំពោះការបំប្លែងបែបនេះ ឡើងខ្ពស់ល្មមដើម្បីបំបែកទម្រង់ស្តេរ៉េអូអ៊ីសូមិក (ឧទាហរណ៍៖ ប៊ីហ្វីនីលសកម្មអុបទិក;)។ ក្នុងករណីបែបនេះ ពួកគេលែងនិយាយអំពីអ្នកអនុលោមទៀតហើយ ប៉ុន្តែអំពីការពិតដែលមានស្រាប់ ស្តេរ៉េអូអ៊ីសូមឺរ .
II.២. ធរណីមាត្រ isomerism
ផលវិបាកសំខាន់នៃភាពរឹងនៃចំណងទ្វេ (អវត្ដមាននៃការបង្វិលជុំវិញវា) គឺជាអត្ថិភាព isomers ធរណីមាត្រ . ទូទៅបំផុតនៃពួកគេគឺ cis-trans isomers សមាសធាតុនៃស៊េរីអេទីឡែនដែលមានសារធាតុជំនួសមិនស្មើគ្នានៅលើអាតូមមិនឆ្អែត។ ឧទាហរណ៍សាមញ្ញបំផុតគឺ isomers នៃ butene-2 ។

isomers ធរណីមាត្រមានដូចគ្នា។ រចនាសម្ព័ន្ធគីមី(លំដាប់ដូចគ្នា។ ចំណងគីមី) ខុសគ្នាក្នុងការរៀបចំលំហនៃអាតូម ការកំណត់រចនាសម្ព័ន្ធ . ភាពខុសគ្នានេះបង្កើតភាពខុសគ្នានៅក្នុងរូបរាងកាយ (ក៏ដូចជា លក្ខណៈសម្បត្តិគីមី) isomers ធរណីមាត្រ, ផ្ទុយទៅនឹង conformers, អាចត្រូវបានដាច់ឆ្ងាយនៅក្នុង ទម្រង់បរិសុទ្ធនិងមានជាបុគ្គល សារធាតុមានស្ថេរភាព។ ការផ្លាស់ប្តូរទៅវិញទៅមករបស់ពួកគេជាធម្មតាតម្រូវឱ្យមានថាមពលនៃលំដាប់នៃ 125-170 kJ / mol (30-40 kcal / mol) ។ ថាមពលនេះអាចត្រូវបានចែកចាយដោយកំដៅ ឬវិទ្យុសកម្ម។
ក្នុងករណីសាមញ្ញបំផុត នាមត្រកូលនៃ isomers ធរណីមាត្រមិនបង្ហាញពីការលំបាកណាមួយឡើយ៖ ស៊ីស- ទម្រង់គឺជា isomers ធរណីមាត្រដែលសារធាតុជំនួសដូចគ្នាបេះបិទនៅលើផ្នែកដូចគ្នានៃយន្តហោះចំណង pi, អន្លង់- isomers មានសារធាតុជំនួសដូចគ្នាបេះបិទ ភាគីផ្សេងគ្នាពីយន្តហោះចំណង pi ។ ក្នុងករណីស្មុគស្មាញជាងនេះវាត្រូវបានប្រើ Z, អ៊ី-នាមវលី . គោលការណ៍សំខាន់របស់វា៖ ដើម្បីបង្ហាញពីការកំណត់រចនាសម្ព័ន្ធ ស៊ីស-(Z, មកពីអាឡឺម៉ង់ Zusammen - រួមគ្នា) ឬ អន្លង់-(អ៊ី ពីអាឡឺម៉ង់ Entgegen - ទល់មុខ) ទីតាំង តំណាងជាន់ខ្ពស់ ជាមួយនឹងចំណងទ្វេ។
នៅក្នុងប្រព័ន្ធ Z,E សារធាតុជំនួសដែលមានចំនួនអាតូមិកខ្ពស់ជាងត្រូវបានចាត់ទុកថាជាជាន់ខ្ពស់។ ប្រសិនបើអាតូមដែលទាក់ទងដោយផ្ទាល់ជាមួយកាបូនមិនឆ្អែតគឺដូចគ្នា នោះពួកវាបន្តទៅ "ស្រទាប់ទីពីរ" បើចាំបាច់ - ទៅ "ស្រទាប់ទីបី" ។ល។
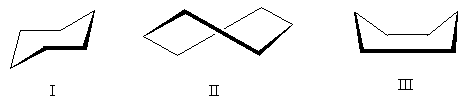
ចូរយើងពិចារណាការអនុវត្តច្បាប់នៃ Z, E-nomenclature ដោយប្រើឧទាហរណ៍ពីរ។

| ខ្ញុំ | II |
ចូរចាប់ផ្តើមជាមួយរូបមន្ត I ដែលអ្វីៗត្រូវបានដោះស្រាយដោយអាតូមនៃ "ស្រទាប់ទីមួយ" ។ ដោយបានរៀបចំលេខអាតូមរបស់ពួកគេ យើងឃើញថា សារធាតុជំនួសជាន់ខ្ពស់នៃគូនីមួយៗ (ប្រូមីននៅផ្នែកខាងលើនៃរូបមន្ត និងអាសូតនៅផ្នែកខាងក្រោម) គឺស្ថិតនៅក្នុង ត្រេកត្រអាល។- ទីតាំង ដូច្នេះការកំណត់ស្តេរ៉េអូគីមី E:
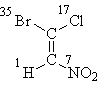 អ៊ី-១-ប្រូម៉ូ-១-ក្លរ៉ូ-២-នីត្រូអេទីន
អ៊ី-១-ប្រូម៉ូ-១-ក្លរ៉ូ-២-នីត្រូអេទីន
ដើម្បីកំណត់រចនាសម្ព័ន្ធស្តេរ៉េអូគីមីនៃរចនាសម្ព័ន្ធ II វាចាំបាច់ត្រូវរកមើលភាពខុសគ្នានៅក្នុង "ស្រទាប់ខ្ពស់ជាង" ។ នៅក្នុងស្រទាប់ទីមួយ ក្រុម CH 3, C 2 H 5, C 3 H 7 មិនខុសគ្នាទេ។ នៅក្នុងស្រទាប់ទីពីរក្រុម CH មាន 3 ផលបូក លេខអាតូមិចគឺស្មើនឹងបី (អាតូមអ៊ីដ្រូសែនបី) ក្រុម C 2 H 5 និង C 3 H 7 មាន 8 នីមួយៗ នេះមានន័យថាក្រុម CH 3 មិនត្រូវបានពិចារណាទេ - វាក្មេងជាងក្រុមពីរផ្សេងទៀត។ ដូច្នេះក្រុមជាន់ខ្ពស់គឺ C 2 H 5 និង C 3 H 7 វាស្ថិតនៅក្នុង ស៊ីស- ទីតាំង; ការកំណត់ស្តេរ៉េអូគីមី Z.
 Z-3-methylheptene-3
Z-3-methylheptene-3
ប្រសិនបើវាចាំបាច់ដើម្បីកំណត់ថាក្រុមណាចាស់ជាង - C 2 H 5 ឬ C 3 H 7 មួយនឹងត្រូវទៅអាតូមនៃ "ស្រទាប់ទីបី" ផលបូកនៃចំនួនអាតូមនៅក្នុងស្រទាប់នេះសម្រាប់ក្រុមទាំងពីរនឹងស្មើគ្នា ទៅ 3 និង 8 រៀងគ្នា i.e. C3H7 ចាស់ជាង C2H5 ។ ក្នុងករណីស្មុគ្រស្មាញបន្ថែមទៀតនៃការកំណត់អាទិភាព លក្ខខណ្ឌបន្ថែមត្រូវតែយកមកពិចារណា ដូចជា៖ អាតូមដែលតភ្ជាប់ដោយចំណងទ្វេត្រូវបានរាប់ពីរដង តភ្ជាប់ដោយចំណងបីដង - បីដង; ក្នុងចំណោមអ៊ីសូតូប ធ្ងន់ជាងគឺចាស់ជាង (deuterium ចាស់ជាងអ៊ីដ្រូសែន) និងមួយចំនួនផ្សេងទៀត។
ចំណាំថាសញ្ញា Z ទេ។ គឺជាសទិសន័យ ស៊ីស-ការរចនាដូចជាការរចនា E មិនតែងតែត្រូវគ្នានឹងទីតាំងនោះទេ។ អន្លង់-, ឧទាហរណ៍៖

ស៊ីស- 1,2-dichloropropene-1 ស៊ីស- 1,2-dichloro-1-bromopropene-1
Z-1,2-dichloropropene-1 E-1,2-dichloro-1-bromopropene-1
គ្រប់គ្រងភារកិច្ច
1. Bombicol - pheromone (ទាក់ទាញផ្លូវភេទ) នៃដង្កូវនាង - គឺ E-10-Z-12-hexadecadienol-1 ។ រូបភាពគាត់ រូបមន្តរចនាសម្ព័ន្ធ.
2. ដាក់ឈ្មោះសមាសធាតុខាងក្រោមដោយប្រើឈ្មោះ Z,E៖

II.៣. អ៊ីសូមឺរីមអុបទិក (អ៊ីសូមេរនិយម)
ក្នុងចំណោមសមាសធាតុសរីរាង្គមានសារធាតុដែលអាចបង្វិលប្លង់ប៉ូលនៃពន្លឺ។ បាតុភូតនេះត្រូវបានគេហៅថាសកម្មភាពអុបទិកហើយសារធាតុដែលត្រូវគ្នាគឺ សកម្មអុបទិក . សារធាតុសកម្មអុបទិកកើតឡើងជាគូ ថ្នាំប្រឆាំងអុបទិក - isomers លក្ខណៈរូបវន្ត និងគីមីដែលដូចគ្នាបេះបិទនៅក្រោមលក្ខខណ្ឌធម្មតា លើកលែងតែរឿងមួយ - សញ្ញានៃការបង្វិលនៃប្លង់ប៉ូល (ឧទាហរណ៍ប្រសិនបើឧបករណ៍ប្រឆាំងអុបទិកមួយមាន ការបង្វិលជាក់លាក់ [ចំណាំ 1] +20 o បន្ទាប់មកមួយទៀតមានការបង្វិលជាក់លាក់នៃ -20 o) ។
II.៤. រូបមន្តព្យាករណ៍
ដើម្បីពណ៌នាអាតូម asymmetric តាមធម្មតានៅលើយន្តហោះ សូមប្រើ រូបមន្តព្យាករណ៍របស់ E. Fisher . ពួកវាត្រូវបានទទួលដោយការបញ្ចាំងទៅលើយន្តហោះនូវអាតូមដែលអាតូម asymmetric ត្រូវបានភ្ជាប់។ ក្នុងករណីនេះ អាតូម asymmetric ជាធម្មតាត្រូវបានលុបចោល ដោយរក្សាបានតែបន្ទាត់ប្រសព្វ និងនិមិត្តសញ្ញាជំនួសប៉ុណ្ណោះ។ ដើម្បីចងចាំការរៀបចំលំហនៃធាតុជំនួស បន្ទាត់បញ្ឈរដែលខូចតែងតែត្រូវបានរក្សាទុកក្នុងទម្រង់ការព្យាករ (ធាតុជំនួសខាងលើ និងខាងក្រោមត្រូវបានដកចេញលើសពីប្លង់នៃគំនូរ) ប៉ុន្តែជារឿយៗវាមិនត្រូវបានធ្វើនោះទេ។ ខាងក្រោម វិធីផ្សេងៗការកត់ត្រារូបមន្តព្យាករដែលត្រូវគ្នានឹងគំរូខាងឆ្វេងក្នុងរូបមុន៖

នេះគឺជាឧទាហរណ៍មួយចំនួននៃរូបមន្តព្យាករណ៍៖

(+)-អាឡានីន (-)-butanol (+)-glyceraldehyde
ឈ្មោះនៃសារធាតុបង្ហាញពីសញ្ញានៃការបង្វិលរបស់វា៖ នេះមានន័យថាជាឧទាហរណ៍ថាអង់ទីប៉ូតខាងឆ្វេងនៃ butanol-2 មាន ការកំណត់រចនាសម្ព័ន្ធលំហ ត្រូវបានបង្ហាញយ៉ាងជាក់លាក់ដោយរូបមន្តខាងលើ ហើយរូបភាពកញ្ចក់របស់វាត្រូវគ្នាទៅនឹង dextrorotatory butanol-2 ។ ការកំណត់រចនាសម្ព័ន្ធ ឧបករណ៍ប្រឆាំងអុបទិកត្រូវបានអនុវត្តដោយពិសោធន៍ [ចំណាំ 3] ។
ជាគោលការណ៍ អង្គបដិបក្ខអុបទិកនីមួយៗអាចត្រូវបានបង្ហាញដោយរូបមន្តព្យាករចំនួនដប់ពីរ (!) ផ្សេងៗគ្នា អាស្រ័យលើរបៀបដែលគំរូត្រូវបានដាក់ក្នុងពេលព្យាករ និងពីផ្នែកណាដែលយើងមើលវា។ ដើម្បីធ្វើឱ្យទម្រង់ការព្យាករមានស្តង់ដារ ច្បាប់មួយចំនួនសម្រាប់ការសរសេរពួកវាត្រូវបានណែនាំ។ ដូច្នេះមុខងារចម្បងប្រសិនបើវានៅចុងបញ្ចប់នៃខ្សែសង្វាក់ជាធម្មតាត្រូវបានដាក់នៅផ្នែកខាងលើខ្សែសង្វាក់សំខាន់ត្រូវបានបង្ហាញបញ្ឈរ។
ដើម្បីប្រៀបធៀបរូបមន្តព្យាករដែលបានសរសេរ "មិនស្តង់ដារ" អ្នកត្រូវដឹង អនុវត្តតាមច្បាប់បំរែបំរួលនៃទម្រង់ការព្យាករណ៍។
1. រូបមន្តអាចត្រូវបានបង្វិល 180° នៅក្នុងយន្តហោះគំនូរដោយមិនផ្លាស់ប្តូរអត្ថន័យ stereochemical របស់ពួកគេ៖

2. ការរៀបចំឡើងវិញពីរ (ឬលេខគូណាមួយ) នៃសារធាតុជំនួសនៅលើអាតូម asymmetric មួយមិនផ្លាស់ប្តូរអត្ថន័យស្តេរ៉េអូគីមីនៃរូបមន្តទេ៖

3. ការផ្លាស់ប្តូរមួយ (ឬលេខសេស) នៃសារធាតុជំនួសនៅមជ្ឈមណ្ឌល asymmetric នាំទៅរករូបមន្តសម្រាប់ optical antipode៖

4. ការបង្វិល 90° នៅក្នុងយន្តហោះគំនូរ ប្រែរូបមន្តទៅជា antipodeal មួយ លុះត្រាតែក្នុងពេលតែមួយលក្ខខណ្ឌសម្រាប់ទីតាំងរបស់ជំនួសដែលទាក់ទងទៅនឹងយន្តហោះគំនូរត្រូវបានផ្លាស់ប្តូរ ពោលគឺឧ។ កុំពិចារណាថាឥឡូវនេះសារធាតុជំនួសក្រោយមានទីតាំងនៅខាងក្រោយយន្តហោះគំនូរហើយផ្នែកខាងលើនិងខាងក្រោមគឺនៅពីមុខវា។ ប្រសិនបើអ្នកប្រើរូបមន្តជាមួយបន្ទាត់ចំនុច នោះការផ្លាស់ប្តូរទិសនៃបន្ទាត់ចំនុចនឹងរំលឹកអ្នកដោយផ្ទាល់អំពីរឿងនេះ៖

5. ជំនួសឱ្យការផ្លាស់ប្តូរ រូបមន្តព្យាករអាចត្រូវបានផ្លាស់ប្តូរដោយការបង្វិលធាតុជំនួសទាំងបីតាមទ្រនិចនាឡិកា ឬច្រាសទ្រនិចនាឡិកា។ សារធាតុជំនួសទីបួនមិនផ្លាស់ប្តូរទីតាំងរបស់វាទេ (ប្រតិបត្តិការនេះគឺស្មើនឹងការផ្លាស់ប្តូរពីរ)៖

6. រូបមន្តព្យាករមិនអាចមកពីប្លង់នៃគំនូរបានទេ (ឧទាហរណ៍ អ្នកមិនអាចពិនិត្យពួកវា "នៅក្នុងពន្លឺ" ពីខាងក្រោយក្រដាសបានទេ - ក្នុងករណីនេះអត្ថន័យ stereochemical នៃរូបមន្តនឹងផ្លាស់ប្តូរ) ។
II.5. អ្នកប្រណាំង
ប្រសិនបើរូបមន្តនៃសារធាតុមានអាតូម asymmetric នេះមិនមានន័យថាសារធាតុបែបនេះនឹងមានសកម្មភាពអុបទិកនោះទេ។ ប្រសិនបើមជ្ឈមណ្ឌល asymmetric កើតឡើងក្នុងអំឡុងពេលប្រតិកម្មធម្មតា (ការជំនួសនៅក្នុងក្រុម CH 2 ការបន្ថែមនៅចំណងទ្វេ។ ល។ ) នោះប្រូបាប៊ីលីតេនៃការបង្កើតការកំណត់រចនាសម្ព័ន្ធ antipodean ទាំងពីរគឺដូចគ្នា។ ដូច្នេះ ទោះបីជាមានភាពមិនស៊ីសង្វាក់គ្នានៃម៉ូលេគុលនីមួយៗក៏ដោយ សារធាតុលទ្ធផលបានប្រែទៅជាអសកម្មអុបទិក។ ប្រភេទនៃការកែប្រែអសកម្មអុបទិកនេះ ដែលមានបរិមាណស្មើគ្នានៃអង្គបដិបក្ខទាំងពីរត្រូវបានគេហៅថា មិត្តរួមជាតិ [កំណត់សម្គាល់ ៤] ។
II.៦. Diastereomerism
សមាសធាតុដែលមានអាតូម asymmetric ជាច្រើនមានលក្ខណៈពិសេសសំខាន់ៗដែលបែងចែកពួកវាពីសារធាតុសកម្មអុបទិកសាមញ្ញជាងដែលបានពិភាក្សាពីមុនជាមួយនឹងចំណុចកណ្តាលនៃ asymmetry ។
អនុញ្ញាតឱ្យយើងសន្មត់ថានៅក្នុងម៉ូលេគុលនៃសារធាតុជាក់លាក់មួយមានអាតូម asymmetric ពីរ; ចូរហៅពួកវាតាមលក្ខខណ្ឌ A និង B។ វាងាយស្រួលមើលថាម៉ូលេគុលដែលមានបន្សំខាងក្រោមអាចធ្វើទៅបាន៖
ម៉ូលេគុល 1 និង 2 គឺជាគូនៃអង់ទីករអុបទិក; ដូចគ្នានេះដែរអនុវត្តចំពោះគូនៃម៉ូលេគុល 3 និង 4។ ប្រសិនបើយើងប្រៀបធៀបម៉ូលេគុលពី គូស្វាមីភរិយាផ្សេងគ្នា antipodes - 1 និង 3, 1 និង 4, 2 និង 3, 2 និង 4 បន្ទាប់មកយើងនឹងឃើញថាគូដែលបានរាយមិនមែនជាអង់ទីករអុបទិកទេ: ការកំណត់រចនាសម្ព័ន្ធនៃអាតូម asymmetric មួយគឺដូចគ្នា ការកំណត់រចនាសម្ព័ន្ធផ្សេងទៀតមិនដូចគ្នាទេ។ . ទាំងនេះគឺជាគូស្នេហ៍ទាំងអស់។ គ្រោះមហន្តរាយ , i.e. isomers លំហ, ទេ។ បង្កើតអង់ទីករអុបទិកជាមួយគ្នា។
Diastereomers ខុសគ្នាពីគ្នាទៅវិញទៅមកមិនត្រឹមតែនៅក្នុងការបង្វិលអុបទិកប៉ុណ្ណោះទេប៉ុន្តែក៏មាននៅក្នុងថេររូបវិទ្យាផ្សេងទៀតផងដែរ: ពួកគេមានចំណុចរលាយនិងរំពុះខុសៗគ្នាការរលាយខុសគ្នា។ល។ .
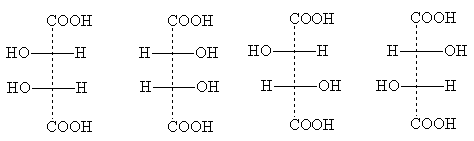
ឧទាហរណ៏នៃសមាសធាតុនៃប្រភេទនេះគឺអាស៊ីត chloromalic

ទម្រង់ stereoisomeric របស់វាមានរូបមន្តព្យាករដូចខាងក្រោមៈ
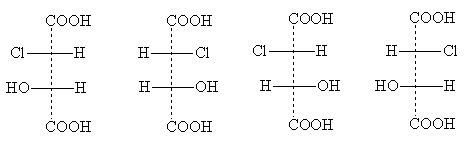
អេរីត្រូ-ទម្រង់ បី-ទម្រង់
ចំណងជើង អេរីត្រូ- និង បី- មកពីឈ្មោះនៃកាបូអ៊ីដ្រាត erythrose និង threose ។ ឈ្មោះទាំងនេះត្រូវបានប្រើដើម្បីបង្ហាញពីទីតាំងទាក់ទងនៃសារធាតុជំនួសនៅក្នុងសមាសធាតុដែលមានអាតូម asymmetric ពីរ៖ អេរីត្រូ - អ៊ីសូមឺរពួកវាជាសារធាតុដែលសារធាតុជំនួសក្រោយដូចគ្នាបេះបិទពីរបង្ហាញក្នុងរូបមន្តព្យាករណ៍ស្តង់ដារនៅម្ខាង (ស្តាំ ឬឆ្វេង)។ បី - អ៊ីសូមឺរមានសារធាតុជំនួសនៅពេលក្រោយដូចគ្នាបេះបិទនៅលើជ្រុងផ្សេងគ្នានៃរូបមន្តព្យាករ [ចំណាំ 5] ។
ពីរ អេរីត្រូ-អ៊ីសូមឺរ គឺជាអង់ទីប៉ូតអុបទិកមួយគូ នៅពេលដែលពួកវាត្រូវបានលាយបញ្ចូលគ្នា មិត្តរួមជាតិសាសន៍មួយត្រូវបានបង្កើតឡើង។ គូនៃ isomers អុបទិកគឺ និង បី-ទម្រង់; ពួកគេក៏បង្កើតមិត្តរួមជាតិផងដែរនៅពេលលាយបញ្ចូលគ្នា ដែលមានលក្ខណៈខុសគ្នាពីមិត្តរួមប្រណាំង អេរីត្រូ-ទម្រង់។ ដូច្នេះមានអ៊ីសូមសកម្មអុបទិកសរុបចំនួនបួននៃអាស៊ីត chloromalic និង 2 racemates ។
ជាមួយនឹងការកើនឡើងបន្ថែមទៀតនៃចំនួនមជ្ឈមណ្ឌល asymmetric ចំនួននៃ isomers spatial កើនឡើង ហើយមជ្ឈមណ្ឌល asymmetric ថ្មីនីមួយៗបង្កើនចំនួន isomers ទ្វេដង។ វាត្រូវបានកំណត់ដោយរូបមន្ត 2 n ដែល n គឺជាចំនួនមជ្ឈមណ្ឌល asymmetric ។
ចំនួននៃ stereoisomers អាចថយចុះដោយសារតែស៊ីមេទ្រីផ្នែកខ្លះលេចឡើងនៅក្នុងរចនាសម្ព័ន្ធមួយចំនួន។ ឧទាហរណ៍មួយគឺអាស៊ីត tartaric ដែលក្នុងនោះចំនួន stereoisomers បុគ្គលត្រូវបានកាត់បន្ថយមកត្រឹមបី។ រូបមន្តព្យាករណ៍របស់ពួកគេ៖
រូបមន្ត I គឺដូចគ្នាបេះបិទទៅនឹងរូបមន្ត Ia៖ វាបំប្លែងទៅជាវានៅពេលបង្វិល 180° នៅក្នុងប្លង់នៃគំនូរ ហើយដូច្នេះវាមិនតំណាងឱ្យស្តេរ៉េអូអ៊ីសូមឺរថ្មីទេ។ នេះគឺជាការកែប្រែអសកម្មអុបទិក - ទម្រង់ meso . មិនដូចអ្នកប្រណាំងទេដែលអាចបំបែកទៅជាអុបទិក ថ្នាំ antipodes, មេសូ-ទម្រង់គឺមិនអាចបំផ្លាញបានជាមូលដ្ឋាន៖ ម៉ូលេគុលនីមួយៗរបស់វាមានចំណុចកណ្តាលមិនស្មើគ្នានៃការកំណត់រចនាសម្ព័ន្ធមួយ ហើយទីពីរ - ផ្ទុយគ្នា។ ជាលទ្ធផល សំណង intramolecular នៃការបង្វិលនៃមជ្ឈមណ្ឌល asymmetric ទាំងពីរកើតឡើង។
មេសូ-សារធាតុសកម្មអុបទិកទាំងអស់មានទម្រង់ដែលដូចគ្នាបេះបិទជាច្រើន (ឧ. ភ្ជាប់ជាមួយសារធាតុជំនួសដូចគ្នា) មជ្ឈមណ្ឌល asymmetric [ចំណាំ 6] ។ រូបមន្តព្យាករណ៍ មេសូ-ទម្រង់អាចត្រូវបានទទួលស្គាល់ដោយការពិតដែលថាពួកវាតែងតែអាចត្រូវបានបែងចែកដោយបន្ទាត់ផ្តេកទៅជាពីរពាក់កណ្តាលដែលនៅពេលសរសេរនៅលើក្រដាសគឺដូចគ្នាបេះបិទប៉ុន្តែតាមពិតត្រូវបានឆ្លុះបញ្ចាំង:

រូបមន្ត II និង III ពិពណ៌នាអំពីអង់ទីករអុបទិកនៃអាស៊ីត tartaric; នៅពេលដែលពួកគេត្រូវបានលាយបញ្ចូលគ្នា មិត្តរួមជាតិសាសន៍អសកម្មអុបទិកត្រូវបានបង្កើតឡើង - អាស៊ីតទំពាំងបាយជូ។
II.៧. នាមត្រកូលនៃ isomers អុបទិក
ប្រព័ន្ធដែលសាមញ្ញបំផុត ចំណាស់ជាងគេបំផុត ប៉ុន្តែនៅតែប្រើប្រាស់ប្រព័ន្ធនៃឈ្មោះនៃអង្គបដិបក្ខអុបទិក គឺផ្អែកលើការប្រៀបធៀបរូបមន្តព្យាករនៃអង្គបដិបក្ខដែលហៅថា antipode ជាមួយនឹងរូបមន្តព្យាករណ៍នៃសារធាតុស្តង់ដារជាក់លាក់មួយដែលត្រូវបានជ្រើសរើសជា "គន្លឹះ" ។ ដូច្នេះសម្រាប់អាស៊ីតអាល់ហ្វាអ៊ីដ្រូស៊ីត និងអាស៊ីតអាមីណូអាល់ហ្វា គន្លឹះគឺ ផ្នែកខាងលើរូបមន្តការព្យាកររបស់ពួកគេ (ក្នុងការកំណត់ស្តង់ដារ):

អិល-អាស៊ីត hydroxy (X = OH) ឃ-អាស៊ីត hydroxy (X = OH)
អាស៊ីត L-amino (X = NH 2) ឃ-អាស៊ីតអាមីណូ (X = NH 2)
ការកំណត់រចនាសម្ព័ន្ធនៃអាស៊ីតអាល់ហ្វា-អ៊ីដ្រូកស៊ីទាំងអស់ដែលមានក្រុមអ៊ីដ្រូកស៊ីលនៅខាងឆ្វេងក្នុងរូបមន្តស្ដង់ដារដែលសរសេរដោយ Fischer ត្រូវបានចង្អុលបង្ហាញដោយសញ្ញា អិល; ប្រសិនបើអ៊ីដ្រូស៊ីលមានទីតាំងនៅក្នុងរូបមន្តព្យាករណ៍នៅខាងស្តាំ - សញ្ញា ឃ[កំណត់សម្គាល់ ៧] ។
គន្លឹះដើម្បីកំណត់រចនាសម្ព័ន្ធជាតិស្ករគឺ glyceraldehyde៖

L-(-)-glyceraldehyde ឃ-(+)-glyceraldehyde
នៅក្នុងម៉ូលេគុលស្ករត្រូវបានកំណត់ ឃ-ឬ អិល-សំដៅលើការកំណត់រចនាសម្ព័ន្ធ ទាបមជ្ឈមណ្ឌល asymmetric ។
ប្រព័ន្ធ ឃ-,អិល-ការរចនាមានគុណវិបត្តិសំខាន់ៗ៖ ទីមួយ ការកំណត់ ឃ-ឬ អិល-បង្ហាញពីការកំណត់រចនាសម្ព័ន្ធនៃអាតូម asymmetric តែមួយ ទីពីរសម្រាប់សមាសធាតុមួយចំនួន និមិត្តសញ្ញាផ្សេងគ្នាត្រូវបានទទួល អាស្រ័យលើថាតើគ្រាប់ចុច glyceraldehyde ឬ hydroxyacid ត្រូវបានយកជាគន្លឹះ ឧទាហរណ៍៖

ភាពខ្វះខាតទាំងនេះនៃប្រព័ន្ធគន្លឹះកំណត់ការប្រើប្រាស់របស់វានៅពេលបច្ចុប្បន្នដល់បីថ្នាក់នៃសារធាតុសកម្មអុបទិក៖ ជាតិស្ករ អាស៊ីតអាមីណូ និងអាស៊ីតអ៊ីដ្រូស៊ីត។ រចនាឡើងសម្រាប់ការប្រើប្រាស់ទូទៅ "R, S-ប្រព័ន្ធ Kahn, Ingold និង Prelog [ចំណាំ 8] ។
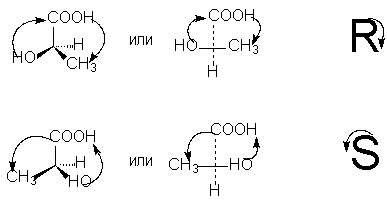
ដើម្បីកំណត់រចនាសម្ព័ន្ធ R- ឬ S នៃអង្គបដិបក្ខអុបទិក វាចាំបាច់ក្នុងការរៀបចំ tetrahedron នៃសារធាតុជំនួសជុំវិញអាតូមកាបូន asymmetric ក្នុងវិធីមួយដែលសារធាតុជំនួសទាបបំផុត (ជាធម្មតាអ៊ីដ្រូសែន) មានទិសដៅ "ឆ្ងាយពីអ្នកសង្កេត" ។ បន្ទាប់មក ប្រសិនបើចលនាកំឡុងពេលផ្លាស់ប្តូរនៅក្នុងរង្វង់នៃអ្នកជំនួសបីនាក់ដែលនៅសល់ពីមនុស្សច្បងទៅមធ្យមក្នុងអតីតភាពការងារ ហើយបន្ទាប់មកទៅក្មេងជាងគេកើតឡើង។ ច្រាសទ្រនិចនាឡិកា - នេះ។ រ -isomer (ទាក់ទងនឹងចលនាដៃដូចគ្នានៅពេលសរសេរអក្សរ R) ប្រសិនបើ ទ្រនិចនាឡិកា - នេះ។ ស- isomer (ទាក់ទងនឹងចលនាដៃដូចគ្នានៅពេលសរសេរអក្សរ S) ។
ដើម្បីកំណត់អតីតភាពរបស់ធាតុជំនួសនៅលើអាតូម asymmetric ច្បាប់សម្រាប់គណនាលេខអាតូមត្រូវបានប្រើ ដែលយើងបានពិចារណារួចហើយទាក់ទងនឹងឈ្មោះ Z,E នៃ isomers ធរណីមាត្រ (សូមមើល) ។
ដើម្បីជ្រើសរើស R, S-notations យោងតាមរូបមន្តព្យាករ វាគឺចាំបាច់ដោយចំនួនគូនៃការផ្លាស់ប្តូរ (ដែលយើងដឹងហើយថាមិនផ្លាស់ប្តូរអត្ថន័យ stereochemical នៃរូបមន្ត) ដើម្បីរៀបចំសារធាតុជំនួសដើម្បីឱ្យកូនពៅរបស់ ពួកវា (ជាធម្មតាអ៊ីដ្រូសែន) គឺនៅខាងក្រោមនៃរូបមន្តព្យាករ។ បន្ទាប់មក អតីតភាពនៃអ្នកជំនួសបីរូបដែលនៅសេសសល់ ធ្លាក់ចុះតាមទ្រនិចនាឡិកា ត្រូវគ្នានឹងការកំណត់ R ច្រាសទ្រនិចនាឡិកា - ការកំណត់ S [ចំណាំ 9]៖
គ្រប់គ្រងភារកិច្ច
3. កំណត់ការកំណត់រចនាសម្ព័ន្ធនៃមជ្ឈមណ្ឌល asymmetric នៃអាស៊ីត ascorbic (វីតាមីន C) (ដោយ R,S-nomenclature និងនៅក្នុងការប្រៀបធៀបជាមួយ glyceraldehyde):

4. អាល់កាឡូអ៊ីដ អេហ្វដ្រីន មានរូបមន្ត៖
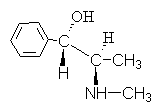
ផ្តល់ឈ្មោះសម្រាប់ការតភ្ជាប់នេះដោយប្រើ R,S- នាមត្រកូល។
5. Cysteine - អាស៊ីតអាមីណូមិនសំខាន់ដែលពាក់ព័ន្ធនឹងបទប្បញ្ញត្តិនៃដំណើរការមេតាប៉ូលីសគឺ អិលអាស៊ីតអាមីណូ 2-mercaptopropionic ។ គូររូបមន្តរចនាសម្ព័ន្ធរបស់វា ហើយដាក់ឈ្មោះរបស់វា។ R,S- នាមត្រកូល។
6. Levomycetin (អង់ទីប៊ីយ៉ូទិកទូលំទូលាយ) គឺ ឃ(-)-threo-1-para-nitrophenyl-2-dichloroacetylamino-propanediol-1,3 ។ គូររចនាសម្ព័ន្ធរបស់វាក្នុងទម្រង់នៃរូបមន្តព្យាករ Fischer ។
7. Synestrol គឺជាថ្នាំ estrogen សំយោគដែលមានរចនាសម្ព័ន្ធមិនស្តេរ៉ូអ៊ីត។ ដាក់ឈ្មោះរបស់វាដែលបង្ហាញពីការកំណត់រចនាសម្ព័ន្ធស្តេរ៉េអូគីមីរបស់វា៖

II.8. គីមីវិទ្យានៃសមាសធាតុរង្វិល
នៅពេលដែលខ្សែសង្វាក់នៃអាតូមកាបូនត្រូវបានបិទចូលទៅក្នុងវដ្តផែនការ មុំចំណងនៃអាតូមកាបូនត្រូវបានបង្ខំឱ្យងាកចេញពីតម្លៃ tetrahedral ធម្មតារបស់ពួកគេ ហើយទំហំនៃគម្លាតនេះអាស្រ័យលើចំនួនអាតូមនៅក្នុងវដ្ត។ មុំនៃគម្លាតកាន់តែធំនៃចំណងវ៉ាឡេន ទុនបម្រុងថាមពលនៃម៉ូលេគុលកាន់តែធំ វដ្តនេះកាន់តែមានស្ថេរភាព។ ទោះជាយ៉ាងណាក៏ដោយមានតែអ៊ីដ្រូកាបូនដែលមានសមាជិកបី (ស៊ីក្លូប្រូផេន) មានរចនាសម្ព័ន្ធរាបស្មើ។ ចាប់ផ្តើមពី cyclobutane ម៉ូលេគុល cycloalkane មានរចនាសម្ព័ន្ធមិនមែនplanar ដែលកាត់បន្ថយ "ភាពតានតឹង" នៅក្នុងប្រព័ន្ធ។
ម៉ូលេគុល cyclohexane អាចមាននៅក្នុងការអនុលោមតាមទម្រង់ជាច្រើនដែលមុំចំណង "ធម្មតា" ត្រូវបានរក្សា (សម្រាប់ភាពសាមញ្ញមានតែអាតូមកាបូនប៉ុណ្ណោះដែលត្រូវបានបង្ហាញ):
ការអនុលោមភាពអំណោយផលបំផុតគឺការអនុលោមតាម I - ទម្រង់ដែលគេហៅថា "កៅអី". ការអនុលោមតាម II - "រមួល" - កាន់កាប់ទីតាំងមធ្យម៖ វាមិនសូវអំណោយផលជាងការអនុលោមតាមកៅអី (ដោយសារតែវត្តមានអាតូមអ៊ីដ្រូសែនដែលលាក់បាំងនៅក្នុងវា) ប៉ុន្តែអំណោយផលជាងការអនុលោមតាម III ។ ការអនុលោមតាម III - "ងូតទឹក" - អំណោយផលតិចបំផុតក្នុងចំណោម 3 ដោយសារតែការច្រានចោលយ៉ាងសំខាន់នៃអាតូមអ៊ីដ្រូសែនដែលដឹកនាំឡើងលើ។
ការពិចារណាលើសញ្ញាប័ណ្ណ C-H ចំនួនដប់ពីរនៅក្នុងការអនុលោមតាមកៅអីអនុញ្ញាតឱ្យយើងបែងចែកវាជាពីរក្រុម: ប្រាំមួយ។ អ័ក្ស ការតភ្ជាប់ដែលដឹកនាំឆ្លាស់គ្នាឡើងលើ និងចុះក្រោម និងប្រាំមួយ។ អេក្វាទ័រ ការតភ្ជាប់ទៅភាគី។ នៅក្នុង monosubstituted cyclohexanes សារធាតុជំនួសអាចស្ថិតនៅក្នុងទីតាំងអេក្វាទ័រ ឬអ័ក្ស។ ការអនុលោមភាពទាំងពីរនេះជាធម្មតាស្ថិតក្នុងលំនឹង ហើយផ្លាស់ប្តូរយ៉ាងលឿនទៅគ្នាទៅវិញទៅមកតាមរយៈការបង្រួបបង្រួម៖

ការអនុលោមតាមអេក្វាទ័រ (e) ជាធម្មតាមានថាមពលខ្សោយជាង ហើយដូច្នេះវាមានអត្ថប្រយោជន៍ច្រើនជាងការអនុលោមតាមអ័ក្ស (a) ។
នៅពេលអ្នកជំនួស (ច្រវាក់ចំហៀង) លេចឡើងនៅក្នុងចិញ្ចៀន បន្ថែមពីលើបញ្ហានៃការអនុលោមតាមចិញ្ចៀនដោយខ្លួនឯង អ្នកស្រាវជ្រាវក៏ប្រឈមនឹងបញ្ហាផងដែរ។ ការកំណត់រចនាសម្ព័ន្ធជំនួស ៖ ដូច្នេះក្នុងករណីមានវត្តមានរបស់សារធាតុជំនួសពីរដូចគ្នា ឬផ្សេងគ្នា។ cis-trans- អ៊ីសូមឺរ។ ចំណាំថានិយាយអំពី cis-trans- ការកំណត់រចនាសម្ព័ន្ធសារធាតុជំនួសមានន័យតែនៅពេលដែលបានអនុវត្តទៅចិញ្ចៀនតូចនិងមធ្យមឆ្អែត (រហូតដល់ទៅ C 8): នៅក្នុងចិញ្ចៀនជាមួយ មួយចំនួនធំភាពចល័តនៃតំណភ្ជាប់កំពុងក្លាយជាសំខាន់រួចទៅហើយដែលការពិភាក្សាអំពី ស៊ីស-ឬ ត្រេកត្រអាល។- តំណែងតំណាងរាស្ត្របាត់បង់អត្ថន័យ។
ដូច្នេះ ឧទាហរណ៍បុរាណគឺជាអាស៊ីត stereoisomeric cyclopropane-1,2-dicarboxylic ។ មានអាស៊ីត stereoisomeric ពីរ: មួយក្នុងចំណោមពួកវាមាន m.p. 139 o C មានសមត្ថភាពបង្កើត cyclic anhydride ហើយដូច្នេះ ស៊ីស- អ៊ីសូមឺរ។ អាស៊ីត stereoisomeric មួយទៀត m.p. 175 o C, មិនបង្កើត cyclic anhydride; នេះ។ ត្រេកត្រអាល។-isomer [ចំណាំ 10]៖
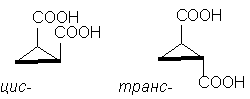
អាស៊ីត stereoisomeric 1,2,2-trimethylcyclopentane-1,3-dicarboxylic មានទំនាក់ទំនងដូចគ្នាជាមួយគ្នាទៅវិញទៅមក។ មួយក្នុងចំណោមពួកគេអាស៊ីត camphoric, m.p. 187 o C បង្កើតជា anhydride ហើយដូច្នេះគឺ ស៊ីស- អ៊ីសូមឺរ។ មួយទៀតគឺអាស៊ីត isocamphoric, m.p. 171 o C, - មិនបង្កើតជា anhydride នេះទេ។ ត្រេកត្រអាល។អ៊ីសូមឺរ៖

cis-trans-
ទោះបីជាម៉ូលេគុល cyclopentane មិនមែនជាប្លង់ពិតក៏ដោយ សម្រាប់ភាពច្បាស់លាស់ វាងាយស្រួលក្នុងការពណ៌នាវាជាទម្រង់រាបស្មើ ដូចក្នុងរូបភាពខាងលើ ដោយចងចាំថានៅក្នុង ស៊ីស- isomer មានសារធាតុជំនួសពីរ នៅផ្នែកម្ខាងនៃវដ្ត , និងនៅក្នុង ត្រេកត្រអាល។- isomer - នៅសងខាងនៃវដ្ត .
និស្សន្ទវត្ថុ cyclohexane ដែលអាចជំនួសបានក៏អាចមាននៅក្នុងទម្រង់ cis ឬ trans៖
អាតូមកាបូនមិនមានសិទ្ធិផ្តាច់មុខលើការបង្កើតមជ្ឈមណ្ឌល chiral នៅក្នុងម៉ូលេគុលនៃសមាសធាតុសរីរាង្គទេ។ ចំណុចកណ្តាលនៃ chirality ក៏អាចជាស៊ីលីកុន សំណប៉ាហាំង និងអាតូមអាសូត tetracovalent នៅក្នុងអំបិលអាម៉ូញ៉ូម quaternary និង អុកស៊ីដអាមីន ទីបី៖

នៅក្នុងសមាសធាតុទាំងនេះ កណ្តាលនៃ asymmetry មានការកំណត់រចនាសម្ព័ន្ធ tetrahedral ដូចជាអាតូមកាបូន asymmetric ។ ទោះយ៉ាងណាក៏ដោយក៏មានសមាសធាតុដែលមានរចនាសម្ព័ន្ធលំហខុសគ្នានៃមជ្ឈមណ្ឌល chiral ។
មជ្ឈមណ្ឌល Chiral បង្កើតឡើងដោយអាតូមនៃអាសូត trivalent ផូស្វ័រ អាសេនិច អង់ទីម៉ូនី និងស្ពាន់ធ័រ មានការកំណត់រចនាសម្ព័ន្ធពីរ៉ាមីត។ ជាគោលការណ៍ ចំណុចកណ្តាលនៃ asymmetry អាចត្រូវបានចាត់ទុកថាជា tetrahedral ប្រសិនបើគូអេឡិចត្រុងឯកកោនៃ heteroatom ត្រូវបានគេយកជាការជំនួសទីបួន៖

សកម្មភាពអុបទិកក៏អាចកើតឡើងផងដែរ។ ដោយគ្មាន មជ្ឈមណ្ឌល chiral ដោយសារតែ chirality នៃរចនាសម្ព័ន្ធនៃម៉ូលេគុលទាំងមូលទាំងមូល ( chirality ម៉ូលេគុល ឬ asymmetry ម៉ូលេគុល ) ភាគច្រើន ឧទាហរណ៍ធម្មតា។ភាពអាចរកបាន អ័ក្ស chiral ឬ យន្តហោះ chiral .
ឧទាហរណ៍ អ័ក្ស chiral លេចឡើងនៅក្នុង allenes ដែលមានសារធាតុជំនួសផ្សេងៗនៅ sp ២- អាតូមកាបូនកូនកាត់។ វាងាយស្រួលមើលថាសមាសធាតុខាងក្រោមគឺជារូបភាពកញ្ចក់ ដូច្នេះហើយ អុបទិក អង់ទីប៉ូតៈ

អ័ក្ស chirality ត្រូវបានបង្ហាញនៅក្នុងតួលេខដោយព្រួញមួយ។
សមាសធាតុផ្សេងទៀតដែលមានអ័ក្ស chiral គឺ biphenyls សកម្មអុបទិកដែលមាន អ័រថូ- ទីតាំងមានសារធាតុជំនួសសំពីងសំពោង ដែលធ្វើអោយពិបាកក្នុងការបង្វិលដោយសេរីជុំវិញ ការតភ្ជាប់ S-Sការភ្ជាប់ចិញ្ចៀនអាពាហ៍ពិពាហ៍:

យន្តហោះ Chiral កំណត់លក្ខណៈដោយការពិតដែលថាវាអាចត្រូវបានបែងចែករវាង "កំពូល" និង "បាត" ក៏ដូចជាផ្នែក "ស្តាំ" និង "ឆ្វេង" ។ ឧទាហរណ៏នៃសមាសធាតុដែលមានយន្តហោះ chiral គឺសកម្មអុបទិក អន្លង់- cyclooctene និងដេរីវេ ferrocene សកម្មអុបទិក។
អ៊ីសូមឺរគឺជាសមាសធាតុដែលមានសមាសភាពគុណភាព និងបរិមាណដូចគ្នា (រូបមន្តម៉ូលេគុល) ប៉ុន្តែខុសគ្នាពីគ្នាទៅវិញទៅមកក្នុងលំដាប់នៃការភ្ជាប់អាតូម ឬការរៀបចំរបស់វានៅក្នុងលំហ ដោយហេតុថារចនាសម្ព័ន្ធនៃសមាសធាតុទាំងនេះខុសគ្នា លក្ខណៈគីមី ឬរូបវន្តរបស់អ៊ីសូម ខុសគ្នា។
ប្រភេទនៃ isomerism: រចនាសម្ព័ន្ធ ( isomers រចនាសម្ព័ន្ធ) និង stereoisomerism (លំហ) ។
isomerism រចនាសម្ព័ន្ធអាចជា បីប្រភេទ:
- isomerism នៃគ្រោងឆ្អឹងកាបូន (isomers យោងទៅតាមរចនាសម្ព័ន្ធនៃខ្សែសង្វាក់កាបូន) ឧទាហរណ៍ butane (សមាសធាតុដែលមានរចនាសម្ព័ន្ធមិនមានសាខាឬធម្មតា) និង 2-methylpropane (សមាសធាតុដែលមានរចនាសម្ព័ន្ធសាខា);
- isomers នៃទីតាំងនៃក្រុមមុខងារ (ឬចំណងច្រើន) ឧទាហរណ៍ 1-butanol (ក្រុម hydroxyl ត្រូវបានភ្ជាប់ទៅនឹងអាតូមកាបូនទី 1 នៅក្នុងខ្សែសង្វាក់) និង 2-butanol (ក្រុម hydroxyl ត្រូវបានផ្សារភ្ជាប់ទៅនឹងអាតូមកាបូនទី 2 នៅក្នុងសង្វាក់។ );
- isomers ក្រុមមុខងារ (ឬ isomerism interclass) ឧទាហរណ៍ 1-butanol (អាល់កុល) និង diethyl ether (ether) ។
Stereoisomerism ត្រូវបានបែងចែកទៅជា conformational និង configurational។
ទម្រង់នៃម៉ូលេគុលតំណាងឱ្យភាពខុសគ្នារបស់វា។ រាងធរណីមាត្រដែលកើតឡើងជាលទ្ធផលនៃការបង្វិលជុំវិញសាមញ្ញ -ចំណង។
ការកំណត់រចនាសម្ព័ន្ធ គឺជាការរៀបចំអាតូមក្នុងលំហដោយមិនគិតពីភាពខុសគ្នាដែលកើតឡើងដោយសារតែការបង្វិលជុំវិញ -bonds សាមញ្ញ។
ការអនុលោមតាមម៉ូលេគុលសរីរាង្គ។ការបង្វិលជុំវិញ -ចំណង C – C ត្រូវបានធ្វើបានយ៉ាងងាយស្រួល ខ្សែសង្វាក់អ៊ីដ្រូកាបូនអាចមានទម្រង់ផ្សេងៗគ្នា។ ទម្រង់អនុលោមភាពអាចបំប្លែងគ្នាទៅវិញទៅមកបានយ៉ាងងាយ ហើយដូច្នេះមិនមែនជាសមាសធាតុផ្សេងគ្នាទេ - ពួកវាជាទម្រង់ថាមវន្តមិនស្ថិតស្ថេរខុសគ្នានៃម៉ូលេគុលដូចគ្នា។ ភាពខុសគ្នានៃថាមពលរវាង conformers មានលំដាប់ដូចគ្នានឹងថាមពលនៃចលនាកម្ដៅ (kJ/mol ជាច្រើន)។ ដូច្នេះ នៅសីតុណ្ហភាពធម្មតា ឧបករណ៍អនុលោមតាមបុគ្គលមិនអាចញែកដាច់ពីគេបានទេ។
ភាពខុសគ្នាមួយត្រូវបានធ្វើឡើងរវាងការអនុលោមតាមសូរ្យគ្រាស និងការរារាំង (រូបភាពទី 2) ។
អង្ករ។ 2. ទម្រង់នៃ pentane: a – eclipsed; ខ - រារាំង
នៅក្នុងរូបភព។ រូបភាពទី 2 បង្ហាញពីការអនុលោមរបស់ pentane ដោយផ្អែកលើចំណងរវាងអាតូមកាបូនទីពីរ និងទីបីនៃសង្វាក់។ វាអាចត្រូវបានគេមើលឃើញថានៅក្នុងការអនុលោមតាមសូរ្យគ្រាស អ៊ីដ្រូសែន ឬអាតូមកាបូនហាក់បីដូចជាបិទបាំងគ្នាទៅវិញទៅមក។ ការអនុលោមតាមដែលរារាំងកើតឡើងជាលទ្ធផលនៃការបង្វិលនៃអាតូមមួយដោយ 60 ហើយចម្ងាយរវាងអាតូមដែលមិនជាប់ចំណងកើនឡើងបន្តិច កម្លាំងច្រានចោលនៃគន្លងអេឡិចត្រុងនៃអាតូមថយចុះ ហើយការកំណត់រចនាសម្ព័ន្ធនេះគឺមានថាមពលអំណោយផលជាង។ ម៉ូលេគុលនៃសមាសធាតុសរីរាង្គជាច្រើនគឺជាល្បាយនៃ conformers ដែលជាលទ្ធផលនៃចលនាកម្ដៅ ម៉ូលេគុលឆ្លងកាត់ការបំប្លែងជាបន្ត។
រូបមន្តព្យាកររបស់ Newman ។ដើម្បីពណ៌នាការអនុលោមតាមរូបមន្ត ការព្យាករណ៍របស់ Newman ត្រូវបានប្រើ ដែលត្រូវបានទទួលដោយការបញ្ចាំងម៉ូលេគុល C ទៅលើយន្តហោះ – គ - ការតភ្ជាប់។ ជាឧទាហរណ៍ក្នុងរូប។ រូបភាពទី 3 បង្ហាញពីការអនុលោមនៃ pentane ទាក់ទងទៅនឹងចំណង C 2 -C 3 ។
អាតូមកាបូននៅជិតអ្នកសង្កេត (C 2) ត្រូវបានកំណត់ដោយចំណុចនៅកណ្តាលរង្វង់; រង្វង់តំណាងឱ្យអាតូមកាបូនដែលបានដកចេញ (C 3) ។ ចំណងបីពីអាតូមមួយត្រូវបានបង្ហាញជាបន្ទាត់ដែលខុសគ្នាពីកណ្តាលរង្វង់ - សម្រាប់អាតូមនៅជិត (C 2) ឬ "លេចចេញ" ពីខាងក្រោយរង្វង់ - សម្រាប់អាតូមឆ្ងាយ (C 3) ប្រសិនបើអាតូមនិងក្រុមដែលភ្ជាប់ជាមួយ អាតូមកាបូននៅក្នុងសំណួរហាក់ដូចជាពួកវាបិទបាំងគ្នាទៅវិញទៅមក ការអនុលោមភាពត្រូវបានគេហៅថា eclipsed (រូបភាព 3. ក) នៅពេលដែលអាតូមមួយបង្វិលទាក់ទងទៅម្ខាងទៀតដោយ 60° យើងទទួលបានទម្រង់រារាំងដែលអំណោយផលជាងនេះ (រូបភព។ 3. ខ).

អង្ករ។ 3. រូបមន្តព្យាករណ៍របស់ Newman សម្រាប់ a: ការអនុលោមតាម eclipsed នៃ pentane និង b: inhibited conformation of pentane ។
ការអនុលោមនៃសមាសធាតុស៊ីលីក។ជិះកង់ទេ។ សមាសធាតុក្រអូបតាមក្បួនមួយមិនមានរាងសំប៉ែតទេ។ ដើម្បីកាត់បន្ថយភាពតានតឹងផ្នែកមុំ និងបង្វិលដែលអាចកើតឡើងដោយសារភាពខុសគ្នានៃតម្លៃនៃមុំចំណង និងមុំពហុកោណ អាតូមចិញ្ចៀនមួយឬច្រើនអាចមានទីតាំងនៅក្នុងយន្តហោះផ្សេងគ្នាទាក់ទងនឹងអាតូមដែលនៅសល់។ ដូច្នេះ វដ្តដែលមានសមាជិកប្រាំនាក់អាចមានរាងដូចស្រោមសំបុត្រក្នុងលំហ (រូបភាពទី 4) ហើយរង្វង់ដែលមានសមាជិកប្រាំមួយអាចមានរូបរាងនៃអាងងូតទឹក ឬកៅអី (រូបភាព 5) ។
អង្ករ។ 4. ការអនុលោមនៃ cyclopentane
នៅក្នុងការអនុលោមតាមស្រោមសំបុត្រ អាតូមកាបូនមួយផ្លាស់ទីចេញពីយន្តហោះ ដែលអាតូមបួនផ្សេងទៀតស្ថិតនៅ។ អាតូមណាមួយក្នុងចំណោមអាតូមទាំងប្រាំអាចផុសចេញពីយន្តហោះ ហើយវដ្តនេះហាក់ដូចជាមានចលនាដូចរលកថេរ។

អង្ករ។ 5. ការអនុលោមនៃ cyclohexane: a - កៅអីនិង b - ងូតទឹក។
នៅក្នុងការអនុលោមតាមកៅអី និងបន្ទប់ទឹក អាតូមកាបូនចំនួន 2 មានទីតាំងនៅខាងក្រៅយន្តហោះ ដែលក្នុងនោះអាតូមចំនួន 4 ទៀតស្ថិតនៅ។
នៅក្នុងការអនុលោមតាមកៅអីរបស់ cyclohexane មិនមានទីតាំងបិទបាំងនៃអាតូមអ៊ីដ្រូសែននិងកាបូនទេ: ការរៀបចំអាតូមអ៊ីដ្រូសែននៅលើអាតូមកាបូនទាំងអស់គឺដូចគ្នាទៅនឹងការរារាំងនៃអេតាន។
សញ្ញាប័ណ្ណ C ចំនួនប្រាំមួយ។ – H ស្របទៅនឹងអ័ក្សស៊ីមេទ្រីនៃទម្រង់ជាកៅអីរបស់ cyclohexane ដែលដឹកនាំឆ្លាស់គ្នាឡើងលើ និងចុះក្រោមត្រូវបានគេហៅថា axial (និមិត្តសញ្ញា ក).នៅសល់ប្រាំមួយគ – មូលបត្របំណុល H មានទីតាំងនៅមុំ 109.5° ទៅអ័ក្សនេះហើយក៏ត្រូវបានដឹកនាំឆ្លាស់គ្នាឡើងលើចុះក្រោមផងដែរ។ ការតភ្ជាប់ទាំងនេះត្រូវបានគេហៅថាអេក្វាទ័រ (និមិត្តសញ្ញា អ៊ី) ដូច្នេះ អាតូមកាបូននីមួយៗមានចំណងមួយជាមួយអាតូមអ៊ីដ្រូសែនដែលមានទីតាំងនៅអ័ក្ស និងចំណងមួយនៅអេក្វាទ័រ។ ការអនុលោមតាមកៅអីមានភាពស្វាហាប់កាន់តែអំណោយផល។
ការកំណត់រចនាសម្ព័ន្ធ isomers ។ isomerism អុបទិក. ការកំណត់រចនាសម្ព័ន្ធគឺជា stereoisomers ដែលមានការរៀបចំផ្សេងៗគ្នាជុំវិញអាតូមជាក់លាក់នៃអាតូមផ្សេងទៀត រ៉ាឌីកាល់ ឬក្រុមមុខងារនៅក្នុងលំហដែលទាក់ទងគ្នាទៅវិញទៅមក។ ទាំងនេះជាចម្បងរួមបញ្ចូល enantiomers - សារធាតុសកម្មអុបទិកដែលជារូបភាពកញ្ចក់នៃគ្នាទៅវិញទៅមក។
តើសារធាតុអ្វីខ្លះដែលគេហៅថាសកម្មអុបទិក? ទាំងនេះគឺជាសមាសធាតុដែលមានសមត្ថភាពផ្លាស់ប្តូរមុំនៃទំនោរនៃយន្តហោះនៃពន្លឺប៉ូលឡាសៀរបស់យន្តហោះ។ សូមចាំថា ពន្លឺធម្មតា (ពីព្រះអាទិត្យ ឬចង្កៀង) គឺជារលកអេឡិចត្រូម៉ាញ៉េទិច ដែលភាគល្អិតញ័រគ្រប់ទិសទី ក្នុងប្លង់កាត់គ្នា និងកាត់កែងទៅទិសនៃការសាយភាយនៃរលក។ នៅក្នុងពន្លឺរាងប៉ូលនៃយន្តហោះ ការរំញ័រនៃភាគល្អិតស្ថិតនៅក្នុងយន្តហោះតែមួយ។ ប្រសិនបើធ្នឹមឆ្លងកាត់សារធាតុថ្លាដែលមានសមត្ថភាពបង្វិលយន្តហោះនៃលំយោលនៃវាលអគ្គិសនីដោយមុំជាក់លាក់មួយ ហើយផ្តល់ទិសដៅថ្មីដល់ពួកគេ នោះសារធាតុបែបនេះត្រូវបានគេនិយាយថាមានសកម្មភាពអុបទិក។
សញ្ញាពីរនៃសកម្មភាពអុបទិកនៃសមាសធាតុសរីរាង្គអាចត្រូវបានបង្កើត: វត្តមាននៃអាតូមកាបូន asymmetric និងអវត្តមាននៃធាតុស៊ីមេទ្រីនៅក្នុងម៉ូលេគុល។
អាតូមកាបូន asymmetric គឺជាអាតូមដែលជាប់នឹងបួន អាតូមផ្សេងគ្នាឬក្រុម ជាធម្មតាត្រូវបានចង្អុលបង្ហាញដោយសញ្ញាផ្កាយ៖ *C ។
ចូរយើងពិចារណាអំពីម៉ូលេគុលនៃអាឡានីន (2-aminopropanoic acid) ដែលជាអាស៊ីតអាមីណូដែលជាផ្នែកមួយនៃប្រូតេអ៊ីន (រូបភាពទី 6) ។ ម៉ូលេគុលមានអាតូមកាបូនមិនស៊ីមេទ្រីមួយ (ទីពីរត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងសារធាតុជំនួសបួនផ្សេងគ្នា៖ ក្រុមអាមីណូ ក្រុម carboxyl អាតូមអ៊ីដ្រូសែន និងក្រុមមេទីល -CH 3) ។ អាតូមកាបូននៃក្រុម carboxyl គឺមិន asymmetric, ដោយសារតែ គាត់មិនមាន 4 ទេប៉ុន្តែមានតែ 3 ជំនួសប៉ុណ្ណោះ។ អាតូមកាបូនទីបី (កាបូនមេទីល) ក៏មិនស្មើគ្នាដែរ។ វាមានសារធាតុជំនួស 4 ប៉ុន្តែ 3 នៃពួកវាដូចគ្នា (អាតូមអ៊ីដ្រូសែន)។ ម៉ូលេគុលនៃសមាសធាតុនេះគឺ asymmetrical ដូច្នេះ alanine គឺជាសមាសធាតុសកម្មអុបទិក ហើយអាចមាននៅក្នុងទម្រង់នៃ enantiomers ពីរ។ Enantiomers ត្រូវបានដាក់ឈ្មោះដោយ D,L nomenclature ដែលពិពណ៌នាអំពីការកំណត់រចនាសម្ព័ន្ធដែលទាក់ទងនៃ isomers (ទាក់ទងទៅនឹងការកំណត់រចនាសម្ព័ន្ធ glyceraldehyde) ។
ដើម្បីពណ៌នា និងដាក់ឈ្មោះ enantiomer វាជាការងាយស្រួលក្នុងការដាក់ខ្សែសង្វាក់កាបូននៃម៉ូលេគុលបញ្ឈរ បន្ទាប់មកសារធាតុជំនួសនៅលើអាតូមកាបូន asymmetric លេចឡើងនៅខាងស្តាំ និងខាងឆ្វេងរបស់វា។ ប្រសិនបើសារធាតុជំនួសជាន់ខ្ពស់ (ក្នុងករណីរបស់យើងក្រុមអាមីណូ) មានទីតាំងនៅខាងឆ្វេងវាគឺជា L-isomer ប្រសិនបើនៅខាងស្តាំវាគឺជា D-isomer (រូបភាព 6) ។

អង្ករ។ 6. Enantiomers នៃ alanine ។
Enantiomers មិនដូច isomers មានលក្ខណៈសម្បត្តិរូបវន្ត និងគីមីដូចគ្នា ពួកវាខុសគ្នាត្រង់ថាពួកវាបង្វិលប្លង់ប៉ូលនៃពន្លឺរាងប៉ូលរបស់យន្តហោះដោយមុំដូចគ្នា ប៉ុន្តែក្នុងទិសដៅផ្ទុយ (មួយទៅខាងឆ្វេង មួយទៀតទៅខាងស្តាំ) . ល្បាយដែលមានបរិមាណស្មើគ្នានៃ enantiomers ត្រូវបានគេហៅថាល្បាយ racemic ឬ racemate ។ មិត្តរួមប្រណាំងមិនសកម្មអុបទិកទេ។
ទោះបីជាវាហាក់ដូចជាមានភាពខុសប្លែកគ្នាតិចតួចនៅក្នុងលក្ខណៈសម្បត្តិក៏ដោយ សកម្មភាពជីវសាស្រ្តរបស់ enantiomers គឺខុសគ្នាខ្លាំងណាស់។ ឧទាហរណ៍ ប្រូតេអ៊ីនមានផ្ទុកតែ L-enantiomers នៃអាស៊ីតអាមីណូ នេះពន្យល់ពីភាពពិសេសនៃរចនាសម្ព័ន្ធ spatial នៃប្រូតេអ៊ីន និងកំណត់ការជ្រើសរើសនៃសកម្មភាពកាតាលីករនៃអង់ស៊ីម D-isomers នៃអាស៊ីតអាមីណូនៅពេលចូលទៅក្នុងខ្លួនអាចបណ្តាលឱ្យមានដំណើរការអវិជ្ជមានផ្សេងៗ។ ដូច្នេះការកំណត់រចនាសម្ព័ន្ធលំហនៃអាស៊ីតអាមីណូត្រូវតែយកមកពិចារណាក្នុងការផលិតថ្នាំ និងសារធាតុបន្ថែមអាហារផ្សេងៗ។
អ៊ីសូមឺរនៃសមាសធាតុនេះ -alanine (អាស៊ីត 3-aminopropanoic) ក៏មានវត្តមាននៅក្នុងខ្លួនយើងដែរ។ សមាសធាតុនេះមិនមែនជាផ្នែកនៃប្រូតេអ៊ីន និងមិនមានសកម្មភាពអុបទិកទេ ពីព្រោះ មិនមានអាតូម asymmetric នៅក្នុងវាទេ។ អាតូមកាបូនទីមួយនៃក្រុម carboxyl មានសារធាតុជំនួសតែ 3 ប៉ុណ្ណោះ ទីពីរ និងទីបីមាន 2 សារធាតុជំនួសដូចគ្នា (អាតូមអ៊ីដ្រូសែន) ។
ចូរយើងបន្តការពិចារណារបស់យើងអំពីបាតុភូតនៃ isomerism អុបទិក។ សារធាតុដែលកំណត់ដោយបាតុភូតនេះច្រើនតែត្រូវបានគេហៅថា stereoisomers ។ Stereoisomers គឺដូចគ្នាបេះបិទក្នុងលក្ខណៈរូបវន្ត និងរូបវិទ្យា ប៉ុន្តែខុសគ្នាក្នុងលក្ខណៈពីរយ៉ាង៖
1. គ្រីស្តាល់នៅក្នុងទម្រង់ដែលមិនមានស៊ីមេទ្រីយន្តហោះ (យន្តហោះ) ប៉ុន្តែទាក់ទងគ្នាទៅវិញទៅមកជាវត្ថុមួយចំពោះរូបភាពកញ្ចក់របស់វា ឧទាហរណ៍ គ្រីស្តាល់អាស៊ីត tartaric ពីរប្រភេទ ដោយបន្លិចអាស៊ីត tartaric stereoisomeric ។

2. Stereoisomers ដូចដែលបានកត់សម្គាល់ខាងលើ បំភ្លឺរាងប៉ូលខុសគ្នា។ ទំ  ហេតុផលសម្រាប់ stereoisomerism អុបទិកគឺដោយសារតែជាក់លាក់នៃការរៀបចំក្រុមជំនួសនៅលើអាតូមកាបូននៅក្នុងស្ថានភាព sp 3 -hybridization នោះគឺជាមួយនឹងកាបូនឆ្អែតនៅកំពូលនៃ tetrahedron (ការរៀបចំអាតូមក្នុងលំហដែលនាំទៅដល់ វត្តមាននៃ stereoisomerism ត្រូវបានគេហៅថា ការកំណត់រចនាសម្ព័ន្ធ) ។
ហេតុផលសម្រាប់ stereoisomerism អុបទិកគឺដោយសារតែជាក់លាក់នៃការរៀបចំក្រុមជំនួសនៅលើអាតូមកាបូននៅក្នុងស្ថានភាព sp 3 -hybridization នោះគឺជាមួយនឹងកាបូនឆ្អែតនៅកំពូលនៃ tetrahedron (ការរៀបចំអាតូមក្នុងលំហដែលនាំទៅដល់ វត្តមាននៃ stereoisomerism ត្រូវបានគេហៅថា ការកំណត់រចនាសម្ព័ន្ធ) ។
និង ![]() ត្រូវបានកំណត់ដូចខាងក្រោមៈ
ត្រូវបានកំណត់ដូចខាងក្រោមៈ
ឧ.

អាល់កុល L, = -5.9
សម្រាប់សារធាតុទាំងនេះ ការកំណត់រចនាសម្ព័ន្ធឆ្វេង និងស្តាំគឺអាចធ្វើទៅបាន។
មិត្តរួមប្រណាំងគឺជាល្បាយនៃបរិមាណស្មើគ្នានៃ L- និង D-isomers ដែលអសកម្មអុបទិក។

តើការកំណត់រចនាសម្ព័ន្ធអ្វីខ្លះដែលបង្វិលប្លង់ប៉ូលនៃពន្លឺទៅខាងស្តាំ និងខាងឆ្វេង - សំណួរពិសេស. វាមិនត្រូវបានចាត់ទុកថានៅទីនេះទេ។
ចង្អុលទៅកាបូន - ចំណងដែលស្ថិតនៅពីលើយន្តហោះគំនូរ ចង្អុលទៅធាតុជំនួស - ខាងក្រោមយន្តហោះនេះ។
ឧទាហរណ៍បុរាណនៃ stereoisomer គឺ៖


ហ  ចំនួនអាតូម asymmetric អាចមានចំនួនច្រើន ក្នុងករណីទូទៅ។
ចំនួនអាតូម asymmetric អាចមានចំនួនច្រើន ក្នុងករណីទូទៅ។
* - អាតូម asymmetric ។ ចំនួន stereoisomers គឺស្មើនឹង 2 n ដែលដូចដែលអ្នកអានយកចិត្តទុកដាក់បានយល់រួចហើយ n គឺជាចំនួនអាតូមសកម្មអុបទិកមិនស៊ីមេទ្រី។
ធរណីមាត្រ (cis- និង trans-) isomers ។ទាំងនេះរួមបញ្ចូល isomers កំណត់រចនាសម្ព័ន្ធដែលមាន ចំណង។ ប្រភេទនៃ diastereomerism នេះគឺជាលក្ខណៈជាពិសេសនៃ alkenes ។ ទាក់ទងទៅនឹងប្លង់នៃចំណង សារធាតុជំនួសដូចគ្នាបេះបិទនៅលើអាតូមកាបូនពីរអាចមានទីតាំងនៅមួយក្នុងពេលតែមួយ (cis-) ឬខុសគ្នា (trans-) ជ្រុង (រូបភាពទី 7) ។ មូលហេតុចម្បងនៃអត្ថិភាពនៃស៊ីស៊ី និង trans isomers គឺជាភាពមិនអាចទៅរួចនៃការបង្វិលជុំវិញចំណងដោយមិនបំបែកវា។

អង្ករ។ 7. អ៊ីសូមធរណីមាត្រនៃ 2-butane ។
ស៊ីស- និង trans isomers មានលំដាប់អាតូមដូចគ្នា ប៉ុន្តែខុសគ្នាពីគ្នាទៅវិញទៅមកក្នុងការរៀបចំលំហនៃសារធាតុជំនួស ហើយដូច្នេះគឺជា stereoisomers ។ ម្យ៉ាងវិញទៀត ម៉ូលេគុលរបស់ពួកគេមិនមានអាតូមកាបូនមិនស៊ីមេទ្រី និងមិនមានសកម្មភាពអុបទិកទេ។
ស៊ីស- និង trans isomers មានលក្ខណៈសម្បត្តិរូបវន្តផ្សេងគ្នា និងអាចឆ្លងកាត់ប្រតិកម្ម (ឧទាហរណ៍ បន្ថែមក្នុងអត្រាផ្សេងគ្នា)។
isomers ធរណីមាត្រត្រូវបានរកឃើញជាញឹកញាប់ក្នុងចំណោមសមាសធាតុធម្មជាតិ ជាពិសេស isomer នៃ retinol (វីតាមីន A) ដែលចំណងទ្វេរទាំង 4 ស្ថិតនៅក្នុងការកំណត់រចនាសម្ព័ន្ធ trans មានសារៈសំខាន់ជាពិសេសសម្រាប់ធានានូវភាពមើលឃើញ។ រ៉ាឌីកាល់អ៊ីដ្រូកាបូននៃអាស៊ីតមិនឆ្អែតដែលបង្កើតជាខ្លាញ់រាវគឺស្ថិតនៅក្នុងការកំណត់រចនាសម្ព័ន្ធស៊ីស៊ីដែលទាក់ទងទៅនឹងចំណងទ្វេ។
