II.1. Cấu hình (đồng phân quay)
Sự chuyển đổi từ hydrocarbon hữu cơ đơn giản nhất - metan sang chất tương đồng gần nhất của nó - ethane - đặt ra các vấn đề về cấu trúc không gian, do đó, việc biết các thông số được thảo luận trong phần này là chưa đủ để giải quyết nó. Trên thực tế, không cần thay đổi góc liên kết hay độ dài liên kết, người ta có thể tưởng tượng ra nhiều dạng hình học của phân tử ethane, khác nhau ở sự quay tương hỗ của các tứ diện carbon xung quanh liên kết C-C nối chúng. Kết quả của vòng quay này, đồng phân quay (conformers) . Năng lượng của các chất phù hợp khác nhau là không giống nhau, nhưng hàng rào năng lượng ngăn cách các đồng phân quay khác nhau đối với hầu hết hợp chất hữu cơ bé nhỏ. Vì vậy, khi điều kiện bình thường Theo quy luật, không thể cố định các phân tử theo một hình dạng được xác định nghiêm ngặt: thông thường một số dạng quay dễ dàng biến đổi lẫn nhau cùng tồn tại ở trạng thái cân bằng.
Các phương pháp mô tả bằng đồ họa sự phù hợp và danh pháp của chúng như sau. Hãy bắt đầu với phân tử ethane. Đối với nó, người ta có thể thấy trước sự tồn tại của hai cấu hình khác nhau tối đa về năng lượng. Chúng được hiển thị dưới đây như phép chiếu phối cảnh (1) (“dê xưởng cưa”), hình chiếu bên (2) và Công thức Newman (3).
Trong phép chiếu phối cảnh (1a, 1b), kết nối C-C phải được tưởng tượng đi vào khoảng cách; Nguyên tử carbon ở bên trái ở gần người quan sát và nguyên tử carbon ở bên phải ở xa người quan sát hơn.
Trong hình chiếu ngang (2a, 2b), bốn nguyên tử H nằm trong mặt phẳng hình vẽ; Các nguyên tử carbon thực sự mở rộng phần nào ra khỏi mặt phẳng này, nhưng chúng thường được coi một cách đơn giản là cũng nằm trong mặt phẳng của hình vẽ. Các liên kết hình nêm “đậm” do độ dày của nêm cho thấy sự thoát ra khỏi mặt phẳng hướng tới người quan sát nguyên tử mà độ dày hướng về phía đó. Các kết nối hình nêm đứt nét đánh dấu khoảng cách từ người quan sát.
Trong phép chiếu Newman (3a, 3b), phân tử được xem xét dọc theo liên kết C-C (theo hướng chỉ bởi mũi tên trong công thức 1a, b). Ba đường phân kỳ một góc 120° so với tâm vòng tròn biểu thị các liên kết của nguyên tử carbon gần người quan sát nhất; các đường “thò ra” từ phía sau vòng tròn là các liên kết của nguyên tử cacbon ở xa.
Cấu hình hiển thị bên trái được gọi là bị che khuất : Tên này nhắc nhở chúng ta rằng các nguyên tử hydro của cả hai nhóm CH 3 đối diện nhau. Hình dạng bị che khuất đã làm tăng nội năng và do đó không thuận lợi. Cấu hình hiển thị bên phải được gọi là bị ức chế , ngụ ý rằng sự quay tự do xung quanh liên kết C-C bị “ức chế” ở vị trí này, tức là phân tử tồn tại chủ yếu ở dạng này.
Năng lượng tối thiểu cần thiết để quay hoàn toàn một phân tử xung quanh một liên kết cụ thể được gọi là rào cản quay cho kết nối này. Rào cản quay trong một phân tử như ethane có thể được biểu thị dưới dạng sự thay đổi năng lượng tiềm năng các phân tử có chức năng thay đổi góc lưỡng diện (xoắn) hệ thống. Góc lưỡng diện (ký hiệu là tau) được mô tả trong hình dưới đây:

Biểu đồ năng lượng của chuyển động quay xung quanh liên kết C-C trong ethane được thể hiện trong hình sau. Chuyển động quay của nguyên tử carbon “ngược” được mô tả bằng sự thay đổi góc nhị diện giữa hai nguyên tử hydro được hiển thị. Để đơn giản, các nguyên tử hydro còn lại đã bị bỏ qua. Rào cản quay ngăn cách hai dạng ethane chỉ là 3 kcal/mol (12,6 kJ/mol). Cực tiểu của đường cong thế năng tương ứng với những cấu hình bị ức chế và cực đại tương ứng với những cấu hình bị che khuất. Vì ở nhiệt độ phòng, năng lượng của một số va chạm phân tử có thể đạt tới 20 kcal/mol (khoảng 80 kJ/mol), rào cản 12,6 kJ/mol này có thể dễ dàng vượt qua và sự quay trong ethane được coi là tự do.
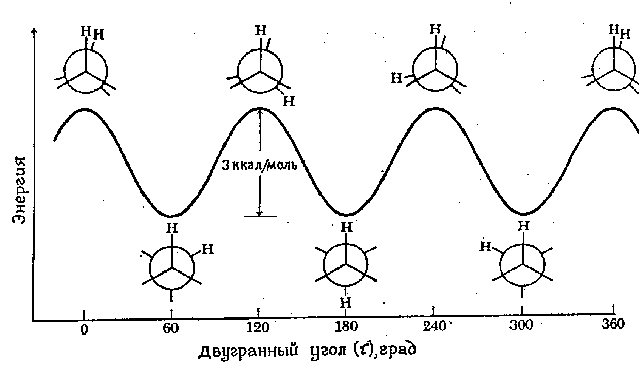
Chúng tôi nhấn mạnh rằng mỗi điểm trên đường cong năng lượng tiềm năng tương ứng với một hình dạng cụ thể. Các điểm tương ứng với cực tiểu tương ứng với các đồng phân hình dạng, nghĩa là các thành phần chiếm ưu thế trong một hỗn hợp của tất cả các dạng phù hợp có thể có .
Khi phân tử trở nên phức tạp hơn, số lượng cấu hình có thể khác nhau rõ rệt về năng lượng sẽ tăng lên. Vâng, đối với N-butan có thể được mô tả theo sáu dạng, khác nhau vị trí tương đối Nhóm CH 3, tức là xoay quanh kết nối trung tâm C-C. Dưới đây, cấu hình của n-butan được mô tả dưới dạng hình chiếu Newman. Những dạng thể hiện ở bên trái (được tô bóng) là không thuận lợi về mặt năng lượng; chỉ những dạng bị ức chế mới được nhận ra trên thực tế.
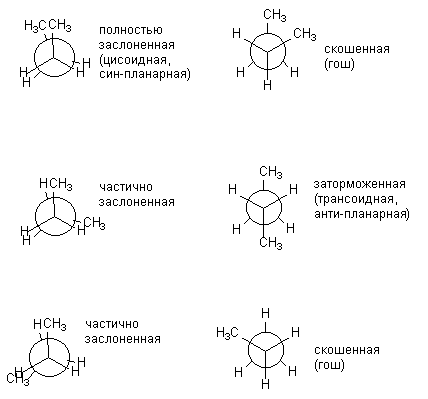
Các dạng bị che khuất và bị ức chế khác nhau của butan không giống nhau về năng lượng. Năng lượng tương ứng của tất cả các dạng hình thành trong quá trình quay quanh liên kết C-C trung tâm được trình bày dưới đây:


Khi một phân tử trở nên phức tạp hơn, số lượng cấu hình có thể có sẽ tăng lên.
Vì vậy, sự phù hợp là khác nhau không giống nhau các hình thức không gian phân tử có cấu hình xác định. Chất phù hợp là các cấu trúc đồng phân lập thể ở trạng thái cân bằng di động và có khả năng chuyển đổi lẫn nhau bằng cách quay quanh các liên kết đơn giản.
Đôi khi rào cản đối với những biến đổi như vậy trở nên đủ cao để tách các dạng đồng phân lập thể (ví dụ: biphenyl hoạt tính quang học;). Trong những trường hợp như vậy, họ không còn nói về những người tuân thủ nữa mà nói về sự tồn tại thực sự của đồng phân lập thể .
II.2. đồng phân hình học
Một hệ quả quan trọng của tính cứng của liên kết đôi (không có chuyển động quay quanh nó) là sự tồn tại đồng phân hình học . Phổ biến nhất trong số đó là đồng phân cis-trans các hợp chất thuộc dãy ethylene chứa các nhóm thế không bằng nhau trên các nguyên tử chưa bão hòa. Ví dụ đơn giản nhất là các đồng phân của butene-2.

Các đồng phân hình học có cùng cấu trúc hóa học(cùng thứ tự liên kết hóa học), khác nhau về sự sắp xếp không gian của các nguyên tử, theo cấu hình . Sự khác biệt này tạo nên sự khác biệt về mặt vật chất (cũng như tính chất hóa học). Các đồng phân hình học, trái ngược với các chất đồng phân, có thể được phân lập ở dạng tinh khiết và tồn tại dưới dạng các chất riêng lẻ, ổn định. Sự biến đổi lẫn nhau của chúng thường đòi hỏi năng lượng khoảng 125-170 kJ/mol (30-40 kcal/mol). Năng lượng này có thể được truyền bằng cách nung nóng hoặc chiếu xạ.
Trong những trường hợp đơn giản nhất, danh pháp của các đồng phân hình học không gặp bất kỳ khó khăn nào: cis- các dạng là các đồng phân hình học trong đó các nhóm thế giống hệt nhau nằm trên cùng một phía của mặt phẳng liên kết pi, xuất thần- đồng phân có nhóm thế giống hệt nhau các mặt khác nhau từ mặt phẳng liên kết pi. Trong những trường hợp phức tạp hơn nó được sử dụng Z, Danh pháp điện tử . Nguyên tắc chính của nó: để chỉ ra cấu hình cho biết cis-(Z, từ tiếng Đức Zusammen - cùng nhau) hoặc xuất thần-(E, từ tiếng Đức Entgegen - đối diện) vị trí đại biểu cấp cao với một liên kết đôi.
Trong hệ thống Z,E, các nhóm thế có số nguyên tử cao hơn được coi là cao cấp. Nếu các nguyên tử liên kết trực tiếp với các nguyên tử cacbon không bão hòa giống nhau, thì chúng sẽ chuyển sang “lớp thứ hai”, nếu cần - sang “lớp thứ ba”, v.v.
Hãy xem xét việc áp dụng các quy tắc của danh pháp Z,E bằng hai ví dụ.

| TÔI | II |
Hãy bắt đầu với công thức I, trong đó mọi thứ được giải quyết bằng các nguyên tử của “lớp đầu tiên”. Sau khi sắp xếp số nguyên tử của chúng, chúng ta thấy rằng các nhóm thế cao cấp của mỗi cặp (brom ở phần trên của công thức và nitơ ở phần dưới) nằm trong xuất thần-vị trí, do đó có tên gọi hóa học lập thể E:
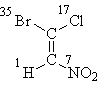 E-1-bromo-1-chloro-2-nitroethene
E-1-bromo-1-chloro-2-nitroethene
Để xác định ký hiệu hóa học lập thể của cấu trúc II, cần phải tìm kiếm sự khác biệt ở “các lớp cao hơn”. Ở lớp thứ nhất, các nhóm CH 3, C 2 H 5, C 3 H 7 không khác nhau. Ở lớp thứ hai nhóm CH có tổng 3 số nguyên tử bằng ba (ba nguyên tử hydro), nhóm C 2 H 5 và C 3 H 7 mỗi nhóm có 8. Điều này có nghĩa là nhóm CH 3 không được xem xét - nó trẻ hơn hai nhóm còn lại. Như vậy, các nhóm cao cấp là C 2 H 5 và C 3 H 7, nó nằm trong cis-chức vụ; ký hiệu hóa học lập thể Z.
 Z-3-metylhepten-3
Z-3-metylhepten-3
Nếu cần xác định nhóm nào cũ hơn - C 2 H 5 hoặc C 3 H 7, người ta sẽ phải đi đến các nguyên tử của “lớp thứ ba”; tổng số nguyên tử trong lớp này đối với cả hai nhóm sẽ bằng nhau; tương ứng là 3 và 8, tức là C3H7 cũ hơn C2H5. Trong những trường hợp xác định độ ưu tiên phức tạp hơn, phải tính thêm các điều kiện như: một nguyên tử liên kết bằng liên kết đôi được tính hai lần, liên kết bằng liên kết ba - ba lần; Trong số các đồng vị, đồng vị nặng hơn thì cũ hơn (đơteri già hơn hydro) và một số đồng vị khác.
Lưu ý rằng ký hiệu Z Không là những từ đồng nghĩa cis- các ký hiệu, như ký hiệu E, không phải lúc nào cũng tương ứng với vị trí xuất thần-, Ví dụ:

cis- 1,2-dichloropropene-1 cis- 1,2-diclo-1-bromopropene-1
Z-1,2-dichloropropene-1 E-1,2-dichloro-1-bromopropene-1
Kiểm soát nhiệm vụ
1. Bombicol - một loại pheromone (chất kích thích sinh dục) của tằm - là E-10-Z-12-hexadecadienol-1. Hãy hình dung anh ấy công thức cấu tạo.
2. Gọi tên các hợp chất sau theo danh pháp Z,E:

II.3. Đồng phân quang học (enantomeism)
Trong số các hợp chất hữu cơ có những chất có khả năng làm quay mặt phẳng phân cực của ánh sáng. Hiện tượng này được gọi là hoạt động quang học và các chất tương ứng là hoạt động quang học . Các chất có hoạt tính quang học xếp thành cặp phản cực quang - các đồng phân, các tính chất vật lý và hóa học giống hệt nhau trong điều kiện bình thường, ngoại trừ một điều - dấu hiệu quay của mặt phẳng phân cực. (Ví dụ, nếu một trong các phản cực quang học có góc quay cụ thể [CHÚ THÍCH 1] +20 o, thì đối cực kia có góc quay cụ thể là -20 o).
II.4. Công thức chiếu
Đối với hình ảnh thông thường của một nguyên tử bất đối xứng trên mặt phẳng, hãy sử dụng công thức chiếu của E. Fisher . Chúng thu được bằng cách chiếu lên một mặt phẳng các nguyên tử mà nguyên tử bất đối xứng được liên kết. Trong trường hợp này, nguyên tử bất đối xứng thường bị bỏ qua, chỉ giữ lại các đường giao nhau và ký hiệu nhóm thế. Để ghi nhớ sự sắp xếp không gian của các nhóm thế, một đường thẳng đứng đứt nét thường được giữ nguyên trong công thức chiếu (các nhóm thế trên và dưới được loại bỏ ngoài mặt phẳng hình vẽ), nhưng điều này thường không được thực hiện. Dưới đây là nhiều cách khác nhau ghi công thức chiếu tương ứng với mô hình bên trái ở hình trước:

Dưới đây là một số ví dụ về công thức chiếu:

(+)-alanine (-)-butanol (+)-glyceraldehyde
Tên của các chất chỉ ra dấu quay của chúng: ví dụ, điều này có nghĩa là đối cực trái của butanol-2 có cấu hình không gian , được biểu thị chính xác bằng công thức trên và hình ảnh phản chiếu của nó tương ứng với butanol-2 dextrorotatory. Định nghĩa cấu hình các phản cực quang học được thực hiện bằng thực nghiệm [CHÚ THÍCH 3].
Về nguyên tắc, mỗi phản cực quang có thể được mô tả bằng mười hai (!) công thức chiếu khác nhau - tùy thuộc vào cách định vị mô hình trong quá trình chiếu và chúng ta nhìn nó từ phía nào. Để chuẩn hóa các công thức chiếu, một số quy tắc viết chúng đã được đưa ra. Như vậy, chức năng chính nếu ở cuối chuỗi thường được đặt ở trên cùng, chuỗi chính được mô tả theo chiều dọc.
Để so sánh các công thức chiếu viết “không chuẩn” bạn cần biết tuân theo các quy tắc các phép biến đổi của công thức chiếu.
1. Các công thức có thể được xoay 180° trong mặt phẳng vẽ mà không làm thay đổi ý nghĩa hóa học lập thể của chúng:

2. Sự sắp xếp lại hai (hoặc số chẵn bất kỳ) của các nhóm thế trên một nguyên tử bất đối xứng không làm thay đổi ý nghĩa hóa học lập thể của công thức:

3. Một (hoặc bất kỳ số lẻ) hoán vị nào của các nhóm thế ở tâm bất đối xứng dẫn đến công thức của phản cực quang:

4. Xoay 90° trong mặt phẳng vẽ sẽ biến công thức thành một công thức đối cực, trừ khi đồng thời điều kiện về vị trí của các nhóm thế so với mặt phẳng vẽ bị thay đổi, tức là. đừng coi rằng bây giờ các nhóm thế bên nằm phía sau mặt phẳng vẽ, còn phần trên và phần dưới ở phía trước nó. Nếu bạn sử dụng công thức có đường chấm chấm thì hướng đã thay đổi của đường chấm chấm sẽ trực tiếp nhắc nhở bạn về điều này:

5. Thay vì hoán vị, các công thức chiếu có thể được biến đổi bằng cách xoay ba nhóm thế bất kỳ theo chiều kim đồng hồ hoặc ngược chiều kim đồng hồ; nhóm thế thứ tư không thay đổi vị trí của nó (thao tác này tương đương với hai hoán vị):

6. Các công thức phép chiếu không thể được suy ra từ mặt phẳng của hình vẽ (ví dụ: bạn không thể xem xét chúng “dưới ánh sáng” từ mặt sau của tờ giấy - trong trường hợp này, ý nghĩa hóa học lập thể của công thức sẽ thay đổi).
II.5. Bạn cùng chủng tộc
Nếu công thức của một chất có chứa một nguyên tử bất đối xứng thì điều này không có nghĩa là chất đó sẽ có hoạt tính quang học. Nếu một tâm bất đối xứng xuất hiện trong một phản ứng bình thường (sự thay thế trong nhóm CH 2, phép cộng ở liên kết đôi, v.v.), thì xác suất tạo ra cả hai cấu hình đối cực là như nhau. Do đó, mặc dù có sự bất đối xứng của từng phân tử riêng lẻ, nhưng chất thu được lại không hoạt động về mặt quang học. Loại biến đổi không hoạt động về mặt quang học này, bao gồm một lượng bằng nhau của cả hai phản cực, được gọi là bạn cùng chủng tộc [LƯU Ý 4] .
II.6. Diastereomeism
Các hợp chất có nhiều nguyên tử bất đối xứng có những đặc điểm quan trọng giúp phân biệt chúng với các chất hoạt tính quang học đơn giản hơn có một tâm bất đối xứng đã được thảo luận trước đó.
Giả sử rằng trong phân tử của một chất nào đó có hai nguyên tử bất đối xứng; Hãy gọi chúng một cách có điều kiện là A và B. Dễ dàng nhận thấy rằng các phân tử có khả năng kết hợp sau đây là có thể:
Phân tử 1 và 2 là một cặp phản cực quang học; điều tương tự cũng áp dụng cho cặp phân tử 3 và 4. Nếu chúng ta so sánh các phân tử từ các cặp đôi khác nhau các phản cực - 1 và 3, 1 và 4, 2 và 3, 2 và 4, khi đó chúng ta sẽ thấy rằng các cặp được liệt kê không phải là các phản cực quang: cấu hình của một nguyên tử bất đối xứng là như nhau, cấu hình của nguyên tử kia không giống nhau . Đây đều là những cặp đôi chất đồng phân không đối quang , tức là đồng phân không gian, Không tạo thành các đối cực quang với nhau.
Các đồng phân không đối quang khác nhau không chỉ ở độ quay quang học mà còn ở tất cả các hằng số vật lý khác: chúng có điểm nóng chảy và điểm sôi khác nhau, độ hòa tan khác nhau, v.v. Sự khác biệt về tính chất của các đồng phân không đối quang thường không kém sự khác biệt về tính chất giữa các đồng phân cấu trúc. .
Một ví dụ về hợp chất thuộc loại này là axit clomalic

Các dạng đồng phân lập thể của nó có các công thức chiếu sau:
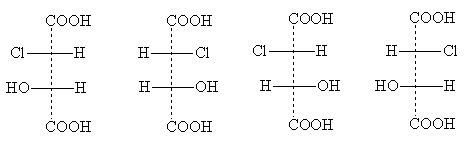
hồng cầu- các hình thức ba- các hình thức
Tiêu đề hồng cầu- Và bộ ba- lấy từ tên của carbohydrate erythrose và threose. Những tên này được sử dụng để chỉ vị trí tương đối của các nhóm thế trong các hợp chất có hai nguyên tử không đối xứng: hồng cầu -đồng phân chúng là những chất có hai nhóm thế bên giống hệt nhau xuất hiện trong công thức chiếu tiêu chuẩn ở một bên (phải hoặc trái); bộ ba -đồng phân có các nhóm thế bên giống hệt nhau ở các phía khác nhau của công thức chiếu [CHÚ THÍCH 5].
Hai hồng cầu- các chất đồng phân là một cặp phản cực quang học; khi chúng trộn lẫn với nhau sẽ tạo thành một loại racemate. Một cặp đồng phân quang học là và ba- các hình thức; chúng cũng tạo ra chất đồng phân khi trộn lẫn, chất này khác về tính chất so với chất đồng phân hồng cầu- các hình thức. Như vậy, có tổng cộng bốn đồng phân có hoạt tính quang học của axit chloromalic và hai đồng phân racemic.
Với sự gia tăng hơn nữa về số lượng các trung tâm bất đối xứng, số lượng các đồng phân không gian cũng tăng lên và mỗi trung tâm bất đối xứng mới sẽ nhân đôi số lượng các đồng phân. Nó được xác định theo công thức 2 n, trong đó n là số tâm bất đối xứng.
Số lượng đồng phân lập thể có thể giảm do tính đối xứng từng phần xuất hiện ở một số cấu trúc. Một ví dụ là axit tartaric, trong đó số lượng đồng phân lập thể riêng lẻ giảm xuống còn ba. Công thức chiếu của họ:
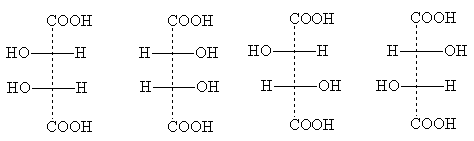
Công thức I giống hệt với công thức Ia: nó biến đổi thành công thức này khi quay 180° trong mặt phẳng của hình vẽ và do đó, không biểu thị một đồng phân lập thể mới. Đây là một sửa đổi không hoạt động về mặt quang học - dạng meso . Không giống như racemate, có thể được chia thành quang học phản âm, trung- về cơ bản, hình dạng này là không thể phá hủy: mỗi phân tử của nó có một tâm bất đối xứng của một cấu hình và cấu hình thứ hai - ngược lại. Kết quả là xảy ra hiện tượng bù nội phân tử khi quay của cả hai trung tâm bất đối xứng.
Meso- Tất cả các chất hoạt tính quang học đều có dạng với một số tâm bất đối xứng giống hệt nhau (tức là liên kết với các nhóm thế giống hệt nhau) [CHÚ THÍCH 6]. Công thức chiếu trung- các hình thức luôn có thể được nhận ra bởi thực tế là chúng luôn có thể được chia bằng một đường ngang thành hai nửa, khi viết trên giấy, chúng giống hệt nhau về mặt hình thức, nhưng trên thực tế lại được phản chiếu:

Công thức II và III mô tả các đối cực quang học của axit tartaric; khi chúng được trộn lẫn, một loại racemate không hoạt động về mặt quang học được hình thành - axit nho.
II.7. Danh pháp các đồng phân quang học
Hệ thống danh pháp đơn giản nhất, lâu đời nhất nhưng vẫn được sử dụng của các phản cực quang dựa trên việc so sánh công thức chiếu của phản cực được gọi với công thức chiếu của một chất chuẩn nhất định được chọn làm “chìa khóa”. Vì vậy, đối với axit alpha hydroxy và axit amin alpha, điều quan trọng là phần trên công thức chiếu của chúng (theo ký hiệu chuẩn):

L- axit hydroxy (X = OH) D- axit hydroxy (X = OH)
Axit L-amino (X = NH 2) D- axit amin (X = NH 2)
Cấu hình của tất cả các axit alpha-hydroxy có nhóm hydroxyl ở bên trái trong công thức chiếu Fischer được viết tiêu chuẩn được biểu thị bằng dấu L; nếu hydroxyl nằm trong công thức chiếu bên phải - dấu D[LƯU Ý 7] .
Chìa khóa để chỉ định cấu hình của đường là glyceraldehyd:

L-(-)-glyceraldehyde D-(+)-glyceraldehyde
Trong phân tử đường, ký hiệu D- hoặc L-đề cập đến cấu hình thấp hơn trung tâm bất đối xứng.
Hệ thống D-,L- Việc chỉ định có những hạn chế đáng kể: thứ nhất, việc chỉ định D- hoặc L- chỉ ra cấu hình của chỉ một nguyên tử bất đối xứng; thứ hai, đối với một số hợp chất, các ký hiệu khác nhau thu được, tùy thuộc vào việc khóa glyceraldehyd hay hydroxyaxit được lấy làm khóa, ví dụ:

Những thiếu sót này của hệ thống then chốt hiện nay hạn chế việc sử dụng nó ở ba loại chất hoạt tính quang học: đường, axit amin và axit hydroxy. Được thiết kế để sử dụng chung "Hệ thống R,S Kahn, Ingold và Prelog [CHÚ THÍCH 8].
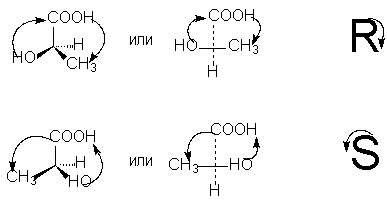
Để xác định cấu hình R hoặc S của phản cực quang, cần sắp xếp tứ diện các nhóm thế xung quanh nguyên tử carbon bất đối xứng sao cho nhóm thế thấp nhất (thường là hydro) có hướng “cách xa người quan sát”. Sau đó, nếu xảy ra sự chuyển động trong quá trình chuyển đổi trong một vòng tròn của ba nhóm thế còn lại từ người lớn tuổi nhất đến người có thâm niên trung bình rồi đến người trẻ nhất ngược chiều kim đồng hồ - Cái này R -đồng phân (gắn liền với động tác tay khi viết chữ R), nếu theo chiều kim đồng hồ - Cái này S- đồng phân (gắn liền với chuyển động của tay khi viết chữ S).
Để xác định thâm niên của các nhóm thế trên một nguyên tử bất đối xứng, các quy tắc tính số nguyên tử được sử dụng mà chúng tôi đã xem xét liên quan đến danh pháp Z,E của các đồng phân hình học (xem).
Để chọn ký hiệu R, S theo công thức chiếu, cần phải bằng một số hoán vị chẵn (mà như chúng ta đã biết, không làm thay đổi ý nghĩa hóa học lập thể của công thức), sắp xếp các nhóm thế sao cho nhỏ nhất trong số đó. chúng (thường là hydro) nằm ở cuối công thức chiếu. Khi đó thâm niên của ba nhóm thế còn lại, rơi theo chiều kim đồng hồ, tương ứng với ký hiệu R, ngược chiều kim đồng hồ - ký hiệu S [LƯU Ý 9]:
Kiểm soát nhiệm vụ
3. Xác định cấu hình tâm bất đối xứng của axit ascorbic (vitamin C) (bằng cách R, S- danh pháp và so sánh với glyceraldehyd):

4. Ephedrin alkaloid có công thức:
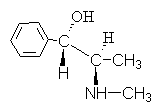
Đặt tên cho kết nối này bằng cách sử dụng R, S- danh pháp.
5. Cysteine - một loại axit amin không thiết yếu tham gia vào việc điều hòa các quá trình trao đổi chất, là L Axit -1-amino-2-mercaptopropionic. Viết công thức cấu tạo và gọi tên nó R,S- danh pháp.
6. Levomycetin (kháng sinh phổ rộng) là D(-)-threo-1-para-nitrophenyl-2-dichloroacetylamino-propanediol-1,3. Vẽ cấu trúc của nó dưới dạng công thức chiếu Fischer.
7. Synestrol là thuốc estrogen tổng hợp có cấu trúc không steroid. Đặt tên cho biết cấu hình hóa học lập thể của nó:

II.8. Hóa học lập thể của các hợp chất tuần hoàn
Khi một chuỗi các nguyên tử cacbon khép kín trong một chu trình phẳng, các góc liên kết của các nguyên tử cacbon buộc phải lệch khỏi giá trị tứ diện thông thường của chúng và độ lớn của độ lệch này phụ thuộc vào số lượng nguyên tử trong chu trình. Góc lệch của liên kết hóa trị càng lớn thì năng lượng dự trữ của phân tử càng lớn thì chu trình càng kém ổn định. Tuy nhiên, chỉ có hydrocacbon mạch vòng ba cạnh (cyclopropane) có cấu trúc phẳng; Bắt đầu từ cyclobutane, các phân tử cycloalkane có cấu trúc không phẳng, làm giảm “sức căng” trong hệ thống.
Phân tử cyclohexane có thể tồn tại ở một số dạng trong đó các góc liên kết “bình thường” được giữ lại (để đơn giản, chỉ hiển thị các nguyên tử carbon):
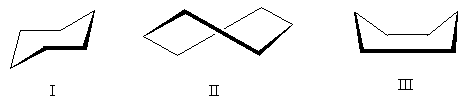
Dạng có lợi nhất về mặt năng lượng là dạng I - còn gọi là dạng "ghế bành". Cấu Hình II - "xoắn" - chiếm vị trí trung gian: kém thuận lợi hơn cấu hình ghế (do có các nguyên tử hydro bị che khuất trong đó), nhưng thuận lợi hơn cấu trúc III. Cấu Hình III - "bồn tắm" - kém thuận lợi nhất trong ba loại do lực đẩy đáng kể của các nguyên tử hydro hướng lên trên.
Việc xem xét 12 liên kết C-H trong cấu hình ghế cho phép chúng ta chia chúng thành hai nhóm: sáu trục các kết nối được định hướng luân phiên lên xuống và sáu xích đạo các kết nối hướng tới các bên. Trong các xyclohexan đơn thế, nhóm thế có thể ở vị trí xích đạo hoặc trục. Hai dạng cấu hình này thường ở trạng thái cân bằng và nhanh chóng chuyển hóa lẫn nhau thông qua dạng xoắn:

Cấu hình xích đạo (e) thường kém năng lượng hơn và do đó có lợi hơn cấu hình trục (a).
Khi các nhóm thế (chuỗi bên) xuất hiện trong các vòng, ngoài vấn đề về cấu tạo của vòng, nhà nghiên cứu còn gặp phải các vấn đề cấu hình thay thế : do đó, trong trường hợp có sự có mặt của hai nhóm thế giống hệt nhau hoặc khác nhau, cis-trans-đồng phân. Lưu ý rằng nói về cis-trans- cấu hình của các nhóm thế chỉ có ý nghĩa khi áp dụng cho các vòng vừa và nhỏ bão hòa (lên đến C 8): trong các vòng có một số lượng lớn tính di động của các liên kết đã trở nên quan trọng đến mức các cuộc thảo luận về cis- hoặc xuất thần- vị trí của các đại biểu mất đi ý nghĩa.
Vì thế, ví dụ cổ điển là các axit cyclopropane-1,2-dicarboxylic đồng phân lập thể. Có hai axit đồng phân lập thể: một trong số chúng có mp. 139 o C, có khả năng tạo thành anhydrit tuần hoàn và do đó, cis-đồng phân. Một axit đồng phân lập thể khác mp. 175 o C, không tạo thành anhydrit tuần hoàn; Cái này xuất thần-đồng phân [CHÚ THÍCH 10]:
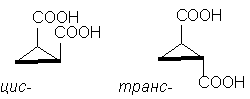
Hai axit 1,2,2-trimethylcyclopentane-1,3-dicarboxylic lập thể có cùng mối quan hệ với nhau. Một trong số đó, axit long não, mp. 187 o C, tạo thành anhydrit và do đó, là cis-đồng phân. Loại còn lại là axit isocamphoric, mp. 171 o C, - không tạo thành anhydrit, chất này xuất thần-đồng phân:

cis-trans-
Mặc dù phân tử cyclopentane thực sự không phẳng, nhưng để rõ ràng, sẽ thuận tiện hơn khi mô tả nó ở dạng phẳng, như trong hình trên, hãy nhớ rằng trong cis-đồng phân có hai nhóm thế ở một bên của chu kỳ , và trong xuất thần-đồng phân - ở phía đối diện của chu kỳ .
Các dẫn xuất cyclohexane bị loại bỏ cũng có thể tồn tại ở dạng cis hoặc trans:
Nguyên tử carbon không có độc quyền trong việc tạo ra các trung tâm trị liệu trong các phân tử của các hợp chất hữu cơ. Trung tâm của chirality cũng có thể là các nguyên tử silicon, thiếc và nitơ hóa trị bốn trong muối amoni bậc bốn và oxit amin bậc ba:

Trong các hợp chất này, tâm bất đối xứng có cấu hình tứ diện, giống như nguyên tử cacbon bất đối xứng. Tuy nhiên, cũng có những hợp chất có cấu trúc không gian khác nhau của trung tâm trị liệu.
Các trung tâm trị liệu được hình thành bởi các nguyên tử nitơ hóa trị ba, phốt pho, asen, antimon và lưu huỳnh có cấu hình hình chóp. Về nguyên tắc, tâm bất đối xứng có thể được coi là tứ diện nếu cặp electron đơn độc của nguyên tử dị hợp được lấy làm nhóm thế thứ tư:

Hoạt động quang học cũng có thể xảy ra không có trung tâm trị liệu, do tính chất chirality của cấu trúc của toàn bộ phân tử ( chirality phân tử hoặc sự bất đối xứng phân tử ). Hầu hết ví dụ điển hình có sẵn trục bất đối xứng hoặc mặt phẳng chirus .
Ví dụ, trục bất đối xuất hiện trong các alen chứa các nhóm thế khác nhau ở sp 2-nguyên tử cacbon lai. Dễ dàng nhận thấy rằng các hợp chất dưới đây là hình ảnh phản chiếu và do đó là phản cực quang học:

Trục chirality được hiển thị trong hình bằng một mũi tên.
Một loại hợp chất khác có trục bất đối là biphenyl có hoạt tính quang học, có chỉnh hình-Các vị trí có các nhóm thế cồng kềnh gây khó khăn cho việc xoay tự do xung quanh Kết nối SS kết nối các vòng are:

Mặt phẳng bất đối xứng được đặc trưng bởi thực tế là nó có thể được phân biệt giữa các bên "trên" và "dưới", cũng như các bên "phải" và "trái". Một ví dụ về các hợp chất có mặt phẳng đối xứng là hợp chất có hoạt tính quang học xuất thần- cyclooctene và một dẫn xuất ferrocene có hoạt tính quang học.
đồng phân là các hợp chất có cùng thành phần định tính và định lượng (công thức phân tử), nhưng khác nhau về trình tự liên kết của các nguyên tử hoặc sự sắp xếp của chúng trong không gian. Vì cấu trúc của các hợp chất này khác nhau nên tính chất hóa học hoặc vật lý của các đồng phân. là khác nhau.
Các loại đồng phân: cấu trúc (đồng phân cấu trúc) và đồng phân lập thể (không gian).
Đồng phân cấu trúc có thể ba loại:
– đồng phân của khung carbon (các đồng phân theo cấu trúc của chuỗi carbon), ví dụ butan (hợp chất có cấu trúc không phân nhánh hoặc bình thường) và 2-methylpropane (hợp chất có cấu trúc phân nhánh);
– các đồng phân về vị trí của các nhóm chức (hoặc nhiều liên kết), ví dụ 1-butanol (nhóm hydroxyl được nối với nguyên tử carbon thứ nhất trong chuỗi) và 2-butanol (nhóm hydroxyl được liên kết với nguyên tử carbon thứ 2 trong chuỗi );
– các chất đồng phân nhóm chức (hoặc các chất đồng phân liên lớp), ví dụ, 1-butanol (rượu) và dietyl ete (ete).
Đồng phân lập thể được chia thành hình dạng và cấu hình.
Cấu hình của một phân tử thể hiện sự đa dạng của nó hình dạng hình học, sinh ra do sự quay quanh các liên kết đơn giản.
Cấu hình là sự sắp xếp của các nguyên tử trong không gian mà không tính đến sự khác biệt phát sinh do sự quay quanh các liên kết đơn giản.
Cấu hình của các phân tử hữu cơ. Chuyển động quay quanh liên kết C – C được thực hiện tương đối dễ dàng, chuỗi hydrocarbon có thể có nhiều dạng khác nhau. Các dạng hình dạng dễ dàng biến đổi lẫn nhau và do đó không phải là các hợp chất khác nhau - chúng là các dạng động không ổn định khác nhau của cùng một phân tử. Sự chênh lệch năng lượng giữa các chất tuân thủ có cùng thứ tự với năng lượng của chuyển động nhiệt (vài kJ/mol). Do đó, ở nhiệt độ bình thường, các chất tuân thủ riêng lẻ không thể bị cô lập.
Sự khác biệt được tạo ra giữa sự phù hợp bị lu mờ và bị ức chế (Hình 2).
Cơm. 2. Cấu hình của pentan: a – che khuất; b – bị ức chế
Trong hình. Hình 2 cho thấy sự hình thành của pentan dựa trên liên kết giữa nguyên tử cacbon thứ hai và thứ ba của chuỗi. Có thể thấy rằng trong cấu hình bị lu mờ, các nguyên tử hydro hoặc carbon dường như che khuất lẫn nhau. Cấu hình bị ức chế xảy ra do sự quay của một trong các nguyên tử 60 và khoảng cách giữa các nguyên tử không liên kết tăng lên một chút, lực đẩy của quỹ đạo electron của nguyên tử giảm và cấu hình này thuận lợi hơn về mặt năng lượng. Các phân tử của nhiều hợp chất hữu cơ là hỗn hợp của các chất tuân thủ; do chuyển động nhiệt, các phân tử trải qua các biến đổi hình dạng liên tục.
Công thức chiếu Newman.Để mô tả sự phù hợp, người ta sử dụng các công thức phép chiếu Newman, thu được bằng cách chiếu phân tử C lên mặt phẳng – C-kết nối. Như một ví dụ trong hình. Hình 3 cho thấy sự hình thành của pentan so với liên kết C 2 –C 3.
Nguyên tử carbon gần người quan sát nhất (C 2) được biểu thị bằng một dấu chấm ở giữa vòng tròn; vòng tròn tượng trưng cho nguyên tử carbon bị loại bỏ (C 3). Ba liên kết từ một nguyên tử được mô tả dưới dạng các đường phân kỳ từ tâm vòng tròn - đối với một nguyên tử ở gần (C 2) hoặc “nhô ra” từ phía sau vòng tròn - đối với một nguyên tử ở xa (C 3). các nguyên tử carbon được đề cập dường như che khuất lẫn nhau, cấu trúc được gọi là lu mờ (Hình 3. a), khi một trong các nguyên tử quay so với nguyên tử kia một góc 60°, chúng ta thu được cấu hình bị ức chế thuận lợi hơn về mặt năng lượng (Hình 2). 3. b).

Cơm. 3. Công thức chiếu Newman cho a: cấu hình bị che khuất của pentan và b: cấu dạng bị ức chế của pentan.
Cấu hình của các hợp chất vòng. Chu kỳ không hợp chất thơm, như một quy luật, không bằng phẳng. Để giảm ứng suất góc và xoắn có thể phát sinh do sự khác biệt về giá trị của góc liên kết và góc đa giác, một hoặc nhiều nguyên tử vòng có thể được đặt trong một mặt phẳng khác so với các nguyên tử còn lại. Do đó, chu trình năm thành viên có thể có hình dạng của một đường bao trong không gian (Hình 4) và chu kỳ sáu thành viên có thể có hình dạng bồn tắm hoặc ghế (Hình 5).
Cơm. 4. Cấu hình của cyclopentane
Trong cấu trúc vỏ, một trong các nguyên tử carbon di chuyển ra khỏi mặt phẳng chứa bốn nguyên tử còn lại. Bất kỳ nguyên tử nào trong số năm nguyên tử đều có thể thoát ra khỏi mặt phẳng, và do đó chu trình dường như chuyển động không đổi giống như sóng.

Cơm. 5. Cấu hình của cyclohexane: a – ghế và b – bồn tắm.
Trong cấu hình ghế và bồn tắm, 2 nguyên tử carbon nằm bên ngoài mặt phẳng, trong đó có thêm 4 nguyên tử nữa.
Trong cấu hình ghế của cyclohexane không có vị trí bị chặn của các nguyên tử hydro và carbon: sự sắp xếp các nguyên tử hydro trên tất cả các nguyên tử carbon giống như trong cấu hình bị ức chế của ethane.
Sáu liên kết C – H, song song với trục đối xứng của dạng cyclohexane hình ghế, hướng lên xuống xen kẽ, được gọi là trục (biểu tượng MỘT) .Sáu C còn lại – Các liên kết H nằm ở góc 109,5° so với trục này và cũng luân phiên hướng lên và xuống. Những kết nối này được gọi là xích đạo (ký hiệu e). Do đó, mỗi nguyên tử carbon có một liên kết với một nguyên tử hydro nằm ở trục và một liên kết ở xích đạo. Hình dạng ghế thuận lợi hơn về mặt năng lượng.
Đồng phân cấu hình. đồng phân quang học. Cấu hình là các đồng phân lập thể có sự sắp xếp khác nhau xung quanh các nguyên tử nhất định của các nguyên tử, gốc hoặc nhóm chức khác trong không gian so với nhau. Chúng chủ yếu bao gồm các chất đồng phân đối quang - các chất hoạt tính quang học là hình ảnh phản chiếu của nhau.
Những chất nào được gọi là hoạt động quang học? Đây là những hợp chất có khả năng làm thay đổi góc nghiêng của mặt phẳng phân cực của ánh sáng phân cực phẳng. Hãy nhớ lại rằng ánh sáng thông thường (từ mặt trời hoặc đèn) là sóng điện từ trong đó các hạt dao động theo mọi hướng trong các mặt phẳng vuông góc với nhau và vuông góc với hướng truyền sóng. Trong ánh sáng phân cực phẳng, dao động của các hạt nằm trong cùng một mặt phẳng. Nếu một chùm tia đi qua một chất trong suốt có khả năng làm quay mặt phẳng dao động của điện trường theo một góc nhất định và tạo cho chúng một hướng mới, thì chất đó được cho là có hoạt động quang học.
Hai dấu hiệu hoạt động quang học của các hợp chất hữu cơ có thể được hình thành: sự có mặt của nguyên tử carbon bất đối xứng và sự vắng mặt của các nguyên tố đối xứng trong phân tử.
Nguyên tử cacbon bất đối xứng là nguyên tử liên kết với bốn nguyên tử khác nhau hoặc nhóm, thường được biểu thị bằng dấu hoa thị: *C.
Hãy xem xét phân tử alanine (axit 2-aminopropanoic), một axit amin là một phần của protein (Hình 6). Phân tử này có một nguyên tử cacbon không đối xứng (nguyên tử cacbon thứ hai, liên kết với bốn nhóm thế khác nhau: nhóm amino, nhóm cacboxyl, nguyên tử hydro và nhóm metyl -CH 3). Nguyên tử cacbon của nhóm cacboxyl không đối xứng vì anh ta không có 4 mà chỉ có 3 nhóm thế. Nguyên tử cacbon thứ ba (metyl cacbon) cũng không có tính chất bất đối xứng. Nó có 4 nhóm thế, nhưng 3 trong số đó giống nhau (nguyên tử hydro). Phân tử của hợp chất này không đối xứng; do đó, alanine là một hợp chất có hoạt tính quang học và có thể tồn tại ở dạng hai chất đồng phân đối ảnh. Các chất đồng phân đối ảnh được đặt tên theo danh pháp D,L, mô tả cấu hình tương đối của các chất đồng phân (liên quan đến cấu hình của glyceraldehyd).
Để mô tả và gọi tên một chất đồng phân đối ảnh, thuận tiện là đặt chuỗi cacbon của phân tử theo chiều dọc, khi đó các nhóm thế trên nguyên tử cacbon bất đối xứng xuất hiện ở bên phải và bên trái của nó. Nếu nhóm thế cao cấp (trong trường hợp của chúng tôi là nhóm amino) nằm ở bên trái thì đó là đồng phân L, nếu ở bên phải thì đó là đồng phân D (Hình 6).

Cơm. 6. Chất đồng phân của alanine.
Các chất đồng phân, không giống như các chất đồng phân, có cùng tính chất vật lý và hóa học; chúng chỉ khác nhau ở chỗ chúng quay mặt phẳng phân cực của ánh sáng phân cực phẳng theo cùng một góc, nhưng theo hướng ngược nhau (một bên trái, một bên phải) . Một hỗn hợp bao gồm lượng mol bằng nhau của các chất đồng phân đối ảnh được gọi là hỗn hợp chủng tộc hoặc chủng tộc. Racemate không có hoạt tính quang học.
Mặc dù có sự khác biệt nhỏ về tính chất nhưng hoạt động sinh học của các chất đồng phân đối ảnh lại rất khác nhau. Ví dụ, protein chỉ chứa các đồng phân L của axit amin, điều này giải thích đặc thù về cấu trúc không gian của protein và xác định tính chọn lọc của hoạt động xúc tác của các enzyme D-của axit amin khi đi vào cơ thể có thể gây ra nhiều quá trình tiêu cực khác nhau. do đó, cấu hình không gian của axit amin phải được tính đến trong quá trình sản xuất thuốc và các chất phụ gia thực phẩm khác nhau.
Một đồng phân của hợp chất này, -alanine (axit 3-aminopropanoic), cũng có trong cơ thể chúng ta. Hợp chất này không phải là một phần của protein và không có hoạt tính quang học, vì không có nguyên tử bất đối xứng trong đó. Nguyên tử carbon đầu tiên của nhóm carboxyl chỉ có 3 nhóm thế, nguyên tử thứ hai và thứ ba có 2 nhóm thế giống hệt nhau (nguyên tử hydro).
Chúng ta hãy tiếp tục xem xét hiện tượng đồng phân quang học. Các chất đặc trưng bởi hiện tượng này thường được gọi là chất đồng phân lập thể. Các đồng phân lập thể giống hệt nhau về tính chất vật lý và hóa lý, nhưng khác nhau ở hai khía cạnh:
1. Kết tinh ở dạng không có đối xứng mặt phẳng (mặt phẳng) mà liên hệ với nhau như một vật thể đối với ảnh phản chiếu của nó, ví dụ như hai loại tinh thể axit tartaric, làm nổi bật các axit tartaric đồng phân lập thể.

2. Các đồng phân lập thể, như đã lưu ý ở trên, phân cực ánh sáng một cách khác nhau. P  Sở dĩ có đồng phân lập thể quang học là do sự sắp xếp chính xác của các nhóm thế trên nguyên tử cacbon ở trạng thái lai hóa sp 3, nghĩa là với cacbon bão hòa ở các đỉnh của tứ diện (sự sắp xếp của các nguyên tử trong không gian, dẫn đến sự sự hiện diện của đồng phân lập thể, được gọi là cấu hình).
Sở dĩ có đồng phân lập thể quang học là do sự sắp xếp chính xác của các nhóm thế trên nguyên tử cacbon ở trạng thái lai hóa sp 3, nghĩa là với cacbon bão hòa ở các đỉnh của tứ diện (sự sắp xếp của các nguyên tử trong không gian, dẫn đến sự sự hiện diện của đồng phân lập thể, được gọi là cấu hình).
Và ![]() được ký hiệu như sau:
được ký hiệu như sau:
Ví dụ,

L-rượu,= –5.9
Đối với những chất này, có thể cấu hình thuận tay trái và tay phải.
Racemate là hỗn hợp của lượng đồng phân L và D bằng nhau, không hoạt động về mặt quang học.

Những cấu hình nào làm quay mặt phẳng phân cực ánh sáng sang phải và trái - câu hỏi đặc biệt. Nó không được xem xét ở đây.
Chỉ vào liên kết carbon nằm phía trên mặt phẳng vẽ, chỉ vào nhóm thế - bên dưới mặt phẳng này.
Các ví dụ cổ điển về đồng phân lập thể là:


H  Trong trường hợp tổng quát, số lượng nguyên tử bất đối xứng có thể nhiều.
Trong trường hợp tổng quát, số lượng nguyên tử bất đối xứng có thể nhiều.
* – nguyên tử bất đối xứng. Số lượng đồng phân lập thể bằng 2n, trong đó, như bạn đọc chú ý đã hiểu, n là số nguyên tử hoạt động quang học không đối xứng.
Đồng phân hình học (cis- và trans-). Chúng bao gồm các đồng phân cấu hình chứa liên kết . Loại đồng phân không đối quang này đặc biệt là đặc trưng của anken. So với mặt phẳng của liên kết , các nhóm thế giống hệt nhau trên hai nguyên tử cacbon có thể được định vị cùng một lúc (cis-) hoặc khác (trans-) hai bên (Hình 7). Lý do chính cho sự tồn tại của cis- và đồng phân trans là không thể quay quanh liên kết mà không phá vỡ nó.

Cơm. 7. Đồng phân hình học của 2-butan.
Cis- và các đồng phân trans có cùng trình tự liên kết nguyên tử, nhưng khác nhau về cách sắp xếp không gian của các nhóm thế và do đó là các đồng phân lập thể. Mặt khác, các phân tử của chúng không chứa các nguyên tử cacbon bất đối xứng và không có hoạt tính quang học.
Cis- và các đồng phân trans có các tính chất vật lý khác nhau và có thể trải qua các phản ứng (ví dụ, phản ứng cộng, ở các tốc độ khác nhau).
Đồng phân hình học thường được tìm thấy trong số các hợp chất tự nhiên; đặc biệt là đồng phân retinol (vitamin A), trong đó cả 4 liên kết đôi đều ở cấu hình trans, đặc biệt quan trọng để đảm bảo thị lực. Các gốc hydrocacbon của axit không bão hòa tạo nên chất béo lỏng có cấu hình cis so với liên kết đôi.
