TRỌNG LƯỢNG PHÂN TỬ(đồng nghĩa. trọng lượng phân tử) - khối lượng phân tử của một chất, biểu thị bằng đơn vị cacbon của khối lượng nguyên tử (đơn vị cacbon của khối lượng nguyên tử bằng 1/12 khối lượng nguyên tử của đồng vị cacbon 12 C); cùng với khối lượng nguyên tử, nó đóng vai trò là cơ sở cho tất cả các loại tính toán được thực hiện bằng hóa học. công thức và phương trình, bao gồm cả các phép tính được thực hiện trong hóa sinh. và các phòng thí nghiệm chẩn đoán lâm sàng.
Nếu hóa chất. công thức của một chất thì đó là M. v. có thể được tính bằng tổng trọng lượng nguyên tử (khối lượng) của các nguyên tử hóa học. các nguyên tố (xem trọng lượng nguyên tử) tạo nên phân tử của chất này. Ví dụ, M.v. khí cacbonic(CO2) bằng:
12,011 + 2 * 15,9994 = 44,0098.
Đối với các chất ở trạng thái khí hoặc hòa tan, phương pháp thí nghiệmđịnh nghĩa của M. thế kỷ. hợp lý nhất. M.v. (M1) của một chất khí thường được xác định bằng cách đo nó mật độ tương đối D cho khí, M.v. mà (M2) đã biết; thì M1 = M2*D. M.v. khí cũng có thể được xác định nếu biết mật độ bình thường d của nó, tức là khối lượng của 1 lít khí tính bằng gam ở áp suất 760 mm Hg. Nghệ thuật. và 0°C. Trong trường hợp này, M.v. khí bằng M = 22,42*d.
Để xác định M. thế kỷ. chất hòa tan trong dung môi như vậy, trong đó chất này không trải qua quá trình phân ly hoặc liên kết, sự giảm điểm đóng băng của dung dịch Δt (xem Cryometry) quan sát thấy trong quá trình hòa tan thường được đo MỘT g chất thử trong b g dung môi: M = (K*a*1000)/(Δt*b), trong đó K là hằng số đo nhiệt độ (cryometric) của dung môi.
M.v. chất hòa tan cũng có thể được xác định bằng cách đo áp suất thẩm thấu của dung dịch (xem Áp suất thẩm thấu). Trong trường hợp này, M = (m*R*T)/p, trong đó m là khối lượng của chất hòa tan tính bằng gam có trong 1 lít dung dịch, p là áp suất thẩm thấu tính bằng atm, T là nhiệt độ tính bằng độ Kelvin và R là hằng số nhiệt độ khí tính bằng l*atm/mol*deg. Phương pháp này được sử dụng thành công để xác định M. thế kỷ. protein, polysaccharides, nucleic và các hợp chất phân tử cao khác (xem). M.v. protein và các polyme sinh học khác có thể được xác định bằng siêu ly tâm (xem).
Trong thực hành hóa sinh, nêm, vệ sinh. phòng thí nghiệm để thực hiện các loại Trong tính toán, đơn vị đại lượng của một chất gọi là mol cũng được sử dụng rộng rãi.
Mol là một lượng chất chứa rất nhiều phân tử, nguyên tử, ion, electron hoặc các chất khác. đơn vị cấu trúc, có bao nhiêu nguyên tử có trong 12 g đồng vị cacbon 12 C. Số lượng phân tử, nguyên tử hoặc các đơn vị cấu trúc khác chứa trong một mol chất bất kỳ, gọi là số Avogadro, được xác định với độ chính xác cao. Đối với các tính toán thực tế, nó được lấy bằng
6,023*10 23 mol -1.
Khối lượng của một mol một chất, tính bằng gam, bằng M.v. chất đó được gọi là khối lượng mol hay gam-phân tử.
Thư mục: Belki, chủ biên. G. Neurath và C. Bailey, chuyển giới. từ tiếng Anh, tập 2, tr. 276, M., 195 6: Gaurowitz F. Hóa học và chức năng của protein, trans. từ tiếng Anh, M., 1965; Ostwald-Luther - Drucker, Đo lường lý hóa, trans. với tiếng Đức, phần 1, €. 294, L., 1935.
Chúng ta thấy rằng một trọng lượng nặng hơn đáng kể bảy quả bóng nhựa. Kinh nghiệm sử dụng cân cho chúng ta câu trả lời - trong một quả cân sắt có nhiều chất hơn, đó là nếu chúng ta so sánh khối lượng - thước đo quán tính của sắt và nhựa.
Nhưng điều gì sẽ xảy ra nếu chúng ta không so sánh khối lượng mà so sánh lượng chất tạo nên những quả bóng và trọng lượng, trên thực tế, số lượng hạt cấu thành nên chúng? Lấy những quả bóng và trọng lượng trên tay, chúng ta sẽ thấy rằng trọng lượng thực sự bị mất đi so với nền của những quả bóng này. Nếu chúng ta có thể đếm số lượng hạt có trong sắt và nhựa thì chúng ta sẽ thấy số lượng nguyên tử sắt sẽ tăng đáng kể. số lượng ít hơn phân tử trong tất cả các quả bóng nhựa. Điều này có nghĩa là có nhiều chất hơn trong nhựa.
Cả hai câu trả lời đều đúng.
Vấn đề là trong trường hợp đầu tiên, chúng tôi so sánh khối lượng, tức là thước đo quán tính của các vật thể, và trong trường hợp thứ hai, chúng tôi so sánh số lượng phân tử, lượng chất.
Chúng ta có thể rút ra một sự tương tự đơn giản với lượng đường trong cốc đong. Câu hỏi có bao nhiêu đường có thể được trả lời bằng cách nhìn vào sự phân chia của ly và cho biết có bao nhiêu gam đường. Bạn có thể đếm từng hạt trong cốc và trả lời xem cốc chứa bao nhiêu hạt. Cả câu trả lời thứ nhất và thứ hai đều đúng. Khi nào thuận tiện hơn khi nói về khối lượng phân tử và khi nào thuận tiện hơn khi nói về lượng chất? Đây chính xác là chủ đề của bài học: “Khối lượng phân tử, Lượng chất”.
Vào thế kỷ 19, nhà khoa học người Ý Avogadro đã thành lập sự thật thú vị: nếu hai loại khí khác nhau, ví dụ như hydro và oxy, ở trong cùng một bình, ở cùng áp suất và nhiệt độ, thì trong mỗi bình sẽ có cùng số lượng phân tử, mặc dù khối lượng của các khí có thể khác nhau rất nhiều, theo ví dụ của chúng tôi - 16 lần (Hình 2 ).
Cơm. 2. Thí nghiệm của Avogadro ()
Tất cả điều này có nghĩa là một số tính chất của vật thể được xác định chính xác bởi số lượng phân tử chứ không chỉ bởi khối lượng.
Chúng ta muốn nói gì qua thuật ngữ “lượng chất”? Bất kỳ chất nào cũng bao gồm các phân tử, nguyên tử, ion - có nghĩa là xét về lượng chất thì chúng ta hiểu được số lượng phân tử.
Đại lượng vật lý xác định số lượng phân tử trong cơ thể này, gọi điện lượng chất. được chỉ định chữ cái Hy Lạpν - khỏa thân.
Chúng tôi đã đồng ý lấy đơn vị lượng của một chất là lượng chứa số hạt (nguyên tử, phân tử) bằng số nguyên tử có trong 0,012 kg (12 gam) đồng vị cacbon có khối lượng nguyên tử 12.
Đơn vị này được gọi là nốt ruồi.
Từ định nghĩa này, suy ra rằng trong một mol của bất kỳ chất nào cũng sẽ có cùng số lượng phân tử. Một mol chất bất kỳ đều chứa 6.02 10 23 phân tử hoặc hạt. Đại lượng này được gọi là hằng số Avogadro.

Cơm. 3. Xác định tổng số phân tử ()
Công thức này cho phép bạn tìm hiểu số đầy đủ phân tử tại số lượng đã biết chất.
Khối lượng của phân tử cực kỳ nhỏ. Các nhà vật lý xác định điều này bằng cách sử dụng cái gọi là máy quang phổ khối. Ví dụ: giá trị khối lượng của một phân tử nước (Hình 4):

Cơm. 4. Xác định khối lượng của phân tử nước ()
Như chúng ta thấy, cũng giống như trong trường hợp lượng chất, việc so sánh khối lượng của một phân tử với khối lượng chuẩn, kilôgam, không thuận tiện lắm. Nếu trong trường hợp có lượng chất thì con số rất lớn thì trong trường hợp có khối lượng phân tử thì con số rất nhỏ. Đó là lý do tại sao một đơn vị ngoại hệ đặc biệt được chọn làm đơn vị đo khối lượng của phân tử hoặc nguyên tử - đơn vị khối lượng nguyên tử. Chúng ta sẽ so sánh một đơn vị khối lượng không phải với một tiêu chuẩn mà với khối lượng của một phân tử của một chất nào đó.
Chất này đã trở thành nguyên tố phổ biến nhất trong tự nhiên - carbon, có trong mọi thứ. hợp chất hữu cơ. Đơn vị khối lượng nguyên tử bằng:
1 bạn = 1/12 khối lượng cacbon - 12 (đồng vị có 12 nucleon)
1 bạn = 1,66·10 -27 kg
Vì chúng ta sẽ đo khối lượng của các phân tử trong đơn vị nguyên tửđại chúng, sau đó chúng ta đến với một cái mới đại lượng vật lý- trọng lượng phân tử tương đối.
Tỉ số giữa khối lượng của một phân tử (nguyên tử) của một chất nhất định với 1/12 khối lượng của nguyên tử cacbon được gọi là trọng lượng phân tử tương đối(hoặc khối lượng nguyên tử tương đối) trong trường hợp cấu trúc nguyên tử của một chất.
Các công thức thể hiện định nghĩa này:
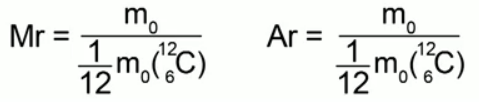
Trọng lượng phân tử tương đối là một đại lượng không thứ nguyên; nó không được đo bằng bất cứ thứ gì. Không có gì ngăn cản chúng ta tiếp tục đo khối lượng nguyên tử và phân tử bằng kilogam bất cứ khi nào chúng ta thấy thuận tiện. Qua môn hóa học chúng ta biết rằng: khối lượng phân tử tương đối của một chất bằng tổng khối lượng nguyên tử tương đối của các nguyên tố có trong nó. Ví dụ, đối với nước H2O trọng lượng phân tử tương đối sẽ là:
Ông = 1 2 + 16 = 18
Tổng tương đối trọng lượng phân tử oxy (16) và hai hydro (2.1) sẽ cho 18
Làm thế nào để tìm ra điểm chung giữa khối lượng tính bằng kilôgam và lượng chất tính bằng mol? Đại lượng này là khối lượng mol.
Khối lượng mol là khối lượng của một mol chất đó.
Ký hiệu [M], đo bằng kg/mol.
Khối lượng mol bằng tỉ số giữa khối lượng và lượng chất:
Chúng tôi thu được các công thức liên quan đến các đặc điểm khác nhau của phân tử.
Để xác định khối lượng mol nguyên tố hóa học chúng ta hãy chuyển sang bảng tuần hoàn các nguyên tố hóa học của Mendeleev - chúng ta chỉ cần lấy khối lượng nguyên tử A (số nucleon của nguyên tố cần thiết) - đây sẽ là khối lượng mol của nó, tính bằng g/mol.
Ví dụ: đối với nhôm (Hình 5):

Cơm. 5. Xác định khối lượng mol của một chất ( )
Khối lượng nguyên tử của nhôm sẽ là 27 và khối lượng mol sẽ là 0,027 kg/mol.
Điều này được giải thích là do khối lượng mol của cacbon theo định nghĩa là 12 g/mol, trong khi hạt nhân của nguyên tử cacbon chứa 12 nucleon - 6 proton và 6 neutron, hóa ra mỗi nucleon đóng góp 1 g/mol vào khối lượng mol nên khối lượng mol của một nguyên tố hóa học có khối lượng nguyên tử A sẽ bằng A g/mol.
Ví dụ, khối lượng mol của một chất có phân tử bao gồm một số nguyên tử thu được bằng cách tính tổng khối lượng mol (Hình 6):

Cơm. 6. Khối lượng mol của cacbon đioxit ()
Bạn cần đặc biệt cẩn thận với khối lượng mol của một số chất khí, chẳng hạn như khí hydro, nitơ, oxy - phân tử của chúng bao gồm hai nguyên tử - H 2, N 2, O 2 và helium, thường gặp trong các vấn đề, có tính đơn nguyên tử và có trọng lượng phân tử 4 g/mol, được quy định trong bảng tuần hoàn (Hình 2). 7).

Cơm. 7. Khối lượng mol của một số chất khí ()
Một mol của bất kỳ chất nào chứa số phân tử Avogadro, có nghĩa là nếu chúng ta nhân số Avogadro (số lượng phân tử trong một mol) với khối lượng của một phân tử m0, thì chúng ta sẽ có khối lượng mol của chất đó, đó là , khối lượng của một mol chất:
M = m 0 N A
Nếu 25 học sinh đang học trong một phòng học có diện tích 50 m2 thì mỗi học sinh có 2 m2. Khi đến phòng tập có diện tích 500 m2, mỗi học sinh sẽ có sẵn 20 m2. Số lượng sinh viên không thay đổi, nhưng họ trở nên ít phân bổ hơn, trong trường hợp này họ nói: sự tập trung của mọi người đã giảm. Theo cách tương tự, khái niệm nồng độ được đưa ra cho các phân tử trong lý thuyết động học phân tử.
Sự tập trung(n) là số lượng phân tử trên một đơn vị thể tích của một chất. Nó bằng tỷ lệ giữa số lượng phân tử và thể tích:
Công thức liên hệ nồng độ với các đặc tính khác của phân tử:

Sử dụng các công thức này, chúng ta có thể so sánh các chất theo số lượng phân tử và khối lượng.
Chúng ta đã nhận được mọi thứ cần thiết để xây dựng lý thuyết động học phân tử mà chúng ta sẽ thực hiện trong các bài học tiếp theo.
Tài liệu tham khảo
- Tikhomirova S.A., Yavorsky B.M. Vật lý ( cấp độ cơ bản) - M.: Mnemosyne, 2012.
- Gendenshtein L.E., Dick Yu.I. Vật lý lớp 10. - M.: Mnemosyne, 2014.
- Kikoin I.K., Kikoin A.K. Vật lý - 9, Mátxcơva, Giáo dục, 1990.
- Lib.podelise.ru ().
- Lớp-fizika.spb.ru ().
- Bolshoyvopros.ru ().
bài tập về nhà
- Xác định khối lượng của một chất.
- Nêu đơn vị đo khối lượng của phân tử hoặc nguyên tử.
- Xác định trọng lượng phân tử tương đối.


Các quy định cơ bản của CNTT. Khối lượng và kích thước của phân tử. Lượng chất. Vật lý phân tử
MKT thật dễ dàng!
“Không có gì tồn tại ngoại trừ nguyên tử và không gian trống rỗng…” - Democritus
“Mọi cơ thể đều có thể phân chia vô thời hạn” - Aristotle
Nguyên lý cơ bản của lý thuyết động học phân tử (MKT)
Mục đích của CNTT- đây là lời giải thích về cấu trúc và tính chất của các vật thể vĩ mô khác nhau và các hiện tượng nhiệt xảy ra trong chúng, bởi sự chuyển động và tương tác của các hạt tạo nên vật thể đó.
Vật thể vĩ mô- Cái này cơ thể to lớn bao gồm một số lượng lớn các phân tử.
Hiện tượng nhiệt- hiện tượng liên quan đến sự nóng lên và làm mát của cơ thể.
Các tuyên bố chính của CNTT
1. Vật chất bao gồm các hạt (phân tử và nguyên tử).
2. Có khoảng trống giữa các hạt.
3. Các hạt chuyển động ngẫu nhiên và liên tục.
4. Các hạt tương tác với nhau (hút và đẩy).
Xác nhận MKT:
1. thực nghiệm
- nghiền cơ học một chất; hòa tan một chất trong nước; nén và giãn nở khí; bay hơi; biến dạng của cơ thể; khuếch tán; Thí nghiệm của Brigman: dầu được đổ vào bình, một pít-tông ép lên trên dầu, ở áp suất 10.000 atm, dầu bắt đầu thấm qua thành bình thép;
Khuếch tán; Chuyển động Brown của các hạt trong chất lỏng dưới tác dụng của phân tử;
Khả năng nén kém của chất rắn và chất lỏng; nỗ lực đáng kể để phá vỡ chất rắn; sự hợp nhất của các giọt chất lỏng;
2. trực tiếp
- chụp ảnh, xác định kích thước hạt. 
Chuyển động Brown
Chuyển động Brown là chuyển động nhiệt của các hạt lơ lửng trong chất lỏng (hoặc chất khí).
Chuyển động Brown đã trở thành bằng chứng của chuyển động liên tục và hỗn loạn (nhiệt) của các phân tử vật chất.
- được phát hiện bởi nhà thực vật học người Anh R. Brown vào năm 1827
- lời giải thích lý thuyết dựa trên MCT được đưa ra bởi A. Einstein vào năm 1905.
- được xác nhận bằng thực nghiệm bởi nhà vật lý người Pháp J. Perrin.
Khối lượng và kích thước của phân tử
Kích thước hạt
Đường kính của bất kỳ nguyên tử nào là khoảng cm.

Số lượng phân tử trong một chất
trong đó V là thể tích của chất, Vo là thể tích của một phân tử
Khối lượng của một phân tử
trong đó m là khối lượng của chất,
N - số lượng phân tử trong một chất
Đơn vị khối lượng SI: [m]= 1 kg
TRONG vật lý nguyên tử khối lượng thường được đo bằng đơn vị khối lượng nguyên tử (amu).
Thông thường, nó được coi là 1 amu. :
Trọng lượng phân tử tương đối của chất
Để thuận tiện cho việc tính toán, một đại lượng được đưa vào - khối lượng phân tử tương đối của chất.
Khối lượng của một phân tử của bất kỳ chất nào có thể được so sánh với 1/12 khối lượng của một phân tử cacbon.
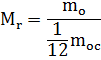
trong đó tử số là khối lượng của phân tử và mẫu số là 1/12 khối lượng của nguyên tử cacbon
Đây là một đại lượng không thứ nguyên, tức là không có đơn vị đo lường
Khối lượng nguyên tử tương đối của một nguyên tố hóa học
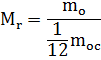
trong đó tử số là khối lượng nguyên tử và mẫu số là 1/12 khối lượng nguyên tử cacbon
Số lượng là không thứ nguyên, tức là không có đơn vị đo lường
Khối lượng nguyên tử tương đối của mỗi nguyên tố hóa học được đưa ra trong bảng tuần hoàn.
Một cách khác để xác định khối lượng phân tử tương đối của một chất
Khối lượng phân tử tương đối của một chất bằng tổng khối lượng nguyên tử tương đối của các nguyên tố hóa học tạo nên phân tử của chất đó.
Chúng ta lấy khối lượng nguyên tử tương đối của bất kỳ nguyên tố hóa học nào từ bảng tuần hoàn!)
Số lượng chất
Lượng chất (ν) quyết định số lượng phân tử tương đối trong cơ thể.
trong đó N là số lượng phân tử trong cơ thể và Na là hằng số Avogadro
Đơn vị đo lượng chất trong hệ SI: [ν]= 1 mol
1 nốt ruồi- đây là lượng chất chứa số phân tử (hoặc nguyên tử) bằng số nguyên tử trong carbon nặng 0,012 kg.
Nhớ!
1 mol chất bất kỳ đều chứa cùng một số nguyên tử hay phân tử!
Nhưng!
Cùng một lượng chất cho chất khác nhau có khối lượng khác nhau!
hằng số Avogadro
Số lượng nguyên tử trong 1 mol của bất kỳ chất nào được gọi là số Avogadro hoặc hằng số Avogadro:
Khối lượng mol
Khối lượng mol (M) là khối lượng của một chất chứa trong một mol, hay nói cách khác, nó là khối lượng của một mol chất đó.
Khối lượng phân tử
- Hằng số Avogadro
Đơn vị khối lượng mol: [M]=1 kg/mol.
Các công thức giải quyết vấn đề
Những công thức này có được bằng cách thay thế các công thức trên.
Khối lượng của bất kỳ lượng chất nào
Phương pháp quan trọng nhất để xác định trọng lượng phân tử của các chất khí dựa trên định luật Avogadro. Nhưng trước khi nói về phương pháp này, cần nhắc lại đơn vị phân tử và trọng lượng nguyên tử.
Khi tính trọng lượng nguyên tử, trọng lượng của nguyên tử hydro, là nguyên tố nhẹ nhất, ban đầu được lấy làm một và trọng lượng nguyên tử của các nguyên tố khác được tính liên quan đến nó. Nhưng vì đối với hầu hết các nguyên tố, khối lượng nguyên tử được xác định từ hợp chất oxy, trên thực tế, các phép tính được thực hiện liên quan đến trọng lượng nguyên tử của oxy, được coi là bằng 16. Tỷ lệ giữa trọng lượng nguyên tử của oxy và hydro được giả định là 16:1. Sau đó thêm nghiên cứu chính xác cho thấy tỷ lệ này là 15,88:1, hay 16:1,008. Do đó, nếu chúng ta giả sử trọng lượng nguyên tử của hydro là 1 thì trọng lượng nguyên tử của oxy sẽ là 15,88. Vì những lý do thực tế, người ta quyết định giữ nguyên trọng lượng nguyên tử của oxy ở mức 16, lấy trọng lượng nguyên tử của hydro là 1,008.
Do đó, đơn vị trọng lượng nguyên tử hiện nay là 1/16 trọng lượng của nguyên tử oxy. Đơn vị này được gọi là “đơn vị oxy”. Trọng lượng nguyên tử hydrobằng 1,008 đơn vị oxy, trọng lượng của một nguyên tử lưu huỳnh là 32,06 đơn vị oxy, v.v.
nguyên tử cân nặng yếu tố gọi điện cân nặng của anh ấy nguyên tử, chiều caođã cưới V. ôxy đơn vị.
Vì trọng lượng của một phân tử của bất kỳ bằng tổng trọng lượng của các nguyên tử tạo thành nó, rõ ràng là trọng lượng phân tử phải được biểu thị theo cùng đơn vị với trọng lượng nguyên tử. Ví dụ, trọng lượng của một phân tử hydro gồm hai nguyên tử bằng 2,016 đơn vị oxy; trọng lượng của một phân tử oxy, cũng bao gồm hai nguyên tử, bằng 32 đơn vị oxy; trọng lượng của một phân tử nước chứa hai nguyên tử hydro và một nguyên tử oxy là 16 + 2,016 = 18,016 đơn vị oxy, v.v.
phân tử cân nặng đơn giản hoặc tổ hợp tênthay đổi cân nặng của anh ấy phân tử, bày tỏ V. ôxy đơn vị.
Bây giờ chúng ta hãy xem trọng lượng phân tử của các chất khí được xác định như thế nào.
Theo định luật Avogadro, những thể tích khí bằng nhau được lấy ở cùng áp suất và cùng nhiệt độ chứa số bằng nhau phân tử. Theo sau đó các trọng số khối lượng bằng nhau hai loại khí phải liên hệ với nhau theo trọng lượng phân tử của chúng.
Ví dụ, hãy lấy một lít hai loại khí khác nhau. Hãy để mỗi người trong số họ chứa N phân tử. Chúng ta hãy biểu thị trọng lượng của một lít khí đầu tiên bằng g, và thứ hai thông qua g 1. Chúng ta hãy biểu thị khối lượng phân tử của các chất khí tương ứng bằng M và M1.
Vì trọng lượng của một lít khí bằng tổng trọng lượng của các phân tử trong đó nên = N g M Và g 1 =N M 1
Chia đẳng thức thứ nhất cho đẳng thức thứ hai, ta được: (1) Tỷ số giữa trọng lượng của một khí nhất định với trọng lượng của cùng một thể tích của khí khác lấy ở cùng nhiệt độ và cùng áp suất được gọi là mật độ của khí thứ nhất so với khí thứ hai. Ví dụ: 1 tôi Tỷ số giữa trọng lượng của một khí nhất định với trọng lượng của cùng một thể tích của khí khác lấy ở cùng nhiệt độ và cùng áp suất được gọi là mật độ của khí thứ nhất so với khí thứ hai. Ví dụ: 1 carbon dioxide nặng 1,98 g và 1
hydro ở cùng điều kiện là 0,09 g, từ đó mật độ của carbon dioxide đối với hydro sẽ là 1,98: 0,09 = 22. Biểu thị mật độ khí bằng chữ cái D,
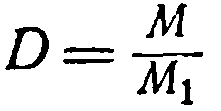
Viết lại phương trình (1):
g = Ở đâu g 1 =N (2)
D cân nặng phân tử khí đốt của anh ấy bằng Tỉ trọng Qua thái độ đến người khác khí đốt, nhân lên TRÊN cân nặng phân tử thứ hai
khí.
M Rất thường xuyên, mật độ của các loại khí khác nhau được xác định liên quan đến hydro là loại nhẹ nhất trong tất cả các loại lon. Vì trọng lượng phân tử của hydro là 2,016 nên trong trường hợp này công thức tính trọng lượng phân tử có dạng:
= 2,016D
M = 2 Ở đâu
hoặc, nếu chúng ta làm tròn trọng lượng phân tử của hydro thành 2:
M = 2 22 = 44
Ví dụ, tính toán trọng lượng phân tử của carbon dioxide, mật độ của hydro, như đã chỉ ra ở trên, bằng 22, chúng ta thấy:
Trọng lượng phân tử của khí cũng thường được tính dựa trên mật độ của nó trong không khí. Mặc dù không khí là hỗn hợp của nhiều loại khí, chúng ta vẫn có thể nói về trọng lượng phân tử trung bình của không khí, được xác định từ mật độ của không khí tính theo hydro. Trọng lượng phân tử của không khí được tìm thấy theo cách này là 29. Biểu thị mật độ của khí đang nghiên cứu trong không khí qua D 1, ta thu được công thức sau
để tính khối lượng phân tử:
M = 29 D 1
Trong thực tế, việc xác định trọng lượng phân tử phụ thuộc vào việc đo trọng lượng và thể tích của một lượng khí nhất định đang nghiên cứu và tính toán mật độ của nó sau đó, sau đó trọng lượng phân tử được tìm thấy trực tiếp từ công thức. Mật độ của một chất khí có thể được tính toán liên quan đến bất kỳ loại khí nào khác có trọng lượng phân tử và trọng lượng trên một đơn vị thể tích đã biết. Nhưng vì sách tham khảo chỉ ra khối lượng của các chất khí ở điều kiện bình thường và theo kinh nghiệm, người ta thường đo khối lượng và thể tích của chất khí đang nghiên cứu ở các điều kiện khác, nên để tính mật độ khí, trước tiên cần phải mang theo thể tích khí đo được ở điều kiện bình thường (0° và 760 mm áp lực).
Việc giảm về điều kiện bình thường được thực hiện trên cơ sở phương trình kết hợp định luật khí đốt Boyle-Mariotte và Gay-Lussac:

Ở đâu r và υ - áp suất và thể tích của khí ở điều kiện thí nghiệm tương ứng; P 0 — huyết áp bình thường; υ 0 - thể tích khí ở điều kiện bình thường; T - nhiệt độ tuyệt đối khí.
