II.1. Konformasyonlar (dönme izomerizmi)
En basit organik hidrokarbondan (metan) en yakın homologu olan etan'a geçiş, çözümü için bölümde tartışılan parametreleri bilmenin yeterli olmadığı mekansal yapı sorunları ortaya çıkarır. Aslında, bağ açılarını veya bağ uzunluklarını değiştirmeden, etan molekülünün, karbon tetrahedranın onları birbirine bağlayan C-C bağı etrafındaki karşılıklı dönüşü açısından birbirinden farklı birçok geometrik biçimi hayal edilebilir. Bu rotasyon sonucunda; döner izomerler (uyumlular) . Farklı konformerlerin enerjisi aynı değildir ancak çoğu için farklı dönme izomerlerini ayıran enerji bariyeri organik bileşikler küçük. Bu nedenle ne zaman normal koşullar Kural olarak, molekülleri kesin olarak tanımlanmış bir konformasyonda sabitlemek imkansızdır: genellikle birbirine kolayca dönüşebilen birkaç dönme formu dengede bir arada bulunur.
Konformasyonları grafiksel olarak gösterme yöntemleri ve bunların isimlendirilmesi aşağıdaki gibidir. Etan molekülüyle başlayalım. Bunun için enerji açısından maksimum farklılık gösteren iki yapının varlığı öngörülebilir. Aşağıda şu şekilde gösterilmiştir: perspektif projeksiyonları (1) (“kereste fabrikası keçileri”), yanal projeksiyonlar (2) ve Newman'ın formülleri (3).
Perspektif projeksiyonunda (1a, 1b), C-C bağlantısının mesafeye doğru gittiği hayal edilmelidir; Soldaki karbon atomu gözlemciye yakın, sağdaki karbon atomu ise gözlemciden uzaktır.
Yanal projeksiyonda (2a, 2b), çizim düzleminde dört H atomu bulunur; Karbon atomları aslında bu düzlemin bir miktar dışına uzanır, ancak genellikle basit bir şekilde çizim düzleminde de yer aldıkları kabul edilir. Kamanın kalınlaşmasıyla ortaya çıkan "kalın" kama şeklindeki bağlar, kalınlaşmanın karşı karşıya olduğu atomun gözlemcisine doğru düzlemden bir çıkışı gösterir. Kesikli kama şeklindeki bağlantılar gözlemciye olan mesafeyi belirtir.
Newman projeksiyonunda (3a, 3b), molekül C-C bağı boyunca (formüller 1a, b'de okla gösterilen yönde) dikkate alınır. Çemberin merkezinden 120° açıyla ayrılan üç çizgi, gözlemciye en yakın karbon atomunun bağlarını gösterir; dairenin arkasından "dışarı çıkan" çizgiler uzaktaki karbon atomunun bağlarıdır.
Solda gösterilen konformasyona denir belirsiz : Bu isim bize her iki CH3 grubunun hidrojen atomlarının birbirine zıt olduğunu hatırlatır. Tutulan konformasyon iç enerjiyi arttırmıştır ve bu nedenle elverişsizdir. Sağda gösterilen konformasyona denir engellenmiş , bu, C-C bağı etrafındaki serbest dönüşün bu konumda "engellendiğini" ima eder, yani. molekül ağırlıklı olarak bu konformasyonda bulunur.
Bir molekülün belirli bir bağ etrafında tamamen dönmesi için gereken minimum enerjiye denir. dönme bariyeri bu bağlantı için. Etan gibi bir moleküldeki dönme bariyeri değişim cinsinden ifade edilebilir. potansiyel enerji değişimin fonksiyonu olarak moleküller dihedral (burulma) açısı sistemler. Dihedral açı (tau ile gösterilir) aşağıdaki şekilde gösterilmektedir:

Etandaki C-C bağı etrafındaki dönmenin enerji profili aşağıdaki şekilde gösterilmektedir. "Geri" karbon atomunun dönüşü değişimle gösterilmektedir dihedral açı gösterilen iki hidrojen atomu arasında. Basitlik açısından geri kalan hidrojen atomları çıkarılmıştır. Etan'ın iki formunu ayıran dönme bariyeri yalnızca 3 kcal/mol'dür (12,6 kJ/mol). Potansiyel enerji eğrisinin minimumları engellenmiş konformasyonlara, maksimumları ise tıkanmış konformasyonlara karşılık gelir. Oda sıcaklığında bazı moleküler çarpışmaların enerjisi 20 kcal/mol'e (yaklaşık 80 kJ/mol) ulaşabildiğinden, 12,6 kJ/mol'lük bu engel kolaylıkla aşılır ve etandaki dönmenin serbest olduğu kabul edilir.
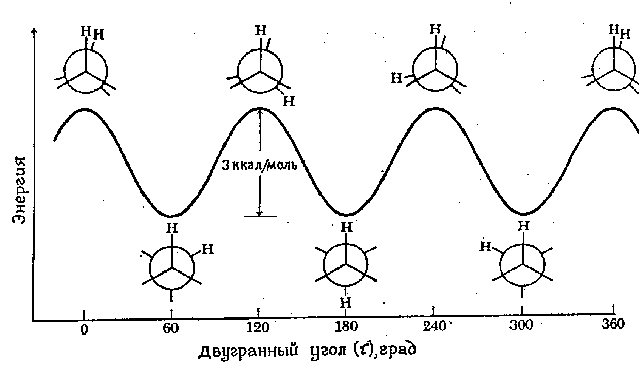
Potansiyel enerji eğrisindeki her noktanın belirli bir konformasyona karşılık geldiğini vurguluyoruz. Minimumlara karşılık gelen noktalar konformasyonel izomerlere karşılık gelir, yani olası tüm konformasyonların bir karışımındaki baskın bileşenler .
Molekül karmaşıklaştıkça, enerji açısından belirgin biçimde farklılık gösteren olası konformasyonların sayısı artar. Evet, için N-bütan altı konformasyonda gösterilebilir; göreceli konum CH 3 grupları, yani. merkezi bağlantı C-C etrafında dönme. Aşağıda n-bütanın konformasyonları Newman projeksiyonları olarak gösterilmektedir. Solda gösterilen (gölgeli) konformasyonlar enerji açısından elverişsizdir; yalnızca engellenmiş olanlar pratikte gerçekleştirilir.
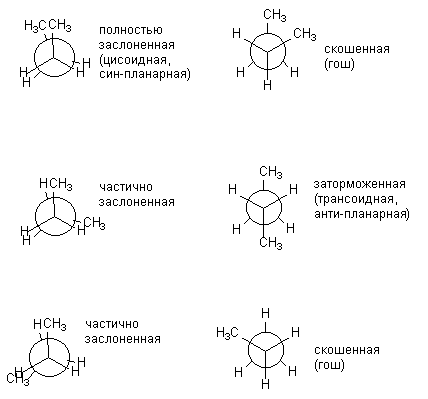
Bütanın çeşitli tutulma ve engellenmiş konformasyonları enerji açısından aynı değildir. Merkezi C-C bağı etrafında dönme sırasında oluşan tüm konformasyonların karşılık gelen enerjileri aşağıda sunulmuştur:
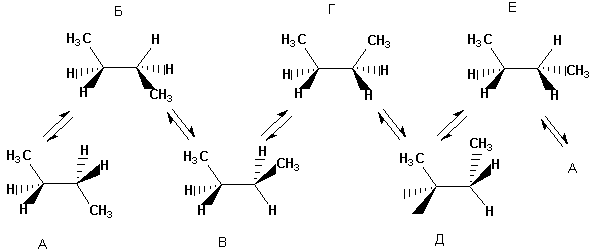


Bir molekül karmaşıklaştıkça olası konformasyonların sayısı artar.
Yani konformasyonlar farklı, özdeş değil mekansal formlar Belirli bir konfigürasyona sahip moleküller. Uyumlular, mobil dengede olan ve basit bağların etrafında dönerek birbirine dönüşme yeteneğine sahip stereoizomerik yapılardır.
Bazen bu tür dönüşümlerin önündeki engel, stereoizomerik formları (örneğin: optik olarak aktif bifeniller;) ayırmaya yetecek kadar yüksek hale gelir. Bu gibi durumlarda artık uyum sağlayanlardan değil, gerçekte var olanlardan bahsediyorlar. stereoizomerler .
II.2. Geometrik izomerizm
Çift bağın sertliğinin (etrafında dönmenin olmaması) önemli bir sonucu, varlığıdır. geometrik izomerler . Bunlardan en yaygın olanları cis-trans izomerleri doymamış atomlar üzerinde eşit olmayan ikame ediciler içeren etilen serisinin bileşikleri. En basit örnek, büten-2'nin izomerleridir.

Geometrik izomerler aynı kimyasal yapı(aynı sıra kimyasal bağ), atomların uzaysal düzenlemesinde farklılık gösteren konfigürasyonlar . Bu farklılık fiziksel (aynı zamanda) bir fark yaratır. kimyasal özellikler). Geometrik izomerler, konformerlerden farklı olarak izole edilebilir. saf biçim ve bireysel, kararlı maddeler olarak bulunurlar. Bunların karşılıklı dönüşümü genellikle 125-170 kJ/mol (30-40 kcal/mol) düzeyinde enerji gerektirir. Bu enerji ısıtma veya ışınlama yoluyla verilebilir.
En basit durumlarda geometrik izomerlerin isimlendirilmesi herhangi bir zorluk yaratmaz: cis- formlar, aynı ikame edicilerin pi bağ düzleminin aynı tarafında yer aldığı geometrik izomerlerdir, trans izomerler aynı ikame edicilere sahiptir farklı taraflar pi bağ düzleminden. Daha karmaşık durumlarda kullanılır Z,E terminolojisi . Ana prensibi: konfigürasyonu belirtmek cis-(Z, Almanca Zusammen'den - birlikte) veya trans(E, Alman Entgegen'den - karşı) konum kıdemli milletvekilleri çift bağ ile.
Z,E sisteminde atom numarası daha yüksek olan ikame ediciler kıdemli olarak kabul edilir. Doymamış karbonlarla doğrudan ilişkili atomlar aynıysa, gerekirse "ikinci katmana", "üçüncü katmana" vb. geçerler.
İki örnek kullanarak Z,E terminoloji kurallarının uygulanmasını ele alalım.

| BEN | II |
Her şeyin "ilk katmanın" atomları tarafından çözüldüğü formül I ile başlayalım. Atom numaralarını düzenledikten sonra, her bir çiftin kıdemli ikame edicilerinin (formülün üst kısmında brom ve alt kısmında nitrojen) bulunduğunu görüyoruz. trans-pozisyon, dolayısıyla stereokimyasal tanım E:
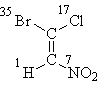 E-1-bromo-1-kloro-2-nitroeten
E-1-bromo-1-kloro-2-nitroeten
Yapı II'nin stereokimyasal tanımını belirlemek için "üst katmanlardaki" farklılıkları aramak gerekir. Birinci katmanda CH3, C2H5, C3H7 grupları farklı değildir. İkinci katmanda CH grubunun 3 toplamı vardır atom numaralarıüçe eşittir (üç hidrojen atomu), C2H5 ve C3H7 gruplarının her biri 8'e sahiptir. Bu, CH3 grubunun dikkate alınmadığı anlamına gelir - diğer ikisinden daha gençtir. Böylece kıdemli gruplar C 2 H 5 ve C 3 H 7'dir. cis-konum; stereokimyasal tanım Z.
 Z-3-metilhepten-3
Z-3-metilhepten-3
Hangi grubun daha yaşlı olduğunu belirlemek gerekirse - C2H5 veya C3H7, "üçüncü katmanın" atomlarına gitmek gerekirdi; her iki grup için bu katmandaki atom numaralarının toplamı eşit olurdu; sırasıyla 3 ve 8'e, yani C3H7, C2H5'ten daha eskidir. Önceliğin belirlenmesine ilişkin daha karmaşık durumlarda, aşağıdaki gibi ek koşullar dikkate alınmalıdır: çift bağla bağlanan bir atom iki kez sayılır, üçlü bağla bağlanan bir atom - üç kez; İzotoplardan ağır olanı daha yaşlıdır (döteryum hidrojenden daha eskidir) ve diğerleri.
Z notasyonuna dikkat edin Olumsuz eşanlamlıdır cis- E işaretleri gibi işaretler her zaman konuma karşılık gelmez trans, Örneğin:

cis- 1,2-dikloropropen-1 cis- 1,2-dikloro-1-bromopropen-1
Z-1,2-dikloropropen-1 E-1,2-dikloro-1-bromopropen-1
Kontrol görevleri
1. Bombicol - ipekböceğinin bir feromonu (cinsel çekici) - E-10-Z-12-heksadekadienol-1'dir. Onu hayal et yapısal formül.
2. Aşağıdaki bileşikleri Z,E terminolojisini kullanarak adlandırın:

II.3. Optik izomerizm (enantiyomerizm)
Organik bileşikler arasında ışığın polarizasyon düzlemini döndürebilen maddeler vardır. Bu olguya optik aktivite denir ve karşılık gelen maddeler optik olarak aktif . Optik olarak aktif maddeler çiftler halinde oluşur optik antipodlar - normal koşullar altında fiziksel ve kimyasal özellikleri aynı olan izomerler, tek bir şey hariç - polarizasyon düzleminin dönme işareti. (Eğer optik antipodlardan biri, örneğin, [NOT 1] +20°'lik belirli bir dönüşe sahipse, diğerinin -20°'lik belirli bir dönüşü vardır).
II.4. Projeksiyon formülleri
Bir düzlemde asimetrik bir atomu geleneksel olarak tasvir etmek için şunu kullanın: E. Fisher'ın projeksiyon formülleri . Asimetrik atomun ilişkili olduğu atomların bir düzlem üzerine yansıtılmasıyla elde edilirler. Bu durumda, asimetrik atomun kendisi genellikle atlanır ve yalnızca kesişen çizgiler ve ikame sembolleri korunur. İkame edicilerin uzaysal düzenlemesini hatırlamak için, projeksiyon formüllerinde genellikle kesik bir dikey çizgi korunur (üst ve alt ikame ediciler çizim düzleminin ötesine kaldırılır), ancak bu genellikle yapılmaz. Aşağıda çeşitli yollarönceki şekilde soldaki modele karşılık gelen projeksiyon formülünün kaydedilmesi:

Aşağıda projeksiyon formüllerinin bazı örnekleri verilmiştir:

(+)-alanin (-)-bütanol (+)-gliseraldehit
Maddelerin adları dönme işaretlerini belirtir: bu, örneğin, butanol-2'nin solak antipodunun olduğu anlamına gelir. mekansal konfigürasyon tam olarak yukarıdaki formülle ifade edilir ve ayna görüntüsü sağa dönen butanol-2'ye karşılık gelir. Yapılandırma Tanımı optik antipodlar deneysel olarak gerçekleştirilir [NOT 3].
Prensip olarak, her bir optik antipod on iki (!) farklı projeksiyon formülüyle gösterilebilir - modelin projeksiyon sırasında nasıl konumlandırıldığına ve ona hangi taraftan baktığımıza bağlı olarak. Projeksiyon formüllerini standartlaştırmak için, bunların yazılmasına ilişkin belirli kurallar getirilmiştir. Böylece ana fonksiyon, eğer zincirin sonundaysa, genellikle en üste yerleştirilir, ana zincir dikey olarak tasvir edilir.
“Standart dışı” yazılı projeksiyon formüllerini karşılaştırmak için bilmeniz gerekenler kurallara uymak Projeksiyon formüllerinin dönüşümleri.
1. Formüller, stereokimyasal anlamlarını değiştirmeden çizim düzleminde 180° döndürülebilir:

2. Bir asimetrik atom üzerindeki ikame edicilerin iki (veya herhangi bir çift sayıda) yeniden düzenlenmesi, formülün stereokimyasal anlamını değiştirmez:

3. Asimetrik merkezdeki ikame edicilerin bir (veya herhangi bir tek sayıda) permütasyonu, optik antipod formülüne yol açar:

4. Çizim düzlemindeki 90°'lik bir dönüş, aynı zamanda sübstitüentlerin çizim düzlemine göre konumunun koşulu değiştirilmediği sürece, yani; Artık yanal ikame edicilerin çizim düzleminin arkasında, üst ve altların ise önünde olduğunu düşünmeyin. Noktalı çizgiye sahip bir formül kullanırsanız, noktalı çizginin değişen yönü size doğrudan şunu hatırlatacaktır:

5. Permütasyonlar yerine, projeksiyon formülleri herhangi üç ikame edicinin saat yönünde veya saat yönünün tersine döndürülmesiyle dönüştürülebilir; dördüncü ikame edici konumunu değiştirmez (bu işlem iki permütasyona eşdeğerdir):

6. Projeksiyon formülleri çizim düzleminden türetilemez (yani, bunları kağıdın arkasından "ışıkta" inceleyemezsiniz - bu durumda formülün stereokimyasal anlamı değişecektir).
II.5. Yarış arkadaşları
Bir maddenin formülünde asimetrik atom bulunması, o maddenin optik aktiviteye sahip olacağı anlamına gelmez. Normal bir reaksiyon sırasında asimetrik bir merkez ortaya çıkarsa (CH2 grubunda ikame, çift bağda ekleme vb.), o zaman her iki antipode konfigürasyonunu yaratma olasılığı aynıdır. Bu nedenle, her bir molekülün asimetrisine rağmen, ortaya çıkan maddenin optik olarak aktif olmadığı ortaya çıkıyor. Eşit miktarda her iki antipoddan oluşan bu tür optik olarak aktif olmayan modifikasyona denir. yarış arkadaşları [NOT 4] .
II.6. Diastereomerizm
Birkaç asimetrik atoma sahip bileşikler, onları daha önce tartışılan tek asimetri merkezli daha basit optik olarak aktif maddelerden ayıran önemli özelliklere sahiptir.
Belirli bir maddenin molekülünde iki asimetrik atomun bulunduğunu varsayalım; Bunlara koşullu olarak A ve B diyelim. Moleküllerin aşağıdaki kombinasyonlara sahip olmasının mümkün olduğunu görmek kolaydır:
Molekül 1 ve 2 bir çift optik antipoddur; aynı durum 3 ve 4 numaralı molekül çiftleri için de geçerlidir. Birbirinden gelen molekülleri birbirleriyle karşılaştırırsak farklı çiftler antipodlar - 1 ve 3, 1 ve 4, 2 ve 3, 2 ve 4, sonra listelenen çiftlerin optik antipodlar olmadığını göreceğiz: bir asimetrik atomun konfigürasyonu aynı, diğerinin konfigürasyonu aynı değil . Bunların hepsi çift diastereomerler , yani uzaysal izomerler, Olumsuz birbirleriyle optik antipodlar oluştururlar.
Diastereomerler yalnızca optik rotasyon açısından değil, aynı zamanda diğer tüm fiziksel sabitler açısından da farklılık gösterir: farklı erime ve kaynama noktalarına, farklı çözünürlüklere vb. sahiptirler. Diastereomerlerin özelliklerindeki farklılıklar genellikle yapısal izomerler arasındaki özelliklerdeki farklılıklardan daha az değildir. .
Bu tip bir bileşiğe örnek olarak kloromalik asit verilebilir.

Stereoizomerik formları aşağıdaki projeksiyon formüllerine sahiptir:
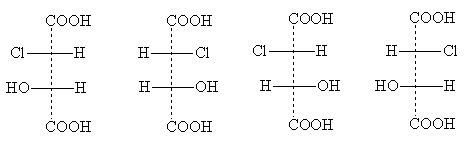
eritro formlar üçlü formlar
Başlıklar eritro- Ve üçlü- eritroz ve treoz karbonhidratlarının isimlerinden gelir. Bu isimler, iki asimetrik atomlu bileşiklerdeki ikame edicilerin göreceli konumunu belirtmek için kullanılır: eritro -izomerler bunlar, standart projeksiyon formülünde bir tarafta (sağ veya sol) iki özdeş yanal ikame edicinin göründüğü durumlardır; üçlü -izomerler projeksiyon formülünün farklı taraflarında aynı yanal ikame edicilere sahiptir [NOT 5].
İki eritro izomerler bir çift optik antipoddur; karıştırıldıklarında bir rasemat oluşur. Bir çift optik izomer ve üçlü formlar; ayrıca karıştırıldıklarında özellikleri bakımından rasemattan farklı olan bir rasemat üretirler eritro formlar. Böylece, kloromalik asitin optik olarak aktif toplam dört izomeri ve iki rasematı vardır.
Asimetrik merkezlerin sayısının daha da artmasıyla uzaysal izomerlerin sayısı artar ve her yeni asimetrik merkez, izomerlerin sayısını ikiye katlar. 2 n formülü ile belirlenir; burada n, asimetrik merkezlerin sayısıdır.
Bazı yapılarda ortaya çıkan kısmi simetri nedeniyle stereoizomerlerin sayısı azalabilir. Bir örnek, bireysel stereoizomerlerin sayısının üçe düşürüldüğü tartarik asittir. Projeksiyon formülleri:
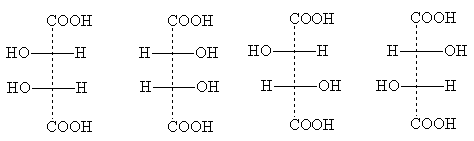
Formül I, formül la ile aynıdır: çizim düzleminde 180° döndürüldüğünde ona dönüşür ve bu nedenle yeni bir stereoizomeri temsil etmez. Bu optik olarak aktif olmayan bir modifikasyondur - orta form . Optik parçalara bölünebilen bir rasemattan farklı olarak antipodlar, mezo form temelde yok edilemez: moleküllerinin her biri, bir konfigürasyonun bir asimetrik merkezine ve ikincisinin tam tersidir. Sonuç olarak, her iki asimetrik merkezin dönüşünün molekül içi telafisi meydana gelir.
Mezo- Tüm optik olarak aktif maddeler, birkaç özdeş (yani aynı ikame edicilerle ilişkili) asimetrik merkezlere sahip formlara sahiptir [NOT 6]. Projeksiyon formülleri mezo formlar her zaman yatay bir çizgiyle iki yarıya bölünebilmeleri gerçeğiyle tanınabilir; bunlar kağıda yazıldığında biçimsel olarak aynıdır, ancak gerçekte yansıtılır:

Formül II ve III, tartarik asidin optik antipodlarını gösterir; karıştırıldıklarında optik olarak aktif olmayan bir rasemat oluşur - üzüm asidi.
II.7. Optik izomerlerin isimlendirilmesi
Optik antipodların en basit, en eski, ancak hala kullanımda olan isimlendirme sistemi, adı verilen antipodun projeksiyon formülünün, "anahtar" olarak seçilen belirli bir standart maddenin projeksiyon formülü ile karşılaştırılmasına dayanmaktadır. Yani, alfa hidroksi asitler ve alfa amino asitler için anahtar şudur: üst kısım projeksiyon formülleri (standart gösterimde):

L- hidroksi asitler (X = OH) D- hidroksi asitler (X = OH)
L-amino asitler (X = NH2) D- amino asitler (X = NH2)
Standart yazılı Fischer projeksiyon formülünde solda bir hidroksil grubu bulunan tüm alfa-hidroksi asitlerin konfigürasyonu işaretle gösterilir. L; hidroksil sağdaki projeksiyon formülünde bulunuyorsa - işaret D[NOT 7] .
Şekerlerin konfigürasyonunu belirlemenin anahtarı gliseraldehittir:

L-(-)-gliseraldehit D-(+)-gliseraldehit
Şeker moleküllerinde atama D- veya L- konfigürasyonu ifade eder daha düşük asimetrik merkez.
Sistem D-,L- atamanın önemli dezavantajları vardır: ilk olarak, atama D- veya L- yalnızca bir asimetrik atomun konfigürasyonunu belirtir; ikinci olarak, bazı bileşikler için, anahtar olarak gliseraldehit veya hidroksiasit anahtarının alınmasına bağlı olarak farklı semboller elde edilir, örneğin:

Anahtar sistemin bu eksiklikleri, şu anda kullanımını optik olarak aktif maddelerin üç sınıfıyla sınırlandırmaktadır: şekerler, amino asitler ve hidroksi asitler. Genel kullanım için tasarlanmıştır "R,S-sistemi Kahn, Ingold ve Prelog [NOT 8].
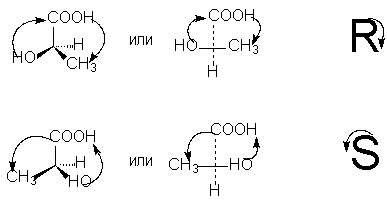
Optik antipodun R- veya S-konfigürasyonunu belirlemek için, sübstitüentlerin tetrahedronunu asimetrik karbon atomu etrafında, en düşük sübstitüent (genellikle hidrojen) "gözlemciden uzakta" yöne sahip olacak şekilde düzenlemek gerekir. O zaman, kalan üç ikame ediciden oluşan bir daire içinde en yaşlıdan kıdem ortalamasına ve daha sonra en küçüğe geçiş sırasında hareket meydana gelirse saat yönünün tersine - Bu R -izomer (R harfini yazarken aynı el hareketiyle ilişkilidir), eğer saat yönünde - Bu S- izomer (S harfini yazarken aynı el hareketiyle ilişkilidir).
Asimetrik bir atom üzerindeki ikame edicilerin kıdemini belirlemek için, geometrik izomerlerin Z,E terminolojisi ile bağlantılı olarak zaten dikkate aldığımız atom numaralarını hesaplama kuralları kullanılır (bkz.).
İzdüşüm formülüne göre R, S notasyonlarını seçmek için, çift sayıda permütasyonla (bildiğimiz gibi, formülün stereokimyasal anlamını değiştirmeyen), ikame edicileri en genç olacak şekilde düzenlemek gerekir. bunlar (genellikle hidrojen) projeksiyon formülünün altındadır. Daha sonra geri kalan üç ikame edicinin saat yönünde azalan kıdemi R gösterimine, saat yönünün tersine ise S gösterimine karşılık gelir [NOT 9]:
Kontrol görevleri
3. Askorbik asitin (C vitamini) asimetrik merkezinin konfigürasyonunu belirleyin (tarafından R,S-isimlendirme ve gliseraldehit ile karşılaştırma):

4. Alkaloit efedrin aşağıdaki formüle sahiptir:
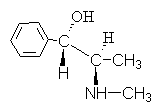
Bu bağlantıya şunu kullanarak bir ad verin: R,S- isimlendirme.
5. Sistein - metabolik süreçlerin düzenlenmesinde yer alan esansiyel olmayan bir amino asittir. L-1-amino-2-merkaptopropiyonik asit. Yapısal formülünü çizin ve adını verin R,S- isimlendirme.
6. Levomisetin (geniş spektrumlu antibiyotik) D(-)-treo-1-para-nitrofenil-2-dikloroasetilamino-propandiol-1,3. Yapısını Fischer projeksiyon formülü şeklinde çizin.
7. Synestrol, steroidal olmayan yapıya sahip sentetik bir östrojen ilacıdır. Stereokimyasal konfigürasyonunu belirten adını verin:

II.8. Döngüsel bileşiklerin stereokimyası
Bir karbon atomu zinciri düzlemsel bir döngüye kapatıldığında, karbon atomlarının bağ açıları normal tetrahedral değerlerinden sapmaya zorlanır ve bu sapmanın büyüklüğü döngüdeki atom sayısına bağlıdır. Değerlik bağlarının sapma açısı ne kadar büyük olursa, molekülün enerji rezervi o kadar büyük olur, döngü o kadar az kararlı olur. Ancak yalnızca üç üyeli bir siklik hidrokarbon (siklopropan) düz bir yapıya sahiptir; Siklobutandan başlayarak sikloalkan molekülleri düzlemsel olmayan bir yapıya sahiptir ve bu da sistemdeki "gerginliği" azaltır.
Sikloheksan molekülü, "normal" bağ açılarının korunduğu çeşitli konformasyonlarda mevcut olabilir (basitlik açısından yalnızca karbon atomları gösterilmiştir):
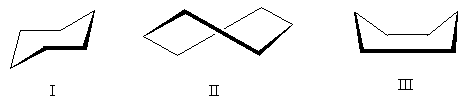
Enerji açısından en uygun konformasyon konformasyon I'dir - sözde form "koltuklar". Konformasyon II - "büküm" - bir ara pozisyonda bulunur: sandalye konformasyonundan daha az elverişlidir (içindeki belirsiz hidrojen atomlarının varlığından dolayı), ancak konformasyon III'ten daha elverişlidir. Konformasyon III - "banyo" - yukarıya doğru yönlendirilmiş hidrojen atomlarının önemli ölçüde itilmesinden dolayı üçü arasında en az tercih edileni.
Sandalye konformasyonundaki on iki C-H bağının dikkate alınması, bunları iki gruba ayırmamıza olanak tanır: altı eksenel bağlantılar dönüşümlü olarak yukarı ve aşağı yönlendirilir ve altı ekvator bağlantılar yanlara yönlendirilmiştir. Tekli sübstitüe edilmiş sikloheksanlarda, sübstitüent ekvatoral veya eksenel konumda olabilir. Bu iki konformasyon genellikle dengededir ve büküm konformasyonu yoluyla hızla birbirine geçiş yapar:

Ekvatoral konformasyon (e) genellikle enerji açısından daha zayıftır ve bu nedenle eksenel konformasyondan (a) daha avantajlıdır.
Halkalarda ikame ediciler (yan zincirler) göründüğünde, halkanın kendisinin konformasyonu sorununun yanı sıra araştırmacı da sorunlarla karşı karşıya kalır. ikame konfigürasyonları : dolayısıyla, iki aynı veya farklı ikame edicinin mevcut olması durumunda, cis-trans-izomer. Hakkında konuştuğumuzu unutmayın cis-trans-ikame edicilerin konfigürasyonu yalnızca doymuş küçük ve orta halkalara (C8'e kadar) uygulandığında anlamlıdır: halkalarda çok sayıda Bağlantıların hareketliliği halihazırda o kadar önemli hale geliyor ki, cis- veya trans- milletvekillerinin pozisyonları anlamını yitiriyor.
Bu yüzden, klasik örnek stereoizomerik siklopropan-1,2-dikarboksilik asitlerdir. İki stereoizomerik asit vardır: bunlardan biri, m.p. 139 o C, siklik anhidrit oluşturma yeteneğine sahiptir ve bu nedenle cis-izomer. Başka bir stereoizomerik asit e.n. 175 o C, siklik anhidrit oluşturmaz; Bu trans-izomer [NOT 10]:
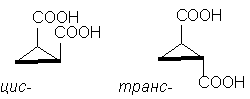
İki stereoizomerik 1,2,2-trimetilsiklopentan-1,3-dikarboksilik asit birbiriyle aynı ilişki içindedir. Bunlardan biri, kafurik asit, e.n. 187 o C, bir anhidrit oluşturur ve bu nedenle cis-izomer. Diğeri izokamforik asittir, m.p. 171 o C, - anhidrit oluşturmaz, bu trans-izomer:

cis-trans-
Siklopentan molekülü aslında düzlemsel olmasa da, netlik sağlamak amacıyla onu yukarıdaki şekilde olduğu gibi düz bir biçimde göstermek uygundur. cis- izomerin iki ikame edicisi vardır döngünün bir tarafında ve içinde trans-izomer - döngünün karşıt taraflarında .
İki ikameli sikloheksan türevleri cis veya trans formunda da mevcut olabilir:
Karbon atomu, organik bileşik moleküllerinde kiral merkezlerin oluşturulması konusunda tekele sahip değildir. Kiralite merkezi aynı zamanda kuaterner amonyum tuzları ve tersiyer amin oksitlerdeki silikon, kalay ve tetrakovalent nitrojen atomları da olabilir:

Bu bileşiklerde asimetrinin merkezi, asimetrik karbon atomu gibi dört yüzlü bir konfigürasyona sahiptir. Bununla birlikte, kiral merkezin farklı uzaysal yapısına sahip bileşikler de vardır.
Üç değerlikli nitrojen, fosfor, arsenik, antimon ve kükürt atomlarının oluşturduğu kiral merkezler piramidal bir konfigürasyona sahiptir. Prensip olarak, heteroatomun yalnız elektron çifti dördüncü ikame edici olarak alınırsa asimetri merkezi tetrahedral olarak kabul edilebilir:

Optik aktivite de meydana gelebilir olmadan kiral merkez, bir bütün olarak tüm molekülün yapısının kiralitesinden dolayı ( moleküler kiralite veya moleküler asimetri ). En tipik örnekler müsaitlik var mı kiral eksen veya kiral düzlem .
Kiral eksen örneğin çeşitli ikame edicileri içeren allenlerde görülür. sp2-hibrit karbon atomları. Aşağıdaki bileşiklerin ayna görüntüleri ve dolayısıyla optik antipodlar olduğunu görmek kolaydır:

Kiralite ekseni şekillerde bir okla gösterilmiştir.
Kiral eksene sahip diğer bir bileşik sınıfı optik olarak aktif bifenillerdir. orto-pozisyonlar serbestçe dönmeyi zorlaştıran hacimli ikame edicilere sahiptir SS bağlantıları aren halkalarının bağlanması:

Kiral düzlem "Üst" ve "alt" ile "sağ" ve "sol" taraflar arasında ayrım yapılabilmesiyle karakterize edilir. Kiral düzlemli bileşiklere bir örnek, optik olarak aktif olanlardır. trans siklookten ve optik olarak aktif bir ferrosen türevi.
İzomerler aynı niteliksel ve niceliksel bileşime (moleküler formül) sahip olan, ancak atomların bağlanma sırası veya uzaydaki düzenleri bakımından birbirinden farklı olan bileşiklerdir. Bu bileşiklerin yapısı farklı olduğundan izomerlerin kimyasal veya fiziksel özellikleri. farklılık gösterir.
İzomerizm türleri: yapısal (yapısal izomerler) ve stereoizomerizm (uzaysal).
Yapısal izomerizm olabilir üç tip:
– karbon iskeletinin izomerizmi (karbon zincirinin yapısına göre izomerler), örneğin bütan (dallanmamış veya normal yapıya sahip bir bileşik) ve 2-metilpropan (dallı yapıya sahip bir bileşik);
– fonksiyonel grupların (veya çoklu bağların) pozisyonundaki izomerler, örneğin 1-butanol (hidroksil grubu zincirdeki 1. karbon atomuna bağlanır) ve 2-butanol (hidroksil grubu zincirdeki 2. karbon atomuna bağlanır) );
– fonksiyonel grup izomerleri (veya sınıflar arası izomerizm), örneğin 1-bütanol (alkol) ve dietil eter (eter).
Stereoizomerizm konformasyonel ve konfigürasyonel olarak ikiye ayrılır.
Bir molekülün konformasyonları onun çeşitliliğini temsil eder. geometrik şekiller basit bağları etrafında dönmenin bir sonucu olarak ortaya çıkar.
Konfigürasyon, basit bağları etrafında dönme nedeniyle ortaya çıkan farklılıklar dikkate alınmaksızın atomların uzayda düzenlenmesidir.
Organik moleküllerin konformasyonları. bağı C etrafında dönme – C nispeten kolay bir şekilde yapılır, hidrokarbon zinciri farklı formlar alabilir. Konformasyonel formlar kolayca birbirine dönüşür ve bu nedenle farklı bileşikler değildir; bunlar aynı molekülün farklı kararsız dinamik formlarıdır. Uyumlular arasındaki enerji farkı, termal hareket enerjisiyle aynı düzeydedir (birkaç kJ/mol). Bu nedenle normal sıcaklıklarda bireysel konformerler izole edilemez.
Tutulan ve engellenen konformasyonlar arasında bir ayrım yapılır (Şekil 2).
Pirinç. 2. Pentan konformasyonları: a – gölgede; b – engellendi
Şek. Şekil 2, zincirin ikinci ve üçüncü karbon atomları arasındaki bağa dayalı olarak pentanın konformasyonlarını göstermektedir. Tutulan konformasyonda hidrojen veya karbon atomlarının birbirini gizlediği görülüyor. Engellenen konformasyon, atomlardan birinin 60 dönmesi sonucu meydana gelir ve bağlanmamış atomlar arasındaki mesafe bir miktar artar, atomların elektron yörüngelerinin itici kuvvetleri azalır ve bu konfigürasyon enerji açısından daha uygundur. Birçok organik bileşiğin molekülleri, termal hareketin bir sonucu olarak konformerlerin karışımlarıdır; moleküller sürekli konformasyonel dönüşümlere uğrar.
Newman'ın projeksiyon formülleri. Konformasyonları tasvir etmek için, C molekülünün düzleme yansıtılmasıyla elde edilen Newman'ın projeksiyon formülleri kullanılır. – C-bağlantılar. Örnek olarak Şekil 2'de yer almaktadır. Şekil 3 pentanın C2-C3 bağına göre konformasyonlarını göstermektedir.
Gözlemciye en yakın karbon atomu (C2), dairenin ortasındaki bir noktayla gösterilir; daire, çıkarılan karbon atomunu (C3) simgelemektedir. Bir atomdan gelen üç bağ, yakın bir atom için (C2) dairenin merkezinden ayrılan çizgiler veya uzak bir atom için (C3) dairenin arkasından "çıkıntı yapan" çizgiler olarak gösterilir. söz konusu karbon atomları sanki birbirlerini engelliyormuş gibi, konformasyona gölgelenmiş denir (Şekil 3.a), atomlardan biri diğerine göre 60° döndüğünde, enerji açısından daha uygun bir inhibe edilmiş konformasyon elde ederiz (Şekil 3.a). 3.b).

Pirinç. 3. Newman'ın a: pentanın gölgelenmiş yapısı ve b: pentanın engellenmiş yapısı için projeksiyon formülü.
Döngüsel bileşiklerin konformasyonları. Döngüsel değil aromatik bileşikler kural olarak düz değildir. Bağ açıları ve poligon açılarının değerlerinin farklılığından dolayı ortaya çıkabilecek açısal ve burulma gerilmelerini azaltmak için bir veya daha fazla halka atomu, kalan atomlara göre farklı bir düzleme yerleştirilebilir. Böylece, beş üyeli çevrimler uzayda bir zarf şekline sahip olabilir (Şek. 4), altı üyeli çevrimler ise küvet veya sandalye şekline sahip olabilir (Şek. 5).
Pirinç. 4. Siklopentan konformasyonu
Zarf yapısında karbon atomlarından biri diğer dört atomun bulunduğu düzlemin dışına doğru hareket eder. Beş atomdan herhangi biri düzlemden çıkabilir ve bu nedenle döngü sürekli dalga benzeri hareket halinde görünür.

Pirinç. 5. Siklohekzanın konformasyonları: a – sandalye ve b – banyo.
Sandalye ve banyo konformasyonlarında 2 karbon atomu, 4 atomun daha bulunduğu düzlemin dışında yer alır.
Siklohekzanın sandalye konformasyonunda hidrojen ve karbon atomlarının kapalı konumları yoktur: hidrojen atomlarının tüm karbon atomları üzerindeki düzeni etanın inhibe edilmiş konformasyonuyla aynıdır.
Altı C bağı – Sikloheksanın sandalye şeklindeki formunun simetri eksenlerine paralel, dönüşümlü olarak yukarı ve aşağı yönlendirilen H'ye eksenel denir. (sembol A).Geri kalan altı C – H bağları bu eksene 109,5° açıyla yerleştirilmiştir ve dönüşümlü olarak yukarı ve aşağı doğru yönlendirilir. Bu bağlantılara ekvator denir (sembol e). Böylece, her karbon atomunun eksenel olarak yerleştirilmiş bir hidrojen atomu ile bir bağı ve ekvatoral olarak bir bağı vardır. Sandalyenin şekli enerjik olarak daha uygundur.
Konfigürasyon izomerleri. Optik izomerizm. Konfigürasyonel, uzayda birbirlerine göre diğer atomların, radikallerin veya fonksiyonel grupların belirli atomları etrafında farklı düzenlemelere sahip stereoizomerlerdir. Bunlar öncelikle birbirinin ayna görüntüsü olan optik olarak aktif maddeler olan enantiyomerleri içerir.
Hangi maddelere optik olarak aktif denir? Bunlar düzlem polarize ışığın polarizasyon düzleminin eğim açısını değiştirebilen bileşiklerdir. Sıradan ışığın (güneşten veya bir lambadan gelen), parçacıkların karşılıklı olarak dik düzlemlerde ve dalganın yayılma yönüne dik olarak her yönde titreştiği bir elektromanyetik dalga olduğunu hatırlayın. Düzlem polarize ışıkta parçacıkların titreşimleri aynı düzlemde bulunur. Bir ışın, elektrik alanı salınımlarının düzlemini belirli bir açıyla döndürebilen ve onlara yeni bir yön verebilen şeffaf bir maddeden geçerse, bu tür bir maddenin optik aktiviteye sahip olduğu söylenir.
Organik bileşiklerin optik aktivitesinin iki işareti formüle edilebilir: asimetrik bir karbon atomunun varlığı ve molekülde simetri elemanlarının bulunmaması.
Asimetrik bir karbon atomu dört atoma bağlı bir atomdur. farklı atomlar veya genellikle yıldız işaretiyle gösterilen gruplar: *C.
Proteinin parçası olan bir amino asit olan alanin (2-aminopropanoik asit) molekülünü ele alalım (Şekil 6). Molekülün bir asimetrik karbon atomu vardır (ikincisi dört farklı ikame ediciyle ilişkilidir: bir amino grubu, bir karboksil grubu, bir hidrojen atomu ve bir metil grubu -CH3). Karboksil grubunun karbon atomu asimetrik değildir çünkü 4 değil sadece 3 ikamesi var. Üçüncü karbon atomu (metil karbon) da asimetrik değildir. 4 ikame edicisi vardır, ancak bunlardan 3'ü aynıdır (hidrojen atomu). Bu bileşiğin molekülü asimetriktir; dolayısıyla alanin optik olarak aktif bir bileşiktir ve iki enantiyomer formunda bulunabilir. Enantiyomerler, izomerlerin göreceli konfigürasyonunu (gliseraldehit konfigürasyonuna göre) tanımlayan D,L terminolojisi ile adlandırılır.
Bir enantiyomeri tasvir etmek ve adlandırmak için, molekülün karbon zincirini dikey olarak konumlandırmak uygundur, ardından asimetrik karbon atomu üzerindeki ikame ediciler onun sağında ve solunda görünür. Kıdemli ikame edici (bizim durumumuzda amino grubu) solda yer alıyorsa bir L-izomeridir, sağdaysa bir D-izomeridir (Şekil 6).

Pirinç. 6. Alaninin enantiyomerleri.
Enantiyomerler, izomerlerden farklı olarak aynı fiziksel ve kimyasal özelliklere sahiptirler; yalnızca düzlem polarize ışığın polarizasyon düzlemini aynı açıyla, ancak zıt yönlerde (biri sola, diğeri sağa) döndürmeleri bakımından farklılık gösterirler. . Eşit molar miktarlarda enantiyomerlerden oluşan bir karışıma rasemik karışım veya rasemat denir. Rasemat optik olarak aktif değildir.
Özelliklerdeki bu küçük gibi görünen farklılığa rağmen, enantiyomerlerin biyolojik aktiviteleri oldukça farklıdır. Örneğin, proteinler yalnızca amino asitlerin L-enantiyomerlerini içerir, bu, proteinlerin uzamsal yapısının özelliklerini açıklar ve amino asitlerin D-izomerlerinin vücuda girerken çeşitli olumsuz işlemlere neden olabileceği enzimlerin katalitik etkisinin seçiciliğini belirler. bu nedenle ilaçların ve çeşitli gıda katkı maddelerinin üretiminde amino asitlerin mekansal konfigürasyonunun dikkate alınması gerekir.
Bu bileşiğin bir izomeri olan -alanin (3-aminopropanoik asit) vücudumuzda da mevcuttur. Bu bileşik proteinlerin bir parçası değildir ve optik olarak aktif değildir, çünkü içinde asimetrik atom yoktur. Karboksil grubunun ilk karbon atomu yalnızca 3 ikame ediciye sahiptir, ikinci ve üçüncüsü 2 özdeş ikame ediciye (hidrojen atomları) sahiptir.
Optik izomerizm olgusunu değerlendirmeye devam edelim. Bu fenomenle karakterize edilen maddelere genellikle stereoizomerler adı verilir. Stereoizomerler fiziksel ve fizikokimyasal özellikler bakımından aynıdır ancak iki açıdan farklılık gösterir:
1. Düzlem (düzlem) simetriye sahip olmayan, ancak ayna görüntüsüne göre birbirleriyle bir nesne olarak ilişkili formlarda kristalleşin, örneğin stereoizomerik tartarik asitleri vurgulayan iki tür tartarik asit kristali.

2. Yukarıda belirtildiği gibi stereoizomerler ışığı farklı şekilde polarize eder. P  Optik stereoizomerizmin nedeni tam olarak sp3-hibridizasyon durumundaki karbon atomu üzerindeki ikame gruplarının düzenlenmesinden, yani tetrahedronun köşelerinde doymuş karbonla (atomların uzayda düzenlenmesi, stereoizomerizmin varlığına konfigürasyon denir).
Optik stereoizomerizmin nedeni tam olarak sp3-hibridizasyon durumundaki karbon atomu üzerindeki ikame gruplarının düzenlenmesinden, yani tetrahedronun köşelerinde doymuş karbonla (atomların uzayda düzenlenmesi, stereoizomerizmin varlığına konfigürasyon denir).
Ve ![]() şu şekilde ifade edilir:
şu şekilde ifade edilir:
Örneğin,

L-alkol,= –5.9
Bu maddeler için sol ve sağ el konfigürasyonları mümkündür.
Bir rasemat, optik olarak aktif olmayan eşit miktarda L- ve D-izomerlerinin bir karışımıdır.

Işığın polarizasyon düzlemini sağa ve sola döndüren konfigürasyonlar nelerdir? özel soru. Burada dikkate alınmıyor.
Çizim düzleminin üzerinde bulunan karbon bağlarını işaretleyin, bu düzlemin altındaki ikame ediciyi işaretleyin.
Bir stereoizomerin klasik örnekleri şunlardır:


H  Genel durumda asimetrik atomların sayısı birkaç olabilir.
Genel durumda asimetrik atomların sayısı birkaç olabilir.
* – asimetrik atom. Stereoizomerlerin sayısı 2 n'ye eşittir; burada dikkatli okuyucunun zaten anladığı gibi n, asimetrik optik olarak aktif atomların sayısıdır.
Geometrik (cis- ve trans-) izomerler. Bunlar bir bağı içeren konfigürasyon izomerlerini içerir. Bu tip diastereomerizm özellikle alkenlerin karakteristik özelliğidir. bağının düzlemine göre, iki karbon atomu üzerindeki özdeş ikame ediciler birer birer yerleştirilebilir (cis-) veya farklı (trans-) yanlar (Şek. 7). Cis'in varlığının temel nedeni ve trans izomerler, bağının etrafında kırılmadan dönmenin imkansızlığıdır.

Pirinç. 7. 2-bütanın geometrik izomerleri.
Cis- ve trans izomerler aynı atomik bağlanma dizisine sahiptir ancak ikame edicilerin uzaysal düzenlemesi bakımından birbirlerinden farklıdır ve bu nedenle stereoizomerlerdir. Öte yandan molekülleri asimetrik karbon atomları içermez ve optik olarak aktif değildir.
Cis- ve trans izomerler farklı fiziksel özelliklere sahiptir ve reaksiyonlara (örneğin, farklı hızlarda katılma) maruz kalabilirler.
Geometrik izomerler genellikle doğal bileşikler arasında bulunur; özellikle 4 çift bağın tamamının trans konfigürasyonunda olduğu retinol izomeri (A vitamini), görme keskinliğini sağlamak için özellikle önemlidir. Sıvı yağları oluşturan doymamış asitlerin hidrokarbon radikalleri çift bağlara göre cis konfigürasyonundadır.
