Односот помеѓу сместувањето на елементите во периодниот систем и својствата на хемиските елементи, едноставни материи, соединенија на елементи со водород и кислород. Концептот на атомски радиус и електронегативност на елементите
Да ја разгледаме врската помеѓу положбата на елементите во Периодниот систем и таквите својства на хемиските елементи како атомски радиус, електронегативност, метални и неметални својства.
Атомскиот радиус е вредност што ја покажува големината на електронската обвивка на атомот. Ова е многу важна количина од која зависат својствата на атомите на хемиските елементи. Во главните подгрупи, како што се зголемува полнежот на атомското јадро, бројот на електронски нивоа, според тоа, атомскиот радиус се зголемува со зголемување на атомскиот број во главните подгрупи. Во периоди има зголемување на полнењето на атомското јадро хемиски елемент, што доведува до зголемена привлечност на надворешните електрони кон јадрото. Покрај тоа, како што се зголемува полнежот на јадрото, бројот на електрони се зголемува за надворешно ниво, сепак, бројот на електронски нивоа не се зголемува. Овие законитости доведуваат до затегнување на електронската обвивка околу јадрото. Затоа, атомскиот радиус се намалува со зголемување на атомскиот број во периоди.
На пример, да ги подредиме хемиските елементи O (кислород), C (јаглерод), Li (литиум), F (флуор), N (азот) по редослед на намалување на атомските радиуси. Дадените хемиски елементи се во вториот период. Во еден период, атомските радиуси се намалуваат со зголемување на атомскиот број. Затоа, наведените хемиски елементи мора да бидат напишани по зголемен редослед на нивните сериски броеви: Li, C, N, O, F (литиум, јаглерод, азот, кислород, флуор)
Електронегативноста е способност на атомот во соединенијата да привлекува валентни електрони, т.е. оние електрони со чија помош се создаваат хемиски врски меѓу атомите. Електронегативноста зависи од способноста на атомското јадро да привлекува електрони однадвор ниво на енергија. Колку е посилна привлечноста, толку е поголема електронегативноста. Колку е помал атомскиот радиус, толку е поголема силата на привлекување помеѓу електроните на надворешното енергетско ниво. Следствено, промената на електронегативноста во периодите и главните подгрупи ќе биде спротивна на промената на атомските радиуси. Затоа, во главните подгрупи електронегативноста се намалува со зголемување на атомскиот број. Во периоди со зголемување на атомскиот број, електронегативноста се зголемува.
На пример, да ги подредиме хемиските елементи Br (Бром), F (флуор), I (јод), Cl (Хлор) по редослед на зголемување на електронегативноста. Дадените хемиски елементи се во главна подгрупаседма група. Во главните подгрупи, електронегативноста се намалува со зголемување на атомскиот број. Затоа, наведените хемиски елементи мора да бидат напишани по редослед на намалување на нивните сериски броеви: I, Br, Cl, F (јод, бром, хлор, флуор).
Металните својства се својства на атомите на хемиските елементи да се откажат од електроните. Хемиските елементи кои покажуваат метални својства обично имаат еден до три електрони во нивната надворешна обвивка. Неметалните својства се својства на атомите на хемиските елементи да прифаќаат електрони. Хемиските елементи кои покажуваат неметални својства обично имаат четири до осум електрони во нивната надворешна обвивка. Колку полесно електронот се откажува од надворешно енергетско ниво, толку се поголеми металните својства и, соодветно, помали неметалните својства. Полесно е да се откаже електрон од надворешно енергетско ниво, толку е поголем атомскиот радиус поради фактот што силата на привлекување помеѓу јадрото и електроните се намалува со зголемување на растојанието меѓу нив. Следствено, промената во металните својства на хемиските елементи ќе биде слична на промената на нивните атомски радиуси. Затоа, во главните подгрупи, металните својства се зголемуваат со зголемување на серискиот број, а во периоди со зголемување на серискиот број, металните својства се намалуваат. Неметалните својства, напротив, во главните подгрупи се намалуваат со зголемување на серискиот број, а во периоди со зголемување на серискиот број тие се зголемуваат.
На пример, да ги подредиме хемиските елементи Al, S, Mg, Cl, Na по редослед на зголемување на неметалните својства. Дадените хемиски елементи се во третиот период. Во периоди, неметалните својства се зголемуваат со зголемување на атомскиот број. Затоа, наведените хемиски елементи мора да се напишат по зголемен редослед на нивните сериски броеви: Na, Mg, Al, S, Cl Да ја разгледаме врската помеѓу положбата на хемиските елементи во Периодниот систем и својствата на оксидите и соодветните хидроксиди кои ги формираат овие хемиски елементи, користејќи ги како пример елементите од третиот период. Третиот период вклучува хемиски елементи: Na, Mg, Al, Si, P, S, Cl, Ar
Овие елементи формираат повисоки оксиди од следниот состав (инертниот хемиски елемент Аргон не формира оксид): Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
Натриум оксид и магнезиум оксид покажуваат својства основни оксиди, алуминиум оксидот е амфотеричен оксид, сите оксиди (силициум (IV) оксид, фосфор (V) оксид, сулфур (VI) оксид, хлор (VII) оксид) покажуваат својства на кисели оксиди. Покрај тоа, во серијата Na2O - MgO ослабуваат основните својства, а во серијата SiO2 - P2O5 - SO3 - Cl2O7 киселински својствасе интензивираат.
Исто така е можно да се анализира природата на промената на својствата на хидроксидите во текот на периодот, што одговара на повисоки оксиди: NaOH, Mg (OH)2, Al (OH)3, H2SiO3, H3PO4, H2SO4, HClO4.
Натриум хидроксид и магнезиум хидроксид покажуваат својства на базите, алуминиум хидроксид се амфотеричен хидроксид, сите други хидроксиди покажуваат својства на киселини: силикатна киселина, ортофосфатна киселина, сулфурна киселина, хлорна киселина. Покрај тоа, во серијата NaOH - Mg (OH)2 ослабуваат основните својства, а во серијата H2SiO3 - H3PO4 - H2SO4 - HClO4 киселинските својства се зголемуваат.
Така, во низа одредени елементи ослабени се својствата на базичните оксиди и нивните соодветни хидроксиди, а се зајакнуваат киселинските својства во иста насока. Премин од основно во киселински оксиди, и, соодветно, од бази до киселини се изведува во период поради амфотеричен оксид или хидроксид. Овој модел важи за вториот и третиот период периодниот систем. За елементи на долги периоди, се забележуваат сложени обрасци.
Под радиус атомсе однесува на растојанието помеѓу јадрото на даденото атоми неговата најоддалечена електронска орбита. Денес, општо прифатената мерна единица за атомскиот радиус е пикометарот (pm). Одреди го радиусот атоммногу лесно.
Ќе ви треба
- периодниот систем на Менделеев
Инструкции
Пред сè, треба да го имате при рака вообичаениот периодичен систем, во кој сè е наредено по ред познати на човештвотохемиски елементи. Многу е лесно да се најде оваа табела во која било референтна книга за хемија, училишен учебник, или може да се купи одделно во вашата локална книжарница.
На десно горниот аголСекој хемиски елемент има свој сериски број. Овој број целосно се совпаѓа со атомскиот број радиусдадена атом.
На пример, атомскиот број на хлорот (Cl) е 17. Тоа значи дека растојанието од јадрото атомхлорот до неговата најдалечна орбита, движењето на стабилен електрон е 17 часот. Ако треба да го пронајдете не само атомскиот радиус, туку и распределбата на електроните над електронски орбити, тогаш овој податок може да се нагласи од колоната со броеви што се наоѓа десно од името на хемискиот елемент.
Структурата на планетата Земја е поделена на јадро, обвивка и кора. Јадро - централен дел, кој се наоѓа најдалеку од површината. Мантијата се наоѓа под кората и над кернели. Конечно, кортексот е надворешниот цврста школкапланети.

Инструкции
Еден од првите што го предложи постоењето кернелиБританскиот хемичар и физичар Хенри Кевендиш во 18 век. Успеал да ја пресмета масата и просечна густинаЗемјата. Тој ја споредил густината на Земјата со густината на карпите на површината. Утврдено е дека густина на површинатазначително под просекот.
Германскиот сеизмолог Е.Вичерт го докажал постоењето кернелиЗемји во 1897 година. Американскиот геофизичар Б. Гутенберг во 1910 година ја одредил длабочината на кернели– 2900 км. Според научниците, јадрото се состои од никел и други елементи со афинитет за железо: злато, јаглерод, кобалт, германиум и други.
Просечна радиус кернелие 3500 километри. Покрај тоа, во зградата кернелиЗемјите ослободуваат цврсто тело внатрешно јадро, имајќи радиусоколу 1300 километри, а течноста надворешна радиусоми околу 2200 километри. Во Центар кернелитемпературите достигнуваат 5000°C. Маса кернелисе проценува на речиси 2 10^24 kg.
Може да се направи аналогија помеѓу структурата на планетите и структурата на атомот. Атомот има и централен дел, јадрото, со најголемиот дел од масата концентрирана во јадрото. Димензии атомски јадрасочинуваат неколку фемтометри (од латинскиот фемто - 15). Префиксот „фемто“ значи множење со десет до минус петнаесеттата сила. Така, јадрото на атомот е 10 илјади пати помало од самиот атом и 10^21 пати помали димензии кернелиЗемјата.
Да се оцени радиуспланети, користат индиректни геохемиски и геофизички методи. Во случај на атом, се анализира распаѓањето на тешките јадра, земајќи ги предвид не толку геометриските радиус, Колку радиусакции нуклеарни сили. Идејата за планетарната структура на атомот ја изнесе Радерфорд. Масовна зависност кернелиод радиусно не е линеарен.
Забелешка
Благодарение на периодниот систем, многу е лесно да се најде не само атомскиот радиус, туку и атомска маса, молекуларна тежина, период и серии на одреден елемент, како и распределба на електроните во електронските орбити заедно со бројот на орбити.
Најпопуларниот модел на атомот е оној усвоен во 1913 година од Нилс Бор. Познат е и како планетарен модел. Ова се должи на фактот дека електроните, како планети сончев систем, се движи околу Сонцето - јадрата на атомот. Орбитите на движењето на електроните се константни. Развојот на овој модел даде поттик за развој на нова насока во теоретска физика - квантна механика.
Првиот радиус од орбитата на движење на електроните се нарекува Боров радиус, а енергијата на електроните во првата орбита се нарекува енергија на јонизација на атомот.
Корисен совет
Вреди да се напомене дека радиусот на кој било атом е обратно пропорционален на бројот на протони во неговото јадро, како и еднакво на полнењенеговото јадро.
Одредувањето на атомските радиуси, исто така, предизвикува одредени проблеми.Прво, атомот не е сфера со строго дефинирана површина и радиус. Потсетиме дека атомот е јадро опкружено со облак од електрони. Веројатноста да се открие електрон додека се оддалечува од јадрото постепено се зголемува до одреден максимум, а потоа постепено се намалува, но станува еднаква на нуласамо на бескрајно големо растојание. Второ, ако сепак избереме некој услов за одредување на радиусот, таков радиус сè уште не може да се измери експериментално.
Експериментот ни овозможува да одредиме само меѓунуклеарни растојанија, со други зборови, должини на врските (а потоа со одредени резерви дадени во насловот на сл. 2.21). За нивно одредување се користи рендгенска дифракциона анализа или методот на дифракција на електрони (врз основа на електронска дифракција). Се претпоставува дека радиусот на атомот е еднаква на половинанајмалото меѓунуклеарно растојание помеѓу идентични атоми.
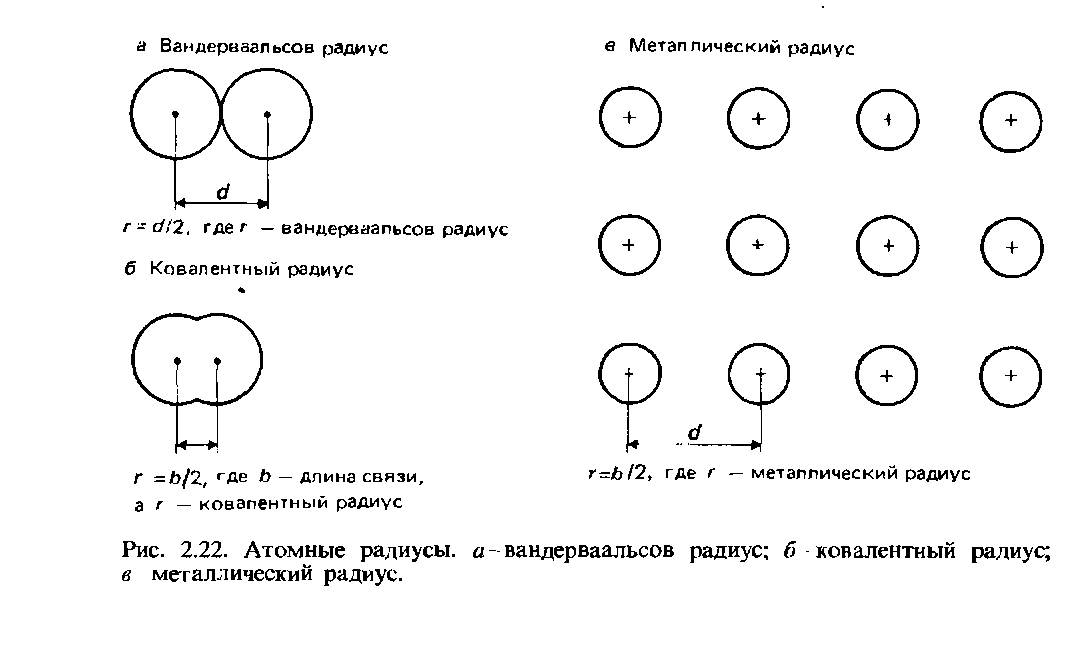
Радиусите на Вандер Валс. За неврзаните атоми, половина од најмалото меѓунуклеарно растојание се нарекува ван дер Валсов радиус. Оваа дефиниција е илустрирана со Сл. 2.22.
Ориз. 2.21. Должина на врската. Бидејќи молекулите постојано вибрираат, меѓунуклеарното растојание или должината на врската нема фиксна вредност. Овој цртеж шематски ја претставува линеарната вибрација на едноставна диатомска молекула. Вибрациите не дозволуваат должината на врската да се дефинира едноставно како растојание помеѓу центрите на два сврзани атоми. Повеќе прецизна дефиницијаизгледа вака: должината на врската е растојанието помеѓу врзаните атоми, мерено помеѓу центрите на маса на два атома и што одговара на минималната енергија на врската. Минималната енергија е прикажана на Морзеовата крива (види Сл. 2.1).

Табела 2.6. Густини на јаглеродни и сулфурни алотропи Табела 2.7. Должина на јаглерод-јаглерод врски
Ковалентни радиуси.Ковалентниот радиус е дефиниран како половина од меѓунуклеарното растојание (должина на врската) помеѓу два идентични атома поврзани еден со друг ковалентна врска (Сл. 2.22, б). Како пример, да ја земеме молекулата на хлор Cl2, чија должина на врската е 0,1988 nm. Ковалентниот радиус на хлорот се претпоставува дека е 0,0944 nm.
Знаејќи го ковалентниот радиус на атом од еден елемент, можете да го пресметате ковалентниот радиус на атом на друг елемент. На пример, експериментално поставена вредностДолжината на врската C-Cl во CH3Cl е 0,1767 nm. Одземајќи го ковалентниот радиус на хлорот (0,0994 nm) од оваа вредност, откриваме дека ковалентниот радиус на јаглеродот е 0,0773 nm. Овој метод на пресметка се заснова на принципот на адитивност, според кој атомските радиуси се покоруваат едноставен закондодавање. Така, должината на врската C-Cl е збир на ковалентни радиуси на јаглерод и хлор. Принципот на адитивност се однесува само на едноставни ковалентни врски. Двојните и тројните ковалентни врски се пократки (Табела 2.7).
Должината на едноставна ковалентна врска зависи и од нејзината околина во молекулата. На пример, должина C-H врскиварира од 0,1070 nm кај трисупституираниот јаглероден атом до 0,115 nm во соединението CH3CN.
Метални радиуси. Металниот радиус се претпоставува дека е еднаков на половина од меѓунуклеарното растојание помеѓу соседните јони во кристална решеткаметал (сл. 2.22, в). Терминот атомски радиус обично се однесува на ковалентен радиус на атоми на неметални елементи, а терминот метален радиус на атоми на метални елементи.
Јонски радиуси. Јонскиот радиус е еден од двата дела на меѓунуклеарното растојание помеѓу соседните моноатомски (едноставни) јони во кристално јонско соединение (сол).Одредувањето на јонскиот радиус е исто така полн со значителни проблеми, бидејќи меѓујонските растојанија се мерат експериментално, а не самите јонски радиуси. Интерионските растојанија зависат од пакувањето на јоните во кристалната решетка. На сл. 2.23 покажува три можни начинипакување на јони во кристална решетка. За жал, експериментално измерените меѓујонски растојанија
Ориз. 2.23. Јонските радиуси, c-анјоните се допираат едни со други, но катјоните не допираат анјони; б-катјоните се во контакт со анјоните, но анјоните не се во контакт еден со друг; во конвенционално прифатениот распоред на јони, во кој катјоните се во контакт со анјоните, а анјоните се во контакт едни со други. Растојанието a се определува експериментално. Се зема дека е двојно поголем од радиусот на анјонот. Ова ни овозможува да го пресметаме меѓујонското растојание b, што е збир на радиусите на анјонот и катјонот. Знаејќи го меѓујонското растојание b, можеме да го пресметаме радиусот на катјонот.
не ни дозволувајте да судиме кој од овие три методи на пакување всушност се спроведува во секоја од нив конкретен случај. Проблемот е да се најде пропорцијата во која ќе се подели меѓујонското растојание на два дела што одговараат на радиусите на двата јона, со други зборови, да се одлучи каде всушност завршува еден јон, а каде започнува другиот. Како што е прикажано, на пример, на сл. 2.12, ова прашање не може да се реши ниту со картички густина на електронисоли За да се надмине оваа тешкотија, обично се претпоставува дека: 1) меѓујонското растојание е збир на два јонски радиуси, 2) јоните се сферични во форма и 3) соседните сфери се во контакт една со друга. Последната претпоставка одговара на методот на јонско пакување прикажан на сл. 2.23, ѓ. Ако е познат еден јонски радиус, други јонски радиуси може да се пресметаат врз основа на принципот на адитивност.
Поклопување на радиусот разни видови. Во табелата 2.8 ги прикажува вредностите на радиусите од различни типови за три елементи од третиот период. Тоа најмногу може да се види големи вредностиприпаѓаат на анјонските и ван дер Валсовите радиуси.На сл. 11.9 ги споредува големините на јоните и атомите за сите елементи од третиот период, со исклучок на аргонот. Големините на атомите се одредуваат според нивните ковалентни радиуси. Треба да се забележи дека катјоните се помали од атомите, а анјоните се големи димензииотколку атоми на истите елементи. За секој елемент од сите видови радиуси најмала вредностсекогаш припаѓа на радиусот на катјоните.
Табела 2.8. Споредба на атомски радиуси од различни типови


Експериментално определување.За да се одреди обликот на едноставни молекули и полиатомски јони, или поточно, должината на врските и аглите на врската (аглите меѓу врските), различни експериментални методи. Тие вклучуваат микробранова спектроскопија, како и методи за проучување на дифракција х-зраци(дифракција на рентген), неутрони (неутронска дифракција) или електрони (електронска дифракција). Следното поглавје детално објаснува како може да се користи дифракција на Х-зраци за да се одреди кристална структура. Меѓутоа, електронската дифракција (метод за проучување на дифракцијата на електроните) обично се користи за одредување на обликот на едноставни молекули во гасната фаза. Овој метод се заснова на користење бранови својстваелектрони. Низ примерок од испитуваниот гас се пренесува сноп од електрони. Молекулите на гасот ги расфрлаат електроните, што резултира со шема на дифракција. Со негова анализа, можно е да се одредат должините на врските и аглите на врската во молекулите. Овој метод е сличен на оној што се користи во анализата на шемата на дифракција формирана од расејувањето на Х-зраците.
Атомски радиуси атомски радиуси
карактеристики кои овозможуваат приближно да се проценат меѓуатомските (меѓунуклеарни) растојанија во молекулите и кристалите. Атомските радиуси се од редот на 0,1 nm. Утврдени главно од податоците на Х-зраци структурна анализа.
АТОМСКИ РАДИУСАТОМСКИ РАДИУС, карактеристики кои овозможуваат приближно да се процени меѓуатомските (меѓунуклеарни) растојанија во молекулите и кристалите.
Ефективниот радиус на атом или јон се подразбира како радиус на неговата сфера на дејство, а атомот (јон) се смета за некомпресибилна топка. Користејќи го планетарниот модел на атом, тој е претставен како јадро околу кое во орбити (цм.ОРБИТАЛИ)електроните ротираат. Редоследот на елементите во периодичниот систем на Менделеев одговара на низата за полнење електронски школки. Ефективниот радиус на јонот зависи од полнењето на електронските обвивки, но не е еднаков на радиусот на надворешната орбита. За да се одреди ефективниот радиус, атомите (јоните) во кристалната структура се претставени како цврсти топчиња што се допираат, така што растојанието помеѓу нивните центри е еднакво на збирот на радиусите. Атомските и јонските радиуси се определуваат експериментално од мерењата на рендгенските зраци на меѓуатомските растојанија и се пресметуваат теоретски врз основа на квантните механички концепти.
Големините на јонските радиуси ги почитуваат следните закони:
1. Во еден вертикален ред од периодниот систем, радиусите на јоните се c еднаков полнежсе зголемуваат со зголемување атомски број, бидејќи бројот на електронски обвивки се зголемува, а оттука и големината на атомот.
2. За истиот елемент, јонскиот радиус се зголемува со зголемување негативен полнежа се намалува со зголемување позитивен полнеж. Анјонски радиус поголем од радиусоткатјон, бидејќи анјонот има вишок на електрони, а катјонот има недостаток. На пример, за Fe, Fe 2+, Fe 3+ ефективниот радиус е 0,126, 0,080 и 0,067 nm, соодветно, за Si 4-, Si, Si 4+ ефективниот радиус е 0,198, 0,118 и 0,040 nm.
3. Големините на атомите и јоните ја следат периодичноста на системот на Менделеев; исклучоци се елементите од бр. 57 (лантан) до бр. 71 (лутетиум), каде што радиусите на атомите не се зголемуваат, туку рамномерно се намалуваат (т.н. контракција на лантанид) и елементите од бр. 89 (актиниум) наваму. (т.н. актинидна контракција).
Атомскиот радиус на хемискиот елемент зависи од координацискиот број (цм.КООРДИНАЦИСКИ БРОЈ). Зголемувањето на координативниот број е секогаш придружено со зголемување на меѓуатомските растојанија. Во овој случај, релативната разлика во вредностите на атомските радиуси што одговараат на два различни координативни броеви не зависи од типот на хемиската врска (под услов типот на врската во структурите со споредените координациски броеви да е ист). Промената на атомските радиуси со промена на координативниот број значително влијае на големината на волуметриските промени за време на полиморфните трансформации. На пример, кога се лади железото, неговата трансформација од модификација со кубна решетка насочена кон лице во модификација со кубна решетка во центарот на телото, која се одвива на 906 o C, треба да биде придружена со зголемување на волуменот за 9%. реално зголемувањето на обемот е 0,8%. Ова се должи на фактот дека поради промена на координативниот број од 12 на 8, атомскиот радиус на железо се намалува за 3%. Односно, промените во атомските радиуси за време на полиморфните трансформации во голема мера ги компензираат оние волуметриски промени што требаше да се случат ако атомскиот радиус не се промени. Атомските радиуси на елементите можат да се споредат само ако имаат ист координативен број.
Атомските (јонски) радиуси зависат и од типот на хемиската врска.
Во кристали со метална врска (цм.МЕТАЛНА Врска)атомскиот радиус е дефиниран како половина од меѓуатомското растојание помеѓу најблиските атоми. Во случај на цврсти раствори (цм.ЦВРСТИ РЕШЕНИЈА)металните атомски радиуси се разликуваат на сложени начини.
Ковалентните радиуси на елементите со ковалентна врска се подразбираат како половина од меѓуатомското растојание помеѓу најблиските атоми поврзани со една ковалентна врска. Карактеристика на ковалентните радиуси е нивната постојаност во различни ковалентни структури со исти координациски броеви. Значи, растојанија во единечни обврзници S-S во дијамант и заситени јаглеводородисе идентични и еднакви на 0,154 nm.
Јонски радиуси во супстанции со јонски врски (цм.јонска обврзница)не може да се определи како половина од збирот на растојанијата помеѓу блиските јони. Како по правило, големини на катјони и анјони остро се разликуваат. Покрај тоа, симетријата на јоните се разликува од сферичната. Постојат неколку пристапи за проценка на јонските радиуси. Врз основа на овие пристапи, се проценуваат јонските радиуси на елементите, а потоа јонските радиуси на другите елементи се одредуваат од експериментално одредени меѓуатомски растојанија.
Ван дер Валсовите радиуси ги одредуваат ефективните големини на атомите благородни гасови. Покрај тоа, атомските радиуси на Ван дер Валс се сметаат за половина од меѓунуклеарното растојание помеѓу најблиските идентични атоми кои не се поврзани еден со друг хемиска врска, т.е. кои припаѓаат на различни молекули (на пример, во молекуларни кристали).
При користење на атомски (јонски) радиуси во пресметките и конструкциите, нивните вредности треба да се земат од табелите конструирани според еден систем.
енциклопедиски речник. 2009 .
Погледнете што се „атомските радиуси“ во другите речници:
Карактеристики на атомите што овозможуваат приближно да се проценат меѓуатомските (меѓунуклеарни) растојанија во молекулите и кристалите. Атомите немаат јасни граници, сепак, според концептите на квант. механика, веројатноста да се најде електрон за одредено растојание од јадрото... ... Физичка енциклопедија
Карактеристики кои овозможуваат приближно да се процени меѓуатомските (меѓунуклеарни) растојанија во молекулите и кристалите. Утврдено главно од податоците за структурна анализа на рендген... Голем енциклопедиски речник
Ефективни карактеристики на атомите, овозможувајќи приближно да се процени меѓуатомското (меѓунуклеарно) растојание во молекулите и кристалите. Според концептите на квантната механика, атомите немаат јасни граници, но веројатноста да се најде електрон... ... Хемиска енциклопедија
Карактеристики на атомите што овозможуваат приближно да се проценат меѓуатомските растојанија во супстанциите. Според квантната механика, атомот нема дефинитивни граници, но веројатноста да се најде електрон на дадено растојаниеод јадрото на атомот, почнувајќи од... ... Голема советска енциклопедија
