II.1. Konformationer (rotationsisomerisme)
Overgangen fra det enkleste organiske kulbrinte, metan, til dets nærmeste homolog, ethan, giver problemer med rumlig struktur, for hvis løsning det ikke er nok at kende de parametre, der er diskuteret i afsnittet. Faktisk, uden at ændre hverken bindingsvinkler eller bindingslængder, kan man forestille sig mange geometriske former for ethanmolekylet, der adskiller sig fra hinanden i den indbyrdes rotation af carbontetraedre omkring den C-C-binding, der forbinder dem. Som et resultat af denne rotation, roterende isomerer (konformere) . Energien af forskellige konformere er ikke den samme, men energibarrieren, der adskiller de forskellige rotationsisomerer for de fleste organiske forbindelser lille. Derfor, hvornår normale forhold Som regel er det umuligt at fiksere molekyler i en strengt defineret konformation: sædvanligvis eksisterer flere rotationsformer, der let omdannes til hinanden, i ligevægt.
Metoderne til grafisk afbildning af konformationer og deres nomenklatur er som følger. Lad os starte med ethanmolekylet. For det kan man forudse eksistensen af to konformationer, der adskiller sig maksimalt i energi. De er vist nedenfor som perspektivfremskrivninger (1) ("savværksgeder"), laterale fremspring (2) og Newmans formler (3).
I perspektivprojektionen (1a, 1b) skal C-C forbindelsen forestilles gå i det fjerne; Kulstofatomet til venstre er tæt på observatøren, og kulstofatomet til højre er længere væk fra ham.
I det laterale projektion (2a, 2b) ligger fire H-atomer i tegningens plan; Kulstofatomerne strækker sig faktisk noget ud af dette plan, men de anses som regel forenklet også for at ligge i tegningens plan. "Fed" kileformede bindinger ved fortykkelsen af kilen indikerer en udgang fra planet mod observatøren af atomet, som fortykkelsen vender mod. Stiplede kileformede forbindelser markerer afstanden fra observatøren.
I Newman-projektionen (3a, 3b) betragtes molekylet langs C-C-bindingen (i retningen angivet af pilen i formlerne 1a, b). Tre linjer, der divergerer i en vinkel på 120° fra midten af cirklen, angiver bindingerne af carbonatomet tættest på observatøren; linjerne "stikker ud" bagved cirklen er bindingerne af det fjerne kulstofatom.
Konformationen vist til venstre kaldes sløret : Dette navn minder os om, at hydrogenatomerne i begge CH 3-grupper er modsat hinanden. Den formørkede konformation har øget indre energi og er derfor ugunstig. Konformationen vist til højre kaldes hæmmet , hvilket antyder, at fri rotation omkring C-C-bindingen er "hæmmet" i denne position, dvs. molekylet eksisterer overvejende i denne konformation.
Den minimale energi, der kræves for fuldstændig at rotere et molekyle omkring en bestemt binding, kaldes rotationsbarriere for denne forbindelse. Rotationsbarrieren i et molekyle som ethan kan udtrykkes i form af ændringen potentiel energi molekyler som funktion af forandring dihedral (torsions) vinkel systemer. Den dihedrale vinkel (betegnet tau) er afbildet i figuren nedenfor:

Energiprofilen for rotation omkring C-C-bindingen i ethan er vist i den følgende figur. Rotationen af "tilbage" carbonatomet er afbildet af ændringen dihedral vinkel mellem de to viste brintatomer. For nemheds skyld er de resterende brintatomer blevet udeladt. Rotationsbarrieren, der adskiller de to former for ethan, er kun 3 kcal/mol (12,6 kJ/mol). Minimaene for den potentielle energikurve svarer til hæmmede konformationer, og maksimaerne svarer til okkluderede konformationer. Da energien fra nogle molekylære kollisioner ved stuetemperatur kan nå 20 kcal/mol (ca. 80 kJ/mol), kan denne barriere på 12,6 kJ/mol let overvindes, og rotation i ethan anses for at være fri.
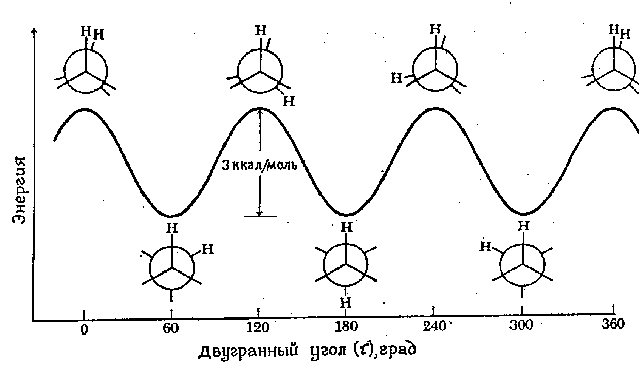
Vi understreger, at hvert punkt på den potentielle energikurve svarer til en specifik konformation. Punkterne svarende til minima svarer til konformationelle isomerer, dvs de fremherskende komponenter i en blanding af alle mulige konformationer .
Efterhånden som molekylet bliver mere komplekst, stiger antallet af mulige konformationer, der adskiller sig markant i energi. Ja, for n-butan kan afbildes i seks konformationer, der er forskellige relativ position CH3-grupper, dvs. rotation omkring den centrale forbindelse C-C. Nedenfor er konformationerne af n-butan afbildet som Newman-projektioner. Konformationerne vist til venstre (skraveret) er energetisk ugunstige, kun hæmmede er praktisk taget realiseret.
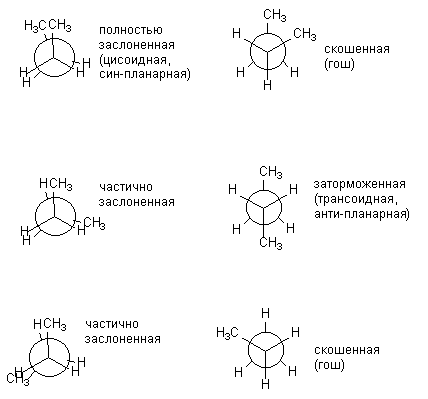
De forskellige formørkede og hæmmede konformationer af butan er ikke de samme i energi. De tilsvarende energier af alle konformationer dannet under rotation omkring den centrale C-C-binding er præsenteret nedenfor:


Efterhånden som et molekyle bliver mere komplekst, stiger antallet af mulige konformationer.
Så konformationer er forskellige ikke-identiske rumlige former molekyler, der har en bestemt konfiguration. Konformere er stereoisomere strukturer, der er i mobil ligevægt og er i stand til interkonvertering ved at rotere omkring simple bindinger.
Nogle gange bliver barrieren for sådanne transformationer høj nok til at adskille stereoisomere former (eksempel: optisk aktive biphenyler;). I sådanne tilfælde taler de ikke længere om konformere, men om faktisk at eksistere stereoisomerer .
II.2. Geometrisk isomeri
En vigtig konsekvens af stivheden af en dobbeltbinding (fraværet af rotation omkring den) er eksistensen geometriske isomerer . De mest almindelige af dem er cis-trans isomerer forbindelser af ethylenserien indeholdende ulige substituenter på umættede atomer. Det enkleste eksempel er isomererne af buten-2.

Geometriske isomerer har det samme kemisk struktur(samme rækkefølge kemisk binding), der adskiller sig i det rumlige arrangement af atomer, ifølge konfigurationer . Denne forskel skaber en forskel i fysisk (såvel som kemiske egenskaber). Geometriske isomerer kan i modsætning til konformere isoleres i ren form og eksisterer som individuelle, stabile stoffer. Deres gensidige transformation kræver normalt energi i størrelsesordenen 125-170 kJ/mol (30-40 kcal/mol). Denne energi kan tilføres ved opvarmning eller bestråling.
I de enkleste tilfælde giver nomenklaturen af geometriske isomerer ingen vanskeligheder: cis- former er geometriske isomerer, hvor identiske substituenter ligger på samme side af pi-bindingsplanet, trance- isomerer har identiske substituenter på forskellige sider fra pi-bindingsplanet. I mere komplekse tilfælde bruges det Z,E-nomenklatur . Dens hovedprincip: at angive konfigurationen angiver cis-(Z, fra tysk Zusammen - sammen) el trance-(E, fra tysk Entgegen - modsat) placering ledende suppleanter med en dobbeltbinding.
I Z,E-systemet betragtes substituenter med et højere atomnummer som senior. Hvis atomerne direkte forbundet med umættede carbonatomer er de samme, går de videre til "andet lag", om nødvendigt - til det "tredje lag" osv.
Lad os overveje anvendelsen af reglerne i Z,E-nomenklaturen ved at bruge to eksempler.

| jeg | II |
Lad os starte med formel I, hvor alt er løst af atomerne i det "første lag". Efter at have arrangeret deres atomnumre finder vi, at de ældre substituenter i hvert par (brom i den øverste del af formlen og nitrogen i den nedre del) er i trance-position, deraf den stereokemiske betegnelse E:
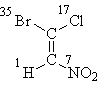 E-1-brom-1-chlor-2-nitroethen
E-1-brom-1-chlor-2-nitroethen
For at bestemme den stereokemiske betegnelse af struktur II er det nødvendigt at se efter forskelle i de "højere lag". I det første lag adskiller grupperne CH 3, C 2 H 5, C 3 H 7 sig ikke. I det andet lag har CH-gruppen 3 sum atomnumre er lig med tre (tre brintatomer), har grupperne C 2 H 5 og C 3 H 7 hver 8. Det betyder, at CH 3-gruppen ikke tages i betragtning - den er yngre end de to andre. Seniorgrupperne er således C 2 H 5 og C 3 H 7, det er i cis-position; stereokemisk betegnelse Z.
 Z-3-methylhepten-3
Z-3-methylhepten-3
Hvis det var nødvendigt at bestemme, hvilken gruppe der er ældre - C 2 H 5 eller C 3 H 7, ville man skulle gå til atomerne i det "tredje lag"; summen af atomnumre i dette lag for begge grupper ville være ens til henholdsvis 3 og 8, dvs. C3H7 er ældre end C2H5. I mere komplekse tilfælde af bestemmelse af forrang skal der tages højde for yderligere forhold, såsom: et atom forbundet med en dobbeltbinding tælles to gange, forbundet med en tredobbelt binding - tre gange; Af isotoperne er den tungere ældre (deuterium er ældre end brint) og nogle andre.
Bemærk, at notationen Z Ikke er synonymer cis- betegnelser, ligesom betegnelser E, svarer ikke altid til placeringen trance-, For eksempel:

cis- 1,2-dichlorpropen-1 cis- 1,2-dichlor-1-brompropen-1
Z-1,2-dichlorpropen-1 E-1,2-dichlor-1-brompropen-1
Kontrolopgaver
1. Bombicol - et feromon (seksuelt tiltrækningsmiddel) fra silkeormen - er E-10-Z-12-hexadecadienol-1. Forestil dig ham strukturformel.
2. Navngiv følgende forbindelser ved hjælp af Z,E-nomenklaturen:

II.3. Optisk isomerisme (enantiomerisme)
Blandt organiske forbindelser er der stoffer, der kan rotere lysets polariseringsplan. Dette fænomen kaldes optisk aktivitet, og de tilsvarende stoffer er optisk aktiv . Optisk aktive stoffer forekommer i par optiske antipoder - isomerer, hvis fysiske og kemiske egenskaber er identiske under normale forhold, med undtagelse af én ting - tegnet på rotation af polariseringsplanet. (Hvis en af de optiske antipoder f.eks. har en specifik rotation [NOTE 1] +20 o, så har den anden en specifik rotation på -20 o).
II.4. Projektionsformler
For konventionelt at afbilde et asymmetrisk atom på et plan, brug projektionsformler for E. Fisher . De opnås ved at projicere de atomer, som det asymmetriske atom er knyttet til, på et plan. I dette tilfælde er det asymmetriske atom i sig selv normalt udeladt, idet kun de skærende linjer og substituentsymboler bibeholdes. For at huske det rumlige arrangement af substituenter er en brudt lodret linje ofte bevaret i projektionsformler (de øvre og nedre substituenter fjernes ud over tegningens plan), men dette gøres ofte ikke. Nedenfor er forskellige måder registrering af projektionsformlen svarende til venstre model i den foregående figur:

Her er nogle eksempler på projektionsformler:

(+)-alanin (-)-butanol (+)-glyceraldehyd
Navnene på stoffer angiver deres rotationstegn: det betyder for eksempel, at den venstrehåndede antipode af butanol-2 har rumlig konfiguration , udtrykt præcist ved ovenstående formel, og dets spejlbillede svarer til højredrejende butanol-2. Konfigurationsdefinition optiske antipoder udføres eksperimentelt [NOTE 3].
I princippet kan hver optisk antipode afbildes med tolv (!) forskellige projektionsformler - alt efter hvordan modellen er placeret under projektion og fra hvilken side vi ser på den. For at standardisere projektionsformler er der indført visse regler for at skrive dem. Således er hovedfunktionen, hvis den er i enden af kæden, normalt placeret øverst, hovedkæden er afbildet lodret.
For at sammenligne "ikke-standardiserede" skrevne projektionsformler skal du vide følgende regler transformationer af projektionsformler.
1. Formler kan roteres 180° i tegneplanet uden at ændre deres stereokemiske betydning:

2. To (eller et hvilket som helst lige tal) omlejringer af substituenter på et asymmetrisk atom ændrer ikke den stereokemiske betydning af formlen:

3. En (eller et hvilket som helst ulige antal) permutationer af substituenter i det asymmetriske centrum fører til formlen for den optiske antipode:

4. En 90° drejning i tegneplanet gør formlen til en antipodeal, medmindre betingelsen for substituenternes placering i forhold til tegneplanet samtidig ændres, dvs. overvej ikke, at nu er de laterale substituenter placeret bag tegneplanet, og de øverste og nederste er foran det. Hvis du bruger en formel med en stiplet linje, vil den ændrede orientering af den stiplede linje direkte minde dig om dette:

5. I stedet for permutationer kan projektionsformler transformeres ved at rotere hvilke som helst tre substituenter med eller mod uret; den fjerde substituent ændrer ikke sin position (denne operation svarer til to permutationer):

6. Projektionsformler kan ikke udledes fra tegningens plan (dvs. du kan for eksempel ikke undersøge dem "i lyset" fra bagsiden af papiret - i dette tilfælde vil den stereokemiske betydning af formlen ændre sig).
II.5. Racekammerater
Hvis formlen for et stof indeholder et asymmetrisk atom, betyder det ikke, at et sådant stof vil have optisk aktivitet. Hvis der opstår et asymmetrisk center under en normal reaktion (substitution i CH 2-gruppen, addition ved en dobbeltbinding osv.), så er sandsynligheden for at skabe begge antipodean-konfigurationer den samme. På trods af asymmetrien af hvert enkelt molekyle viser det resulterende stof sig derfor at være optisk inaktivt. Denne form for optisk inaktiv modifikation, der består af en lige stor mængde af begge antipoder, kaldes racekammerater [NOTE 4] .
II.6. Diastereomerisme
Forbindelser med flere asymmetriske atomer har vigtige egenskaber, der adskiller dem fra de tidligere diskuterede simplere optisk aktive stoffer med ét asymmetricenter.
Lad os antage, at der i et molekyle af et bestemt stof er to asymmetriske atomer; Lad os kalde dem betinget A og B. Det er let at se, at molekyler med følgende kombinationer er mulige:
Molekylerne 1 og 2 er et par optiske antipoder; det samme gælder for et molekylepar 3 og 4. Hvis vi sammenligner molekyler fra forskellige par antipoder - 1 og 3, 1 og 4, 2 og 3, 2 og 4, så vil vi se, at de anførte par ikke er optiske antipoder: konfigurationen af et asymmetrisk atom er den samme, konfigurationen af den anden er ikke den samme . Disse er alle par diastereomerer , dvs. rumlige isomerer, Ikke udgør optiske antipoder med hinanden.
Diastereomerer adskiller sig ikke kun fra hinanden i optisk rotation, men også i alle andre fysiske konstanter: de har forskellige smelte- og kogepunkter, forskellige opløseligheder osv. Forskelle i diastereomers egenskaber er ofte ikke mindre end forskellene i egenskaber mellem strukturelle isomerer .
Et eksempel på en forbindelse af denne type er chlormalsyre

Dens stereoisomere former har følgende projektionsformler:
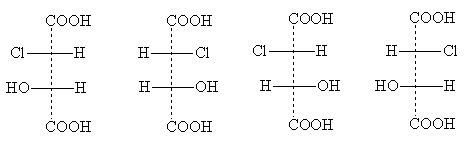
erytro- formularer treo- formularer
Titler erythro- Og trio- kommer fra navnene på kulhydraterne erythrose og threose. Disse navne bruges til at angive den relative position af substituenter i forbindelser med to asymmetriske atomer: erythro -isomerer de er dem, for hvilke to identiske laterale substituenter forekommer i standardprojektionsformlen på den ene side (højre eller venstre); trio -isomerer har identiske laterale substituenter på forskellige sider af projektionsformlen [NOTE 5].
To erytro- isomerer er et par optiske antipoder; når de blandes, dannes et racemat. Et par optiske isomerer er og treo- former; de producerer også et racemat, når de blandes, som adskiller sig i egenskaber fra racematet erytro- formularer. Der er således i alt fire optisk aktive isomerer af chlormalsyre og to racemater.
Med en yderligere stigning i antallet af asymmetriske centre øges antallet af rumlige isomerer, og hvert nyt asymmetrisk center fordobler antallet af isomerer. Det bestemmes af formlen 2 n, hvor n er antallet af asymmetriske centre.
Antallet af stereoisomerer kan falde på grund af delvis symmetri, der forekommer i nogle strukturer. Et eksempel er vinsyre, hvor antallet af individuelle stereoisomerer er reduceret til tre. Deres projektionsformler:
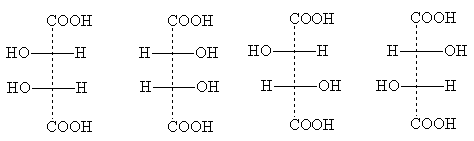
Formel I er identisk med formel Ia: den forvandles til den, når den drejes 180° i tegningens plan og repræsenterer derfor ikke en ny stereoisomer. Dette er en optisk inaktiv modifikation - meso form . I modsætning til et racemat, som kan opdeles i optisk antipoder, meso- formen er grundlæggende uforgængelig: hvert af dets molekyler har et asymmetrisk center i en konfiguration, og det andet - det modsatte. Som et resultat opstår intramolekylær kompensation af rotationen af begge asymmetriske centre.
Meso- Alle optisk aktive stoffer har former med flere identiske (dvs. forbundet med identiske substituenter) asymmetriske centre [NOTE 6]. Projektionsformler meso- Former kan altid genkendes ved, at de altid kan opdeles med en vandret linje i to halvdele, som, når de er skrevet på papir, formelt set er identiske, men i virkeligheden er spejlet:

Formlerne II og III afbilder de optiske antipoder af vinsyre; når de blandes, dannes et optisk inaktivt racemat - druesyre.
II.7. Nomenklatur af optiske isomerer
Det enkleste, ældste, men stadig i brug system for nomenklatur af optiske antipoder er baseret på sammenligning af projektionsformlen for den kaldede antipode med projektionsformlen for et bestemt standardstof valgt som "nøgle". Så for alfa-hydroxysyrer og alfa-aminosyrer er nøglen øverste del deres projektionsformel (i standardnotation):

L- hydroxysyrer (X = OH) D- hydroxysyrer (X = OH)
L-aminosyrer (X = NH 2) D- aminosyrer (X = NH 2)
Konfigurationen af alle alfa-hydroxysyrer, der har en hydroxylgruppe til venstre i den standard skrevne Fischer-projektionsformel, er angivet med tegnet L; hvis hydroxylen er placeret i projektionsformlen til højre - tegn D[NOTE 7] .
Nøglen til at udpege konfigurationen af sukkerarter er glyceraldehyd:

L-(-)-glyceraldehyd D-(+)-glyceraldehyd
I sukkermolekyler betegnelsen D- eller L- henviser til konfiguration nederste asymmetrisk center.
System D-,L- betegnelsen har væsentlige ulemper: for det første betegnelsen D- eller L- angiver konfigurationen af kun ét asymmetrisk atom; for det andet opnås forskellige symboler for nogle forbindelser, afhængigt af om glyceraldehyd- eller hydroxysyrenøglen tages som nøglen, for eksempel:

Disse mangler ved nøglesystemet begrænser dets anvendelse på nuværende tidspunkt til tre klasser af optisk aktive stoffer: sukkerarter, aminosyrer og hydroxysyrer. Designet til almindelig brug "R,S-system Kahn, Ingold og Prelog [NOTE 8].
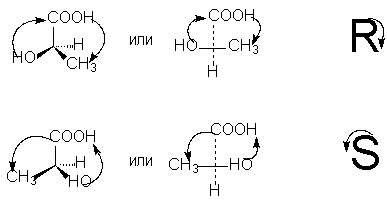
For at bestemme R- eller S-konfigurationen af den optiske antipode er det nødvendigt at arrangere tetraederet af substituenter omkring det asymmetriske carbonatom på en sådan måde, at den laveste substituent (normalt hydrogen) har retningen "væk fra observatøren". Så hvis bevægelsen under overgangen i en cirkel af de tre resterende substituenter fra den ældste til gennemsnittet i anciennitet og derefter til den yngste sker mod uret - Det her R -isomer (associeret med samme håndbevægelse, når man skriver bogstavet R), hvis med uret - Det her S- isomer (associeret med den samme håndbevægelse, når du skriver bogstavet S).
For at bestemme ancienniteten af substituenter på et asymmetrisk atom anvendes reglerne for beregning af atomnumre, som vi allerede har overvejet i forbindelse med Z,E-nomenklaturen af geometriske isomerer (se).
For at vælge R, S-notationer i henhold til projektionsformlen er det nødvendigt, ved et lige antal permutationer (der som bekendt ikke ændrer den stereokemiske betydning af formlen), at arrangere substituenterne således, at de yngste af dem (normalt brint) er i bunden af projektionsformlen. Derefter svarer ancienniteten af de resterende tre substituenter, der falder med uret, til betegnelsen R, mod uret - betegnelsen S [NOTE 9]:
Kontrolopgaver
3. Bestem konfigurationen af det asymmetriske center for ascorbinsyre (vitamin C) (ved R,S-nomenklatur og i sammenligning med glyceraldehyd):

4. Alkaloidet efedrin har formlen:
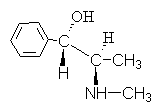
Giv denne forbindelse et navn vha R,S- nomenklatur.
5. Cystein - en ikke-essentiel aminosyre involveret i reguleringen af metaboliske processer, er L-1-amino-2-mercaptopropionsyre. Tegn dens strukturformel og giv dens navn R,S- nomenklatur.
6. Levomycetin (bredspektret antibiotikum) er D(-)-threo-1-para-nitrophenyl-2-dichloracetylamino-propandiol-1,3. Tegn dens struktur i form af Fischer-projektionsformlen.
7. Synestrol er et syntetisk østrogenlægemiddel med en ikke-steroid struktur. Giv dens navn, der angiver dens stereokemiske konfiguration:

II.8. Stereokemi af cykliske forbindelser
Når en kæde af carbonatomer lukkes ind i en plan cyklus, tvinges carbonatomernes bindingsvinkler til at afvige fra deres normale tetraedriske værdi, og størrelsen af denne afvigelse afhænger af antallet af atomer i cyklussen. Jo større afvigelsesvinklen af valensbindingerne er, jo større er molekylets energireserve, jo mindre stabil er cyklussen. Imidlertid har kun et treleddet cyklisk carbonhydrid (cyclopropan) en flad struktur; Med udgangspunkt i cyclobutan har cycloalkanmolekyler en ikke-plan struktur, hvilket reducerer "spændingen" i systemet.
Cyclohexanmolekylet kan eksistere i flere konformationer, hvor de "normale" bindingsvinkler bibeholdes (for nemheds skyld er kun carbonatomer vist):
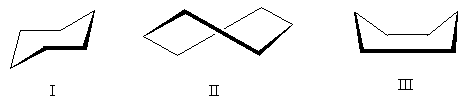
Den mest energimæssigt gunstige konformation er konformation I - den såkaldte form "lænestole". Konformation II - "vride" - indtager en mellemposition: den er mindre gunstig end stolkonformationen (på grund af tilstedeværelsen af skjulte brintatomer i den), men mere gunstig end konformation III. Konformation III - "bad" - den mindst gunstige af de tre på grund af den betydelige frastødning af opadrettede brintatomer.
Overvejelse af de tolv CH-bindinger i stolens konformation giver os mulighed for at opdele dem i to grupper: seks aksial forbindelser rettet skiftevis op og ned, og seks ækvatorial forbindelser rettet til siderne. I monosubstituerede cyclohexaner kan substituenten være i enten en ækvatorial eller aksial position. Disse to konformationer er normalt i ligevægt og går hurtigt over i hinanden gennem twist-konformationen:

Ækvatorkonformationen (e) er normalt dårligere i energi og derfor mere fordelagtig end den aksiale konformation (a).
Når substituenter (sidekæder) optræder i ringe, står forskeren ud over problemet med selve ringens konformation også over for problemer substituentkonfigurationer : således, i tilfælde af tilstedeværelse af to identiske eller forskellige substituenter, cis-trans-isomer. Bemærk at taler om cis-trans-konfiguration af substituenter giver kun mening, når den anvendes på mættede små og mellemstore ringe (op til C 8): i ringe med et stort antal mobiliteten af links er allerede ved at blive så betydelig, at diskussioner vedr cis- eller trance- deputeredes stillinger mister deres betydning.
Så, klassisk eksempel er stereoisomere cyclopropan-1,2-dicarboxylsyrer. Der er to stereoisomere syrer: en af dem med et smp. 139 o C, er i stand til at danne cyklisk anhydrid og er derfor, cis-isomer. En anden stereoisomer syre, smp. 175 o C, danner ikke cyklisk anhydrid; Det her trance-isomer [NOTE 10]:
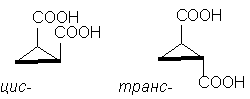
To stereoisomere 1,2,2-trimethylcyclopentan-1,3-dicarboxylsyrer er i samme forhold med hinanden. En af dem, kamfersyre, smp. 187 o C, danner et anhydrid og er derfor cis-isomer. Den anden er isocamphorsyre, smp. 171 o C, - danner ikke anhydrid, dette trance-isomer:

cis-trans-
Selvom cyclopentanmolekylet faktisk ikke er plant, er det for klarhedens skyld praktisk at afbilde det i en flad form, som i figuren ovenfor, idet man husker på, at i cis- isomer har to substituenter på den ene side af cyklussen , og i trance-isomer - på modsatte sider af cyklussen .
Disubstituerede cyclohexanderivater kan også eksistere i cis- eller trans-form:
Kulstofatomet har ikke monopol på dannelsen af chirale centre i organiske forbindelsers molekyler. Centret for chiralitet kan også være silicium, tin og tetrakovalente nitrogenatomer i kvaternære ammoniumsalte og tertiære aminoxider:

I disse forbindelser har asymmetricentret en tetraedrisk konfiguration, ligesom det asymmetriske carbonatom. Der er dog også forbindelser med en anden rumlig struktur af det chirale center.
Chirale centre dannet af atomer af trivalent nitrogen, fosfor, arsen, antimon og svovl har en pyramideformet konfiguration. I princippet kan asymmetricentret betragtes som tetraedrisk, hvis det enlige elektronpar i heteroatomet tages som den fjerde substituent:

Optisk aktivitet kan også forekomme uden chiralt center, på grund af chiraliteten af strukturen af hele molekylet som helhed ( molekylær chiralitet eller molekylær asymmetri ). Mest typiske eksempler er tilgængelighed chiral akse eller chiralt plan .
Den chirale akse optræder for eksempel i allener, der indeholder forskellige substituenter ved sp 2-hybride carbonatomer. Det er let at se, at forbindelserne nedenfor er spejlbilleder og derfor optiske antipoder:

Chiralitetsaksen er vist i figurerne med en pil.
En anden klasse af forbindelser med en chiral akse er optisk aktive biphenyler, som har ortho-positioner har voluminøse substituenter, der gør det vanskeligt at rotere frit rundt S-S forbindelser forbinder arene-ringene:

Chiralt fly kendetegnet ved, at der kan skelnes mellem "top" og "bund", samt "højre" og "venstre" side. Et eksempel på forbindelser med et chiralt plan er den optisk aktive trance- cycloocten og et optisk aktivt ferrocenderivat.
Isomerer er forbindelser, der har samme kvalitative og kvantitative sammensætning (molekylformel), men adskiller sig fra hinanden i rækkefølgen af bindinger af atomer eller deres arrangement i rummet. Da strukturen af disse forbindelser er forskellig, er isomerernes kemiske eller fysiske egenskaber er forskellige.
Typer af isomeri: strukturel (strukturelle isomerer) og stereoisomerisme (rumlig).
Strukturel isomerisme kan være tre typer:
– isomerisme af kulstofskelettet (isomerer i henhold til strukturen af kulstofkæden), for eksempel butan (en forbindelse med uforgrenet eller normal struktur) og 2-methylpropan (en forbindelse med en forgrenet struktur);
– isomerer af positionen af funktionelle grupper (eller multiple bindinger), for eksempel 1-butanol (hydroxylgruppen er forbundet med det 1. carbonatom i kæden) og 2-butanol (hydroxylgruppen er bundet til det 2. carbonatom i kæden );
– funktionelle gruppeisomerer (eller interklasse-isomerisme), for eksempel 1-butanol (alkohol) og diethylether (ether).
Stereoisomerisme er opdelt i konformationel og konfigurationel.
Konformationerne af et molekyle repræsenterer dets forskellige geometriske former, der opstår som følge af rotation omkring simple -bindinger.
Konfiguration er arrangementet af atomer i rummet uden at tage højde for forskelle, der opstår på grund af rotation omkring simple -bindinger.
Konformationer af organiske molekyler. Rotation omkring -bindingen C – C udføres relativt let, kulbrintekæden kan antage forskellige former. Konformationelle former omdannes let til hinanden og er derfor ikke forskellige forbindelser - de er forskellige ustabile dynamiske former af det samme molekyle. Energiforskellen mellem konformere er af samme størrelsesorden som energien fra termisk bevægelse (adskillige kJ/mol). Derfor kan individuelle konformere ikke isoleres ved almindelige temperaturer.
Der skelnes mellem formørket og hæmmet konformation (fig. 2).
Ris. 2. Konformationer af pentan: a – formørket; b – hæmmet
I fig. Figur 2 viser konformationerne af pentan baseret på bindingen mellem det andet og tredje carbonatom i kæden. Det kan ses, at brint- eller kulstofatomerne i den formørkede konformation ser ud til at skjule hinanden. Den hæmmede konformation opstår som et resultat af en rotation af et af atomerne med 60 og afstanden mellem ubundne atomer øges lidt, frastødende kræfter af atomernes elektronorbitaler falder, og denne konfiguration er energimæssigt mere gunstig. Molekylerne af mange organiske forbindelser er blandinger af konformere; som et resultat af termisk bevægelse gennemgår molekylerne kontinuerlige konformationelle transformationer.
Newmans projektionsformler. For at afbilde konformationer bruges Newmans projektionsformler, som opnås ved at projicere molekylet C på planet – C – forbindelser. Som et eksempel i fig. Figur 3 viser konformationerne af pentan i forhold til C2-C3-bindingen.
Kulstofatomet tættest på observatøren (C 2) er betegnet med en prik i midten af cirklen; cirklen symboliserer det fjernede carbonatom (C 3). Tre bindinger fra et atom er afbildet som linjer, der divergerer fra midten af cirklen - for et nærliggende atom (C 2) eller "stikker ud" bagved cirklen - for et fjernt atom (C 3). Hvis atomer og grupper forbundet med de pågældende kulstofatomer, som om de skjuler hinanden, kaldes konformationen formørket (fig. 3. a), når et af atomerne roterer i forhold til det andet med 60°, opnår vi en energimæssigt mere gunstig inhiberet konformation (fig. 3. b).

Ris. 3. Newmans projektionsformel for a: formørket konformation af pentan og b: hæmmet konformation af pentan.
Konformationer af cykliske forbindelser. Cyklisk ikke aromatiske forbindelser, som regel ikke er flade. For at reducere de vinkel- og torsionsspændinger, der kan opstå på grund af forskellen i værdierne af bindingsvinkler og polygonvinkler, kan et eller flere ringatomer placeres i et andet plan i forhold til de resterende atomer. Således kan femleddede cykler have form som en konvolut i rummet (fig. 4), og seksleddede kan have form som et badekar eller en stol (fig. 5).
Ris. 4. Konformation af cyclopentan
I kappekonformationen bevæger et af kulstofatomerne sig ud af det plan, hvor de andre fire atomer er placeret. Ethvert af de fem atomer kan komme ud af planet, og cyklussen ser derfor ud til at være i konstant bølgelignende bevægelse.

Ris. 5. Konformationer af cyclohexan: a – stol og b – bad.
I stole- og badkonformationen er 2 kulstofatomer placeret uden for det plan, hvori yderligere 4 atomer er placeret.
I stolkonformationen af cyclohexan er der ingen okkluderede positioner af hydrogen og carbonatomer: arrangementet af hydrogenatomer på alle carbonatomer er det samme som i den hæmmede konformation af ethan.
Seks C-bindinger – H, parallelt med symmetriakserne af den stolformede form af cyclohexan, rettet skiftevis op og ned, kaldes aksial (symbol EN).De resterende seks C – H-bindingerne er placeret i en vinkel på 109,5° i forhold til denne akse og er også skiftevis rettet op og ned. Disse forbindelser kaldes ækvatoriale (symbol e). Således har hvert carbonatom en binding med et hydrogenatom placeret aksialt og en binding ækvatorialt. Stolens konformation er energimæssigt mere gunstig.
Konfigurationsisomerer. Optisk isomeri. Konfigurationelle er stereoisomerer med forskellige arrangementer omkring visse atomer af andre atomer, radikaler eller funktionelle grupper i rummet i forhold til hinanden. Disse omfatter primært enantiomerer - optisk aktive stoffer, der er spejlbilleder af hinanden.
Hvilke stoffer kaldes optisk aktive? Disse er forbindelser, der er i stand til at ændre hældningsvinklen af polariseringsplanet for plan-polariseret lys. Husk på, at almindeligt lys (fra solen eller en lampe) er en elektromagnetisk bølge, hvor partikler vibrerer i alle retninger i indbyrdes vinkelrette planer og vinkelret på bølgens udbredelsesretning. I planpolariseret lys ligger partikelvibrationer i samme plan. Hvis en stråle passerer gennem et gennemsigtigt stof, der er i stand til at rotere planet af elektriske feltoscillationer med en bestemt vinkel og give dem en ny retning, så siges et sådant stof at have optisk aktivitet.
To tegn på optisk aktivitet af organiske forbindelser kan formuleres: tilstedeværelsen af et asymmetrisk carbonatom og fraværet af symmetrielementer i molekylet.
Et asymmetrisk carbonatom er et atom bundet til fire forskellige atomer eller grupper, normalt angivet med en stjerne: *C.
Lad os betragte molekylet af alanin (2-aminopropansyre), en aminosyre, der er en del af proteinet (fig. 6). Molekylet har et asymmetrisk carbonatom (det andet, forbundet med fire forskellige substituenter: en aminogruppe, en carboxylgruppe, et hydrogenatom og en methylgruppe -CH3). Carboxylgruppens carbonatom er ikke asymmetrisk, fordi han har ikke 4, men kun 3 substituenter. Det tredje carbonatom (methylcarbonet) er heller ikke asymmetrisk. Den har 4 substituenter, men 3 af dem er ens (brintatomer). Molekylet af denne forbindelse er asymmetrisk; derfor er alanin en optisk aktiv forbindelse og kan eksistere i form af to enantiomerer. Enantiomerer er navngivet af D,L nomenklatur, som beskriver den relative konfiguration af isomererne (i forhold til konfigurationen af glyceraldehyd).
For at afbilde og navngive en enantiomer er det praktisk at placere molekylets carbonkæde lodret, hvorefter substituenterne på det asymmetriske carbonatom vises til højre og venstre for det. Hvis seniorsubstituenten (i vores tilfælde aminogruppen) er placeret til venstre, er den en L-isomer, hvis den er til højre, er den en D-isomer (fig. 6).

Ris. 6. Enantiomerer af alanin.
Enantiomerer, i modsætning til isomerer, har de samme fysiske og kemiske egenskaber; de adskiller sig kun ved, at de roterer polariseringsplanet for planpolariseret lys med samme vinkel, men i modsatte retninger (den ene til venstre, den anden til højre) . En blanding bestående af lige store mængder af enantiomerer kaldes en racemisk blanding eller racemat. Racematet er ikke optisk aktivt.
På trods af denne tilsyneladende mindre forskel i egenskaber er den biologiske aktivitet af enantiomererne meget forskellig. For eksempel indeholder proteiner kun L-enantiomerer af aminosyrer, dette forklarer ejendommelighederne ved den rumlige struktur af proteiner og bestemmer selektiviteten af den katalytiske virkning af enzymer. D-isomerer af aminosyrer, når de kommer ind i kroppen, kan forårsage forskellige negative processer, derfor skal den rumlige konfiguration af aminosyrer tages i betragtning ved fremstillingen af medicin og forskellige fødevaretilsætningsstoffer.
En isomer af denne forbindelse, -alanin (3-aminopropansyre), er også til stede i vores krop. Denne forbindelse er ikke en del af proteiner og er ikke optisk aktiv, pga der er ingen asymmetriske atomer i den. Det første carbonatom i carboxylgruppen har kun 3 substituenter, det andet og tredje har 2 identiske substituenter (hydrogenatomer).
Lad os fortsætte vores overvejelse af fænomenet optisk isomerisme. Stoffer karakteriseret ved dette fænomen kaldes ofte stereoisomerer. Stereoisomerer er identiske i fysiske og fysisk-kemiske egenskaber, men adskiller sig i to henseender:
1. Krystalliser i former, der ikke har plan (plan) symmetri, men relaterer til hinanden som et objekt til dets spejlbillede, for eksempel to typer vinsyrekrystaller, der fremhæver stereoisomere vinsyrer.

2. Stereoisomerer, som nævnt ovenfor, polariserer lys forskelligt. P  Årsagen til optisk stereoisomerisme skyldes netop arrangementet af substituentgrupper på carbonatomet i sp 3 -hybridiseringstilstanden, det vil sige med det mættede carbon ved tetraederens hjørner (arrangementet af atomer i rummet, hvilket fører til tilstedeværelse af stereoisomerisme, kaldes konfiguration).
Årsagen til optisk stereoisomerisme skyldes netop arrangementet af substituentgrupper på carbonatomet i sp 3 -hybridiseringstilstanden, det vil sige med det mættede carbon ved tetraederens hjørner (arrangementet af atomer i rummet, hvilket fører til tilstedeværelse af stereoisomerisme, kaldes konfiguration).
Og ![]() er betegnet som følger:
er betegnet som følger:
For eksempel,

L-alkohol,= –5,9
For disse stoffer er venstre- og højrehåndskonfigurationer mulige.
Et racemat er en blanding af lige store mængder L- og D-isomerer, optisk inaktive.

Hvilke konfigurationer roterer lysets polariseringsplan til højre og venstre - særligt spørgsmål. Det er ikke taget i betragtning her.
Peg på kulstof - bindinger placeret over tegneplanet, peg på substituent - under dette plan.
Klassiske eksempler på en stereoisomer er:


H  Antallet af asymmetriske atomer kan være flere, i det generelle tilfælde.
Antallet af asymmetriske atomer kan være flere, i det generelle tilfælde.
* – asymmetrisk atom. Antallet af stereoisomerer er lig med 2 n, hvor, som den opmærksomme læser allerede har forstået, n er antallet af asymmetriske optisk aktive atomer.
Geometriske (cis- og trans-) isomerer. Disse omfatter konfigurationsisomerer, der indeholder en -binding. Denne type diastereomerisme er især karakteristisk for alkener. I forhold til -bindingens plan kan identiske substituenter på to carbonatomer være placeret én ad gangen (cis-) eller anderledes (trans-) sider (fig. 7). Hovedårsagen til eksistensen af cis- og trans-isomerer er umuligheden af at rotere omkring -bindingen uden at bryde den.

Ris. 7. Geometriske isomerer af 2-butan.
Cis- og trans-isomerer har den samme atomare bindingssekvens, men adskiller sig fra hinanden i det rumlige arrangement af substituenter og er derfor stereoisomerer. På den anden side indeholder deres molekyler ikke asymmetriske carbonatomer og er ikke optisk aktive.
Cis- og trans-isomerer har forskellige fysiske egenskaber og kan undergå reaktioner (for eksempel addition, med forskellige hastigheder).
Geometriske isomerer findes ofte blandt naturlige forbindelser; især retinolisomeren (vitamin A), hvor alle 4 dobbeltbindinger er i trans-konfigurationen, er især vigtig for at sikre synsstyrken. Kulbrinteradikaler af umættede syrer, der udgør flydende fedtstoffer, er i cis-konfiguration i forhold til dobbeltbindinger.
