Genel bilgi Karbonik asit́ zayıf dibazik asit. İÇİNDE saf biçim vurgulanmadı. Çözünme üzerine küçük miktarlarda oluşur karbondioksit Havadaki karbondioksit de dahil olmak üzere suda. Bir dizi kararlı inorganik ve organik türev oluşturur: tuzlar (karbonatlar ve bikarbonatlar), esterler, amidler vb.



Ayrışma Çözeltinin sıcaklığı arttığında ve/veya karbondioksitin kısmi basıncı azaldığında, sistemdeki denge sola kayar, bu da karbonik asidin bir kısmının su ve karbondioksite ayrışmasına yol açar. Çözelti kaynadığında karbonik asit tamamen ayrışır:

Hazırlanışı Karbonik asit, karbondioksitin suda çözünmesiyle oluşur. Çözeltideki karbonik asit içeriği, çözelti sıcaklığının azalması ve karbondioksit basıncının artmasıyla artar. Karbonik asit aynı zamanda tuzlarının (karbonatlar ve bikarbonatlar) daha güçlü bir asitle etkileşimi sonucu da oluşur. Bu durumda, oluşan karbonik asidin çoğu kural olarak su ve karbondioksite ayrışır.

Uygulama Karbonik asit her zaman karbondioksitin (karbonatlı su) sulu çözeltilerinde bulunur. Biyokimya, sabit bir sıcaklıkta oksonyum iyonlarının (asitlik) içeriğindeki değişiklikle orantılı olarak gaz basıncını değiştirmek için bir denge sisteminin özelliğini kullanır. Bu, ilerlemeyi gerçek zamanlı olarak kaydetmenizi sağlar enzimatik reaksiyonlarÇözeltinin pH değerindeki değişikliklerle ortaya çıkan

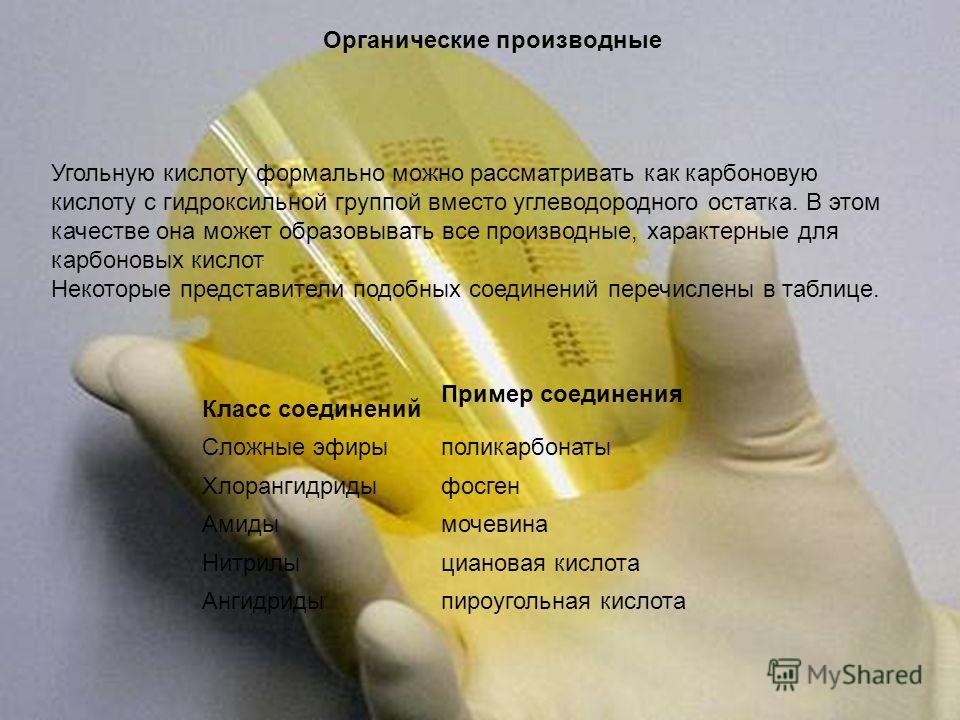
Organik türevler Karbonik asit resmi olarak bir hidrokarbon kalıntısı yerine hidroksil grubuna sahip bir karboksilik asit olarak düşünülebilir. Bu sıfatla karakteristik tüm türevleri oluşturabilir. karboksilik asitler. Bu tür bileşiklerin bazı temsilcileri tabloda listelenmiştir. Bileşiklerin sınıfı Bileşik örneği Esterler polikarbonatlar Asit klorürler Fosgen amidler Üre Nitrilisiyanoik asit Anhidritler pirokarbonik asit
Dünya atmosferindeki karbondioksit, 2011 yılı itibarıyla 392 ppm veya %0,0392 miktarında sunulmaktadır. Karbon dioksitin (CO2, karbon dioksit veya karbondioksit) biyosferin yaşamındaki rolü öncelikle karbondioksit oluşumunu desteklemektir. bitkiler tarafından gerçekleştirilen fotosentez. Bir sera gazı olarak havadaki karbondioksit, gezegenin çevredeki alanla ısı alışverişini etkiler, çeşitli frekanslarda yeniden yayılan ısıyı etkili bir şekilde engeller ve böylece gezegenin ikliminin şekillenmesine katkıda bulunur.
Dolayı aktif kullanımİnsanlığın fosil yakıtları yakıt olarak kullanması, bu gazın atmosferdeki konsantrasyonunun hızla artmasına neden oluyor. İlk kez antropojenik etki Karbondioksit konsantrasyonları üzerindeki etkisi 19. yüzyılın ortalarından beri not edilmiştir. O zamandan bu yana büyüme hızı artmış ve 2000'li yılların sonunda 2,20 ± 0,01 ppm/yıl yani yılda %1,7 oranında gerçekleşmiştir. Buna göre bireysel çalışmalar, modern seviye Atmosferdeki CO2 son 800 bin yılda ve muhtemelen son 20 milyon yılda en yüksek seviyeye ulaştı.
Sera etkisindeki rol
Karbondioksiti bir sera gazı olarak diğer gazlardan ayıran şey, iklim üzerindeki uzun vadeli etkisidir ve bu etki, ona neden olan emisyonun sona ermesinden sonra bin yıla kadar büyük ölçüde sabit kalır. Diğer sera gazları Metan ve nitrik oksit gibi oksitler atmosferde daha kısa süreliğine serbest halde bulunur.
Havadaki nispeten düşük konsantrasyonuna rağmen CO2 önemli bir bileşen Dünya atmosferi emip yeniden yayarken kızılötesi radyasyon 4,26 μm (titreşim modu - molekülün asimetrik gerilmesi) ve 14,99 μm (bükülme titreşimleri) dalga boyu dahil olmak üzere çeşitli dalga boylarında. Bu işlem, Dünya'dan uzaya bu dalga boylarındaki radyasyonu ortadan kaldırır veya azaltır, bu da sera etkisine neden olur.
Atmosferdeki CO2 konsantrasyonundaki mevcut değişiklik, soğurma bantlarına yansır ve burada modern etki Dünyanın yeniden emisyon spektrumu yalnızca kısmi emilime yol açar.
Karbondioksitin sera etkisi yaratmasının yanı sıra daha fazla olması da önemlidir. ağır gaz hava ile karşılaştırıldığında. Havanın ortalama bağıl molar kütlesi 28,98 g/mol ve CO2'nin molar kütlesi 44,01 g/mol olduğundan, karbondioksit oranındaki bir artış, hava yoğunluğunun artmasına ve buna bağlı olarak yoğunluğunda bir değişikliğe yol açar. Yüksekliğe bağlı basınç profili. yürürlükte fiziksel doğa sera etkisi Atmosferin özelliklerinde böyle bir değişiklik, yüzeydeki ortalama sıcaklığın artmasına neden olur.
Dünya atmosferindeki sera etkisinin ana kaynağı gazlı su veya havadaki nem eksikliğidir. sera gazları atmosferde ve güneş sabitinin değerinin 1368 W m2'ye eşit olması, ortalama sıcaklık yüzeyde -15°C olmalıdır. Aslında Dünya yüzeyinin ortalama sıcaklığı +15°C'dir, yani sera etkisi 30°C'lik bir artışa neden olur, bunun 20,6°C'si havadaki su buharının varlığıyla açıklanır, Sıcaklıktaki 7,2°C'lik artıştan içindeki karbondioksitin sorumlu olduğu düşünülüyor. Çünkü bu gazın atmosferdeki oranının artmasıyla, daha büyük molar kütlesi yoğunluk ve basınçta bir artışa yol açıyor. Aynı sıcaklıkta CO2 konsantrasyonunun artması, havanın nem kapasitesinin artmasına ve atmosferde daha fazla su bulunması nedeniyle sera etkisinin artmasına neden olur. Aynı bağıl nem seviyesine ulaşmak için havadaki su oranının arttırılması - düşük nem nedeniyle molar kütle su (18 g mol) - havanın yoğunluğunu azaltır, bu da mevcudiyetten kaynaklanan yoğunluk artışını telafi eder daha yüksek seviye atmosferdeki karbondioksit.
Kombinasyon listelenen faktörler Genel olarak, konsantrasyonun sanayi öncesi seviye olan 280 ppm'den modern seviye olan 392 ppm'e yükselmesi, başına ilave 1,8 W'a eşdeğerdir. metrekare gezegenin yüzeyi.
Karbondioksit kaynakları
Atmosferdeki doğal karbondioksit kaynakları arasında volkanik patlamalar, yanmalar yer alır. organik madde hayvan dünyasının temsilcilerinin (aerobik organizmalar) havada ve nefes almasında. Karbondioksit ayrıca fermantasyon süreci, hücresel solunum ve havadaki organik kalıntıların çürümesi sonucu bazı mikroorganizmalar tarafından da üretilir. İLE antropojenik kaynaklar Atmosfere CO2 emisyonları şunları içerir: ısı üretmek, elektrik üretmek ve insanları ve eşyaları taşımak için fosil ve fosil olmayan enerji kaynaklarının yakılması. Çimento üretimi ve gaz yakma gibi bazı endüstriyel faaliyetler önemli miktarda CO2 emisyonuna neden olur.
Bitkiler, enerji kullanan pigment klorofil aracılığıyla gerçekleştirilen fotosentez yoluyla ortaya çıkan karbondioksiti karbonhidratlara dönüştürür. güneş radyasyonu. Ortaya çıkan gaz, oksijen, Dünya atmosferine salınır ve heterotrofik organizmalar ve diğer bitkiler tarafından solunum için kullanılır, böylece karbon döngüsü oluşur.
Doğal kaynaklar
CO2 emisyonlarının çoğu kaynağı doğaldır. Ölü ağaçlar ve otlar gibi çürüyen organik maddeler her yıl 220 milyar ton karbondioksit açığa çıkarıyor. dünyadaki okyanuslar 1997'deki Endonezya orman ve turba yangınları, fosil yakıtların yakılmasından kaynaklanan yıllık ortalama CO2 emisyonlarının %13-40'ını saldı. volkanik aktivite Modern yanardağlar her yıl ortalama 130-230 milyon ton CO2 yayar, bu da antropojenik emisyonların %1'inden azdır.
Normal koşullar altında bu doğal kaynaklar, karbondioksiti atmosferden uzaklaştıran fiziksel ve biyolojik süreçlerle dengededir; CO2'nin bir kısmı atmosferde çözünür. deniz suyu ve bir kısmı fotosentez işlemi yoluyla havadan uzaklaştırılır. Çünkü genellikle bu süreç 5,5 10×11 derece karbondioksit emilir ve toplam kütle V dünyanın atmosferi 3,03 1012 ton ise, ortalama olarak tüm atmosferik CO2 her altı yılda bir karbon döngüsüne katılmaktadır. İnsan kaynaklı emisyonların varlığı nedeniyle, CO2'nin biyosfer tarafından emilmesi, 2000'li yılların ortalarında emisyonunu 17 milyar ton aşmıştır. emilim hızı istikrarlı eğilim Artan atmosferik konsantrasyonla birlikte artar.
Antropojenik emisyonlar
Gelecek olanla sanayi devrimi 19. yüzyılın ortalarında atmosfere antropojenik karbondioksit emisyonlarında giderek artan bir artış oldu ve bu da karbon döngüsünde dengesizliğe ve CO2 konsantrasyonunda artışa yol açtı. Şu anda insanlığın ürettiği karbondioksitin yaklaşık %57'si bitkiler ve okyanuslar tarafından atmosferden uzaklaştırılıyor. Atmosferdeki CO2 miktarındaki artışın salınan toplam CO2'ye oranı ise şöyle: sabit değer yaklaşık %45 civarındadır ve kısa süreli dalgalanmalara ve beş yıllık bir süre boyunca dalgalanmalara uğramaktadır.
Kömür, petrol gibi fosil yakıtların yakılması ve doğal gaz insan kaynaklı CO2 emisyonlarının ana nedenidir ve ormansızlaşma ikinci önemli nedendir. Fosil yakıtların yakılması, 1990 yılındaki yıllık 6,14 milyar ton karbon emisyonuna kıyasla, 2008 yılında atmosfere 8,67 milyar ton karbon (31,8 milyar ton CO2) saldı. Arazi kullanımı nedeniyle ormanların yok edilmesi, 2008'de 1,2 milyar ton kömürün yakılmasına eşdeğer atmosferik karbondioksit artışına yol açmıştır (1990'da 1,64 milyar ton). 18 yıllık kümülatif artış, yıllık doğal CO2 döngüsünün %3'üdür; Dengesiz sistemleri ortadan kaldırmak ve CO2 düzeylerinde hızlı bir artış sağlamak için. Sonuç olarak, karbondioksit atmosferde yavaş yavaş birikti ve 2009'da konsantrasyonu sanayi öncesi değerden %39 daha yüksekti.
Dolayısıyla, (2011 yılı itibarıyla) toplam antropojenik CO2 emisyonu doğal yıllık döngüsünün %8'ini aşmamasına rağmen, yalnızca antropojenik emisyonların seviyesinden değil aynı zamanda aynı zamanda konsantrasyonda da bir artış söz konusudur. sürekli büyüme Zaman içindeki emisyon seviyeleri.
Sıcaklık Değişimi ve Karbon Döngüsü
Atmosferdeki CO2 içeriğini artıran diğer faktörler arasında, 20. yüzyılda ortalama sıcaklıktaki bir artış yer alıyor; bu, organik kalıntıların çürümesinin hızlanmasına ve okyanusların ısınmasına bağlı olarak toplam CO2 miktarının azalmasına yansımış olmalı. Suda çözünmüş karbondioksit. Sıcaklıktaki artış aynı zamanda olağanüstü yüksek güneş aktivitesi bu dönemde ve 19. yüzyılda (örneğin bkz. Carrington Olayı, 1859).
Son milyon yılda soğuk iklimlerden sıcak iklimlere geçiş sırasında atmosferik CO2 konsantrasyonlarındaki doğal değişim 100 ppm'de kaldı; bu, toplam artışın %40'tan az olduğu anlamına geliyor. Üstelik, örneğin MÖ 9000-5000 yıllarında iklimsel optimum döneminde gezegenin ortalama sıcaklığı. bugüne göre yaklaşık 1 - 2 °C daha yüksekti ve sıcak iklimlerde sera etkisinin daha belirgin olması nedeniyle yarı arktik enlemlerde yıllık ortalama sıcaklık anomalisi 9 °C'ye ulaştı.
Karbon monoksit (IV), karbonik asit ve tuzları
D karbon monoksit CO 2 (karbon dioksit) - normal koşullar renksiz ve kokusuz, hafif ekşimsi tada sahip, havadan yaklaşık 1,5 kat daha ağır, suda çözünen, oldukça kolay sıvılaştırılan (°C'de) bir gazdır. oda sıcaklığı yaklaşık 60 ∙ 10 5 Pa basınç altında sıvıya dönüştürülebilir). Sıvı karbondioksit −56,2ºС'ye soğutulduğunda katılaşır ve kar benzeri bir kütleye dönüşür.
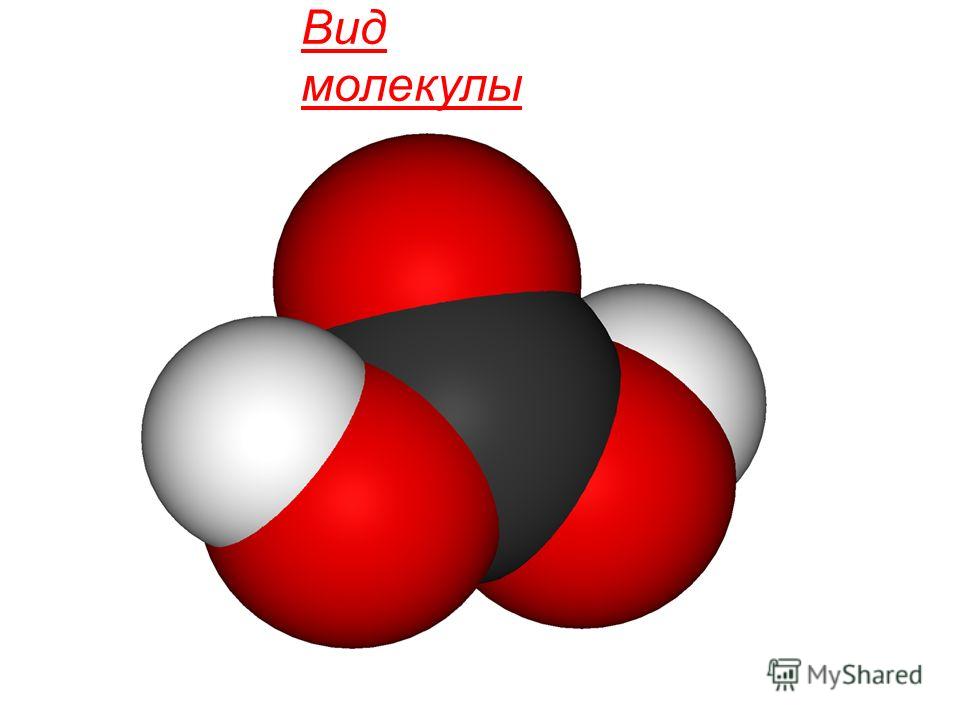
sonuçta toplanma durumları polar olmayan doğrusal moleküllerden oluşur. Kimyasal yapı CO 2 molekülü, merkezi karbon atomunun sp-hibridizasyonu ve ilave π oluşumu ile belirlenir. r-r-bağlantıları: Ö = C = Ö.
İçinde çözünen CO2'nin bir kısmı karbonik asit oluşturmak üzere onunla etkileşime girecektir:
C02 + H20 ↔ C02 ∙ H20 ↔ H2C03.
Karbondioksit, karbonatlar ve bikarbonatlar oluşturmak için alkali çözeltiler tarafından çok kolay emilir:
C02 + 2NaOH = Na2C03 + H20; C02 + NaOH = NaHC03.
CO2 molekülleri termal olarak oldukça stabildir; ayrışma yalnızca 2000°C sıcaklıkta başlar. Bu nedenle karbondioksit yanmaz ve konvansiyonel yakıtların yanmasını desteklemez. Ama atmosferinde bazıları yanıyor basit maddeler atomları oksijen için yüksek bir afinite sergileyen, örneğin magnezyum, ısıtıldığında bir CO2 atmosferinde tutuşur.
Karbonik asit H2C03 zayıf bir bileşiktir ve yalnızca sulu çözeltilerde bulunur. En Suda çözünmüş karbondioksit, hidratlı CO2 molekülleri formundadır, küçük olanı karbonik asit oluşturur.
Atmosferdeki CO2 ile dengede olan sulu çözeltiler asidiktir: = 0,04 M ve pH ≈ 4.
Karbonik asit dibaziktir ve zayıf elektrolitler, adım adım ayrışır (K 1 = 4, 4 ∙ 10 −7; K 2 = 4, 8 ∙ 10 −11). CO2 suda çözündüğünde aşağıdaki dinamik denge oluşur:
H 2 O + CO 2 ↔ CO 2 ∙ H 2 Ö ↔ H 2 CO 3 ↔ H + + HCO 3 −
Isıtıldığında sulu çözelti karbondioksit, gazın çözünürlüğü azalır, çözeltiden CO2 salınır ve denge sola kayar.
Dibazik olan karbonik asit iki dizi tuz oluşturur: orta tuzlar (karbonatlar) ve asidik tuzlar (bikarbonatlar). Karbonik asit tuzlarının çoğu renksizdir. Karbonatlardan sadece tuzları suda çözünür. alkali metaller ve amonyum.
Suda karbonatlar hidrolize uğrar ve bu nedenle çözeltileri alkali reaksiyon:
Na2C03 + H20 ↔ NaHC03 + NaOH.
Karbonik asit oluşumu ile daha fazla hidroliz pratik olarak normal koşullar altında gerçekleşmez.
Hidrokarbonatların suda çözünmesine de hidroliz eşlik eder, ancak çok daha az oranda ve ortam hafif alkalin (pH ≈ 8) yaratılır.
Amonyum karbonat (NH4)2CO3 yüksek sıcaklıklarda ve hatta normal sıcaklıklarda, özellikle su buharının varlığında oldukça uçucudur ve bu da ciddi hidrolize neden olur.
Güçlü asitler ve hatta zayıf asetik asit, karbonik asidi karbonatlardan uzaklaştırır:
K 2 C03 + H 2 SO 4 = K 2 SO 4 + H 2 O + C02.
Çoğu karbonatın aksine, tüm bikarbonatlar suda çözünür. Οʜᴎ aynı metallerin karbonatlarından daha az kararlıdır ve ısıtıldığında kolayca ayrışarak karşılık gelen karbonatlara dönüşür:
2KHCO3 = K2C03 + H20 + C02;
Ca(HCO3)2 = CaC03 + H20 + C02.
Güçlü asitler hidrokarbonatlar karbonatlar gibi ayrışır:
KHCO 3 + H 2 SO 4 = KHSO 4 + H 2 O + C02
Karbonik asit tuzlarından en yüksek değer sodyum karbonat (soda), potasyum karbonat (potas), kalsiyum karbonat (tebeşir, mermer, kireçtaşı), sodyum bikarbonat (kabartma tozu) ve bazik bakır karbonat (CuOH)2C03 (malakit) içerir.
Karbonik asidin bazik tuzları suda pratik olarak çözünmez ve ısıtıldığında kolayca ayrışır:
(CuOH)2C03 = 2CuO + C02 + H20.
Karbonatların termal kararlılığı, karbonatı oluşturan iyonların polarizasyon özelliklerine bağlıdır. Katyonun karbonat iyonu üzerindeki polarizasyonu ne kadar fazla olursa, tuzun ayrışma sıcaklığı o kadar düşük olur. Katyon kolayca deforme olabiliyorsa, karbonat iyonunun kendisi de katyon üzerinde polarizasyon etkisine sahip olacak ve bu da tuzun ayrışma sıcaklığında keskin bir düşüşe yol açacaktır.
Sodyum ve potasyum karbonatlar ayrışmadan erir ve diğer karbonatların çoğu ısıtıldığında metal oksit ve karbondioksite ayrışır:
MgCO3 = MgO + CO2.
Karbon monoksit
CO molekülü aşağıdaki yapıya sahiptir
: İLE ≡ HAKKINDA :
Karbon ve oksijen atomlarının 2p elektronlarının eşleşmesi nedeniyle iki bağ oluşur, üçüncü bağ, karbonun serbest 2p yörüngesi ve oksijen atomunun 2p elektron çifti nedeniyle donör-alıcı mekanizması tarafından oluşturulur. Molekülün dipol momenti önemsizdir, karbon atomundaki etkin yük negatif, oksijen atomundaki ise pozitiftir.
CO molekülünün yapısı nitrojen molekülünün yapısına benzer olduğundan benzerdirler. fiziksel özellikler. CO'nun çok düşük sıcaklıklar erime (- 204°С) ve kaynama (- 191.5°С), renksizdir, çok zehirli gaz kokusuzdur, havadan biraz daha hafiftir. Suda az çözünür ve onunla etkileşime girmez.
CO, tuz oluşturmayan bir oksit olarak kabul edilir, çünkü normal koşullar altında asitlerle veya alkalilerle etkileşime girmez. Oksijene sınırlı erişimi olan kömür ve karbon bileşiklerinin yanması sırasında ve ayrıca karbondioksitin sıcak kömürle etkileşimi sırasında oluşur: CO 2 + C = 2CO.
Laboratuvarda formik asitten, ısıtıldığında konsantre sülfürik asidin etkimesiyle elde edilir:
HCOOH + H 2 SO 4 (kons.) = CO + H 2 SO 4 ∙ H 2 O.
Oksalik asit de kullanabilirsiniz. Sülfürik asit bu reaksiyonlarda su uzaklaştırıcı ajan olarak görev yapar.
Normal koşullar altında CO kimyasal olarak oldukça inerttir ancak ısıtıldığında onarıcı özellikler belirli metalleri elde etmek için pirometalurjide yaygın olarak kullanılan: Fe203 + 3CO = 2Fe + 3CO2.
CO havada mavimsi bir alevle yanar ve açığa çıkar. büyük miktarısı: 2CO + O2 = 2CO2 + 569 kJ.
Hattaki oksijene ek olarak güneş ışığı veya bir katalizör (aktif karbon) varlığında CO, fosgen oluşturmak üzere klor ile birleşir:
CO + Cl2 = COCl2.
Fosgen, karakteristik bir kokuya sahip, renksiz bir gazdır. Suda az çözünür, ancak karbonik asit klorür olarak aşağıdaki şemaya göre yavaş yavaş hidrolize olur: COCl2 + 2H20 = 2HCl + H2CO3. Yüksek toksisitesi nedeniyle fosgen ilk olarak kimyasal savaş ajanı olarak kullanıldı. dünya savaşı. Sönmüş kireç kullanılarak nötralize edilebilir.
Isıtıldığında CO kükürt tarafından oksitlenir: CO + S = COS.
CO molekülü çeşitli karmaşık bileşiklerde ligand görevi görebilir. Karbonun bağlanmayan elektron çifti nedeniyle σ-verici özellikler sergiler ve serbest π-antibağlanma yörüngeleri nedeniyle π-alıcı özellikler sergiler. Özel İlgi d-metallerin karbonil komplekslerini temsil eder, çünkü termal ayrışma Karboniller yüksek saflıkta metaller üretir.
Karbonik asit (formül H2CO3) zayıf bir dibazik asittir. Çözeltiler ısıtıldığında suya ayrışır. Bu asit var büyük önem sadece hayvanlar için değil bitkiler için de. İnsan vücudunda H2CO3 ve tuzları kanın bir parçasıdır. Desteklenen kullanımı asit-baz dengesi Normal işleyiş için gerekli olan vücutta. Asitlerin ayrışması su ortamı anyon ve katyonların oluşumuna yol açar. İyon konsantrasyonu birçok maddenin akışı için büyük önem taşımaktadır. biyokimyasal süreçler hayvanların ve bitkilerin vücudunda. Bazı hastalıklar için aktif reaksiyon kan asidik hale gelir (ülser ile) duodenum ve mide) veya alkalin (sepsis, zatürre için) tarafı. Asidoz ile hidrojen iyonlarının konsantrasyonu artar. Bu tür değişiklikler, sırasıyla, gelişimi teşvik eder. nihai sonuç hayvanın kendisinin ölümüne yol açar. Alkaloz ile kandaki katyon konsantrasyonu artar, bu da tetanoza ve hayvanın ölümüne yol açar.
CO2'nin H2O ile reaksiyonu sırasında karbonik asit oluşur. Çoğu araştırmacı, ilkel dünyadaki bitki örtüsünün inanılmaz gelişiminin, atmosferdeki önemli miktarda karbonik asit konsantrasyonuyla ilişkili olduğuna inanıyor. En yoğun büyüme, atmosferde yüksek (%5-10) karbonik asit konsantrasyonuyla yetiştirilen bitkilerde gözlendi.
Bitkilerin yarı karbonlu olduğunu belirtmek gerekir. Karbonik asit bitkiyi beslerken toprağın mineral bileşenlerinin çözünürlüğünü de destekler. Bu nedenle, bu durumda Bu gerekli bileşen toprak. Karbonik asit nitrifikasyon yapan mikroorganizmaları engellediğinden toprağın minimum konsantrasyonunu içermesi gerekir.
Bu nedenle yüksek verim elde etmek için bu asidin konsantrasyonunun dengelenmesi gerekir. Bilim adamları yaptıkları deneylerde, toprağa günlük olarak karbonik asit (400 cm3) ve hava (1200 cm3) verildiğinde, bu bileşikleri içermeyen toprağa kıyasla iki kat daha fazla bitki ürettiğini tespit ettiler.
Kırsal toprak bol miktarda hava ile karakterize edilir, bu nedenle nitrifikasyon ve çürüme süreçleri çok yoğun bir şekilde gerçekleşir. Ormandaki yaprakların bir yıl içerisinde tamamen çürüdüğü tespit edilmiştir. Bu tür güçlü nitrifikasyon bozkırlarda da meydana gelir. Ayrışma işlemi sırasında önemli miktarda karbonik asit açığa çıkar. İkincisi havadan bir buçuk kat daha ağırdır, bu nedenle karbonik asit toprağın havadan daha derinlerine nüfuz eder ve orada etki gösterir. faydalı etki Mineral bileşenler hakkında.
Derin sürümle organik kalıntılar, O2'nin bulunmadığı, ancak bol miktarda karbonik asidin bulunduğu toprağın daha derin katmanlarına düşer. Bu durumda nitrifikasyon son derece yavaş gerçekleşir. Bu koşullar altında mineral bileşenler ayrışmaz ve azot bileşikleri oluşmaz. Kocaman gübre parçaları yıllarca çürümeden toprakta yatıyor. Toprak sahipleri sentetik gübre (kainit, süperfosfat, Yenilikçi teknolojiler Toprak işleme bitki verimliliğini artırabilir. Bunun temel nedeni, araziyi yetiştirme sürecinde organik kalıntıların kalmasıdır. Oluşturuluyor optimal koşullar nitrifikasyon mikroorganizmalarının gelişimi ve çoğaltılması için.
Toprakta bulunan fosfor her zaman bitkiler tarafından alınamamaktadır. Tribazik kalsiyum fosfat az çözünen bir bileşiktir. Bu nedenle fosforik asit bileşikleri bakımından zengin olan toprak verimsiz hale gelir.
