Związek pomiędzy rozmieszczeniem pierwiastków w układzie okresowym a właściwościami pierwiastków chemicznych, proste substancje, związki pierwiastków z wodorem i tlenem. Pojęcie promienia atomowego i elektroujemności pierwiastków
Rozważmy związek między pozycją pierwiastków w układzie okresowym a takimi właściwościami pierwiastków chemicznych, jak promień atomowy, elektroujemność, właściwości metaliczne i niemetaliczne.
Promień atomowy to wartość pokazująca rozmiar powłoki elektronowej atomu. Jest to bardzo ważna wielkość, od której zależą właściwości atomów pierwiastków chemicznych. W głównych podgrupach, wraz ze wzrostem ładunku jądra atomowego, liczba poziomy elektroniczne dlatego promień atomowy wzrasta wraz ze wzrostem liczby atomowej w głównych podgrupach. W okresach następuje wzrost ładunku jądra atomowego pierwiastek chemiczny, co prowadzi do zwiększonego przyciągania elektronów zewnętrznych do jądra. Ponadto wraz ze wzrostem ładunku jądra liczba elektronów wzrasta o poziom zewnętrzny jednak liczba poziomów elektronicznych nie wzrasta. Te prawidłowości prowadzą do zacieśnienia powłoki elektronowej wokół jądra. Dlatego promień atomowy maleje wraz ze wzrostem liczby atomowej w okresach.
Na przykład uporządkujmy pierwiastki chemiczne O (tlen), C (węgiel), Li (lit), F (fluor), N (azot) w kolejności malejącego promienia atomowego. Podane pierwiastki chemiczne należą do drugiego okresu. W okresie promienie atomowe maleją wraz ze wzrostem liczby atomowej. Dlatego wskazane pierwiastki chemiczne należy zapisać w rosnącej kolejności ich numerów seryjnych: Li, C, N, O, F (lit, węgiel, azot, tlen, fluor)
Elektroujemność to zdolność atomu w związkach do przyciągania elektronów walencyjnych, tj. te elektrony, za pomocą których tworzą się wiązania chemiczne między atomami. Elektroujemność zależy od zdolności jądra atomowego do przyciągania elektronów z zewnątrz poziom energii. Im silniejsze przyciąganie, tym większa elektroujemność. Im mniejszy promień atomowy, tym większa siła przyciągania między elektronami na zewnętrznym poziomie energii. W konsekwencji zmiana elektroujemności w okresach i głównych podgrupach będzie przeciwna do zmiany promieni atomowych. Dlatego w głównych podgrupach elektroujemność maleje wraz ze wzrostem liczby atomowej. W okresach ze wzrostem liczby atomowej wzrasta elektroujemność.
Na przykład uporządkujmy pierwiastki chemiczne Br (brom), F (fluor), I (jod), Cl (chlor) w kolejności rosnącej elektroujemności. Podane pierwiastki chemiczne znajdują się w główna podgrupa siódma grupa. W głównych podgrupach elektroujemność maleje wraz ze wzrostem liczby atomowej. Dlatego wskazane pierwiastki chemiczne należy zapisać w kolejności malejącej według ich numerów seryjnych: I, Br, Cl, F (jod, brom, chlor, fluor).
Właściwości metaliczne to właściwości atomów pierwiastków chemicznych umożliwiające oddawanie elektronów. Pierwiastki chemiczne wykazujące właściwości metaliczne zazwyczaj mają od jednego do trzech elektronów na swojej zewnętrznej powłoce. Właściwości niemetaliczne to właściwości atomów pierwiastków chemicznych do przyjmowania elektronów. Pierwiastki chemiczne wykazujące właściwości niemetaliczne zazwyczaj mają od czterech do ośmiu elektronów w swojej zewnętrznej powłoce. Im łatwiej elektron jest oddawany z zewnętrznego poziomu energii, tym większe są właściwości metaliczne i tym samym mniejsze właściwości niemetaliczne. Łatwiej jest oddać elektron z zewnętrznego poziomu energii, im większy promień atomowy, ze względu na fakt, że siła przyciągania pomiędzy jądrem a elektronami maleje wraz ze wzrostem odległości między nimi. W konsekwencji zmiana właściwości metalicznych pierwiastków chemicznych będzie podobna do zmiany ich promieni atomowych. Zatem w głównych podgrupach właściwości metaliczne rosną wraz ze wzrostem numeru seryjnego, a w okresach wraz ze wzrostem numeru seryjnego właściwości metaliczne maleją. Natomiast właściwości niemetaliczne w głównych podgrupach maleją wraz ze wzrostem numeru seryjnego, a w okresach wraz ze wzrostem numeru seryjnego rosną.
Na przykład uporządkujmy pierwiastki chemiczne Al, S, Mg, Cl, Na według rosnących właściwości niemetalicznych. Podane pierwiastki chemiczne należą do trzeciego okresu. W okresach właściwości niemetaliczne rosną wraz ze wzrostem liczby atomowej. Dlatego wskazane pierwiastki chemiczne należy zapisać w rosnącej kolejności ich numerów seryjnych: Na, Mg, Al, S, Cl Rozważmy związek pomiędzy pozycją pierwiastków chemicznych w układzie okresowym a właściwościami tlenków i odpowiednich wodorotlenków tworzące te pierwiastki chemiczne, na przykładzie pierwiastków trzeciego okresu. Trzeci okres obejmuje pierwiastki chemiczne: Na, Mg, Al, Si, P, S, Cl, Ar
Pierwiastki te tworzą wyższe tlenki o następującym składzie (obojętny pierwiastek chemiczny Argon nie tworzy tlenku): Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
Tlenek sodu i tlenek magnezu wykazują właściwości zasadowe tlenki, tlenek glinu jest tlenkiem amfoterycznym, wszystkie tlenki (tlenek krzemu (IV), tlenek fosforu (V), tlenek siarki (VI), tlenek chloru (VII)) wykazują właściwości tlenków kwasowych. Dodatkowo w serii Na2O – MgO podstawowe właściwości słabną, a w serii SiO2 – P2O5 – SO3 – Cl2O7 właściwości kwasowe nasilają się.
Można także analizować charakter zmiany właściwości wodorotlenków w okresie, który odpowiada wyższe tlenki: NaOH, Mg (OH)2, Al (OH)3, H2SiO3, H3PO4, H2SO4, HClO4.
Wodorotlenek sodu i wodorotlenek magnezu wykazują właściwości zasad, wodorotlenek glinu wodorotlenek amfoteryczny, wszystkie pozostałe wodorotlenki wykazują właściwości kwasów: kwas krzemianowy, kwas ortofosforanowy, Kwas Siarkowy, kwas chlorowy. Dodatkowo w serii NaOH - Mg (OH)2 właściwości podstawowe słabną, a w serii H2SiO3 - H3PO4 - H2SO4 - HClO4 właściwości kwasowe rosną.
Zatem w szeregu niektórych pierwiastków właściwości zasadowych tlenków i odpowiadających im wodorotlenków są osłabione, a właściwości kwasowe w tym samym kierunku ulegają wzmocnieniu. Przejście z podstawowego na tlenki kwasowe i odpowiednio od zasad do kwasów przeprowadza się w okresie z powodu amfoterycznego tlenku lub wodorotlenku. Ten wzór obowiązuje dla drugiego i trzeciego okresu układ okresowy. W przypadku elementów o długich okresach obserwuje się złożone wzorce.
Pod promień atom odnosi się do odległości pomiędzy rdzeniem danego obiektu atom i jego najdalsza orbita elektronowa. Obecnie ogólnie przyjętą jednostką miary promienia atomowego jest pikometr (pm). Określ promień atom bardzo łatwe.
Będziesz potrzebować
- Układ okresowy Mendelejewa
Instrukcje
Przede wszystkim powinieneś mieć pod ręką zwykły układ okresowy, w którym wszystko jest uporządkowane znane ludzkości pierwiastki chemiczne. Bardzo łatwo jest znaleźć tę tabelę w dowolnym podręczniku chemii, podręcznik szkolny lub można ją kupić osobno w lokalnej księgarni.
Po prawej górny róg Każdy pierwiastek chemiczny ma swoje numer seryjny. Liczba ta całkowicie pokrywa się z liczbą atomową promień dany atom.
Na przykład liczba atomowa chloru (Cl) wynosi 17. Oznacza to, że odległość od jądra atom chloru na najdalszą orbitę, ruch stabilnego elektronu wynosi 17:00. Jeśli chcesz znaleźć nie tylko promień atomowy, ale także rozkład elektronów orbity elektronowe, wówczas dane te można podkreślić z kolumny liczb znajdującej się po prawej stronie nazwy pierwiastka chemicznego.
Struktura planety Ziemia jest podzielona na rdzeń, płaszcz i skorupę. Rdzeń - Środkowa część, położony najdalej od powierzchni. Płaszcz znajduje się poniżej skorupy i powyżej jądra. Wreszcie kora jest korą zewnętrzną twarda skorupa planety.

Instrukcje
Jeden z pierwszych, który zasugerował istnienie jądra Brytyjski chemik i fizyk Henry Cavendish w XVIII wieku. Udało mu się obliczyć masę i średnia gęstość Ziemia. Porównał gęstość Ziemi z gęstością skał na jej powierzchni. Stwierdzono, że gęstość powierzchniowa znacznie poniżej średniej.
Niemiecki sejsmolog E. Wichert udowodnił istnienie jądra Ląduje w 1897 r. Amerykański geofizyk B. Guttenberg w 1910 roku określił głębokość jądra– 2900 km. Według naukowców rdzeń składa się z niklu i innych pierwiastków mających powinowactwo do żelaza: złota, węgla, kobaltu, germanu i innych.
Przeciętny promień jądra wynosi 3500 kilometrów. Dodatkowo w budynku jądra Ziemie uwalniają ciało stałe Rdzeń wewnętrzny, mając promień około 1300 kilometrów, a ciecz zewnętrzna promień och, około 2200 kilometrów. W centrum jądra temperatury osiągają 5000°C. Masa jądra szacuje się na prawie 2 10^24 kg.
Można dokonać analogii pomiędzy strukturą planet i strukturą atomu. Atom ma również część centralną, jądro, przy czym większość masy jest skupiona w jądrze. Wymiary jądra atomowe tworzą kilka femtometrów (od łacińskiego femto - 15). Przedrostek „femto” oznacza mnożenie przez dziesięć do minus piętnastej potęgi. Zatem jądro atomu jest 10 tysięcy razy mniejsze od samego atomu i 10^21 razy mniejsze rozmiary jądra Ziemia.
Oceniać promień planet, należy zastosować pośrednie metody geochemiczne i geofizyczne. W przypadku atomu analizuje się rozpad ciężkich jąder, biorąc pod uwagę nie tyle geometrię promień, Ile promień działania siły nuklearne. Ideę planetarnej struktury atomu wysunął Rutherford. Zależność masowa jądra z promień ale nie jest liniowy.
notatka
Dzięki układowi okresowemu bardzo łatwo jest znaleźć nie tylko promień atomowy, ale także masa atomowa, waga molekularna, okres i serię danego pierwiastka, a także rozkład elektronów na orbitach elektronowych wraz z liczbą orbit.
Najpopularniejszym modelem atomu jest ten przyjęty w 1913 roku przez Nielsa Bohra. Nazywa się go także modelem planetarnym. Wynika to z faktu, że elektrony, podobnie jak planety Układ Słoneczny, poruszają się wokół Słońca - jądra atomu. Orbity ruchu elektronów są stałe. Rozwój tego modelu dał impuls do opracowania nowego kierunku w Fizyka teoretyczna - mechanika kwantowa.
Pierwszy promień orbity ruchu elektronów nazywany jest promieniem Bohra, a energia elektronów na pierwszej orbicie nazywana jest energią jonizacji atomu.
Pomocna rada
Warto zauważyć, że promień dowolnego atomu jest odwrotnie proporcjonalny do liczby protonów w jego jądrze, a także równe ładunkowi jego rdzeń.
Określenie promieni atomowych również stwarza pewne problemy. Po pierwsze, atom nie jest kulą o ściśle określonej powierzchni i promieniu. Przypomnijmy, że atom to jądro otoczone chmurą elektronów. Prawdopodobieństwo wykrycia elektronu w miarę oddalania się od jądra stopniowo wzrasta do pewnego maksimum, a następnie stopniowo maleje, ale staje się równy zeru tylko na nieskończenie dużą odległość. Po drugie, jeśli mimo to wybierzemy jakiś warunek wyznaczania promienia, to i tak promienia takiego nie da się zmierzyć eksperymentalnie.
Eksperyment pozwala wyznaczyć jedynie odległości międzyjądrowe, czyli długości wiązań (i to z pewnymi zastrzeżeniami podanymi w podpisie do rys. 2.21). Do ich określenia wykorzystuje się analizę dyfrakcji promieni rentgenowskich lub metodę dyfrakcji elektronów (opartą na dyfrakcji elektronów). Przyjmuje się, że promień atomu wynosi równy połowie najmniejsza odległość międzyjądrowa pomiędzy identycznymi atomami.
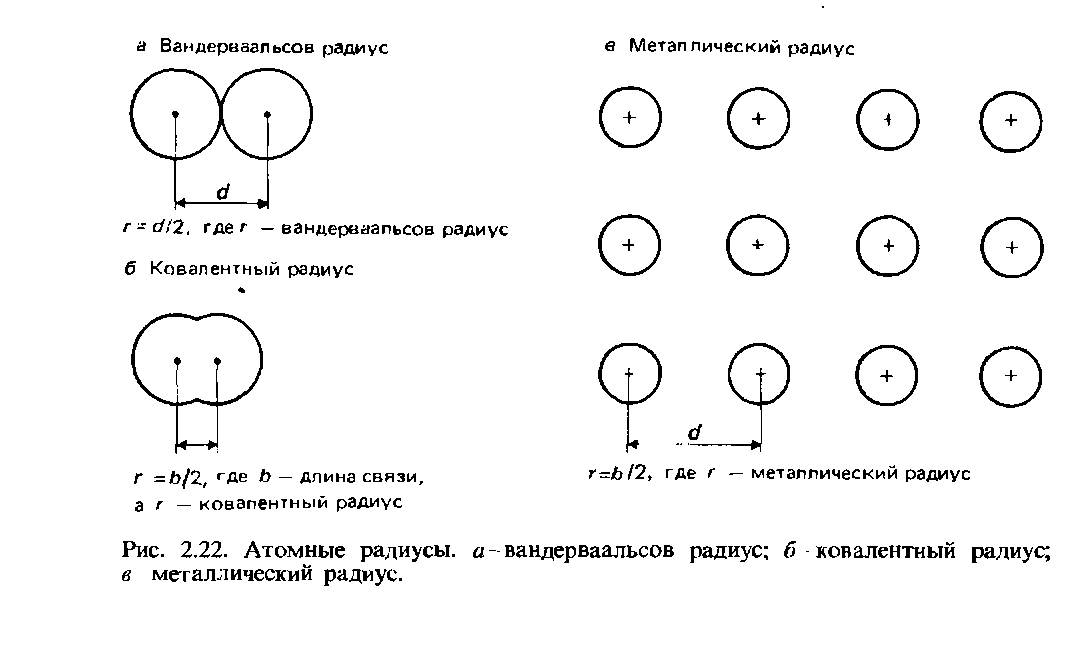
Promienie Vandera Waalsa. W przypadku niezwiązanych atomów połowa najmniejszej odległości międzyjądrowej nazywana jest promieniem van der Waalsa. Definicja ta ilustruje rys. 2.22.
Ryż. 2.21. Długość łącza. Ponieważ cząsteczki nieustannie wibrują, odległość międzyjądrowa lub długość wiązania nie ma stałej wartości. Ten rysunek schematycznie przedstawia drgania liniowe prostej cząsteczki dwuatomowej. Wibracje nie pozwalają na zdefiniowanie długości wiązania po prostu jako odległości między środkami dwóch związanych atomów. Więcej precyzyjna definicja wygląda tak: długość wiązania to odległość między związanymi atomami, mierzona między środkami mas dwóch atomów i odpowiadająca minimalnej energii wiązania. Energię minimalną pokazano na krzywej Morse’a (patrz rys. 2.1).

Tabela 2.6. Gęstości alotropów węgla i siarki Tabela 2.7. Długość wiązań węgiel-węgiel
Promienie kowalencyjne.Promień kowalencyjny definiuje się jako połowę odległości międzyjądrowej (długości wiązania) pomiędzy dwoma identycznymi atomami związanymi ze sobą wiązanie kowalencyjne (ryc. 2.22, b). Jako przykład weźmy cząsteczkę chloru Cl2, której długość wiązania wynosi 0,1988 nm. Przyjmuje się, że promień kowalencyjny chloru wynosi 0,0944 nm.
Znając promień kowalencyjny atomu jednego pierwiastka, możesz obliczyć promień kowalencyjny atomu innego pierwiastka. Na przykład eksperymentalnie ustalić wartość Długość wiązania C-Cl w CH3Cl wynosi 0,1767 nm. Odejmując promień kowalencyjny chloru (0,0994 nm) od tej wartości, okazuje się, że promień kowalencyjny węgla wynosi 0,0773 nm. Ta metoda obliczeń opiera się na zasadzie addytywności, zgodnie z którą promienie atomowe są przestrzegane proste prawo dodatek. Zatem długość wiązania C-Cl jest sumą promieni kowalencyjnych węgla i chloru. Zasada addytywności dotyczy tylko prostych wiązań kowalencyjnych. Podwójne i potrójne wiązania kowalencyjne są krótsze (tabela 2.7).
Długość prostego wiązania kowalencyjnego zależy również od jego otoczenia w cząsteczce. Na przykład długość Wiązania CH zmienia się od 0,1070 nm przy trójpodstawionym atomie węgla do 0,115 nm w związku CH3CN.
Promienie metalu. Przyjmuje się, że promień metaliczny jest równy połowie odległości międzyjądrowej pomiędzy sąsiednimi jonami sieci krystalicznej metal (ryc. 2.22, c). Termin promień atomowy zwykle odnosi się do promienia kowalencyjnego atomów pierwiastków niemetalicznych, a termin promień metaliczny do atomów pierwiastków metalicznych.
Promienie jonowe. Promień jonowy to jedna z dwóch części odległości międzyjądrowej pomiędzy sąsiednimi jonami jednoatomowymi (prostymi) w krystalicznym związku jonowym (soli). Określenie promienia jonowego również jest obarczone sporymi problemami, ponieważ odległości międzyjonowe mierzy się eksperymentalnie, a nie same promienie jonowe. Odległości między jonami zależą od upakowania jonów w sieci krystalicznej. Na ryc. 2.23 pokazuje trzy możliwe sposoby upakowanie jonów w sieci krystalicznej. Niestety, doświadczalnie zmierzono odległości międzyjonowe
Ryż. 2.23. Promienie jonowe, c-aniony stykają się ze sobą, ale kationy nie stykają się z anionami; b-kationy stykają się z anionami, ale aniony nie stykają się ze sobą; w tradycyjnie przyjęty układ jonów, w którym kationy stykają się z anionami, a aniony stykają się ze sobą. Odległość a wyznacza się doświadczalnie. Przyjmuje się, że jest to dwukrotność promienia anionu. Pozwala to obliczyć odległość międzyjonową b, która jest sumą promieni anionu i kationu. Znając odległość międzyjonową b, możemy obliczyć promień kationu.
nie pozwalają nam ocenić, który z tych trzech sposobów pakowania jest faktycznie realizowany w każdym z nich konkretny przypadek. Problem polega na znalezieniu proporcji, w jakiej należy podzielić odległość międzyjonową na dwie części odpowiadające promieniom dwóch jonów, innymi słowy, aby zdecydować, gdzie faktycznie kończy się jeden jon, a gdzie zaczyna drugi. Jak pokazano na przykład na ryc. 2.12 tej kwestii nie da się rozwiązać nawet kartami gęstość elektronów sole Aby przezwyciężyć tę trudność, zwykle przyjmuje się, że: 1) odległość międzyjonowa jest sumą dwóch promieni jonowych, 2) jony mają kształt kulisty i 3) sąsiednie kule stykają się ze sobą. Ostatnie założenie odpowiada metodzie upakowania jonów pokazanej na ryc. 2.23, f. Jeśli znany jest jeden promień jonowy, inne promienie jonowe można obliczyć w oparciu o zasadę addytywności.
Dopasowanie promienia różne rodzaje. W tabeli 2.8 pokazuje wartości promieni różnych typów dla trzech elementów trzeciego okresu. To jak najbardziej widać duże wartości należą do promieni anionowych i promieni van der Waalsa. Na ryc. 11.9 porównuje rozmiary jonów i atomów wszystkich pierwiastków 3. okresu, z wyjątkiem argonu. Rozmiary atomów są określone przez ich promienie kowalencyjne. Należy zauważyć, że kationy są mniejsze od atomów, a aniony – tak duże rozmiary niż atomy tych samych pierwiastków. Dla każdego elementu ze wszystkich rodzajów promieni najmniejsza wartość zawsze należy do promienia kationu.
Tabela 2.8. Porównanie promieni atomowych różnych typów


Ustalenie eksperymentalne. Aby określić kształt prostych cząsteczek i jonów wieloatomowych, a dokładniej długości wiązań i kąty wiązań (kąty między wiązaniami), stosuje się różne metody eksperymentalne. Należą do nich spektroskopia mikrofalowa, a także metody badania dyfrakcji zdjęcia rentgenowskie(dyfrakcja promieni rentgenowskich), neutrony (dyfrakcja neutronów) lub elektrony (dyfrakcja elektronów). W następnym rozdziale opisano szczegółowo, w jaki sposób można wykorzystać dyfrakcję promieni rentgenowskich do określenia struktura krystaliczna. Jednakże dyfrakcja elektronów (metoda badania dyfrakcji elektronów) jest zwykle stosowana do określenia kształtu prostych cząsteczek w fazie gazowej. Metoda ta opiera się na użyciu właściwości fal elektrony. Przez próbkę badanego gazu przepuszcza się wiązkę elektronów. Cząsteczki gazu rozpraszają elektrony, tworząc obraz dyfrakcyjny. Analizując to, można określić długość i kąt wiązania w cząsteczkach. Metoda ta jest podobna do tej stosowanej w analizie obrazu dyfrakcyjnego powstałego w wyniku rozproszenia promieni rentgenowskich.
Promienie atomowe promienie atomowe
cechy, które pozwalają w przybliżeniu oszacować odległości międzyatomowe (międzyjądrowe) w cząsteczkach i kryształach. Promienie atomowe są rzędu 0,1 nm. Określane głównie na podstawie danych rentgenowskich analiza strukturalna.
PROMIEŃ ATOMOWYPROMIeń ATOMOWY, cecha, która pozwala w przybliżeniu oszacować odległości międzyatomowe (międzyjądrowe) w cząsteczkach i kryształach.
Przez efektywny promień atomu lub jonu rozumie się promień jego sfery działania, a atom (jon) uważa się za nieściśliwą kulę. Używając planetarnego modelu atomu, przedstawia się go jako jądro, wokół którego krąży (cm. ORBITALE) elektrony się obracają. Kolejność pierwiastków w układzie okresowym Mendelejewa odpowiada kolejności napełniania powłoki elektronowe. Efektywny promień jonu zależy od wypełnienia powłok elektronowych, ale nie jest równy promieniowi orbity zewnętrznej. Aby określić efektywny promień, atomy (jony) w strukturze kryształu przedstawia się jako stykające się sztywne kule, tak aby odległość między ich środkami była równa sumie promieni. Promienie atomowe i jonowe wyznaczane są eksperymentalnie na podstawie rentgenowskich pomiarów odległości międzyatomowych i obliczane teoretycznie w oparciu o koncepcje mechaniki kwantowej.
Wielkości promieni jonowych podlegają następującym prawom:
1. W jednym pionowym rzędzie układu okresowego promienie jonów wynoszą ok równy ładunek wzrastać wraz ze wzrostem Liczba atomowa, ponieważ wzrasta liczba powłok elektronowych, a co za tym idzie, rozmiar atomu.
2. W przypadku tego samego pierwiastka promień jonowy rośnie wraz ze wzrostem ładunek ujemny i maleje wraz ze wzrostem ładunek dodatni. Promień anionów większy niż promień kation, ponieważ anion ma nadmiar elektronów, a kation ma niedobór. Na przykład dla Fe, Fe 2+, Fe 3+ promień efektywny wynosi odpowiednio 0,126, 0,080 i 0,067 nm, dla Si 4-, Si, Si 4+ promień efektywny wynosi odpowiednio 0,198, 0,118 i 0,040 nm.
3. Wielkości atomów i jonów odpowiadają okresowości układu Mendelejewa; wyjątkami są pierwiastki od nr 57 (lantan) do nr 71 (lutet), w których promienie atomów nie rosną, ale równomiernie maleją (tzw. skurcz lantanowców) oraz pierwiastki od nr 89 (aktyn) i wzwyż (tzw. skurcz aktynowca).
Promień atomowy pierwiastka chemicznego zależy od liczby koordynacyjnej (cm. NUMER KOORDYNACYJNY). Wzrostowi liczby koordynacyjnej zawsze towarzyszy wzrost odległości międzyatomowych. W tym przypadku względna różnica wartości promieni atomowych odpowiadających dwóm różnym liczbom koordynacyjnym nie jest zależna od rodzaju wiązania chemicznego (pod warunkiem, że rodzaj wiązania w strukturach o porównywanych liczbach koordynacyjnych jest taki sam). Zmiana promieni atomowych wraz ze zmianą liczby koordynacyjnej znacząco wpływa na wielkość zmian objętościowych podczas transformacji polimorficznych. Przykładowo podczas chłodzenia żelaza, jego przemianie z modyfikacji z siatką sześcienną skupioną na ścianie do modyfikacji z siatką sześcienną skupioną na ciele, która następuje w temperaturze 906 o C, powinno towarzyszyć zwiększenie objętości o 9%, w rzeczywistości wzrost wolumenu wynosi 0,8%. Wynika to z faktu, że w wyniku zmiany liczby koordynacyjnej z 12 na 8 promień atomowy żelaza zmniejsza się o 3%. Oznacza to, że zmiany promieni atomowych podczas transformacji polimorficznych w dużej mierze kompensują te zmiany objętościowe, które powinny wystąpić, gdyby promień atomowy się nie zmienił. Promienie atomowe pierwiastków można porównywać tylko wtedy, gdy mają tę samą liczbę koordynacyjną.
Promienie atomowe (jonowe) zależą również od rodzaju wiązania chemicznego.
W kryształkach z wiązanie metaliczne (cm.ŁĄCZE METALOWE) promień atomowy definiuje się jako połowę odległości międzyatomowej pomiędzy najbliższymi atomami. W przypadku roztworów stałych (cm. SOLIDNE ROZWIĄZANIA) metaliczne promienie atomowe różnią się w złożony sposób.
Przez promienie kowalencyjne pierwiastków posiadających wiązanie kowalencyjne rozumie się połowę odległości międzyatomowej pomiędzy najbliższymi atomami połączonymi pojedynczym wiązaniem kowalencyjnym. Cechą promieni kowalencyjnych jest ich stałość w różnych strukturach kowalencyjnych o tych samych liczbach koordynacyjnych. Zatem odległości w wiązania pojedyncze SS w diamentach i węglowodory nasycone są identyczne i równe 0,154 nm.
Promienie jonowe w substancjach posiadających wiązania jonowe (cm. WIĄZANIE JONOWE) nie można określić jako połowy sumy odległości pomiędzy pobliskimi jonami. Z reguły rozmiary kationów i anionów znacznie się różnią. Ponadto symetria jonów różni się od kulistej. Istnieje kilka podejść do szacowania promieni jonowych. W oparciu o te podejścia szacuje się promienie jonowe pierwiastków, a następnie wyznacza się promienie jonowe pozostałych pierwiastków na podstawie eksperymentalnie określonych odległości międzyatomowych.
Promienie Van der Waalsa określają efektywne rozmiary atomów Gazy szlachetne. Ponadto za promienie atomowe van der Waalsa uważa się połowę odległości międzyjądrowej między najbliższymi identycznymi atomami, które nie są ze sobą połączone wiązanie chemiczne, tj. należące do różnych cząsteczek (na przykład w kryształach molekularnych).
Stosując w obliczeniach i konstrukcjach promienie atomowe (jonowe), ich wartości należy przyjmować z tabel zbudowanych według jednego systemu.
słownik encyklopedyczny. 2009 .
Zobacz, jakie „promienie atomowe” znajdują się w innych słownikach:
Charakterystyka atomów pozwalająca w przybliżeniu oszacować odległości międzyatomowe (międzyjądrowe) w cząsteczkach i kryształach. Atomy nie mają jednak wyraźnych granic, zgodnie z koncepcjami kwantowymi. mechanika, prawdopodobieństwo znalezienia elektronu dla pewnego odległość od rdzenia... ... Encyklopedia fizyczna
Cechy, które pozwalają w przybliżeniu oszacować odległości międzyatomowe (międzyjądrowe) w cząsteczkach i kryształach. Określane głównie na podstawie danych z analizy strukturalnej rentgenowskiej... Wielki słownik encyklopedyczny
Efektywne charakterystyki atomów, pozwalające w przybliżeniu oszacować odległość międzyatomową (międzyjądrową) w cząsteczkach i kryształach. Zgodnie z koncepcjami mechaniki kwantowej atomy nie mają wyraźnych granic, ale prawdopodobieństwo znalezienia elektronu... ... Encyklopedia chemiczna
Charakterystyki atomów umożliwiające przybliżone oszacowanie odległości międzyatomowych w substancjach. Według mechaniki kwantowej atom nie ma określonych granic, ale prawdopodobieństwo znalezienia elektronu wynosi podana odległość od jądra atomu, zaczynając od... ... Wielka encyklopedia radziecka
