1. មូលដ្ឋានមានប្រតិកម្មជាមួយអាស៊ីតដើម្បីបង្កើតជាអំបិល និងទឹក៖
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O
2. គ អុកស៊ីដអាស៊ីតបង្កើតជាអំបិល និងទឹក៖
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
3. អាល់កាឡាំងមានប្រតិកម្មជាមួយនឹងអុកស៊ីដ amphoteric និង hydroxides បង្កើតជាអំបិល និងទឹក៖
2NaOH + Cr 2 O 3 = 2NaCrO 2 + H 2 O
KOH + Cr(OH) 3 = KCrO 2 + 2H 2 O
4. អាល់កាឡាំងប្រតិកម្មជាមួយអំបិលរលាយ បង្កើតជាមូលដ្ឋានខ្សោយ ទឹកភ្លៀង ឬឧស្ម័ន៖
2NaOH + NiCl 2 = Ni(OH) 2 ¯ + 2NaCl
មូលដ្ឋាន
2KOH + (NH 4) 2 SO 4 = 2NH 3 + 2H 2 O + K 2 SO 4
បា(OH) 2 + Na 2 CO 3 = BaCO 3 ¯ + 2NaOH
5. អាល់កាឡាំងមានប្រតិកម្មជាមួយនឹងលោហធាតុមួយចំនួន ដែលត្រូវនឹងអុកស៊ីដ amphoteric៖
2NaOH + 2Al + 6H 2 O = 2Na + 3H 2
6. ឥទ្ធិពលនៃអាល់កាឡាំងលើសូចនាករ៖
អូ - + phenolphthalein ® ពណ៌ក្រហម
អូ - + litmus ® ពណ៌ខៀវ
7. ការរលួយនៃមូលដ្ឋានមួយចំនួននៅពេលដែលកំដៅ:
Сu(OH) 2 ® CuO + H 2 O
Amphoteric hydroxides – សមាសធាតុគីមីបង្ហាញលក្ខណៈសម្បត្តិនៃមូលដ្ឋាន និងអាស៊ីត។ Amphoteric hydroxides ត្រូវគ្នាទៅនឹងអុកស៊ីដ amphoteric (សូមមើលកថាខណ្ឌ 3.1) ។
Amphoteric hydroxides ជាធម្មតាត្រូវបានសរសេរក្នុងទម្រង់នៃមូលដ្ឋានមួយ ប៉ុន្តែពួកវាក៏អាចត្រូវបានបង្ហាញជាទម្រង់អាស៊ីត៖
Zn(OH) 2 Û H 2 ZnO ២
គ្រឹះ
លក្ខណៈសម្បត្តិគីមី អ៊ីដ្រូសែន amphoteric
1. Amphoteric hydroxides មានអន្តរកម្មជាមួយអាស៊ីត និងអុកស៊ីដអាស៊ីត៖
Be(OH) 2 + 2HCl = BeCl 2 + 2H 2 O
Be(OH) 2 + SO 3 = BeSO 4 + H 2 O
2. អន្តរកម្មជាមួយអាល់កាឡាំងនិង អុកស៊ីដមូលដ្ឋានអាល់កាឡាំងនិង លោហធាតុដីអាល់កាឡាំង:
Al(OH) 3 + NaOH = NaAlO 2 + 2H 2 O;
H 3 AlO 3 អាស៊ីតសូដ្យូមមេតាប៉ូលីស
(H 3 AlO 3 ® HAlO 2 + H 2 O)
2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
អ៊ីដ្រូសែន amphoteric ទាំងអស់គឺជាអេឡិចត្រូលីតខ្សោយ
អំបិល
អំបិល- នេះ។ សារធាតុស្មុគស្មាញដែលមានអ៊ីយ៉ុងដែក និងសំណល់អាស៊ីត។ អំបិលគឺជាផលិតផលនៃការជំនួសពេញលេញឬដោយផ្នែកនៃអ៊ីយ៉ុងអ៊ីដ្រូសែនជាមួយនឹងអ៊ីយ៉ុងដែក (ឬអាម៉ូញ៉ូម) នៅក្នុងអាស៊ីត។ ប្រភេទនៃអំបិល៖ មធ្យម (ធម្មតា) អាសុីត និងមូលដ្ឋាន។
អំបិលមធ្យម- ទាំងនេះគឺជាផលិតផលនៃការជំនួសទាំងស្រុងនៃអ៊ីដ្រូសែន cations នៅក្នុងអាស៊ីតជាមួយនឹងអ៊ីយ៉ុងដែក (ឬអាម៉ូញ៉ូម)៖ Na 2 CO 3, NiSO 4, NH 4 Cl ។ល។
លក្ខណៈគីមីនៃអំបិលមធ្យម
1. អំបិលមានអន្តរកម្មជាមួយអាស៊ីត អាល់កាឡាំង និងអំបិលផ្សេងទៀត បង្កើតបានជាអេឡិចត្រូលីតខ្សោយ ឬទឹកភ្លៀង។ ឬឧស្ម័ន៖
បា(NO 3) 2 + H 2 SO 4 = BaSO 4 ¯ + 2HNO 3
Na 2 SO 4 + Ba(OH) 2 = BaSO 4 ¯ + 2NaOH
CaCl 2 + 2AgNO 3 = 2AgCl¯ + Ca(NO 3) 2
2CH 3 COONa + H 2 SO 4 = Na 2 SO 4 + 2CH 3 COOH
NiSO 4 + 2KOH = Ni(OH) 2 ¯ + K 2 SO ៤
មូលដ្ឋាន
NH 4 NO 3 + NaOH = NH 3 + H 2 O + NaNO ៣
2. អំបិលមានអន្តរកម្មជាមួយលោហៈសកម្មជាង។ ច្រើនទៀត លោហៈធាតុសកម្មផ្លាស់ប្តូរសារធាតុសកម្មតិចចេញពីដំណោះស្រាយអំបិល (ឧបសម្ព័ន្ធទី 3) ។
Zn + CuSO 4 = ZnSO 4 + Cu
អំបិលអាស៊ីត - ទាំងនេះគឺជាផលិតផលនៃការជំនួសអ៊ីយ៉ុងអ៊ីដ្រូសែនមិនពេញលេញនៅក្នុងអាស៊ីតជាមួយអ៊ីយ៉ុងដែក (ឬអាម៉ូញ៉ូម)៖ NaHCO 3, NaH 2 PO 4, Na 2 HPO 4 ជាដើម។ អំបិលអាស៊ីតអាចត្រូវបានបង្កើតឡើងដោយអាស៊ីត polybasic ប៉ុណ្ណោះ។ អំបិលអាស៊ីដស្ទើរតែទាំងអស់គឺមានភាពរលាយខ្លាំងក្នុងទឹក។
ការទទួលបានអំបិលអាសុីត និងបំប្លែងវាទៅជាអំបិលមធ្យម
1. អំបិលអាស៊ីតត្រូវបានទទួលដោយប្រតិកម្មលើសនៃអាស៊ីត ឬអុកស៊ីដអាស៊ីតជាមួយនឹងមូលដ្ឋាន:
H 2 CO 3 + NaOH = NaHCO 3 + H 2 O
CO 2 + NaOH = NaHCO ៣
2. នៅពេលដែលអាស៊ីតលើសធ្វើអន្តរកម្មជាមួយអុកស៊ីដមូលដ្ឋាន៖
2H 2 CO 3 + CaO = Ca(HCO 3) 2 + H 2 O
3. អំបិលអាស៊ីតទទួលបានពីអំបិលមធ្យមដោយបន្ថែមអាស៊ីត៖
· និទ្ទេស
Na 2 SO 3 + H 2 SO 3 = 2NaHSO 3;
Na 2 SO 3 + HCl = NaHSO 3 + NaCl
4. អំបិលអាស៊ីតត្រូវបានបំប្លែងទៅជាអំបិលមធ្យមដោយប្រើអាល់កាឡាំង៖
NaHCO 3 + NaOH = Na 2 CO 3 + H 2 O
អំបិលមូលដ្ឋាន- ទាំងនេះគឺជាផលិតផលនៃការជំនួសមិនពេញលេញនៃក្រុម hydroxo (OH - ) មូលដ្ឋាន សំណល់អាស៊ីត៖ MgOHCl, AlOHSO 4 ជាដើម។ អំបិលមូលដ្ឋានអាចត្រូវបានបង្កើតឡើងដោយមូលដ្ឋានខ្សោយនៃលោហៈ polyvalent ។ អំបិលទាំងនេះជាទូទៅអាចរលាយបានតិចតួច។
ការទទួលបានអំបិលជាមូលដ្ឋាន និងបំប្លែងវាទៅជាអំបិលមធ្យម
1. អំបិលមូលដ្ឋានត្រូវបានទទួលដោយប្រតិកម្មលើសនៃមូលដ្ឋានជាមួយនឹងអាស៊ីត ឬអុកស៊ីដអាស៊ីត៖
Mg(OH) 2 + HCl = MgOHCl¯ + H 2 O
អ៊ីដ្រូហ្សូ-
ម៉ាញ៉េស្យូមក្លរីត
Fe(OH) 3 + SO 3 = FeOHSO 4 ¯ + H 2 O
អ៊ីដ្រូហ្សូ-
ជាតិដែក (III) ស៊ុលហ្វាត
2. អំបិលមូលដ្ឋានត្រូវបានបង្កើតឡើងពីអំបិលមធ្យមដោយបន្ថែមកង្វះជាតិអាល់កាឡាំង៖
Fe 2 (SO 4) 3 + 2NaOH = 2FeOHSO 4 + Na 2 SO 4
3. អំបិលមូលដ្ឋានត្រូវបានបំប្លែងទៅជាអំបិលមធ្យមដោយបន្ថែមអាស៊ីត (និយមមួយដែលត្រូវនឹងអំបិល)៖
MgOHCl + HCl = MgCl 2 + H 2 O
2MgOHCl + H 2 SO 4 = MgCl 2 + MgSO 4 + 2H 2 O
អេឡិចត្រូលីត
អេឡិចត្រូលីត- ទាំងនេះគឺជាសារធាតុដែលបំបែកទៅជាអ៊ីយ៉ុងនៅក្នុងដំណោះស្រាយក្រោមឥទ្ធិពលនៃម៉ូលេគុលសារធាតុរំលាយប៉ូល (H 2 O) ។ ដោយផ្អែកលើសមត្ថភាពរបស់ពួកគេក្នុងការបំបែក (បំបែកទៅជាអ៊ីយ៉ុង) អេឡិចត្រូលីតត្រូវបានបែងចែកតាមធម្មតាទៅជាខ្លាំង និងខ្សោយ។ អេឡិចត្រូលីតខ្លាំងបំបែកស្ទើរតែទាំងស្រុង (នៅក្នុងដំណោះស្រាយរំលាយ) ខណៈពេលដែលអេឡិចត្រូលីតខ្សោយបំបែកទៅជាអ៊ីយ៉ុងតែផ្នែកខ្លះប៉ុណ្ណោះ។
TO អេឡិចត្រូលីតខ្លាំងទាក់ទង:
· អាស៊ីតខ្លាំង(សូមមើលទំព័រ 20);
· ហេតុផលខ្លាំង- អាល់កាឡាំង (មើលទំព័រ 22);
· អំបិលរលាយស្ទើរតែទាំងអស់។
អេឡិចត្រូលីតខ្សោយរួមមាន៖
អាស៊ីតខ្សោយ (មើលទំ។ 20);
· មូលដ្ឋានមិនមានជាតិអាល់កាឡាំង;
លក្ខណៈសំខាន់មួយនៃអេឡិចត្រូលីតខ្សោយគឺ ការបែកបាក់ថេរ – TO . ឧទាហរណ៍សម្រាប់អាស៊ីត monobasic ។
HA Û H + + ក - ,
ដែលជាកន្លែងដែលកំហាប់លំនឹងនៃ H + ions;
- កំហាប់លំនឹងនៃអាស៊ីតអាមីណូ A - ;
- កំហាប់លំនឹងនៃម៉ូលេគុលអាស៊ីត
ឬសម្រាប់ គ្រឹះខ្សោយ,
MOH Û M + + អូ - ,
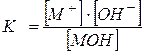 ,
,
ដែលជាកន្លែងដែលកំហាប់លំនឹងនៃ M + cations;
- កំហាប់លំនឹងនៃអ៊ីយ៉ុងអ៊ីដ្រូសែន OH - ;
- កំហាប់លំនឹងនៃម៉ូលេគុលមូលដ្ឋានខ្សោយ។
ភាពមិនស៊ីសង្វាក់គ្នានៃចំនួនមួយចំនួន អេឡិចត្រូលីតខ្សោយ(នៅ t = 25 °С)
| សារធាតុ | TO | សារធាតុ | TO |
| HCOOH | K = 1.8 × 10 −4 | H3PO4 | K 1 = 7.5 × 10 −3 |
| CH3COOH | K = 1.8 × 10 −5 | K 2 = 6.3 × 10 −8 | |
| HCN | K = 7.9 × 10 −10 | K 3 = 1.3 × 10 −12 | |
| H2CO3 | K 1 = 4.4 × 10 −7 | HClO | K = 2.9 × 10 −8 |
| K2 = 4.8 × 10 −11 | H3BO3 | K 1 = 5.8 × 10 −10 | |
| អេហ្វអេហ្វ | K = 6.6 × 10 −4 | K2 = 1.8 × 10 −13 | |
| HNO2 | K = 4.0 × 10 −4 | K 3 = 1.6 × 10 −14 | |
| H2SO3 | K 1 = 1.7 × 10 −2 | H2O | K = 1.8 × 10 −16 |
| K 2 = 6.3 × 10 −8 | NH 3 × H 2 O | K = 1.8 × 10 −5 | |
| H2S | K 1 = 1.1 × 10 −7 | អាល់(OH) ៣ | K 3 = 1.4 × 10 −9 |
| K2 = 1.0 × 10 −14 | Zn(OH) ២ | K 1 = 4.4 × 10 −5 | |
| H2SiO3 | K 1 = 1.3 × 10 −10 | K 2 = 1.5 × 10 −9 | |
| K2 = 1.6 × 10 −12 | ស៊ីឌី (OH) ២ | K 2 = 5.0 × 10 −3 | |
| Fe(OH) ២ | K 2 = 1.3 × 10 −4 | Cr(OH) ៣ | K 3 = 1.0 × 10 −10 |
| Fe(OH) ៣ | K2 = 1.8 × 10 −11 | Ag(OH) | K = 1.1 × 10 −4 |
| K 3 = 1.3 × 10 −12 | Pb(OH) ២ | K 1 = 9.6 × 10 −4 | |
| Cu(OH) ២ | K 2 = 3.4 × 10 −7 | K 2 = 3.0 × 10 −8 | |
| Ni(OH) ២ | K 2 = 2.5 × 10 −5 |
4.4 ការរំលាយកំដៅមូលដ្ឋានមិនរលាយក្នុងទឹក។
មូលដ្ឋានមិនរលាយក្នុងទឹកជាច្រើន រលួយនៅពេលកំដៅ។ ផលិតផលដែលរលួយនឹងជាអុកស៊ីដនៃលោហធាតុ និងទឹកដែលត្រូវគ្នា។ សីតុណ្ហភាពកំដៅអាស្រ័យលើលោហៈដែលជាផ្នែកមួយនៃមូលដ្ឋាននិងមានចាប់ពី 200 ° C និងខ្ពស់ជាងនេះ។
ចូរយើងសរសេរនូវប្រតិកម្ម decomposition សម្រាប់ស័ង្កសី ទង់ដែង និងអាលុយមីញ៉ូម hydroxides៖
ផលិតផលនៃប្រតិកម្មខាងលើគឺអុកស៊ីដទឹក និងលោហៈ៖ និង .
4.5 អន្តរកម្មជាមួយអំបិលដែក។
ប្រតិកម្មនេះគឺជាលក្ខណៈនៃអាល់កាឡាំង។ ប៉ូតាស្យូមអ៊ីដ្រូសែន។ សូដ្យូម លីចូមមានអន្តរកម្មជាមួយអំបិលលោហៈ ដែលជាលទ្ធផលនៃអ៊ីដ្រូអុកស៊ីតដែលមិនអាចរលាយបាននៃលោហធាតុទាំងនេះ precipitate:
ដោយប្រើប្រតិកម្មទាំងនេះ អ៊ីដ្រូសែនមិនរលាយក្នុងទឹកនៃលោហធាតុជាច្រើនត្រូវបានទទួល ដែលបន្ទាប់មកត្រូវបានប្រើក្នុងការសំយោគគីមី ថ្នាំពេទ្យ។ល។
ជំពូកទី 5. ការប្រើប្រាស់មូលដ្ឋានក្នុងគីមីវិទ្យា និងឧស្សាហកម្ម។
មូលដ្ឋានត្រូវបានគេប្រើយ៉ាងទូលំទូលាយទាំងនៅក្នុងមន្ទីរពិសោធន៍គីមីសាស្ត្រនិង ឧស្សាហកម្មគីមីពួកគេរកឃើញកម្មវិធីរបស់ពួកគេនៅក្នុងជីវិតប្រចាំថ្ងៃ។
សូមក្រឡេកមើលកម្មវិធីនៃមូលដ្ឋានដែលប្រើយ៉ាងទូលំទូលាយបំផុត។
នៅក្នុងមន្ទីរពិសោធន៍គីមី និងក្នុងឧស្សាហកម្ម សូដ្យូម អ៊ីដ្រូស៊ីត គឺជាសារធាតុប្រតិកម្មដ៏ពេញនិយមបំផុតមួយ។
សូដ្យូមអ៊ីដ្រូសែន, ។
ប្រើសម្រាប់ផលិតអំបិលសូដ្យូមផ្សេងៗ៖ ស៊ុលហ្វាត នីត្រាត នីទ្រីត ក្រូម ស៊ីលីត ឬកែវទឹក ផ្លរីដា អំបិល អាស៊ីតសរីរាង្គ. វាត្រូវបានគេប្រើនៅក្នុងការផលិតនៃ pulp ពីឈើក្នុងអំឡុងពេលចម្អិនអាហារ kraft, សរសៃសិប្បនិម្មិត, សាប៊ូនិង ម្សៅសាប៊ូភ្នាក់ងារសើម និងសារធាតុ emulsifiers, ថ្នាំជ្រលក់, អុកស៊ីដអាលុយមីញ៉ូមពី bauxite, phenols ។ រួមបញ្ចូលនៅក្នុងអេឡិចត្រូលីតសម្រាប់ bluing ដែក លោហៈ oxidizing ជាពិសេសអាលុយមីញ៉ូមសម្រាប់ ដំណើរការអេឡិចត្រូលីតនៅក្នុងបច្ចេកវិទ្យាសំណប៉ាហាំង និងស័ង្កសី។
ប៉ូតាស្យូមអ៊ីដ្រូសែន, ។
បម្រើជាសម្ភារៈចាប់ផ្តើមសម្រាប់ការផលិតអំបិលប៉ូតាស្យូមជាច្រើន សាប៊ូរាវ និងថ្នាំជ្រលក់មួយចំនួន។ វាត្រូវបានគេប្រើជាអេឡិចត្រូលីតរួមជាមួយនឹងលីចូមអ៊ីដ្រូអុកស៊ីតនៅក្នុងថ្មនីកែល - កាដមីញ៉ូមក្នុងទម្រង់ជាដំណោះស្រាយជាតិអាល់កុលសម្រាប់ការផលិត xanthates - អន្តរការីក្នុងការផលិតភ្នាក់ងារអណ្តែត។
អាម៉ូញ៉ូមអ៊ីដ្រូសែន, ។
ផលិតកម្មរបស់វានៅលើពិភពលោកគឺប្រហែល 10 ទៅ 12 លានតោន។ វាត្រូវបានគេប្រើជាជីក្នុងការផលិតចំណីសត្វដើម្បីបង្កើនតម្លៃអាហារូបត្ថម្ភរបស់ពួកគេ និងជាសារធាតុថែរក្សា ក្នុងការផលិតសូដា សារធាតុពណ៌ ក្នុងការផលិតអេឡិចត្រូលីតនៃសមាសធាតុម៉ង់ហ្គាណែស។ ការអនុវត្តមន្ទីរពិសោធន៍.
កាល់ស្យូមអ៊ីដ្រូសែន, ។
កាល់ស្យូមអ៊ីដ្រូអ៊ីត (កំបោរកំបោរ) ត្រូវបានប្រើក្នុងការផលិតសម្ភារៈសំណង់។ សារធាតុ Bleach (ល្បាយ) និងសមាសធាតុកាល់ស្យូមផ្សេងទៀត ជីកំបោរ និងភ្នាក់ងារការពាររុក្ខជាតិត្រូវបានផលិតចេញពីវា។ Calcium hydroxide ត្រូវបានគេប្រើដើម្បីធ្វើឱ្យទឹកទន់ ស្បែកប្រែពណ៌ និងបន្សាប ទឹកសំណល់ញែកអំបិលអាស៊ីតសរីរាង្គចេញពីទឹករុក្ខជាតិ។
លីចូមអ៊ីដ្រូស៊ីត, ។
វាត្រូវបានគេប្រើដើម្បីបំពេញថ្មអាល់កាឡាំង ដែលបង្កើនអាយុជីវិតរបស់វា ហើយត្រូវបានប្រើសម្រាប់ផលិតស្រោម និងកញ្ចក់។
ម៉ាញ៉េស្យូមអ៊ីដ្រូសែន, ។
ប្រើក្នុងឧស្សាហកម្មសំណង់ ជាធាតុផ្សំនៃសម្ភារៈសំណង់ដែលធន់នឹងភ្លើង សម្រាប់ការផលិតសម្ភារៈគីមីសេរ៉ាមិច។ ប្រើក្នុងឱសថជាភ្នាក់ងារបន្សាបស្រាល (សម្រាប់ជាតិអាស៊ីតខ្ពស់។ ទឹកក្រពះ).
កម្មវិធីសម្រាប់ hydroxides ផ្សេងទៀតដែលមិនសូវមានត្រូវបានរាយក្នុងតារាងទី 3
តារាងទី 3. ការប្រើប្រាស់អ៊ីដ្រូសែនដែក។
| № | ឈ្មោះអ៊ីដ្រូសែន | គីមី | ការដាក់ពាក្យ |
| 1. | ស្ពាន់អ៊ីដ្រូសែន | ប្រើជាសារធាតុពណ៌សម្រាប់កញ្ចក់ ស្រោម និងកញ្ចក់ សារធាតុសម្រាប់ជ្រលក់ក្រណាត់ និងជាថ្នាំសម្លាប់មេរោគ។ ស្ថេរភាពនីឡុងសម្រាប់ការរៀបចំ reagent របស់ Schweitzer ។ | |
| 2. | ស័ង្កសីអ៊ីដ្រូសែន | ជ័រកៅស៊ូ សមាសធាតុថ្នាំលាប ក្នុងថ្នាំពេទ្យសត្វ ជាធាតុផ្សំនៃមួន។ | |
| 3. | Cobalt hydroxide | ប្រើសម្រាប់ផលិតកាតាលីករ សារធាតុពណ៌... |
|
| 4. | កាដ្យូមអ៊ីដ្រូសែន | ប្រើសម្រាប់ការរៀបចំសមាសធាតុ cadmium ជាភ្នាក់ងារវិភាគសម្រាប់ផលិតម៉ាស់សកម្មនៅក្នុងប្រភពបច្ចុប្បន្ន cadmium ។ | |
| 5. | អាលុយមីញ៉ូមអ៊ីដ្រូសែន | វាត្រូវបានគេប្រើដើម្បីផលិតសមាសធាតុអាលុយមីញ៉ូម ជាសារធាតុធន់នឹងភ្លើងនៅក្នុងថ្នាំលាប និងផ្លាស្ទិច សមាសធាតុនៃថ្នាំដុសធ្មេញ និងជាស្រោម និងសារធាតុ adsorbent ក្នុងថ្នាំ។ | |
| 6. | បេរីលយ៉ូមអ៊ីដ្រូសែន | ប្រើសម្រាប់ផលិត សេរ៉ាមិច refractory ។ crucibles ដែលជាសមាសធាតុនៃវ៉ែនតាដែលបញ្ជូនកាំរស្មី UV បានយ៉ាងល្អ។ | |
| 7. | សំណប៉ាហាំងអ៊ីដ្រូសែន | សម្រាប់ក្រណាត់ etching ជាពិសេសសូត្រ។ | |
| 8. | អ៊ីដ្រូសែននាំមុខ | សម្រាប់ក្រណាត់ឆ្លាក់, សម្រាប់ធ្វើកញ្ចក់, ឧបករណ៍បំពេញថ្ម។ | |
| 9. | ប៊ីស្មុតអ៊ីដ្រូសែន | ប្រើក្នុងការផលិត enamels និងសេរ៉ាមិច គ្រីស្តាល់ និងពិសេស។ កញ្ចក់សម្រាប់ផលិតវត្ថុធាតុដើម ultrasonic | |
| 10. | Chromium hydroxide | ប្រើក្នុងគីមីវិទ្យាវិភាគ។ | |
| 11. | ម៉ង់ហ្គាណែសអ៊ីដ្រូសែន | ប្រើដើម្បីទទួលបានសមាសធាតុម៉ង់ហ្គាណែស។ | |
| 12. | ជាតិដែកអ៊ីដ្រូសែន | មូលដ្ឋានសម្រាប់ការផលិតដែកលោហធាតុ សារធាតុពណ៌ |
សេចក្តីសន្និដ្ឋាន។
មូលនិធិគឺជាថ្នាក់មួយក្នុងចំណោមថ្នាក់ សារធាតុអសរីរាង្គដែលរួមជាមួយនឹងអាស៊ីត អុកស៊ីដ និងអំបិល បង្កើតជាមូលដ្ឋាននៃគីមីវិទ្យាអសរីរាង្គ។ ពួកវាត្រូវបានគេប្រើយ៉ាងទូលំទូលាយនៅក្នុង តំបន់ផ្សេងគ្នាគីមីវិទ្យា និងឧស្សាហកម្មគីមី។ ជាមួយនឹងជំនួយរបស់ពួកគេ ជីត្រូវបានទទួល។ សម្ភារសំណង់, កញ្ចក់ពណ៌។ បើគ្មានពួកវាទេ យើងនឹងបាត់បង់ថ្មអាល់កាឡាំងស្រាល និងសន្សំសំចៃ និងការផ្គត់ផ្គង់វេជ្ជសាស្រ្តជាច្រើន។
ភារកិច្ចនៃការងារនេះគឺដើម្បីរៀបចំចំណេះដឹងជាប្រព័ន្ធអំពីថ្នាក់នៃអសរីរាង្គនេះ។ សារធាតុគីមីជាមូលដ្ឋានគ្រឹះ វាចាំបាច់ក្នុងការប្រមូលផ្តុំសារធាតុគីមី និង លក្ខណៈសម្បត្តិរាងកាយការផលិត និងការប្រើប្រាស់របស់ពួកគេនៅក្នុងឧស្សាហកម្ម។
កំពុងដំណើរការ ការយកចិត្តទុកដាក់ពិសេសត្រូវបានឧទ្ទិសដល់ការបន្លិចគោលគំនិតនៃមូលដ្ឋានដែលជាថ្នាក់មួយនៃសារធាតុអសរីរាង្គដោយផ្អែកលើទ្រឹស្តីអាស៊ីត - មូលដ្ឋានទំនើបរបស់Brønsted, Lewis, Izmailov ។ យូសានណូវិច។ ពិចារណាផងដែរ។ វិធីសាស្រ្តឧស្សាហកម្មការទទួលបានអាល់កាឡាំងដោយប្រើឧទាហរណ៍នៃសូដ្យូម hydroxide [3, សិល្បៈ។ ៣៦–៤២ ]។ ការយកចិត្តទុកដាក់ច្រើន។បានបង់ទៅឱ្យវិធីសាស្រ្តនៃការប្រើប្រាស់មូលដ្ឋានទាំងនៅក្នុងជីវិតប្រចាំថ្ងៃ និងនៅក្នុងឧស្សាហកម្មគីមី វេជ្ជសាស្ត្រ និងសំណង់ ដែលពួកគេស្វែងរកកម្មវិធីរបស់ពួកគេ។ ផ្នែកសំខាន់នៃការអនុវត្តសារធាតុជាក់លាក់ត្រូវបានរាយក្នុងតារាងយោងពិសេសសម្រាប់ភាពងាយស្រួលនៃការប្រើប្រាស់។
ការសិក្សាអំពីលក្ខណៈសម្បត្តិនៃមូលដ្ឋានមាន សារៈសំខាន់ដ៏អស្ចារ្យក្នុងការសិក្សាគីមីវិទ្យា ក៏ដូចជាសម្រាប់ការអភិវឌ្ឍន៍ទស្សនៈពិភពលោកបែបវិទ្យាសាស្ត្រ។
បញ្ជីអក្សរសិល្ប៍ដែលបានប្រើ។
1. Glinka N.L. គីមីវិទ្យាទូទៅ. – អិល៖ គីមីវិទ្យា ឆ្នាំ ១៩៨៨ – ៧០២ ទំ។
2. Kreshkov A.P., Yaroslavtsev A.A. វគ្គសិក្សាគីមីវិទ្យា។ - អិមៈ គីមីវិទ្យា ឆ្នាំ ១៩៦៤ - ៤៣០ ទំ។
3. Podobaev N.I. អេឡិចត្រូលីស។ - អិមៈ ការអប់រំ, ១៩៨៩, ១០០ ទំ។
4. Polees M.E. គីមីវិទ្យាវិភាគ. - M. : វេជ្ជសាស្ត្រ ឆ្នាំ 1981 - 286 ទំ។
5. Rabinovich V. A., Khavin Z. Ya សៀវភៅយោងគីមី. – អិល៖ គីមីវិទ្យា ឆ្នាំ ១៩៧៨ – ៣៣១ ទំ។
៦.គីមីវិទ្យា៖ ការបោះពុម្ពឯកសារយោង/ ed ។ W. Schröter, K.-H, Lautenschläger, H. Bibrak et al.: Trans ។ ជាមួយគាត់។ – អិមៈ គីមីវិទ្យា ឆ្នាំ ១៩៨៩ – ៦៤៨ ទំ។
7. សព្វវចនាធិប្បាយគីមីក្នុង 5 ភាគ / ed ។ I. L. Knunyants ។ - អិមៈ សព្វវចនាធិប្បាយសូវៀត, 1990.
8. Shchukarev S.A. គីមីវិទ្យាអសរីរាង្គ. - អិមៈ បញ្ចប់ការសិក្សានៅវិទ្យាល័យ, 1970. – 437 ទំ។
នៅប្រទេសហូឡង់ ជាកន្លែងដែលប្រទេសទាំងពីរលក់រោមចៀម និងជាកន្លែងដែលអង់គ្លេសបានជួយជនជាតិ Gueuze ដែលបានបះបោរប្រឆាំងនឹងនឹមអេស្ប៉ាញ។ នៅក្រោមលក្ខខណ្ឌទាំងនេះជាមួយបន្ទាប់មក ការអភិវឌ្ឍន៍យ៉ាងឆាប់រហ័សទំនាក់ទំនង bourgeois នៅប្រទេសអង់គ្លេស ពិភពថ្មី- ផ្នែកខាងក្រោយនៃប្រទេសអេស្ប៉ាញ ដែលជារតនាគារដ៏មានបំផុត និងទីផ្សារធំទូលាយបំផុត - បានក្លាយជាគោលដៅ និងនុយសម្រាប់អ្នកផ្សងព្រេងអង់គ្លេស សម្រាប់ធនធាន ពាណិជ្ជករអង់គ្លេសនិងសុភាពបុរស។ ការលួចចម្លងនៅក្នុងទឹក...
ដើមឈើ។ វាគ្មានចំណុចណាមួយក្នុងការបំប៉ោងភាពផ្ទុយគ្នារវាងអេកូ និងជីវមណ្ឌលទេ។ វាជាការត្រឹមត្រូវជាងក្នុងការនិយាយអំពីអ្វីដែលបង្រួបបង្រួមពួកគេ អ្វីដែលពួកគេមានដូចគ្នា អ្វីដែលអាចប្រើជាមូលដ្ឋានសម្រាប់ វេទិកាទូទៅក្រមសីលធម៌បរិស្ថាន។ ទាំងនេះគឺដូចខាងក្រោម ចំណុចសំខាន់ៗ: 1) អ្វីៗទាំងអស់ បុគ្គល ប្រភេទនៃសត្វមានជីវិត និងប្រព័ន្ធអេកូឡូស៊ី មានគុណសម្បត្តិផ្ទាល់ខ្លួន សិទ្ធិ គុណតម្លៃខាងក្នុងរបស់វា ព្រោះមានតម្លៃ...
សម្រាប់ 1.5% នៃប្រជាជនរបស់ពួកគេ។ ដូច្នេះ ខ្ញុំនៅឆ្ងាយពីសំណួរថាអ្វីដែលខ្លាំង និងអ្វីខ្សោយ សង្គមស៊ីវិលខ្ញុំបានបន្តទៅសំណួរទីបួននៅក្នុងកាលវិភាគរបស់ខ្ញុំ - អំពីសង្គមស៊ីវិល និង កំណើនសេដ្ឋកិច្ច. អ្នកនិពន្ធដូចគ្នានៃទ្រឹស្តីនៃសកម្មភាពសមូហភាពដែលបានលើកឡើងរួចហើយដោយខ្ញុំ Mansur Olson បានសួរយ៉ាងខ្លាំង ចំណាប់អារម្មណ៍ សួរ- អំពីប្រទេសរបស់យើងដោយវិធីនេះ។ អ្នកមិនអាចមើលមុខគ្នាបានទេ។ ពួកយើង...
សិក្សាភូគព្ភវិទ្យា និងវិទ្យាសាស្ត្រដី យើងត្រូវទទួលស្គាល់ថា ភារកិច្ចនៃធរណីមាត្រគឺសិក្សាតែធរណីមាត្រប៉ុណ្ណោះ ប៉ុន្តែមិនមែនទ្រព្យសម្បត្តិសម្ភារៈទេ។ ផ្ទៃផែនដី. នៅក្នុងរូបមន្តគណិតវិទ្យា នេះមានន័យថា វត្ថុនៃការសិក្សាភូគព្ភសាស្ត្រ គួរតែត្រូវបានចាត់ទុកថាមិនមែនជាព្រំដែននៃសំណុំ L ផ្ទាល់នោះទេ ប៉ុន្តែការគូសវាសរបស់វាទៅក្នុងលំហ P, i.e. ផ្ទៃក្នុងលំហអឺគ្លីដបីវិមាត្រ គំរូដើម...
រាងកាយនិង លក្ខណៈសម្បត្តិគីមីដី។ ការប្រុងប្រយ័ត្នសុវត្ថិភាពនៅពេលធ្វើការជាមួយអាល់កាឡាំង។ គំនិតនៃ amphoteric hydroxides
មូលដ្ឋានរលាយក្នុងទឹក (អាល់កាឡាំង) គឺ សារធាតុរឹង សងាយរលាយក្នុងទឹក។ នៅ សីតុណ្ហភាពបន្ទប់ Ca (OH)2 និង Sr (OH)2 មានភាពរលាយទាប។ មូលដ្ឋានដែលមិនរលាយក្នុងទឹកគឺជាសារធាតុរឹង ឧទាហរណ៍ Al (OH)3 មានពណ៌ស Cu (OH)2 ពណ៌ខៀវ, Fe (OH)3 មានពណ៌ត្នោត។
មូលដ្ឋានរលាយ និងមិនអាចរលាយបានបង្ហាញពីលក្ខណៈគីមីទូទៅ និងប្លែកមួយចំនួន។
1. ឥទ្ធិពលនៃដំណោះស្រាយអាល់កាឡាំងលើដំណោះស្រាយសូចនាករ (ធម្មតាសម្រាប់តែអាល់កាឡាំងប៉ុណ្ណោះ)។ នៅក្នុងដំណោះស្រាយអាល់កាឡាំង, litmus និងក្រដាសសូចនាករជាសកលមាន ពណ៌ខៀវទឹកក្រូចមេទីលមានពណ៌លឿងពណ៌ទឹកក្រូច ហើយ phenolphthalein មានពណ៌ក្រហម។
2. អន្តរកម្មនៃមូលដ្ឋានជាមួយអាស៊ីតដើម្បីបង្កើតជាអំបិលនិងទឹក - ប្រតិកម្មអព្យាក្រឹត (លក្ខណៈនៃទាំងពីរ មូលដ្ឋានរលាយនិងមិនរលាយ):
KOH + HCl = KCl + H2O
3. អន្តរកម្មនៃមូលដ្ឋានជាមួយអុកស៊ីដអាស៊ីតដើម្បីបង្កើតជាអំបិល និងទឹក (ធម្មតាសម្រាប់តែអាល់កាឡាំង):
2NaOH + CO2 = Na2CO3 + H2O
4. អន្តរកម្មនៃមូលដ្ឋានជាមួយនឹងដំណោះស្រាយអំបិលដើម្បីបង្កើតជាមូលដ្ឋានមួយផ្សេងទៀត និងអំបិលមួយផ្សេងទៀត (ធម្មតាសម្រាប់តែអាល់កាឡាំង):
2KOH + CuSO4 = K2SO4 + Cu (OH)2 ¯
សមាសភាពនៃអំបិលដែលមានប្រតិកម្មជាមួយនឹងដំណោះស្រាយអាល់កាឡាំងត្រូវតែរួមបញ្ចូលលោហៈដែលមានសមត្ថភាពបង្កើតមូលដ្ឋានមិនរលាយ។
5. ការរលួយ មូលដ្ឋានមិនរលាយនៅពេលដែលកំដៅជាមួយនឹងការបង្កើតអុកស៊ីដនិងទឹក (លក្ខណៈសម្រាប់តែមូលដ្ឋានមិនរលាយ):
2Fe (OH)3 Fe2O3 + 3H2O
នៅពេលធ្វើការជាមួយអាល់កាឡាំង អ្នកគួរតែប្រយ័ត្ន ព្រោះវាលស្មៅមានសារធាតុឈ្លានពានខ្លាំង។ ប្រសិនបើសូលុយស្យុងអាល់កាឡាំងឡើងលើស្បែករបស់អ្នក អ្នកត្រូវលាងសម្អាតវាចេញភ្លាមៗជាមួយនឹងទឹកដែលកំពុងរត់ រហូតទាល់តែអារម្មណ៍នៃភាពផ្អែមល្ហែមរលាយបាត់ បន្ទាប់មកលាងសម្អាត (បន្សាប) ជាមួយនឹងដំណោះស្រាយ។ អាស៊ីតខ្សោយ(acetic ឬ boric) ហើយទៅស្ថានីយ៍ជំនួយដំបូង។
យើងបានរកឃើញរួចហើយថា មូលដ្ឋានមានប្រតិកម្មជាមួយអាស៊ីតក្នុងប្រតិកម្មអព្យាក្រឹត បង្កើតជាអំបិល។ មូលដ្ឋានដែលមានមូលដ្ឋានក៏ដូចជាអាស៊ីតដែលមានអាស៊ីតមិនចូលទៅក្នុងប្រតិកម្មអព្យាក្រឹតទេ។ ប៉ុន្តែមានអ៊ីដ្រូសែនដែលមានប្រតិកម្មជាមួយអាស៊ីដ និងមូលដ្ឋាន បង្កើតជាអំបិល។ អ៊ីដ្រូសែនបែបនេះត្រូវបានគេហៅថា amphoteric ។ Amphoteric hydroxides បង្ហាញលក្ខណៈសម្បត្តិនៃមូលដ្ឋាននៅក្នុងប្រតិកម្មជាមួយអាស៊ីត និងលក្ខណៈសម្បត្តិរបស់អាស៊ីតក្នុងប្រតិកម្មជាមួយមូលដ្ឋាន។ អ៊ីដ្រូសែន amphoteric ទាំងអស់គឺមិនអាចរលាយក្នុងទឹកបានទេ។ ទាំងនេះរួមមានស័ង្កសីអ៊ីដ្រូសែន Zn (OH) 2 អាលុយមីញ៉ូមអ៊ីដ្រូសែនអាល់ (OH) 3 បេរីលយ៉ូមអ៊ីដ្រូស៊ីត Be (OH) 2 ក្រូមីញ៉ូម (III) អ៊ីដ្រូសែន Cr (OH) 3 ហ្វឺរ៉ុម (III) អ៊ីដ្រូសែន Fe (OH) 3 និងផ្សេងៗទៀត។ ចូរយើងពិចារណាអំពីលក្ខណៈសម្បត្តិគីមីនៃ amphoteric hydroxides ដោយប្រើ zinc hydroxide ជាឧទាហរណ៍មួយ។
1. ប្រតិកម្មជាមួយអាស៊ីតដើម្បីបង្កើតជាអំបិល និងទឹក៖
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2. អន្តរកម្មជាមួយអាល់កាឡាំងដើម្បីបង្កើតជាអំបិល និងទឹក៖
Zn(OH)2 + 2NaOH Na2ZnO2 + 2H2O
