Давайте вспомним: 1.Основной закон, описывающий состояние газов называют законом _______. 2.Один моль любого газа занимает объём _____. 3.Атмосферный воздух состоит в основном из __ и ____. 4.Аллотропной модификацией кислорода является ____. 5.Самый легкий газ -______ получают в аппарате Кипа. 6.Углекислый газ получают в промышленности обжигом _______. 7. Аммиак распознают по изменению окраски влажной лакмусовой бумаги с красного на ______.


Попробуй реши: 1 вариант. Задача 1. Какой объём (при н.у.) будут занимать 2 моль углекислого газа. Задача 2. Человек выдыхает в сутки 1300 г углекислого газа. Определите его объём при н.у. 2 вариант Задача 1. Какое количество вещества азота содержится в 6,72 л этого газа? Задача 2. При дыхании человек потребляет за час около 56 л кислорода (н.у.). Какое количество вещества кислорода человек потребляет за сутки?



Особенности жидкого состояния вещества. 1. Молекулы находятся непосредственно друг возле друга, поэтому жидкости – малосжимаемы, в отличие от газов; 2. Текучи,т.е. не имеют формы, а принимают форму сосуда, в котором находятся; 3.В состоянии невесомости принимают форму шара или круглой капли.

Вода в природе. Важнейшим жидким веществом является вода, которая покрывает 2/3 поверхности Земли. 97,2 % общего запаса приходится на воды Мирового океана. Запас пресной воды на Земле всего 2,8%,но из них пригодна к использованию лишь 0,3% водных ресурсов. Животные, растения и человек на % состоят из воды, потеря % массы тела в результате обезвоживания приводит к гибели организма. Благодаря круговороту воды в природе её запасы практически неисчерпаемы. Круговорот воды состоит из 2 процессов: испарения и конденсации.

Чем уникальна вода? Физические свойства воды обусловлены строением её молекул, а также межмолекулярными связями. Молекулы воды имеют угловую форму, величина угла НОН равна Это приводит к появлению в молекуле 2 полюсов. Электронная плотность смещается к атому кислорода. Полярность молекулы воды делает её универсальным растворителем.

Вода имеет аномально высокую температуру плавления и кипения. Сравните молекулярные массы воды и других гидридов элементов 6 А группы с их температурами кипения. Н2О – М(Н2О) = 18 г/ моль Жидкость! Н2S- M(H2S) = 34 г/ моль Газ Н2Se- M (H2Se)= 81г/ моль Газ Н2Те- М(Н2Те) = 130 г/ моль 0 0 Газ Вывод: В группах с увеличением молекулярной массы соединений увеличиваются температуры кипения и плавления веществ. Причина аномально высокой температуры кипения воды наличие межмолекулярных водородных связей.


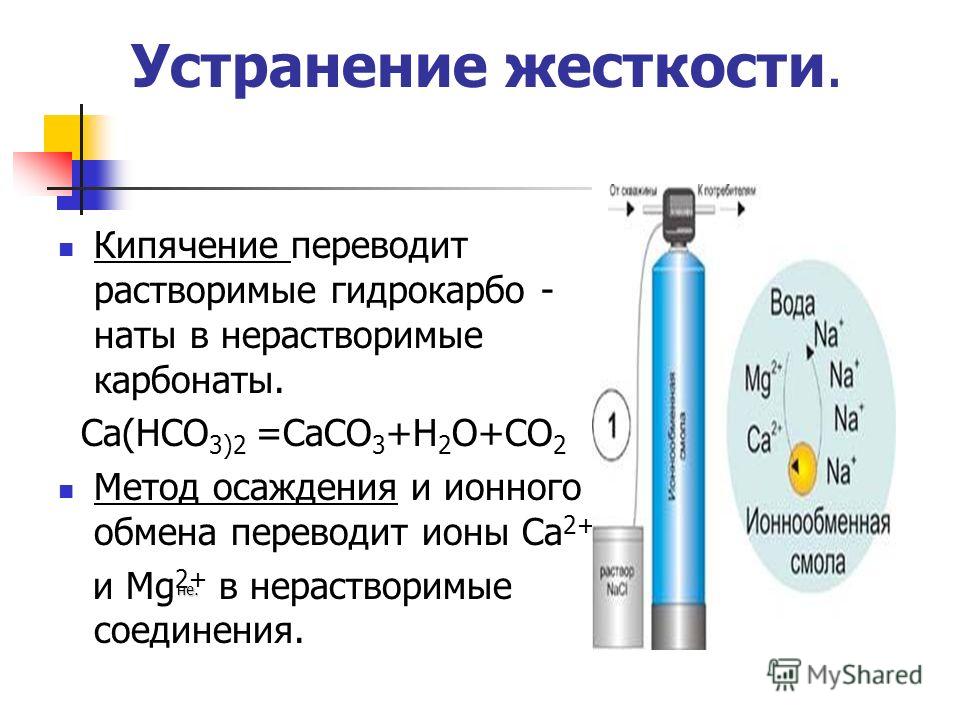
Бывает ли вода «жесткой»? Жесткость природных вод может меняться в зависимости от года: она понижается зимой, а летом – повышается. Жесткость природных вод может меняться в зависимости от года: она понижается зимой, а летом – повышается. Природная вода, содержащая в растворе большое количество солей кальция и магния называется жесткой водой. Природная вода, содержащая в растворе большое количество солей кальция и магния называется жесткой водой. Содержание солей кальция и магния в воде зависит и от состава почвы в водоносных слоях. Содержание солей кальция и магния в воде зависит и от состава почвы в водоносных слоях.


ВИДЫ ЖЕСТКОСТИ. КАРБОНАТНАЯ жесткость зависит от содержания в воде гидрокарбонатов кальция и магния Са(НСО 3) 2, Mg(HCO 3) 2. Некарбонатная жесткость вызвана присутствием в воде других солей, например сульфатов кальция и магния СаSO 4, MgSO 4 Кислые соли- продукт неполного замещения атомов водорода в кислоте.

Что такое «жесткая» вода? Жесткая вода- это накипь на деталях бытовой техники, стенках котлов и радиаторов. Жесткая вода- это накипь на деталях бытовой техники, стенках котлов и радиаторов. В жесткой воде плохо В жесткой воде плохо разваривается мясо. разваривается мясо. В жесткой воде не мылится мыло. В жесткой воде не мылится мыло.

 Подведем итоги. Подсчитайте свои баллы (каждый правильный ответ теста- 1балл) Поставьте себе оценку: баллов- «пять» 10-9 баллов- «четыре» 8-6 баллов- «три» менее 6 баллов- « два»!
Подведем итоги. Подсчитайте свои баллы (каждый правильный ответ теста- 1балл) Поставьте себе оценку: баллов- «пять» 10-9 баллов- «четыре» 8-6 баллов- «три» менее 6 баллов- « два»!


МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
ДОНЕЦКОЙ НАРОДНОЙ РЕСПУБЛИКИ
Государственное профессиональное образовательное учреждение
«Донецкий техникум промышленной автоматики»
Сборник методических материалов для
Самостоятельных работ студентов (СРС)
По дисциплине " химия "
Для студентов I курса
Технического профиля обучения
(общий объём -68 ч., из них 22ч. –срс)
Составила
Специалист
Поплавская Е.Ф.
Сборник методических материалов для самостоятельных работ студентов по дисциплине " Химия " для студентов технического профиля обучения I курса, ГПОУ «Донецкий техникум промышленной автоматики» - 2015г.
Сборник может использоваться студентами при подготовке и проверке знаний студентов ГПОУ . Сборник рекомендован также для работы преподавателей при подготовке к занятиям по дисциплине «Химия». Составитель: Поплавская Е.Ф.- преподаватель квалификационной категории «специалист высшей категории» ГПОУ «Донецкий техникум промышленной автоматики» - 2015г.
Рецензент: Пугачова О.М.- преподаватель квалификационной категории «специалист высшей категории» ГПОУ «Донецкий техникум промышленной автоматики».Воробьева Н.В.- преподаватель квалификационной категории «специалист высшей категории» ГПОУ «Донецкий техникум промышленной автоматики» - 2015г
Рассмотрено и утверждено на заседании цикловой комиссии физико-химических дисциплин (протокол № 1от 30.09.2015г.) Пугачёва О.М.
(Срс 1)
Тема: Газообразное состояние вещества : Три агрегатных состояния воды . Особенности строения газов. Молярный объем газообразных веществ. Примеры газообразных природных смесей: воздух,природный газ. Загрязнение атмосферы (кислотные дожди, парниковый эффект) и борьба с ним. Представители газообразных веществ: водород, кислород, углекислый газ, аммиак, метан, этилен. Их получение, собирание и распознавание.
Жидкое состояние вещества : Вода. Жесткость воды и способы ее устранения. Минеральные воды , их использование в столовых и лечебных целях. Жидкие кристаллы и их применение.
Твердое состояние вещества: Аморфные твердые вещества в природе и в жизни человека, их значение и применение. Кристаллическое строение вещества.
Дисперсные системы : Понятие о дисперсных системах. Дисперсная фаза и дисперсионная среда. Классификация дисперсных систем в зависимости от агрегатного состояния дисперсной среды и дисперсионной фазы. Грубодисперсные системы: эмульсии, суспензии, аэрозоли. Тонкодисперсные системы: гели и золи. Состав вещества и смесей . Вещества молекулярного и немолекулярного строения. Закон постоянства состава веществ. Понятие «доля» и ее разновидности: массовая (доля элементов в соединении, доля компонента в смеси - доля примесей, доля растворенного вещества в растворе) и объемная. Доля выхода продукта реакции от теоретически возможного.
Основные понятия и термины по теме: три агрегатных состояния воды, Жидкое состояние вещества. Физические свойства. Жесткость воды и способы ее устранения, дисперсные системы, фаза, среда, классификация, грубодисперсные системы, тонкодисперсные системы, коллоидные растворы, состав вещества и смесей.закон постоянства состава веществ, понятие «доля» и её разновидности.
План изучения темы
(перечень вопросов, обязательных к изучению):
1. Три агрегатных состояния воды.
2. Молярный объем газообразных веществ.
3. Примеры газообразных природных смесей: воздух,природный газ.
4. Загрязнение атмосферы (кислотные дожди, парниковый эффект) и борьба с ним.
5. Жидкое состояние вещества.
6. Потребление воды в быту и на производстве.
7. Жесткость воды и способы ее устранения.
8. Минеральные воды, их использование в столовых и лечебных целях.
9. Твердое состояние вещества.
10. Понятие о дисперсных системах. Классификация.
11. Закон постоянства состава веществ. Понятие «доля» и ее разновидности.
Химики изучают превращения веществ, находящихся в трех агрегатных состояниях – газообразном (газы), жидком (жидкости) и твердом (твердые аморфные тела либо кристаллы)
Свойства газов, жидкостей, твердых веществ
Газы. Наиболее характерным свойством является сжимаемость и способность расширяться.
Газы не имеют собственной формы, они расширяются до тех пор, пока равномерно не заполнят весь сосуд, куда их поместили. Это означает, что газы не имеют собственного объема, т.е. объем газа определяется объемом сосуда, в котором он находится. Газ оказывает на стенки сосуда давление, одинаковое во всех направлениях. Еще одним свойством газов является их способность смешиваться друг с другом в любых соотношениях . Частицы газа располагаются случайным образом, они находятся так далеко друг от друга, что между ними не может возникнуть сила притяжения.
Газообразному состоянию присущи две особенности:
1) расстояние между молекулами обычно в несколько раз превышает их размеры;
2) газы способны занимать весь объем предоставленного им пространства.
Строение газообразных, жидких и твердых тел характеризуется разными расстояниями между мельчайшими частицами этих веществ. Частицы газа находятся гораздо дальше друг от друга, чем в твердом или жидком состоянии. В воздухе, например, среднее расстояние между частицами примерно в десять раз превышает диаметр каждой частицы. Таким образом, объем молекул занимает всего около 0,1 % от общего объема. Остальные 99,9 % составляет пустое пространство. В противоположность этому частицы жидкости заполняют около 70 % общего объема жидкости.
Газы в отличие от жидкостей и твердых тел могут сравнительно легко сжиматься. Для того чтобы хорошо понимать особенности строения газообразного вещества, нужно знать, чему равен молярный объем газа, какова взаимосвязь между занимаемым газом объемом и количеством вещества, температурой и давлением, как определить среднее расстояние между молекулами газа и как оно зависит от его давления, с какой скоростью двигаются молекулы газообразного вещества и от чего эта скорость зависит.
Закон Авогадро:
В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Из закона Авогадро вытекает важное следствие:
при одинаковых условиях 1 моль любого газа занимает одинаковый объем. Этот объем можно вычислить, если известна масса 1 л газа. При нормальных условиях, т.е. температуре 273 К (0° С) и давлении 101325 Па, масса 1 л водорода равна 0,09 г, молярная масса его равна 1,008 2 = 2,016 г/моль. Тогда объем, занимаемый 1 молем водорода, равен
2,016 г/моль
(2,016 г/моль)/0,09 г/л=22,4 л/моль.
При тех же условиях масса 1 л кислорода 1,429 г; молярная масса 32 г/моль.
Тогда объем равен
32 г/моль/1,429 г/л =22,4 л/моль.
Следовательно,
При нормальных условиях 1 моль различных газов занимает объём, равный 22.4 л.
При нормальных условиях 1 моль различных газов занимает объём, равный 22.4 л. Этот объем называется молярным объемом газа.
Молярный объем газа – это отношение объема вещества к количеству этого вещества.
Молярный объем газа – постоянная величина, поскольку она мало зависит от природы вещества. Молярный объем при давлении 1 атм (101,3 кПа) и температуре 0 °С (273 K) по закону Авогадро равен 22,4 л . Газ, строго подчиняющийся закону Авогадро, принято называть идеальным.
Выбранные условия (1 атм, 0 °С) названы нормальными (н.у.)
Естественно, что молярный объем газа зависит от температуры и давления. При 25 °С и давлении 1 атм (эти условия названы стандартными ) молярный объем идеального газа равен уже 24,4 л.
Молярные объемы реальных газов при одних и тех же условиях несколько отличаются от молярного объема идеального газа.
Молярные объемы некоторых газов при 0 °С и 1 атм.
На основании закона Авогадро осуществляют различные расчеты - вычисление объема, массы, плотности газов при нормальных условиях, молярной массы газообразных веществ, а также относительной плотности газов.
Веществам свойственно принимать то или иное агрегатное состояние. Множество веществ находится в форме газов или жидкостей. При этом они обладают характерными свойствами, присущими соответствующему агрегатному состоянию.
Определение
В большинстве своем газы – ковалентные соединения (исключение составляет группа благородных газов) либо простые вещества. Сжимаемость и способность к расширению – характерные свойства газов. Газам присущи слабые связи между теми частицами, что составляют их. Частицы газа обладают большой подвижностью, свободным хаотическим движением, происходящем в промежутках между их столкновениями, при которых они резко меняют характер движения.
Жидкость – агрегатное состояние веществ. Ее основное свойство – способность к неограниченному изменению формы, которая трансформируется из-за воздействия механических касательных движений, даже если сила их ничтожна. При этом жидкость практически сохраняет изначальный объем. Ковалентные (вода), а так же ионные соединения (азотная кислота) и металлы (ртуть) могут находиться в жидком состоянии.
Сравнение
Газы не обладают собственной формой и объемом. Они, помещенные в сосуд, расширяются и равномерно по нему распределяются, пока не займут весь объем. Объем сосуда, где находится газ, определяет его объем. Газ способен оказывать постоянное давление на стенки сосудов, которое одинаково во всех направлениях. Газы могут смешиваться один с другим в любых пропорциях.
Жидкости, как и газы, не наделены определенными формами. Они, установившись под влиянием силы тяжести на определенном уровне, принимают форму сосуда, в который их наливают. Зато в отличие от газов, любая жидкость обладает определенным объемом. У них сжимаемость ничтожно мала. Жидкости заметно сжимаются только при воздействии чрезвычайно высокого давления. Кроме того, они кипят, испаряются и кондесируются.
Выводы сайт
- У газов нет фиксированного объема, а у жидкостей есть. Они неспособны к образованию свободных поверхностей. Газы стремятся занять весь объем, который им доступен.
- Жидкости чрезвычайно трудно сжимаются, потому что между их молекулами свободного пространства крайне мало.
- Жидкости образуют поверхностное натяжение, свободные поверхности.

