МОЛЕКУЛЯРНА ВАГА(Син. молекулярна маса) - маса молекули речовини, виражена у вуглецевих одиницях атомної маси (вуглецева одиниця атомної маси - 1/12 маси атома ізотопу вуглецю 12 C); поряд з атомними масами є основою для всіляких розрахунків, що виконуються за допомогою хім. формул та рівнянь, у т. ч. розрахунків, що виробляються в біохім. та клініко-діагностичних лабораторіях
Якщо відома хім. формула речовини, то його М. в. може бути обчислений як сума атомних ваг (мас) атомів хім. елементів (див. Атомна вага), що входять до складу молекули даної речовини. Напр., М. в. вуглекислого газу(CO 2) дорівнює:
12,011 + 2 * 15,9994 = 44,0098.
Для речовин, що знаходяться в газоподібному або розчиненому стані, експериментальні методивизначення М. в. найбільш обґрунтовані. М. в. (М1) газу зазвичай визначають, вимірявши його відносну щільність D по газу, М. в. до-рого (М2) відомий; тоді М1 = M2 * D. М. в. газу можна також визначити, якщо відома його нормальна густина d, тобто маса 1 л газу в грамах при тиску 760 мм рт. ст. та 0 °C. І тут М. в. газу дорівнює M = 22,42 * d.
Для визначення М. в. розчиненої речовини в такому розчиннику, в якому ця речовина не піддається дисоціації або асоціації, найбільш часто вимірюють зниження температури замерзання розчину Δt (див. Кріометрія), що спостерігається при розчиненні аг досліджуваної речовини в bг розчинника: М = (K*a*1000)/(Δt*b), де К - кріометрічна (кріоскопічна) постійна розчинника.
М. в. розчиненої речовини можна також визначити, вимірявши осмотичний тиск розчину (див. Осмотичний тиск). У цьому випадку M = (m*R*T)/p, де m - маса розчиненої речовини в грамах, що міститься в 1 л р-ну, p - осмотичний тиск в атм, T - температура в градусах Кельвіна і R - газова постійна в л*атм/моль*град. Цей метод успішно застосовується визначення М. в. білків, полісахаридів, нуклеїнових та інших високомолекулярних сполук (див.). М. в. білків та інших біополімерів можна визначити методом ультрацентрифугування (див.).
У практиці біохім., клин, та сан.-гіг. лабораторій для виконання різного родурозрахунків широко користуються також одиницею кількості речовини, яка називається молем.
Міль - це кількість речовини, що містить стільки молекул, атомів, іонів, електронів або інших структурних одиниць, скільки міститься атомів в 12 г ізотопу вуглецю 12 C. Число молекул, атомів або інших структурних одиниць, що містяться в одному молі будь-якої речовини, зване числом Авогадро, визначено з великою точністю. Для практичних розрахунків його приймають рівним
6,023*10 23 моль-1.
Маса одного молячи речовини, виражена в грамах, чисельно дорівнює М. ст. речовини, називається мольною масою, або грам-молекулою.
Бібліографія:Білки, за ред. Г. Нейрата та К. Бейлі, пров. з англ., т. 2, с. 276, М., 195 6: Гауровіц Ф. Хімія та функція білків, пров. з англ., М., 1965; Ост-вальд-Лютер - Друкер, Фізикохімічні виміри, пров. з ньому., Ч. 1, €. 294, Л., 1935.
Ми бачимо, що одна гирка значно переважує сім пластмасових кульок. Досвід з вагами дає нам відповідь – більше речовини в залізній гирці, це якщо ми порівнюємо маси – заходи інертності заліза та пластмаси.
А якщо ми порівняємо не маси, а кількість речовини, яка пішла на виготовлення кульок і гирки, фактично кількість частинок, з яких вони складаються? Взявши до рук кульки та гирку, ми побачимо, що гирка фактично губиться на тлі цих кульок. Якби ми вміли рахувати кількість частинок, що входять до заліза та пластмаси, то ми б побачили, що кількість атомів заліза виявиться значною. менше кількостімолекул у всіх пластмасових кульках. Значить речовини більше у пластмасі.
Правильними є обидві відповіді.
Вся справа в тому, що в першому випадку ми порівнювали масу, тобто міру інертності тіл, а в другому ми порівнювали кількість молекул, кількість речовини.
Просту аналогію ми можемо провести з цукром у мірному стаканчику. На питання, скільки там цукру, можна відповісти, подивившись на поділ стаканчика і орієнтовно сказати, скільки там грамів цукру. Можна перерахувати кожну крупинку, що у стаканчике, і відповісти, скільки їх містить стаканчик. Правильними будуть і перша, і друга відповіді. Коли ж зручніше говорити про масу молекул, а коли зручніше говорити про кількість речовини? Саме це є темою уроку: «Маса молекул, Кількість речовини».
У XIX столітті італійський вчений Авогадро встановив цікавий факт: якщо два різні гази, наприклад водень і кисень, знаходяться в однакових судинах, при однакових тисках і температурах, то в кожній посудині буде однакова кількість молекул, хоча маси газів можуть відрізнятися дуже сильно, в нашому прикладі - в 16 разів (мал. ).
Мал. 2. Досвід Авогадро ()
Усе це означає, деякі властивості тіла визначаються саме кількістю молекул, а чи не лише масою.
Що ми розуміємо під терміном «кількість речовини»? Будь-яка речовина складається з молекул, атомів, іонів - отже, має сенс під кількістю речовини розуміти кількість молекул.
Фізична величина, яка визначає кількість молекул в даному тілі, називається кількістю речовини. Позначається грецькою літероюν - ню.
Умовилися за одиницю кількості речовини прийняти таку її кількість, в якій міститься стільки частинок (атомів, молекул), скільки атомів міститься в 0,012 кг (12 г) ізотопу вуглецю з атомною масою 12.
Називається ця одиниця міль.
З цього визначення виходить, що в одному молі будь-якої речовини буде однакова кількість молекул. В одному молі будь-якої речовини міститься 6,02·10 23молекул чи частинок. Ця величина носить назву постійна Авогадро.

Мал. 3. Визначення повного числа молекул ()
Ця формула дозволяє дізнатися повне числомолекул при відомій кількостіречовини.
Маса молекули дуже мала. Визначили це фізики з допомогою так званого мас-спектрографа. Наприклад, значення маси молекули води (рис. 4):

Мал. 4. Визначення маси молекули води ()
Як бачимо, як і, як і випадках із кількістю речовини, порівнювати масу однієї молекули з зразком маси, кілограмом, дуже зручно. Якщо у випадках із кількістю речовини числа величезні, то у випадках із масою молекул числа дуже малі. Саме тому як одиниця виміру маси молекули або атома була обрана особлива позасистемна одиниця - атомна одиниця маси. Ми порівнюватимемо одиницю маси не з еталоном, а з масою молекули якоїсь речовини.
Цією речовиною став найпоширеніший у природі елемент - вуглець, що входить у всі органічні сполуки. Атомна одиниця маси дорівнює:
1 а.е.м. = 1/12 маси вуглецю - 12 (ізотоп, у якому 12 нуклонів)
1 а.е.м. = 1, 66 · 10 -27 кг
Оскільки ми будемо вимірювати масу молекул у атомних одиницяхмаси, то ми приходимо до нової фізичної величини- Відносна молекулярна маса.
Відношення маси молекули (атома) даної речовини до 1/12 маси атома вуглецю називається відносною молекулярною масою(або відносною атомною масою) у разі атомарної будови речовини.
Формули, що виражають це визначення:
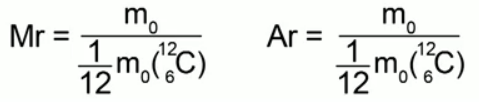
Відносна молекулярна маса - це безрозмірна величина, вона нічого не вимірюється. Нам нічого не заважає, як і раніше, вимірювати маси атомів і молекул у кілограмах тоді, коли нам це буде зручно. З курсу хімії ми знаємо, що: відносна молекулярна маса речовини дорівнює сумі відносних атомних мас елементів, що входять до нього. Наприклад, для води Н 2 Про відносна молекулярна маса буде:
Мr = 1 · 2 + 16 = 18
Сума відносної молекулярної масикисню (16) та двох водень (2.1) дасть 18
Як знайти спільне між масою в кілограмах і кількістю речовини в молях? Це величина – молярна маса.
Молярна маса- це маса одного молячи речовини.
Позначається [М], вимірюється кг/моль.
Молярна маса дорівнює відношенню маси до кількості речовини:
Отримаємо формули, які пов'язують різні властивості молекул.
Для визначення молярної маси хімічного елементазвернемося до періодичної таблиціхімічних елементів Менделєєва - беремо просто атомну масуА (кількість нуклонів необхідного елемента) - це і буде його молярна маса, виражена в г/моль.
Наприклад, для алюмінію (рис. 5):

Мал. 5. Визначення молярної маси речовини ( )
Атомна маса алюмінію дорівнюватиме 27, а молярна маса дорівнюватиме 0,027 кг/моль.
Це тим, що молярна маса вуглецю дорівнює 12 г/моль за визначенням, у той самий час ядро атома вуглецю містить 12 нуклонів - 6 протонів і 6 нейтронів, виходить, кожен нуклон вносить у молярну масу 1 г/моль, тому молярна маса хімічного елемента з атомною масою А дорівнюватиме А г/моль.
Молярна маса речовини, молекула якої складається з кількох атомів, виходить простим підсумовуванням малярних мас, наприклад (рис. 6):

Мал. 6. Молярна маса вуглекислого газу ()
Потрібно бути особливо уважними з молярними масами деяких газів, таких як газоподібний водень, азот, кисень - їхня молекула складається з двох атомів - H 2 , N 2 , O 2 , а гелій, що часто зустрічається в задачах, є одноатомним і має молекулярну масу 4 г/моль, запропоновану таблицею Менделєєва (рис. 7).

Мал. 7. Молярні маси деяких газів ()
В одному молі будь-якої речовини міститься число Авогадро молекул, отже, якщо помножити число Авогадро (число молекул в одному молі) на масу однієї молекули m 0 то ми отримаємо молярну масу речовини, тобто масу одного моля речовини:
М = m 0 · N А
Якщо 25 учнів займаються у класі, площа якого 50 м 2 , то кожного учня припадає 2 м 2 . При переході їх на заняття до спортзалу, площа якого 500 м 2 на кожного учня вже буде припадати 20 м 2 . Число учнів не змінилося, але вони стали рідше розташованими, у цьому випадку кажуть: зменшилася концентрація людей. Так само для молекул вводиться поняття концентрації в молекулярній кінетичній теорії.
Концентрацією(n) називається кількість молекул, що припадають на одиницю об'єму речовини. Вона дорівнює відношенню числа молекул до обсягу:
Формули, що пов'язують концентрацію з іншими характеристиками молекул:

Користуючись цими формулами, ми можемо порівнювати речовини як за кількістю молекул, і за масою.
Ми отримали все необхідне для того, щоб побудувати молекулярно-кінетичну теорію, аніж ми займемося на наступних уроках.
Список литературы
- Тихомирова С.А., Яворський Б.М. Фізика ( базовий рівень) – К.: Мнемозіна, 2012.
- Генденштейн Л.Е., Дік Ю.І. Фізика 10 клас. – К.: Мнемозіна, 2014.
- Кікоїн І.К., Кікоїн А.К. Фізика – 9, Москва, Просвітництво, 1990.
- Lib.podelise.ru ().
- Class-fizika.spb.ru().
- Bolshoyvopros.ru ().
Домашнє завдання
- Дати визначення кількості речовини.
- Назвіть одиницю вимірювання маси молекули чи атома.
- Дати визначення відносної молекулярної маси.


Основні становища МКТ. Маса та розмір молекул. Кількість речовини. Молекулярна фізика
МКТ – це просто!
«Ніщо не існує, крім атомів та порожнього простору…» - Демокріт
"Будь-яке тіло може ділитися до нескінченності" - Аристотель
Основні положення молекулярно-кінетичної теорії (МКТ)
Мета МКТ- це пояснення будови та властивостей різних макроскопічних тіл і теплових явищ, які протікають, рухом і взаємодією частинок, з яких складаються тіла.
Макроскопічні тіла- це великі тіла, Що складаються з великої кількості молекул.
Теплові явища- явища, пов'язані з нагріванням та охолодженням тіл.
Основні твердження МКТ
1. Речовина складається з частинок (молекул та атомів).
2. Між частинками є проміжки.
3. Частинки безладно і безперервно рухаються.
4. Частинки взаємодіють один з одним (притягуються та відштовхуються).
Підтвердження МКТ:
1. експериментальне
- механічне дроблення речовини; розчинення речовини у воді; стиснення та розширення газів; випаровування; деформація тіл; дифузія; досвід Бригмана: в посудину заливається масло, зверху на масло тисне поршень, при тиску 10 000 атм масло починає просочуватися крізь стінки сталевої судини;
Дифузія; броунівський рух частинок у рідині під ударами молекул;
Погана стисливість твердих і рідких тіл; значні зусилля для розриву твердих тіл; злиття крапель рідини;
2. пряме
- Фотографування, визначення розмірів частинок. 
Броунівський рух
Броунівський рух – це тепловий рух зважених частинок у рідині (або газі).
Броунівський рух став доказом безперервного та хаотичного (теплового) руху молекул речовини.
- відкрито англійським ботаніком Р. Броуном у 1827 р.
- дано теоретичне пояснення на основі МКТ А. Ейнштейном у 1905 р.
- Експериментально підтверджено французьким фізиком Ж. Перреном.
Маса та розміри молекул
Розміри частинок
Діаметр будь-якого атома становить близько див.

Число молекул у речовині
де V – обсяг речовини, Vo – обсяг однієї молекули
Маса однієї молекули
де m - маса речовини,
N - число молекул у речовині
Одиниця виміру маси в СІ: [m] = 1 кг
У атомної фізикимасу зазвичай вимірюють атомних одиницях маси (а.е.м.).
Умовно прийнято рахувати за 1 а.е.м. :
Відносна молекулярна маса речовини
Для зручності розрахунків запроваджується величина - відносна молекулярна маса речовини.
Масу молекули будь-якої речовини можна порівняти з 1/12 маси молекули вуглецю.
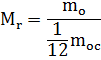
де чисельник – це маса молекули, а знаменник – 1/12 маси атома вуглецю
Це величина безрозмірна, тобто. не має одиниць виміру
Відносна атомна маса хімічного елемента
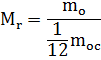
де чисельник – це маса атома, а знаменник – 1/12 маси атома вуглецю
Розмір безрозмірна, тобто. не має одиниць виміру
Відносна атомна маса кожного хімічного елемента наведена в таблиці Менделєєва.
Інший спосіб визначення відносної молекулярної маси речовини
Відносна молекулярна маса речовини дорівнює сумі відносних атомних мас хімічних елементів, що входять до складу молекули речовини.
Відносну атомну масу будь-якого хімічного елемента беремо з таблиці Менделєєва!)
Кількість речовини
Кількість речовини (ν) визначає відносне число молекул у тілі.
де N – число молекул у тілі, а Na – постійна Авогадро
Одиниця виміру кількості речовини у системі СІ: [ν]= 1 моль
1 моль- це кількість речовини, в якій міститься стільки молекул (або атомів), скільки атомів міститься у вуглеці масою 0,012 кг.
Запам'ятай!
В 1 молі будь-якої речовини міститься однакове числоатомів чи молекул!
Але!
Однакові кількості речовини для різних речовинмають різну масу!
Постійна Авогадро
Число атомів в 1 молі будь-якої речовини називають числом Авогадро або постійною Авогадро:
Молярна маса
Молярна маса (M) – це маса речовини, взятої в одному молі, або інакше – це маса одного молячи речовини.
Маса молекули
- постійна Авогадро
Одиниця виміру молярної маси: [M]=1 кг/моль.
Формули для вирішення завдань
Ці формули виходять у результаті підстановки вищерозглянутих формул.
Маса будь-якої кількості речовини
На законі Авогадро засновано найважливіший метод визначення молекулярних ваг газоподібних речовин. Але перш ніж говорити про цей метод, слід нагадати, в яких одиницях виражаються молекулярні та атомні ваги.
При обчислення атомних ваг спочатку приймали за одиницю вага атома водню, як найлегшого елемента, і по відношенню до нього обчислювали атомні ваги інших елементів. Але так як для більшості елементів атомні ваги визначаються з них кисневих сполук, фактично обчислення проводилися по відношенню до атомної ваги кисню, який вважався рівним 16. Ставлення між атомними вагами кисню та водню приймалося рівним 16:1. Згодом більше точні дослідженняпоказали, що це відношення дорівнює 15,88: 1 або 16: 1,008. Отже, якщо вважати атомну вагу водню дорівнює 1, атомна вага кисню буде 15,88. З практичних міркувань було вирішено залишити для кисню атомну вагу 16, прийнявши для водню атомну вагу 1,008.
Таким чином, в даний час одиницею ваги атомів є 1/16 частина ваги атома кисню. Ця одиниця отримала назву «кисневої одиниці». Вага атома воднюдорівнює 1,008 кисневої одиниці, вага атома сірки - 32,06 кисневої одиниці і т.д.
Атомним вагою елемента називається вага його атома, вирідружинний в кисневих одиницях.
Оскільки вага молекули будь-якого дорівнює сумітерезів утворюють її атомів, зрозуміло, що молекулярні ваги повинні виражатися в тих самих одиницях, що і атомні ваги. Наприклад, вага молекули водню, що складається з двох атомів, дорівнює 2016 кисневої одиниці; вага молекули кисню, що також складається з двох атомів, дорівнює 32 кисневим одиницям; вага молекули води, що містить два атоми водню та один атом кисню, дорівнює 16 + 2,016 = 18,016 кисневої одиниці і т.д.
Молекулярним вагою простого або складного назиється вага його молекули, виражений в кисневих одиницях.
Подивимося тепер, як визначаються молекулярні ваги газоподібних речовин.
За законом Авогадро, рівні обсяги газів, взятих при однаковому тиску та однаковій температурі, містять рівне числомолекул. Звідси випливає, що ваги рівних обсягівдвох газів повинні ставитись один до одного, як їх молекулярні ваги.
Візьмемо, наприклад, по одному літру двох різних газів. Нехай у кожному з них міститься по N молекул. Позначимо вагу літра першого газу через g, а другого через g 1 . Молекулярні ваги газів позначимо відповідно через М та M 1 . Так як вага літра газу дорівнює сумі ваг молекул, що знаходяться в ньому,
g = N M і g 1 =N M 1 Розділивши першу рівність на другу, отримаємо:(1)
Відношення ваги даного газу до ваги того ж обсягу іншого газу, взятого при тій же температурі і тому ж тиску, називається щільністю першого газу по другому. Наприклад, 1 лвуглекислого газу важить 1,98 г, а 1 л водню за тих самих умов 0,09 г, звідки щільність вуглекислого газу водню буде 1,98:0,09 = 22.
Позначивши густину газу буквою D, перепишемо рівняння (1):
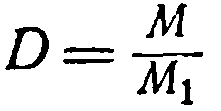
звідки
M = D M 1 (2)
Молекулярний вага газу дорівнює його щільності по відношенню до іншого газу, помноженою на молекулярний вага другого газу.
Дуже часто густини різних газів визначають по відношенню до водню як найлегшого з усіх тазів. Так як молекулярна вага самого водню дорівнює 2,016, то в цьому випадку формула для розрахунку молекулярних ваг набуває вигляду:
М = 2,016 D
або, якщо округлити молекулярну вагу водню до 2:
М = 2 D
Обчислюючи, наприклад, за цією формулою молекулярна вага вуглекислого газу, щільність якого водню, як зазначено вище, дорівнює 22, знаходимо:
М = 2 22 = 44
Нерідко також обчислюють молекулярну вагу газу, виходячи з його густини повітрям. Хоча повітря є сумішшю кількох газів, все ж таки ми можемо говорити про середню молекулярну вагу повітря, яка визначається з щільності повітря по водню. Знайдена таким шляхом молекулярна вага повітря дорівнює 29.
Позначивши щільність досліджуваного газу повітрям через D 1 отримаємо наступну формулудля обчислення молекулярних ваг:
М = 29 D 1
Число 29 корисно запам'ятати, тому що його часто застосовують при розрахунках.
Практично визначення молекулярної ваги зводиться до вимірювання ваги та обсягу деякої кількості досліджуваного газу та подальшого обчислення його щільності, після чого молекулярна вага знаходять прямо за формулою. Щільність газу може бути обчислена стосовно будь-якого іншого газу, молекулярна вага якого і вага одиниці об'єму відомі. Але так як у довідниках вказуються ваги газів за нормальних умов, а на досвіді зазвичай доводиться вимірювати вагу та об'єм досліджуваного газу за інших умов, то для обчислення щільності газу потрібно попередньо привести обмірюваний об'єм газу до нормальних умов (0° і 760 мм тиску).
Приведення до нормальних умов проводиться на підставі рівняння, що поєднує газові закониБойля-Маріотта та Геї-Люссака:

де рта υ - відповідно тиск та обсяг газу в умовах досвіду; Р 0 - нормальний тиск; υ 0 - обсяг газу за нормальних умов; Т - абсолютна температурагазу.
