II.1. Konformasjoner (rotasjonsisomerisme)
Overgangen fra det enkleste organiske hydrokarbonet, metan, til dets nærmeste homolog, etan, byr på problemer med romlig struktur, for løsningen som det ikke er nok å kjenne til parameterne som er diskutert i avsnittet. Faktisk, uten å endre verken bindingsvinkler eller bindingslengder, kan man forestille seg mange geometriske former av etanmolekylet, som skiller seg fra hverandre i den gjensidige rotasjonen av karbontetraedre rundt C-C-bindingen som forbinder dem. Som et resultat av denne rotasjonen, roterende isomerer (konformatorer) . Energien til forskjellige konformere er ikke den samme, men energibarrieren som skiller de forskjellige rotasjonsisomerene for de fleste organiske forbindelser liten. Derfor, når normale forhold Som regel er det umulig å fikse molekyler i en strengt definert konformasjon: vanligvis eksisterer flere rotasjonsformer som lett forvandles til hverandre i likevekt.
Metodene for grafisk fremstilling av konformasjoner og deres nomenklatur er som følger. La oss starte med etanmolekylet. For det kan man forutse eksistensen av to konformasjoner som er maksimalt forskjellige i energi. De er vist nedenfor som perspektivprojeksjoner (1) ("sagbruksgeiter"), sidefremspring (2) og Newmans formler (3).
I perspektivprojeksjonen (1a, 1b) må C-C-forbindelsen tenkes å gå i det fjerne; Karbonatomet til venstre er nær observatøren, og karbonatomet til høyre er lenger unna ham.
I sideprojeksjonen (2a, 2b) ligger fire H-atomer i tegningens plan; Karbonatomene strekker seg faktisk noe ut av dette planet, men de anses vanligvis forenklet å også ligge i plan på tegningen. "Fete" kileformede bindinger ved fortykningen av kilen indikerer en utgang fra planet mot observatøren av atomet som fortykkelsen vender mot. Stiplede kileformede forbindelser markerer avstanden fra observatøren.
I Newman-projeksjonen (3a, 3b) betraktes molekylet langs C-C-bindingen (i retningen angitt av pilen i formlene 1a, b). Tre linjer som divergerer i en vinkel på 120° fra sentrum av sirkelen indikerer bindingene til karbonatomet nærmest observatøren; linjene som "stikker ut" bak sirkelen er bindingene til det fjerne karbonatomet.
Konformasjonen vist til venstre kalles tilslørt : Dette navnet minner oss om at hydrogenatomene til begge CH 3-gruppene er motsatte hverandre. Den formørkede konformasjonen har økt indre energi og er derfor ugunstig. Konformasjonen vist til høyre kalles hemmet , noe som antyder at fri rotasjon rundt C-C-bindingen er "hemmet" i denne posisjonen, dvs. molekylet eksisterer hovedsakelig i denne konformasjonen.
Minimumsenergien som kreves for å rotere et molekyl fullstendig rundt en bestemt binding kalles rotasjonsbarriere for denne forbindelsen. Rotasjonsbarrieren i et molekyl som etan kan uttrykkes i form av endringen potensiell energi molekyler som funksjoner av endring dihedral (torsjons) vinkel systemer. Den dihedrale vinkelen (betegnet tau) er avbildet i figuren nedenfor:

Energiprofilen for rotasjon rundt C-C-bindingen i etan er vist i følgende figur. Rotasjonen av det "tilbake" karbonatomet er avbildet av endringen dihedral vinkel mellom de to viste hydrogenatomene. For enkelhets skyld er de resterende hydrogenatomene utelatt. Rotasjonsbarrieren som skiller de to formene for etan er bare 3 kcal/mol (12,6 kJ/mol). Minimumene til den potensielle energikurven tilsvarer inhiberte konformasjoner, og maksimaene tilsvarer okkluderte konformasjoner. Siden energien til noen molekylære kollisjoner ved romtemperatur kan nå 20 kcal/mol (ca. 80 kJ/mol), kan denne barrieren på 12,6 kJ/mol lett overvinnes og rotasjon i etan anses som fri.
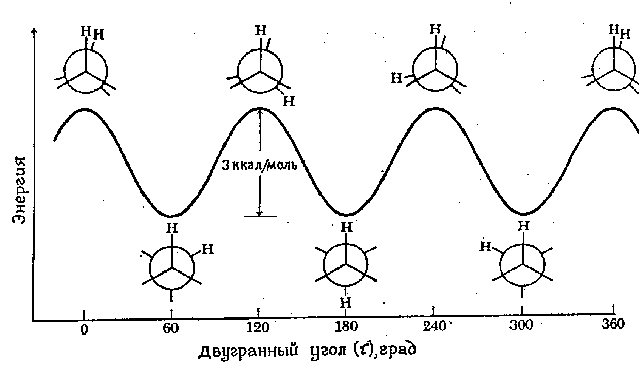
Vi understreker at hvert punkt på den potensielle energikurven tilsvarer en spesifikk konformasjon. Punktene som tilsvarer minimaene tilsvarer konformasjonsisomerer, det vil si de dominerende komponentene i en blanding av alle mulige konformasjoner .
Etter hvert som molekylet blir mer komplekst, øker antallet mulige konformasjoner som varierer markant i energi. Ja, for n-butan kan avbildes i seks konformasjoner, forskjellige relativ posisjon CH 3 grupper, dvs. rotasjon rundt den sentrale forbindelsen C-C. Nedenfor er konformasjonene til n-butan avbildet som Newman-projeksjoner. Konformasjonene vist til venstre (skyggelagt) er energimessig ugunstige, kun hemmete er praktisk talt realisert.
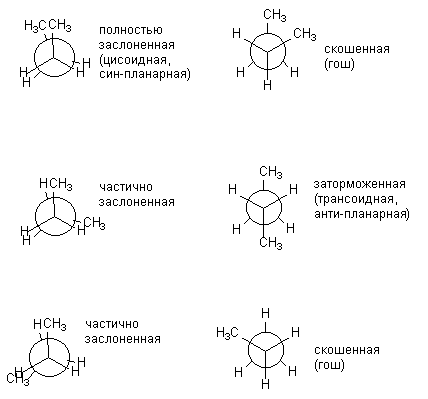
De forskjellige formørkede og hemme konformasjonene av butan er ikke de samme i energi. De tilsvarende energiene til alle konformasjoner dannet under rotasjon rundt den sentrale C-C-bindingen er presentert nedenfor:
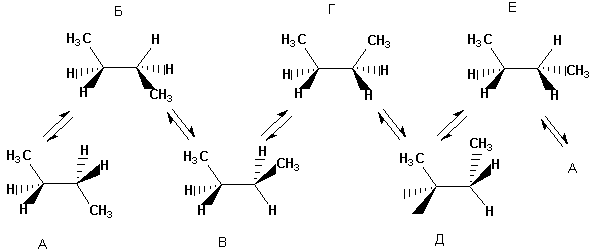


Etter hvert som et molekyl blir mer komplekst, øker antallet mulige konformasjoner.
Så konformasjoner er forskjellige ikke-identiske romlige former molekyler som har en bestemt konfigurasjon. Konformatorer er stereoisomere strukturer som er i mobil likevekt og er i stand til interkonvertering ved å rotere rundt enkle bindinger.
Noen ganger blir barrieren for slike transformasjoner høy nok til å skille stereoisomere former (eksempel: optisk aktive bifenyler;). I slike tilfeller snakker de ikke lenger om konformere, men om å faktisk eksistere stereoisomerer .
II.2. Geometrisk isomeri
En viktig konsekvens av stivheten til en dobbeltbinding (fravær av rotasjon rundt den) er eksistensen geometriske isomerer . De vanligste av dem er cis-trans isomerer forbindelser av etylenserien som inneholder ulik substituenter på umettede atomer. Det enkleste eksemplet er isomerene av buten-2.

Geometriske isomerer har det samme kjemisk struktur(samme rekkefølge kjemisk forbindelse), forskjellig i det romlige arrangementet av atomer, i henhold til konfigurasjoner . Denne forskjellen skaper en forskjell i fysisk (så vel som kjemiske egenskaper). Geometriske isomerer, i motsetning til konformere, kan isoleres i ren form og eksisterer som individuelle, stabile stoffer. Deres gjensidige transformasjon krever vanligvis energi i størrelsesorden 125-170 kJ/mol (30-40 kcal/mol). Denne energien kan formidles ved oppvarming eller bestråling.
I de enkleste tilfellene gir ikke nomenklaturen til geometriske isomerer noen vanskeligheter: cis- former er geometriske isomerer der identiske substituenter ligger på samme side av pi-bindingsplanet, transe- isomerer har identiske substituenter på forskjellige sider fra pi-bindingsplanet. I mer komplekse tilfeller brukes det Z,E-nomenklatur . Dens hovedprinsipp: å indikere konfigurasjonen indikerer cis-(Z, fra tysk Zusammen - sammen) eller transe-(E, fra tysk Entgegen - motsatt) plassering senior varamedlemmer med en dobbeltbinding.
I Z,E-systemet regnes substituenter med et høyere atomnummer som senior. Hvis atomene direkte assosiert med umettede karboner er de samme, går de videre til "andre lag", om nødvendig - til "tredje lag", etc.
La oss vurdere bruken av reglene i Z,E-nomenklaturen ved å bruke to eksempler.

| Jeg | II |
La oss starte med formel I, der alt løses av atomene i det "første laget". Etter å ha ordnet atomnummeret deres, finner vi at seniorsubstituentene til hvert par (brom i den øvre delen av formelen og nitrogen i den nedre delen) er i transe-posisjon, derav den stereokjemiske betegnelsen E:
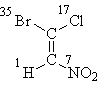 E-1-brom-1-klor-2-nitroeten
E-1-brom-1-klor-2-nitroeten
For å bestemme den stereokjemiske betegnelsen på struktur II, er det nødvendig å se etter forskjeller i de "høyere lagene". I det første laget er gruppene CH 3, C 2 H 5, C 3 H 7 ikke forskjellige. I det andre laget har CH-gruppen 3 sum atomtall er lik tre (tre hydrogenatomer), gruppene C 2 H 5 og C 3 H 7 har 8 hver. Dette betyr at CH 3-gruppen ikke regnes - den er yngre enn de to andre. Dermed er seniorgruppene C 2 H 5 og C 3 H 7, den er inne cis-posisjon; stereokjemisk betegnelse Z.
 Z-3-metylhepten-3
Z-3-metylhepten-3
Hvis det var nødvendig å bestemme hvilken gruppe som er eldre - C 2 H 5 eller C 3 H 7, ville man måtte gå til atomene i det "tredje laget" ville summen av atomnummer i dette laget for begge grupper være lik til henholdsvis 3 og 8, dvs. C3H7 er eldre enn C2H5. I mer komplekse tilfeller av å bestemme forrang, må tilleggsbetingelser tas i betraktning, for eksempel: et atom forbundet med en dobbeltbinding telles to ganger, forbundet med en trippelbinding - tre ganger; Av isotopene er den tyngre eldre (deuterium er eldre enn hydrogen) og noen andre.
Merk at notasjonen Z Ikke er synonymer cis- betegnelser, som betegnelser E, samsvarer ikke alltid med plasseringen transe-, For eksempel:

cis- 1,2-diklorpropen-1 cis- 1,2-diklor-1-brompropen-1
Z-1,2-diklorpropen-1 E-1,2-diklor-1-brompropen-1
Kontrolloppgaver
1. Bombicol - et feromon (seksuell lokkemiddel) av silkeormen - er E-10-Z-12-heksadekadienol-1. Bilde ham strukturformel.
2. Nevn følgende forbindelser ved å bruke Z,E-nomenklaturen:

II.3. Optisk isomerisme (enantiomerisme)
Blant organiske forbindelser er det stoffer som kan rotere lysets polariseringsplan. Dette fenomenet kalles optisk aktivitet, og de tilsvarende stoffene er optisk aktiv . Optisk aktive stoffer forekommer i par optiske antipoder - isomerer, hvis fysiske og kjemiske egenskaper er identiske under normale forhold, med unntak av en ting - tegnet på rotasjon av polariseringsplanet. (Hvis en av de optiske antipodene har for eksempel en spesifikk rotasjon [NOTE 1] +20 o, så har den andre en spesifikk rotasjon på -20 o).
II.4. Projeksjonsformler
For å konvensjonelt skildre et asymmetrisk atom på et plan, bruk projeksjonsformler til E. Fisher . De oppnås ved å projisere på et plan atomene som det asymmetriske atomet er knyttet til. I dette tilfellet er det asymmetriske atomet i seg selv vanligvis utelatt, og beholder bare de kryssende linjene og substituentsymbolene. For å huske det romlige arrangementet av substituenter, er en brutt vertikal linje ofte bevart i projeksjonsformler (de øvre og nedre substituentene fjernes utenfor planen på tegningen), men dette gjøres ofte ikke. Nedenfor er ulike måter registrere projeksjonsformelen som tilsvarer venstre modell i forrige figur:

Her er noen eksempler på projeksjonsformler:

(+)-alanin (-)-butanol (+)-glyceraldehyd
Navnene på stoffene indikerer deres rotasjonstegn: dette betyr for eksempel at den venstrehendte antipoden av butanol-2 har romlig konfigurasjon , uttrykt nøyaktig ved formelen ovenfor, og speilbildet tilsvarer høyreroterende butanol-2. Konfigurasjonsdefinisjon optiske antipoder utføres eksperimentelt [NOTE 3].
I prinsippet kan hver optisk antipode avbildes med tolv (!) forskjellige projeksjonsformler – avhengig av hvordan modellen er plassert under projeksjonen og fra hvilken side vi ser på den. For å standardisere projeksjonsformler er det innført visse regler for å skrive dem. Dermed er hovedfunksjonen, hvis den er i enden av kjeden, vanligvis plassert øverst, hovedkjeden er avbildet vertikalt.
For å sammenligne "ikke-standard" skriftlige projeksjonsformler, må du vite følgende regler transformasjoner av projeksjonsformler.
1. Formler kan roteres 180° i tegneplanet uten å endre deres stereokjemiske betydning:

2. To (eller et hvilket som helst partall) omorganiseringer av substituenter på ett asymmetrisk atom endrer ikke den stereokjemiske betydningen av formelen:

3. En (eller et hvilket som helst oddetall) permutasjoner av substituenter ved det asymmetriske senteret fører til formelen for den optiske antipoden:

4. En 90° rotasjon i tegneplanet gjør formelen til en antipodeal, med mindre betingelsen for plasseringen av substituentene i forhold til tegneplanet samtidig endres, dvs. ikke tenk på at nå er de laterale substituentene plassert bak tegneplanet, og de øvre og nedre er foran det. Hvis du bruker en formel med en stiplet linje, vil den endrede retningen til den stiplede linjen direkte minne deg om dette:

5. I stedet for permutasjoner kan projeksjonsformler transformeres ved å rotere hvilke som helst tre substituenter med eller mot klokken; den fjerde substituenten endrer ikke sin posisjon (denne operasjonen tilsvarer to permutasjoner):

6. Projeksjonsformler kan ikke utledes fra planen til tegningen (dvs. du kan for eksempel ikke undersøke dem "i lyset" fra baksiden av papiret - i dette tilfellet vil den stereokjemiske betydningen av formelen endres).
II.5. Racekamerater
Hvis formelen til et stoff inneholder et asymmetrisk atom, betyr ikke dette at et slikt stoff vil ha optisk aktivitet. Hvis et asymmetrisk senter oppstår under en normal reaksjon (substitusjon i CH 2-gruppen, addisjon ved en dobbeltbinding, etc.), så er sannsynligheten for å skape begge antipodekonfigurasjonene den samme. Derfor, til tross for asymmetrien til hvert enkelt molekyl, viser det seg at det resulterende stoffet er optisk inaktivt. Denne typen optisk inaktiv modifikasjon, som består av en lik mengde av begge antipoder, kalles rasekamerater [NOTE 4] .
II.6. Diastereomerisme
Forbindelser med flere asymmetriske atomer har viktige egenskaper som skiller dem fra de tidligere diskuterte enklere optisk aktive stoffene med ett asymmetrisenter.
La oss anta at i et molekyl av et bestemt stoff er det to asymmetriske atomer; La oss kalle dem betinget A og B. Det er lett å se at molekyler med følgende kombinasjoner er mulige:
Molekylene 1 og 2 er et par optiske antipoder; det samme gjelder for et molekylpar 3 og 4. Hvis vi sammenligner molekyler fra hverandre med hverandre forskjellige par antipoder - 1 og 3, 1 og 4, 2 og 3, 2 og 4, så vil vi se at de oppførte parene ikke er optiske antipoder: konfigurasjonen av ett asymmetrisk atom er den samme, konfigurasjonen til den andre er ikke den samme . Disse er alle par diastereomerer , dvs. romlige isomerer, Ikke utgjør optiske antipoder med hverandre.
Diastereomerer skiller seg ikke bare fra hverandre i optisk rotasjon, men også i alle andre fysiske konstanter: de har forskjellige smelte- og kokepunkter, forskjellige løseligheter osv. Forskjeller i egenskapene til diastereomerer er ofte ikke mindre enn forskjellene i egenskaper mellom strukturelle isomerer .
Et eksempel på en forbindelse av denne typen er klormalsyre

Dens stereoisomere former har følgende projeksjonsformler:
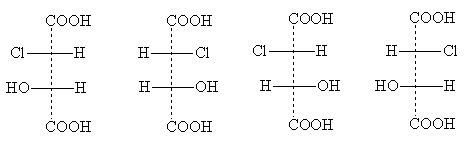
erytro- skjemaer treo- skjemaer
Titler erythro- Og trio- kommer fra navnene på karbohydratene erythrose og threose. Disse navnene brukes til å indikere den relative posisjonen til substituenter i forbindelser med to asymmetriske atomer: erythro -isomerer de er de for hvilke to identiske laterale substituenter vises i standard projeksjonsformel på den ene siden (høyre eller venstre); trio -isomerer har identiske laterale substituenter på forskjellige sider av projeksjonsformelen [NOTE 5].
To erytro- isomerer er et par optiske antipoder når de blandes, dannes et racemat. Et par optiske isomerer er og treo- former; de produserer også et racemat når de blandes, som skiller seg i egenskaper fra racematet erytro- skjemaer. Dermed er det totalt fire optisk aktive isomerer av klormalsyre og to racemater.
Med en ytterligere økning i antall asymmetriske sentre øker antallet romlige isomerer, og hvert nytt asymmetrisk senter dobler antall isomerer. Det bestemmes av formelen 2n, hvor n er antall asymmetriske sentre.
Antall stereoisomerer kan reduseres på grunn av delvis symmetri som vises i noen strukturer. Et eksempel er vinsyre, hvor antallet individuelle stereoisomerer reduseres til tre. Deres projeksjonsformler:
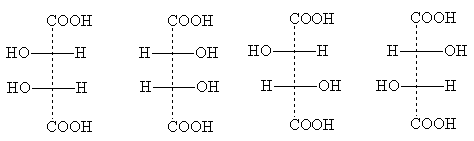
Formel I er identisk med formel Ia: den forvandles til den når den roteres 180° i tegningens plan og representerer derfor ikke en ny stereoisomer. Dette er en optisk inaktiv modifikasjon - meso form . I motsetning til et racemat, som kan deles i optisk antipoder, meso- formen er fundamentalt uforgjengelig: hvert av dets molekyler har ett asymmetrisk senter av en konfigurasjon, og det andre - det motsatte. Som et resultat oppstår intramolekylær kompensasjon av rotasjonen av begge asymmetriske sentrene.
Meso- Alle optisk aktive stoffer har former med flere identiske (dvs. assosiert med identiske substituenter) asymmetriske sentre [NOTE 6]. Projeksjonsformler meso- former kan alltid gjenkjennes av det faktum at de alltid kan deles av en horisontal linje i to halvdeler, som, når de er skrevet på papir, er formelt identiske, men i virkeligheten er speilet:

Formlene II og III viser de optiske antipodene til vinsyre; når de blandes, dannes et optisk inaktivt racemat - druesyre.
II.7. Nomenklatur for optiske isomerer
Det enkleste, eldste, men fortsatt i bruk systemet for nomenklatur av optiske antipoder er basert på sammenligning av projeksjonsformelen til den kalte antipoden med projeksjonsformelen til et visst standardstoff valgt som "nøkkel". Så for alfahydroksysyrer og alfaaminosyrer er nøkkelen øverste del deres projeksjonsformel (i standardnotasjon):

L- hydroksysyrer (X = OH) D- hydroksysyrer (X = OH)
L-aminosyrer (X = NH 2) D- aminosyrer (X = NH 2)
Konfigurasjonen av alle alfa-hydroksysyrer som har en hydroksylgruppe til venstre i den standard skrevne Fischer-projeksjonsformelen er indikert med tegnet L; hvis hydroksylen er plassert i projeksjonsformelen til høyre - tegn D[NOTE 7] .
Nøkkelen til å angi konfigurasjonen av sukker er glyseraldehyd:

L-(-)-glyceraldehyd D-(+)-glyceraldehyd
I sukkermolekyler betegnelsen D- eller L- refererer til konfigurasjon Nedre asymmetrisk senter.
System D-,L- betegnelsen har betydelige ulemper: for det første betegnelsen D- eller L- indikerer konfigurasjonen av bare ett asymmetrisk atom for det andre, for noen forbindelser oppnås forskjellige symboler, avhengig av om glyceraldehyd- eller hydroksysyrenøkkelen tas som nøkkelen, for eksempel:

Disse manglene ved nøkkelsystemet begrenser bruken for øyeblikket til tre klasser av optisk aktive stoffer: sukker, aminosyrer og hydroksysyrer. Designet for generell bruk "R,S-system Kahn, Ingold og Prelog [NOTE 8].
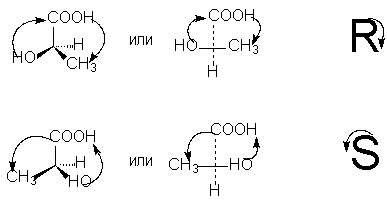
For å bestemme R- eller S-konfigurasjonen til den optiske antipoden, er det nødvendig å arrangere tetraederet av substituenter rundt det asymmetriske karbonatomet på en slik måte at den laveste substituenten (vanligvis hydrogen) har retningen "bort fra observatøren". Så hvis bevegelsen under overgangen i en sirkel av de tre gjenværende substituentene fra den eldste til gjennomsnittet i ansiennitet og deretter til den yngste skjer mot klokken - Dette R -isomer (assosiert med samme håndbevegelse når du skriver bokstaven R), hvis med urviseren - Dette S- isomer (assosiert med samme håndbevegelse når du skriver bokstaven S).
For å bestemme ansienniteten til substituenter på et asymmetrisk atom, brukes reglene for beregning av atomtall, som vi allerede har vurdert i forbindelse med Z,E-nomenklaturen for geometriske isomerer (se).
For å velge R, S-notasjoner i henhold til projeksjonsformelen, er det nødvendig, ved et jevnt antall permutasjoner (som, som vi vet, ikke endrer den stereokjemiske betydningen av formelen), å ordne substituentene slik at de yngste av dem (vanligvis hydrogen) er nederst i projeksjonsformelen. Da tilsvarer ansienniteten til de resterende tre substituentene, som faller med klokken, betegnelsen R, mot klokken - betegnelsen S [NOTE 9]:
Kontrolloppgaver
3. Bestem konfigurasjonen av det asymmetriske senteret av askorbinsyre (vitamin C) (ved R,S-nomenklatur og sammenlignet med glyceraldehyd):

4. Alkaloidet efedrin har formelen:
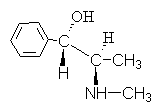
Gi et navn for denne forbindelsen ved å bruke R,S- nomenklatur.
5. Cystein - en ikke-essensiell aminosyre involvert i reguleringen av metabolske prosesser, er L-1-amino-2-merkaptopropionsyre. Tegn dens strukturelle formel og gi dens navn R,S- nomenklatur.
6. Levomycetin (bredspektret antibiotikum) er D(-)-treo-l-p-nitrofenyl-2-dikloracetylamino-propandiol-1,3. Tegn strukturen i form av Fischer-projeksjonsformelen.
7. Synestrol er et syntetisk østrogen medikament med en ikke-steroid struktur. Gi navnet som indikerer dens stereokjemiske konfigurasjon:

II.8. Stereokjemi av sykliske forbindelser
Når en kjede av karbonatomer lukkes inn i en plan syklus, tvinges bindingsvinklene til karbonatomene til å avvike fra deres normale tetraedriske verdi, og størrelsen på dette avviket avhenger av antall atomer i syklusen. Jo større avviksvinkelen til valensbindingene er, jo større er energireserven til molekylet, jo mindre stabil er syklusen. Imidlertid har bare et tre-leddet syklisk hydrokarbon (cyklopropan) en flat struktur; Med utgangspunkt i syklobutan har sykloalkanmolekyler en ikke-plan struktur, noe som reduserer "spenningen" i systemet.
Sykloheksanmolekylet kan eksistere i flere konformasjoner der de "normale" bindingsvinklene beholdes (for enkelhets skyld er bare karbonatomer vist):
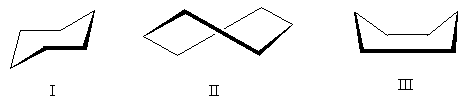
Den mest energimessig gunstige konformasjonen er konformasjon I - den såkalte formen "lenestoler". Konformasjon II - "vri" - inntar en mellomposisjon: den er mindre gunstig enn stolkonformasjonen (på grunn av tilstedeværelsen av skjulte hydrogenatomer i den), men mer gunstig enn konformasjonen III. Konformasjon III - "bad" - den minst gunstige av de tre på grunn av den betydelige frastøtingen av oppadrettede hydrogenatomer.
Ved å vurdere de tolv CH-bindingene i stolkonformasjonen kan vi dele dem inn i to grupper: seks aksial koblinger rettet vekselvis opp og ned, og seks ekvatorial koblinger rettet til sidene. I monosubstituerte cykloheksaner kan substituenten være i enten ekvatorial eller aksial posisjon. Disse to konformasjonene er vanligvis i likevekt og går raskt over i hverandre gjennom vrikonformasjonen:

Ekvatorialkonformasjonen (e) er vanligvis dårligere i energi og derfor mer fordelaktig enn den aksiale konformasjonen (a).
Når substituenter (sidekjeder) vises i ringer, i tillegg til problemet med konformasjonen av selve ringen, møter forskeren også problemer substituentkonfigurasjoner : således, i tilfelle av nærvær av to identiske eller forskjellige substituenter, cis-trans-isomer. Merk at snakker om cis-trans-konfigurasjon av substituenter gir mening bare når den brukes på mettede små og mellomstore ringer (opptil C 8): i ringer med et stort antall mobiliteten til lenker er allerede i ferd med å bli så betydelig at diskusjoner om cis- eller transe– stillingene til varamedlemmene mister sin mening.
Så, klassisk eksempel er stereoisomere cyklopropan-1,2-dikarboksylsyrer. Det er to stereoisomere syrer: en av dem med et smp. 139 o C, er i stand til å danne syklisk anhydrid og er derfor, cis-isomer. En annen stereoisomer syre, smp. 175 o C, danner ikke syklisk anhydrid; Dette transe-isomer [NOTE 10]:
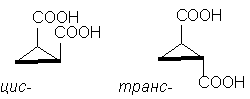
To stereoisomere 1,2,2-trimetylcyklopentan-1,3-dikarboksylsyrer er i samme forhold til hverandre. En av dem, kamfersyre, smp. 187 o C, danner et anhydrid og er derfor cis-isomer. Den andre er isokamforsyre, smp. 171 o C, - danner ikke anhydrid, dette transe-isomer:

cis-trans-
Selv om cyklopentanmolekylet egentlig ikke er plant, er det for klarhetens skyld praktisk å avbilde det i en flat form, som i figuren ovenfor, med tanke på at i cis- isomeren har to substituenter på den ene siden av syklusen , og i transe-isomer - på motsatte sider av syklusen .
Disubstituerte cykloheksanderivater kan også eksistere i cis- eller transform:
Karbonatomet har ikke monopol på dannelsen av kirale sentre i molekylene til organiske forbindelser. Sentrum av chiralitet kan også være silisium, tinn og tetrakovalente nitrogenatomer i kvartære ammoniumsalter og tertiære aminoksider:

I disse forbindelsene har asymmetrisenteret en tetraedrisk konfigurasjon, som det asymmetriske karbonatomet. Det er imidlertid også forbindelser med en annen romlig struktur av det kirale senteret.
Kirale sentre dannet av atomer av trivalent nitrogen, fosfor, arsen, antimon og svovel har en pyramideformet konfigurasjon. I prinsippet kan asymmetrisenteret betraktes som tetraedrisk hvis det ensomme elektronparet til heteroatomet tas som den fjerde substituenten:

Optisk aktivitet kan også forekomme uten kiralt senter, på grunn av kiraliteten til strukturen til hele molekylet som helhet ( molekylær kiralitet eller molekylær asymmetri ). Mest typiske eksempler er tilgjengelighet kiral akse eller chiralt plan .
Den kirale aksen vises for eksempel i allener som inneholder forskjellige substituenter ved sp 2-hybride karbonatomer. Det er lett å se at forbindelsene nedenfor er speilbilder, og derfor optiske antipoder:

Kiralitetsaksen er vist i figurene med en pil.
En annen klasse av forbindelser som har en chiral akse er optisk aktive bifenyler, som har orto-posisjoner har voluminøse substituenter som gjør det vanskelig å rotere fritt rundt S-S tilkoblinger koble til arene-ringene:

Kiralt fly preget av at det kan skilles mellom «topp» og «bunn», samt «høyre» og «venstre» side. Et eksempel på forbindelser med et chiralt plan er det optisk aktive transe- cyklookten og et optisk aktivt ferrocenderivat.
Isomerer er forbindelser som har samme kvalitative og kvantitative sammensetning (molekylformel), men som skiller seg fra hverandre i sekvensen av bindinger av atomer eller deres arrangement i rommet Siden strukturen til disse forbindelsene er forskjellig, er de kjemiske eller fysiske egenskapene til isomerene er forskjellig.
Typer isomeri: strukturelle (strukturelle isomerer) og stereoisomerisme (romlig).
Strukturell isomerisme kan være tre typer:
– isomerisme av karbonskjelettet (isomerer i henhold til strukturen til karbonkjeden), for eksempel butan (en forbindelse med uforgrenet eller normal struktur) og 2-metylpropan (en forbindelse med forgrenet struktur);
– isomerer av posisjonen til funksjonelle grupper (eller multiple bindinger), for eksempel 1-butanol (hydroksylgruppe er koblet til 1. karbonatom i kjeden) og 2-butanol (hydroksylgruppe er bundet til 2. karbonatom i kjeden );
– funksjonelle gruppe-isomerer (eller interklasse-isomerisme), for eksempel 1-butanol (alkohol) og dietyleter (eter).
Stereoisomerisme er delt inn i konformasjon og konfigurasjon.
Konformasjonene til et molekyl representerer dets forskjellige geometriske former, som oppstår som et resultat av rotasjon rundt enkle -bindinger.
Konfigurasjon er arrangementet av atomer i rommet uten å ta hensyn til forskjeller som oppstår på grunn av rotasjon rundt enkle -bindinger.
Konformasjoner av organiske molekyler. Rotasjon rundt -bindingen C – C gjøres relativt enkelt, hydrokarbonkjeden kan ha forskjellige former. Konformasjonsformer forvandles lett til hverandre og er derfor ikke forskjellige forbindelser - de er forskjellige ustabile dynamiske former av samme molekyl. Energiforskjellen mellom konformere er av samme størrelsesorden som energien til termisk bevegelse (flere kJ/mol). Derfor, ved vanlige temperaturer, kan individuelle konformer ikke isoleres.
Det skilles mellom formørket og hemmet konformasjon (fig. 2).
Ris. 2. Konformasjoner av pentan: a – formørket; b – hemmet
I fig. Figur 2 viser konformasjonene til pentan basert på bindingen mellom det andre og tredje karbonatomet i kjeden. Det kan sees at i den formørkede konformasjonen ser det ut til at hydrogen- eller karbonatomene skjuler hverandre. Den inhiberte konformasjonen oppstår som et resultat av en rotasjon av ett av atomene med 60 og avstanden mellom ubundne atomer øker litt, frastøtende krefter til elektronorbitalene til atomene avtar, og denne konfigurasjonen er energimessig mer gunstig. Molekylene til mange organiske forbindelser er blandinger av konformatorer som et resultat av termisk bevegelse, molekylene gjennomgår kontinuerlige konformasjonstransformasjoner.
Newmans projeksjonsformler. For å skildre konformasjoner brukes Newmans projeksjonsformler, som oppnås ved å projisere molekylet C på planet – C – koblinger. Som et eksempel i fig. Figur 3 viser konformasjonene til pentan i forhold til C 2 – C 3 bindingen.
Karbonatomet nærmest observatøren (C 2) er angitt med en prikk i midten av sirkelen; sirkelen symboliserer det fjernede karbonatomet (C 3). Tre bindinger fra et atom er avbildet som linjer som divergerer fra sentrum av sirkelen - for et nærliggende atom (C 2) eller "stikker ut" bak sirkelen - for et fjernt atom (C 3). de aktuelle karbonatomene som om de skjuler hverandre, konformasjonen kalles formørket (fig. 3. a), når ett av atomene roterer i forhold til det andre med 60°, får vi en energimessig gunstigere hemmet konformasjon (fig. 3. b).

Ris. 3. Newmans projeksjonsformel for a: formørket konformasjon av pentan og b: hemmet konformasjon av pentan.
Konformasjoner av sykliske forbindelser. Syklisk ikke aromatiske forbindelser, som regel, er ikke flate. For å redusere vinkel- og torsjonsspenningene som kan oppstå på grunn av forskjellen i verdiene til bindingsvinkler og polygonvinkler, kan ett eller flere ringatomer være plassert i et annet plan i forhold til de gjenværende atomene. Dermed kan femleddede sykluser ha form som en konvolutt i rommet (fig. 4), og seksleddede kan ha form som badekar eller stol (fig. 5).
Ris. 4. Konformasjon av cyklopentan
I konvoluttkonformasjonen beveger ett av karbonatomene seg ut av planet der de andre fire atomene befinner seg. Hvilket som helst av de fem atomene kan komme ut av planet, og syklusen ser derfor ut til å være i konstant bølgelignende bevegelse.

Ris. 5. Konformasjoner av cykloheksan: a – stol og b – bad.
I stol- og badkonformasjonen er 2 karbonatomer plassert utenfor planet der 4 flere atomer befinner seg.
I stolkonformasjonen av cykloheksan er det ingen okkluderte posisjoner av hydrogen og karbonatomer: arrangementet av hydrogenatomer på alle karbonatomer er det samme som i den hemme konformasjonen av etan.
Seks C-bindinger – H, parallelt med symmetriaksene til den stolformede formen av cykloheksan, rettet vekselvis opp og ned, kalles aksial (symbol EN).De resterende seks C – H-bindingene er plassert i en vinkel på 109,5° til denne aksen og er også vekselvis rettet opp og ned. Disse forbindelsene kalles ekvatorial (symbol e). Dermed har hvert karbonatom en binding med et hydrogenatom lokalisert aksialt og en binding ekvatorialt. Stolens konformasjon er energimessig gunstigere.
Konfigurasjonsisomerer. Optisk isomeri. Konfigurasjons er stereoisomerer med forskjellige arrangementer rundt visse atomer av andre atomer, radikaler eller funksjonelle grupper i rommet i forhold til hverandre. Disse inkluderer først og fremst enantiomerer - optisk aktive stoffer som er speilbilder av hverandre.
Hvilke stoffer kalles optisk aktive? Dette er forbindelser som er i stand til å endre helningsvinkelen til polariseringsplanet til planpolarisert lys. Husk at vanlig lys (fra solen eller en lampe) er en elektromagnetisk bølge der partikler vibrerer i alle retninger i gjensidig vinkelrette plan og vinkelrett på bølgens utbredelsesretning. I planpolarisert lys ligger partikkelvibrasjoner i samme plan. Hvis en stråle passerer gjennom et gjennomsiktig stoff som er i stand til å rotere planet av elektriske feltsvingninger med en viss vinkel og gi dem en ny retning, så sies et slikt stoff å ha optisk aktivitet.
To tegn på optisk aktivitet av organiske forbindelser kan formuleres: tilstedeværelsen av et asymmetrisk karbonatom og fraværet av symmetrielementer i molekylet.
Et asymmetrisk karbonatom er et atom bundet til fire forskjellige atomer eller grupper, vanligvis indikert med en stjerne: *C.
La oss vurdere molekylet til alanin (2-aminopropansyre), en aminosyre som er en del av proteinet (fig. 6). Molekylet har ett asymmetrisk karbonatom (det andre, assosiert med fire forskjellige substituenter: en aminogruppe, en karboksylgruppe, et hydrogenatom og en metylgruppe -CH 3). Karbonatomet i karboksylgruppen er ikke asymmetrisk, fordi han har ikke 4, men bare 3 substituenter. Det tredje karbonatomet (metylkarbonet) er heller ikke asymmetrisk. Den har 4 substituenter, men 3 av dem er like (hydrogenatomer). Molekylet til denne forbindelsen er asymmetrisk, derfor er alanin en optisk aktiv forbindelse og kan eksistere i form av to enantiomerer. Enantiomerer er navngitt av D,L-nomenklaturen, som beskriver den relative konfigurasjonen av isomerene (i forhold til konfigurasjonen av glyseraldehyd).
For å skildre og navngi en enantiomer, er det praktisk å plassere karbonkjeden til molekylet vertikalt, så vises substituentene på det asymmetriske karbonatomet til høyre og venstre for det. Hvis seniorsubstituenten (i vårt tilfelle, aminogruppen) er lokalisert til venstre, er det en L-isomer, hvis den er til høyre, er det en D-isomer (fig. 6).

Ris. 6. Enantiomerer av alanin.
Enantiomerer, i motsetning til isomerer, har de samme fysiske og kjemiske egenskapene bare ved at de roterer polariseringsplanet til planpolarisert lys med samme vinkel, men i motsatte retninger (den ene til venstre, den andre til høyre) . En blanding bestående av like molare mengder enantiomerer kalles en racemisk blanding eller racemat. Racematet er ikke optisk aktivt.
Til tross for denne tilsynelatende mindre forskjellen i egenskaper, er den biologiske aktiviteten til enantiomerene svært forskjellig. For eksempel inneholder proteiner bare L-enantiomerer av aminosyrer, dette forklarer særegenhetene til den romlige strukturen til proteiner og bestemmer selektiviteten til den katalytiske virkningen av enzymer D-isomerer av aminosyrer når de kommer inn i kroppen, kan forårsake ulike negative prosesser. derfor må den romlige konfigurasjonen av aminosyrer tas i betraktning ved produksjon av medisiner og ulike mattilsetningsstoffer.
En isomer av denne forbindelsen, -alanin (3-aminopropansyre), er også tilstede i kroppen vår. Denne forbindelsen er ikke en del av proteiner og er ikke optisk aktiv, fordi det er ingen asymmetriske atomer i den. Det første karbonatomet i karboksylgruppen har bare 3 substituenter, det andre og tredje har 2 identiske substituenter (hydrogenatomer).
La oss fortsette vår vurdering av fenomenet optisk isomerisme. Stoffer preget av dette fenomenet kalles ofte stereoisomerer. Stereoisomerer er identiske i fysiske og fysisk-kjemiske egenskaper, men er forskjellige på to måter:
1. Krystallisere i former som ikke har plan (plan) symmetri, men forholder seg til hverandre som et objekt til speilbildet, for eksempel to typer vinsyrekrystaller, som fremhever stereoisomere vinsyrer.

2. Stereoisomerer, som nevnt ovenfor, polariserer lys annerledes. P  Årsaken til optisk stereoisomerisme skyldes nettopp arrangementet av substituentgrupper på karbonatomet i sp 3-hybridiseringstilstanden, det vil si med det mettede karbonet ved hjørnene til tetraederet (arrangementet av atomer i rommet, som fører til tilstedeværelse av stereoisomerisme, kalles konfigurasjon).
Årsaken til optisk stereoisomerisme skyldes nettopp arrangementet av substituentgrupper på karbonatomet i sp 3-hybridiseringstilstanden, det vil si med det mettede karbonet ved hjørnene til tetraederet (arrangementet av atomer i rommet, som fører til tilstedeværelse av stereoisomerisme, kalles konfigurasjon).
Og ![]() er angitt som følger:
er angitt som følger:
For eksempel,

L-alkohol,= –5,9
For disse stoffene er venstre- og høyrehendte konfigurasjoner mulig.
Et racemat er en blanding av like mengder L- og D-isomerer, optisk inaktive.

Hvilke konfigurasjoner roterer lysets polariseringsplan til høyre og venstre - spesielt spørsmål. Det vurderes ikke her.
Pek på karbon - bindinger plassert over tegneplanet, pek på substituent - under dette planet.
Klassiske eksempler på en stereoisomer er:


H  Antall asymmetriske atomer kan være flere, i det generelle tilfellet.
Antall asymmetriske atomer kan være flere, i det generelle tilfellet.
* – asymmetrisk atom. Antall stereoisomerer er lik 2 n, hvor, som den oppmerksomme leser allerede har forstått, n er antall asymmetriske optisk aktive atomer.
Geometriske (cis- og trans-) isomerer. Disse inkluderer konfigurasjonsisomerer som inneholder en -binding. Denne typen diastereomerisme er spesielt karakteristisk for alkener. I forhold til planet for -bindingen, kan identiske substituenter på to karbonatomer lokaliseres en om gangen (cis-) eller annerledes (trans-) sider (fig. 7). Hovedårsaken til eksistensen av cis- og trans-isomerer er umuligheten av å rotere rundt -bindingen uten å bryte den.

Ris. 7. Geometriske isomerer av 2-butan.
Cis- og trans-isomerer har samme atombindingssekvens, men skiller seg fra hverandre i det romlige arrangementet av substituenter og er derfor stereoisomerer. På den annen side inneholder ikke molekylene deres asymmetriske karbonatomer og er ikke optisk aktive.
Cis- og trans-isomerer har forskjellige fysiske egenskaper og kan gjennomgå reaksjoner (for eksempel addisjon, med forskjellige hastigheter).
Geometriske isomerer finnes ofte blant naturlige forbindelser, spesielt retinolisomeren (vitamin A), der alle 4 dobbeltbindingene er i trans-konfigurasjon, er spesielt viktig for å sikre synsskarphet. Hydrokarbonradikaler av umettede syrer som utgjør flytende fett er i cis-konfigurasjon i forhold til dobbeltbindinger.
