II.1. Конформации (ротациона изомеризам)
Преминот од наједноставниот органски јаглеводород, метанот, до неговиот најблизок хомолог, етанот, поставува проблеми на просторна структура, за чие решавање не е доволно да се знаат параметрите што се дискутирани во делот. Всушност, без промена на аглите или должината на врските, може да се замисли многу геометриски форми на молекулата на етанот, кои се разликуваат една од друга во меѓусебната ротација на јаглеродните тетраедри околу врската C-C што ги поврзува. Како резултат на оваа ротација, ротациони изомери (конформатори) . Енергијата на различни конформери не е иста, но енергетската бариера што ги одвојува различните ротациони изомери за повеќето органски соединенијамали. Затоа, кога нормални условиКако по правило, невозможно е да се поправат молекулите во една строго дефинирана конформација: обично неколку ротациони форми кои лесно се трансформираат една во друга коегзистираат во рамнотежа.
Методите за графички приказ на конформациите и нивната номенклатура се следните. Да почнеме со молекулата на етанот. За него може да се предвиди постоење на две конформации кои максимално се разликуваат по енергија. Тие се прикажани подолу како перспективни проекции (1) („кози од пилана“), странични проекции (2) и Њуманови формули (3).
Во перспективната проекција (1а, 1б), врската C-C мора да се замисли како оди во далечина; Јаглеродниот атом лево е блиску до набљудувачот, а јаглеродниот атом од десната страна е подалеку од него.
Во страничната проекција (2а, 2б), четири H-атоми лежат во рамнината на цртежот; Јаглеродните атоми всушност се протегаат донекаде надвор од оваа рамнина, но обично се смета дека тие лежат и во рамнината на цртежот. „Задебелени“ клиновидни врски со задебелување на клинот укажуваат на излез од рамнината кон набљудувачот на атомот кон кој е свртен задебелувањето. Испрекинати врски во облик на клин го означуваат растојанието од набљудувачот.
Во Њумановата проекција (3а, 3б), молекулата се разгледува по должината на врската C-C (во насоката означена со стрелката во формулите 1а, б). Три линии кои се разминуваат под агол од 120° од центарот на кругот ги означуваат врските на јаглеродниот атом најблиску до набљудувачот; линиите што „излегуваат“ од зад кругот се врските на далечниот јаглероден атом.
Конформацијата прикажана лево се нарекува заматен : Ова име нè потсетува дека атомите на водородот на двете групи CH 3 се едни спроти други. Затемнетата конформација има зголемена внатрешна енергија и затоа е неповолна. Конформацијата прикажана на десната страна се нарекува инхибирана , што значи дека слободната ротација околу врската C-C е „инхибирана“ во оваа позиција, т.е. молекулата постои претежно во оваа конформација.
Минималната енергија потребна за целосно ротирање на молекула околу одредена врска се нарекува бариера за ротација за оваа врска. Бариерата за ротација во молекула како етанот може да се изрази во однос на промената потенцијална енергијамолекулите како функции на промена диедрален (торзија) агол системи. Диедралниот агол (означен тау) е прикажан на сликата подолу:

Енергетскиот профил на ротација околу врската C-C во етанот е прикажан на следната слика. Ротацијата на „задниот“ јаглероден атом е прикажана со промената диедрален аголпомеѓу двата прикажани атоми на водород. За едноставност, преостанатите атоми на водород се испуштени. Ротационата бариера што ги одвојува двете форми на етан е само 3 kcal/mol (12,6 kJ/mol). Минимумите на кривата на потенцијалната енергија одговараат на инхибирани конформации, а максимумите одговараат на оклудираните конформации. Бидејќи на собна температура енергијата на некои молекуларни судири може да достигне 20 kcal/mol (околу 80 kJ/mol), оваа бариера од 12,6 kJ/mol лесно се надминува и ротацијата во етанот се смета за бесплатна.
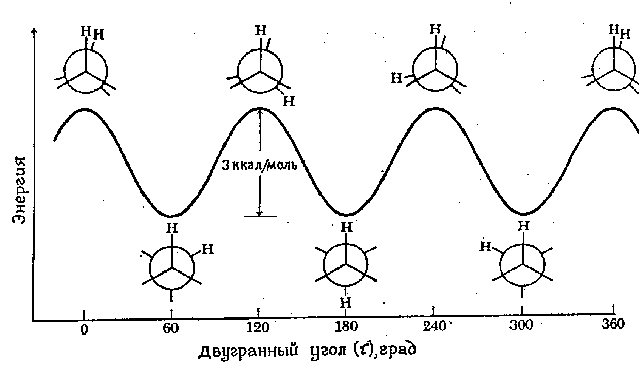
Нагласуваме дека секоја точка на кривата на потенцијалната енергија одговара на одредена конформација. Точките што одговараат на минимумите одговараат на конформационите изомери, т.е доминантните компоненти во мешавина од сите можни конформации .
Како што молекулата станува посложена, бројот на можни конформации кои значително се разликуваат по енергија се зголемува. Да, за n-бутанот може да се прикаже во шест конформации, кои се разликуваат релативна положба CH 3 групи, т.е. ротација околу централната врска C-C. Подолу, конформациите на n-бутан се прикажани како Њуманови проекции. Конформациите прикажани лево (засенчени) се енергетски неповолни, практично се реализираат само инхибираните.
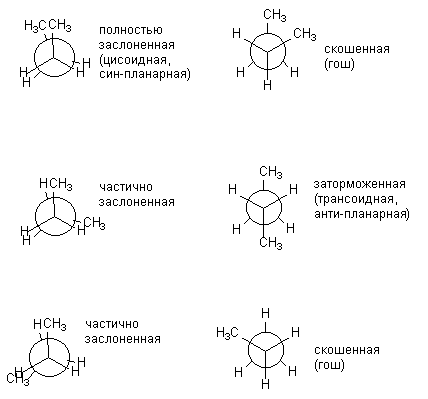
Различните затемнети и инхибирани конформации на бутанот не се исти по енергија. Соодветните енергии на сите конформации формирани при ротација околу централната врска C-C се претставени подолу:
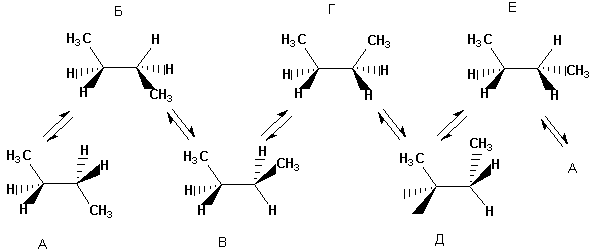


Како што молекулата станува посложена, бројот на можни конформации се зголемува.
Значи, конформациите се различни не-идентични просторни формимолекули кои имаат специфична конфигурација. Конформерите се стереоизомерни структури кои се во мобилна рамнотежа и се способни за интерконверзија со ротирање околу едноставни врски.
Понекогаш бариерата за таквите трансформации станува доволно висока за да се одделат стереоизомерните форми (пример: оптички активни бифенили;). Во такви случаи, тие повеќе не зборуваат за конформери, туку за реално постоење стереоизомери .
II.2. Геометриски изомеризам
Важна последица на ригидноста на двојната врска (отсуството на ротација околу неа) е постоењето геометриски изомери . Најчести од нив се цис-транс изомери соединенија од етиленската серија кои содржат нееднакви супституенти на незаситените атоми. Наједноставен пример се изомерите на бутен-2.

Геометриските изомери го имаат истото хемиска структура(ист ред хемиска врска), кои се разликуваат во просторниот распоред на атомите, според конфигурации . Оваа разлика создава разлика во физичкиот (како и хемиски својства). Геометриските изомери, за разлика од конформерите, можат да се изолираат во чиста формаи постојат како индивидуални, стабилни супстанции. Нивната меѓусебна трансформација обично бара енергија од редот на 125-170 kJ/mol (30-40 kcal/mol). Оваа енергија може да се пренесе со загревање или зрачење.
Во наједноставните случаи, номенклатурата на геометриските изомери не претставува никакви тешкотии: cis- формите се геометриски изомери во кои идентични супституенти лежат на истата страна од рамнината на врската пи, транс- изомерите имаат идентични супституенти на различни страниод пи бонд рамнината. Во посложени случаи се користи З, Е-номенклатура . Нејзиниот главен принцип: да се укаже на конфигурацијата наведете cis-(З, од германски Zusammen - заедно) или транс-(Е, од германски Ентгеген - спроти) локација виши заменици со двојна врска.
Во системот Z,E, супституентите со поголем атомски број се сметаат за постари. Ако атомите директно поврзани со незаситените јаглероди се исти, тогаш тие преминуваат на „вториот слој“, доколку е потребно - на „третиот слој“ итн.
Да ја разгледаме примената на правилата на Z,E-номенклатурата користејќи два примери.

| Јас | II |
Да почнеме со формулата I, каде што сè е решено со атомите на „првиот слој“. Откако ги подредивме нивните атомски броеви, откриваме дека постарите супституенти на секој пар (бром во горниот дел од формулата и азот во долниот дел) се во транс-положба, па оттука и стереохемиската ознака Е:
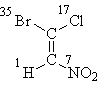 Е-1-бромо-1-хлоро-2-нитроетин
Е-1-бромо-1-хлоро-2-нитроетин
За да се одреди стереохемиската ознака на структурата II, неопходно е да се бараат разлики во „повисоките слоеви“. Во првиот слој, групите CH 3, C 2 H 5, C 3 H 7 не се разликуваат. Во вториот слој CH групата има 3 збир атомски броевие еднаква на три (три атоми на водород), групите C 2 H 5 и C 3 H 7 имаат по 8. Тоа значи дека групата CH 3 не се смета - таа е помлада од другите две. Така, постарите групи се C 2 H 5 и C 3 H 7, тоа е во цис-позиција; стереохемиска ознака З.
 Z-3-метилхептен-3
Z-3-метилхептен-3
Ако требаше да се одреди која група е постара - C 2 H 5 или C 3 H 7, ќе треба да се оди на атомите на „третиот слој“; збирот на атомските броеви во овој слој за двете групи би бил еднаков до 3 и 8, соодветно, т.е. C3H7 е постар од C2H5. Во посложени случаи на одредување на предност, мора да се земат предвид дополнителни услови, како што се: атом поврзан со двојна врска се брои двапати, поврзан со тројна врска - три пати; Од изотопите, потешкиот е постар (деутериумот е постар од водородот) и некои други.
Забележете дека ознаката З Не се синоними cis-ознаките, како ознаките Е, не секогаш одговараат на локацијата транс-, На пример:

cis- 1,2-дихлоропропен-1 cis- 1,2-дихлоро-1-бромопропен-1
Z-1,2-дихлоропропен-1 Е-1,2-дихлоро-1-бромопропен-1
Контролирајте ги задачите
1. Бомбикол - феромон (сексуална привлечност) на свилената буба - е Е-10-З-12-хексадекадиенол-1. Замислете го структурна формула.
2. Именувај ги следните соединенија користејќи ја номенклатурата Z,E:

II.3. Оптички изомеризам (енантиомеризам)
Меѓу органските соединенија има супстанции кои можат да ја ротираат рамнината на поларизација на светлината. Овој феномен се нарекува оптичка активност, а соодветните супстанции се оптички активни . Оптички активните супстанции се јавуваат во парови оптички антиподи - изомери, чии физички и хемиски својства се идентични во нормални услови, со исклучок на една работа - знакот на ротација на рамнината на поларизација. (Ако еден од оптичките антиподи има, на пример, специфична ротација [ЗАБЕЛЕШКА 1] +20 o, тогаш другиот има специфична ротација од -20 o).
II.4. Формули за проекција
За конвенционално прикажување на асиметричен атом на рамнина, користете формули за проекција на E. Fisher . Тие се добиваат со проектирање на рамнина на атомите на кои е поврзан асиметричниот атом. Во овој случај, самиот асиметричен атом обично се испушта, задржувајќи ги само линиите што се пресекуваат и симболите за замена. За да се запамети просторниот распоред на супституентите, скршената вертикална линија често се зачувува во формулите за проекција (горните и долните супституенти се отстрануваат надвор од рамнината на цртежот), но тоа често не се прави. Подолу се различни начинизапишување на формулата за проекција што одговара на левиот модел на претходната слика:

Еве неколку примери на формули за проекција:

(+)-аланин (-)-бутанол (+)-глицералдехид
Имињата на супстанциите ги означуваат нивните знаци на ротација: тоа значи, на пример, дека леворакиот антипод на бутанол-2 има просторна конфигурација , изразена токму со горната формула, а нејзината огледална слика одговара на декстророторниот бутанол-2. Дефиниција за конфигурација оптичките антиподи се изведуваат експериментално [ЗАБЕЛЕШКА 3].
Во принцип, секој оптички антипод може да се прикаже со дванаесет (!) различни формули за проекција - во зависност од тоа како е поставен моделот за време на проекцијата и од која страна гледаме на него. За стандардизирање на формулите за проекција, воведени се одредени правила за нивно пишување. Така, главната функција, ако е на крајот од ланецот, обично се поставува на врвот, главниот синџир е прикажан вертикално.
За да ги споредите „нестандардните“ напишани формули за проекција, треба да знаете следејќи ги правилататрансформации на проекционите формули.
1. Формулите може да се ротираат за 180° во рамнината на цртање без да се промени нивното стереохемиско значење:

2. Две (или кој било парен број) преуредување на супституентите на еден асиметричен атом не го менуваат стереохемиското значење на формулата:

3. Една (или кој било непарен број) пермутации на супституенти во асиметричниот центар доведува до формулата за оптичкиот антипод:

4. Вртење од 90° во рамнината на цртање ја претвора формулата во антиподеална, освен ако во исто време не се промени условот за локацијата на супституентите во однос на рамнината на цртање, т.е. не сметајте дека сега страничните супституенти се наоѓаат зад рамнината на цртање, а горните и долните се пред неа. Ако користите формула со испрекината линија, тогаш променетата ориентација на точкастата линија директно ќе ве потсети на ова:

5. Наместо пермутации, формулите за проекција може да се трансформираат со ротирање на трите супституенти во насока на стрелките на часовникот или спротивно од стрелките на часовникот; четвртиот супституент не ја менува својата позиција (оваа операција е еквивалентна на две пермутации):

6. Формулите за проекција не можат да се изведат од рамнината на цртежот (т.е., не можете, на пример, да ги испитате „на светлина“ од задниот дел на хартијата - во овој случај, стереохемиското значење на формулата ќе се промени).
II.5. Рацемати
Ако формулата на супстанцијата содржи асиметричен атом, тоа не значи дека таквата супстанција ќе има оптичка активност. Ако се појави асиметричен центар за време на нормална реакција (замена во групата CH 2, додавање на двојна врска итн.), тогаш веројатноста за создавање на двете антиподни конфигурации е иста. Затоа, и покрај асиметријата на секоја поединечна молекула, добиената супстанција се покажува како оптички неактивна. Овој вид на оптички неактивна модификација, која се состои од еднаква количина на двата антиподи, се нарекува тркамите [ЗАБЕЛЕШКА 4] .
II.6. Дијастереомеризам
Соединенијата со неколку асиметрични атоми имаат важни карактеристики што ги разликуваат од претходно дискутираните поедноставни оптички активни супстанции со еден центар на асиметрија.
Да претпоставиме дека во молекула на одредена супстанција има два асиметрични атоми; Да ги наречеме условно А и Б. Лесно е да се види дека можни се молекули со следните комбинации:
Молекулите 1 и 2 се пар оптички антиподи; истото важи и за пар молекули 3 и 4. Ако ги споредиме молекулите од различни паровиантиподи - 1 и 3, 1 и 4, 2 и 3, 2 и 4, тогаш ќе видиме дека наведените парови не се оптички антиподи: конфигурацијата на еден асиметричен атом е иста, конфигурацијата на другиот не е иста . Сите овие се парови дијастереомери , т.е. просторни изомери, Не кои сочинуваат оптички антиподи едни со други.
Дијастереомерите се разликуваат едни од други не само во оптичката ротација, туку и во сите други физички константи: тие имаат различни точки на топење и вриење, различна растворливост итн. .
Пример за соединение од овој тип е хлоромална киселина

Неговите стереоизомерни форми ги имаат следните формули за проекција:
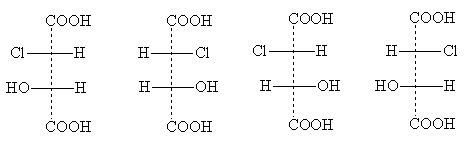
еритро-форми три-форми
Наслови еритро- И трио- потекнуваат од имињата на јаглехидратите еритроза и треоза. Овие имиња се користат за да се покаже релативната положба на супституентите во соединенијата со два асиметрични атоми: еритро -изомеритие се оние за кои два идентични странични супституенти се појавуваат во стандардната формула за проекција на едната страна (десно или лево); трио -изомериимаат идентични странични супституенти на различни страни од формулата за проекција [ЗАБЕЛЕШКА 5].
Две еритро-изомерите се пар оптички антиподи, кога тие се мешаат, се формира рацемат. Пар оптички изомери се и три-форми; тие, исто така, произведуваат рацемат кога се мешаат, кој по својства се разликува од рацематот еритро-форми. Така, има вкупно четири оптички активни изомери на хлоромална киселина и два рацемати.
Со дополнително зголемување на бројот на асиметрични центри, бројот на просторни изомери се зголемува, а секој нов асиметричен центар го удвојува бројот на изомери. Се одредува со формулата 2 n, каде што n е бројот на асиметрични центри.
Бројот на стереоизомери може да се намали поради делумната симетрија што се појавува во некои структури. Пример е винската киселина, во која бројот на поединечни стереоизомери е намален на три. Нивните формули за проекција:
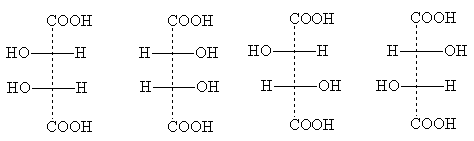
Формулата I е идентична со формулата Ia: таа се трансформира во неа кога се ротира за 180° во рамнината на цртежот и, според тоа, не претставува нов стереоизомер. Ова е оптички неактивна модификација - мезо форма . За разлика од рацематот, кој може да се подели на оптички антиподи, мезо-формата е фундаментално неуништлива: секоја од нејзините молекули има еден асиметричен центар на една конфигурација, а вториот - спротивното. Како резултат на тоа, се јавува интрамолекуларна компензација на ротацијата на двата асиметрични центри.
мезо-Сите оптички активни супстанции имаат форми со неколку идентични (т.е., поврзани со идентични супституенти) асиметрични центри [ЗАБЕЛЕШКА 6]. Формули за проекција мезо-формите секогаш може да се препознаат по тоа што тие секогаш можат да се поделат со хоризонтална линија на две половини, кои, кога се напишани на хартија, се формално идентични, но во реалноста се огледуваат:

Формулите II и III ги прикажуваат оптичките антиподи на винската киселина; кога ќе се измешаат, се формира оптички неактивен рацемат - грозје киселина.
II.7. Номенклатура на оптички изомери
Наједноставниот, најстариот, но сè уште во употреба систем за номенклатура на оптички антиподи се заснова на споредба на проекциската формула на наречениот антипод со формулата за проекција на одредена стандардна супстанција избрана како „клуч“. Значи, за алфа хидрокси киселини и алфа амино киселини, клучот е горниот делнивната формула за проекција (во стандардна нотација):

L-хидрокси киселини (X = OH) Д-хидрокси киселини (X = OH)
L-амино киселини (X = NH 2) Д-амино киселини (X = NH 2)
Конфигурацијата на сите алфа-хидрокси киселини кои имаат хидроксилна група лево во стандардната напишана формула за проекција на Фишер е означена со знакот Л; ако хидроксилот се наоѓа во проекциската формула десно - знак Д[ЗАБЕЛЕШКА 7] .
Клучот за одредување на конфигурацијата на шеќерите е глицералдехид:

L-(-)-глицералдехид Д-(+)-глицералдехид
Во молекулите на шеќер ознаката Д-или L-се однесува на конфигурација понискоасиметричен центар.
Систем Д-,L-ознаката има значителни недостатоци: прво, ознаката Д-или L-означува конфигурација на само еден асиметричен атом; второ, за некои соединенија се добиваат различни симболи, во зависност од тоа дали клучот на глицералдехид или хидрокси киселина се зема како клуч, на пример:

Овие недостатоци на клучниот систем ја ограничуваат неговата употреба во моментов на три класи оптички активни супстанции: шеќери, амино киселини и хидрокси киселини. Дизајниран за општа употреба „Р, С-систем Кан, Инголд и Прелог [ЗАБЕЛЕШКА 8].
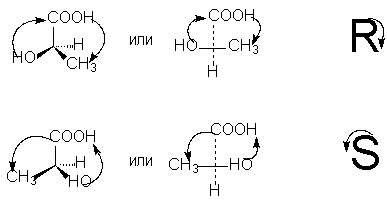
За да се одреди R- или S-конфигурацијата на оптичкиот антипод, неопходно е да се распореди тетраедарот на супституентите околу асиметричниот јаглероден атом на таков начин што најнискиот супституент (обично водород) има насока „далеку од набљудувачот“. Потоа, ако се појави движење за време на преминот во круг на трите преостанати супституенти од најстариот кон просечниот стаж, а потоа кон најмладиот спротивно од стрелките на часовникот - Ова Р -изомер (поврзан со истото движење на раката при пишување на буквата R), ако во насока на стрелките на часовникот - Ова С- изомер (поврзан со истото движење на раката при пишување на буквата S).
За да се одреди стажот на супституентите на асиметричен атом, се користат правилата за пресметување на атомски броеви, кои веќе ги разгледавме во врска со номенклатурата Z,E на геометриските изомери (види).
За да се изберат R, S-нотации според формулата за проекција, потребно е, со парен број пермутации (кои, како што знаеме, не го менуваат стереохемиското значење на формулата), супституентите да се подредат така што најмладите од нив (обично водород) е на дното на формулата за проекција. Тогаш стажот на преостанатите три супституенти, паѓајќи во насока на стрелките на часовникот, одговара на ознаката R, спротивно од стрелките на часовникот - ознаката S [ЗАБЕЛЕШКА 9]:
Контролирајте ги задачите
3. Одредете ја конфигурацијата на асиметричниот центар на аскорбинска киселина (витамин Ц) (со Р, С-номенклатура и во споредба со глицералдехид):

4. Алкалоидот ефедрин ја има формулата:
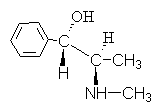
Наведете име за оваа врска користејќи Р, С- номенклатура.
5. Цистеин - несуштинска амино киселина вклучена во регулирањето на метаболичките процеси, е Л-1-амино-2-меркаптопропионска киселина. Нацртајте ја неговата структурна формула и наведете го неговото име Р, С- номенклатура.
6. Левомицетин (антибиотик со широк спектар) е Д(-)-трео-1-p-нитрофенил-2-дихлороацетиламино-пропанедиол-1,3. Нацртајте ја неговата структура во форма на формулата за проекција на Фишер.
7. Синестрол е синтетички естрогенски лек со нестероидна структура. Наведете го неговото име што ја покажува неговата стереохемиска конфигурација:

II.8. Стереохемија на циклични соединенија
Кога синџирот на јаглеродни атоми е затворен во рамнински циклус, аглите на врската на јаглеродните атоми се принудени да отстапат од нивната нормална тетраедрална вредност, а големината на ова отстапување зависи од бројот на атоми во циклусот. Колку е поголем аголот на отстапување на валентните врски, толку е поголема енергетската резерва на молекулата, толку е помалку стабилен циклусот. Сепак, само тричлен цикличен јаглеводород (циклопропан) има рамна структура; Почнувајќи од циклобутан, молекулите на циклоалканот имаат нерамна структура, што ја намалува „напнатоста“ во системот.
Молекулата на циклохексан може да постои во неколку конформации во кои се задржуваат „нормалните“ агли на врската (за едноставност, прикажани се само атоми на јаглерод):
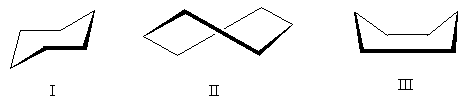
Енергетски најповолна конформација е конформацијата I - т.н "фотелји". Конформација II - "пресврт" - зазема средна позиција: понеповолна е од конформацијата на столот (поради присуството на заматени атоми на водород во неа), но поповолна од конформацијата III. Конформација III - "бања" - најмалку поволна од трите поради значителното одбивање на атоми на водород насочени нагоре.
Разгледувањето на дванаесетте C-H врски во конформацијата на столот ни овозможува да ги поделиме во две групи: шест аксијален врски насочени наизменично нагоре и надолу, и шест екваторијална врски насочени кон страните. Кај моносупституираните циклохексани, супституентот може да биде или во екваторијална или аксијална положба. Овие две конформации обично се во рамнотежа и брзо преминуваат една во друга преку конформацијата на извртување:

Екваторијалната конформација (д) обично е посиромашна со енергија и затоа е поповолна од аксијалната конформација (а).
Кога во прстените се појавуваат супституенти (странични синџири), покрај проблемот со конформацијата на самиот прстен, истражувачот се соочува и со проблеми конфигурации на супституенти : така, во случај на присуство на два идентични или различни супституенти, цис-транс-изомер. Забележете дека зборуваме за цис-транс-конфигурацијата на супституентите има смисла само кога се применува на заситени мали и средни прстени (до C 8): во прстени со голем бројмобилноста на врските веќе станува толку значајна што дискусиите за cis-или транс- ставовите на пратениците губат значење.
Значи, класичен примерсе стереоизомерни циклопропан-1,2-дикарбоксилни киселини. Постојат две стереоизомерни киселини: едната од нив има m.p. 139 o C, е способен да формира цикличен анхидрид и затоа е, цис-изомер. Друга стереоизомерна киселина m.p. 175 o C, не формира цикличен анхидрид; Ова транс-изомер [ЗАБЕЛЕШКА 10]:
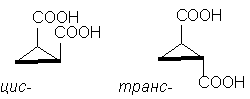
Две стереоизомерни 1,2,2-триметилциклопентан-1,3-дикарбоксилни киселини се во иста врска една со друга. Еден од нив, камфорна киселина, м.п. 187 o C, формира анхидрид и, според тоа, е цис-изомер. Другата е изокамфорна киселина, м.п. 171 o C, - не формира анхидрид, ова транс-изомер:

цис-транс-
Иако молекулата на циклопентан всушност не е рамна, за јасност е погодно да се прикаже во рамна форма, како на сликата погоре, имајќи предвид дека во cis-изомер има два супституенти на едната страна од циклусот , и во транс-изомер - на спротивните страни на циклусот .
Десупституираните деривати на циклохексан може да постојат и во цис или транс форма:
Јаглеродниот атом нема монопол на создавање на хирални центри во молекулите на органските соединенија. Центарот на киралност може да биде и силициум, калај и тетраковалентни азотни атоми во кватернерните амониумски соли и терциерни амин оксиди:

Во овие соединенија, центарот на асиметрија има тетраедарска конфигурација, како асиметричниот јаглероден атом. Меѓутоа, постојат и соединенија со различна просторна структура на хиралниот центар.
Хиралните центри формирани од атоми на тривалентен азот, фосфор, арсен, антимон и сулфур имаат пирамидална конфигурација. Во принцип, центарот на асиметрија може да се смета за тетраедар ако единствениот електронски пар на хетероатомот се земе како четврти супституент:

Може да се појави и оптичка активност без хирален центар, поради хиралноста на структурата на целата молекула како целина ( молекуларна хиралност или молекуларна асиметрија ). Повеќето типични примерисе достапност хирална оска или хирална рамнина .
Хиралната оска се појавува, на пример, во алините кои содржат различни супституенти на сп 2-хибридни јаглеродни атоми. Лесно е да се види дека соединенијата подолу се огледални слики, а со тоа и оптички антиподи:

Оската на хиралноста е прикажана на сликите со стрелка.
Друга класа на соединенија кои имаат хирална оска се оптички активните бифенили, кои имаат орто-позициите имаат гломазни супституенти кои го отежнуваат слободното ротирање наоколу S-S врскиповрзување на аренските прстени:

Хирален авион се карактеризира со тоа што може да се разликува помеѓу „горната“ и „долната“, како и „десната“ и „левата“ страна. Пример за соединенија со хирална рамнина е оптички активниот транс-циклооктен и оптички активен дериват на фероцен.
Изомерисе соединенија кои имаат ист квалитативен и квантитативен состав (молекуларна формула), но се разликуваат меѓу себе по редоследот на поврзување на атомите или нивниот распоред во просторот.Бидејќи структурата на овие соединенија е различна, хемиските или физичките својства на изомерите се различни.
Видови изомеризам: структурни (структурни изомери) и стереоизомеризам (просторни).
Структурниот изомеризам може да биде три вида:
– изомеризам на јаглеродниот скелет (изомери според структурата на јаглеродниот синџир), на пример, бутан (соединение со неразгранета или нормална структура) и 2-метилпропан (соединение со разгранета структура);
– изомери на позицијата на функционалните групи (или повеќекратни врски), на пример 1-бутанол (хидроксилната група е поврзана со првиот јаглероден атом во синџирот) и 2-бутанол (хидроксилната група е поврзана со вториот јаглероден атом во синџирот );
– изомери на функционална група (или меѓукласен изомеризам), на пример, 1-бутанол (алкохол) и диетил етер (етер).
Стереоизомеризмот е поделен на конформациски и конфигурациски.
Конформациите на молекулата ги претставуваат нејзините различни геометриски форми, кои произлегуваат како резултат на ротација околу едноставни -врски.
Конфигурација е распоред на атомите во просторот без да се земат предвид разликите што се јавуваат поради ротација околу едноставни -врски.
Конформации на органски молекули.Ротација околу -врската C – C се прави релативно лесно, јаглеводородниот синџир може да има различни форми. Конформациските форми лесно се трансформираат една во друга и затоа не се различни соединенија - тие се различни нестабилни динамички форми на иста молекула. Енергетската разлика помеѓу конформаторите е од ист ред како и енергијата на топлинското движење (неколку kJ/mol). Затоа, при обични температури, индивидуалните конформатори не можат да се изолираат.
Се прави разлика помеѓу затемнети и инхибирани конформации (сл. 2).
Ориз. 2. Конформации на пентан: а – затемнет; б – инхибирана
На сл. Слика 2 ги прикажува конформациите на пентанот врз основа на врската помеѓу вториот и третиот јаглеродни атоми на синџирот. Може да се види дека во затемнетата конформација, атомите на водород или јаглерод се чини дека се заматуваат еден со друг. Инхибираната конформација се јавува како резултат на ротација на еден од атомите за 60 и растојанието помеѓу неврзаните атоми малку се зголемува, одбивните сили на електронските орбитали на атомите се намалуваат и оваа конфигурација е енергетски поповолна. Молекулите на многу органски соединенија се мешавини на конформери; како резултат на термичко движење, молекулите се подложени на континуирани конформациски трансформации.
Њуманови формули за проекција.За да се прикажат конформациите, се користат Њумановите формули за проекција, кои се добиваат со проектирање на молекулата C на рамнината – В – врски. Како пример на сл. Слика 3 ги прикажува конформациите на пентанот во однос на врската C 2 – C 3.
Јаглеродниот атом најблиску до набљудувачот (C 2) е означен со точка во центарот на кругот; кругот го симболизира отстранетиот јаглероден атом (C 3). Три врски од атом се прикажани како линии што се разминуваат од центарот на кругот - за блискиот атом (C 2) или „испакнати“ од зад кругот - за далечен атом (C 3). Ако атомите и групите поврзани со атоми на јаглерод во прашање како да се заматуваат еден со друг, конформацијата се нарекува затемнета (сл. 3. а), кога еден од атомите се ротира во однос на другиот за 60°, добиваме енергетски поповолна инхибирана конформација (Сл. 3. б).

Ориз. 3. Њумановата формула за проекција за a: затемнета конформација на пентан и b: инхибирана конформација на пентан.
Конформации на циклични соединенија.Циклично не ароматични соединенија, како по правило, не се рамни. За да се намалат аголните и торзионите напрегања што може да се појават поради разликата во вредностите на аглите на врската и аглите на многуаголникот, еден или повеќе атоми на прстенот може да се лоцираат во различна рамнина во однос на преостанатите атоми. Така, петчлените циклуси можат да имаат облик на обвивка во просторот (сл. 4), а шестчлените може да имаат облик на када или стол (сл. 5).
Ориз. 4. Конформација на циклопентан
Во конформацијата на обвивката, еден од атомите на јаглеродот се движи надвор од рамнината во која се наоѓаат другите четири атоми. Било кој од петте атоми може да излезе од рамнината, и затоа се чини дека циклусот е во постојано движење слично на бранови.

Ориз. 5. Конформации на циклохексан: а – стол и б – бања.
Во конформациите за стол и бања, 2 јаглеродни атоми се наоѓаат надвор од рамнината во која се наоѓаат уште 4 атоми.
Во конформацијата на столот на циклохексан нема затскриени позиции на атоми на водород и јаглерод: распоредот на атоми на водород на сите јаглеродни атоми е ист како и во инхибираната конформација на етанот.
Шест C врски – H, паралелно со оските на симетријата на формата на циклохексан во облик на стол, насочена наизменично нагоре и надолу, се нарекуваат аксијални (симбол А).Останатите шест В – Врските H се наоѓаат под агол од 109,5° во однос на оваа оска и исто така се наизменично насочени нагоре и надолу. Овие врски се нарекуваат екваторијални (симбол д). Така, секој јаглероден атом има една врска со атом на водород лоциран аксијално и една врска екваторијално. Конформацијата на столот е енергетски поповолна.
Конфигурациски изомери. Оптички изомеризам. Конфигурациски се стереоизомери со различни распореди околу одредени атоми на други атоми, радикали или функционални групи во просторот во однос на едни со други. Тие првенствено вклучуваат енантиомери - оптички активни супстанции кои се огледални слики едни на други.
Кои супстанции се нарекуваат оптички активни? Тоа се соединенија способни да го променат аголот на наклонетост на рамнината на поларизација на рамно-поларизираната светлина. Потсетиме дека обичната светлина (од сонцето или светилка) е електромагнетен бран во кој честичките вибрираат во сите правци во меѓусебно нормални рамнини и нормално на насоката на ширење на бранот. Во рамно-поларизирана светлина, вибрациите на честичките лежат во истата рамнина. Ако зрак поминува низ проѕирна супстанција која е способна да ја ротира рамнината на осцилации на електричното поле за одреден агол и да им даде нова насока, тогаш се вели дека таквата супстанција има оптичка активност.
Може да се формулираат два знаци на оптичка активност на органски соединенија: присуство на асиметричен јаглероден атом и отсуство на елементи на симетрија во молекулата.
Асиметричен јаглероден атом е атом поврзан со четири различни атомиили групи, обично означени со ѕвездичка: *В.
Да ја разгледаме молекулата на аланин (2-аминопропаноична киселина), амино киселина која е дел од протеинот (сл. 6). Молекулата има еден асиметричен јаглероден атом (вториот, поврзан со четири различни супституенти: амино група, карбоксилна група, атом на водород и метил група -CH3). Јаглеродниот атом на карбоксилната група не е асиметричен, бидејќи тој нема 4, туку само 3 замени. Третиот јаглероден атом (метил јаглерод) исто така не е асиметричен. Има 4 супституенти, но 3 од нив се исти (атоми на водород). Молекулата на ова соединение е асиметрична; затоа, аланин е оптички активно соединение и може да постои во форма на два енантиомери. Енантиомерите се именувани по номенклатурата D,L, која ја опишува релативната конфигурација на изомерите (во однос на конфигурацијата на глицералдехидот).
За да се прикаже и именува енантиомер, погодно е да се постави јаглеродниот синџир на молекулата вертикално, а потоа супституентите на асиметричниот јаглероден атом се појавуваат десно и лево од него. Ако постариот супституент (во нашиот случај, амино групата) се наоѓа лево, тоа е L-изомер, ако на десно, тоа е D-изомер (сл. 6).

Ориз. 6. Енантиомери на аланин.
Енантиомерите, за разлика од изомерите, имаат исти физички и хемиски својства; тие се разликуваат само по тоа што ја ротираат рамнината на поларизација на рамно-поларизираната светлина за ист агол, но во спротивни насоки (едниот налево, другиот надесно). . Мешавината која се состои од еднакви моларни количества енантиомери се нарекува расемична смеса или рацемат. Рацематот не е оптички активен.
И покрај оваа навидум мала разлика во својствата, биолошката активност на енантиомерите е многу различна. На пример, протеините содржат само L-енантиомери на амино киселини, ова ги објаснува особеностите на просторната структура на протеините и ја одредува селективноста на каталитичкото дејство на ензимите.Д-изомерите на амино киселините кога влегуваат во телото може да предизвикаат различни негативни процеси, затоа мора да се води сметка за просторната конфигурација на аминокиселините при производството на лекови и разни прехранбени адитиви.
Изомер на ова соединение, -аланин (3-аминопропаноична киселина), исто така е присутен во нашето тело. Ова соединение не е дел од протеините и не е оптички активно, бидејќи во него нема асиметрични атоми. Првиот јаглероден атом од карбоксилната група има само 3 супституенти, вториот и третиот имаат 2 идентични супституенти (атоми на водород).
Да продолжиме со нашето разгледување на феноменот на оптичка изомеризам. Супстанциите кои се карактеризираат со овој феномен често се нарекуваат стереоизомери. Стереоизомерите се идентични по физички и физичко-хемиски својства, но се разликуваат во два аспекта:
1. Кристализирајте во форми кои немаат рамна (рамнина) симетрија, но се поврзуваат едни со други како предмет на неговата огледална слика, на пример, два вида кристали на винска киселина, истакнувајќи ги стереоизомерните вински киселини.

2. Стереоизомерите, како што е наведено погоре, ја поларизираат светлината поинаку. П  Причината за оптичкиот стереоизомеризам се должи токму на распоредот на супституентните групи на јаглеродниот атом во состојба на сп 3-хибридизација, односно со заситениот јаглерод на темињата на тетраедронот (распоредот на атомите во вселената, што доведува до присуство на стереоизомеризам, се нарекува конфигурација).
Причината за оптичкиот стереоизомеризам се должи токму на распоредот на супституентните групи на јаглеродниот атом во состојба на сп 3-хибридизација, односно со заситениот јаглерод на темињата на тетраедронот (распоредот на атомите во вселената, што доведува до присуство на стереоизомеризам, се нарекува конфигурација).
И ![]() се означува на следниов начин:
се означува на следниов начин:
На пример,

L-алкохол,= –5,9
За овие супстанции, можни се конфигурации со лева и десна рака.
Рацемат е мешавина од еднакви количини на L- и D-изомери, оптички неактивни.

Кои конфигурации ја ротираат рамнината на поларизација на светлината десно и лево - посебно прашање. Овде не се разгледува.
Точка на јаглерод - врски лоцирани над рамнината на цртање, точка на супституент - под оваа рамнина.
Класичните примери на стереоизомер се:


Х  Бројот на асиметрични атоми може да биде неколку, во општ случај.
Бројот на асиметрични атоми може да биде неколку, во општ случај.
* – асиметричен атом. Бројот на стереоизомери е еднаков на 2 n, каде што, како што внимателниот читател веќе разбра, n е бројот на асиметрични оптички активни атоми.
Геометриски (цис- и транс-) изомери.Тие вклучуваат конфигурациски изомери кои содржат врска. Овој тип на диастереомеризам е карактеристичен, особено, за алкените. Во однос на рамнината на врската, идентични супституенти на два јаглеродни атоми може да се лоцираат еден по еден (cis-) или различни (транс-) страни (сл. 7). Главната причина за постоењето на цис- а транс изомери е неможноста за ротација околу врската без нејзино раскинување.

Ориз. 7. Геометриски изомери на 2-бутан.
Cis- и транс изомерите имаат иста атомска сврзувачка низа, но се разликуваат едни од други во просторниот распоред на супституентите и затоа се стереоизомери. Од друга страна, нивните молекули не содржат асиметрични јаглеродни атоми и не се оптички активни.
Cis- и транс изомерите имаат различни физички својства и можат да подлежат на реакции (на пример, додавање, со различна брзина).
Геометриските изомери често се наоѓаат меѓу природните соединенија; особено, изомерот на ретинол (витамин А), во кој сите 4 двојни врски се во транс конфигурација, е особено важен за обезбедување на визуелна острина. Јаглеводородните радикали на незаситените киселини кои ги сочинуваат течните масти се во цис конфигурација во однос на двојните врски.
