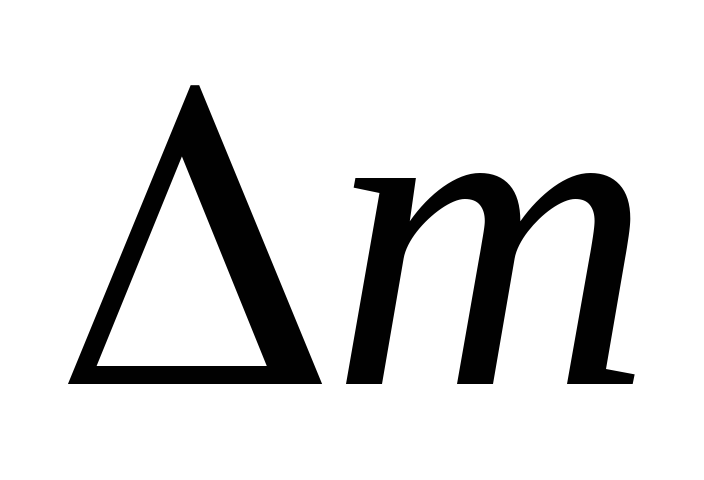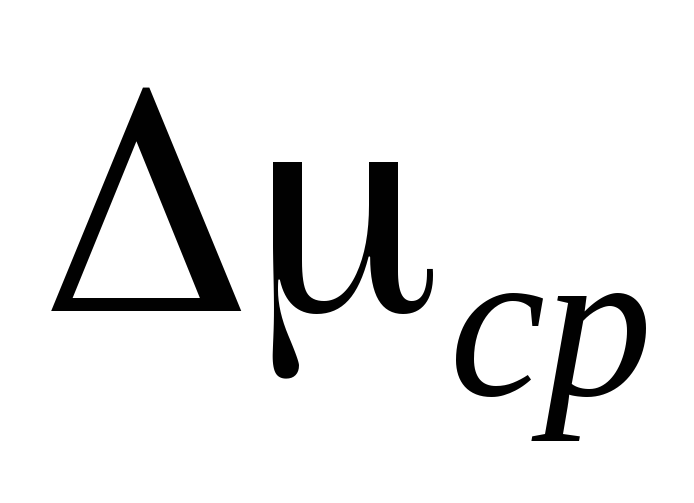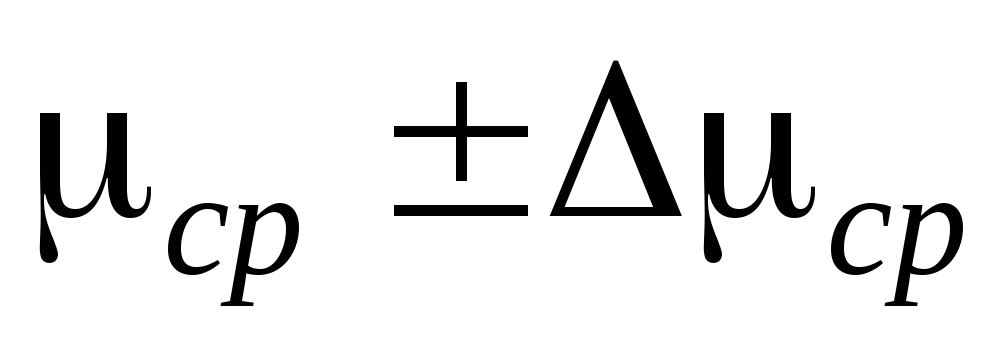Molær masseenhed: g/mol. Da molekylmasserne af CO2 og H2O og atommassen af oxygen er henholdsvis 44; 18 og 16 amu, så er deres molære masser ens: a) 44 g/mol; b) 18 g/mol; c) 16 g/mol.
På samme måde beregnes andre forbindelsers molekylvægte i kemiske beregninger. Molekylmasse er en karakteristik af den gennemsnitlige masse af et molekyle; den tager højde for den isotopiske sammensætning af alle grundstoffer, der danner en given Kemisk stof. Denne indikator kan også bestemmes for en blanding af flere stoffer, hvis sammensætning er kendt. Denne lov siger, at der er under de samme forhold i samme mængder af gasser samme nummer molekyler.
Massen af et bestemt kendt volumen gas ved et bestemt tryk og temperatur bestemmes. Denne metode giver ret nøjagtige værdier af molekylære masser, som nogle gange endda bruges til at bestemme atommasser kemiske forbindelser. For omtrentlige molekylvægtsestimater antages gassen sædvanligvis at være ideel, og der foretages ingen yderligere korrektioner.
Luft er nødvendig for den normale eksistens af levende organismer på Jorden. I industrien og i hverdagen bruges atmosfærisk ilt til at forbrænde brændstof for at producere varme og mekanisk energi i motorer. intern forbrænding. I 1754 beviste Joseph Black eksperimentelt, at luft er en blanding af gasser og ikke homogent stof. Det første symbol er et generelt accepteret billede af elementet luft. Det tredje billede er lufttrigrammet i Forandringernes Bog.
Menneskets frihed er vævet ud af den blå luft. Derfor er luftens symbol først og fremmest et symbol på frihed. Dette er en frihed, som der ikke er nogen barrierer for, fordi luften ikke kan begrænses, den kan ikke fanges og formes.
Atmosfærisk luft er en blanding af tør luft og vanddamp (fra 0,2% til 2,6%). Luften kan således næsten altid betragtes som fugtig. Den mekaniske blanding af tør luft og vanddamp kaldes fugtig luft eller luft-dampblanding. Absolut luftfugtighed er massen af damp i 1 m3 fugtig luft.
Når man slukker en brand med vand, skabes begge forhold: Vand køler brændende genstande, og dets dampe gør det svært for luft at nå dem. Spørgsmålet om luftens sammensætning i videnskaben blev ikke umiddelbart løst.I 1774 beviste den franske videnskabsmand A. Lavoisier, at luft er en blanding af hovedsageligt to gasser - nitrogen og oxygen. Derudover indeholder luften kulilte (IV) og vanddamp. Den omtrentlige luftsammensætning er vist i tabellen.
Elektrisk svejsning af let oxiderede metaller udføres i den inerte atmosfære af argon. Neon, argon, krypton og xenon fylder pærer. Du er allerede blevet fortrolig med forbrænding af stoffer i ilt. Når stoffer brænder i luft, dannes der som regel de samme produkter, det vil sige forskellige oxider. Antallet af atomer af grundstoffer, der indgår i sammensætningen af det brændte stof, udlignes: C6H6 + O2 -> 6CO2 + 3H2O3.
Denne teknik bruges ved slukning af brande i tilfælde af brændende olie og dens produkter. Kemisk sammensætning luft er vigtigt hygiejnisk værdi siden han spiller afgørende rolle i implementeringen af kroppens åndedrætsfunktion.
I bolig-, offentlige- og sportslokaler observeres ingen væsentlige ændringer i iltindholdet, da udendørs luft trænger ind i dem. Ved langvarig indånding af luft indeholdende 1 - 1,5 % carbondioxid der er en forringelse af helbredet, og ved 2-2,5 % opdages patologiske ændringer.
Hvordan finder man luftens molære masse
Grundstoffers atomer er karakteriseret ved en vis (kun iboende) masse. Relative molekylmasseværdier beregnes ud fra relative atommasseværdier under hensyntagen til antallet af atomer af hvert element i formelenheden for et komplekst stof. Sum massefraktioner elementer, der indgår i sammensatte, er lig med 1 (100%). I kemiske beregninger er massen af gasformige reaktanter og produkter ofte erstattet af deres volumen. Denne fysiske konstant er molært volumen gas kl normale forhold.
De er baseret på lovene om bevarelse af masse, konstans af sammensætning, multiple forhold, samt gaslovgivning – volumetriske relationer og Avogadro. I produktionen beregnes materialebalancer på dette grundlag. Loven gælder altid for gasformige og flydende stoffer. Loven om multiple forhold er ligesom loven om sammensætningens konstanthed ikke universel og er heller ikke gyldig for stoffer i fast tilstand. For eksempel, når 2 volumener brint og 1 volumen ilt interagerer, dannes 2 volumener vanddamp. Disse tal falder sammen med de støkiometriske koefficienter i reaktionsligningen.

I forhold atommasser kendte elementer er angivet i tabellen " Periodiske system elementer D.I. Mendeleev". Mængden af stof B er en fysisk størrelse, der angiver antallet af formelenheder af stoffet i forhold til Avogadros konstant. Avogadros konstant viser til gengæld antallet af atomer indeholdt i 12g af kulstofisotopen 126C, eller antallet atomare enheder masse i 1 g stof.
10. Bestemmelse af molekylvægte af stoffer i gasform.
Faktisk er 126C Ar = 12 for kulstofisotopen, og den molære masse af atomer (per definition af begrebet "mol") er 12 g/mol. Under normale forhold (101,325 kPa; 273 K) er det molære volumen af enhver gas 22,4 l/mol (mere præcist, Vn = 22,4 l/mol). For ikke ideelle gasser, kaldet ægte, er molarvolumenerne forskellige og noget anderledes end præcise værdi. Hvis volumenet og trykket af en gas er udtrykt i andre måleenheder, vil værdien af gaskonstanten i Clapeyron-Mendeleev-ligningen få en anden værdi.
Derfor bruges de til oplyste reklamer og i fyrtårne Forbrænding af stoffer i luften. Definition molære masser stoffer i gasform. Ifølge loven indeholder lige store mængder gasser taget ved samme temperatur og samme tryk lige mange molekyler. Luftens molekylære masse kan, ligesom andre gasser, findes ved hjælp af Avogadros lov.
Murom Instituttet (filial)
føderal statsbudget uddannelsesinstitution
videregående faglig uddannelse
"Vladimir State University
opkaldt efter Alexander Grigorievich og
Nikolai Grigorievich Stoletov"
Afdeling: "FPM"
Disciplin: Fysik
Laboratoriearbejde nr. 6.03
Godkendt på metodisk
seminar af afdelingen for FPM
Hoved afdeling ____________
Laboratoriearbejde nr. 6.03
BESTEMMELSE AF LUFTMOLEKYLEMASSE
Målet med arbejdet- stifte bekendtskab med en af metoderne til at bestemme en gass molekylvægt og måle luftens molekylvægt.
Enheder og tilbehør: luftcylinder, vejeinstallation eller teknisk vægt, trykmåler, vægte, vakuumpumpe.
SIKKERHED
Håndter glasbeholderen i linnedposen med forsigtighed.
TEORETISK INFORMATION
Molekylmasse er forholdet mellem massen af et molekyle af et givet stof og 1/12 massen af et kulstofatom C.
Molekylmasse kan ifølge definition repræsenteres som summen af atommasserne af de grundstoffer, der udgør molekylet
=
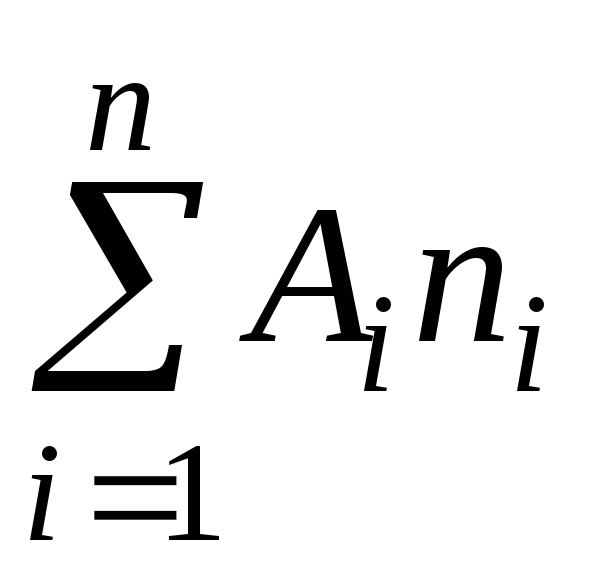 (1)
(1)
hvor A er atommasse th element inkluderet i sammensætningen af molekylet;
n er antallet af atomer.
Metoder til bestemmelse af molekylvægt er opdelt i to grupper - absolut og statistisk. De absolutte metoder, der giver den "sande" værdi af molekylvægt inkluderer massespektroskopimetoden. Andre metoder giver kun den gennemsnitlige molekylvægt.
Bestemmelse af molekylmassen af gasser er baseret på gastilstandsligningen
PV = 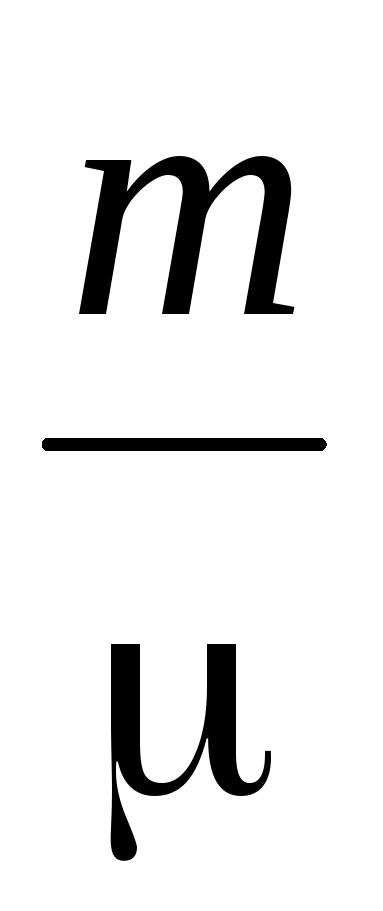 RT (2)
RT (2)
hvor P er gastryk,
m, V - dens masse og volumen,
T – absolut temperatur
R – universel gaskonstant,
– statistisk gennemsnit molekylær masse.
Ligning 2 gælder kun for ideel gas. En ideel gas er en gas, hvor der ikke er nogen interaktionskræfter (tiltrækning eller frastødning) mellem dens molekyler. Molekyler af en ideel gas er repræsenteret som elastiske kugler af uendelig lille størrelse. Reelle gasser har interaktionskræfter mellem molekyler, og molekyler kan ikke altid betragtes som elastiske kugler af forsvindende små størrelser, derfor afviger reelle gasser fra loven (2).
Men ved ikke for høje tryk, når gasmolekyler frit kan rejse lange afstande før de kolliderer, kan molekylernes interaktion negligeres, molekylernes størrelse kan også negligeres (når gasvolumenet er stort nok), så er den rigtige gas vil være tæt på ideal, og ligning (2) kan anvendes. På atmosfærisk tryk og stuetemperaturer, kan mange gasser (nitrogen, brint, helium, oxygen, luft osv.) betragtes som en ideel gas med en ret god tilnærmelse.
En vigtig egenskab ved molekylær bevægelse er den gennemsnitlige frie vej. Molekyler i en gas er i en tilstand af kontinuerlig og kaotisk bevægelse, kolliderer med hinanden og bevæger sig frit en bestemt vej mellem kollisioner . Længden af denne vej mellem to kollisioner er forskellig, men på grund af det store antal molekyler og tilfældigheden af deres bevægelse, kan vi tale om den gennemsnitlige frie vej for molekylerne. Gennemsnitlig længde den frie vej af molekyler kan bestemmes ved formlen
 =
=
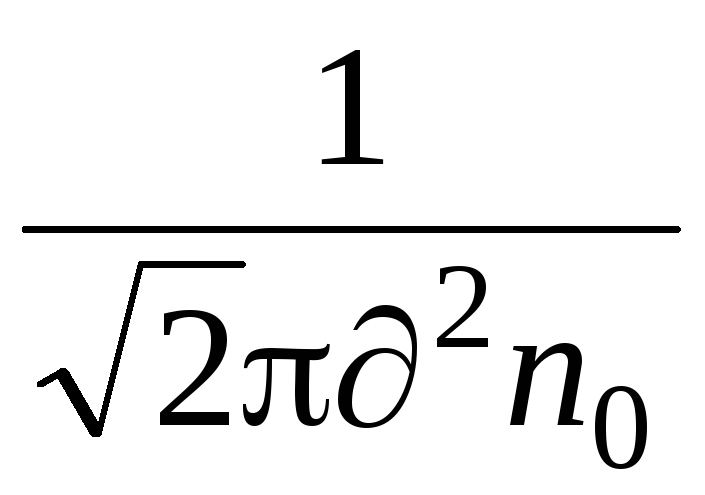 ,
,
hvor er den effektive diameter af molekylet (for luft = 0,27 10  m),
m),
n  – antal molekyler pr volumenhed.
– antal molekyler pr volumenhed.
n  =
=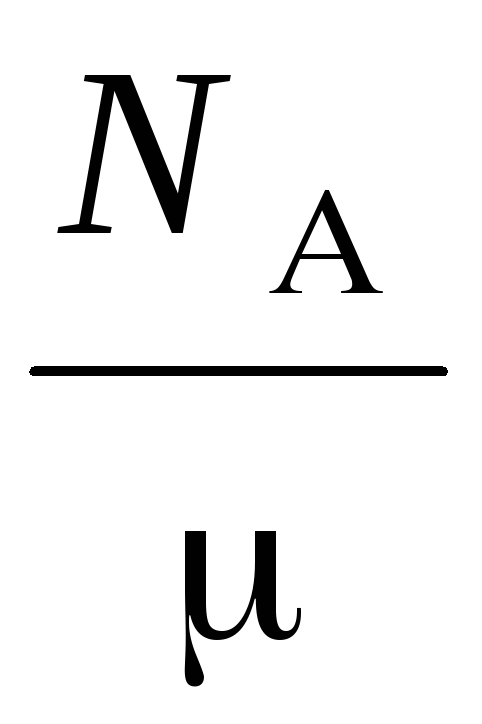
 ,
,
derefter tage dette i betragtning formlen , for har formen:
=
 ,
,
Hvor  - molekylvægt af gas, N
- molekylvægt af gas, N  – Avogadros nummer, – gasdensitet.
– Avogadros nummer, – gasdensitet.
Lad luften i en åben cylinder optage volumen V, dens masse T atmosfærisk tryk P; pumpe luften ud fra cylinderen til P  . Nu vil massen af luft i cylinderen være m
. Nu vil massen af luft i cylinderen være m  . For disse to tilstande skriver vi ligning (2)
. For disse to tilstande skriver vi ligning (2)
PV =  RT (3)
RT (3)
P  V=
V= 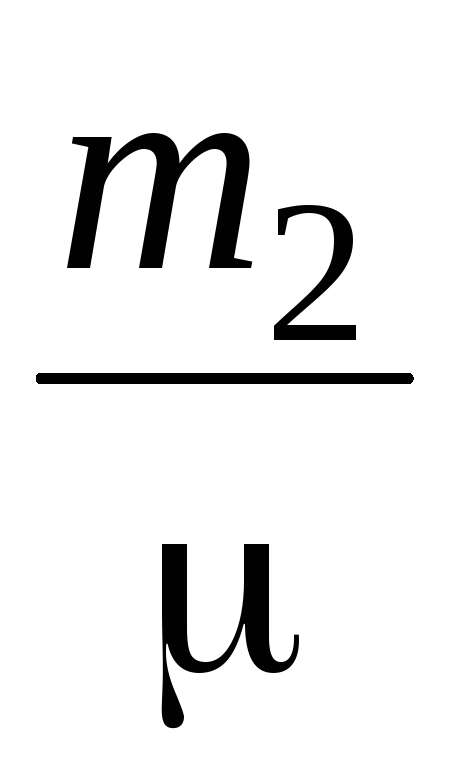 RT (4)
RT (4)
Når vi trækker fra (3) (4), udtrykker vi .
=

 =
=
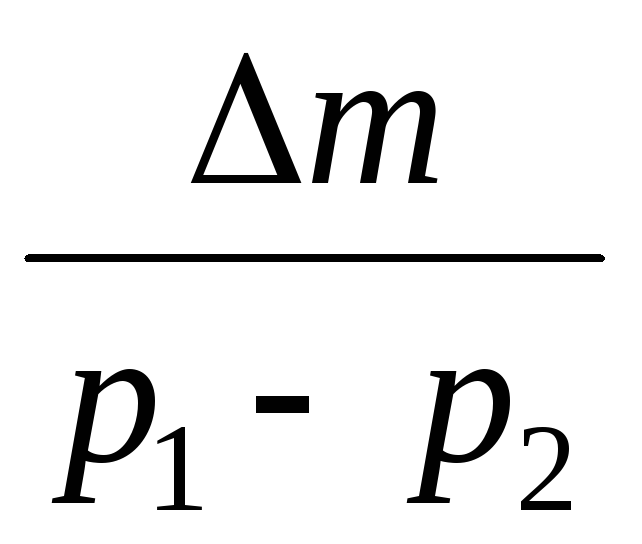
 (5)
(5)
Ved at kende ændringen i massen med ændringer i tryk kan du således finde luftens molekylære masse ved hjælp af formel (5).
INSTALLATIONSBESKRIVELSE
Et generelt billede af installationen er vist i fig. 1. Installationen består af en vakuumpumpe(1) , hane (2) (ved hjælp af hane 2 kobles systemet fra vakuumpumpen), vakuummåler (3) Rotationen af vakuummålerens pil er proportional med det opnåede vakuum i systemet, dvs. forskellen mellem atmosfærisk tryk og lufttryk i installationen. Nulværdien på vakuummålerskalaen svarer til det atmosfæriske tryk i installationen. Enheden begynder først at vise, når luft pumpes ud af systemet, dvs. når lufttrykket i installationen er under atmosfærisk.

Ved hjælp af hane 4 forbindes systemet med atmosfæren. I fig. 1 viser en vakuumledning (5), en aftagelig cylinder (6) (volumen jeg/1225 ml) med et gummirør og en klemme (7), som tjener til at afbryde cylinderen 6 fra atmosfæren, når cylinderen vejes.
FULDFØRELSE AF ARBEJDET
Øvelse 1. Bestemmelse af luftens molekylvægt.
1. Åbn hanerne 2 og 4, klem 7 og afbryd cylinder 6 fra installationen. Vi vejer cylinderen 6 sammen med gummirøret og klemmen 7 og registrerer måleresultaterne i tabel I. Vejningen skal udføres med en ret høj grad af nøjagtighed, og der skal lægges særlig vægt på denne operation.
2. Fastgør cylinderen 6 til installationen og pump luften ud fra cylinderen, så trykændringen bliver  P=0,1
P=0,1 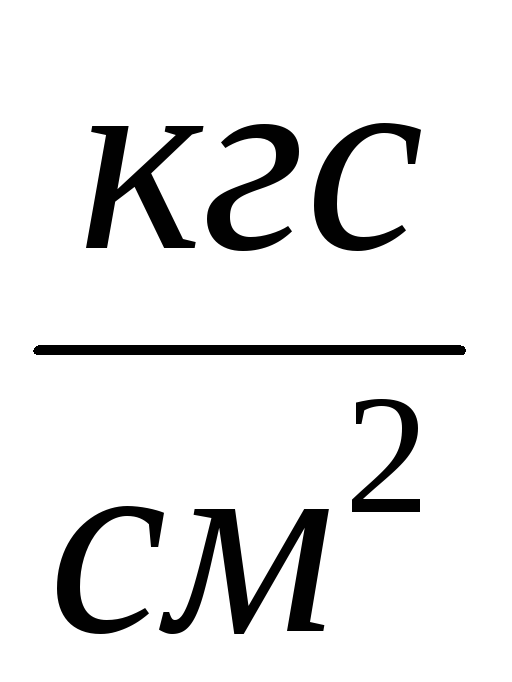 . Luk tryk 2 og tilføj
. Luk tryk 2 og tilføj  P til måletabellen. Luk hane 4, brug klemme 7, afbryd cylinder 6 fra installationen og vej den. Måleresultaterne er indtastet i tabellen.
P til måletabellen. Luk hane 4, brug klemme 7, afbryd cylinder 6 fra installationen og vej den. Måleresultaterne er indtastet i tabellen.
3. Åbn klemme 7, åbn let tap 2 og 4 og gentag trin 2 4 gange mere for andre værdier  P.
P.
4. Ud fra måleresultaterne beregner vi luft og estimerer målefejlen.
Opgave 2. Bestemmelse af lufttæthed.
Vi bestemmer lufttætheden ved hjælp af Mendeleev-Cliperon-ligningen for ideelle gasser.
PV = 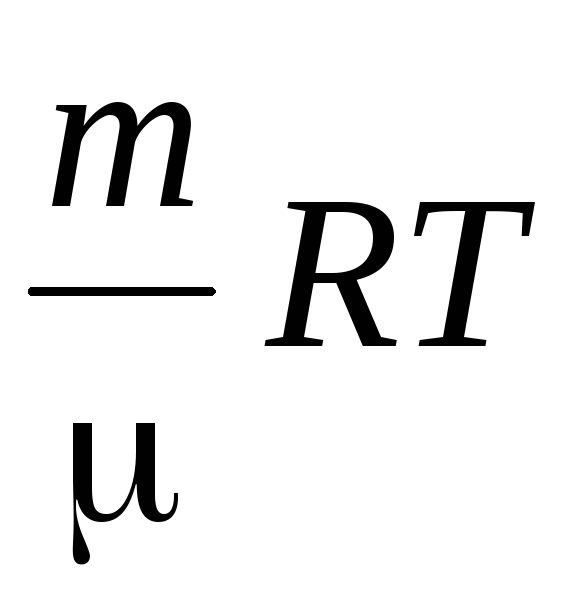 .
.
Af denne ligning følger det, at siden 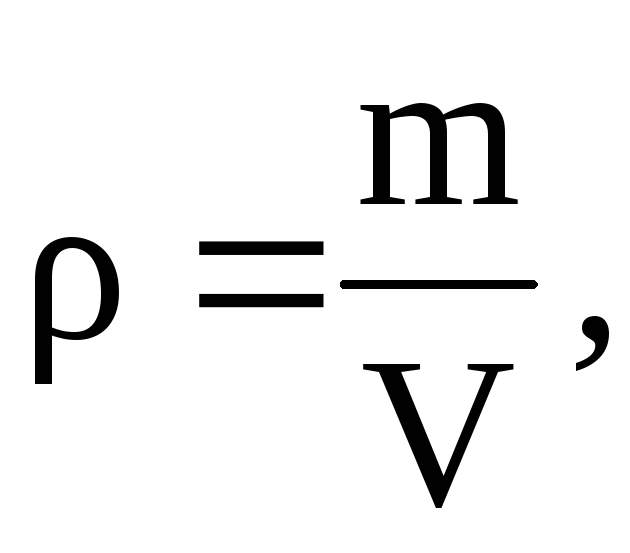 At
At
=
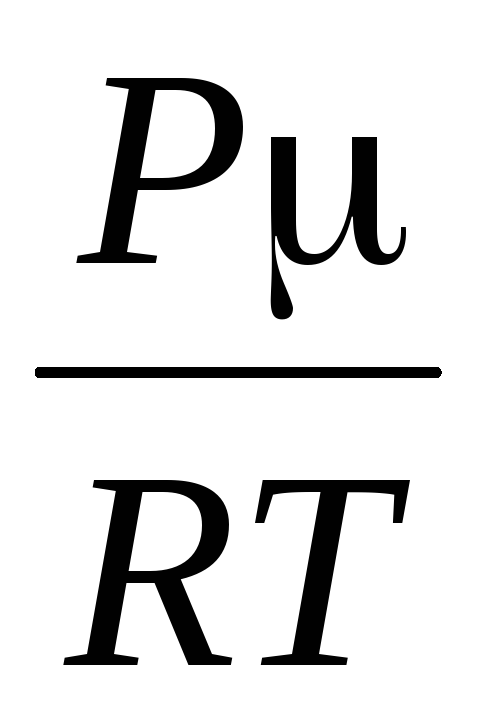 ,
,
hvor R = 8,31*10 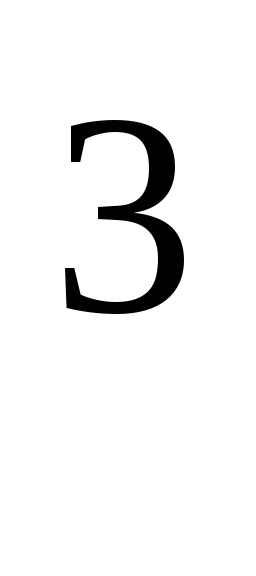 J/(kmol·K), universel gaskonstant.
J/(kmol·K), universel gaskonstant.
Lad os først bestemme lufttætheden i cylinderen før pumpning, idet vi antager, at trykket P=P  lig med atmosfærisk tryk (P
lig med atmosfærisk tryk (P  = 101 kPa). Så bestemmer vi lufttætheden ved forskellige
= 101 kPa). Så bestemmer vi lufttætheden ved forskellige  P taget fra måletabellen, forudsat at trykket i kolben er P = P
P taget fra måletabellen, forudsat at trykket i kolben er P = P  -
- P.
P.
Baseret på beregningsresultaterne, plot afhængigheden af tæthed på tryk P: 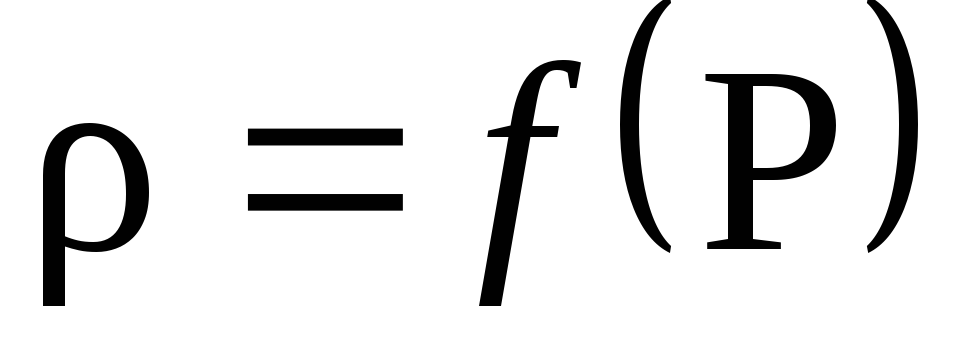
MÅLETABEL
|
m |
|
|
|
|
|
| ||||||
Opgave 3. Baseret på de beregnede beregninger , bestem den gennemsnitlige frie vejbølgelængde og plot afhængigheden af af : 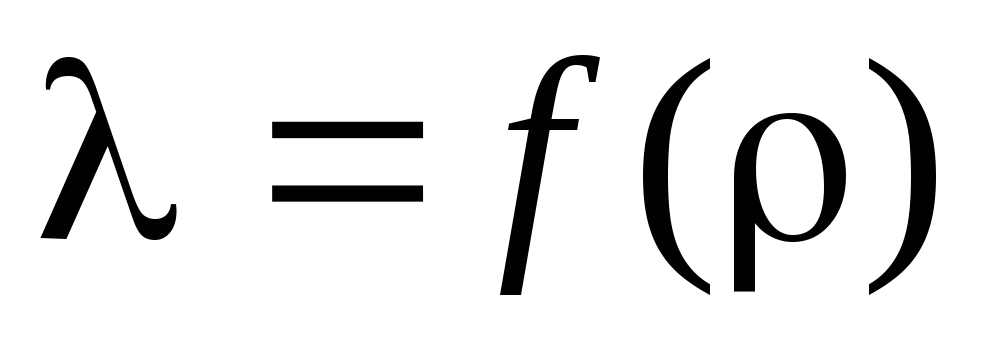 .
.
KONTROLSPØRGSMÅL
1. Angiv de vigtigste bestemmelser i den molekylære kinetiske teori om ideelle gasser.
2. Hvad fysiske mængder kaldes gastilstandsparametre, giv deres definition.
3. Formuler lovene for ideelle gasser.
4. Under hvilke forhold adlyder en gas de ideelle gaslove?
5. Under hvilke betingelser er Clapeyron-Mendeleev-ligningen anvendelig for gasser?
6. Hvad er molekylvægt, hvad afhænger molekylvægt af.
7. Luftdensitet, hvad afhænger den af?
8. Gennemsnitlig fri vej for gasmolekyler og effektiv diameter.
9. Udled formler til beregning af og .
10. Hvilke målinger skal der foretages for at beregne molekylvægten og luftdensiteten .
Liste over brugt litteratur
1. Savelyev I.V. Godt generel fysik. M.: Nauka, 1970. T.1, § 98.
2. A.A. Detlaff, B.M. Yavorsky. Fysik kursus. M.: Forlag" forskerskole", 1973, s. 175-179.
Side 1
Luftens molekylvægt beregnes under hensyntagen procent forskellige komponenter. Massen af et luftmolekyle forstås som gennemsnitsværdien af masserne af molekyler indeholdt i luften, under hensyntagen til deres relative koncentration.
Luftens molekylvægt beregnes under hensyntagen til procentdelen af forskellige komponenter. Massen af et luftmolekyle er gennemsnitsværdien af masserne af de molekyler, der er indeholdt i luften, under hensyntagen til deres relative koncentration.
TIL; M er molekylvægten af luft; rzab - lufttryk i siden.
Rvzh - det samme, over overfladen af den fordampende væske, kg / m3, Mw - molekylvægt af luft lig med 29; MP er molekylvægten af dampen i den fordampende væske.
Så for at tælle antallet af luftmolekyler i jordens atmosfære, er det nok kun at kende lufttrykket ved havoverfladen, luftens molekylvægt, jordens radius og accelerationen frit fald g på overfladen. Svaret inkluderer ikke atmosfærens højde, kun at den er lille i forhold til Jordens radius.
| Karakteristika for kulbrintekomponenter i naturgas.| Beregning af pseudokritisk temperatur og tryk af naturgas. |
Derfor, for at bestemme molekylvægten af en gas, skal vi gange den specifik vægt(taget som 1 for luft) af luftens molekylvægt.
Ah, cm, på 1 sek. med en trykforskel på begge sider af skillevæggen Ar, dyner / cm2; M er molekylvægten af luft, g/mol; R - universel gaskonstant, erg/mol - deg.
Ud fra lovene for ideelle gasser kan det påvises, at en gass vægtfylde også er lig med forholdet mellem gassens molekylvægt og luftens molekylvægt.
Der kan dog også være en uoverensstemmelse mellem materialets dampgennemtrængelighed og luftgennemtrængeligheden af hegnskonstruktionen lavet af samme materiale. Dette sker på grund af den uundgåelige tilstedeværelse af lækager og revner i strukturen, som markant øger hegnets luftgennemtrængelighed, og også fordi molekylvægten af luft og vanddamp ikke er den samme.
For at karakterisere naturgasser bruges dens specifikke vægt i vid udstrækning. Relativ tæthed gas udtrykkes ved forholdet mellem densiteten af gas ved atmosfærisk tryk og standardtemperatur og densiteten af luft ved samme tryk og temperatur. Siden ved atmosfærisk tryk og bestemt temperatur Gassernes massefylde er direkte proportional med deres molekylvægte; den relative massefylde af en gas kan repræsenteres som forholdet mellem gassens molekylvægt og luftens molekylvægt. Den relative massefylde af naturgasser varierer fra 0 6 til 1 1 afhængig af den relative koncentration af tungere kulbrinter i gassen.
I kuldioxidanlæg kræver tørisproduktion også fjernelse af luft fra systemet. Ud over de tidligere nævnte luftinfiltrationsveje, indføres der i tørismaskiner i ismaskiner systematisk luft i systemet, når isblokke fjernes fra ismaskinen. Efter isblokken falder ud, fyldes ismaskinens volumen med luft, som, når ismaskinen tændes, suges af kompressoren og sammen med kuldioxid tilføres kondensatoren. På grund af det faktum, at molekylvægten af kuldioxid er større end molekylvægten af luft, er arten af linjerne i pa / (ga) grafen den samme som for freoner. Men da molekylvægtene af kuldioxid og luft sammenlignet med freoner afviger lidt fra hinanden, er graflinjerne tæt på lige linjer over et betydeligt område. Nomogrammet for kuldioxid, konstrueret af R. R. Skvarchenko (VNIHI), er vist i fig.
I kuldioxidanlæg kræver tørisproduktion også fjernelse af luft fra systemet. Ud over de tidligere nævnte luftinfiltrationsveje, indføres der i tørismaskiner i ismaskiner systematisk luft i systemet, når isblokke fjernes fra ismaskinen. Efter isblokken falder ud, fyldes ismaskinens volumen med luft, som, når ismaskinen tændes, suges af kompressoren og sammen med kuldioxid tilføres kondensatoren. På grund af det faktum, at molekylvægten af kuldioxid er større end molekylvægten af luft, er karakteren af linjerne i grafen pa f (ga) den samme som for freoner. Men da molekylvægtene af kuldioxid og luft sammenlignet med freoner afviger lidt fra hinanden, er graflinjerne tæt på lige linjer over et betydeligt område.