ព័ត៌មានទូទៅ អាស៊ីតកាបូនអាស៊ីត dibasic ខ្សោយ។ IN ទម្រង់បរិសុទ្ធមិនត្រូវបានបន្លិច។ បង្កើតឡើងក្នុងបរិមាណតិចតួចនៅពេលរំលាយ កាបូនឌីអុកស៊ីតនៅក្នុងទឹក រួមទាំងកាបូនឌីអុកស៊ីតពីខ្យល់។ បង្កើតបានជានិស្សន្ទវត្ថុសរីរាង្គ និងសរីរាង្គមានស្ថេរភាពមួយចំនួន៖ អំបិល (កាបូន និងប៊ីកាបូណាត) អេស្ទ័រ អាមីដ ជាដើម។



ការរលួយ នៅពេលដែលសីតុណ្ហភាពនៃដំណោះស្រាយកើនឡើង និង/ឬសម្ពាធផ្នែកនៃកាបូនឌីអុកស៊ីតថយចុះ លំនឹងនៅក្នុងប្រព័ន្ធនឹងផ្លាស់ប្តូរទៅខាងឆ្វេង ដែលនាំទៅដល់ការបំបែកផ្នែកនៃអាស៊ីតកាបូនទៅក្នុងទឹក និងកាបូនឌីអុកស៊ីត។ នៅពេលដែលសូលុយស្យុងឆ្អិន អាស៊ីតកាបូនិចនឹងរលាយទាំងស្រុង៖

ការរៀបចំអាស៊ីតកាបូនត្រូវបានបង្កើតឡើងនៅពេលដែលកាបូនឌីអុកស៊ីតត្រូវបានរំលាយនៅក្នុងទឹក។ មាតិកាអាស៊ីតកាបូននៅក្នុងដំណោះស្រាយកើនឡើងជាមួយនឹងការថយចុះសីតុណ្ហភាពនៃដំណោះស្រាយ និងការកើនឡើងសម្ពាធកាបូនឌីអុកស៊ីត។ អាស៊ីតកាបូនក៏ត្រូវបានបង្កើតឡើងដោយអន្តរកម្មនៃអំបិលរបស់វា (កាបូន និងប៊ីកាបូណាត) ជាមួយនឹងអាស៊ីតខ្លាំងជាង។ ក្នុងករណីនេះភាគច្រើននៃអាស៊ីតកាបូនិកដែលបានបង្កើតឡើងជាក្បួន decomposes ចូលទៅក្នុងទឹកនិងកាបូនឌីអុកស៊ីត

ការប្រើប្រាស់អាស៊ីតកាបូនតែងតែមានវត្តមាននៅក្នុងដំណោះស្រាយ aqueous នៃកាបូនឌីអុកស៊ីត (ទឹកកាបូន) ។ ជីវគីមីវិទ្យាប្រើទ្រព្យសម្បត្តិនៃប្រព័ន្ធលំនឹងដើម្បីផ្លាស់ប្តូរសម្ពាធឧស្ម័នក្នុងសមាមាត្រទៅនឹងការផ្លាស់ប្តូរមាតិកានៃអ៊ីយ៉ុងអុកស៊ីតូនីញ៉ូម (អាស៊ីត) នៅសីតុណ្ហភាពថេរ។ នេះអនុញ្ញាតឱ្យអ្នកកត់ត្រាវឌ្ឍនភាពក្នុងពេលវេលាជាក់ស្តែង ប្រតិកម្មអង់ស៊ីមកើតឡើងជាមួយនឹងការផ្លាស់ប្តូរ pH នៃដំណោះស្រាយ

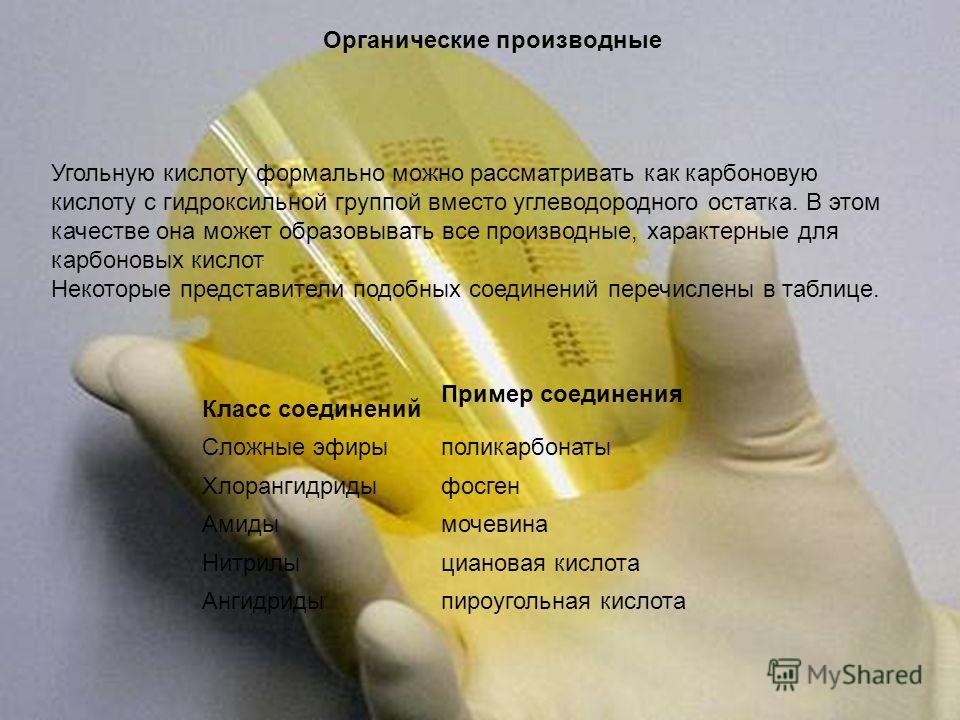
និស្សន្ទវត្ថុសរីរាង្គ អាស៊ីតកាបូនអាចត្រូវបានចាត់ទុកជាផ្លូវការថាជាអាស៊ីត carboxylic ជាមួយនឹងក្រុម hydroxyl ជំនួសឱ្យសំណល់អ៊ីដ្រូកាបូន។ ក្នុងសមត្ថភាពនេះ វាអាចបង្កើតជាលក្ខណៈនិស្សន្ទវត្ថុទាំងអស់នៃ អាស៊ីត carboxylic. អ្នកតំណាងខ្លះនៃសមាសធាតុបែបនេះត្រូវបានរាយក្នុងតារាង។ ថ្នាក់នៃសមាសធាតុ ឧទាហរណ៍នៃសមាសធាតុ Esters polycarbonates អាស៊ីតក្លរួ Phosgene amides អាស៊ីត Urea Nitrilycyanoic Anhydrides អាស៊ីត pyrocarbonic
កាបូនឌីអុកស៊ីតនៅក្នុងបរិយាកាសផែនដីគិតត្រឹមឆ្នាំ 2011 ត្រូវបានតំណាងក្នុងបរិមាណ 392 ppm ឬ 0.0392% តួនាទីរបស់កាបូនឌីអុកស៊ីត (CO2, កាបូនឌីអុកស៊ីត ឬកាបូនឌីអុកស៊ីត) នៅក្នុងជីវិតនៃជីវមណ្ឌលគឺជាចម្បងដើម្បីគាំទ្រដល់ដំណើរការនៃ រស្មីសំយោគ ដែលត្រូវបានអនុវត្តដោយរុក្ខជាតិ។ ក្នុងនាមជាឧស្ម័នផ្ទះកញ្ចក់ កាបូនឌីអុកស៊ីតនៅក្នុងខ្យល់ប៉ះពាល់ដល់ការផ្លាស់ប្តូរកំដៅនៃភពផែនដីជាមួយនឹងលំហជុំវិញ ដោយទប់ស្កាត់កំដៅដែលបញ្ចេញកាំរស្មីឡើងវិញនៅប្រេកង់មួយចំនួន ហើយដូច្នេះចូលរួមនៅក្នុងការផ្លាស់ប្តូរអាកាសធាតុរបស់ភពផែនដី។
ដោយសារតែការ ការប្រើប្រាស់សកម្មមនុស្សជាតិប្រើឥន្ធនៈហ្វូស៊ីលជាឥន្ធនៈដែលបណ្តាលឱ្យមានការកើនឡើងយ៉ាងឆាប់រហ័សនៃការប្រមូលផ្តុំឧស្ម័ននេះនៅក្នុងបរិយាកាស។ ទីមួយ ឥទ្ធិពល anthropogenicនៅលើកំហាប់កាបូនឌីអុកស៊ីតត្រូវបានកត់សម្គាល់ចាប់តាំងពីពាក់កណ្តាលសតវត្សទី 19 ។ ចាប់តាំងពីពេលនោះមក អត្រាកំណើនរបស់វាបានកើនឡើង ហើយនៅចុងទសវត្សរ៍ឆ្នាំ 2000 វាបានកើតឡើងក្នុងអត្រា 2.20 ± 0.01 ppm ក្នុងមួយឆ្នាំ ឬ 1.7% ក្នុងមួយឆ្នាំ។ យោងទៅតាម ការសិក្សាបុគ្គល, កម្រិតទំនើបឧស្ម័នកាបូនិកនៅក្នុងបរិយាកាសគឺខ្ពស់បំផុតក្នុងរយៈពេល 800 ពាន់ឆ្នាំចុងក្រោយនេះ ហើយប្រហែលជាក្នុងរយៈពេល 20 លានឆ្នាំចុងក្រោយនេះ។
តួនាទីនៅក្នុងឥទ្ធិពលផ្ទះកញ្ចក់
អ្វីដែលកំណត់កាបូនឌីអុកស៊ីតក្រៅពីឧស្ម័នផ្សេងទៀតជាឧស្ម័នផ្ទះកញ្ចក់គឺជាផលប៉ះពាល់រយៈពេលវែងរបស់វាទៅលើអាកាសធាតុ ដែលភាគច្រើននៅតែស្ថិតស្ថេររហូតដល់មួយពាន់ឆ្នាំបន្ទាប់ពីការបំភាយដែលបណ្តាលឱ្យវាឈប់។ ផ្សេងទៀត ឧស្ម័នផ្ទះកញ្ចក់អុកស៊ីដ ដូចជា មេតាន និងនីទ្រីកអុកស៊ីដ មាននៅក្នុងស្ថានភាពទំនេរក្នុងបរិយាកាសក្នុងរយៈពេលខ្លីជាង។
ទោះបីជាមានកំហាប់ទាបនៅក្នុងខ្យល់ក៏ដោយ CO2 គឺ សមាសធាតុសំខាន់មួយ។បរិយាកាសរបស់ផែនដី ព្រោះវាស្រូបយក និងបញ្ចេញរស្មីឡើងវិញ វិទ្យុសកម្មអ៊ីនហ្វ្រារ៉េដនៅចម្ងាយរលកផ្សេងៗគ្នា រួមទាំងរលកប្រវែង 4.26 μm (របៀបរំញ័រ - ការលាតសន្ធឹងមិនស្មើគ្នានៃម៉ូលេគុល) និង 14.99 μm (រំញ័រពត់កោង) ។ ដំណើរការនេះលុបបំបាត់ ឬកាត់បន្ថយវិទ្យុសកម្មពីផែនដីទៅក្នុងលំហនៅចម្ងាយរលកទាំងនេះ ដែលបណ្តាលឱ្យមានផលផ្ទះកញ្ចក់។
ការផ្លាស់ប្តូរបច្ចុប្បន្ននៃកំហាប់ CO2 បរិយាកាសត្រូវបានឆ្លុះបញ្ចាំងនៅក្នុងក្រុមស្រូបទាញដែលវាកើតឡើង ឥទ្ធិពលទំនើបនៅលើវិសាលគមនៃការបំភាយឧស្ម័នឡើងវិញរបស់ផែនដី នាំទៅដល់ការស្រូបចូលតែផ្នែកប៉ុណ្ណោះ។
បន្ថែមពីលើលក្ខណៈសម្បត្តិផ្ទះកញ្ចក់នៃកាបូនឌីអុកស៊ីតវាក៏សំខាន់ផងដែរដែលវាមានច្រើន។ ឧស្ម័នធ្ងន់បើប្រៀបធៀបទៅនឹងខ្យល់។ ចាប់តាំងពីម៉ាស់ម៉ូលដែលទាក់ទងជាមធ្យមនៃខ្យល់គឺ 28.98 ក្រាម / mol ហើយម៉ាស់ម៉ូលេគុលនៃ CO2 គឺ 44.01 ក្រាម / mol ការកើនឡើងនៃសមាមាត្រនៃកាបូនឌីអុកស៊ីតនាំទៅរកការកើនឡើងនៃដង់ស៊ីតេខ្យល់ហើយយោងទៅតាមការផ្លាស់ប្តូររបស់វា ទម្រង់សម្ពាធអាស្រ័យលើកម្ពស់។ ដោយគុណធម៌ ធម្មជាតិរាងកាយ ឥទ្ធិពលផ្ទះកញ្ចក់ការផ្លាស់ប្តូរលក្ខណៈនៃបរិយាកាសបែបនេះនាំឱ្យមានការកើនឡើងនៃសីតុណ្ហភាពជាមធ្យមនៅលើផ្ទៃ។
ប្រភពចម្បងនៃឥទ្ធិពលផ្ទះកញ្ចក់នៅក្នុងបរិយាកាសរបស់ផែនដីគឺទឹកឧស្ម័នឬសំណើមខ្យល់ក្នុងការអវត្ដមាន ឧស្ម័នផ្ទះកញ្ចក់នៅក្នុងបរិយាកាសនិងតម្លៃនៃថេរព្រះអាទិត្យស្មើនឹង 1368 W m2, សីតុណ្ហភាពមធ្យមនៅលើផ្ទៃគួរតែមាន -15 អង្សាសេ។ ជាការពិត សីតុណ្ហភាពជាមធ្យមនៃផ្ទៃផែនដីគឺ +15°C ពោលគឺឥទ្ធិពលផ្ទះកញ្ចក់នាំឲ្យមានការកើនឡើង 30°C ដែលក្នុងនោះ 20.6°C ត្រូវបានពន្យល់ដោយវត្តមានចំហាយទឹកនៅក្នុងខ្យល់។ វត្តមាននៃកាបូនឌីអុកស៊ីតនៅក្នុងវាត្រូវបានចាត់ទុកថាទទួលខុសត្រូវចំពោះការកើនឡើងនៃសីតុណ្ហភាព 7.2 ° C ចាប់តាំងពីជាមួយនឹងការកើនឡើងនៃសមាមាត្រនៃឧស្ម័ននេះនៅក្នុងបរិយាកាស ម៉ាសធំរបស់វានាំទៅរកការកើនឡើងនៃដង់ស៊ីតេ និងសម្ពាធ បន្ទាប់មកនៅសីតុណ្ហភាព។ សីតុណ្ហភាពដូចគ្នា ការកើនឡើងនៃកំហាប់ CO2 នាំឱ្យមានការកើនឡើងនូវសមត្ថភាពសំណើមនៃខ្យល់ និងការកើនឡើងនៃឥទ្ធិពលផ្ទះកញ្ចក់ ដោយសារតែទឹកកាន់តែច្រើននៅក្នុងបរិយាកាស។ ការបង្កើនសមាមាត្រនៃទឹកនៅក្នុងខ្យល់ដើម្បីសម្រេចបាននូវកម្រិតដូចគ្នានៃសំណើមដែលទាក់ទង - ដោយសារតែទាប ម៉ាសថ្គាមទឹក (18 ក្រាម mol) - កាត់បន្ថយដង់ស៊ីតេខ្យល់ដែលទូទាត់សងសម្រាប់ការកើនឡើងនៃដង់ស៊ីតេដែលបណ្តាលមកពីវត្តមាន កម្រិតខ្ពស់កាបូនឌីអុកស៊ីតនៅក្នុងបរិយាកាស។
បន្សំ កត្តាដែលបានរាយបញ្ជីសរុបមក ការកើនឡើងនៃការប្រមូលផ្តុំពីកម្រិតមុនឧស្សាហកម្ម 280 ppm ដល់កម្រិតទំនើប 392 ppm គឺស្មើនឹង 1.8 W បន្ថែមក្នុងមួយ ម៉ែត្រការេផ្ទៃនៃភពផែនដី។
ប្រភពនៃកាបូនឌីអុកស៊ីត
ប្រភពធម្មជាតិនៃកាបូនឌីអុកស៊ីតនៅក្នុងបរិយាកាសរួមមានការផ្ទុះភ្នំភ្លើង ការឆេះ បញ្ហាសរិរាង្គនៅក្នុងខ្យល់និងការដកដង្ហើមរបស់អ្នកតំណាងនៃពិភពសត្វ (សារពាង្គកាយ aerobic) ។ កាបូនឌីអុកស៊ីតក៏ត្រូវបានផលិតដោយអតិសុខុមប្រាណមួយចំនួនដែលជាលទ្ធផលនៃដំណើរការ fermentation ការដកដង្ហើមកោសិកា និងនៅក្នុងដំណើរការនៃការពុកផុយនៃសំណល់សរីរាង្គនៅក្នុងខ្យល់។ TO ប្រភព anthropogenicការបំភាយឧស្ម័ន CO2 ទៅក្នុងបរិយាកាសរួមមានៈ ការដុតបំផ្លាញប្រភពថាមពលហ្វូស៊ីល និងមិនមែនហ្វូស៊ីល ដើម្បីបង្កើតកំដៅ ផលិតអគ្គិសនី និងដឹកជញ្ជូនមនុស្ស និងទំនិញ។ សកម្មភាពឧស្សាហកម្មមួយចំនួន ដូចជាការផលិតស៊ីម៉ងត៍ និងការផ្ទុះឧស្ម័ន បណ្តាលឱ្យមានការបំភាយឧស្ម័ន CO2 យ៉ាងសំខាន់។
រុក្ខជាតិបំប្លែងកាបូនឌីអុកស៊ីតជាលទ្ធផលទៅជាកាបូអ៊ីដ្រាតតាមរយៈការធ្វើរស្មីសំយោគ ដែលត្រូវបានអនុវត្តតាមរយៈសារធាតុ chlorophyll ដោយប្រើថាមពល វិទ្យុសកម្មព្រះអាទិត្យ. ឧស្ម័នដែលជាលទ្ធផល អុកស៊ីហ៊្សែនត្រូវបានបញ្ចេញទៅក្នុងបរិយាកាសរបស់ផែនដី ហើយប្រើសម្រាប់ការដកដង្ហើមដោយសារពាង្គកាយ heterotrophic និងរុក្ខជាតិដទៃទៀត ដូច្នេះបង្កើតជាវដ្តកាបូន។
ប្រភពធម្មជាតិ
ប្រភពនៃការបំភាយឧស្ម័ន CO2 ភាគច្រើនគឺធម្មជាតិ។ សម្ភារៈសរីរាង្គដែលរលួយដូចជាដើមឈើងាប់ និងស្មៅបញ្ចេញកាបូនឌីអុកស៊ីត 220 ពាន់លានតោនជារៀងរាល់ឆ្នាំ។ មហាសមុទ្រនៃផែនដីភ្លើងឆេះព្រៃ និង peat របស់ឥណ្ឌូនេស៊ីក្នុងឆ្នាំ 1997 បានបញ្ចេញ 13-40% នៃការបញ្ចេញឧស្ម័នកាបូនិកប្រចាំឆ្នាំជាមធ្យមពីចំហេះឥន្ធនៈហ្វូស៊ីល ទោះបីជាកាបូនឌីអុកស៊ីតត្រូវបានណែនាំដំបូងចូលទៅក្នុងបរិយាកាសនៃផែនដីក៏ដោយ។ សកម្មភាពភ្នំភ្លើងភ្នំភ្លើងទំនើបបញ្ចេញឧស្ម័ន CO2 ជាមធ្យម 130-230 លានតោនជារៀងរាល់ឆ្នាំ ដែលតិចជាង 1% នៃការបំភាយ anthropogenic ។
នៅក្រោមលក្ខខណ្ឌធម្មតា ប្រភពធម្មជាតិទាំងនេះមានតុល្យភាពជាមួយនឹងដំណើរការរូបវ័ន្ត និងជីវសាស្រ្តដែលដកកាបូនឌីអុកស៊ីតចេញពីបរិយាកាស - ឧស្ម័នកាបូនិកមួយចំនួនរលាយក្នុង ទឹកសមុទ្រហើយខ្លះត្រូវបានយកចេញពីខ្យល់តាមរយៈដំណើរការនៃការធ្វើរស្មីសំយោគ។ ចាប់តាំងពីជាធម្មតាក្នុងអំឡុងពេល ដំណើរការនេះ។ 5.5 10 × 11 ដឺក្រេនៃកាបូនឌីអុកស៊ីតត្រូវបានស្រូបយក, និងរបស់វា។ ទំងន់សរុបវ បរិយាកាសផែនដីគឺ 3.03 1012 តោន បន្ទាប់មកជាមធ្យម CO2 បរិយាកាសទាំងអស់ចូលរួមក្នុងវដ្តកាបូនម្តងរៀងរាល់ប្រាំមួយឆ្នាំម្តង ដោយសារវត្តមាននៃការបំភាយឧស្ម័ន anthropogenic ការស្រូបយក CO2 ដោយ biosphere លើសពីការបញ្ចេញរបស់វា 17 ពាន់លានតោននៅពាក់កណ្តាលឆ្នាំ 2000 ។ អត្រានៃការស្រូបយករបស់វា វាមាន និន្នាការស្ថិរភាពបង្កើនជាមួយនឹងការបង្កើនកំហាប់បរិយាកាស។
ការបំភាយ Anthropogenic
ជាមួយនឹងការមកដល់ បដិវត្តន៍ឧស្សាហកម្មនៅពាក់កណ្តាលសតវត្សទី 19 មានការកើនឡើងជាបន្តបន្ទាប់នៃការបញ្ចេញកាបូនឌីអុកស៊ីតទៅក្នុងបរិយាកាស ដែលនាំឱ្យមានអតុល្យភាពនៅក្នុងវដ្តកាបូន និងការកើនឡើងនៃកំហាប់ CO2 ។ បច្ចុប្បន្ននេះប្រហែល 57% នៃកាបូនឌីអុកស៊ីតដែលផលិតដោយមនុស្សជាតិត្រូវបានដកចេញពីបរិយាកាសដោយរុក្ខជាតិនិងមហាសមុទ្រសមាមាត្រនៃការកើនឡើងនៃបរិមាណ CO2 នៅក្នុងបរិយាកាសទៅនឹងឧស្ម័ន CO2 សរុបដែលត្រូវបានបញ្ចេញ តម្លៃថេរប្រហែល 45% និងឆ្លងកាត់ការប្រែប្រួលរយៈពេលខ្លី និងការប្រែប្រួលជាមួយនឹងរយៈពេលប្រាំឆ្នាំ។
ការដុតឥន្ធនៈហ្វូស៊ីល ដូចជា ធ្យូងថ្ម ប្រេង និង ឧស្ម័នធម្មជាតិគឺជាមូលហេតុចម្បងនៃការបំភាយឧស្ម័ន CO2 របស់មនុស្ស ហើយការកាប់បំផ្លាញព្រៃឈើគឺជាមូលហេតុចម្បងទីពីរ។ ក្នុងឆ្នាំ 2008 ការដុតឥន្ធនៈហ្វូស៊ីលបានបញ្ចេញកាបូន 8.67 ពាន់លានតោនទៅក្នុងបរិយាកាស (31.8 ពាន់លានតោន CO2) កើនឡើងពី 6.14 ពាន់លានតោននៃការបំភាយកាបូនប្រចាំឆ្នាំ 1990 ។ ការកាប់បំផ្លាញព្រៃឈើសម្រាប់ការប្រើប្រាស់ដីបានបណ្តាលឱ្យមានការកើនឡើងនៃកាបូនឌីអុកស៊ីតបរិយាកាសដែលស្មើនឹងការដុតធ្យូងថ្មចំនួន 1.2 ពាន់លានតោនក្នុងឆ្នាំ 2008 (1.64 ពាន់លានតោនក្នុងឆ្នាំ 1990) ដែលជាការកើនឡើងសរុបក្នុងរយៈពេល 18 ឆ្នាំគឺ 3% នៃវដ្ត CO2 ធម្មជាតិប្រចាំឆ្នាំ វាគ្រប់គ្រាន់ហើយក្នុងការដកប្រព័ន្ធចេញពីលំនឹង និងសម្រាប់ការកើនឡើងកម្រិត CO2 ជាលទ្ធផល កាបូនឌីអុកស៊ីតបានប្រមូលផ្តុំបន្តិចម្តងៗនៅក្នុងបរិយាកាស ហើយនៅឆ្នាំ ២០០៩ កំហាប់របស់វាគឺខ្ពស់ជាងតម្លៃមុនឧស្សាហកម្ម ៣៩%។
ដូច្នេះបើទោះបីជាការពិតដែលថា (គិតត្រឹមឆ្នាំ 2011) ការបំភាយឧស្ម័ន anthropogenic សរុបមិនលើសពី 8% នៃវដ្តប្រចាំឆ្នាំធម្មជាតិរបស់វា វាមានការកើនឡើងនៃការប្រមូលផ្តុំដោយសារតែមិនត្រឹមតែកម្រិតនៃការបំភាយ anthropogenic ប៉ុណ្ណោះទេប៉ុន្តែក៏មានផងដែរ។ កំណើនថេរកម្រិតនៃការបំភាយឧស្ម័នតាមពេលវេលា។
ការផ្លាស់ប្តូរសីតុណ្ហភាព និងវដ្តកាបូន
កត្តាផ្សេងទៀតដែលបង្កើនមាតិកា CO2 នៅក្នុងបរិយាកាសរួមមានការកើនឡើងនៃសីតុណ្ហភាពជាមធ្យមក្នុងសតវត្សទី 20 ដែលគួរត្រូវបានឆ្លុះបញ្ចាំងនៅក្នុងការបង្កើនល្បឿននៃការពុកផុយនៃសំណល់សរីរាង្គ និងដោយសារការឡើងកំដៅនៃមហាសមុទ្រ ការថយចុះនៃបរិមាណសរុប។ កាបូនឌីអុកស៊ីតរលាយក្នុងទឹក។ ការកើនឡើងនៃសីតុណ្ហភាពក៏ដោយសារតែកម្រិតខ្ពស់ពិសេស សកម្មភាពព្រះអាទិត្យក្នុងអំឡុងពេលនេះ និងក្នុងសតវត្សទី 19 (សូមមើលឧទាហរណ៍ ព្រឹត្តិការណ៍ Carrington ឆ្នាំ 1859)។
ក្នុងអំឡុងពេលនៃការផ្លាស់ប្តូរពីអាកាសធាតុត្រជាក់ទៅជាអាកាសធាតុក្តៅក្នុងរយៈពេលមួយលានឆ្នាំមុន ការផ្លាស់ប្តូរធម្មជាតិនៃកំហាប់ CO2 បរិយាកាសនៅតែមានក្នុងរង្វង់ 100 ppm ដែលមានន័យថាការកើនឡើងសរុបគឺតិចជាង 40% ។ ជាងនេះទៅទៀត ជាឧទាហរណ៍ សីតុណ្ហភាពជាមធ្យមនៃភពផែនដី កំឡុងពេលនៃអាកាសធាតុល្អបំផុត 9000-5000 ឆ្នាំ មុនគ.ស។ គឺប្រហែល 1 - 2 °C ខ្ពស់ជាងថ្ងៃនេះ ហើយដោយសារតែឥទ្ធិពលផ្ទះកញ្ចក់កាន់តែច្បាស់នៅក្នុងអាកាសធាតុក្តៅ សីតុណ្ហភាពប្រចាំឆ្នាំជាមធ្យមនៃភាពមិនធម្មតានៅក្នុងរយៈទទឹង subarctic បានឈានដល់ 9 °C ។
កាបូនម៉ូណូអុកស៊ីត (IV) អាស៊ីតកាបូនិក និងអំបិលរបស់វា។
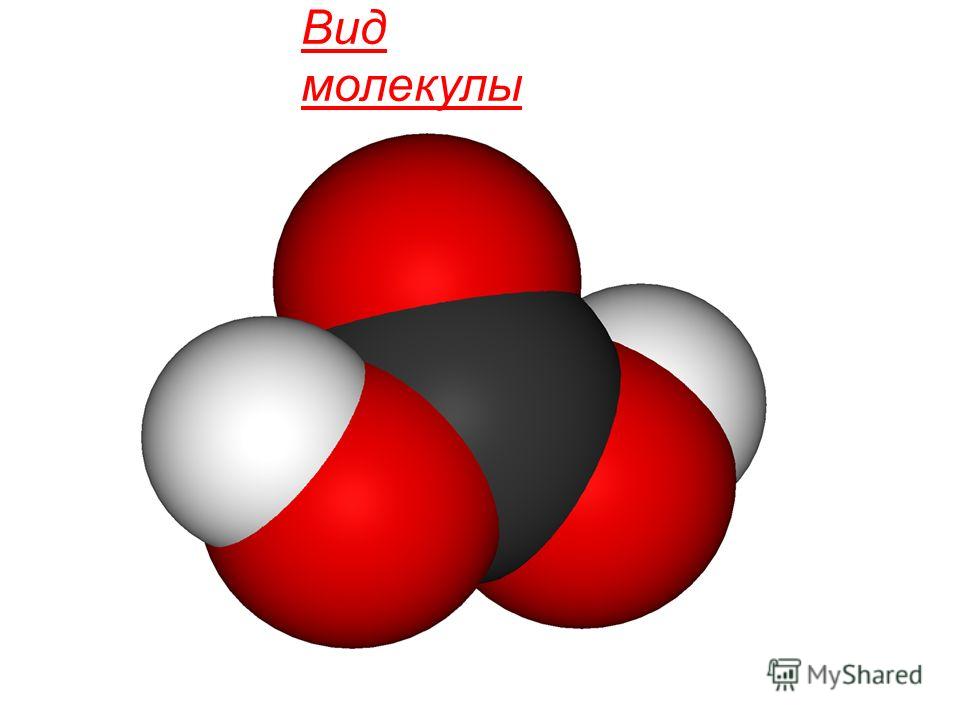
ឃ កាបូនម៉ូណូអុកស៊ីត CO 2 (កាបូនឌីអុកស៊ីត) - នៅ លក្ខខណ្ឌធម្មតា។វាជាឧស្ម័នគ្មានពណ៌ និងគ្មានក្លិន មានរសជាតិជូរបន្តិច ធ្ងន់ជាងខ្យល់ប្រហែល 1,5 ដង រលាយក្នុងទឹក រាវបានយ៉ាងងាយ (នៅ សីតុណ្ហភាពបន្ទប់នៅក្រោមសម្ពាធប្រហែល 60 ∙ 10 5 Pa វាអាចប្រែទៅជារាវ) ។ នៅពេលដែលត្រជាក់ដល់ −56.2ºС កាបូនឌីអុកស៊ីតរាវនឹងរឹង ហើយប្រែទៅជាម៉ាស់ដូចព្រិល។
ជារួម រដ្ឋនៃការប្រមូលផ្តុំមានម៉ូលេគុលលីនេអ៊ែរដែលមិនមានប៉ូល រចនាសម្ព័ន្ធគីមីម៉ូលេគុល CO 2 ត្រូវបានកំណត់ដោយ sp-hybridization នៃអាតូមកាបូនកណ្តាល និងការបង្កើតπបន្ថែម។ r-r-ការតភ្ជាប់: O = C = O ។
CO 2 មួយចំនួនដែលរលាយក្នុងនឹងធ្វើអន្តរកម្មជាមួយវាដើម្បីបង្កើតជាអាស៊ីតកាបូនិក៖
CO 2 + H 2 O ↔ CO 2 ∙ H 2 O ↔ H 2 CO 3 ។
កាបូនឌីអុកស៊ីតត្រូវបានស្រូបយកបានយ៉ាងងាយដោយដំណោះស្រាយអាល់កាឡាំងដើម្បីបង្កើតជាកាបូននិងប៊ីកាបូណាតៈ
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O; CO 2 + NaOH = NaHCO ៣.
ម៉ូលេគុល CO 2 មានស្ថេរភាពកម្ដៅខ្លាំង ការរលួយចាប់ផ្តើមតែនៅសីតុណ្ហភាព 2000ºC ប៉ុណ្ណោះ។ សម្រាប់ហេតុផលនេះកាបូនឌីអុកស៊ីតមិនឆេះនិងមិនគាំទ្រការឆេះនៃឥន្ធនៈធម្មតា។ ប៉ុន្តែនៅក្នុងបរិយាកាសរបស់វាខ្លះកំពុងឆេះ សារធាតុសាមញ្ញអាតូមដែលបង្ហាញពីភាពស្និទ្ធស្នាលខ្ពស់សម្រាប់អុកស៊ីសែន ឧទាហរណ៍ ម៉ាញេស្យូម នៅពេលកំដៅ បញ្ឆេះក្នុងបរិយាកាស CO 2 ។
អាស៊ីតកាបូន H 2 CO 3 គឺជាសមាសធាតុខ្សោយ ហើយមាននៅក្នុងដំណោះស្រាយ aqueous ប៉ុណ្ណោះ។ ភាគច្រើនកាបូនឌីអុកស៊ីតដែលរលាយក្នុងទឹកមានទម្រង់ជាម៉ូលេគុលអ៊ីដ្រូសែន CO 2 ដែលតូចជាងបង្កើតជាអាស៊ីតកាបូន។
សូលុយស្យុងទឹកក្នុងលំនឹងជាមួយ CO2 បរិយាកាសមានអាសុីត: = 0.04 M និង pH ≈ 4 ។
អាស៊ីតកាបូនគឺជាឌីបាស៊ីក និងជារបស់ អេឡិចត្រូលីតខ្សោយ, dissociates stepwise (K 1 = 4, 4 ∙ 10 −7; K 2 = 4, 8 ∙ 10 −11) ។ នៅពេលដែល CO 2 ត្រូវបានរំលាយនៅក្នុងទឹក លំនឹងថាមវន្តខាងក្រោមត្រូវបានបង្កើតឡើង៖
H 2 O + CO 2 ↔ CO 2 ∙ H 2 O ↔ H 2 CO 3 ↔ H + + HCO 3 −
នៅពេលកំដៅ ដំណោះស្រាយទឹក។កាបូនឌីអុកស៊ីត ភាពរលាយនៃឧស្ម័នថយចុះ CO 2 ត្រូវបានបញ្ចេញចេញពីដំណោះស្រាយ ហើយលំនឹងផ្លាស់ទីទៅខាងឆ្វេង។
ក្នុងនាមជាឌីបាស៊ីក អាស៊ីតកាបូនិកបង្កើតជាអំបិលស៊េរីពីរ៖ អំបិលមធ្យម (កាបូន) និងអំបិលអាស៊ីត (ប៊ីកាបូណាត)។ អំបិលអាស៊ីតកាបូនិកភាគច្រើនគ្មានពណ៌។ ក្នុងចំណោមកាបូណាត មានតែអំបិលប៉ុណ្ណោះដែលអាចរលាយក្នុងទឹកបាន។ លោហធាតុអាល់កាឡាំងនិងអាម៉ូញ៉ូម។
នៅក្នុងទឹក កាបូណាតឆ្លងកាត់អ៊ីដ្រូលីស៊ីស ហើយដូច្នេះដំណោះស្រាយរបស់វាមាន ប្រតិកម្មអាល់កាឡាំង:
Na 2 CO 3 + H 2 O ↔ NaHCO 3 + NaOH ។
អ៊ីដ្រូលីស៊ីតបន្ថែមទៀតជាមួយនឹងការបង្កើតអាស៊ីតកាបូនិកអនុវត្តមិនកើតឡើងក្រោមលក្ខខណ្ឌធម្មតាទេ។
ការរំលាយអ៊ីដ្រូកាបូនក្នុងទឹកក៏ត្រូវបានអមដោយអ៊ីដ្រូលីស៊ីសដែរ ប៉ុន្តែក្នុងកម្រិតតិចជាងនេះ ហើយបរិស្ថានត្រូវបានបង្កើតអាល់កាឡាំងបន្តិច (pH ≈ 8) ។
អាម៉ូញ៉ូមកាបូណាត (NH 4) 2 CO 3 គឺងាយនឹងបង្កជាហេតុខ្ពស់នៅសីតុណ្ហភាពខ្ពស់ និងសូម្បីតែនៅសីតុណ្ហភាពធម្មតា ជាពិសេសនៅក្នុងវត្តមាននៃចំហាយទឹក ដែលបណ្តាលឱ្យមានអ៊ីដ្រូលីស៊ីសធ្ងន់ធ្ងរ។
អាស៊ីតខ្លាំង និងសូម្បីតែអាស៊ីតអាសេទិកខ្សោយ បំប្លែងអាស៊ីតកាបូនិកពីកាបូនិក៖
K 2 CO 3 + H 2 SO 4 = K 2 SO 4 + H 2 O + CO 2 ។
មិនដូចកាបូណាតភាគច្រើនទេ ប៊ីកាបូណាតទាំងអស់គឺរលាយក្នុងទឹក។ Οʜᴎមានស្ថេរភាពតិចជាងកាបូននៃលោហធាតុដូចគ្នា ហើយនៅពេលដែលកំដៅ ងាយរលួយ ប្រែទៅជាកាបូនដែលត្រូវគ្នា៖
2KHCO 3 = K 2 CO 3 + H 2 O + CO 2;
Ca(HCO 3) 2 = CaCO 3 + H 2 O + CO 2 ។
អាស៊ីតខ្លាំងអ៊ីដ្រូកាបូនរលាយដូចកាបូន៖
KHCO 3 + H 2 SO 4 = KHSO 4 + H 2 O + CO 2
ពីអំបិលអាស៊ីតកាបូន តម្លៃខ្ពស់បំផុតមានសូដ្យូមកាបូន (សូដា) ប៉ូតាស្យូមកាបូណាត (ប៉ូតាស្យូម) កាល់ស្យូមកាបូណាត (ដីសថ្មម៉ាបថ្មកំបោរ) សូដ្យូមប៊ីកាកាបូណាត (សូដាដុតនំ) និងកាបូនទង់ដែងមូលដ្ឋាន (CuOH) 2 CO 3 (malachite) ។
អំបិលមូលដ្ឋាននៃអាស៊ីតកាបូនិកគឺមិនរលាយក្នុងទឹក ហើយងាយរលួយពេលត្រូវកម្ដៅ៖
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O ។
ស្ថេរភាពកម្ដៅនៃកាបូនគឺអាស្រ័យលើលក្ខណៈសម្បត្តិប៉ូលនៃអ៊ីយ៉ុងដែលបង្កើតជាកាបូន។ កាលណាមានប៉ូឡារីងស៊ីតុងកាន់តែច្រើននៅលើអ៊ីយ៉ុងកាបូណាត សីតុណ្ហភាពរលាយអំបិលកាន់តែទាប។ ប្រសិនបើ cation អាចខូចទ្រង់ទ្រាយបានយ៉ាងងាយស្រួល នោះអ៊ីយ៉ុងកាបូនខ្លួនឯងក៏នឹងមានឥទ្ធិពលប៉ូលលើ cation ដែលនឹងនាំឱ្យមានការថយចុះយ៉ាងខ្លាំងនៃសីតុណ្ហភាព decomposition នៃអំបិល។
សូដ្យូម និងប៉ូតាស្យូមកាបូណាតរលាយដោយមិនរលួយ ហើយកាបូណាតផ្សេងទៀតភាគច្រើននៅពេលដែលកំដៅវារលួយទៅជាអុកស៊ីដលោហៈ និងកាបូនឌីអុកស៊ីត៖
MgCO 3 = MgO + CO 2 ។
កាបូនម៉ូណូអុកស៊ីត
ម៉ូលេគុល CO មានរចនាសម្ព័ន្ធដូចខាងក្រោម
: ជាមួយ ≡ អំពី :
ចំណងពីរត្រូវបានបង្កើតឡើងដោយសារតែការផ្គូផ្គងនៃអេឡិចត្រុង 2p នៃអាតូមកាបូន និងអុកស៊ីហ៊្សែន ចំណងទីបីត្រូវបានបង្កើតឡើងដោយយន្តការអ្នកទទួលជំនួយដោយសារគន្លង 2p សេរីនៃកាបូន និងគូអេឡិចត្រុង 2p នៃអាតូមអុកស៊ីសែន។ ពេល dipole នៃម៉ូលេគុលគឺមិនសំខាន់ទេ ខណៈពេលដែលការចោទប្រកាន់ដ៏មានប្រសិទ្ធិភាពនៅលើអាតូមកាបូនគឺអវិជ្ជមាន ហើយនៅលើអាតូមអុកស៊ីហ៊្សែនវាមានភាពវិជ្ជមាន។
ដោយសាររចនាសម្ព័ន្ធនៃម៉ូលេគុល CO គឺស្រដៀងនឹងរចនាសម្ព័ន្ធនៃម៉ូលេគុលអាសូត ពួកវាគឺស្រដៀងគ្នា លក្ខណៈសម្បត្តិរាងកាយ. CO មានច្រើន។ សីតុណ្ហភាពទាបរលាយ (- 204ºС) និងឆ្អិន (- 191.5ºС) វាគ្មានពណ៌ខ្លាំងណាស់ ឧស្ម័នពុលគ្មានក្លិន ស្រាលជាងខ្យល់បន្តិច។ វាមិនរលាយក្នុងទឹក ហើយមិនមានអន្តរកម្មជាមួយវាទេ។
CO ត្រូវបានចាត់ទុកថាជាអុកស៊ីដមិនបង្កើតអំបិល ពីព្រោះ នៅក្រោមលក្ខខណ្ឌធម្មតា វាមិនមានប្រតិកម្មជាមួយអាស៊ីត ឬអាល់កាឡាំងទេ។ វាត្រូវបានបង្កើតឡើងកំឡុងពេលចំហេះនៃធ្យូងថ្មនិងសមាសធាតុកាបូនជាមួយនឹងការចូលប្រើអុកស៊ីសែនមានកម្រិតក៏ដូចជាកំឡុងពេលអន្តរកម្មនៃកាបូនឌីអុកស៊ីតជាមួយធ្យូងថ្មក្តៅ: CO 2 + C = 2CO ។
នៅក្នុងមន្ទីរពិសោធន៍ វាត្រូវបានទទួលពីអាស៊ីត formic ដោយសកម្មភាពនៃអាស៊ីតស៊ុលហ្វួរីកកំហាប់នៅលើវានៅពេលកំដៅ៖
HCOOH + H 2 SO 4 (conc.) = CO + H 2 SO 4 ∙ H 2 O ។
អ្នកក៏អាចប្រើអាស៊ីត oxalic ផងដែរ។ អាស៊ីតស៊ុលហ្វួរីកនៅក្នុងប្រតិកម្មទាំងនេះ វាដើរតួជាភ្នាក់ងារយកទឹកចេញ។
នៅក្រោមលក្ខខណ្ឌធម្មតា ឧស្ម័នកាបូនម៉ូណូអុកស៊ីតគឺមានលក្ខណៈគីមី ប៉ុន្តែនៅពេលដែលកំដៅវាបង្ហាញ លក្ខណៈសម្បត្តិស្តារឡើងវិញដែលត្រូវបានគេប្រើយ៉ាងទូលំទូលាយនៅក្នុង pyrometallurgy ដើម្បីទទួលបានលោហៈជាក់លាក់៖ Fe 2 O 3 + 3CO = 2Fe + 3CO 2 ។
នៅក្នុងខ្យល់ CO ឆេះដោយអណ្តាតភ្លើងពណ៌ខៀវបញ្ចេញ បរិមាណដ៏ច្រើន។កំដៅ: 2CO + O 2 = 2CO 2 + 569 kJ ។
បន្ថែមពីលើអុកស៊ីសែននៅលើបន្ទាត់ ពន្លឺព្រះអាទិត្យឬនៅក្នុងវត្តមាននៃកាតាលីករ (កាបូនដែលបានធ្វើឱ្យសកម្ម) CO រួមផ្សំជាមួយក្លរីនដើម្បីបង្កើតផូហ្សេនៈ
CO + Cl 2 = COCl ២.
Phosgene គឺជាឧស្ម័នគ្មានពណ៌ដែលមានក្លិនលក្ខណៈ។ វារលាយក្នុងទឹកបន្តិច ប៉ុន្តែដោយសារអាស៊ីតកាបូនិកក្លរួ វារលាយបន្តិចម្តងៗតាមគ្រោងការណ៍ខាងក្រោម៖ COCl 2 + 2H 2 O = 2HCl + H 2 CO 3 ។ ដោយសារតែការពុលខ្ពស់របស់វា phosgene ត្រូវបានគេប្រើជាលើកដំបូងជាភ្នាក់ងារសង្គ្រាមគីមី។ សង្គ្រាមលោក. វាអាចត្រូវបានបន្សាបដោយប្រើកំបោរ។
នៅពេលដែលកំដៅ CO ត្រូវបានកត់សុីដោយស្ពាន់ធ័រ: CO + S = COS ។
ម៉ូលេគុល CO អាចដើរតួជា ligand នៅក្នុងសមាសធាតុស្មុគស្មាញផ្សេងៗ។ ដោយសារតែគូអេឡិចត្រុងដែលមិនជាប់ចំណង វាបង្ហាញលក្ខណៈសម្បត្តិ σ-ម្ចាស់ជំនួយ ហើយដោយសារតែ π-antibonding orbitals ឥតគិតថ្លៃ វាបង្ហាញលក្ខណៈសម្បត្តិ π-ទទួល។ ចំណាប់អារម្មណ៍ពិសេសតំណាងឱ្យស្មុគ្រស្មាញ carbonyl នៃ d-metals, ដោយសារតែ ការរំលាយកំដៅ Carbonyls ផលិតលោហធាតុដែលមានភាពបរិសុទ្ធខ្ពស់។
អាស៊ីតកាបូនិក (រូបមន្ត H2CO3) គឺជាអាស៊ីតឌីបាស៊ីកខ្សោយ។ នៅពេលដែលដំណោះស្រាយត្រូវបានកំដៅវា decompose ចូលទៅក្នុងទឹក។ អាស៊ីតនេះមាន តម្លៃដ៏អស្ចារ្យមិនត្រឹមតែសម្រាប់សត្វប៉ុណ្ណោះទេ ថែមទាំងសម្រាប់រុក្ខជាតិទៀតផង។ នៅក្នុងខ្លួនមនុស្ស H2CO3 ក៏ដូចជាអំបិលរបស់វា គឺជាផ្នែកមួយនៃឈាម។ ការប្រើប្រាស់ដែលគាំទ្រ តុល្យភាពអាស៊ីត - មូលដ្ឋាននៅក្នុងរាងកាយដែលចាំបាច់សម្រាប់ជីវិតធម្មតា។ ការបំបែកអាស៊ីតនៅក្នុង បរិស្ថានទឹកនាំឱ្យមានការបង្កើត anions និង cations ។ ការប្រមូលផ្តុំអ៊ីយ៉ុងមានសារៈសំខាន់ខ្លាំងសម្រាប់លំហូរនៃមនុស្សជាច្រើន ដំណើរការជីវគីមីនៅក្នុងរាងកាយរបស់សត្វនិងរុក្ខជាតិ។ សម្រាប់ជំងឺមួយចំនួន ប្រតិកម្មសកម្មឈាមផ្លាស់ប្តូរទៅជាអាស៊ីត (ជាមួយដំបៅ duodenumនិងក្រពះ) ឬអាល់កាឡាំង (សម្រាប់ sepsis, រលាកសួត) ចំហៀង។ ជាមួយនឹង acidosis កំហាប់អ៊ីយ៉ុងអ៊ីដ្រូសែនកើនឡើង។ ការផ្លាស់ប្តូរបែបនេះ, នៅក្នុងវេន, provoke ការអភិវឌ្ឍនៃ លទ្ធផលចុងក្រោយនាំឱ្យសត្វស្លាប់ខ្លួនឯង។ ជាមួយនឹង alkalosis កំហាប់នៃ cations នៅក្នុងឈាមកើនឡើងដែលនាំឱ្យមានជំងឺតេតាណូសនិងការស្លាប់របស់សត្វ។
អាស៊ីតកាបូនត្រូវបានបង្កើតឡើងកំឡុងពេលប្រតិកម្ម CO2 ជាមួយ H2O ។ អ្នកស្រាវជ្រាវភាគច្រើនជឿថា ការអភិវឌ្ឍន៍មិនគួរឱ្យជឿនៃបន្លែនៅក្នុងពិភពបុព្វកាលត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងកំហាប់អាស៊ីតកាបូនិចនៅក្នុងបរិយាកាស។ ការលូតលាស់ខ្លាំងបំផុតត្រូវបានគេសង្កេតឃើញនៅក្នុងរុក្ខជាតិទាំងនោះដែលត្រូវបានដាំដុះជាមួយនឹងការកើនឡើង (5-10%) នៃអាស៊ីតកាបូននៅក្នុងបរិយាកាស។
គួរកត់សម្គាល់ថារុក្ខជាតិមានកាបូនពាក់កណ្តាល។ អាស៊ីតកាបូនជួយចិញ្ចឹមរុក្ខជាតិ ខណៈពេលដែលលើកកម្ពស់ការរលាយនៃសមាសធាតុរ៉ែនៃដី។ ដូច្នេះនៅក្នុង ក្នុងករណីនេះនេះ។ សមាសធាតុចាំបាច់ដី។ ដោយសារអាស៊ីតកាបូនរារាំងអតិសុខុមប្រាណ nitrifying ដីគួរតែមានកំហាប់អប្បបរមារបស់វា។
ដូច្នេះដើម្បីទទួលបានទិន្នផលខ្ពស់វាចាំបាច់ដើម្បីធ្វើឱ្យមានតុល្យភាពនៃកំហាប់អាស៊ីតនេះ។ អ្នកវិទ្យាសាស្ត្របានបង្កើតនៅក្នុងការពិសោធន៍របស់ពួកគេថា ជាមួយនឹងការណែនាំប្រចាំថ្ងៃនៃអាស៊ីតកាបូន (400 cm3) និងខ្យល់ (1200 cm3) ទៅក្នុងដី វាបង្កើតបានរុក្ខជាតិពីរដងច្រើនជាងបើធៀបនឹងដីដែលមិនមានសមាសធាតុទាំងនេះ។
ដីជនបទត្រូវបានកំណត់លក្ខណៈដោយខ្យល់ដ៏បរិបូរណ៍ ដូច្នេះដំណើរការនៃ nitrification និងការពុកផុយកើតឡើងយ៉ាងខ្លាំង។ វាត្រូវបានបង្កើតឡើងដែលស្លឹកឈើនៅក្នុងព្រៃរលួយទាំងស្រុងក្នុងរយៈពេលមួយឆ្នាំ។ nitrification ដ៏ខ្លាំងក្លាបែបនេះក៏កើតឡើងនៅក្នុងវាលស្មៅដែរ។ កំឡុងពេលដំណើរការរលួយ បរិមាណអាស៊ីតកាបូនិកយ៉ាងច្រើនត្រូវបានបញ្ចេញ។ ក្រោយមកទៀតគឺធ្ងន់ជាងខ្យល់មួយដងកន្លះ ដូច្នេះអាស៊ីតកាបូនបានជ្រាបចូលទៅក្នុងដីកាន់តែជ្រៅជាងខ្យល់ ហើយមានឥទ្ធិពលនៅទីនោះ។ ឥទ្ធិពលដែលមានប្រយោជន៍លើសមាសធាតុរ៉ែ។
ជាមួយនឹងការភ្ជួរជ្រៅ សំណល់សរីរាង្គធ្លាក់ចូលទៅក្នុងស្រទាប់ជ្រៅនៃដី ដែលមិនមាន O2 ប៉ុន្តែមានអាស៊ីតកាបូនិកច្រើន។ ក្នុងករណីនេះ nitrification កើតឡើងយឺតណាស់។ នៅក្រោមលក្ខខណ្ឌទាំងនេះសមាសធាតុរ៉ែមិនរលួយទេហើយសមាសធាតុអាសូតមិនត្រូវបានបង្កើតឡើងទេ។ លាមកសត្វធំៗនៅក្នុងដីរាប់ឆ្នាំដោយមិនរលួយ។ ម្ចាស់ដីត្រូវបានបង្ខំឱ្យទិញជីសំយោគ (kainite, superphosphate, បច្ចេកវិទ្យាច្នៃប្រឌិតការភ្ជួររាស់អាចបង្កើនផលិតភាពរបស់រុក្ខជាតិ។ នេះជាចម្បងដោយសារតែការពិតដែលថានៅក្នុងដំណើរការនៃការដាំដុះដីសំណល់សរីរាង្គនៅតែមាន។ កំពុងត្រូវបានបង្កើតឡើង លក្ខខណ្ឌល្អបំផុតសម្រាប់ការអភិវឌ្ឍនិងការបន្តពូជនៃ microorganisms nitrifying ។
ផូស្វ័រដែលមាននៅក្នុងដីមិនតែងតែត្រូវបានស្រូបយកដោយរុក្ខជាតិទេ។ កាល់ស្យូម Tribasic phosphate គឺជាសមាសធាតុរលាយតិចតួច។ ដូច្នេះដីដែលសម្បូរទៅដោយសមាសធាតុអាស៊ីត phosphoric ក្លាយជាគ្មានកូន។
