Растворение как физико-химический процесс
Растворы образуются при взаимодействии растворителя и растворённого вещества. Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией).

Рис.1 Процесс растворения электролитов.
Растворение протекает с образованием различных по форме и прочности продуктов - гидратов. При этом участвуют силы как физической, так и химической природы. Процесс растворения вследствие такого рода взаимодействий компонентов сопровождается различными тепловыми явлениями.
Энергетической характеристикой растворения является теплота образования раствора, рассматриваемая как алгебраическая сумма тепловых эффектов всех эндо - и экзотермических стадий процесса. Наиболее значительными среди них являются:
– поглощающие тепло процессы - разрушение кристаллической решётки, разрывы химических связей в молекулах;
– выделяющие тепло процессы - образование продуктов взаимодействия растворённого вещества с растворителем (гидраты) и др.
Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание). Так, растворение NaOH – экзотермический процесс: на разрушение кристаллической решётки тратится 884 кДж/моль, а при образовании гидратированных ионов Na+ и OH- выделяется соответственно 422 и 510 кДж/моль.
Если энергия кристаллической решётки больше энергии гидратации, то растворение протекает с поглощением теплоты (при приготовлении водного раствора NH 4 NO 3 наблюдается понижение температуры).
Взаимная растворимость жидкостей или твердых веществ в жидкостях зависит от ряда свойств этих веществ: химической природы, величины и строения частиц, электрического заряда (в случае ионов), дипольных моментов и т. д.
Известна так называемая неограниченная растворимость, когда две жидкости растворяются одна в другой во всех соотношениях, и ограниченная, когда растворимость одной жидкости в другой ограничена определенной концентрацией.
При ограниченной взаимной растворимости двух жидкостей А и Б каждая из них растворяется, причем после отстаивания образуется два слоя, которые располагаются один над другим в порядке уменьшения плотности и состоят один из раствора Б в А, а другой -- из раствора А в Б.
Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. От химических соединений растворы отличаются переменностью своего состава, а от вторых - своей однородностью. Вот почему растворами называют однофазные системы переменного состава, образованные не менее чем двумя независимыми компонентами.
Д.И. Менделеев впервые стал рассматривать растворение не только как физический процесс, но и как процесс химического взаимодействия растворяемого вещества с растворителем. В частности, при растворении всегда поглощается или выделяется энергия (теплота растворения) и изменяется объем жидкости.
Исследование растворов с помощью разных методов дало возможность установить наличие во многих из них так называемых сольватов или гидратов, которые образуются в результате соответствующих процессов сольватации и гидратации.
Гидратация веществ в водных растворах составляет отдельный случай сольватации всяким растворителем. Если растворитель вода, то эти соединения называются гидратами. Процесс гидратации следует рассматривать как химическую реакцию присоединения воды к веществу. Гидратация происходит под влиянием сил молекулярного взаимодействия молекул воды и гидратированного вещества. Соли гидратируются ионами, имеющими значительные электрические поля, которые притягивают электрические полярные молекулы воды. Чем сильнее поле иона, то есть чем больший его заряд и меньший радиус, тем сильнее он гидратируется и тем крепче образованные гидраты. Образование сольватов во многих случаях изменяет свойства растворяемого вещества, что легко определяется непосредственным наблюдением.
Например, йод, который состоит из отдельных молекул, в газообразном состоянии имеет фиолетовое окрашивание. Такое же окрашивание сохраняется при растворении йода в бензине. Если же йод растворить в спирте, получается раствор темно-коричневого цвета. Эта смена окраски свидетельствует о наличии взаимодействия между молекулами йода и спирта.
Гидраты - довольно неустойчивые соединения, во многих случаях разлагаются уже при выпаривании растворов. Но иногда гидратная вода настолько прочно связана с молекулами растворенного вещества, что при выделении последнего из раствора она входит в состав его кристаллов. К таким лекарственным веществам относятся глюкоза, терпингидрат, магния сульфат, меди сульфат, квасцы, кодеин и др., которые являются кристаллогидратами с различным содержанием кристаллизационной воды. При удалении воды из кристаллогидратов они изменяют внешний вид и отдельные свойства (меди сульфат, гипс, кристаллическая сода и др.).
В гидратированном состоянии пребывают и отдельные ионы растворенной в воде соли, что имеет определяющее значение для многих свойств растворов солей. Идея гидратации ионов в растворах была впервые высказана И.А. Каблуковым и В.А. Кистяковским.
Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях).
Препарат считают растворившимся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества. Относительно растворимости в некоторой степени руководствуются старым положением «подобное растворяется в подобном» (similia similibus solventur ), то есть в свете современных взглядов на строение молекулы это представляется так: в неполярных растворителях (бензин, эфир и др.) хорошо растворяются разные соединения с неполярными или малополярными молекулами и не растворяются вещества другого типа. Наоборот, растворитель с сильно выраженным полярным характером молекул (вода), как правило, растворяет вещества с молекулами полярного и отчасти ионного типов и не растворяет вещества с неполярными молекулами. К полярным растворителям относятся жидкости, сочетающие большую диэлектрическую постоянную, большой дипольный момент, с наличием функциональных групп, обеспечивающих образование координационных (большей частью водородных) связей: вода, кислоты, низшие спирты и гликоли, амины и т. д. Наличие полярных групп в молекуле вещества сильно влияет на его растворимость.
Как правило, вещества хорошо растворимы в воде и друг в друге, если на каждую полярную группу приходится не более трех атомов углеводородного радикала. При большем наличии углеводородных радикалов между молекулами возникают столь большие дисперсионные силы, что они препятствуют растворению таких веществ в полярных растворителях.
Полярные вещества - это вещества с ионной (ионные кристаллы) и полярной связью (полярные молекулы), например, натрия хлорид.
К неполярным растворителям относятся жидкости с малым дипольным моментом, не имеющие активных функциональных групп, например, углеводороды, галоидалкилы и др. Неполярные вещества - это вещества строго симметричной структуры, без электрических полюсов (например, парафин, скипидар, камфора, тимол и др.).
Однако вышеприведенное правило не всегда действительно, особенно в применении к сложным органическим соединениям, которые содержат как полярные (-ОН, -SO 3 H, -NH 2 , -COOH, -COONa), так и неполярные (алкильные или арильные радикалы) группы. К таким соединениям относятся углеводы, спирты, кетоны, органические кислоты, амины и др. Растворимость этих веществ зависит от преобладания полярных или неполярных групп. Например, спирт этиловый С 2 Н 5 ОН смешивается с водой в любых соотношениях, амиловый С 5 Н 11 ОН - не выше 10 %, а спирт цетиловый С 16 Н 33 ОН практически в воде не растворяется
Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления.
1)Природа растворяемого вещества.

Рис.2 Природа растворенного вещества.
Кристаллические вещества подразделяются на:
P - хорошо растворимые (более 1,0 г на 100 г воды);
M - малорастворимые (0,1 г - 1,0 г на 100 г воды);
Н - нерастворимые (менее 0,1 г на 100 г воды).
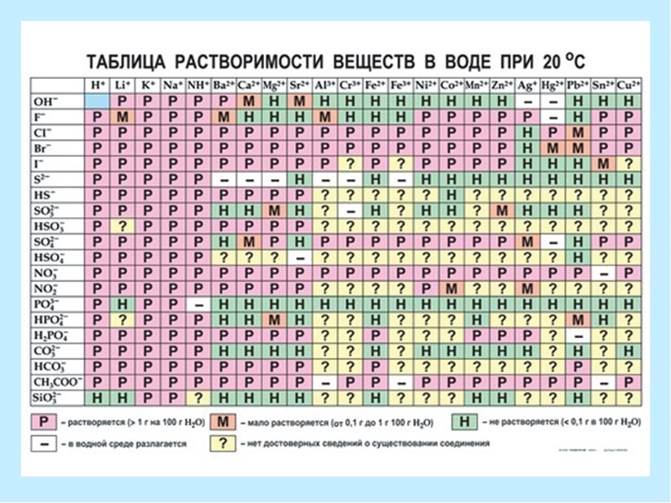
Рис.3. Таблица растворимости.
2) Природа растворителя. При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а
молекулярные вещества - наоборот.
Вода - уникальный, наиболее распространенный и доступный растворитель. Водные растворы неорганических (соли, кислоты, основания) и органических (аминокислоты, азотистые основания, нуклеиновые кислоты) веществ, низко – и высокомолекулярных соединений, электролитов и неэлектролитов, составляют основу важнейших биологических жидкостей, в которых протекают все физико – химические процессы, обеспечивающие жизнедеятельность организма. Например, в медицине используют искусственные аналоги биологических жидкостей – коллоидные и солевые кровезаменяющие растворы.

Рис. 4. Зависимость растворимости веществ от природы растворимости.
3)Влияние температуры. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Например, Ca(OH)2 в воде) и наоборот. Для большинства солей характерно увеличение растворимости при нагревании. Практически все газы растворяются с выделением тепла. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается.
4) Влияние давления. С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
Растворы веществ с молярной массой меньше 5000 г/моль называются растворами низкомолекулярных соединений (НМС), а растворы веществ с молярной массой больше 5000 г/моль – растворами высокомолекулярных соединений (ВМС).
По наличию или отсутствию электролитической диссоциации растворы НМС подразделяют на два класса – растворы электролитов и неэлектролитов.
Таблица 1.
Таблица электролитов и неэлектролитов.
Растворы электролитов – растворы диссоциирующих на ионы солей, кислот, оснований, амфолитов. Например, растворы KNО3, HCl, КОН, Аl(ОН)3, глицина. Электрическая проводимость растворов электролитов выше, чем растворителя.
Растворы неэлектролитов – растворы веществ, практически не диссоциирующих в воде. Например, растворы сахарозы, глюкозы, мочевины. Электрическая проводимость растворов неэлектролитов мало отличается от растворителя.
Растворы НМС (электролитов и неэлектролитов) называются истинными в отличие от коллоидных растворов. Истинные растворы характеризуются гомогенностью состава и отсутствием поверхности раздела между растворенным веществом и растворителем. Размер растворенных частиц (ионов и молекул) меньше 10 -9 м.
Большинство ВМС – полимеры, молекулы которых (макромолекулы) состоят из большого числа повторяющихся группировок или мономерных звеньев, соединенных между собой химическими связями. Растворы ВМС называются растворами полиэлектролитов.
К полиэлектролитам относятся поликислоты (гепарин, полиадениловая кислота, полиаспарагиновая кислота и др.), полиоснования (полилизин), полиамфолиты (белки, нуклеиновые кислоты).
Свойства растворов ВМС существенно отличаются от свойств растворов НМС.
Вы уже знаете, что с телами и веществами происходят различные изменения, которые называют явлениями, и помните, что их делят на физические и химические. При физических явлениях состав чистых индивидуальных веществ остаётся без изменения, а изменяется лишь его агрегатное состояние или форма и размеры тел.
Физические явления, выражающиеся в изменениях агрегатного состояния вещества или формы и размеров тел, определяют важнейшие области применения их в народном хозяйстве. Так, пластичность алюминия позволяет вытягивать его в проволоку или прокатывать в тонкую фольгу; электропроводность и сравнительная лёгкость алюминия позволяют использовать его в качестве проводов линий электропередачи, а сплавы - в самолетостроении; теплопроводность, пластичность и неядовитость - при изготовлении посуды и т. д.
Многие способы получения чистых химических веществ, по сути, физические явления. К ним относят перегонку, кристаллизацию, фильтрование, возгонку и др. Например, на различии температур кипения веществ основан способ дистилляции (рис. 84), или перегонки.
Рис. 84.
Дистилляция
Этим способом получают воду, очищенную от растворённых в ней веществ. Такая вода называется дистиллированной. Именно её используют для приготовления лекарственных растворов и для заливки в систему охлаждения автомобилей.
Перегонку как способ разделения жидких смесей применяют для получения из природной нефти отдельных нефтепродуктов. Промышленная установка для непрерывной перегонки нефти состоит из трубчатой печи (рис. 85, 1) для нагревания нефти и разделительной, или ректификационной, колонны (рис. 85, 2), где нефть разделяется на фракции (дистилляты) - отдельные нефтепродукты.
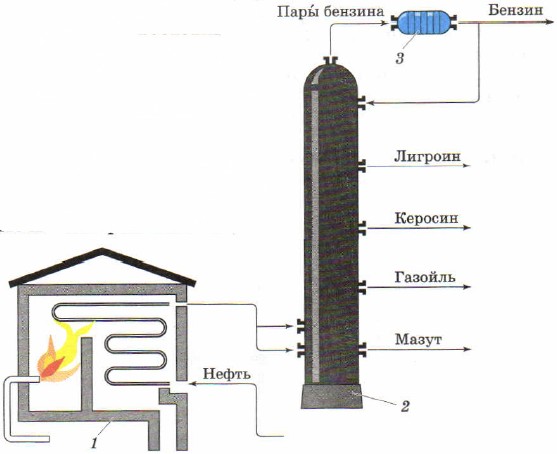
Рис. 85.
Схема трубчатой установки для непрерывной перегонки нефти:
1 - трубчатая печь; 2 - ректификационная колонна;
3 - холодильник
В трубчатой печи в виде змеевика расположен длинный трубопровод. Печь обогревается горящим мазутом или газом. По трубопроводу непрерывно подаётся нефть, в нём она нагревается до 320-350 °С и в виде смеси жидкости и паров поступает в ректификационную колонну.
Ректификационная колонна - стальной цилиндрический аппарат высотой около 40 м. Она имеет внутри несколько десятков горизонтальных перегородок с отверстиями, так называемых тарелок. Пары нефти, поступая в колонну, поднимаются вверх и проходят через отверстия в тарелках. Постепенно охлаждаясь при своём движении вверх, они сжижаются на тех или иных тарелках в зависимости от температур кипения и плотности. Углеводороды менее летучие и сжижаются уже на первых тарелках, образуя газойлевую фракцию, более летучие углеводороды собираются выше и образуют керосиновую фракцию, ещё выше собирается лигроиновая фракция, наиболее летучие углеводороды выходят в виде паров из колонны и образуют бензин. Внизу собирается густая чёрная жидкость - мазут. Его используют в качестве топлива, а также для получения смазочных масел путём дополнительной перегонки.
Способ перегонки жидкого воздуха лежит в основе получения из него отдельных составных частей - азота (он выкипает первым), кислорода и др.

Рис. 86.
Фильтрование
Для очистки солей используют способ кристаллизации. При этом, например, природную соль растворяют в воде и затем фильтруют (рис. 86). В результате получают раствор поваренной соли, очищенный от песка, глины и других нерастворимых в воде примесей. Затем соль выделяют из раствора выпариванием (рис. 87), вода испаряется, а в фарфоровой чашке остаются кристаллы соли.
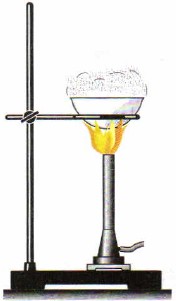
Рис. 87.
Выпаривание
Способ фильтрования основан на различной пропускной способности пористого материала - фильтра по отношению к составляющим смесь частицам. Фильтром для очистки питьевой воды на станциях водоочистки служит слой песка. В пылесосе, который очищает воздух от взвешенной в нём пыли, применяют бумажные или матерчатые фильтры; в медицине при уходе за больными или во время хирургической операции используют в качестве фильтра многослойные марлевые повязки.
Для получения чистых иода и серы используют такое физическое явление, как возгонка (сублимация), т. е. переход вещества из твёрдого состояния в газообразное, минуя жидкую фазу (рис. 88). При возгонке в нагреваемой части прибора кристаллическое вещество испаряется, а в охлаждаемой - снова конденсируется с образованием кристаллов. Лёд способен к возгонке, недаром мокрое бельё высыхает и на морозе.
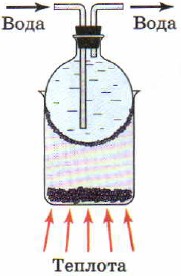
Рис. 88.
Возгонка иода
Возгонка определила использование твёрдого углекислого газа СО 2 (как вы знаете, его называют сухим льдом) для хранения продуктов, и в первую очередь мороженого.
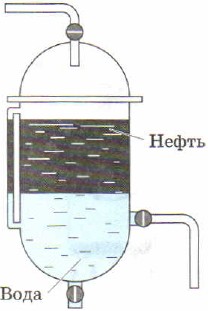
Рис. 89.
Нефтеразделительная колонка
Различная плотность веществ лежит в основе такого способа разделения смесей, как отстаивание. Например, смеси нефти и воды, растительного масла и воды быстро расслаиваются и поэтому их легко отделить друг от друга с помощью делительной воронки (рис. 89, 90).

Рис. 90.
Делительная воронка
Чтобы ускорить процесс разделения смесей, вместо отстаивания в лабораторной практике часто используют центрифугирование, которое получило такое название из-за особого прибора - центрифуги. В центрифугу помещают пробирки со смесью веществ. Включают прибор, который начинает, подобно карусели, интенсивно раскручивать закреплённые в нём пробирки. Под действием центробежной силы частицы разных веществ получают различное ускорение, так как обладают различной плотностью, и смесь разделяется (рис. 91).
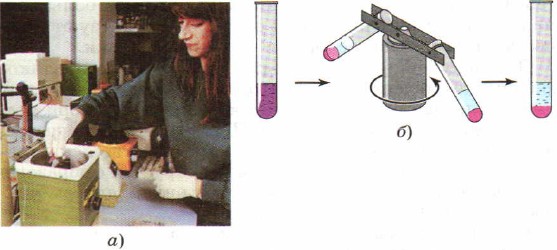
Рис. 91.
Центрифугирование:
а - фотография центрифуги; б - схема действия центрифуги
Ключевые слова и словосочетания
- Дистилляция, или перегонка.
- Дистиллированная вода.
- Кристаллизация и выпаривание.
- Фильтрование.
- Возгонка.
- Отстаивание.
- Делительная воронка.
- Центрифугирование.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока - сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Какой способ разделения смесей описан в научно-фантастическом произведении А. Беляева «Продавец воздуха»?
- Откуда берёт своё начало поверье, что рассыпанная соль - к ссоре? Как помирить людей, поссорившихся из-за рассыпанной соли?
- Укажите способы разделения следующих смесей: а) зубной порошок и поваренная соль; б) спирт и вода; в) бензин и вода.
- Как в походных условиях очистить и обеззаразить речную воду и сделать её пригодной для питья и приготовления пищи?
- Почему работники элеваторов (зернохранилищ) при просеивании и сортировке зерна надевают специальную маску?
- Какой способ очистки чайной заварки от чаинок вы используете, когда наливаете её из чайника через ситечко?
Руководитель: Богер Наталья Владимировна, учитель химии
Тема: «Растворение – физический или химический процесс?»
Образовательное учреждение: МБОУ Каргасокская СОШ № 2 п. Каргасок, Томская область
Используемые медиаресурсы: текстовый редактор WORD, ресурсы сети Интернет
1) Актуальность исследования (почему данная тема взята автором для исследования)
Уже два года мы изучаем физику, увлекаемся данной наукой, изучаем основные законы, физические явления. И для нас всегда было понятно, что процесс растворения сахара, соли и других растворимых веществ в воде – физическое явление. В этом году мы стали изучать новую науку – химию. И каким было для нас удивлением, что процесс растворения –химическое явление. Химия - наука о веществах, свойствах и их превращениях. Но ведь в процессе растворения сахара в воде мы не получили ни кислоту, ни щелочь, ни какое - то другое вещество. Сахар так и остался сахаром.
2) Определение предмета исследования (Что подлежит изучению?)
Нас заинтересовал вопрос, чем же отличаются физические изменения от химических? Это не очень простой вопрос.
3) Формулировка проблемы. В чем заключается проблема? На какой вопрос(ы) предстоит ответить?
Выяснить, физическим или химическим – является процесс растворения веществ в воде.
4) Выдвижение гипотезы. Каким может быть предположительный ответ?
Мы выдвинули гипотезу : возможно, что грань между физическими и химическими превращениями условна, проведена произвольно.
5) Проверка гипотезы.
На данном этапе работа проходит по трем направлениям:
- Теоретический анализ научной литературы;
- Физический и химический эксперимент;
- Анализ экспериментальных данных.
Работа в рамках первого направления дала возможность рассмотреть теоретические вопросы процесса растворения веществ в воде. Проблема растворения издавна интересовала человека. Сущность процесса растворения пытались разгадать еще алхимики, а затем химики последующих веков. Так, английский химик Р,Бойль (1627-1691) предполагал, что частицы растворителя имеют шипы, крючочки и другие приспособления, с помощью которых сцепляются с частицами растворенного вещества, от чего и происходит растворение.
Более научно высказал мнение о растворении М.В. Ломоносов(1711-1765): «частицы соли отделяются друг от друга действием частиц воды…» и, сцепляясь с водными частицами, вместе начинают двигаться поступательно и разносятся по растворителю».
В XIX веке исследования растворов продолжил Д.И. Менделеев (1834-1907). Большое значение он придавал изучению тепловых эффектов при растворении. Известно, что при растворении одних веществ теплота выделяется, а при других – поглощается.
Теория растворения получила развитие в работах шведского ученого Сванте Аррениуса (1859-1927). Он предположил, что вещество в растворе распадается на ионы. В дальнейшем русский ученый И.А. Каблуков (1857-1942) соединил теорию электролитической диссоциации С. Аррениуса с гидратной теорией Д.И. Менделеева. Он выдвинул предположение о гидратации (взаимодействии с водой) образующихся в растворе ионов, что и было доказано экспериментально.
Сторонники физической теории растворов, которую развивали Вант-Гофф, Аррениус и Освальд, считали, что процесс растворения является результатом диффузии, т.е. проникновения растворенного вещества в промежутки между молекулами воды, т.е. физическое явление.
Сторонники химической теории растворов, которую развивали Д.И. Менделеев, И.А. Каблуков, В.А. Кистяковский, считали, что процесс растворения является химическим взаимодействием растворенного вещества и воды.
Рассмотрев теоретические вопросы, мы приступили к экспериментальной части нашей работы.
Проведем опыт , цель которого продемонстрировать, что при растворении происходит процесс равномерного распределения одного вещества в другом, при котором растворяемое вещество переходит в агрегатное состояние растворителя, т.е. происходит физическое явление.
Опыт №1. Явление диффузии на примере перманганата калия
Если в химический стакан с водой поместить несколько гранул перманганата калия, мы можем наблюдать, как количество твердого вещества постепенно уменьшается. При этом вода, в которую были добавлены кристаллы, приобретает новые свойства. Появляется малиновая окраска.
Вывод : Мы наблюдаем процесс диффузии – это самопроизвольное взаимное проникновение молекул одного вещества в промежутки между молекулами другого. Происходит она потому, что молекулы одного и другого вещества взаимно проникают друг между другом.
Опыт №2. Влияние температуры на процесс диффузии
Оказывается, на скорость диффузии определенных веществ можно влиять изменение температуры. Чтобы убедиться в этом, мы взяли два стакана, один с горячей, а другой с холодной водой. Насыпали одинаковое количество перманганата калия. В одном из стаканов диффузия пойдет гораздо быстрее. Как подсказывает нам жизненный опыт, диффузия происходит тем быстрее, чем выше температура диффундирующих веществ.
Вывод: Чем выше температура веществ, тем быстрее происходит диффузия.
О химическом взаимодействии вещества с растворителем судят по некоторым признакам. Перечислим признаки химических реакций:
- изменение цвета;
- появление запаха;
- образование и растворение осадка;
- выделение газа;
- выделение или поглощение теплоты.
Проведем опыт, цель которого продемонстрировать, что при образовании растворов может происходить выделение теплоты.
Опыт № 3. Выделение теплоты при растворении кислоты в воде.
Для этого эксперимента мы взяли следующее оборудование: серная кислота (98%), вода, датчик температуры, химический стакан на 100мл.В ходе эксперимента при растворении в воде небольшого количества (5мл) серной кислоты порциями по 1мл наблюдали значительное повышение температуры.
Химическая реакция процесса:
Вывод: При растворении серной кислоты в воде мы наблюдали значительное повышение температуры, а это признак химической реакции.
Опыт№4. Поглощение теплоты при растворении соли в воде.
Цель: продемонстрировать, что при образовании растворов может происходит поглощение теплоты.
Химическая реакция:
Для эксперимента мы взяли 5г нитрата калия и растворили в 10мл воды.
Вывод : Мы наблюдали понижение температуры при растворении нитрата калия в воде, а это признак химического взаимодействия.
О сложности процесса растворения свидетельствуют не только тепловые эффекты, но и такой признак химических реакций, как изменение цвета.
Опыт №5 .Изменение цвета в процессе растворения соли.
Возьмем белый порошок сульфата меди и растворим его в воде. При этом образуется раствор голубого цвета. Это доказывает, что при растворении происходит химический процесс – гидратация ионов:
Если раствор выпаривать, то выпадают голубые кристаллы. Сохранение окраски кристаллов свидетельствует о том, что при кристаллизации соли из растворов гидратированные ионы не разрушаются, а сохраняются
Вывод: Вещества, в кристаллические решетки которых входят гидратированные ионы, называют кристаллогидратами, а воду, входящую в состав кристаллогидрата – кристаллизационной.
Опыт №6 Изменение цвета в процессе растворения йода.
Мы провели эксперимент, растворяя йод в различных растворителях. Пары йода имеют фиолетовый цвет. Такой же цвет и у раствора йода в бензине. В воде раствор йода желтый, в бензоле или спирте – коричневый (этот цвет знакомой всем йодной настойки), в растворе поливинилового спирта йод синий (это цвет лекарственного средства иодинола). И меняется не только цвет в разных растворителях, химически ведет себя тоже по-разному.
Вывод: Молекулы растворенного вещества связываются с молекулами растворителя, в результате образуются новые химические соединения.
6 ) Объяснение результатов. Возможные выводы.
Мы выяснили, каким является процесс растворения - физическим или химическим. Мы изучили теоретические вопросы процесса растворения. Рассмотрели признаки физических и химических явлений при растворении. Экспериментально подтвердили все рассмотренные признаки и процессы. В результате проведенного исследования, мы выяснили, что процесс растворения является физико – химическим процессом, а растворы – это однородная (гомогенная) система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия – гидратов. Мы выяснили, что грань между физическими и химическими явлениями во многом условна. Она проведена учеными произвольно. Процесс растворения по некоторым признакам можно отнести к физическим, а по другим – к химическим. Поэтому такие процессы стали называть физико – химическими явлениями.
Сформулированные выводы позволяют судить о том, что цель исследования достигнута. Однако на этом наше исследование не окончено, оно ставит перед нами новую задачу - почему водные растворы некоторых веществ проводят электрический ток, найти причину такого явления. Но это будет уже другое исследование.
- Подготовка к презентации исследовательского материала. Написание отчета.
Для написания отчета были использованы возможности текстового редактора WORD.Итоговый материал представлен также в виде презентации, выполненной в редакторе POWER POINT.
В результате работы была использована следующая литература:
- Аликбеков Л.Ю. Занимательные задания и опыты по химии М.Дрофа,2006.
- Горев Л.А. Занимательные опыты по физике. М. Просвещение, 1985г.
- Журнал «Наука и жизнь», № 5 2004г.
- Кузнецова Л.М. Химия 9класс. М. Мнемозина, 2003.
- Олма энциклопедия. Превращения вещества. Химия. М. Олма Медиа Групп,2013.
- Интернет-ресурс.
Растворение – это процесс равномерного распределения одного вещества в другом, при котором растворяемое вещество переходит в агрегатное состояние растворителя
Раствор – это химическая система, образованная несколькими веществами, между которыми нет поверхностей раздела.
Физическая теория растворов:
Растворение – это процесс диффузии, растворы – это однородные смеси
Химическая теория растворов:
Растворение – это процесс химического взаимодействия растворяемого вещества с водой – гидратация, растворы – соединения гидраты
Рассмотрим процесс растворения веществ.
Например, если мы добавляем в чай сахар, то можем наблюдать, как количество твердого вещества постепенно уменьшается. Если чай холодный, то сахар растворяется медленно. Наоборот, если чай горячий и размешивается ложечкой, то растворение происходит быстро. Попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют связи с молекулами воды. При этом с одной молекулой сахара связывается несколько молекул воды. Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя. Молекулы сахара, перешедшие из кристалла в раствор, могут передвигаться по всему объему раствора вместе с молекулами воды благодаря диффузии. Если раствор нагреть или перемешивать, то диффузия происходит интенсивнее и растворение сахара проходит быстрее. Молекулы сахара распределяются равномерно и раствор становится одинаково сладким по всему объему.
Вещества при растворении не меняются, после выпаривания растворов мы можем получить растворенное вещество в твердом состоянии. При растворении разрушается кристаллическая решетка растворенного вещества и ее частицы перемещаются в растворе, следовательно, растворение - это физический процесс. Для осуществления такого процесса необходимо затратить энергию.
Но когда молекулы растворенного вещества связываются с молекулами воды, то фактически образуются новые химические соединения. Эти молекулярные ассоциаты не имеют постоянного состава. Их общее название - гидраты. Процесс связывания веществ с водой называется гидратацией. При выпаривании растворов происходит разрушение гидратов и образования кристаллического вещества. Однако некоторые вещества способны образовывать устойчивые гидраты, которые могут содержать воду даже в кристаллическом состоянии. Такие вещества называются кристаллогидратов. Их можно выделить из раствора, осторожно выпаривая воду. В формулах таких веществ кристаллизационная вода указывается после формулы соединения со знаком умножения. Например: CuSO 4 ·5H 2 O - медный купорос, FeSO 4 · 7H 2 O - железный купорос. Образование гидратов, т.е. новых веществ, свидетельствует, что растворение - химический процесс.
Разобраться в сущности процесса растворения помогает изучение тепловых явлений, происходящих при этом. Известно, что одним из признаков химических реакций является выделение теплоты, а для физических явлений необходимо тратить энергию. Растворения серной кислоты сопровождается сильным разогревом раствора. Это результат химического взаимодействия между молекулами воды и растворенного вещества - гидратация сопровождается выделением энергии. А растворения нитрата аммония сопровождается охлаждением раствора. В этом случае на физический процесс разрушения кристаллической решетки тратится больше энергии, чем образуется при получении гидратов.
Приведенные факты говорят о том, что растворение следует считать физико-химическим процессом.
Домашнее задание: параграф 34 , упр.2
выучить определения
Электролиты и неэлектролиты.
Электролиты – это вещества, растворы или расплавы которых проводят электрический ток.
Неэлектролиты – это вещества, растворы или расплавы которых не проводят электрический ток.
Электролитическая диссоциация – это распад электролита на свободно перемещающиеся ионы при растворении его в воде или при плавлении.
Электролиты при растворении в воде или
расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно(анионы) заряженные частицы.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома - это простые ионы (Na + , Mg 2+ , Аl 3+ и т.д.) - или из нескольких атомов - это сложные ионы (NО 3 - , SO 2- 4 , РО З- 4 и т.д.).
В растворах и расплавах электролиты проводят электрический ток .
Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные - к аноду. Поэтому первые называются катионами, вторые - анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
Диссоциация - обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместознака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К + и анион А - в общем виде записывается
КА ↔ K + + A -
Домашнее задание: параграф 35, упр. 1,4,5,выучить определения
Основные положения ТЭД.
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные.
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные частицы движутся к катоду, отрицательно заряженные – к аноду. Поэтому положительно заряженные частицы называются катионами, а отрицательно заряженные – анионами.
3. Направленное движение происходит в результате притяжения их противоположно заряженными электродами (катод заряжен отрицательно, а анод – положительно).
4. Ионизация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов в молекулы (ассоциация).
Основываясь на теории электролитической диссоциации, можно дать следующие определения для основных классов соединений:
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Например,
HCl → H + + Cl - ;
CH 3 COOH H + + CH 3 COO - .
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, HCl, HNO 3 – одноосновные кислоты, H 2 SO 4 , H 2 CO 3 – двухосновные, H 3 PO 4 , H 3 AsO 4 – трехосновные.
Основаниями называют электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например,
KOH → K + + OH - ,
NH 4 OH NH 4 + + OH - .
Растворимые в воде основания называются щелочами.
Кислотность основания определяется числом его гидроксильных групп. Например, KOH, NaOH – однокислотные основания, Ca(OH) 2 – двухкислотное, Sn(OH) 4 – четырехкислотное и т.д.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также ион NH 4 +) и анионы кислотных остатков. Например,
CaCl 2 → Ca 2+ + 2Cl - ,
NaF → Na + + F - .
Электролиты, при диссоциации которых одновременно, в зависимости от условий, могут образовываться и катионы водорода, и анионы – гидроксид-ионы называются амфотерными. Например,
H 2 O H + +OH - ,
Zn(OH) 2 Zn 2+ +2OH - ,
Zn(OH) 2 2H + +ZnO 2 2- или
Zn(OH) 2 + 2H 2 O 2- + 2H + .
Домашнее задание: параграф 36,упр. 2-5, выучить определения
