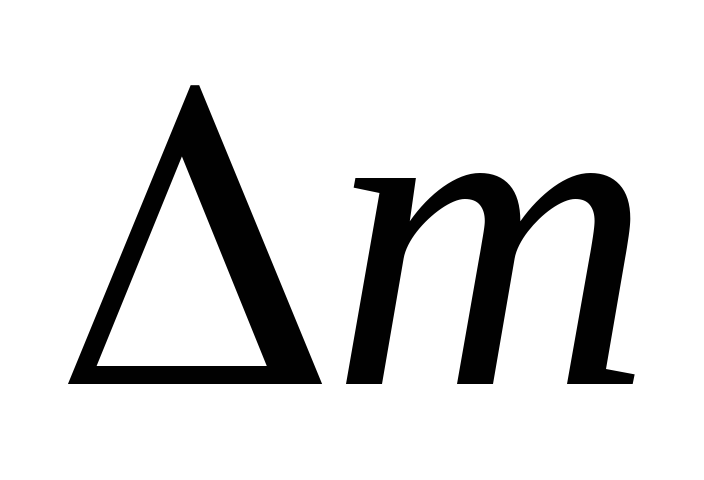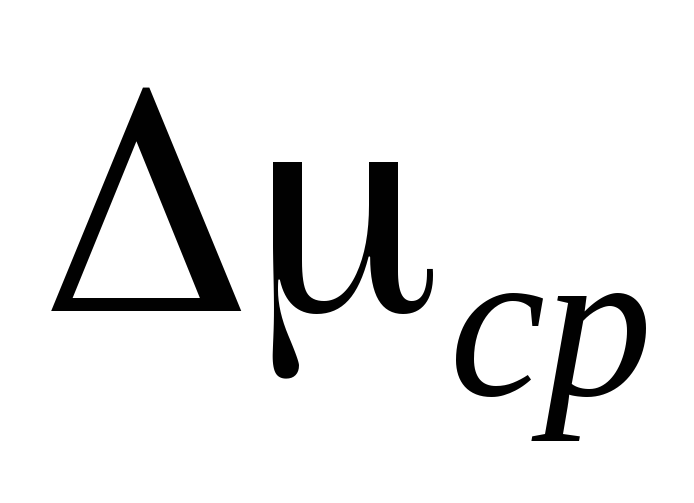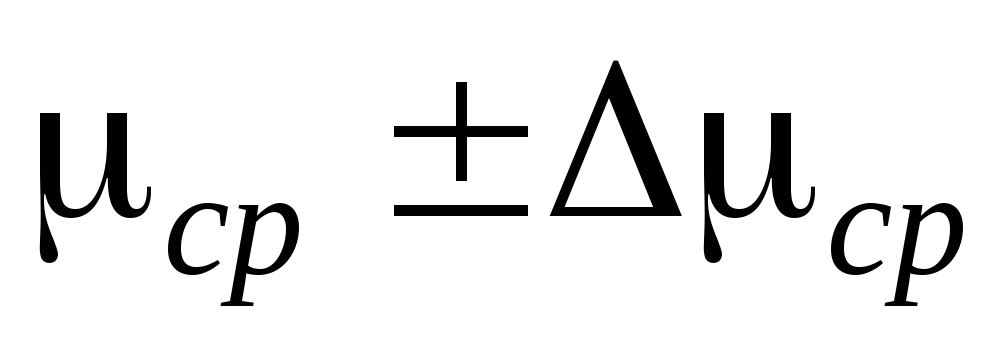Единица измерения молярной массы: г/моль. Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44; 18 и 16а.е.м.,то их молярные массы равны: а) 44г/моль; б) 18г/моль; в)16г/моль.
Таким же образом в химических расчетах просчитываются и молекулярные массы других соединений. Молекулярная масса — это характеристика средней массы молекулы, она учитывает изотопный состав всех элементов, которые образуют данное химическое вещество. Этот показатель можно определить и для смеси нескольких веществ, состав которых известен. Этот закон гласит, что при одинаковых условиях в одинаковых объемах газов присутствует одинаковое число молекул.
Определяется масса некоторого известного объема газа при определенных давлении и температуре. Этот метод дает достаточно точные значения молекулярных масс, которые иногда используются даже для определения атомных масс химических соединений. Для приблизительной оценки молекулярной массы обычно газ считается идеальным, и никаких дополнительных поправок не делается.
Воздух необходим для нормального существования на Земле живых организмов. В промышленности и в быту кислород воздуха используется для сжигания топлива с целью получения тепла и механической энергии в двигателях внутреннего сгорания. В 1754 году Джозеф Блэк экспериментально доказал, что воздух представляет собой смесь газов, а не однородное вещество. Первый символ – общепринятое изображение стихии воздух. Третье изображение – триграмма воздуха в Книге Перемен.
Из воздуха соткана свобода человека. Поэтому символ воздуха в первую очередь — это символ свободы. Это свобода, для которой нет никаких преград, ведь воздух нельзя ограничить, нельзя поймать и придать ему форму.
Атмосферный воздух представляет собой смесь сухого воздуха и водяного пара (от 0,2% до 2,6%). Таким образом, воздух практически всегда можно рассматривать как влажный. Механическая смесь сухого воздуха с водяным паром называется влажным воздухом или воздушно-паровой смесью. Абсолютная влажность воздуха – масса пара в 1 м3 влажного воздуха.
При тушении пожара водой создаются оба условия: вода охлаждает горящие предметы, а ее пары затрудняют к ним доступ воздуха. Вопрос о составе воздуха в науке был решен не сразу.В 1774 г. французский ученый А. Лавуазье доказал, что воздух — это смесь в основном двух газов — азота и кислорода. Кроме того, в воздухе содержится оксид углерода(IV) и водяные пары. Примерный состав воздуха показан в таблице.
В инертной среде аргона производят электросварку легкоокисляющихся металлов. Неоном, аргоном, криптоном и ксеноном заполняют электрические лампочки. С горением веществ в кислороде вы уже познакомились. При горении веществ в воздухе образуются, как правило, те же продукты, т. е. различные оксиды. Уравнивают число атомов элементов, входящих в состав сгоревшего вещества:C6H6+O2->6CO2+3H2O3.
Этот прием используется при тушении пожаров в случаях горения нефти и ее продуктов. Химический состав воздуха имеет важное гигиеническое значение, так как он играет решающую роль в осуществлении дыхательной функции организма.
В жилых, общественных и спортивных помещениях значительных изменений в содержании кислорода не наблюдается, так как в них проникает наружный воздух. При продолжительном вдыхании воздуха с содержанием 1 - 1,5% углекислого газа отмечается ухудшение самочувствия, а при 2-2,5 % обнаруживаются патологические сдвиги.
Как найти молярную массу воздуха
Атомы элементов характеризуются определённой (только им присущей) массой. Значения относительной молекулярной массы рассчитываются из значений относительной атомной массы с учётом числа атомов каждого элемента в формульной единице сложного вещества. Сумма массовых долей элементов, входящих в сложное вещество, равна 1 (100%). В химических расчетах массу газообразных реагентов и продуктов часто заменяют их объёмами. Эта физическая постоянная — молярный объём газа при нормальных условиях.
В основе их лежат законы сохранения массы, постоянства состава, кратных отношений, а также газовые законы – объемных отношений и Авогадро. В производстве на этой основе ведутся расчеты материальных балансов. Закон всегда выполняется для газообразных и жидких веществ. Закон кратных отношений, как и закон постоянства состава, не является всеобщим и также не справедлив для веществ в твердом состоянии. Например, при взаимодействии 2 объемов водорода и 1 объема кислорода образуются 2 объема водяного пара. Эти числа совпадают со стехиометрическими коэффициентами в уравнении реакции.

Относительные атомные массы известных элементов приведены в таблице «Периодическая система элементов Д.И. Менделеева». Количество вещества В – это физическая величина, указывающая на число формульных единиц вещества относительно постоянной Авогадро. Постоянная Авогадро, в свою очередь, показывает число атомов, содержащихся в 12г изотопа углерода 126С, или количество атомных единиц массы в 1г вещества.
10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
В самом деле, для изотопа углерода 126С Аr = 12, а молярная масса атомов (по определению понятия «моль») равна 12г/моль. При нормальных условиях (101,325 кПа; 273 К) молярный объем любого газа равен 22,4 л/моль (точнее, Vn = 22,4 л/моль). Для неидеальных газов, называемых реальными, молярные объемы различны и несколько отличаются от точного значения. Если объем и давление газа выражены в других единицах измерения, то значение газовой постоянной в уравнении Клапейрона – Менделеева примет другое значение.
Поэтому их используют для световых реклам и в маяках.Горение веществ в воздухе. Определение молярных масс веществ, находящихся в газообразном состоянии.По закону Авогадроравные объемы газов, взятых при одинаковой температуре и одинаковом давлении, содержит равное число молекул. Молекулярная масса воздуха, как и других газов, может быть найдена при помощи закона Авогадро.
Муромский институт (филиал)
федерального государственного бюджетного образовательного учреждения
высшего профессионального образования
«Владимирский государственный университет
имени Александра Григорьевича и
Николая Григорьевича Столетовых»
Кафедра: «ФПМ»
Дисциплина: Физика
Лабораторная работа №6.03
Утверждена на методическом
семинаре кафедры ФПМ
Зав. кафедрой ____________
Лабораторная работа № 6.03
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ ВОЗДУХА
Цель работы - познакомиться с одним из методов определения молекулярной массы газа и измерить молекулярную массу воздуха.
Приборы и принадлежности: баллон для воздуха, установка для взвешивания или технические весы, манометр, разновесы,вакуумный насос.
ТЕХНИКА БЕЗОПАСНОСТИ
Осторожно обращаться со стеклянным баллоном, находящимся в полотняном мешочке.
ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
Молекулярной массой называют отношение массы молекулы данного вещества к 1/12 массы атома углерода С.
Молекулярная масса согласно определению может быть представлена, как сумма атомных масс элементов, составляющих молекулу
=
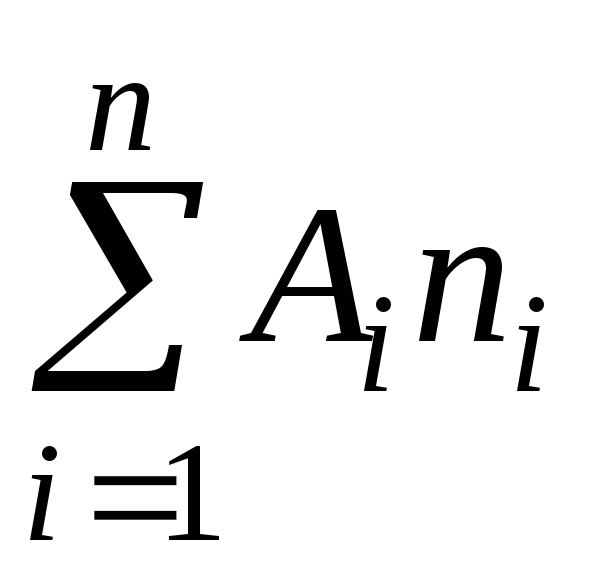 (1)
(1)
где А- атомная массаi-го элемента, входящего а состав молекулы;
n - число атомов.
Методы определения молекулярной массы разделяются на две групп-пы – абсолютные и статистические. К абсолютным методам, дающим "истинное" значение молекулярной массы относится метод масспектроскопии. Другие методы дают лишь среднестатистическое значение молекулярной массы.
Определение молекулярной массы газов основано на уравнении состояния газа
PV
=
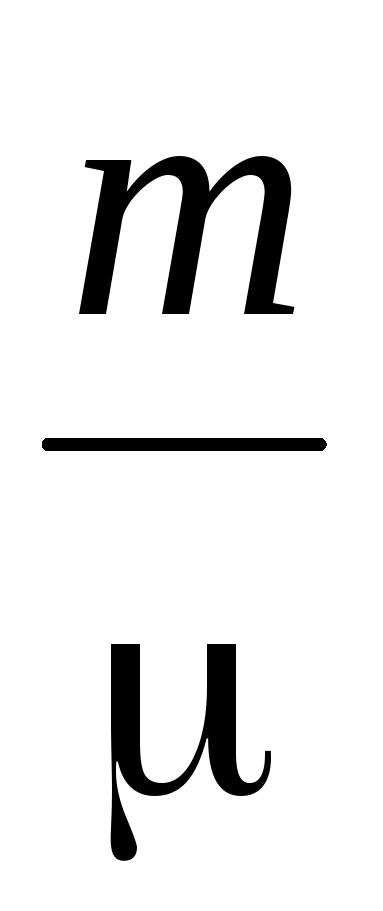 RT
(2)
RT
(2)
где Р – давление газа,
m, V – его масса и объем,
Т – абсолютная температура
R – универсальная газовая постоянная,
– среднестатистическая молекулярная масса.
Уравнение 2 справедливо лишь для идеального газа. Идеальный газ – это такой газ, между молекулами которого отсутствуют силы взаимодействия (притяжения и отталкивания). Молекулы идеального газа представляются в виде упругих шариков бесконечно малого размера. У реальных газов существуют силы взаимодействия между молекулами, и не всегда молекулы можно рассматривать как упругие шарики исчезающе малых размеров, поэтому реальные газы отступают от закона(2).
Однако при не слишком больших давлениях, когда молекулы газа могут свободно пробегать до столкновения большие расстояния, взаимодействием молекул можно пренебречь, можно пренебречь также и размерами молекул (когда объем газа достаточно велик), тогда реальный газ будет близок к идеальному и уравнение (2) может быть применено. При атмосферном давлении и комнатных температур многие газы (азот, водород, гелий, кислород, воздух и т.д.) можно с достаточно хорошим приближением считать идеальным газом.
Важной характеристикой движения молекул является средняя длина свободного пробега. Молекулы в газе находятся в состоянии непрерывного и хаотического движения, сталкиваются друг с другом и между столкновениями проходят свободно некоторый путь . Длина этого пути между двумя столкновениями различна, но, благодаря большому числу молекул и беспорядочности их движения можно говорить о средней длине свободного пробега молекул. Среднюю длину свободного пробега молекул можно определить по формуле
 =
=
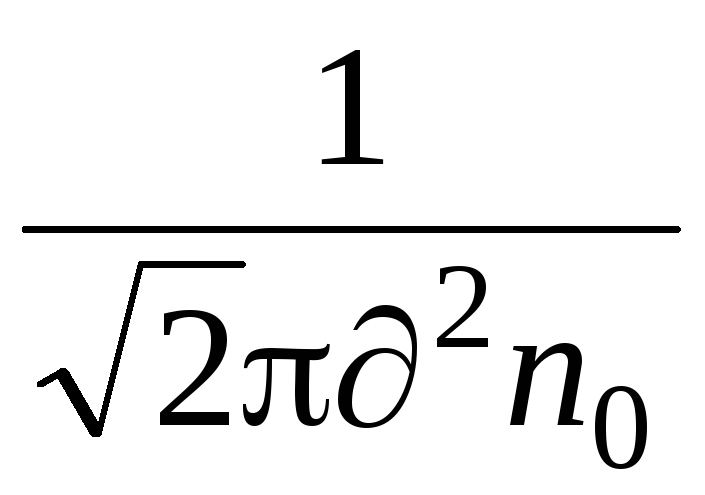 ,
,
где
– эффективный диаметр молекулы (для
воздуха
= 0.27·10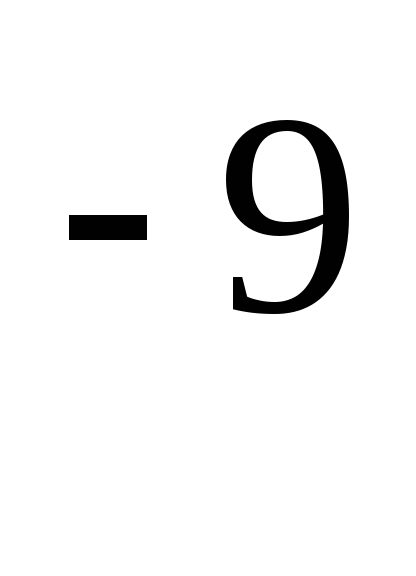 м),
м),
n – число молекул в единице объема.
– число молекул в единице объема.
n =
=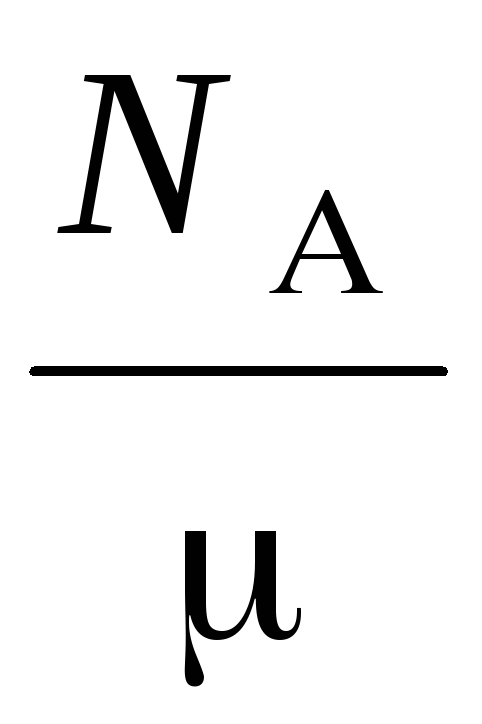
 ,
,
то с учетом этого формула, для имеет вид:
=
 ,
,
где
 – молекулярная масса газа,N
– молекулярная масса газа,N – число Авогадро,
– плотность газа.
– число Авогадро,
– плотность газа.
Пусть
воздух в открытом баллоне занимает
объем V
,
масса его т
,
давление атмосферноеP;
откачиваем воздух из баллона до P .
Теперь масса воздуха в баллоне будет
m
.
Теперь масса воздуха в баллоне будет
m .
Для этих двух состояний запишем уравнение(2)
.
Для этих двух состояний запишем уравнение(2)
PV
=
 RT
(3)
RT
(3)
P V
=
V
=
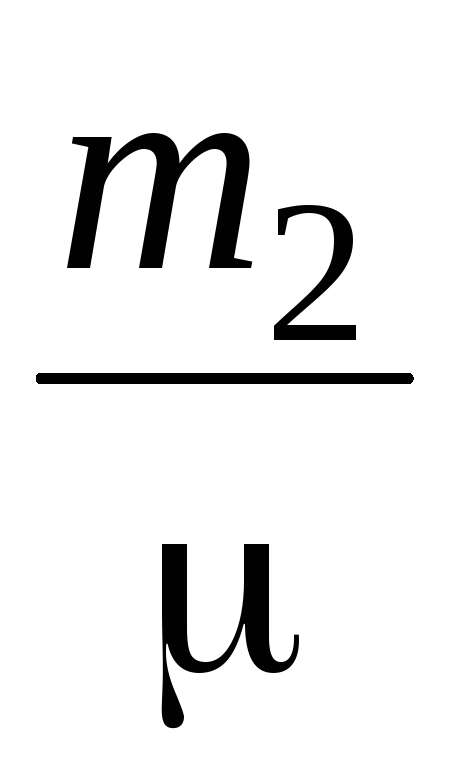 RT
(4)
RT
(4)
Вычитая из(3) (4), выразим .
=

 =
=
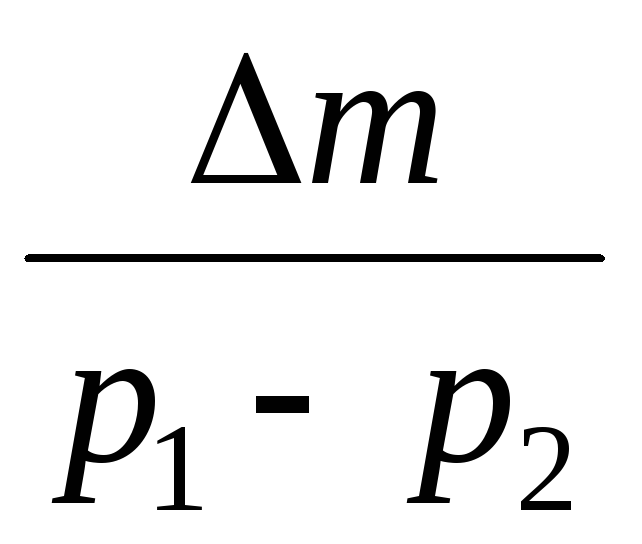
 (5)
(5)
Таким образом, зная изменение массы при изменениях давления, можно найти молекулярную массу воздуха по формуле (5).
ОПИСАНИЕ УСТАНОВКИ
Общий вид установки показан на рис. 1. Установка состоит из вакуумного насоса(1), крана(2) (с помощью крана 2 система отсоединяется от вакуумного насоса), вакуумметра(3).Поворот стрелки-указателя вакуумметра пропорционален достигнутому в системе разрежению, т.е. разности между атмосферные давлением и давлением воздуха в установке. Нулевое значение на шкале вакуумметра соответствует атмосферному давлении в установке. Прибор начинает показывать только при откачке воздуха из системы, т.е. при давлении воздуха в установке ниже атмосферного.

С помощью крана 4 система соединяется с атмосферой. На рис. 1 изображен вакуумпровод (5), съемный баллон (6) (объемом I /1225 мл) с резиновой трубкой и зажимом (7), служащим для отсоединения баллона 6 от атмосферы при взвешивании баллона.
ВЫПОЛНЕНИЕ РАБОТЫ
Задание 1. Определение молекулярной массы воздуха.
1. Открываем краны 2 и 4, зажим 7 и отсоединяем баллон 6 от установки. Взвешиваем баллон 6 вместе с резиновой трубкой и зажимом 7 и записываем результаты измерений в таблицу I. Взвешивание необходимо проводить с достаточно высокой степенью точности ина эту операцию обратить особое внимание.
2.
Присоединяем баллон 6 к установке и
откачиваем воздух из баллона так, чтобы
изменение давления составило
 P
= 0,1
P
= 0,1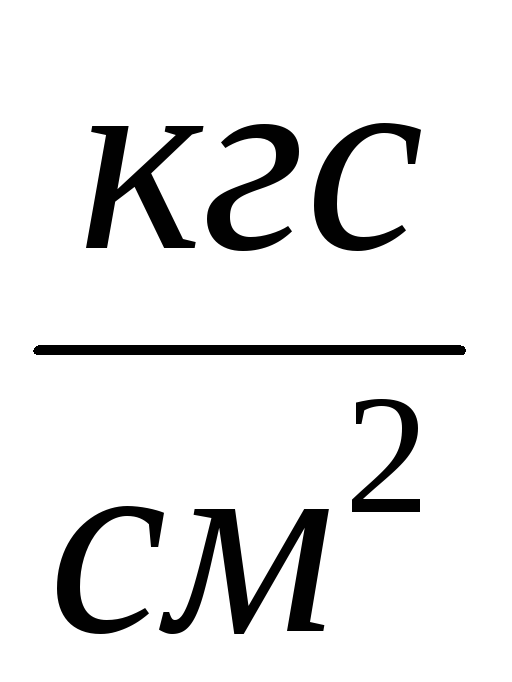 .
Закрываем кран 2 и заносим
.
Закрываем кран 2 и заносим P
в таблицу измерений. Закрываем кран 4,
за жим 7 и отсоединяем баллон 6 от установки
и взвешиваем его. Результаты измерений
заносим в таблицу.
P
в таблицу измерений. Закрываем кран 4,
за жим 7 и отсоединяем баллон 6 от установки
и взвешиваем его. Результаты измерений
заносим в таблицу.
3.
Открываем зажим 7, плавно открываем
краны 2 и 4 и пункт 2 повторяем еще 4 раза
для других значений
 P.
P.
4. По результатам измерений вычисляем воздуха и оцениваем погрешность измерений.
Задание 2 . Определение плотности воздуха.
Плотность воздуха определим, используя уравнение Менделеева – Клайперона для идеальных газов.
PV
=
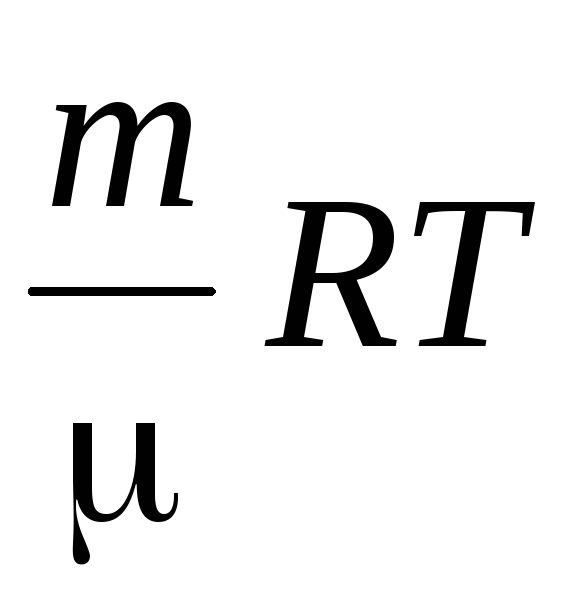 .
.
Из
этого уравнения следует, что, так как
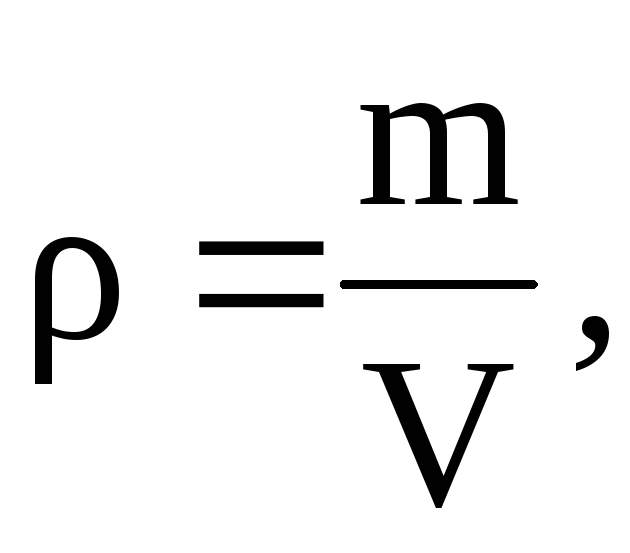 то
то
=
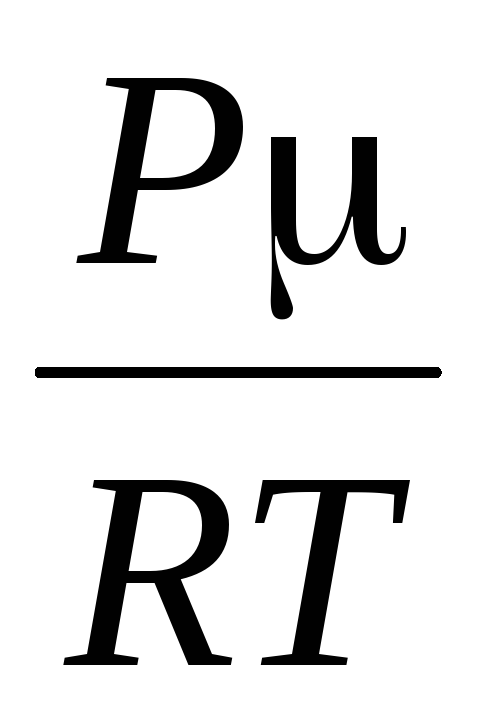 ,
,
где
R
= 8,31*10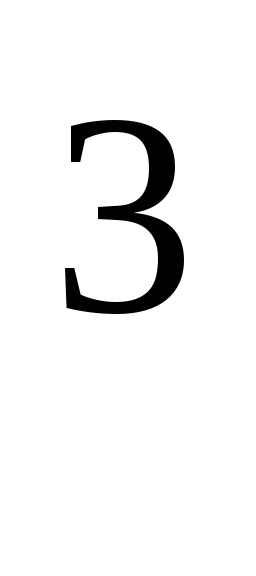 Дж/(кмоль·К), универсальная газовая
постоянная.
Дж/(кмоль·К), универсальная газовая
постоянная.
Определим
сначала плотность воздуха в баллоне до
откачки, приняв, что давление P=P равно атмосферному давлению (P
равно атмосферному давлению (P = 101 кПа). Затем определим плотности
воздуха при различных
= 101 кПа). Затем определим плотности
воздуха при различных
 P,
взятых из таблицы измерений, считая,
что давление в колбе равно P
= P
P,
взятых из таблицы измерений, считая,
что давление в колбе равно P
= P -
- P.
P.
По
результатам расчета построить график
зависимости плотности от давления P:
ТАБЛИЦА ИЗМЕРЕНИЙ
|
m |
|
|
|
|
|
| ||||||
Задание
3.
По вычисленным расчетам
определить длину волны свободного
пробега
и построить график зависимости
от :
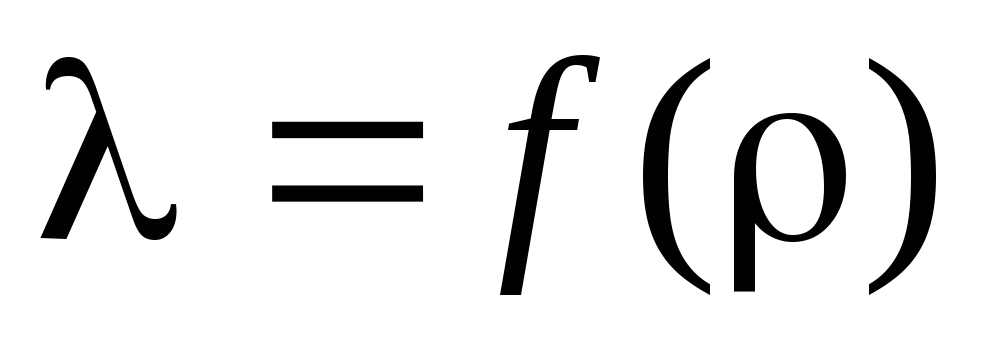 .
.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Перечислите основные положения молекулярно-кинетической теории идеальных газов.
2. Какие физические величины называют параметрами состояния газа, дайте их определение.
3. Сформулируйте законы идеальных газов.
4. При каких условиях газ подчиняется законам идеального газа?
5. При каких условиях уравнение Клапейрона-Менделеева применимо к газам.
6. Что такое молекулярная масса, от чего зависит молекулярная масса.
7. Плотность воздуха, от чего она зависит?
8. Длина свободного пробега молекул газа и эффективный диаметр.
9. Выведите формулы для расчета и .
10. Какие измерения надо провести, чтобы рассчитать молекулярную массу и плотность воздуха .
Список использованной литературы
1. Савельев И.В. Курс общей физики. М.: Наука, 1970. Т.1, § 98.
2. А.А. Детлаф, Б.М. Яворский. Курс физики. М.: Изд-во "Высшая школа", 1973, стр. 175-179.
Cтраница 1
Молекулярный вес воздуха вычислен с учетом процентного содержания различных компонентов. Под массой молекулы воздуха понимается среднее значение масс молгкул, содержащихся в воздухе, с учетом их относительной концентрации.
Молекулярный вес воздуха вычислен с учетом процентного содержания различных компонентов. Под массой молекулы воздуха понимается среднее значение масс молекул, содержащихся в воздухе, с учетом их относительной концентрации.
К; М - молекулярный вес воздуха; рзаб - давление воздуха на забо.
Рвж - то же, над поверхностью испаряющейся жидкости, кг / м3, Мв - молекулярный вес воздуха, равный 29; Мп - молекулярный вес паров испаряющейся жидкости.
Итак, чтобы подсчитать число молекул воздуха в земной атмосфере, достаточно знать лишь давление воздуха на уровне моря, молекулярный вес воздуха, радиус Земли и ускорение свободного падения g у ее поверхности. В ответ не входит высота атмосферы, важно лишь, чтобы она была мала по сравнению с радиусом Земли.
| Характеристики углеводородных компонентов природного газа.| Расчет псевдокритических температуры и давления природного газа. |
Следовательно, чтобы определить молекулярный вес газа, надо помножить его удельный вес (принятый для воздуха за 1) на молекулярный вес воздуха.
Ах, см, за 1 сек при перепаде давления с обеих сторон перегородки Ар, дин / см2; М - молекулярный вес воздуха, г / моль; R - универсальная газовая постоянная, эрг / моль - град.
На основании законов идеальных газов можно показать, что удельный вес газа равен также отношению молекулярного веса газа к молекулярному весу воздуха.
Однако может иметь место и несоответствие между па-ропроницаемостью материала и воздухопроницаемостью конструкции ограждения, выполненного из этого же материала. Происходит это вследствие неизбежного наличия в конструкции неплотностей и щелей, которые значительно увеличивают воздухопроницаемость ограждения, а также и потому, что молекулярный вес воздуха и водяного пара неодинаков.
Для характеристики природных газов широко используется его удельный вес. Относительная плотность газа выражается отношением плотности газа при атмосферном давлении и стандартной температуре к плотности воздуха при тех же давлении и температуре. Так как при атмосферном давлении и определенной температуре плотности газов прямо пропорциональны их молекулярным весам, относительную плотность газа можно представить как отношение молекулярного веса газа к молекулярному весу воздуха. Относительная плотность природных газов изменяется от 0 6 до 1 1 в зависимости от относительной концентрации в газе более тяжелых углеводородов.
В углекислотных установках при производстве сухого льда также приходится удалять воздух из системы. Кроме указанных ранее путей проникновения воздуха, в установках для производства сухого льда в ледогенераторах воздух систематически поступает в систему при выемке блоков льда из ледогенераторов. После выпадения блока льда объем ледогенератора заполняется воздухом, который по включении ледогенератора в работу, отсасывается компрессором и вместе с углекислотой поступает на конденсатор. В связи с тем, что молекулярный вес углекислоты больше молекулярного веса воздуха, характер линий графика ра / (ga) аналогичен таковому для фрео-нов. Но так как молекулярные веса углекислоты и воздуха сравнительно с фреонами мало отличаются друг от друга, то линии графика на значительном участке близки к прямым. Номограмма для углекислоты, построенная Р. Р. Скварченко (ВНИХИ), приведена на фиг.
В углекислотных установках при производстве сухого льда также приходится удалять воздух из системы. Кроме указанных ранее путей проникновения воздуха, в установках для производства сухого льда в ледогенераторах воздух систематически поступает в систему при выемке блоков льда из ледогенераторов. После выпадения блока льда объем ледогенератора заполняется воздухом, который по включении ледогенератора в работу, отсасывается компрессором и вместе с углекислотой поступает на конденсатор. В связи с тем, что молекулярный вес углекислоты больше молекулярного веса воздуха, характер линий графика ра f (ga) аналогичен таковому для фрео-нов. Но так как молекулярные веса углекислоты и воздуха сравнительно с фреонами мало отличаются друг от друга, то линии графика на значительном участке близки к прямым.