1922లో నోబెల్ బహుమతిని అందుకున్న డానిష్ శాస్త్రవేత్త నీల్స్ బోర్ 1913లో ప్రతిష్టంభనకు పరిష్కారాన్ని కనుగొన్నాడు.
అని పిలువబడే ఊహలను బోర్ చేసాడు బోర్ యొక్క ప్రతిపాదనలు.
· మొదటి ప్రతిపాదన (నిశ్చల స్థితి):ఎలక్ట్రాన్లు నిర్దిష్టంగా మాత్రమే కదులుతాయి(స్థిరమైన)కక్ష్యలు. ఇందులో, వేగంతో కదులుతున్నప్పుడు కూడా,అవి శక్తిని విడుదల చేయవు.
· రెండవ ప్రతిపాదన (ఫ్రీక్వెన్సీ నియమం):కాంతి క్వాంటం రూపంలో శక్తిని విడుదల చేయడం మరియు గ్రహించడం (hn) ఒక ఎలక్ట్రాన్ ఒక స్థిర స్థితి నుండి మరొక స్థితికి మారినప్పుడు మాత్రమే సంభవిస్తుంది. కాంతి క్వాంటం యొక్క పరిమాణం ఆ నిశ్చల స్థితుల శక్తుల వ్యత్యాసానికి సమానం,దీని మధ్య ఎలక్ట్రాన్ దూకుతుంది: .
ఫోటాన్ శోషించబడినప్పుడు రేడియేషన్తో సంబంధం ఉన్న పరమాణు శక్తిలో మార్పు ఫ్రీక్వెన్సీ νకి అనులోమానుపాతంలో ఉంటుందని ఇది అనుసరిస్తుంది:
కక్ష్య పరిమాణీకరణ నియమం : అన్ని ఎలక్ట్రాన్ కక్ష్యలలో, అవి మాత్రమే సాధ్యమవుతాయి,దీని కోసం కోణీయ మొమెంటం ప్లాంక్ స్థిరాంకం యొక్క పూర్ణాంక గుణకానికి సమానం:
| , | (6.3.2) |
ఎక్కడ n= 1, 2, 3,... – ప్రధాన క్వాంటం సంఖ్య.
అణువులోని ఎలక్ట్రాన్ శక్తికి వ్యక్తీకరణను పొందుదాం.
ఛార్జ్తో అణు కేంద్రకం రంగంలో వేగంతో కదులుతున్న ఎలక్ట్రాన్ (Fig. 6.6a)ని పరిగణించండి జడ్ ఈ(వద్ద Z= 1 - హైడ్రోజన్ అణువు).
 | |||
| ఎ | బి |
ఎలక్ట్రాన్ చలనం యొక్క సమీకరణం రూపాన్ని కలిగి ఉంటుంది:
|
|
(6.3.3) |
ఫార్ములా (6.3.3) నుండి సెంట్రిఫ్యూగల్ ఫోర్స్ కూలంబ్ ఫోర్స్కి సమానం అని స్పష్టంగా తెలుస్తుంది, ఇక్కడ .
(6.3.2) నుండి (6.3.3)కి υ విలువను ప్రత్యామ్నాయం చేద్దాం మరియు నిశ్చల కక్ష్యల వ్యాసార్థం కోసం వ్యక్తీకరణను పొందండి (Fig. 6.6, b):
| . | (6.3.4) |
హైడ్రోజన్ పరమాణువు యొక్క మొదటి కక్ష్య యొక్క వ్యాసార్థాన్ని అంటారు బోర్ వ్యాసార్థం . వద్ద n =1, Zహైడ్రోజన్ కోసం = 1 మన వద్ద ఉంది:
![]() Å = 0.529·10 –10 మీ.
Å = 0.529·10 –10 మీ.
పరమాణువు యొక్క అంతర్గత శక్తి ఎలక్ట్రాన్ యొక్క గతిశక్తి (న్యూక్లియస్ చలనం లేనిది) మరియు న్యూక్లియస్తో ఎలక్ట్రాన్ యొక్క పరస్పర చర్య యొక్క సంభావ్య శక్తితో కూడి ఉంటుంది:
![]() .
.
ఎలక్ట్రాన్ చలనం యొక్క సమీకరణం నుండి అది అనుసరిస్తుంది, అనగా. గతి శక్తి సంభావ్య శక్తికి సమానం. అప్పుడు మనం వ్రాయవచ్చు:
![]() .
.
మొదటి కక్ష్య యొక్క వ్యాసార్థం కోసం వ్యక్తీకరణను ఇక్కడ ప్రత్యామ్నాయం చేద్దాం మరియు పొందండి:
|
|
(6.3.5) |
ప్లాంక్ యొక్క స్థిరాంకం ఇక్కడ పరిగణనలోకి తీసుకోబడింది, అనగా. .
వద్ద హైడ్రోజన్ అణువు కోసం Z= 1 మేము కలిగి ఉన్నాము:
|
|
(6.3.6) |
ఫార్ములా (6.3.6) నుండి ఇది వివిక్త శక్తి విలువలను మాత్రమే తీసుకుంటుందని స్పష్టంగా తెలుస్తుంది, ఎందుకంటే n = 1, 2, 3….
సమీకరణం (6.3.6) ద్వారా నిర్ణయించబడిన శక్తి స్థాయిల రేఖాచిత్రం అంజీర్లో చూపబడింది. 6.1 మరియు 6.7.


హైడ్రోజన్ పరమాణువులోని ఎలక్ట్రాన్ స్థితి నుండి వెళుతున్నప్పుడు nఒక రాష్ట్రంలో కెశక్తితో కూడిన ఫోటాన్ విడుదల అవుతుంది:
![]() .
.
ఉద్గార ఫ్రీక్వెన్సీ:
![]() .
.
సాధారణీకరించిన బాల్మెర్ సూత్రం పొందబడింది, ఇది ప్రయోగంతో బాగా అంగీకరిస్తుంది. బ్రాకెట్ల ముందు వ్యక్తీకరణ, ఇప్పటికే చెప్పినట్లుగా, అంటారు రిడ్బర్గ్ స్థిరాంకం :
![]() .
.
హైడ్రోజన్-వంటి వ్యవస్థల కోసం రైడ్బర్గ్ స్థిరాంకం యొక్క గణన మరియు వాటి రేఖ స్పెక్ట్రా యొక్క నిర్మాణాన్ని వివరించడం బోర్ సిద్ధాంతం యొక్క ప్రధాన విజయం. బోర్ స్పెక్ట్రం యొక్క పంక్తులను వివరించగలిగాడు అయనీకరణం చేయబడిందిహీలియం అతను సిద్ధాంతపరంగా ప్రోటాన్ ద్రవ్యరాశి మరియు ఎలక్ట్రాన్ ద్రవ్యరాశి నిష్పత్తిని లెక్కించాడు, ఇది ప్రయోగానికి అనుగుణంగా ఉంది, ఇది అతని సిద్ధాంతంలో ఉన్న ప్రధాన ఆలోచనల యొక్క ముఖ్యమైన నిర్ధారణ. అణు భౌతిక శాస్త్ర సృష్టిలో బోర్ సిద్ధాంతం భారీ పాత్ర పోషించింది. దాని అభివృద్ధి కాలంలో (1913-1925), ప్రపంచ విజ్ఞాన ఖజానాలో ఎప్పటికీ చేర్చబడిన ముఖ్యమైన ఆవిష్కరణలు జరిగాయి.
అయినప్పటికీ, విజయాలతో పాటు, బోర్ సిద్ధాంతంలో మొదటి నుండి ముఖ్యమైన లోపాలు కనుగొనబడ్డాయి. వాటిలో ముఖ్యమైనది అంతర్గత అస్థిరతసిద్ధాంతాలు: క్వాంటం పోస్టులేట్లతో క్లాసికల్ ఫిజిక్స్ యొక్క మెకానికల్ కనెక్షన్. అనే ప్రశ్నను సిద్ధాంతం వివరించలేకపోయింది తీవ్రతలువర్ణపట రేఖలు. దాని కక్ష్యలో రెండు ఎలక్ట్రాన్లను కలిగి ఉన్న హీలియం పరమాణువు యొక్క స్పెక్ట్రాను వివరించడానికి సిద్ధాంతాన్ని వర్తింపజేయడం పూర్తిగా అసంభవం, మరియు బహుళ-ఎలక్ట్రాన్ అణువుల కోసం (Fig. 6.8) తీవ్రమైన వైఫల్యం.

బోర్ యొక్క సిద్ధాంతం మరింత సాధారణ మరియు సరైన సిద్ధాంతాన్ని రూపొందించే మార్గంలో ఒక పరివర్తన దశ మాత్రమే అని స్పష్టమైంది. క్వాంటం మెకానిక్స్ అటువంటి సిద్ధాంతం.
డెమోలను వీక్షించడానికి, తగిన హైపర్లింక్పై క్లిక్ చేయండి:
పరమాణువు (ప్రాచీన గ్రీకు నుండి ἄτομος - విడదీయరానిది) అనేది రసాయన మూలకం యొక్క అతిచిన్న రసాయనికంగా విడదీయలేని భాగం, ఇది దాని లక్షణాలను కలిగి ఉంటుంది. ఒక పరమాణువులో పరమాణు కేంద్రకం మరియు ఎలక్ట్రాన్లు ఉంటాయి. పరమాణువు యొక్క కేంద్రకం ధనాత్మకంగా చార్జ్ చేయబడిన ప్రోటాన్లు మరియు ఛార్జ్ చేయని న్యూట్రాన్లను కలిగి ఉంటుంది. న్యూక్లియస్లోని ప్రోటాన్ల సంఖ్య ఎలక్ట్రాన్ల సంఖ్యతో సమానంగా ఉంటే, అణువు మొత్తం విద్యుత్ తటస్థంగా మారుతుంది. లేకపోతే, ఇది కొంత సానుకూల లేదా ప్రతికూల చార్జ్ కలిగి ఉంటుంది మరియు దీనిని అయాన్ అంటారు. న్యూక్లియస్లోని ప్రోటాన్లు మరియు న్యూట్రాన్ల సంఖ్యను బట్టి పరమాణువులు వర్గీకరించబడతాయి: ప్రోటాన్ల సంఖ్య అణువు నిర్దిష్ట రసాయన మూలకానికి చెందినదా అని నిర్ణయిస్తుంది మరియు న్యూట్రాన్ల సంఖ్య ఈ మూలకం యొక్క ఐసోటోప్ను నిర్ణయిస్తుంది.
పరమాణువు అనే పదానికి మొదట చిన్న భాగాలుగా విభజించబడని కణం అని అర్థం అయినప్పటికీ, శాస్త్రీయ భావనల ప్రకారం ఇది సబ్టామిక్ పార్టికల్స్ అని పిలువబడే చిన్న కణాలతో కూడి ఉంటుంది. ఒక పరమాణువులో ఎలక్ట్రాన్లు, ప్రోటాన్లు ఉంటాయి, హైడ్రోజన్-1 మినహా అన్ని పరమాణువులు కూడా న్యూట్రాన్లను కలిగి ఉంటాయి.
9.11·10−31 కిలోల ద్రవ్యరాశి, ప్రతికూల చార్జ్ మరియు ఆధునిక పద్ధతుల ద్వారా కొలవలేనంత చిన్న పరిమాణంతో అణువును తయారు చేసే తేలికైన కణం ఎలక్ట్రాన్. ప్రోటాన్లు ధనాత్మక చార్జ్ని కలిగి ఉంటాయి మరియు ఎలక్ట్రాన్ (1.6726·10−27 kg) కంటే 1836 రెట్లు ఎక్కువ బరువు కలిగి ఉంటాయి. న్యూట్రాన్లకు విద్యుత్ ఛార్జ్ ఉండదు మరియు ఎలక్ట్రాన్ (1.6929·10−27 kg) కంటే 1839 రెట్లు ఎక్కువ బరువు ఉంటుంది. ఈ సందర్భంలో, న్యూక్లియస్ యొక్క ద్రవ్యరాశి ద్రవ్యరాశి లోపం ప్రభావం కారణంగా దానిలోని ప్రోటాన్లు మరియు న్యూట్రాన్ల ద్రవ్యరాశి మొత్తం కంటే తక్కువగా ఉంటుంది. న్యూట్రాన్లు మరియు ప్రోటాన్లు పోల్చదగిన పరిమాణాన్ని కలిగి ఉంటాయి, దాదాపు 2.5 × 10−15 మీ, అయితే ఈ కణాల పరిమాణాలు సరిగా నిర్వచించబడలేదు.
హైడ్రోజన్ పరమాణువు మరియు హైడ్రోజన్ లాంటి అయాన్లు (బామర్-రైడ్బర్గ్ ఫార్ములా) మరియు కాంతి యొక్క ఉద్గారం మరియు శోషణ యొక్క క్వాంటం స్వభావాన్ని వివరించడానికి 1913లో నీల్స్ బోర్ రూపొందించిన ప్రాథమిక అంచనాలు బోర్ యొక్క ప్రతిపాదనలు. బోర్ రూథర్ఫోర్డ్ యొక్క పరమాణువు యొక్క గ్రహ నమూనా నుండి ముందుకు సాగాడు.
ఒక పరమాణువు ప్రత్యేక స్థిరమైన లేదా క్వాంటంలో మాత్రమే ఉంటుంది, వీటిలో ప్రతి ఒక్కటి నిర్దిష్ట శక్తిని కలిగి ఉంటుంది. నిశ్చల స్థితిలో, అణువు విద్యుదయస్కాంత తరంగాలను విడుదల చేయదు.
అణువులోని ఒక ఎలక్ట్రాన్, శక్తిని కోల్పోకుండా, నిర్దిష్ట వివిక్త వృత్తాకార కక్ష్యల వెంట కదులుతుంది, దీని కోసం కోణీయ మొమెంటం పరిమాణీకరించబడుతుంది: , సహజ సంఖ్యలు ఎక్కడ ఉన్నాయి మరియు ప్లాంక్ యొక్క స్థిరాంకం. కక్ష్యలో ఎలక్ట్రాన్ ఉనికిని ఈ స్థిర స్థితుల శక్తిని నిర్ణయిస్తుంది.
ఎలక్ట్రాన్ ఒక కక్ష్య (శక్తి స్థాయి) నుండి ఒక కక్ష్యకు కదులుతున్నప్పుడు, శక్తి యొక్క క్వాంటం విడుదల చేయబడుతుంది లేదా గ్రహించబడుతుంది, పరివర్తన సంభవించే శక్తి స్థాయిలు ఎక్కడ ఉన్నాయి. పై స్థాయి నుండి దిగువ స్థాయికి వెళ్ళేటప్పుడు, శక్తి విడుదల అవుతుంది; దిగువ నుండి పై స్థాయికి వెళ్ళేటప్పుడు, అది గ్రహించబడుతుంది.
ఈ పోస్టులేట్లు మరియు క్లాసికల్ మెకానిక్స్ నియమాలను ఉపయోగించి, బోర్ అణువు యొక్క నమూనాను ప్రతిపాదించాడు, దీనిని ఇప్పుడు అణువు యొక్క బోర్ మోడల్ అని పిలుస్తారు. తదనంతరం, సోమర్ఫెల్డ్ బోర్ సిద్ధాంతాన్ని దీర్ఘవృత్తాకార కక్ష్యల విషయంలో విస్తరించాడు. దీనిని బోర్-సోమర్ఫెల్డ్ మోడల్ అంటారు.
హైడ్రోజన్ పరమాణువు అనేది ప్రాథమిక సానుకూల విద్యుత్ చార్జ్ను మోసే పరమాణు కేంద్రకం మరియు ప్రాథమిక ప్రతికూల విద్యుత్ చార్జ్ను మోసే ఎలక్ట్రాన్తో కూడిన భౌతిక వ్యవస్థ. పరమాణు కేంద్రకం ఒకటి లేదా అంతకంటే ఎక్కువ న్యూట్రాన్లతో కూడిన ప్రోటాన్ లేదా ప్రోటాన్ను కలిగి ఉండవచ్చు, హైడ్రోజన్ ఐసోటోప్లను ఏర్పరుస్తుంది. ఎలక్ట్రాన్ ప్రధానంగా పరమాణు కేంద్రకం చుట్టూ సన్నని కేంద్రీకృత గోళాకార పొరలో ఉంది, ఇది అణువు యొక్క ఎలక్ట్రాన్ షెల్ను ఏర్పరుస్తుంది. స్థిరమైన స్థితిలో హైడ్రోజన్ అణువు యొక్క ఎలక్ట్రాన్ షెల్ యొక్క అత్యంత సంభావ్య వ్యాసార్థం బోర్ వ్యాసార్థం a0 = 0.529 Åకి సమానం.
హైడ్రోజన్ అణువు క్వాంటం మెకానిక్స్ మరియు సాపేక్ష క్వాంటం మెకానిక్స్లో ప్రత్యేక ప్రాముఖ్యతను కలిగి ఉంది ఎందుకంటే దీనికి రెండు-శరీర సమస్య ఖచ్చితమైన లేదా సుమారుగా విశ్లేషణాత్మక పరిష్కారాన్ని కలిగి ఉంటుంది. ఈ పరిష్కారాలు తగిన దిద్దుబాట్లతో విభిన్న హైడ్రోజన్ ఐసోటోపులకు వర్తిస్తాయి.
క్వాంటం మెకానిక్స్లో, హైడ్రోజన్ అణువు రెండు-కణ సాంద్రత మాతృక లేదా రెండు-కణాల వేవ్ ఫంక్షన్ ద్వారా వివరించబడుతుంది. ఇది చలనంలో పాల్గొనని (లేదా 1/r రూపం యొక్క కూలంబ్ ఎలెక్ట్రోస్టాటిక్ పొటెన్షియల్లో) అనంతమైన భారీ పరమాణు కేంద్రకం యొక్క ఎలెక్ట్రోస్టాటిక్ ఫీల్డ్లోని ఎలక్ట్రాన్గా కూడా సరళంగా పరిగణించబడుతుంది. ఈ సందర్భంలో, హైడ్రోజన్ అణువు తగ్గిన సింగిల్-పార్టికల్ డెన్సిటీ మ్యాట్రిక్స్ లేదా వేవ్ ఫంక్షన్ ద్వారా వివరించబడుతుంది.
1913లో, నీల్స్ బోర్ హైడ్రోజన్ అణువు యొక్క నమూనాను ప్రతిపాదించాడు, ఇది అనేక ఊహలు మరియు సరళీకరణలను కలిగి ఉంది మరియు దాని నుండి హైడ్రోజన్ యొక్క ఉద్గార స్పెక్ట్రమ్ను పొందింది. మోడల్ యొక్క అంచనాలు పూర్తిగా సరైనవి కావు, అయినప్పటికీ అణువు యొక్క శక్తి స్థాయిలకు సరైన విలువలకు దారితీసింది.
బోర్ యొక్క లెక్కల ఫలితాలు 1925-1926లో ష్రోడింగర్ సమీకరణం ఆధారంగా కఠినమైన క్వాంటం మెకానికల్ విశ్లేషణ ద్వారా నిర్ధారించబడ్డాయి. పరమాణు కేంద్రకం యొక్క ఎలెక్ట్రోస్టాటిక్ ఫీల్డ్లో ఎలక్ట్రాన్ కోసం ష్రోడింగర్ సమీకరణానికి పరిష్కారం విశ్లేషణాత్మక రూపంలో తీసుకోబడింది. ఇది ఎలక్ట్రాన్ శక్తి స్థాయిలు మరియు ఉద్గార వర్ణపటాలను మాత్రమే వివరిస్తుంది,
అణువులో ఎలక్ట్రాన్ శక్తి యొక్క పరిమాణీకరణసూక్ష్మ వస్తువులకు సంబంధించిన కొన్ని భౌతిక పరిమాణాలు నిరంతరంగా కాకుండా ఆకస్మికంగా మారుతాయి. బాగా నిర్వచించబడిన, అంటే వివిక్త విలువలు (లాటిన్ "డిస్క్రీటస్" అంటే విభజించబడినవి, నిరంతరాయంగా) మాత్రమే తీసుకోగల పరిమాణాలు పరిమాణీకరించబడతాయి.
1900 లో, ఘనపదార్థాల యొక్క ఉష్ణ వికిరణాన్ని అధ్యయనం చేసిన జర్మన్ భౌతిక శాస్త్రవేత్త M. ప్లాంక్, విద్యుదయస్కాంత వికిరణం శక్తి యొక్క ప్రత్యేక భాగాలు - క్వాంటా - రూపంలో విడుదలవుతుందని నిర్ధారణకు వచ్చారు. ఒక శక్తి క్వాంటం విలువ ΔE = hν,
ఇక్కడ ΔE అనేది క్వాంటం శక్తి, J; ν - ఫ్రీక్వెన్సీ, s-1; h అనేది ప్లాంక్ యొక్క స్థిరాంకం (ప్రకృతి యొక్క ప్రాథమిక స్థిరాంకాలలో ఒకటి), 6.626·10−34 J·sకి సమానం.
ఎనర్జీ క్వాంటాను తరువాత ఫోటాన్లు అని పిలిచేవారు.
ఎనర్జీ క్వాంటైజేషన్ యొక్క ఆలోచన లైన్ అటామిక్ స్పెక్ట్రా యొక్క మూలాన్ని వివరించడానికి సాధ్యపడింది, ఇది వరుసలో కలిపిన పంక్తుల సమితిని కలిగి ఉంటుంది.
1911కి తిరిగి వెళ్దాం. ఈ సమయానికి, పరమాణు వర్ణపటంలో సూక్ష్మదర్శిని యొక్క విచక్షణ చాలా స్పష్టంగా వ్యక్తమవుతుంది. అణువులు ఒక నిర్దిష్ట తరంగదైర్ఘ్యం యొక్క కాంతిని మాత్రమే గ్రహిస్తాయి మరియు విడుదల చేస్తాయి మరియు వర్ణపట పంక్తులు సిరీస్ అని పిలవబడే (Fig. 3.1) గా విభజించబడ్డాయి.
అన్నం. 3.1 హైడ్రోజన్ అణువు ద్వారా విడుదలయ్యే తరంగదైర్ఘ్యాలు: స్పెక్ట్రం శ్రేణిని కలిగి ఉంటుంది (మొదటి మూడు చూపబడ్డాయి)-
కనిష్టాన్ని పరిమితం చేసే నిర్దిష్ట (ప్రతి శ్రేణికి వేర్వేరుగా) ఘనీభవించే పంక్తుల క్రమాలు
విలువ; బాల్మెర్ సిరీస్లోని నాలుగు లైన్లు మాత్రమే కనిపించే పరిధిలో ఉన్నాయి

అన్నం. 3.2 (ఎ) హైడ్రోజన్, పాదరసం మరియు హీలియం వాయువుల లైన్ ఎమిషన్ స్పెక్ట్రా: (బి) హైడ్రోజన్ యొక్క శోషణ స్పెక్ట్రం

అన్నం. 3.3 నిరంతర ఉద్గార స్పెక్ట్రా వేడిచేసిన ఘన మరియు ద్రవ పదార్ధాలు, అధిక సంపీడన వాయువులు, అధిక-ఉష్ణోగ్రత ప్లాస్మాను అందిస్తుంది
హైడ్రోజన్ యొక్క స్పెక్ట్రం కోసం, పరమాణువులలో సరళమైనది, ఒక సాధారణ సూత్రం స్థాపించబడింది (ఉత్పన్నమైనది కాదు, కానీ ఊహించబడింది!)
|
|
ఇక్కడ -
హైడ్రోజన్ అణువు రేడియేషన్ తరంగదైర్ఘ్యం, nమరియు k > n -
మొత్తం సంఖ్యలు, ఆర్ -
అని పిలవబడే రిడ్బర్గ్ స్థిరాంకం (![]() , ఎక్కడ -
శక్తి యొక్క ఆఫ్-సిస్టమ్ యూనిట్ "రిడ్బర్గ్", సగం అణు శక్తి యూనిట్కు సమానం) .
విలువల కోసం ఈ ఫార్ములా ద్వారా లైమాన్ సిరీస్ వివరించబడిందని తేలింది ,
బామర్ సిరీస్ -
వద్ద , Paschen సిరీస్ -
వద్ద, మొదలైనవి
, ఎక్కడ -
శక్తి యొక్క ఆఫ్-సిస్టమ్ యూనిట్ "రిడ్బర్గ్", సగం అణు శక్తి యూనిట్కు సమానం) .
విలువల కోసం ఈ ఫార్ములా ద్వారా లైమాన్ సిరీస్ వివరించబడిందని తేలింది ,
బామర్ సిరీస్ -
వద్ద , Paschen సిరీస్ -
వద్ద, మొదలైనవి
![]()

అన్నం. 3.4 జోహన్నెస్ రాబర్ట్ రైడ్బర్గ్ (1854–1919)

అన్నం. 3.5 థియోడర్ లైమాన్ (1874–1954)

అన్నం. 3.6 లైమాన్ స్పెక్ట్రల్ సిరీస్

అన్నం. 3.7 జోహన్ జాకబ్ బామర్ (1825–1898)
అన్నం. 3.8 బామర్ సిరీస్లో కనిపించే హైడ్రోజన్ ఉద్గార పంక్తులు. Hα అనేది 656.3 nm తరంగదైర్ఘ్యం కలిగిన కుడివైపున ఉన్న ఎరుపు రేఖ. ఎడమవైపు రేఖ - Hε, 397.0 nm తరంగదైర్ఘ్యం వద్ద స్పెక్ట్రం యొక్క అతినీలలోహిత ప్రాంతంలో ఇప్పటికే ఉన్న రేడియేషన్కు అనుగుణంగా ఉంటుంది.

అన్నం. 3.9 లూయిస్ కార్ల్ హెన్రిచ్ ఫ్రెడరిక్ పాస్చెన్ (1865–1947)
అన్నం. 3.10 పాస్చెన్ సిరీస్ యొక్క అన్ని పంక్తులు ఇన్ఫ్రారెడ్ పరిధిలో ఉన్నాయి
అదనంగా, వాయువుల లక్షణాలను అధ్యయనం చేసిన ఫలితంగా, అణువుల పరిమాణాలు సుమారుగా ఉన్నాయని అప్పటికి తెలిసింది.
సమానం అందువల్ల, అణువుల స్పెక్ట్రం మరియు పరిమాణాలను వివరించే సిద్ధాంతం పొడవు యొక్క పరిమాణంతో (స్థిరమైన) పరిమాణాన్ని నిర్మించడానికి అనుమతించే కొన్ని పరామితిని కలిగి ఉండాలి. ఇమరియు m -
ఎలక్ట్రాన్ ఛార్జ్ మరియు ద్రవ్యరాశి -
దీనికి సరిపోదు). సాంప్రదాయ సిద్ధాంతంలో అలాంటి పరామితి లేదు. ఇది Rydberg స్థిరాంకం అయి ఉండవచ్చు, కానీ దాని మూలాలు చీకటిగా మరియు రహస్యంగా ఉన్నాయి.
1911లో, E. రూథర్ఫోర్డ్ ఒక సైద్ధాంతిక రచనను ప్రచురించాడు ( రూథర్ఫోర్డ్ E., ఫిలాసఫికల్ మ్యాగజైన్, v. 21, పేజి. 669–688 , 1911), దీనిలో ప్రదర్శించిన ప్రయోగాల విశ్లేషణ ఆధారంగా 1908–1909 అతని విద్యార్థులచే సంవత్సరాలు - ఇంటర్న్ హన్స్ గీగర్ మరియు గ్రాడ్యుయేట్ విద్యార్థి ఎర్నెస్ట్ మార్స్డెన్ - ( గీగర్ హెచ్., మార్స్డెన్ టి., రాయల్ సొసైటీ ఆఫ్ లండన్, సిరీస్ A, v. 82, p. 495–499 , 1909) ధనాత్మకంగా చార్జ్ చేయబడిన కేంద్రకం యొక్క పరమాణువు లోపల ఉనికిని నొక్కి చెప్పింది, ఇందులో పరమాణువు యొక్క మొత్తం ద్రవ్యరాశి కేంద్రీకృతమై ఉంటుంది.

అన్నం. 3.11 ఎర్నెస్ట్ రూథర్ఫోర్డ్ (1871–1937)
వీడియో 3.2. ఒక చిన్న చరిత్ర. బ్లాక్ టోపీ మరియు స్కాటరింగ్ మోడల్.తదనంతరం, తన ఉపన్యాసాలలో ఒకదానిలో, E. రూథర్ఫోర్డ్ స్వయంగా ఆ సమయాన్ని ఈ క్రింది విధంగా గుర్తుచేసుకున్నాడు (J. ట్రిగ్ యొక్క పుస్తకం నుండి ఉల్లేఖించబడింది, ఆధునిక భౌతిక శాస్త్రంలో కీలకమైన ప్రయోగాలు, మాస్కో, MIR, 1974, p. 77): “...నాకు గుర్తుంది. ... చాలా ఉత్సాహంగా ఉన్న గీగర్ నా వద్దకు వచ్చి ఇలా అన్నాడు: "మేము అనేక వికీర్ణ కేసులను స్వీకరించినట్లు తెలుస్తోంది - కణాలు తిరిగి ...". ఇది నా జీవితంలో జరిగిన అత్యంత అపురూపమైన సంఘటన. మీరు టిష్యూ పేపర్పై 15-అంగుళాల షెల్ను పేల్చినప్పుడు అది ఎగిరిపోయి మిమ్మల్ని తాకినట్లు ఇది దాదాపుగా నమ్మశక్యంకాదు. దీనిని విశ్లేషించేటప్పుడు, అటువంటి వెనుకబడిన చెదరగొట్టడం ఒకే తాకిడి ఫలితంగా ఉంటుందని నేను గ్రహించాను మరియు లెక్కలు చేసిన తర్వాత, పరమాణువు ద్రవ్యరాశిలో అత్యధిక భాగం కేంద్రీకృతమై ఉందని ఊహించినట్లయితే తప్ప ఇది ఏ విధంగానూ సాధ్యం కాదని నేను గ్రహించాను. ఒక చిన్న కేంద్రకం. అప్పుడే నాకు ఛార్జ్ కేంద్రీకృతమై ఉన్న ఒక చిన్న, భారీ కేంద్రం ఉన్న అణువు గురించి ఆలోచన వచ్చింది. "వెనుకబడిన స్కాటరింగ్" అనే పదాలు వాస్తవానికి 150 డిగ్రీల వెదజల్లడాన్ని సూచిస్తాయని మనం స్వంతంగా జోడిద్దాము; పెద్ద కోణాల్లో వెదజల్లడం ఆ సమయంలో ఉపయోగించిన ఇన్స్టాలేషన్ రూపకల్పన ద్వారా పరిశీలనను అనుమతించదు.
రూథర్ఫోర్డ్ ప్రయోగాల స్కీమాటిక్ రేఖాచిత్రం అంజీర్లో చూపబడింది. 3.12 పైన ఉదహరించిన J. ట్రిగ్ ద్వారా వాస్తవ సంస్థాపన యొక్క రేఖాచిత్రం పుస్తకంలో చూడవచ్చు.

అన్నం. 3.12 రూథర్ఫోర్డ్ యొక్క స్కాటరింగ్ ప్రయోగం యొక్క స్కీమాటిక్ - కణాలు
వీడియో 3.3. ప్రయోగశాల సెటప్లో రూథర్ఫోర్డ్ పూర్తి స్థాయి ప్రయోగం. వీడియో 3.4. రూథర్ఫోర్డ్ అనుభవం "లోపల నుండి" (ప్రయోగశాల సెటప్). వీడియో 3.5. రూథర్ఫోర్డ్ అనుభవం యొక్క కంప్యూటర్ మోడల్.సీసం కంటైనర్లో ఉంచబడిన రేడియోధార్మిక మూలం నుండి, కణాలు సన్నని రేకుపైకి మళ్లించబడ్డాయి ఎఫ్పరీక్షించబడుతున్న మెటల్ నుండి. జింక్ సల్ఫైడ్ స్ఫటికాల పొరతో కప్పబడిన స్క్రీన్పై చెల్లాచెదురుగా ఉన్న కణాలు పడిపోయాయి, ఇవి వేగంగా చార్జ్ చేయబడిన కణాలతో కొట్టబడినప్పుడు మెరుస్తాయి. మైక్రోస్కోప్ని ఉపయోగించి స్క్రీన్పై స్కింటిలేషన్స్ (ఫ్లాషెస్) కంటి ద్వారా గమనించబడ్డాయి. రూథర్ఫోర్డ్ యొక్క ప్రయోగంలో చెల్లాచెదురుగా ఉన్న కణాల పరిశీలనలు పుంజం యొక్క అసలు దిశకు వేర్వేరు కోణాల్లో నిర్వహించబడతాయి. చాలా కణాలు తక్కువ లేదా విక్షేపం లేకుండా లోహం యొక్క పలుచని పొర గుండా వెళుతున్నట్లు కనుగొనబడింది. అయినప్పటికీ, కణాల యొక్క చిన్న భాగం మించిన ముఖ్యమైన కోణాల వద్ద విక్షేపం చెందుతుంది 30°. చాలా అరుదైన కణాలు (సుమారు పదివేలలో ఒకటి) కి దగ్గరగా ఉన్న కోణాలలో విక్షేపణలను అనుభవించాయి. సహజంగానే, పరమాణువు యొక్క ధనాత్మక చార్జ్ మరియు దాని ద్రవ్యరాశి పరమాణువు లోపల చాలా చిన్న పరిమాణంలో కేంద్రీకృతమై ఉంటే మాత్రమే కణాన్ని వెనక్కి విసిరివేయవచ్చు. ఆ విధంగా అది తెరవబడింది పరమాణు కేంద్రకం- పరమాణువుతో పోలిస్తే చిన్న పరిమాణాల శరీరం, దీనిలో అన్ని సానుకూల చార్జ్ మరియు దాదాపు మొత్తం ద్రవ్యరాశి కేంద్రీకృతమై ఉంటుంది. న్యూక్లియస్ యొక్క కొలతలు 1911లో E. రూథర్ఫోర్డ్ ద్వారా అంచనా వేయబడ్డాయి, అంచనా కంటే తక్కువగా లేదా క్రమంలో ఉంది.
వీడియో 3.6. ఇంపాక్ట్ పరామితి మరియు పథం ఆకారం. వీడియో 3.7. చెల్లాచెదురుగా ఉన్న కణం యొక్క ఛార్జ్ మరియు పథం యొక్క ఆకృతి. వీడియో 3.8. చెల్లాచెదురుగా ఉన్న కణం యొక్క శక్తి మరియు పథం యొక్క ఆకారం. వీడియో 3.9. అణు ఛార్జ్ మరియు పథం ఆకారం.
అన్నం. 3.13 బంగారు పరమాణువు యొక్క కేంద్రకంపై ఆల్ఫా కణాల విక్షేపణ రేఖాచిత్రం

అన్నం. 3.14 సన్నని బంగారు రేకులో ఆల్ఫా పార్టికల్ ఫ్లక్స్ స్కాటరింగ్ యొక్క పథకం
హైడ్రోజన్ అణువు యొక్క గ్రహ నమూనా ఉద్భవించింది: కక్ష్యలో ఎలక్ట్రాన్తో కూడిన ప్రోటాన్. భౌతిక శాస్త్రవేత్తలు ఏకీకృత నమూనాలను ఇష్టపడతారు, కానీ ఇక్కడ పెద్దది చిన్నది, అణువులో - సౌర వ్యవస్థలో చాలా అందంగా పునరావృతమైంది.

అన్నం. 3.15 పరమాణువు యొక్క రూథర్ఫోర్డ్ యొక్క న్యూక్లియర్ (ప్లానెటరీ) నమూనా యొక్క రేఖాచిత్రం
సమస్య ఏమిటంటే, కేంద్రకం దగ్గర పరిమితమైన మరియు వేగవంతమైన కదలికను ప్రదర్శించే ఎలక్ట్రాన్ తప్పనిసరిగా కేంద్రకంపై పడాలి. వాస్తవం ఏమిటంటే, ఎలక్ట్రాన్ ఛార్జ్ చేయబడుతుంది మరియు వేగవంతమైన కదలికతో, విద్యుదయస్కాంత వికిరణాన్ని విడుదల చేయాలి, అనగా స్థిర కదలిక అసాధ్యం. క్లాసికల్ ఎలక్ట్రోడైనమిక్స్ అంచనా వేసింది, త్వరగా దాని శక్తిని మరియు కక్ష్య చలనం యొక్క కోణీయ మొమెంటంను కోల్పోయి, ఎలక్ట్రాన్ సుమారుగా కేంద్రకంపై పడాలి. ఈ సమయంలో కాంతి చుట్టూ తిరుగుతుంది 1.5 సెం.మీ(మనం "చనిపోయిన" అణువులను మాత్రమే చూస్తాము, కానీ ఇది అలా కాదు!). రూథర్ఫోర్డ్ సమస్యను అర్థం చేసుకున్నాడు, అయితే పరమాణు ఎలక్ట్రాన్ల ప్రవర్తనను అధ్యయనం చేయడం ద్వారా అణువు యొక్క స్థిరత్వం యొక్క ప్రశ్న పరిష్కరించబడుతుందని నమ్ముతూ, కేంద్రకం యొక్క ఉనికిపై ఉద్దేశపూర్వకంగా దృష్టి సారించాడు. ఇది పరమాణువు యొక్క కొత్త సిద్ధాంతాన్ని ప్రతిపాదించిన N. బోర్చే 1913లో చేయాలని నిర్ణయించబడింది.


అన్నం. 3.16 పరమాణువు యొక్క రూథర్ఫోర్డ్ నమూనా యొక్క అస్థిరత
బోర్ యొక్క ప్రతిపాదనలు
బోర్ యొక్క మొదటి ప్రతిపాదన
ఇక్కడ మనం విచక్షణ యొక్క "బలవంతంగా" పరిచయం (అన్ని కక్ష్యలు అనుమతించబడవు), అలాగే సాధారణ భౌతిక శాస్త్రం "రగ్గు కింద సమస్యను తుడిచివేయడం" చూడవచ్చు: ఏదైనా వివరణ లేనట్లయితే, వారు దానిని మంజూరు చేసి అధ్యయనం చేస్తారు. ఏదో ఒక రోజు వారు అర్థం చేసుకుంటారు మరియు హేతువు చేస్తారనే ఆశతో పరిణామాలు.

అన్నం. 3.17 బోర్ యొక్క మొదటి పోస్ట్యులేట్ యొక్క ఉదాహరణ
బోర్ యొక్క రెండవ ప్రతిపాదన
ఈ ప్రతిపాదన శక్తి పరిరక్షణ మరియు ప్లాంక్-ఐన్స్టీన్ సంబంధాన్ని ప్రతిబింబిస్తుంది.

అన్నం. 3.18 బోర్ యొక్క రెండవ పోస్ట్యులేట్ కోసం దృష్టాంతం
బోర్ యొక్క మూడవ ప్రతిపాదన
ఒక అనివార్య పరిణామం: ఎలక్ట్రాన్ కోసం మిగిలిన కక్ష్యలు నిషేధించబడినందున, పరివర్తన ఆకస్మికంగా సంభవిస్తుంది; కక్ష్యల మధ్య ఎలక్ట్రాన్ యొక్క మార్గం మరియు శక్తి గురించి మాట్లాడటానికి అర్ధమే లేదు: మెకానిక్స్ నియమాలు అక్కడ వర్తించవు.
బోర్ యొక్క నాల్గవ ప్రతిపాదన
ప్లాంక్ స్థిరంగా ఉంటుంది ħ కోణీయ మొమెంటం యొక్క కోణాన్ని మరియు ఎలక్ట్రాన్ యొక్క ఛార్జ్తో కలిపి ఉంటుంది ఇమరియు దాని ద్రవ్యరాశి mపొడవు పరిమాణం పరామితిని సృష్టించడానికి మిమ్మల్ని అనుమతిస్తుంది. ఇది పరమాణువు యొక్క పరిమాణాన్ని లెక్కించే సామర్థ్యానికి దారి తీస్తుంది.

అన్నం. 3.19 నీల్స్ హెన్రిక్ డేవిడ్ బోర్ (1885–1962)
బోర్ యొక్క పోస్ట్యులేట్ల అప్లికేషన్
వ్యాసార్థం యొక్క వృత్తాకార కక్ష్యలో తిరిగే ఎలక్ట్రాన్ కోసం క్లాసికల్ మెకానిక్స్ ఆర్వేగంతో vఛార్జ్తో ఒక కేంద్రకం చుట్టూ జడ్ ఈ, చలన సమీకరణాన్ని ఇస్తుంది


అందువలన శక్తి ఇమరియు కోణీయ మొమెంటం ఎల్ఎలక్ట్రాన్లు కక్ష్య వ్యాసార్థం పరంగా వ్యక్తీకరించబడతాయి ఆర్:

బోర్ యొక్క పరిమాణీకరణ పరిస్థితి చివరి వ్యక్తీకరణకు వర్తింపజేస్తే L=nħ (n=1, 2, 3, …), అప్పుడు క్రింది ఫలితాలు పొందబడతాయి.

అన్నం. 3.20 బోర్ అణువు నమూనా
హైడ్రోజన్ లాంటి అణువు యొక్క లక్షణాలు
అనుమతించబడిన కక్ష్యల వ్యాసార్థం
|
|
స్థిర కక్ష్యలో ఎలక్ట్రాన్ యొక్క శక్తి
స్థిరమైన ఎIN,
పొడవు యొక్క పరిమాణాన్ని కలిగి ఉండటం అంటారు బోర్ వ్యాసార్థం: ![]() . సంఖ్య యొక్క అర్థం -
అనుమతించబడిన కక్ష్య సంఖ్య. బోర్ వ్యాసార్థం -
హైడ్రోజన్ అణువులో అత్యల్ప కక్ష్య యొక్క వ్యాసార్థం.
. సంఖ్య యొక్క అర్థం -
అనుమతించబడిన కక్ష్య సంఖ్య. బోర్ వ్యాసార్థం -
హైడ్రోజన్ అణువులో అత్యల్ప కక్ష్య యొక్క వ్యాసార్థం.
ఫార్ములా (3.3) నిర్ణయిస్తుంది వివిక్త హైడ్రోజన్ అణువులో ఎలక్ట్రాన్ కలిగి ఉండే శక్తి విలువలు లేదా, వారు చెప్పినట్లు, శక్తి స్థాయిలు. ప్రతికూల విలువలు పరమాణువులోని ఎలక్ట్రాన్ యొక్క బంధిత స్థితులకు అనుగుణంగా ఉంటాయి, అనగా పరిమిత స్థలంలో కదలికలు (క్లాసికల్ ఫిజిక్స్లో అనలాగ్ - దీర్ఘవృత్తాకారంలో గ్రహాల కదలిక, అనంతం వరకు వెళ్ళే అతిపరావలయ మరియు పారాబొలిక్ పథాలకు విరుద్ధంగా).
పరమాణువులో ఎలక్ట్రాన్ యొక్క ప్రవర్తన గురించి సమస్యలను పరిష్కరించేటప్పుడు, ఎలక్ట్రాన్ యొక్క ఎలెక్ట్రిక్ చార్జ్ యొక్క చతురస్రాన్ని ఎలెక్ట్రిక్ స్థిరాంకంతో కలిపి వ్యక్తీకరణలు సాధారణంగా ఉత్పన్నమవుతాయి. ప్రాథమిక ప్రపంచ స్థిరాంకాల యొక్క పరిమాణం లేని కలయికను పరిచయం చేయడానికి ఇది చాలా ఉపయోగకరంగా ఉంటుంది - అని పిలవబడేవి చక్కటి నిర్మాణం స్థిరంగా ఉంటుంది:
|
|
పరమాణు సంఖ్య మరియు కక్ష్య సంఖ్యతో కలిసి, పరమాణువులోని సాపేక్ష ప్రభావాల స్థాయిని నిర్ణయిస్తుంది. దీన్ని మరింత స్పష్టంగా చేయడానికి, ఫార్ములా (3.3)ని మళ్లీ వ్రాద్దాం, తద్వారా దాని కుడి వైపు చక్కటి నిర్మాణ స్థిరాంకం ఉంటుంది:
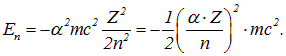
గుణకం కారణంగా, అణువు యొక్క శక్తుల లక్షణం ఎలక్ట్రాన్ యొక్క మిగిలిన శక్తి కంటే నాలుగు ఆర్డర్ల పరిమాణం తక్కువగా ఉంటుంది. ఇది చాలా తేలికైన అణు వ్యవస్థల యొక్క నాన్ రిలేటివిజం యొక్క అభివ్యక్తి. పై సూత్రంలోని చివరి వ్యక్తీకరణ నుండి చూడగలిగినట్లుగా, సాపేక్ష ప్రభావాలు భారీ పరమాణువులలో కేంద్రకానికి దగ్గరగా ఉండే ఎలక్ట్రాన్ల కోసం చిన్న దిద్దుబాట్లుగా నిలిచిపోతాయి.
ఉదాహరణ 1.ద్వారా ఎలక్ట్రాన్ వేగాన్ని నిర్ధారిద్దాం nబోర్ అణువు యొక్క వ కక్ష్య. వ్యాసార్థం nవకక్ష్య సూత్రం ద్వారా నిర్ణయించబడుతుంది
ఎక్కడ ఒక బి- బోర్ వ్యాసార్థం. ఎలక్ట్రాన్ వేగం vకోణీయ మొమెంటం పరంగా వ్యక్తీకరించవచ్చు L=nħ:

ప్రవేశపెట్టిన ఫైన్ స్ట్రక్చర్ స్థిరాంకాన్ని ఉపయోగించి బోర్ వ్యాసార్థం కోసం వ్యక్తీకరణను సరళీకృతం చేద్దాం:
|
|
ఈ వ్యక్తీకరణను ఎలక్ట్రాన్ వేగం కోసం పై సూత్రంలోకి మార్చడం ద్వారా, మేము పొందుతాము nవ కక్ష్యలు
అన్నం. 3.21 బోర్ సిద్ధాంతం ప్రకారం హైడ్రోజన్ అణువులో శక్తి స్థాయిలు మరియు పరివర్తనాల రేఖాచిత్రం:
ఘన పంక్తులు (పై నుండి క్రిందికి పరివర్తనాలు) - ఉద్గారం, చుక్కల పంక్తులు (దిగువ నుండి పైకి పరివర్తనాలు) - శోషణ.
సిరీస్ యొక్క సరిహద్దులు (పరిమితులు) చూపబడ్డాయి ![]() , ఇది స్థాయి c నుండి పరివర్తనలకు అనుగుణంగా ఉంటుంది
, ఇది స్థాయి c నుండి పరివర్తనలకు అనుగుణంగా ఉంటుంది
- నిరంతర మరియు వివిక్త స్పెక్ట్రం మధ్య సరిహద్దులు
ఫ్రాంక్-హెర్ట్జ్ ప్రయోగాలలో పరమాణువుల శక్తి వర్ణపటం యొక్క విచక్షణ గురించి బోర్ యొక్క ప్రకటన ప్రయోగాత్మకంగా నిర్ధారించబడింది, ఇందులో వాక్యూమ్ ట్యూబ్లోని ఎలక్ట్రాన్లతో పాదరసం ఆవిరిని పేల్చివేయడం మరియు వేగవంతమైన సంభావ్య వ్యత్యాసంపై యానోడ్ కరెంట్ ఆధారపడటాన్ని కొలవడం వంటివి ఉన్నాయి. ప్రయోగాత్మక రేఖాచిత్రం అంజీర్లో చూపబడింది. 3.22

అన్నం. 3.22 ఫ్రాంక్ యొక్క ప్రయోగ పథకం - హెర్ట్జ్
తక్కువ పీడనం (సుమారు 1 mm Hg) కింద పాదరసం ఆవిరితో నిండిన ట్యూబ్లో మూడు ఎలక్ట్రోడ్లు ఉన్నాయి: యానోడ్, కాథోడ్ మరియు గ్రిడ్. థర్మియోనిక్ ఉద్గారాల కారణంగా వేడిచేసిన కాథోడ్ ఉపరితలం నుండి తప్పించుకునే ఎలక్ట్రాన్లు వోల్టేజ్ ద్వారా వేగవంతం చేయబడతాయి యు, కాథోడ్ మరియు గ్రిడ్ మధ్య వర్తించబడుతుంది. ఈ వోల్టేజ్ను పొటెన్షియోమీటర్ ఉపయోగించి మార్చవచ్చు పి. యొక్క క్రమం యొక్క సంభావ్య వ్యత్యాసంతో బలహీనమైన రివర్స్ ఫీల్డ్ 0.5BB, యానోడ్కు ఎలక్ట్రాన్ల కదలికను నిరోధిస్తుంది. కరెంట్ యొక్క ఆధారపడటం నిర్ణయించబడింది Iఅనువర్తిత వోల్టేజ్ నుండి యానోడ్ సర్క్యూట్లో యు. పొందిన ఫలితాలు అంజీర్లో చూపబడ్డాయి. 3.23

అన్నం. 3.23 అనువర్తిత వోల్టేజ్ Uపై యానోడ్ సర్క్యూట్లో ప్రస్తుత I యొక్క ఆధారపడటం ఫ్రాంక్-హెర్ట్జ్ ప్రయోగంలో
ప్రస్తుత బలం మొదట మార్పు లేకుండా పెరుగుతుంది మరియు వోల్టేజ్ వద్ద గరిష్ట స్థాయికి చేరుకుంటుంది 4.9 వి, దాని తర్వాత పెరుగుదలతో యుతీవ్రంగా పడిపోతుంది, కనిష్ట స్థాయికి చేరుకుంటుంది మరియు మళ్లీ పెరగడం ప్రారంభమవుతుంది. వోల్టేజీల వద్ద ప్రస్తుత గరిష్టం పునరావృతమవుతుంది 9.8 వి, 14.7 విమొదలైనవి. ఒకదానికొకటి సమాన దూరంలో ఉన్న మాగ్జిమా యొక్క ప్రత్యామ్నాయం అణువు యొక్క శక్తిలో మార్పు యొక్క వివిక్త స్వభావాన్ని నిరూపించింది.
వీడియో 3.10. ఫ్రాంక్ మరియు హెర్ట్జ్ అనుభవం. ప్రదర్శన సంస్థాపన. వీడియో 3.11. ఫ్రాంక్ మరియు హెర్ట్జ్ అనుభవం. నియాన్ మరియు హీలియం కోసం ప్రస్తుత-వోల్టేజ్ లక్షణాల పోలిక. వీడియో 3.12. ఫ్రాంక్ మరియు హెర్ట్జ్ అనుభవం. ప్రయోగశాల సెటప్ 1. వీడియో 3.12. ఫ్రాంక్ మరియు హెర్ట్జ్ అనుభవం. ప్రయోగశాల ఏర్పాటు 2.
మూలకం యొక్క పరమాణు సంఖ్య పూర్ణాంకం, కాబట్టి చుట్టుముట్టిన తర్వాత మనకు లభిస్తుంది Z=2, ఇది హీలియంకు అనుగుణంగా ఉంటుంది.
పైన పేర్కొన్నట్లుగా, బోర్ సిద్ధాంతం రాకముందే, హైడ్రోజన్ అణువు యొక్క స్పెక్ట్రం అధ్యయనం చేయబడింది మరియు సూత్రం (3.1) అనుభవపూర్వకంగా స్థాపించబడింది. కానీ సూర్యుని వర్ణపటాన్ని గమనించినప్పుడు, ఈ సూత్రాన్ని ఉల్లంఘించినట్లు అనిపించే పంక్తులు గమనించబడ్డాయి, ఎందుకంటే అవి సగం-పూర్ణాంక విలువలకు అనుగుణంగా ఉంటాయి. nమరియు కె. బోర్ సిద్ధాంతం కనిపించిన తరువాత, క్వాంటం సంఖ్యలు అని స్పష్టమైంది n మరియు కెఇప్పటికీ పూర్ణాంకాలు ఉండాలి మరియు స్పష్టమైన అర్ధ-పూర్ణాంక విలువలను భిన్నంగా వివరించవచ్చు. నిజానికి, హైడ్రోజన్ లాంటి పరమాణువు ద్వారా విడుదలయ్యే పౌనఃపున్యాల కోసం సూత్రం (3.6) నుండి, అది అనుసరిస్తుంది

అంటే, గమనించిన పంక్తులు మూలకం యొక్క అయాన్కు చెందినవి Z=2. మీకు తెలిసినట్లుగా, ఈ మూలకానికి "సౌర" పేరు ఉంది - హీలియం.
వివిక్త శక్తి స్థాయిల ఉనికి పరమాణువుల (అలాగే అణువులు మరియు పరమాణు కేంద్రకాలు) యొక్క ప్రాథమిక ఆస్తి.
అణువు యొక్క నిర్మాణాన్ని ఊహించడానికి మనకు తెలిసిన భౌతిక శాస్త్ర నియమాలను వర్తింపజేయడానికి ప్రయత్నిద్దాం, ఇది దాని శక్తి స్థాయిల విచక్షణను వివరిస్తుంది.
పరమాణువులలో సరళమైనది - హైడ్రోజన్ అణువును పరిశీలిద్దాం. మూలకాల యొక్క ఆవర్తన పట్టికలో హైడ్రోజన్ యొక్క పరమాణు సంఖ్య ఒకదానికి సమానం, కాబట్టి, హైడ్రోజన్ అణువు సానుకూల కేంద్రకాన్ని కలిగి ఉంటుంది, దీని ఛార్జ్ సమానంగా ఉంటుంది మరియు ఒక ఎలక్ట్రాన్. న్యూక్లియస్ మరియు ఎలక్ట్రాన్ మధ్య చార్జ్ల మధ్య ఆకర్షణ శక్తి ఉంటుంది. ఈ శక్తి యొక్క ఉనికి రేడియల్ (సెంట్రిపెటల్) త్వరణాన్ని అందిస్తుంది, దీని కారణంగా ఒక గ్రహం గురుత్వాకర్షణ ప్రభావంతో సూర్యుని చుట్టూ తిరిగే విధంగానే వృత్తాకార లేదా దీర్ఘవృత్తాకార కక్ష్యలో భారీ కేంద్రకం చుట్టూ ఒక కాంతి ఎలక్ట్రాన్ తిరుగుతుంది. అందువలన, పరమాణువు యొక్క వివిధ సాధ్యమయ్యే స్థితులు కేంద్రకం చుట్టూ తిరిగే ఎలక్ట్రాన్ యొక్క కక్ష్య యొక్క పరిమాణం (మరియు ఆకారం)లోని వ్యత్యాసానికి అనుగుణంగా ఉంటాయి.
పరమాణువులోని ఎలక్ట్రాన్ యొక్క శక్తి కక్ష్యలో చలనం యొక్క గతి శక్తి మరియు కేంద్రకం యొక్క విద్యుత్ క్షేత్రంలో సంభావ్య శక్తితో కూడి ఉంటుంది. ఒక వృత్తాకార కక్ష్యలో ఎలక్ట్రాన్ యొక్క శక్తి మరియు మొత్తంగా పరమాణువు యొక్క శక్తి కక్ష్య యొక్క వ్యాసార్థంపై ఆధారపడి ఉంటుందని చూపవచ్చు (పేరా చివరిలో చూడండి) : కక్ష్య యొక్క చిన్న వ్యాసార్థం అనుగుణంగా ఉంటుంది అణువు యొక్క చిన్న శక్తికి. కానీ, మనం § 204లో చూసినట్లుగా, అణువు యొక్క శక్తి ఏదీ తీసుకోదు, కానీ నిర్దిష్ట ఎంపిక విలువలను మాత్రమే తీసుకోవచ్చు. కక్ష్య యొక్క వ్యాసార్థం ద్వారా శక్తి నిర్ణయించబడుతుంది కాబట్టి, అణువు యొక్క ప్రతి శక్తి స్థాయి నిర్దిష్ట ఎంచుకున్న వ్యాసార్థం యొక్క కక్ష్యకు అనుగుణంగా ఉంటుంది.
హైడ్రోజన్ అణువులోని ఎలక్ట్రాన్ యొక్క వృత్తాకార కక్ష్యల చిత్రం అంజీర్లో చూపబడింది. 367. పరమాణువు యొక్క ప్రధాన శక్తి స్థాయి అతి చిన్న వ్యాసార్థం యొక్క కక్ష్యకు అనుగుణంగా ఉంటుంది.

అన్నం. 367. హైడ్రోజన్ అణువులో ఎలక్ట్రాన్ యొక్క సాధ్యమైన కక్ష్యలు: కక్ష్యల వ్యాసార్థం నిష్పత్తిలో పెరుగుతుంది, అనగా. సంబంధించి, మొదలైనవి.
సాధారణంగా ఎలక్ట్రాన్ ఈ కక్ష్యలో ఉంటుంది. శక్తి యొక్క తగినంత పెద్ద భాగం అందించబడినప్పుడు, ఎలక్ట్రాన్ మరొక శక్తి స్థాయికి కదులుతుంది, అనగా, బయటి కక్ష్యలలో ఒకదానికి "జంప్" అవుతుంది. సూచించినట్లుగా, అటువంటి ఉత్తేజిత స్థితిలో అణువు అస్థిరంగా ఉంటుంది. కొంత సమయం తరువాత, ఎలక్ట్రాన్ తక్కువ స్థాయికి కదులుతుంది, అనగా, చిన్న వ్యాసార్థం యొక్క కక్ష్యకు "జంప్స్" అవుతుంది. ఎలక్ట్రాన్ సుదూర కక్ష్య నుండి సమీప కక్ష్యకు మారడం అనేది కాంతి క్వాంటం ఉద్గారంతో కూడి ఉంటుంది.
కాబట్టి, పరమాణువు యొక్క అణు నమూనా మరియు దాని శక్తి స్థాయిల యొక్క వివిక్తత నుండి, అణువులో ఎంచుకున్న, "అనుమతించబడిన" ఎలక్ట్రాన్ కక్ష్యల ఉనికిని అనుసరిస్తుంది. ఒక ఎలక్ట్రాన్ ఒక ఏకపక్ష వ్యాసార్థం యొక్క కక్ష్యలో ఒక కేంద్రకం చుట్టూ ఎందుకు తిరుగుతుంది అనే ప్రశ్న తలెత్తుతుంది. అనుమతించబడిన మరియు అనధికార కక్ష్యల మధ్య భౌతిక వ్యత్యాసం ఏమిటి?
పాఠ్యపుస్తకంలోని మునుపటి విభాగాల నుండి మనకు తెలిసిన మెకానిక్స్ మరియు విద్యుత్ చట్టాలు (వాల్యూమ్లు I, II చూడండి), ఈ ప్రశ్నలకు ఎటువంటి సమాధానం ఇవ్వవు. ఈ చట్టాల కోణం నుండి, అన్ని కక్ష్యలు పూర్తిగా సమానంగా ఉంటాయి. అంకితమైన కక్ష్యల ఉనికి ఈ చట్టాలకు విరుద్ధంగా ఉంది.
మనకు తెలిసిన భౌతిక శాస్త్ర నియమాలకు సమానంగా అద్భుతమైన వైరుధ్యం అణువు యొక్క స్థిరత్వం (భూమి స్థితిలో). త్వరణంతో కదిలే ఏదైనా ఛార్జ్ విద్యుదయస్కాంత తరంగాలను విడుదల చేస్తుందని మనకు తెలుసు. విద్యుదయస్కాంత వికిరణం శక్తిని తీసుకువెళుతుంది. ఒక అణువులో, ఒక ఎలక్ట్రాన్ చిన్న వ్యాసార్థం యొక్క కక్ష్యలో అధిక వేగంతో కదులుతుంది మరియు అందువల్ల, భారీ సెంట్రిపెటల్ త్వరణం ఉంటుంది. మనకు తెలిసిన చట్టాల ప్రకారం, ఎలక్ట్రాన్ విద్యుదయస్కాంత తరంగాల రూపంలో విడుదల చేయడం ద్వారా శక్తిని కోల్పోవాలి. కానీ, పైన చెప్పినట్లుగా, ఎలక్ట్రాన్ శక్తిని కోల్పోతే, దాని కక్ష్య యొక్క వ్యాసార్థం తగ్గుతుంది. పర్యవసానంగా, ఎలక్ట్రాన్ స్థిరమైన వ్యాసార్థం యొక్క కక్ష్యలో తిరగదు. రేడియేషన్ కారణంగా కక్ష్య యొక్క వ్యాసార్థంలో తగ్గుదల ఫలితంగా, ఎలక్ట్రాన్ సెకనులో వంద మిలియన్ల వంతులో కేంద్రకంపై పడవలసి ఉంటుందని లెక్కలు చూపిస్తున్నాయి. ఈ ముగింపు మా రోజువారీ అనుభవానికి తీవ్రంగా విరుద్ధంగా ఉంది, ఇది అణువుల స్థిరత్వాన్ని సూచిస్తుంది.
కాబట్టి, ప్రయోగం నుండి పొందిన అణువు యొక్క నిర్మాణంపై డేటా మధ్య వైరుధ్యం ఉంది మరియు మెకానిక్స్ మరియు విద్యుత్ యొక్క ప్రాథమిక చట్టాల మధ్య కూడా ప్రయోగాత్మకంగా కనుగొనబడింది.
కానీ పేర్కొన్న చట్టాలు చాలా పెద్ద సంఖ్యలో ఎలక్ట్రాన్లు మరియు పెద్ద సంఖ్యలో అణువులను కలిగి ఉన్న శరీరాలతో ప్రయోగాలలో కనుగొనబడ్డాయి మరియు పరీక్షించబడ్డాయి అని మనం మర్చిపోకూడదు. పరమాణువులోని వ్యక్తిగత ఎలక్ట్రాన్ కదలికకు ఈ చట్టాలు వర్తిస్తాయని నమ్మడానికి మాకు ఎటువంటి కారణం లేదు. అంతేకాకుండా, పరమాణువులోని ఎలక్ట్రాన్ యొక్క ప్రవర్తన మరియు శాస్త్రీయ భౌతిక శాస్త్ర నియమాల మధ్య వ్యత్యాసం పరమాణు దృగ్విషయాలకు ఈ చట్టాల యొక్క అసమర్థతను సూచిస్తుంది (§ 210 కూడా చూడండి).
పైన మేము పరమాణువు యొక్క ప్లానెటరీ మోడల్ అని పిలవబడే విషయాన్ని వివరించాము, అనగా. పరమాణు కేంద్రకం చుట్టూ అనుమతించబడిన కక్ష్యలలో ఎలక్ట్రాన్లు తిరిగే ఆలోచన. గ్రహ నమూనాను సమర్థించేటప్పుడు, మేము శాస్త్రీయ భౌతిక శాస్త్ర నియమాలను ఉపయోగించాము. కానీ, ఇప్పటికే గుర్తించినట్లుగా మరియు మేము § 210లో మరింత వివరంగా చూస్తాము, పరమాణువులోని ఎలక్ట్రాన్ యొక్క చలనం శాస్త్రీయ మెకానిక్స్ వర్తించని దృగ్విషయాల క్షేత్రానికి చెందినది. అందువల్ల, "మైక్రోవరల్డ్" యొక్క లోతైన అధ్యయనం గ్రహాల నమూనా యొక్క అసంపూర్ణత మరియు కఠినమైన ఉజ్జాయింపును చూపించడంలో ఆశ్చర్యం లేదు; పరమాణువు యొక్క వాస్తవ చిత్రం మరింత క్లిష్టంగా ఉంటుంది. అయినప్పటికీ, ఈ మోడల్ అణువు యొక్క అనేక ప్రాథమిక లక్షణాలను సరిగ్గా ప్రతిబింబిస్తుంది మరియు అందువల్ల, దాని ఉజ్జాయింపు ఉన్నప్పటికీ, ఇది కొన్నిసార్లు ఉపయోగించబడుతుంది.
ఎలక్ట్రాన్ కక్ష్య యొక్క వ్యాసార్థంలో హైడ్రోజన్ అణువు యొక్క శక్తి యొక్క ఆధారపడటాన్ని పరిశీలిద్దాం. ఛార్జీల కూలంబ్ ఆకర్షణ శక్తి (SI వ్యవస్థలో) ద్వారా సెంట్రిపెటల్ త్వరణం అందించబడే పరిస్థితి నుండి వ్యాసార్థం యొక్క కక్ష్యలో ఎలక్ట్రాన్ చలనం యొక్క గతి శక్తిని మేము నిర్ణయిస్తాము. ఈ శక్తి ద్వారా సృష్టించబడిన త్వరణాన్ని సెంట్రిపెటల్ త్వరణానికి సమం చేస్తూ, ఎలక్ట్రాన్ యొక్క గతిశక్తి కక్ష్య యొక్క వ్యాసార్థానికి విలోమానుపాతంలో ఉంటుందని మేము కనుగొన్నాము, అనగా. ![]() .
.
వ్యాసార్థం మరియు రెండు కక్ష్యలను ఎంచుకుందాం. రెండవ కక్ష్యలో ఎలక్ట్రాన్ భ్రమణం యొక్క గతిశక్తి మొదటిదాని కంటే ఎక్కువ మొత్తంలో ఉంటుంది  .
.
కక్ష్యలు ఒకదానికొకటి దూరంగా ఉండకపోతే, అప్పుడు . అందువల్ల, హారంలోని పరిమాణాన్ని విస్మరించవచ్చు మరియు గతి శక్తులలో వ్యత్యాసం దాదాపు సమానంగా ఉంటుంది.
ఎలక్ట్రాన్ యొక్క సంభావ్య శక్తి, దీనికి విరుద్ధంగా, మొదటి, సుదూర కక్ష్యలో ఎక్కువగా ఉంటుంది, ఎందుకంటే సిరీస్ నుండి ఎలక్ట్రాన్ను తొలగించడానికి, ఎలక్ట్రాన్ మరియు న్యూక్లియస్ మధ్య పనిచేసే విద్యుత్ ఆకర్షణ శక్తులకు వ్యతిరేకంగా పని చేయాలి; ఈ పని సంభావ్య శక్తిని పెంచే దిశగా సాగుతుంది.
ఎలక్ట్రాన్ను సమీప కక్ష్య నుండి రేడియల్ మార్గంలో దూరానికి బదిలీ చేయనివ్వండి. మార్గం పొడవు ఉంది ![]() . ఈ మార్గంలో విద్యుత్ శక్తి పరిమాణంలో స్థిరంగా ఉండదు. కానీ కక్ష్యలు ఒకదానికొకటి దగ్గరగా ఉన్నందున, పని యొక్క ఉజ్జాయింపు గణన కోసం న్యూక్లియస్ నుండి ఎలక్ట్రాన్ యొక్క సగటు దూరం వద్ద శక్తి యొక్క విలువను ఉపయోగించడం సాధ్యమవుతుంది.
. ఈ మార్గంలో విద్యుత్ శక్తి పరిమాణంలో స్థిరంగా ఉండదు. కానీ కక్ష్యలు ఒకదానికొకటి దగ్గరగా ఉన్నందున, పని యొక్క ఉజ్జాయింపు గణన కోసం న్యూక్లియస్ నుండి ఎలక్ట్రాన్ యొక్క సగటు దూరం వద్ద శక్తి యొక్క విలువను ఉపయోగించడం సాధ్యమవుతుంది. ![]() .
కూలంబ్ చట్టం ప్రకారం, శక్తి , మరియు మార్గంలో పని, సంభావ్య శక్తి పెరుగుదలకు సమానంగా ఉంటుంది.
.
కూలంబ్ చట్టం ప్రకారం, శక్తి , మరియు మార్గంలో పని, సంభావ్య శక్తి పెరుగుదలకు సమానంగా ఉంటుంది.
ఈ విధంగా, ఒక ఎలక్ట్రాన్ సుదూర కక్ష్య నుండి సమీప కక్ష్యకు కదులుతున్నప్పుడు, దాని సంభావ్య శక్తిలో తగ్గుదల గతి శక్తి పెరుగుదలకు రెండు రెట్లు సమానంగా ఉంటుంది. మేము సన్నిహిత కక్ష్యల కోసం ఈ సిద్ధాంతాన్ని నిరూపించాము, దీని మధ్య దూరం పరిస్థితిని సంతృప్తిపరుస్తుంది . సన్నిహిత కక్ష్యల వరుస జతల మధ్య పరివర్తన సమయంలో ఎలక్ట్రాన్ శక్తిలో మార్పులను సంగ్రహించడం ద్వారా, సిద్ధాంతం ఏకపక్షంగా సుదూర కక్ష్యలకు కూడా చెల్లుబాటు అవుతుందని మేము నమ్ముతున్నాము.
ఇప్పుడు మనం అనంతమైన సుదూర కక్ష్యను పరిశీలిద్దాం, అనగా. దానిపై ఎలక్ట్రాన్ యొక్క సంభావ్య శక్తిని సంభావ్య శక్తి యొక్క మూలంగా తీసుకుందాం, అనగా, సెట్ చేద్దాం ![]() . గతి శక్తి
. గతి శక్తి ![]() వద్ద సున్నాకి వెళుతుంది; ఒక కక్ష్య నుండి వ్యాసార్థం యొక్క చివరి కక్ష్యకు వెళ్లినప్పుడు, అది ఒక మొత్తం పెరుగుతుంది. సంభావ్య శక్తి రెండు రెట్లు తగ్గుతుంది, అనగా.
వద్ద సున్నాకి వెళుతుంది; ఒక కక్ష్య నుండి వ్యాసార్థం యొక్క చివరి కక్ష్యకు వెళ్లినప్పుడు, అది ఒక మొత్తం పెరుగుతుంది. సంభావ్య శక్తి రెండు రెట్లు తగ్గుతుంది, అనగా.
 .(206.1)
.(206.1)
కాబట్టి ఎలక్ట్రాన్ యొక్క మొత్తం శక్తి సమానంగా ఉంటుంది ![]() ; కక్ష్య వ్యాసార్థం చిన్నది, అది చిన్నది (మైనస్ గుర్తు!).
; కక్ష్య వ్యాసార్థం చిన్నది, అది చిన్నది (మైనస్ గుర్తు!).
13.7 బోర్ సిద్ధాంతం ప్రకారం హైడ్రోజన్ అణువు (హైడ్రోజన్ లాంటి అణువు).
13.7.3 ఎలక్ట్రాన్ పరమాణువులో పరిభ్రమిస్తుంది
ప్రకారం కక్ష్య పరిమాణీకరణ నియమం ( సోమర్ఫెల్డ్ సూత్రం) ఒక పరమాణువులోని ఎలక్ట్రాన్ యొక్క స్థిర స్థితుల శక్తి, దాని కక్ష్య యొక్క వ్యాసార్థం మరియు ఈ కక్ష్యలో వేగం సూత్రం ద్వారా ఇవ్వబడుతుంది
mvr = nℏ,
ఇక్కడ m అనేది ఎలక్ట్రాన్ ద్రవ్యరాశి, m = 9.11 ⋅ 10 −31 kg; v - ఎలక్ట్రాన్ వేగం; r అనేది ఎలక్ట్రాన్ కక్ష్య యొక్క వ్యాసార్థం; ℏ - తగ్గిన ప్లాంక్ స్థిరాంకం, ℏ = h /2π ≈ 1.055 ⋅ 10 −34 J ⋅ s; h అనేది ప్లాంక్ యొక్క స్థిరాంకం, h = 6.626 ⋅ 10 −34 J ⋅ s; n అనేది ప్రధాన క్వాంటం సంఖ్య.
కక్ష్యల పరిమాణీకరణ నియమం ప్రకారం, పరమాణువులోని ఎలక్ట్రాన్ యొక్క నిశ్చల స్థితులు అటువంటి ఎలక్ట్రాన్ కక్ష్యలకు మాత్రమే అనుగుణంగా ఉంటాయి.
mv n r n = n ℏ,
ఇక్కడ r n అనేది n సంఖ్యతో కక్ష్యలో ఉన్న ఎలక్ట్రాన్ యొక్క వ్యాసార్థం; v n - సంఖ్య n తో కక్ష్యలో ఎలక్ట్రాన్ వేగం; m అనేది ఎలక్ట్రాన్ ద్రవ్యరాశి, m = 9.11 ⋅ 10 −31 kg; ℏ - తగ్గిన ప్లాంక్ స్థిరాంకం, ℏ = h /2π ≈ 1.055 ⋅ 10 −34 J ⋅ s; h అనేది ప్లాంక్ యొక్క స్థిరాంకం, h = 6.626 ⋅ 10 −34 J ⋅ s; n అనేది ప్రధాన క్వాంటం సంఖ్య.
స్థిర ఎలక్ట్రాన్ కక్ష్య యొక్క వ్యాసార్థం
r n = ℏ 2 n 2 k Z e 2 m,
ఇక్కడ k = 1/4πε 0 ≈ 9 ⋅ 10 9 N ⋅ m 2 /Cl 2; ε 0 - విద్యుత్ స్థిరాంకం, ε 0 = 8.85 ⋅ 10 -12 F/m; Z - మూలకం యొక్క క్రమ సంఖ్య; e అనేది ఎలక్ట్రాన్ ఛార్జ్, e = -1.6 ⋅ 10 −19 C; m అనేది ఎలక్ట్రాన్ ద్రవ్యరాశి, m = 9.11 ⋅ 10 −31 kg; ℏ - తగ్గిన ప్లాంక్ స్థిరాంకం, ℏ = h /2π ≈ 1.055 ⋅ 10 −34 J ⋅ s; h అనేది ప్లాంక్ యొక్క స్థిరాంకం, h = 6.626 ⋅ 10 −34 J ⋅ s; n అనేది ప్రధాన క్వాంటం సంఖ్య.
మొదటి కక్ష్య వ్యాసార్థంహైడ్రోజన్ అణువులోని ఎలక్ట్రాన్ (Z = 1 మరియు n = 1) సమానం
r 1 = ℏ 2 k e 2 m = 0.53 ⋅ 10 - 10 m
మరియు అంటారు మొదటి బోర్ వ్యాసార్థం.
గణనలను సరళీకృతం చేయడానికి nవ కక్ష్య యొక్క వ్యాసార్థంహైడ్రోజన్ లాంటి అణువులో ఎలక్ట్రాన్, సూత్రాన్ని ఉపయోగించండి
r (Å) = 0.53 ⋅ n 2 Z,
ఇక్కడ r (Å) అనేది ఆంగ్స్ట్రోమ్స్లోని వ్యాసార్థం (1 Å = 1.0 ⋅ 10 −10 మీ); Z అనేది ఆవర్తన పట్టికలోని రసాయన మూలకం యొక్క క్రమ సంఖ్య D.I. మెండలీవ్; n = 1, 2, 3, … అనేది ప్రధాన క్వాంటం సంఖ్య.
స్థిర కక్ష్యలో ఎలక్ట్రాన్ వేగంహైడ్రోజన్ లాంటి అణువులో సూత్రం ద్వారా నిర్ణయించబడుతుంది
v n = k Z e 2 n ℏ,
ఇక్కడ k = 1/4πε 0 ≈ 9 ⋅ 10 9 N ⋅ m 2 /Cl 2; ε 0 - విద్యుత్ స్థిరాంకం, ε 0 = 8.85 ⋅ 10 -12 F/m; Z - మూలకం యొక్క క్రమ సంఖ్య; e అనేది ఎలక్ట్రాన్ ఛార్జ్, e = -1.6 ⋅ 10 −19 C; ℏ - తగ్గిన ప్లాంక్ స్థిరాంకం, ℏ = = h /2π ≈ 1.055 ⋅ 10 −34 J ⋅ s; h అనేది ప్లాంక్ యొక్క స్థిరాంకం, h = 6.626 ⋅ 10 −34 J ⋅ s; n అనేది ప్రధాన క్వాంటం సంఖ్య.
మొదటి కక్ష్యలో ఎలక్ట్రాన్ వేగంహైడ్రోజన్ అణువులో (Z = 1 మరియు n = 1) సమానం
v n = k e 2 ℏ = 2.2 ⋅ 10 6 m/s.
విలువ యొక్క గణనలను సరళీకృతం చేయడానికి nవ కక్ష్యలో ఎలక్ట్రాన్ వేగంహైడ్రోజన్ లాంటి అణువులో, సూత్రం ఉపయోగించబడుతుంది
v (m/s) = 2.2 ⋅ 10 6 ⋅ Z n ,
ఇక్కడ v (m/s) - m/sలో వేగం మాడ్యూల్; Z అనేది ఆవర్తన పట్టికలోని రసాయన మూలకం యొక్క క్రమ సంఖ్య D.I. మెండలీవ్; n = 1, 2, 3, … అనేది ప్రధాన క్వాంటం సంఖ్య.
ఉదాహరణ 21. హీలియం అణువులోని ఎలక్ట్రాన్ మొదటి కక్ష్య నుండి 9 రెట్లు పెద్ద వ్యాసార్థం ఉన్న కక్ష్యకు కదులుతుంది. అణువు ద్వారా శోషించబడిన శక్తిని కనుగొనండి.
పరిష్కారం . హీలియం అణువు ద్వారా శోషించబడిన శక్తి శక్తి వ్యత్యాసానికి సమానం:
∆E = E 2 - E 1 ,
ఇక్కడ E 1 అనేది కక్ష్య వ్యాసార్థం r 1కి సంబంధించిన ఎలక్ట్రాన్ శక్తి; E 2 అనేది కక్ష్య వ్యాసార్థం r 2కి సంబంధించిన ఎలక్ట్రాన్ శక్తి.
హీలియం అణువు (Z = 2)లోని ఎలక్ట్రాన్ శక్తులు క్రింది సూత్రాల ద్వారా నిర్ణయించబడతాయి:
- ప్రధాన క్వాంటం సంఖ్య n 1 = 1 ఉన్న స్థితిలో -
E 1 (eV) = - 13.6 Z 2 n 1 2 = - 54.4 eV;
- ప్రధాన క్వాంటం సంఖ్య n 2తో ఉన్న స్థితి -
E 2 (eV) = - 54.4 n 2 2 .
E 2 శక్తిని నిర్ణయించడానికి మేము సంబంధిత కక్ష్యల వ్యాసార్థం కోసం వ్యక్తీకరణను ఉపయోగిస్తాము:
- ప్రధాన క్వాంటం సంఖ్య n 1 = 1 ఉన్న కక్ష్య కోసం -
r 1 (Å) ≈ 0.53 n 1 2 Z = 0.265 Å;
- ప్రధాన క్వాంటం సంఖ్య n 2తో కక్ష్యలు -
r 2 (Å) ≈ 0.265 n 2 2.
వ్యాసార్థ నిష్పత్తి
r 2 (Å) r 1 (Å) = 0.265 n 2 2 0.265 = n 2 2
రెండవ స్థితి యొక్క ప్రధాన క్వాంటం సంఖ్యను నిర్ణయించడానికి మమ్మల్ని అనుమతిస్తుంది:
n 2 = r 2 (Å) r 1 (Å) = 9 = 3,
ఇక్కడ r 2 /r 1 అనేది షరతులో పేర్కొన్న కక్ష్య రేడియాల నిష్పత్తి, r 2 /r 1 = 9.
శక్తి నిష్పత్తి నుండి
E 2 E 1 = 1 n 2 2
ఇది రెండవ స్థితిలో హీలియం పరమాణువులోని ఎలక్ట్రాన్ యొక్క శక్తి
E 2 = E 1 n 2 2 = - 54.4 eV 3 2 = - 6.04 eV.
సూచించిన పరివర్తన సమయంలో అణువు ద్వారా గ్రహించిన శక్తి వ్యత్యాసం
∆E = E 2 - E 1 = -6.04 - (-54.4) = 48.4 eV.
పర్యవసానంగా, సూచించిన పరివర్తన సమయంలో, అణువు 48.4 eVకి సమానమైన శక్తిని గ్రహించింది.




