ಪಾಠ 5 ರಲ್ಲಿ " ರಾಸಾಯನಿಕ ಸೂತ್ರ"ಕೋರ್ಸಿನಿಂದ" ಡಮ್ಮೀಸ್ಗಾಗಿ ರಸಾಯನಶಾಸ್ತ್ರ"ನಾವು ರಾಸಾಯನಿಕ ಸೂತ್ರಗಳು ಮತ್ತು ಅವುಗಳ ಸೂಚ್ಯಂಕಗಳನ್ನು ವ್ಯಾಖ್ಯಾನಿಸುತ್ತೇವೆ ಮತ್ತು ಆಣ್ವಿಕ ಮತ್ತು ಅಣುರಹಿತ ರಚನೆಯ ವಸ್ತುಗಳ ರಾಸಾಯನಿಕ ಸೂತ್ರಗಳ ನಡುವಿನ ವ್ಯತ್ಯಾಸಗಳನ್ನು ಸಹ ಕಂಡುಹಿಡಿಯುತ್ತೇವೆ. "" ಕೊನೆಯ ಪಾಠದಲ್ಲಿ ನಾವು ರಾಸಾಯನಿಕ ಸಂಯುಕ್ತಗಳನ್ನು ವ್ಯಾಖ್ಯಾನಿಸಿದ್ದೇವೆ, ಸಾವಯವ ಮತ್ತು ಅಜೈವಿಕ ಸಂಯುಕ್ತಗಳ ನಡುವಿನ ವ್ಯತ್ಯಾಸಗಳನ್ನು ನೋಡಿದ್ದೇವೆ ಮತ್ತು ಗುಣಾತ್ಮಕ ಮತ್ತು ಪರಿಮಾಣಾತ್ಮಕ ಸಂಯೋಜನೆಯ ಅರ್ಥವನ್ನು ಸಹ ಕಂಡುಕೊಂಡಿದ್ದೇವೆ ಎಂದು ನಾನು ನಿಮಗೆ ನೆನಪಿಸುತ್ತೇನೆ.
ಯಾವುದೇ ವಸ್ತುವಿನ ಸಂಯೋಜನೆಯನ್ನು ವ್ಯಕ್ತಪಡಿಸಲಾಗುತ್ತದೆ ರಾಸಾಯನಿಕ ಸೂತ್ರ.
ರಾಸಾಯನಿಕ ಸೂತ್ರರಾಸಾಯನಿಕ ಚಿಹ್ನೆಗಳು ಮತ್ತು ಸೂಚ್ಯಂಕಗಳನ್ನು ಬಳಸಿಕೊಂಡು ವಸ್ತುವಿನ ಸಂಯೋಜನೆಯ ಸಾಂಪ್ರದಾಯಿಕ ಸಂಕೇತವಾಗಿದೆ.
ರಾಸಾಯನಿಕ ಅಂಶಗಳ ಚಿಹ್ನೆಗಳು (ಚಿಹ್ನೆಗಳು) ಮತ್ತು ಪರಿಮಾಣಾತ್ಮಕ ಸಂಯೋಜನೆಯನ್ನು ಬಳಸಿಕೊಂಡು ಗುಣಾತ್ಮಕ ಸಂಯೋಜನೆಯನ್ನು ತೋರಿಸಲಾಗಿದೆ - ಬಲಕ್ಕೆ ಮತ್ತು ರಾಸಾಯನಿಕ ಅಂಶಗಳ ಚಿಹ್ನೆಗಳ ಕೆಳಗೆ ಬರೆಯಲಾದ ಸೂಚ್ಯಂಕಗಳನ್ನು ಬಳಸಿ.
ಸೂಚ್ಯಂಕ- ವಸ್ತುವಿನ ಸೂತ್ರದಲ್ಲಿ ನಿರ್ದಿಷ್ಟ ರಾಸಾಯನಿಕ ಅಂಶದ ಪರಮಾಣುಗಳ ಸಂಖ್ಯೆ.
ಉದಾಹರಣೆಗೆ, ಹೈಡ್ರೋಜನ್ ಎಂಬ ಸರಳ ವಸ್ತುವಿನ ರಾಸಾಯನಿಕ ಸೂತ್ರವನ್ನು ಈ ಕೆಳಗಿನಂತೆ ಬರೆಯಲಾಗಿದೆ:
ಮತ್ತು "ಬೂದಿ-ಎರಡು" ಎಂದು ಓದುತ್ತದೆ.
ಆಣ್ವಿಕ ರಚನೆಯ ವಸ್ತುಗಳ ರಾಸಾಯನಿಕ ಸೂತ್ರಗಳು
ಡಯಾಟಮಿಕ್ ಅಣುಗಳ ಸೂತ್ರಗಳು: ಆಮ್ಲಜನಕ - O 2 ("o-ಎರಡು"), ಕ್ಲೋರಿನ್ - Cl 2 ("ಕ್ಲೋರಿನ್-ಎರಡು"), ಸಾರಜನಕ - N 2 ("ಎನ್-ಎರಡು"). ಟ್ರೈಟಾಮಿಕ್ ಓಝೋನ್ ಅಣು ಮತ್ತು ಎಂಟು ಪರಮಾಣು ಸಲ್ಫರ್ ಅಣುಗಳನ್ನು O 3 ("o-ಮೂರು") ಮತ್ತು S 8 ("es-8") ಸೂತ್ರಗಳಿಂದ ಗೊತ್ತುಪಡಿಸಲಾಗಿದೆ.
ಸಂಕೀರ್ಣ ಪದಾರ್ಥಗಳ ಅಣುಗಳ ಸೂತ್ರಗಳು ಅವುಗಳ ಗುಣಾತ್ಮಕ ಮತ್ತು ಪರಿಮಾಣಾತ್ಮಕ ಸಂಯೋಜನೆಯನ್ನು ಪ್ರತಿಬಿಂಬಿಸುತ್ತವೆ. ಉದಾಹರಣೆಗೆ, ನೀವು ಬಹುಶಃ ಈಗಾಗಲೇ ತಿಳಿದಿರುವಂತೆ ನೀರಿನ ಸೂತ್ರವು H 2 O ("ಬೂದಿ-ಎರಡು-o"), ಮೀಥೇನ್ CH 4 ("tse-ash-four"), ಮತ್ತು ಅಮೋನಿಯಾ NH 3 (" ಎನ್-ಬೂದಿ-ಮೂರು"). ಯಾವುದೇ ಸಂಕೀರ್ಣ ಪದಾರ್ಥಗಳ ಸೂತ್ರಗಳನ್ನು ಅದೇ ರೀತಿಯಲ್ಲಿ ಓದಲಾಗುತ್ತದೆ. ಉದಾಹರಣೆಗೆ, ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದ ಸೂತ್ರವು H 2 SO 4 ("ಬೂದಿ-ಎರಡು-es-o-ನಾಲ್ಕು"), ಮತ್ತು ಗ್ಲೂಕೋಸ್ C 6 H 12 O 6 ("tse-six-ash-twelve-o- ಆರು").
ಆಣ್ವಿಕ ರಚನೆಯ ವಸ್ತುಗಳ ರಾಸಾಯನಿಕ ಸೂತ್ರಗಳು (ಅವುಗಳನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಆಣ್ವಿಕ ಸೂತ್ರಗಳು) ಪ್ರಾಥಮಿಕ ಭಾಗಗಳ ಸಂಯೋಜನೆಯನ್ನು ತೋರಿಸಿ, ಅಂದರೆ, ಈ ಪದಾರ್ಥಗಳನ್ನು ಸಂಯೋಜಿಸಿರುವ ಸಾಂಪ್ರದಾಯಿಕ "ಇಟ್ಟಿಗೆಗಳು". ಅಂತಹ ಪ್ರಾಥಮಿಕ ಘಟಕಗಳು ( ಪ್ರಾಥಮಿಕ ರಚನಾತ್ಮಕ ಘಟಕಗಳು, ಅಥವಾ ಸರಳವಾಗಿ ರಚನಾತ್ಮಕ ಘಟಕಗಳು) ಈ ಸಂದರ್ಭದಲ್ಲಿ ಅಣುಗಳು.
ವಸ್ತುವು ಆಣ್ವಿಕವಲ್ಲದ ರಚನೆಯನ್ನು ಹೊಂದಿದ್ದರೆ ಏನು? ಈ ಪ್ರಕಾರದ ಸರಳ ಪದಾರ್ಥಗಳ ರಾಸಾಯನಿಕ ಸೂತ್ರಗಳನ್ನು (ಉದಾಹರಣೆಗೆ, ಲೋಹಗಳು) ಅನುಗುಣವಾದ ಅಂಶಗಳ ಚಿಹ್ನೆಗಳಿಂದ ಸಬ್ಸ್ಕ್ರಿಪ್ಟ್ಗಳಿಲ್ಲದೆ ಸರಳವಾಗಿ ಬರೆಯಲಾಗುತ್ತದೆ (ಅಥವಾ, ಹೆಚ್ಚು ಸರಿಯಾಗಿ, ಒಂದಕ್ಕೆ ಸಮಾನವಾದ ಸೂಚ್ಯಂಕದೊಂದಿಗೆ, ಅದನ್ನು ಬರೆಯಲಾಗಿಲ್ಲ). ಹೀಗಾಗಿ, ಕಬ್ಬಿಣದ ಸರಳ ವಸ್ತುವಿನ ಸೂತ್ರವು Fe ಆಗಿದೆ, ತಾಮ್ರವು Cu ಆಗಿದೆ, ಅಲ್ಯೂಮಿನಿಯಂ ಅಲ್ ಆಗಿದೆ.
ಆಣ್ವಿಕವಲ್ಲದ ರಚನೆಯ ಸಂಕೀರ್ಣ ಪದಾರ್ಥಗಳ ಸಂಯೋಜನೆಯನ್ನು ತೋರಿಸುವ ಸೂತ್ರಗಳನ್ನು ಬಳಸಿಕೊಂಡು ವ್ಯಕ್ತಪಡಿಸಲಾಗುತ್ತದೆ ಪರಮಾಣು ಸಂಖ್ಯೆಗಳ ಸರಳ ಅನುಪಾತಈ ವಸ್ತುಗಳಲ್ಲಿ ವಿವಿಧ ರಾಸಾಯನಿಕ ಅಂಶಗಳು. ಅಂತಹ ಸೂತ್ರಗಳನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಸರಳವಾದದ್ದು. ಉದಾಹರಣೆಗೆ, ಸ್ಫಟಿಕ ಶಿಲೆಗೆ ಸರಳವಾದ ಸೂತ್ರ - ನದಿ ಮರಳಿನ ಮುಖ್ಯ ಅಂಶ - SiO 2. ಸ್ಫಟಿಕ ಶಿಲೆಯ ಸ್ಫಟಿಕದಲ್ಲಿ ಸಿಲಿಕಾನ್ ಪರಮಾಣುವಿಗೆ ಎರಡು ಆಮ್ಲಜನಕ ಪರಮಾಣುಗಳಿವೆ ಎಂದು ತೋರಿಸುತ್ತದೆ, ಅಂದರೆ ಈ ವಸ್ತುವಿನಲ್ಲಿರುವ ಸಿಲಿಕಾನ್ ಮತ್ತು ಆಮ್ಲಜನಕ ಪರಮಾಣುಗಳ ಸಂಖ್ಯೆಗಳ ಸರಳ ಅನುಪಾತವು 1:2 ಆಗಿದೆ. ಅಲ್ 2 ಒ 3 ಸರಳ ಸೂತ್ರವು ಈ ಸಂಯುಕ್ತದಲ್ಲಿ ಅಲ್ಯೂಮಿನಿಯಂ ಮತ್ತು ಆಮ್ಲಜನಕ ಪರಮಾಣುಗಳ ಸಂಖ್ಯೆಗಳ ನಡುವಿನ ಸರಳ ಅನುಪಾತವು 2:3 ಎಂದು ತೋರಿಸುತ್ತದೆ.
ಪರಮಾಣುಗಳ ಗುಂಪನ್ನು ಅದರ ಸಂಯೋಜನೆಯು ಆಣ್ವಿಕವಲ್ಲದ ರಚನೆಯ ವಸ್ತುವಿನ ಸರಳ ಸೂತ್ರಕ್ಕೆ ಅನುರೂಪವಾಗಿದೆ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ ಸೂತ್ರ ಘಟಕ.
ಸೂತ್ರದ ಘಟಕ, ಟೇಬಲ್ ಉಪ್ಪು NaCl ("ಸೋಡಿಯಂ ಕ್ಲೋರಿನ್") ಒಂದು ಸೋಡಿಯಂ ಪರಮಾಣು ಮತ್ತು ಒಂದು ಕ್ಲೋರಿನ್ ಪರಮಾಣುವಿನ ಒಂದು ಗುಂಪು. ಸೀಮೆಸುಣ್ಣದ ಸೂತ್ರದ ಘಟಕ CaCO 3 ("ಕ್ಯಾಲ್ಸಿಯಂ-ಸಿಇ-ಒ-ಮೂರು") ಒಂದು ಕ್ಯಾಲ್ಸಿಯಂ ಪರಮಾಣು, ಒಂದು ಕಾರ್ಬನ್ ಪರಮಾಣು ಮತ್ತು ಮೂರು ಆಮ್ಲಜನಕ ಪರಮಾಣುಗಳ ಗುಂಪು.
ಆಣ್ವಿಕವಲ್ಲದ ರಚನೆಯ ಹೆಚ್ಚು ಸಂಕೀರ್ಣ ಸಂಯುಕ್ತಗಳ ಸೂತ್ರಗಳನ್ನು ಇದೇ ರೀತಿ ಓದಲಾಗುತ್ತದೆ. ಹೆಚ್ಚುವರಿಯಾಗಿ, ಆವರಣಗಳಲ್ಲಿ ಸುತ್ತುವರಿದ ಪರಮಾಣುಗಳ ಗುಂಪುಗಳ ಸಂಖ್ಯೆಯನ್ನು ಮಾತ್ರ ಸೂಚಿಸಲಾಗುತ್ತದೆ: ಅಲ್ 2 (SO 4) 3 ("ಅಲ್ಯೂಮಿನಿಯಂ-ಎರಡು-ಇಎಸ್-ಒ-ನಾಲ್ಕು-ಮೂರು ಬಾರಿ"), Mg(NO 3) 2 ("ಮೆಗ್ನೀಸಿಯಮ್-en -o-ಮೂರು -ಎರಡು ಬಾರಿ"), ಇತ್ಯಾದಿ.
ಹೀಗಾಗಿ, ವಸ್ತುಗಳ ರಚನಾತ್ಮಕ ಘಟಕಗಳು ಆಣ್ವಿಕ ರಚನೆಇವೆ ಅಣುಗಳು. ವಸ್ತುಗಳ ರಚನಾತ್ಮಕ ಘಟಕಗಳು ಆಣ್ವಿಕವಲ್ಲದ ರಚನೆಅವರದು ಸೂತ್ರ ಘಟಕಗಳು .
ಕೆಳಗಿನ ಕೋಷ್ಟಕವು ವಿವಿಧ ರೀತಿಯ ವಸ್ತುಗಳ ಸಂಯೋಜನೆಯ ಸೂತ್ರದ ಸಂಕೇತ ಮತ್ತು ಸ್ಕೀಮ್ಯಾಟಿಕ್ ಪ್ರಾತಿನಿಧ್ಯವನ್ನು ತೋರಿಸುತ್ತದೆ.
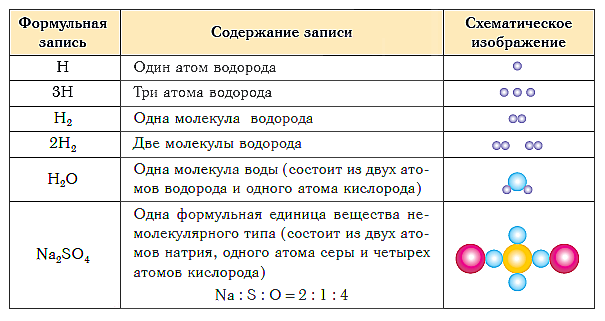
ಪಾಠದ ಸಂಕ್ಷಿಪ್ತ ತೀರ್ಮಾನಗಳು:
- ವಸ್ತುವಿನ ಗುಣಾತ್ಮಕ ಮತ್ತು ಪರಿಮಾಣಾತ್ಮಕ ಸಂಯೋಜನೆಯನ್ನು ರಾಸಾಯನಿಕ ಸೂತ್ರಗಳನ್ನು ಬಳಸಿಕೊಂಡು ವ್ಯಕ್ತಪಡಿಸಲಾಗುತ್ತದೆ.
- ಆಣ್ವಿಕ ರಚನೆಯೊಂದಿಗೆ ವಸ್ತುವಿನ ರಾಸಾಯನಿಕ ಸೂತ್ರವು ಅದರ ಅಣುವಿನ ಸಂಯೋಜನೆಯನ್ನು ತೋರಿಸುತ್ತದೆ, ಇದು ಈ ವಸ್ತುವಿನ ಪ್ರಾಥಮಿಕ ರಚನಾತ್ಮಕ ಘಟಕವಾಗಿದೆ.
- ಆಣ್ವಿಕವಲ್ಲದ ರಚನೆಯ ವಸ್ತುವಿನ ರಾಸಾಯನಿಕ ಸೂತ್ರವು ಅದರ ಸೂತ್ರ ಘಟಕದಲ್ಲಿ ಪರಮಾಣುಗಳ ಸರಳ ಅನುಪಾತವನ್ನು ತೋರಿಸುತ್ತದೆ.
ಹೋಪ್ ಪಾಠ 5" ರಾಸಾಯನಿಕ ಸೂತ್ರ"ಸ್ಪಷ್ಟ ಮತ್ತು ತಿಳಿವಳಿಕೆಯಾಗಿತ್ತು. ನೀವು ಯಾವುದೇ ಪ್ರಶ್ನೆಗಳನ್ನು ಹೊಂದಿದ್ದರೆ, ಅವುಗಳನ್ನು ಕಾಮೆಂಟ್ಗಳಲ್ಲಿ ಬರೆಯಿರಿ.
ಅಜೈವಿಕ ಪದಾರ್ಥಗಳ ವರ್ಗೀಕರಣ ಮತ್ತು ಅವುಗಳ ನಾಮಕರಣವು ಕಾಲಾನಂತರದಲ್ಲಿ ಸರಳ ಮತ್ತು ಸ್ಥಿರ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಆಧರಿಸಿದೆ - ರಾಸಾಯನಿಕ ಸಂಯೋಜನೆ, ಇದು ಅವುಗಳ ಸಂಖ್ಯಾತ್ಮಕ ಅನುಪಾತದಲ್ಲಿ ನಿರ್ದಿಷ್ಟ ವಸ್ತುವನ್ನು ರೂಪಿಸುವ ಅಂಶಗಳ ಪರಮಾಣುಗಳನ್ನು ತೋರಿಸುತ್ತದೆ. ಒಂದು ವಸ್ತುವು ಒಂದು ಪರಮಾಣುವಿನಿಂದ ಮಾಡಲ್ಪಟ್ಟಿದ್ದರೆ, ಅಂದರೆ. ಉಚಿತ ರೂಪದಲ್ಲಿ ಈ ಅಂಶದ ಅಸ್ತಿತ್ವದ ರೂಪವಾಗಿದೆ, ನಂತರ ಅದನ್ನು ಸರಳ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ ವಸ್ತು; ವಸ್ತುವು ಎರಡು ಅಥವಾ ಹೆಚ್ಚಿನ ಅಂಶಗಳ ಪರಮಾಣುಗಳಿಂದ ಮಾಡಲ್ಪಟ್ಟಿದ್ದರೆ, ಅದನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಸಂಕೀರ್ಣ ವಸ್ತು. ಎಲ್ಲಾ ಸರಳ ಪದಾರ್ಥಗಳು (ಮೊನಾಟೊಮಿಕ್ ಪದಗಳಿಗಿಂತ) ಮತ್ತು ಎಲ್ಲಾ ಸಂಕೀರ್ಣ ಪದಾರ್ಥಗಳನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಕರೆಯಲಾಗುತ್ತದೆ ರಾಸಾಯನಿಕ ಸಂಯುಕ್ತಗಳು, ಏಕೆಂದರೆ ಅವುಗಳಲ್ಲಿ ಒಂದು ಅಥವಾ ವಿಭಿನ್ನ ಅಂಶಗಳ ಪರಮಾಣುಗಳು ರಾಸಾಯನಿಕ ಬಂಧಗಳಿಂದ ಪರಸ್ಪರ ಸಂಪರ್ಕ ಹೊಂದಿವೆ.
ಅಜೈವಿಕ ಪದಾರ್ಥಗಳ ನಾಮಕರಣವು ಸೂತ್ರಗಳು ಮತ್ತು ಹೆಸರುಗಳನ್ನು ಒಳಗೊಂಡಿದೆ. ರಾಸಾಯನಿಕ ಸೂತ್ರ - ರಾಸಾಯನಿಕ ಅಂಶಗಳು, ಸಂಖ್ಯಾತ್ಮಕ ಸೂಚ್ಯಂಕಗಳು ಮತ್ತು ಕೆಲವು ಇತರ ಚಿಹ್ನೆಗಳ ಚಿಹ್ನೆಗಳನ್ನು ಬಳಸಿಕೊಂಡು ವಸ್ತುವಿನ ಸಂಯೋಜನೆಯ ಚಿತ್ರಣ. ರಾಸಾಯನಿಕ ಹೆಸರು - ಪದ ಅಥವಾ ಪದಗಳ ಗುಂಪನ್ನು ಬಳಸಿಕೊಂಡು ವಸ್ತುವಿನ ಸಂಯೋಜನೆಯ ಚಿತ್ರ. ರಾಸಾಯನಿಕ ಸೂತ್ರಗಳು ಮತ್ತು ಹೆಸರುಗಳ ನಿರ್ಮಾಣವನ್ನು ವ್ಯವಸ್ಥೆಯಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ ನಾಮಕರಣ ನಿಯಮಗಳು.
ರಾಸಾಯನಿಕ ಅಂಶಗಳ ಚಿಹ್ನೆಗಳು ಮತ್ತು ಹೆಸರುಗಳನ್ನು ಆವರ್ತಕ ಕೋಷ್ಟಕದಲ್ಲಿ D.I ಮೂಲಕ ನೀಡಲಾಗಿದೆ. ಮೆಂಡಲೀವ್. ಅಂಶಗಳನ್ನು ಸಾಂಪ್ರದಾಯಿಕವಾಗಿ ವಿಂಗಡಿಸಲಾಗಿದೆ ಲೋಹಗಳು ಮತ್ತು ಅಲೋಹಗಳು . ಲೋಹವಲ್ಲದವುಗಳು ಗುಂಪು VIIIA (ಉದಾತ್ತ ಅನಿಲಗಳು) ಮತ್ತು ಗುಂಪು VIIA (ಹ್ಯಾಲೊಜೆನ್ಗಳು), VIA ಗುಂಪಿನ ಅಂಶಗಳು (ಪೊಲೊನಿಯಮ್ ಹೊರತುಪಡಿಸಿ), ಸಾರಜನಕ, ರಂಜಕ, ಆರ್ಸೆನಿಕ್ (VA ಗುಂಪು) ಅಂಶಗಳನ್ನು ಒಳಗೊಂಡಿವೆ; ಕಾರ್ಬನ್, ಸಿಲಿಕಾನ್ (IVA ಗುಂಪು); ಬೋರಾನ್ (IIIA ಗುಂಪು), ಹಾಗೆಯೇ ಹೈಡ್ರೋಜನ್. ಉಳಿದ ಅಂಶಗಳನ್ನು ಲೋಹಗಳಾಗಿ ವರ್ಗೀಕರಿಸಲಾಗಿದೆ.
ಪದಾರ್ಥಗಳ ಹೆಸರುಗಳನ್ನು ಕಂಪೈಲ್ ಮಾಡುವಾಗ, ಅಂಶಗಳ ರಷ್ಯಾದ ಹೆಸರುಗಳನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ, ಉದಾಹರಣೆಗೆ, ಡೈಆಕ್ಸಿಜನ್, ಕ್ಸೆನಾನ್ ಡಿಫ್ಲೋರೈಡ್, ಪೊಟ್ಯಾಸಿಯಮ್ ಸೆಲೆನೇಟ್. ಸಾಂಪ್ರದಾಯಿಕವಾಗಿ, ಕೆಲವು ಅಂಶಗಳಿಗೆ, ಅವುಗಳ ಲ್ಯಾಟಿನ್ ಹೆಸರುಗಳ ಬೇರುಗಳನ್ನು ವ್ಯುತ್ಪನ್ನ ಪದಗಳಾಗಿ ಪರಿಚಯಿಸಲಾಗಿದೆ:
ಉದಾಹರಣೆಗೆ: ಕಾರ್ಬೋನೇಟ್, ಮ್ಯಾಂಗನೇಟ್, ಆಕ್ಸೈಡ್, ಸಲ್ಫೈಡ್, ಸಿಲಿಕೇಟ್.
ಶೀರ್ಷಿಕೆಗಳು ಸರಳ ಪದಾರ್ಥಗಳುಒಂದು ಪದವನ್ನು ಒಳಗೊಂಡಿರುತ್ತದೆ - ಸಂಖ್ಯಾತ್ಮಕ ಪೂರ್ವಪ್ರತ್ಯಯದೊಂದಿಗೆ ರಾಸಾಯನಿಕ ಅಂಶದ ಹೆಸರು, ಉದಾಹರಣೆಗೆ:
 ಕೆಳಗಿನವುಗಳನ್ನು ಬಳಸಲಾಗುತ್ತದೆ ಸಂಖ್ಯಾತ್ಮಕ ಪೂರ್ವಪ್ರತ್ಯಯಗಳು:
ಕೆಳಗಿನವುಗಳನ್ನು ಬಳಸಲಾಗುತ್ತದೆ ಸಂಖ್ಯಾತ್ಮಕ ಪೂರ್ವಪ್ರತ್ಯಯಗಳು:
 ಅನಿರ್ದಿಷ್ಟ ಸಂಖ್ಯೆಯನ್ನು ಸಂಖ್ಯಾ ಪೂರ್ವಪ್ರತ್ಯಯದಿಂದ ಸೂಚಿಸಲಾಗುತ್ತದೆ ಎನ್- ಪಾಲಿ.
ಅನಿರ್ದಿಷ್ಟ ಸಂಖ್ಯೆಯನ್ನು ಸಂಖ್ಯಾ ಪೂರ್ವಪ್ರತ್ಯಯದಿಂದ ಸೂಚಿಸಲಾಗುತ್ತದೆ ಎನ್- ಪಾಲಿ.
ಕೆಲವು ಸರಳ ಪದಾರ್ಥಗಳಿಗಾಗಿ ಅವರು ಬಳಸುತ್ತಾರೆ ವಿಶೇಷ O 3 - ಓಝೋನ್, P 4 - ಬಿಳಿ ರಂಜಕದಂತಹ ಹೆಸರುಗಳು.
ರಾಸಾಯನಿಕ ಸೂತ್ರಗಳು ಸಂಕೀರ್ಣ ಪದಾರ್ಥಗಳುಪದನಾಮದಿಂದ ಮಾಡಲ್ಪಟ್ಟಿದೆ ಎಲೆಕ್ಟ್ರೋಪಾಸಿಟಿವ್(ಷರತ್ತುಬದ್ಧ ಮತ್ತು ನೈಜ ಕ್ಯಾಟಯಾನುಗಳು) ಮತ್ತು ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್(ಷರತ್ತುಬದ್ಧ ಮತ್ತು ನೈಜ ಅಯಾನುಗಳು) ಘಟಕಗಳು, ಉದಾಹರಣೆಗೆ, CuSO 4 (ಇಲ್ಲಿ Cu 2+ ನಿಜವಾದ ಕ್ಯಾಷನ್ ಆಗಿದೆ, SO 4 2- ನಿಜವಾದ ಅಯಾನು) ಮತ್ತು PCl 3 (ಇಲ್ಲಿ P +III ಒಂದು ಷರತ್ತುಬದ್ಧ ಕ್ಯಾಷನ್ ಆಗಿದೆ, Cl -I ಒಂದು ಷರತ್ತುಬದ್ಧ ಅಯಾನ್).
ಶೀರ್ಷಿಕೆಗಳು ಸಂಕೀರ್ಣ ಪದಾರ್ಥಗಳುಬಲದಿಂದ ಎಡಕ್ಕೆ ರಾಸಾಯನಿಕ ಸೂತ್ರಗಳ ಪ್ರಕಾರ ಸಂಯೋಜಿಸಲಾಗಿದೆ. ಅವು ಎರಡು ಪದಗಳಿಂದ ಮಾಡಲ್ಪಟ್ಟಿದೆ - ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್ ಘಟಕಗಳ ಹೆಸರುಗಳು (ನಾಮಕರಣ ಪ್ರಕರಣದಲ್ಲಿ) ಮತ್ತು ಎಲೆಕ್ಟ್ರೋಪೊಸಿಟಿವ್ ಘಟಕಗಳು (ಜೆನಿಟಿವ್ ಸಂದರ್ಭದಲ್ಲಿ), ಉದಾಹರಣೆಗೆ:
CuSO 4 - ತಾಮ್ರ(II) ಸಲ್ಫೇಟ್
ಪಿಸಿಎಲ್ 3 - ಫಾಸ್ಫರಸ್ ಟ್ರೈಕ್ಲೋರೈಡ್
LaCl 3 - ಲ್ಯಾಂಥನಮ್ (III) ಕ್ಲೋರೈಡ್
CO - ಕಾರ್ಬನ್ ಮಾನಾಕ್ಸೈಡ್
ಹೆಸರುಗಳಲ್ಲಿನ ಎಲೆಕ್ಟ್ರೋಪಾಸಿಟಿವ್ ಮತ್ತು ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್ ಘಟಕಗಳ ಸಂಖ್ಯೆಯನ್ನು ಮೇಲೆ ನೀಡಲಾದ ಸಂಖ್ಯಾತ್ಮಕ ಪೂರ್ವಪ್ರತ್ಯಯಗಳಿಂದ (ಸಾರ್ವತ್ರಿಕ ವಿಧಾನ) ಅಥವಾ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಗಳಿಂದ (ಸೂತ್ರದಿಂದ ನಿರ್ಧರಿಸಬಹುದಾದರೆ) ರೋಮನ್ ಅಂಕಿಗಳನ್ನು ಆವರಣದಲ್ಲಿ (ಪ್ಲಸ್ ಚಿಹ್ನೆಯನ್ನು ಬಿಟ್ಟುಬಿಡಲಾಗಿದೆ) ಸೂಚಿಸಲಾಗುತ್ತದೆ. ಕೆಲವು ಸಂದರ್ಭಗಳಲ್ಲಿ, ಅಯಾನುಗಳ ಚಾರ್ಜ್ ಅನ್ನು ನೀಡಲಾಗುತ್ತದೆ (ಕ್ಯಾಟಯಾನ್ಸ್ ಮತ್ತು ಸಂಕೀರ್ಣ ಸಂಯೋಜನೆಯ ಅಯಾನುಗಳಿಗೆ), ಅನುಗುಣವಾದ ಚಿಹ್ನೆಯೊಂದಿಗೆ ಅರೇಬಿಕ್ ಅಂಕಿಗಳನ್ನು ಬಳಸಿ.
ಸಾಮಾನ್ಯ ಮಲ್ಟಿಲೆಮೆಂಟ್ ಕ್ಯಾಟಯಾನುಗಳು ಮತ್ತು ಅಯಾನುಗಳಿಗೆ ಕೆಳಗಿನ ವಿಶೇಷ ಹೆಸರುಗಳನ್ನು ಬಳಸಲಾಗುತ್ತದೆ:
ಕಡಿಮೆ ಸಂಖ್ಯೆಯ ಪ್ರಸಿದ್ಧ ವಸ್ತುಗಳಿಗೆ ಸಹ ಇದನ್ನು ಬಳಸಲಾಗುತ್ತದೆ ವಿಶೇಷಶೀರ್ಷಿಕೆಗಳು:
![]() 1. ಆಮ್ಲೀಯ ಮತ್ತು ಮೂಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು. ಲವಣಗಳು
1. ಆಮ್ಲೀಯ ಮತ್ತು ಮೂಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು. ಲವಣಗಳು
ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಕೆಲವು ಅಂಶ E (ಫ್ಲೋರಿನ್ ಮತ್ತು ಆಮ್ಲಜನಕವನ್ನು ಹೊರತುಪಡಿಸಿ) ಮತ್ತು ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪುಗಳು OH ನ ಪರಮಾಣುಗಳನ್ನು ಒಳಗೊಂಡಿರುವ ಒಂದು ರೀತಿಯ ಸಂಕೀರ್ಣ ಪದಾರ್ಥಗಳಾಗಿವೆ; ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಸಾಮಾನ್ಯ ಸೂತ್ರ E(OH) ಎನ್, ಎಲ್ಲಿ ಎನ್= 1÷6. ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ರೂಪ E(OH) ಎನ್ ಎಂದು ಕರೆದರು ಆರ್ಥೋ- ಆಕಾರ; ನಲ್ಲಿ ಎನ್> 2 ಹೈಡ್ರಾಕ್ಸೈಡ್ ಅನ್ನು ಸಹ ಕಾಣಬಹುದು ಮೆಟಾ-ಫಾರ್ಮ್, ಇದು E ಪರಮಾಣುಗಳು ಮತ್ತು OH ಗುಂಪುಗಳ ಜೊತೆಗೆ, ಆಮ್ಲಜನಕ ಪರಮಾಣುಗಳು O, ಉದಾಹರಣೆಗೆ E(OH) 3 ಮತ್ತು EO(OH), E(OH) 4 ಮತ್ತು E(OH) 6 ಮತ್ತು EO 2 (OH) 2 .
ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳನ್ನು ವಿರುದ್ಧ ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳೊಂದಿಗೆ ಎರಡು ಗುಂಪುಗಳಾಗಿ ವಿಂಗಡಿಸಲಾಗಿದೆ: ಆಮ್ಲೀಯ ಮತ್ತು ಮೂಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು.
^ ಆಮ್ಲೀಯ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ, ಇದನ್ನು ಸ್ಟೊಚಿಯೊಮೆಟ್ರಿಕ್ ವೇಲೆನ್ಸಿ ನಿಯಮಕ್ಕೆ ಒಳಪಟ್ಟಿರುವ ಲೋಹದ ಪರಮಾಣುಗಳಿಂದ ಬದಲಾಯಿಸಬಹುದು. ಹೆಚ್ಚಿನ ಆಮ್ಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಕಂಡುಬರುತ್ತವೆ ಮೆಟಾ-ರೂಪ, ಮತ್ತು ಆಮ್ಲೀಯ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಸೂತ್ರಗಳಲ್ಲಿ ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುಗಳಿಗೆ ಮೊದಲ ಸ್ಥಾನವನ್ನು ನೀಡಲಾಗುತ್ತದೆ, ಉದಾಹರಣೆಗೆ, H 2 SO 4, HNO 3 ಮತ್ತು H 2 CO 3, ಮತ್ತು SO 2 (OH) 2, NO 2 (OH) ಮತ್ತು CO ( OH) 2. ಆಮ್ಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಸಾಮಾನ್ಯ ಸೂತ್ರವು H ಆಗಿದೆ Xಇಒ ನಲ್ಲಿ, ಅಲ್ಲಿ ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್ ಕಾಂಪೊನೆಂಟ್ EO ನಲ್ಲಿ X-ಆಮ್ಲ ಶೇಷ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಎಲ್ಲಾ ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುಗಳನ್ನು ಲೋಹದಿಂದ ಬದಲಾಯಿಸದಿದ್ದರೆ, ಅವು ಆಮ್ಲದ ಶೇಷದ ಭಾಗವಾಗಿ ಉಳಿಯುತ್ತವೆ.
ಸಾಮಾನ್ಯ ಆಮ್ಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಹೆಸರುಗಳು ಎರಡು ಪದಗಳನ್ನು ಒಳಗೊಂಡಿರುತ್ತವೆ: "ಅಯಾ" ಎಂಬ ಅಂತ್ಯದೊಂದಿಗೆ ಸರಿಯಾದ ಹೆಸರು ಮತ್ತು "ಆಮ್ಲ" ಎಂಬ ಗುಂಪಿನ ಪದ. ಸಾಮಾನ್ಯ ಆಮ್ಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಅವುಗಳ ಆಮ್ಲೀಯ ಅವಶೇಷಗಳ ಸೂತ್ರಗಳು ಮತ್ತು ಸರಿಯಾದ ಹೆಸರುಗಳು ಇಲ್ಲಿವೆ (ಡ್ಯಾಶ್ ಎಂದರೆ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಮುಕ್ತ ರೂಪದಲ್ಲಿ ಅಥವಾ ಆಮ್ಲೀಯ ಜಲೀಯ ದ್ರಾವಣದಲ್ಲಿ ತಿಳಿದಿಲ್ಲ):
ಸಂಕೀರ್ಣ ಸಂಯುಕ್ತಗಳಿಗೆ ನಾಮಕರಣ ನಿಯಮಗಳ ಪ್ರಕಾರ ಕಡಿಮೆ ಸಾಮಾನ್ಯ ಆಮ್ಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳನ್ನು ಹೆಸರಿಸಲಾಗಿದೆ, ಉದಾಹರಣೆಗೆ:
 ಆಮ್ಲದ ಅವಶೇಷಗಳ ಹೆಸರುಗಳನ್ನು ಲವಣಗಳ ಹೆಸರನ್ನು ನಿರ್ಮಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ.
ಆಮ್ಲದ ಅವಶೇಷಗಳ ಹೆಸರುಗಳನ್ನು ಲವಣಗಳ ಹೆಸರನ್ನು ನಿರ್ಮಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ.
^ ಮೂಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಹೈಡ್ರಾಕ್ಸೈಡ್ ಅಯಾನುಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ, ಇದನ್ನು ಸ್ಟೊಚಿಯೊಮೆಟ್ರಿಕ್ ವೇಲೆನ್ಸಿ ನಿಯಮಕ್ಕೆ ಒಳಪಟ್ಟಿರುವ ಆಮ್ಲದ ಉಳಿಕೆಗಳಿಂದ ಬದಲಾಯಿಸಬಹುದು. ಎಲ್ಲಾ ಮೂಲಭೂತ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಕಂಡುಬರುತ್ತವೆ ಆರ್ಥೋ- ಆಕಾರ; ಅವರ ಸಾಮಾನ್ಯ ಸೂತ್ರವು M(OH) ಎನ್, ಎಲ್ಲಿ ಎನ್= 1.2 (ಕಡಿಮೆ ಬಾರಿ 3.4) ಮತ್ತು ಎಂ ಎನ್+ - ಲೋಹದ ಕ್ಯಾಷನ್. ಮೂಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಸೂತ್ರಗಳು ಮತ್ತು ಹೆಸರುಗಳ ಉದಾಹರಣೆಗಳು:
 ಮೂಲ ಮತ್ತು ಆಮ್ಲೀಯ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಪ್ರಮುಖ ರಾಸಾಯನಿಕ ಗುಣವೆಂದರೆ ಲವಣಗಳನ್ನು ರೂಪಿಸಲು ಪರಸ್ಪರ ಪರಸ್ಪರ ಕ್ರಿಯೆ ( ಉಪ್ಪು ರಚನೆಯ ಪ್ರತಿಕ್ರಿಯೆ), ಉದಾಹರಣೆಗೆ:
ಮೂಲ ಮತ್ತು ಆಮ್ಲೀಯ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಪ್ರಮುಖ ರಾಸಾಯನಿಕ ಗುಣವೆಂದರೆ ಲವಣಗಳನ್ನು ರೂಪಿಸಲು ಪರಸ್ಪರ ಪರಸ್ಪರ ಕ್ರಿಯೆ ( ಉಪ್ಪು ರಚನೆಯ ಪ್ರತಿಕ್ರಿಯೆ), ಉದಾಹರಣೆಗೆ:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O
Ca(OH) 2 + 2H 2 SO 4 = Ca (HSO 4) 2 + 2H 2 O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
ಲವಣಗಳು ಎಂ ಕ್ಯಾಟಯಾನುಗಳನ್ನು ಒಳಗೊಂಡಿರುವ ಒಂದು ರೀತಿಯ ಸಂಕೀರ್ಣ ಪದಾರ್ಥಗಳಾಗಿವೆ ಎನ್+ ಮತ್ತು ಆಮ್ಲೀಯ ಉಳಿಕೆಗಳು*.
ಸಾಮಾನ್ಯ ಸೂತ್ರದೊಂದಿಗೆ ಲವಣಗಳು ಎಂ X(ಇಒ ನಲ್ಲಿ) ಎನ್ಎಂದು ಕರೆದರು ಸರಾಸರಿ ಲವಣಗಳು, ಮತ್ತು ಬದಲಿಯಾಗದ ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುಗಳೊಂದಿಗೆ ಲವಣಗಳು - ಹುಳಿಲವಣಗಳು. ಕೆಲವೊಮ್ಮೆ ಲವಣಗಳು ಹೈಡ್ರಾಕ್ಸೈಡ್ ಮತ್ತು/ಅಥವಾ ಆಕ್ಸೈಡ್ ಅಯಾನುಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ; ಅಂತಹ ಲವಣಗಳನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಮುಖ್ಯಲವಣಗಳು. ಲವಣಗಳ ಉದಾಹರಣೆಗಳು ಮತ್ತು ಹೆಸರುಗಳು ಇಲ್ಲಿವೆ:
 ಆಮ್ಲ ಮತ್ತು ಮೂಲ ಲವಣಗಳನ್ನು ಸೂಕ್ತವಾದ ಮೂಲ ಮತ್ತು ಆಮ್ಲೀಯ ಹೈಡ್ರಾಕ್ಸೈಡ್ನೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯೆಯ ಮೂಲಕ ಮಧ್ಯಮ ಲವಣಗಳಾಗಿ ಪರಿವರ್ತಿಸಬಹುದು, ಉದಾಹರಣೆಗೆ:
ಆಮ್ಲ ಮತ್ತು ಮೂಲ ಲವಣಗಳನ್ನು ಸೂಕ್ತವಾದ ಮೂಲ ಮತ್ತು ಆಮ್ಲೀಯ ಹೈಡ್ರಾಕ್ಸೈಡ್ನೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯೆಯ ಮೂಲಕ ಮಧ್ಯಮ ಲವಣಗಳಾಗಿ ಪರಿವರ್ತಿಸಬಹುದು, ಉದಾಹರಣೆಗೆ:
Ca(HSO 4) 2 + Ca(OH) = CaSO 4 + 2H 2 O
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = Ca 2 SO 4 + 2H 2 O
ಎರಡು ವಿಭಿನ್ನ ಕ್ಯಾಟಯಾನುಗಳನ್ನು ಹೊಂದಿರುವ ಲವಣಗಳು ಸಹ ಇವೆ: ಅವುಗಳನ್ನು ಹೆಚ್ಚಾಗಿ ಕರೆಯಲಾಗುತ್ತದೆ ಡಬಲ್ ಲವಣಗಳು, ಉದಾಹರಣೆಗೆ:
 2. ಆಮ್ಲೀಯ ಮತ್ತು ಮೂಲ ಆಕ್ಸೈಡ್ಗಳು
2. ಆಮ್ಲೀಯ ಮತ್ತು ಮೂಲ ಆಕ್ಸೈಡ್ಗಳು
ಆಕ್ಸೈಡ್ ಇ Xಬಗ್ಗೆ ನಲ್ಲಿ- ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಸಂಪೂರ್ಣ ನಿರ್ಜಲೀಕರಣದ ಉತ್ಪನ್ನಗಳು:
 ಆಮ್ಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು (H 2 SO 4, H 2 CO 3) ಆಮ್ಲ ಆಕ್ಸೈಡ್ ಉತ್ತರ(SO 3, CO 2), ಮತ್ತು ಮೂಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು (NaOH, Ca(OH) 2) - ಮೂಲ ಆಕ್ಸೈಡ್ಗಳು(Na 2 O, CaO), ಮತ್ತು ಹೈಡ್ರಾಕ್ಸೈಡ್ನಿಂದ ಆಕ್ಸೈಡ್ಗೆ ಚಲಿಸುವಾಗ ಅಂಶ E ಯ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ ಬದಲಾಗುವುದಿಲ್ಲ. ಆಕ್ಸೈಡ್ಗಳ ಸೂತ್ರಗಳು ಮತ್ತು ಹೆಸರುಗಳ ಉದಾಹರಣೆ:
ಆಮ್ಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು (H 2 SO 4, H 2 CO 3) ಆಮ್ಲ ಆಕ್ಸೈಡ್ ಉತ್ತರ(SO 3, CO 2), ಮತ್ತು ಮೂಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು (NaOH, Ca(OH) 2) - ಮೂಲ ಆಕ್ಸೈಡ್ಗಳು(Na 2 O, CaO), ಮತ್ತು ಹೈಡ್ರಾಕ್ಸೈಡ್ನಿಂದ ಆಕ್ಸೈಡ್ಗೆ ಚಲಿಸುವಾಗ ಅಂಶ E ಯ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ ಬದಲಾಗುವುದಿಲ್ಲ. ಆಕ್ಸೈಡ್ಗಳ ಸೂತ್ರಗಳು ಮತ್ತು ಹೆಸರುಗಳ ಉದಾಹರಣೆ:
 ಆಮ್ಲೀಯ ಮತ್ತು ಮೂಲ ಆಕ್ಸೈಡ್ಗಳು ವಿರುದ್ಧ ಗುಣಲಕ್ಷಣಗಳ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳೊಂದಿಗೆ ಅಥವಾ ಪರಸ್ಪರ ಸಂವಹನ ಮಾಡುವಾಗ ಅನುಗುಣವಾದ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಉಪ್ಪು-ರೂಪಿಸುವ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಉಳಿಸಿಕೊಳ್ಳುತ್ತವೆ:
ಆಮ್ಲೀಯ ಮತ್ತು ಮೂಲ ಆಕ್ಸೈಡ್ಗಳು ವಿರುದ್ಧ ಗುಣಲಕ್ಷಣಗಳ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳೊಂದಿಗೆ ಅಥವಾ ಪರಸ್ಪರ ಸಂವಹನ ಮಾಡುವಾಗ ಅನುಗುಣವಾದ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಉಪ್ಪು-ರೂಪಿಸುವ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಉಳಿಸಿಕೊಳ್ಳುತ್ತವೆ:
N 2 O 5 + 2NaOH = 2NaNO 3 + H 2 O
3CaO + 2H 3 PO 4 = Ca 3 (PO 4) 2 + 3H 2 O
La 2 O 3 + 3SO 3 = La 2 (SO 4) 3
^ 3. ಆಂಫೋಟೆರಿಕ್ ಆಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು
ಆಂಫೋಟೆರಿಸಿಟಿಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಆಕ್ಸೈಡ್ಗಳು - ಅವುಗಳಿಂದ ಎರಡು ಸಾಲುಗಳ ಲವಣಗಳ ರಚನೆಯನ್ನು ಒಳಗೊಂಡಿರುವ ರಾಸಾಯನಿಕ ಆಸ್ತಿ, ಉದಾಹರಣೆಗೆ, ಅಲ್ಯೂಮಿನಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಮತ್ತು ಅಲ್ಯೂಮಿನಿಯಂ ಆಕ್ಸೈಡ್:
(a) 2Al(OH) 3 + 3SO 3 = Al 2 (SO 4) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2 O
(b) 2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
ಹೀಗಾಗಿ, ಅಲ್ಯೂಮಿನಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಮತ್ತು ಆಕ್ಸೈಡ್ ಪ್ರತಿಕ್ರಿಯೆಗಳಲ್ಲಿ (ಎ) ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತವೆ ಮುಖ್ಯಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಆಕ್ಸೈಡ್ಗಳು, ಅಂದರೆ. ಆಮ್ಲೀಯ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಆಕ್ಸೈಡ್ಗಳೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯಿಸಿ, ಅನುಗುಣವಾದ ಉಪ್ಪನ್ನು ರೂಪಿಸುತ್ತದೆ - ಅಲ್ಯೂಮಿನಿಯಂ ಸಲ್ಫೇಟ್ ಅಲ್ 2 (SO 4) 3, ಆದರೆ ಪ್ರತಿಕ್ರಿಯೆಗಳಲ್ಲಿ (ಬಿ) ಅವು ಗುಣಲಕ್ಷಣಗಳನ್ನು ಸಹ ಪ್ರದರ್ಶಿಸುತ್ತವೆ ಆಮ್ಲೀಯಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಆಕ್ಸೈಡ್ಗಳು, ಅಂದರೆ. ಮೂಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಮತ್ತು ಆಕ್ಸೈಡ್ನೊಂದಿಗೆ ಪ್ರತಿಕ್ರಿಯಿಸಿ, ಉಪ್ಪನ್ನು ರೂಪಿಸುತ್ತದೆ - ಸೋಡಿಯಂ ಡೈಆಕ್ಸೊಅಲುಮಿನೇಟ್ (III) NaAlO 2. ಮೊದಲ ಪ್ರಕರಣದಲ್ಲಿ, ಅಲ್ಯೂಮಿನಿಯಂ ಅಂಶವು ಲೋಹದ ಆಸ್ತಿಯನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತದೆ ಮತ್ತು ಎಲೆಕ್ಟ್ರೋಪೊಸಿಟಿವ್ ಘಟಕದ ಭಾಗವಾಗಿದೆ (ಅಲ್ 3+), ಎರಡನೆಯದು - ಲೋಹವಲ್ಲದ ಆಸ್ತಿ ಮತ್ತು ಉಪ್ಪು ಸೂತ್ರದ ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್ ಘಟಕದ ಭಾಗವಾಗಿದೆ ( AlO 2 -).
ಈ ಪ್ರತಿಕ್ರಿಯೆಗಳು ಜಲೀಯ ದ್ರಾವಣದಲ್ಲಿ ಸಂಭವಿಸಿದಲ್ಲಿ, ಪರಿಣಾಮವಾಗಿ ಲವಣಗಳ ಸಂಯೋಜನೆಯು ಬದಲಾಗುತ್ತದೆ, ಆದರೆ ಕ್ಯಾಷನ್ ಮತ್ತು ಅಯಾನುಗಳಲ್ಲಿ ಅಲ್ಯೂಮಿನಿಯಂನ ಉಪಸ್ಥಿತಿಯು ಉಳಿದಿದೆ:
2Al(OH) 3 + 3H 2 SO 4 = 2 (SO 4) 3
ಅಲ್(OH) 3 + NaOH = Na
ಇಲ್ಲಿ, ಸಂಕೀರ್ಣ ಅಯಾನುಗಳು 3+ - ಹೆಕ್ಸಾಕ್ವಾಲುಮಿನಿಯಮ್(III) ಕ್ಯಾಶನ್, - - ಟೆಟ್ರಾಹೈಡ್ರಾಕ್ಸೊಅಲುಮಿನೇಟ್(III) ಅಯಾನುಗಳನ್ನು ಚದರ ಬ್ರಾಕೆಟ್ಗಳಲ್ಲಿ ಹೈಲೈಟ್ ಮಾಡಲಾಗುತ್ತದೆ.
ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಲೋಹೀಯ ಮತ್ತು ಲೋಹವಲ್ಲದ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಪ್ರದರ್ಶಿಸುವ ಅಂಶಗಳನ್ನು ಆಂಫೋಟೆರಿಕ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ, ಇವುಗಳು ಆವರ್ತಕ ಕೋಷ್ಟಕದ ಎ-ಗುಂಪುಗಳ ಅಂಶಗಳನ್ನು ಒಳಗೊಂಡಿವೆ - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po, ಇತ್ಯಾದಿ. ಹಾಗೆಯೇ B- ಗುಂಪುಗಳ ಹೆಚ್ಚಿನ ಅಂಶಗಳು - Cr, Mn, Fe, Zn, Cd, Au, ಇತ್ಯಾದಿ. ಆಂಫೋಟೆರಿಕ್ ಆಕ್ಸೈಡ್ಗಳನ್ನು ಮೂಲ ಪದಗಳಂತೆಯೇ ಕರೆಯಲಾಗುತ್ತದೆ, ಉದಾಹರಣೆಗೆ:
 ಆಂಫೊಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳನ್ನು (ಧಾತುವಿನ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ + II ಮೀರಿದರೆ) ಕಾಣಬಹುದು ಆರ್ಥೋ- ಅಥವಾ (ಮತ್ತು) ಮೆಟಾ- ರೂಪ. ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಉದಾಹರಣೆಗಳು ಇಲ್ಲಿವೆ:
ಆಂಫೊಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳನ್ನು (ಧಾತುವಿನ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ + II ಮೀರಿದರೆ) ಕಾಣಬಹುದು ಆರ್ಥೋ- ಅಥವಾ (ಮತ್ತು) ಮೆಟಾ- ರೂಪ. ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಉದಾಹರಣೆಗಳು ಇಲ್ಲಿವೆ:
 ಆಂಫೋಟೆರಿಕ್ ಆಕ್ಸೈಡ್ಗಳು ಯಾವಾಗಲೂ ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳಿಗೆ ಹೊಂದಿಕೆಯಾಗುವುದಿಲ್ಲ, ಏಕೆಂದರೆ ಎರಡನೆಯದನ್ನು ಪಡೆಯಲು ಪ್ರಯತ್ನಿಸುವಾಗ, ಹೈಡ್ರೀಕರಿಸಿದ ಆಕ್ಸೈಡ್ಗಳು ರೂಪುಗೊಳ್ಳುತ್ತವೆ, ಉದಾಹರಣೆಗೆ:
ಆಂಫೋಟೆರಿಕ್ ಆಕ್ಸೈಡ್ಗಳು ಯಾವಾಗಲೂ ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳಿಗೆ ಹೊಂದಿಕೆಯಾಗುವುದಿಲ್ಲ, ಏಕೆಂದರೆ ಎರಡನೆಯದನ್ನು ಪಡೆಯಲು ಪ್ರಯತ್ನಿಸುವಾಗ, ಹೈಡ್ರೀಕರಿಸಿದ ಆಕ್ಸೈಡ್ಗಳು ರೂಪುಗೊಳ್ಳುತ್ತವೆ, ಉದಾಹರಣೆಗೆ:
 ಸಂಯುಕ್ತದಲ್ಲಿನ ಆಂಫೊಟೆರಿಕ್ ಅಂಶವು ಹಲವಾರು ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಗಳನ್ನು ಹೊಂದಿದ್ದರೆ, ಅನುಗುಣವಾದ ಆಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಆಂಫೋಟೆರಿಸಿಟಿ (ಮತ್ತು, ಪರಿಣಾಮವಾಗಿ, ಅಂಶದ ಆಂಫೋಟೆರಿಸಿಟಿಯು) ವಿಭಿನ್ನವಾಗಿ ವ್ಯಕ್ತವಾಗುತ್ತದೆ. ಕಡಿಮೆ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಗಳಿಗೆ, ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಆಕ್ಸೈಡ್ಗಳು ಮೂಲಭೂತ ಗುಣಲಕ್ಷಣಗಳ ಪ್ರಾಬಲ್ಯವನ್ನು ಹೊಂದಿವೆ, ಮತ್ತು ಅಂಶವು ಸ್ವತಃ ಲೋಹೀಯ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿದೆ, ಆದ್ದರಿಂದ ಇದು ಯಾವಾಗಲೂ ಕ್ಯಾಟಯಾನುಗಳ ಸಂಯೋಜನೆಯಲ್ಲಿ ಒಳಗೊಂಡಿರುತ್ತದೆ. ಹೆಚ್ಚಿನ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಗಳಿಗೆ, ಇದಕ್ಕೆ ವಿರುದ್ಧವಾಗಿ, ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಆಕ್ಸೈಡ್ಗಳು ಆಮ್ಲೀಯ ಗುಣಲಕ್ಷಣಗಳ ಪ್ರಾಬಲ್ಯವನ್ನು ಹೊಂದಿವೆ, ಮತ್ತು ಅಂಶವು ಲೋಹವಲ್ಲದ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿದೆ, ಆದ್ದರಿಂದ ಇದು ಯಾವಾಗಲೂ ಅಯಾನುಗಳ ಸಂಯೋಜನೆಯಲ್ಲಿ ಒಳಗೊಂಡಿರುತ್ತದೆ. ಹೀಗಾಗಿ, ಮ್ಯಾಂಗನೀಸ್ (II) ಆಕ್ಸೈಡ್ ಮತ್ತು ಹೈಡ್ರಾಕ್ಸೈಡ್ ಪ್ರಬಲವಾದ ಮೂಲ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿವೆ, ಮತ್ತು ಮ್ಯಾಂಗನೀಸ್ ಸ್ವತಃ 2+ ಪ್ರಕಾರದ ಕ್ಯಾಟಯಾನುಗಳ ಭಾಗವಾಗಿದೆ, ಆದರೆ ಮ್ಯಾಂಗನೀಸ್ (VII) ಆಕ್ಸೈಡ್ ಮತ್ತು ಹೈಡ್ರಾಕ್ಸೈಡ್ ಪ್ರಬಲ ಆಮ್ಲೀಯ ಗುಣಗಳನ್ನು ಹೊಂದಿವೆ, ಮತ್ತು ಮ್ಯಾಂಗನೀಸ್ ಸ್ವತಃ MnO 4 ನ ಭಾಗವಾಗಿದೆ - ಅಯಾನ್ ಟೈಪ್ ಮಾಡಿ.. ಆಮ್ಲೀಯ ಗುಣಲಕ್ಷಣಗಳ ಹೆಚ್ಚಿನ ಪ್ರಾಬಲ್ಯವನ್ನು ಹೊಂದಿರುವ ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳಿಗೆ ಆಮ್ಲೀಯ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಮಾದರಿಯಲ್ಲಿ ಸೂತ್ರಗಳು ಮತ್ತು ಹೆಸರುಗಳನ್ನು ನಿಗದಿಪಡಿಸಲಾಗಿದೆ, ಉದಾಹರಣೆಗೆ HMn VII O 4 - ಮ್ಯಾಂಗನೀಸ್ ಆಮ್ಲ.
ಸಂಯುಕ್ತದಲ್ಲಿನ ಆಂಫೊಟೆರಿಕ್ ಅಂಶವು ಹಲವಾರು ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಗಳನ್ನು ಹೊಂದಿದ್ದರೆ, ಅನುಗುಣವಾದ ಆಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಆಂಫೋಟೆರಿಸಿಟಿ (ಮತ್ತು, ಪರಿಣಾಮವಾಗಿ, ಅಂಶದ ಆಂಫೋಟೆರಿಸಿಟಿಯು) ವಿಭಿನ್ನವಾಗಿ ವ್ಯಕ್ತವಾಗುತ್ತದೆ. ಕಡಿಮೆ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಗಳಿಗೆ, ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಆಕ್ಸೈಡ್ಗಳು ಮೂಲಭೂತ ಗುಣಲಕ್ಷಣಗಳ ಪ್ರಾಬಲ್ಯವನ್ನು ಹೊಂದಿವೆ, ಮತ್ತು ಅಂಶವು ಸ್ವತಃ ಲೋಹೀಯ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿದೆ, ಆದ್ದರಿಂದ ಇದು ಯಾವಾಗಲೂ ಕ್ಯಾಟಯಾನುಗಳ ಸಂಯೋಜನೆಯಲ್ಲಿ ಒಳಗೊಂಡಿರುತ್ತದೆ. ಹೆಚ್ಚಿನ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಗಳಿಗೆ, ಇದಕ್ಕೆ ವಿರುದ್ಧವಾಗಿ, ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಆಕ್ಸೈಡ್ಗಳು ಆಮ್ಲೀಯ ಗುಣಲಕ್ಷಣಗಳ ಪ್ರಾಬಲ್ಯವನ್ನು ಹೊಂದಿವೆ, ಮತ್ತು ಅಂಶವು ಲೋಹವಲ್ಲದ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿದೆ, ಆದ್ದರಿಂದ ಇದು ಯಾವಾಗಲೂ ಅಯಾನುಗಳ ಸಂಯೋಜನೆಯಲ್ಲಿ ಒಳಗೊಂಡಿರುತ್ತದೆ. ಹೀಗಾಗಿ, ಮ್ಯಾಂಗನೀಸ್ (II) ಆಕ್ಸೈಡ್ ಮತ್ತು ಹೈಡ್ರಾಕ್ಸೈಡ್ ಪ್ರಬಲವಾದ ಮೂಲ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿವೆ, ಮತ್ತು ಮ್ಯಾಂಗನೀಸ್ ಸ್ವತಃ 2+ ಪ್ರಕಾರದ ಕ್ಯಾಟಯಾನುಗಳ ಭಾಗವಾಗಿದೆ, ಆದರೆ ಮ್ಯಾಂಗನೀಸ್ (VII) ಆಕ್ಸೈಡ್ ಮತ್ತು ಹೈಡ್ರಾಕ್ಸೈಡ್ ಪ್ರಬಲ ಆಮ್ಲೀಯ ಗುಣಗಳನ್ನು ಹೊಂದಿವೆ, ಮತ್ತು ಮ್ಯಾಂಗನೀಸ್ ಸ್ವತಃ MnO 4 ನ ಭಾಗವಾಗಿದೆ - ಅಯಾನ್ ಟೈಪ್ ಮಾಡಿ.. ಆಮ್ಲೀಯ ಗುಣಲಕ್ಷಣಗಳ ಹೆಚ್ಚಿನ ಪ್ರಾಬಲ್ಯವನ್ನು ಹೊಂದಿರುವ ಆಂಫೋಟೆರಿಕ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳಿಗೆ ಆಮ್ಲೀಯ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಮಾದರಿಯಲ್ಲಿ ಸೂತ್ರಗಳು ಮತ್ತು ಹೆಸರುಗಳನ್ನು ನಿಗದಿಪಡಿಸಲಾಗಿದೆ, ಉದಾಹರಣೆಗೆ HMn VII O 4 - ಮ್ಯಾಂಗನೀಸ್ ಆಮ್ಲ.
ಹೀಗಾಗಿ, ಲೋಹಗಳು ಮತ್ತು ಲೋಹವಲ್ಲದ ಅಂಶಗಳ ವಿಭಜನೆಯು ಷರತ್ತುಬದ್ಧವಾಗಿದೆ; ಸಂಪೂರ್ಣವಾಗಿ ಲೋಹೀಯ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿರುವ ಧಾತುಗಳ (Na, K, Ca, Ba, ಇತ್ಯಾದಿ) ಮತ್ತು ಸಂಪೂರ್ಣವಾಗಿ ಲೋಹವಲ್ಲದ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿರುವ ಅಂಶಗಳ (F, O, N, Cl, S, C, ಇತ್ಯಾದಿ) ನಡುವೆ, ಒಂದು ದೊಡ್ಡ ಗುಂಪು ಇರುತ್ತದೆ. ಆಂಫೋಟೆರಿಕ್ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿರುವ ಅಂಶಗಳ.
4. ಬೈನರಿ ಸಂಯುಕ್ತಗಳು
ವಿಶಾಲ ವಿಧದ ಅಜೈವಿಕ ಸಂಕೀರ್ಣ ವಸ್ತುಗಳು ಬೈನರಿ ಸಂಯುಕ್ತಗಳಾಗಿವೆ. ಇವುಗಳಲ್ಲಿ ಮೊದಲನೆಯದಾಗಿ, ಎಲ್ಲಾ ಎರಡು ಅಂಶಗಳ ಸಂಯುಕ್ತಗಳು (ಮೂಲಭೂತ, ಆಮ್ಲೀಯ ಮತ್ತು ಆಂಫೊಟೆರಿಕ್ ಆಕ್ಸೈಡ್ಗಳನ್ನು ಹೊರತುಪಡಿಸಿ), ಉದಾಹರಣೆಗೆ H 2 O, KBr, H 2 S, Cs 2 (S 2), N 2 O, NH 3, HN 3, CaC 2 , SiH 4 . ಈ ಸಂಯುಕ್ತಗಳ ಸೂತ್ರಗಳ ಎಲೆಕ್ಟ್ರೋಪೊಸಿಟಿವ್ ಮತ್ತು ಎಲೆಕ್ಟ್ರೋನೆಗೆಟಿವ್ ಘಟಕಗಳು ಪ್ರತ್ಯೇಕ ಪರಮಾಣುಗಳು ಅಥವಾ ಅದೇ ಅಂಶದ ಪರಮಾಣುಗಳ ಬಂಧಿತ ಗುಂಪುಗಳನ್ನು ಒಳಗೊಂಡಿರುತ್ತವೆ.
ಬಹುವಿಧದ ಪದಾರ್ಥಗಳು, ಒಂದು ಘಟಕವು ಹಲವಾರು ಅಂಶಗಳ ಸಂಬಂಧವಿಲ್ಲದ ಪರಮಾಣುಗಳನ್ನು ಒಳಗೊಂಡಿರುವ ಸೂತ್ರಗಳಲ್ಲಿ, ಹಾಗೆಯೇ ಪರಮಾಣುಗಳ ಏಕ-ಅಂಶ ಅಥವಾ ಬಹು-ಅಂಶ ಗುಂಪುಗಳನ್ನು (ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಲವಣಗಳನ್ನು ಹೊರತುಪಡಿಸಿ) ಬೈನರಿ ಸಂಯುಕ್ತಗಳಾಗಿ ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ, ಉದಾಹರಣೆಗೆ CSO, IO 2 F 3, SBrO 2 F, CrO (O2)2, PSI3, (CaTi)O3, (FeCu)S2, Hg(CN)2, (PF3)2O, VCl2 (NH2). ಹೀಗಾಗಿ, CSO ಅನ್ನು CS 2 ಸಂಯುಕ್ತವಾಗಿ ಪ್ರತಿನಿಧಿಸಬಹುದು, ಇದರಲ್ಲಿ ಒಂದು ಸಲ್ಫರ್ ಪರಮಾಣು ಆಮ್ಲಜನಕದ ಪರಮಾಣುವಿನಿಂದ ಬದಲಾಯಿಸಲ್ಪಡುತ್ತದೆ.
ಬೈನರಿ ಸಂಯುಕ್ತಗಳ ಹೆಸರುಗಳನ್ನು ಸಾಮಾನ್ಯ ನಾಮಕರಣ ನಿಯಮಗಳ ಪ್ರಕಾರ ನಿರ್ಮಿಸಲಾಗಿದೆ, ಉದಾಹರಣೆಗೆ:
 ಕೆಲವು ಬೈನರಿ ಸಂಯುಕ್ತಗಳಿಗೆ, ವಿಶೇಷ ಹೆಸರುಗಳನ್ನು ಬಳಸಲಾಗುತ್ತದೆ, ಅದರ ಪಟ್ಟಿಯನ್ನು ಮೊದಲೇ ನೀಡಲಾಗಿದೆ.
ಕೆಲವು ಬೈನರಿ ಸಂಯುಕ್ತಗಳಿಗೆ, ವಿಶೇಷ ಹೆಸರುಗಳನ್ನು ಬಳಸಲಾಗುತ್ತದೆ, ಅದರ ಪಟ್ಟಿಯನ್ನು ಮೊದಲೇ ನೀಡಲಾಗಿದೆ.
ಬೈನರಿ ಸಂಯುಕ್ತಗಳ ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳು ಸಾಕಷ್ಟು ವೈವಿಧ್ಯಮಯವಾಗಿವೆ, ಆದ್ದರಿಂದ ಅವುಗಳನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಅಯಾನುಗಳ ಹೆಸರಿನಿಂದ ಗುಂಪುಗಳಾಗಿ ವಿಂಗಡಿಸಲಾಗಿದೆ, ಅಂದರೆ. ಹಾಲೈಡ್ಗಳು, ಚಾಲ್ಕೊಜೆನೈಡ್ಗಳು, ನೈಟ್ರೈಡ್ಗಳು, ಕಾರ್ಬೈಡ್ಗಳು, ಹೈಡ್ರೈಡ್ಗಳು ಇತ್ಯಾದಿಗಳನ್ನು ಪ್ರತ್ಯೇಕವಾಗಿ ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ.ಬೈನರಿ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಇತರ ವಿಧದ ಅಜೈವಿಕ ವಸ್ತುಗಳ ಕೆಲವು ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿರುವವುಗಳೂ ಇವೆ. ಹೀಗಾಗಿ, ಸಂಯುಕ್ತಗಳು CO, NO, NO 2, ಮತ್ತು (Fe II Fe 2 III) O 4, ಇವುಗಳ ಹೆಸರುಗಳನ್ನು ಆಕ್ಸೈಡ್ ಪದವನ್ನು ಬಳಸಿ ನಿರ್ಮಿಸಲಾಗಿದೆ, ಆಕ್ಸೈಡ್ಗಳಾಗಿ ವರ್ಗೀಕರಿಸಲಾಗುವುದಿಲ್ಲ (ಆಮ್ಲ, ಮೂಲ, ಆಂಫೋಟೆರಿಕ್). ಕಾರ್ಬನ್ ಮಾನಾಕ್ಸೈಡ್ CO, ನೈಟ್ರೋಜನ್ ಮಾನಾಕ್ಸೈಡ್ NO ಮತ್ತು ನೈಟ್ರೋಜನ್ ಡೈಆಕ್ಸೈಡ್ NO 2 ಅನುಗುಣವಾದ ಆಮ್ಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳನ್ನು ಹೊಂದಿಲ್ಲ (ಆದಾಗ್ಯೂ ಈ ಆಕ್ಸೈಡ್ಗಳು ಲೋಹವಲ್ಲದ C ಮತ್ತು N ನಿಂದ ರಚನೆಯಾಗುತ್ತವೆ), ಅಥವಾ ಅವು ಲವಣಗಳನ್ನು ರೂಪಿಸುವುದಿಲ್ಲ, ಅದರ ಅಯಾನುಗಳು C II, N II ಮತ್ತು N ಪರಮಾಣುಗಳನ್ನು ಒಳಗೊಂಡಿರುತ್ತವೆ. IV. ಡಬಲ್ ಆಕ್ಸೈಡ್ (Fe II Fe 2 III) O 4 - ಡೈರಾನ್ (III)-ಐರನ್ (II) ಆಕ್ಸೈಡ್, ಇದು ಆಂಫೋಟೆರಿಕ್ ಅಂಶದ ಪರಮಾಣುಗಳನ್ನು ಹೊಂದಿದ್ದರೂ - ಎಲೆಕ್ಟ್ರೋಪಾಸಿಟಿವ್ ಘಟಕದಲ್ಲಿ ಕಬ್ಬಿಣ, ಆದರೆ ಎರಡು ವಿಭಿನ್ನ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಗಳಲ್ಲಿ, ಇದರ ಪರಿಣಾಮವಾಗಿ , ಆಮ್ಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳೊಂದಿಗೆ ಸಂವಹನ ಮಾಡುವಾಗ, ಅದು ಒಂದಲ್ಲ, ಆದರೆ ಎರಡು ವಿಭಿನ್ನ ಲವಣಗಳನ್ನು ರೂಪಿಸುತ್ತದೆ.
ಬೈನರಿ ಸಂಯುಕ್ತಗಳಾದ AgF, KBr, Na 2 S, Ba(HS) 2, NaCN, NH 4 Cl, ಮತ್ತು Pb(N 3) 2 ಲವಣಗಳಂತೆ ನೈಜ ಕ್ಯಾಟಯಾನುಗಳು ಮತ್ತು ಅಯಾನುಗಳಿಂದ ನಿರ್ಮಿಸಲಾಗಿದೆ, ಅದಕ್ಕಾಗಿಯೇ ಅವುಗಳನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಉಪ್ಪಿನಂತಹ ಬೈನರಿ ಸಂಯುಕ್ತಗಳು (ಅಥವಾ ಸರಳವಾಗಿ ಲವಣಗಳು). HF, HCl, HBr, H 2 S, HCN ಮತ್ತು HN 3 ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುಗಳ ಪರ್ಯಾಯದ ಉತ್ಪನ್ನಗಳಾಗಿ ಅವುಗಳನ್ನು ಪರಿಗಣಿಸಬಹುದು. ಜಲೀಯ ದ್ರಾವಣದಲ್ಲಿ ಎರಡನೆಯದು ಆಮ್ಲೀಯ ಕಾರ್ಯವನ್ನು ಹೊಂದಿರುತ್ತದೆ ಮತ್ತು ಆದ್ದರಿಂದ ಅವುಗಳ ಪರಿಹಾರಗಳನ್ನು ಆಮ್ಲಗಳು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ, ಉದಾಹರಣೆಗೆ HF (ಆಕ್ವಾ) - ಹೈಡ್ರೋಫ್ಲೋರಿಕ್ ಆಮ್ಲ, H 2 S (ಆಕ್ವಾ) - ಹೈಡ್ರೋಸಲ್ಫೈಡ್ ಆಮ್ಲ. ಆದಾಗ್ಯೂ, ಅವು ಆಮ್ಲ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳ ಪ್ರಕಾರಕ್ಕೆ ಸೇರಿರುವುದಿಲ್ಲ ಮತ್ತು ಅವುಗಳ ಉತ್ಪನ್ನಗಳು ಅಜೈವಿಕ ಪದಾರ್ಥಗಳ ವರ್ಗೀಕರಣದೊಳಗೆ ಲವಣಗಳಿಗೆ ಸೇರಿರುವುದಿಲ್ಲ.
ರಸಾಯನಶಾಸ್ತ್ರ ಪರೀಕ್ಷೆ
14. ಯಾವ ಪ್ರಮಾಣದ Cr(OH) 3 Mg(OH) 2 ರ 174.96 ಗ್ರಾಂ ನಂತೆ ಸಮಾನ ಸಂಖ್ಯೆಯ ಸಮಾನತೆಯನ್ನು ಹೊಂದಿದೆ?
ಮೆಗ್ನೀಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ನ ಮೋಲಾರ್ ದ್ರವ್ಯರಾಶಿಯು 58.32 g/mol ಆಗಿದೆ, ಮತ್ತು ಸಮಾನ ದ್ರವ್ಯರಾಶಿಯು 29.16 g/mol ಆಗಿದೆ. ಆದ್ದರಿಂದ, 174.96 ಗ್ರಾಂನ ಮೆಗ್ನೀಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ ದ್ರವ್ಯರಾಶಿಯು 174.96 ಗ್ರಾಂ ಅನ್ನು ಹೊಂದಿರುತ್ತದೆ: 29.16 g/mol = 6 mol-equiv.
ಕ್ರೋಮಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ (III) ಗೆ ಸಮಾನವಾದ ಮೋಲಾರ್ ದ್ರವ್ಯರಾಶಿಯು 1/3 M Cr(OH)3 ಅಥವಾ 34.34 g/mol ಆಗಿದೆ, ಮತ್ತು ಈ ವಸ್ತುವಿನ 6 mol-equiv 34.33 g/mol x 6 mol = 205.98 g ಆಗಿರುತ್ತದೆ.
ಹೀಗಾಗಿ, 205.98 ಗ್ರಾಂ Cr(OH)3 174.96 ಗ್ರಾಂ Mg(OH)2 ಗೆ ಸಮಾನವಾದ ಸಂಖ್ಯೆಯನ್ನು ಹೊಂದಿರುತ್ತದೆ.
34. ಆಯಸ್ಕಾಂತೀಯ ಕ್ವಾಂಟಮ್ ಸಂಖ್ಯೆ m l ಕಕ್ಷೀಯ ಕ್ವಾಂಟಮ್ ಸಂಖ್ಯೆ l=0,1,2,3 ನೊಂದಿಗೆ ಎಷ್ಟು ಮತ್ತು ಯಾವ ಮೌಲ್ಯಗಳನ್ನು ತೆಗೆದುಕೊಳ್ಳಬಹುದು? ಆವರ್ತಕ ಕೋಷ್ಟಕದಲ್ಲಿನ ಯಾವ ಅಂಶಗಳನ್ನು s-, p-, d-, f- ಅಂಶಗಳು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ? ಉದಾಹರಣೆಗಳನ್ನು ನೀಡಿ
ಮ್ಯಾಗ್ನೆಟಿಕ್ ಕ್ವಾಂಟಮ್ ಸಂಖ್ಯೆಯ ಮೌಲ್ಯಗಳ ಸಂಖ್ಯೆಯು ಕಕ್ಷೀಯ ಕ್ವಾಂಟಮ್ ಸಂಖ್ಯೆಯನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ ಮತ್ತು ಸಮಾನವಾಗಿರುತ್ತದೆ
(21 + 1), ಇಲ್ಲಿ 1 ಕಕ್ಷೀಯ ಕ್ವಾಂಟಮ್ ಸಂಖ್ಯೆ. ಆದ್ದರಿಂದ, ಯಾವಾಗ l=0m ಎಲ್ =0,
ನಲ್ಲಿ l=1ಮೀ ಎಲ್ಮೌಲ್ಯಗಳನ್ನು ತೆಗೆದುಕೊಳ್ಳುತ್ತದೆ -1.0, +1;
ನಲ್ಲಿ 1=2ಮೀ ಎಲ್-2,-1, 0,+1,+2 ಮೌಲ್ಯಗಳನ್ನು ತೆಗೆದುಕೊಳ್ಳುತ್ತದೆ;
ನಲ್ಲಿ =3ಮೀ ಎಲ್-3,-2,-1, 0, +1,+2,+3 ಮೌಲ್ಯಗಳನ್ನು ತೆಗೆದುಕೊಳ್ಳಬಹುದು.
s-, p-, d-, f- ಆರ್ಬಿಟಲ್ಗಳು ಅನುಕ್ರಮವಾಗಿ ಎಲೆಕ್ಟ್ರಾನ್ಗಳಿಂದ ತುಂಬಿರುವ ಪರಮಾಣುಗಳಲ್ಲಿನ ರಾಸಾಯನಿಕ ಅಂಶಗಳನ್ನು s-, p-, d-, f- ಅಂಶಗಳು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.
ಉದಾಹರಣೆಗೆ, s-ಅಂಶಗಳು H, He, ಹಾಗೆಯೇ ಕ್ಷಾರ ಮತ್ತು ಕ್ಷಾರೀಯ ಭೂಮಿಯ ಲೋಹಗಳನ್ನು ಒಳಗೊಂಡಿರುತ್ತವೆ (1A ಮತ್ತು 11A ಗುಂಪುಗಳ ಲೋಹಗಳು - Na, K, Rb, Be. Ca, Mg, Sg, ಇತ್ಯಾದಿ.)
ಪಿ-ಅಂಶಗಳು, ಉದಾಹರಣೆಗೆ, ಅಂಶಗಳ ಆವರ್ತಕ ವ್ಯವಸ್ಥೆಯಲ್ಲಿ ಅವಧಿಗಳನ್ನು ಪೂರ್ಣಗೊಳಿಸುವ ಅಂಶಗಳು (ಮೊದಲ ಅವಧಿಯನ್ನು ಹೊರತುಪಡಿಸಿ) - B, C, N, Ne, J, Cl, Br, P, S, F, As, Se, Ar, Rn, Te ಮತ್ತು ಇತ್ಯಾದಿ.
ಡಿ-ಅಂಶಗಳು ಎಸ್-ಎಲಿಮೆಂಟ್ಸ್ ಮತ್ತು ಪಿ-ಎಲಿಮೆಂಟ್ಗಳ ನಡುವೆ ದೊಡ್ಡ ಅವಧಿಗಳಲ್ಲಿ ಇರುವ ಅಂಶಗಳನ್ನು ಒಳಗೊಂಡಿವೆ, ಉದಾಹರಣೆಗೆ, Fe, Mn, Cr, Ti, Mo, Pt, Co, Ru, Rh, ಇತ್ಯಾದಿ.
ಎಫ್-ಅಂಶಗಳು ಲ್ಯಾಂಥನೈಡ್ಗಳನ್ನು ಒಳಗೊಂಡಿವೆ, ಉದಾಹರಣೆಗೆ, Ce, Nd, Pm, Sm, Eu, Gd, ಮತ್ತು ಆಕ್ಟಿನೈಡ್ಗಳು, ಉದಾಹರಣೆಗೆ, Th, U, Np, Pu, Am, ಇತ್ಯಾದಿ.
54. ಹೈಡ್ರೋಜನ್, ಫ್ಲೋರಿನ್, ಸಲ್ಫರ್ ಮತ್ತು ಸಾರಜನಕದ ಅತ್ಯಂತ ಕಡಿಮೆ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ ಯಾವುದು? ಏಕೆ? ಈ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಯಲ್ಲಿ ಈ ಅಂಶಗಳೊಂದಿಗೆ ಕ್ಯಾಲ್ಸಿಯಂ ಸಂಯುಕ್ತಗಳಿಗೆ ಸೂತ್ರಗಳನ್ನು ರೂಪಿಸಿ. ಅನುಗುಣವಾದ ಸಂಯುಕ್ತಗಳ ಹೆಸರುಗಳು ಯಾವುವು?
ಹೈಡ್ರೋಜನ್ ಪರಮಾಣು ಒಂದೇ ವೇಲೆನ್ಸಿ ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಹೊಂದಿದೆ. ಆದ್ದರಿಂದ, ಹೈಡ್ರೋಜನ್ನ ಕಡಿಮೆ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ -1 ಆಗಿರುತ್ತದೆ (ಹೈಡ್ರೋಜನ್ ಪರಮಾಣು ಮತ್ತೊಂದು ಅಂಶದಿಂದ 1 ಎಲೆಕ್ಟ್ರಾನ್ ಅನ್ನು ಸ್ವೀಕರಿಸುತ್ತದೆ). ಹೈಡ್ರೋಜನ್ ಈ ಕಡಿಮೆ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಯನ್ನು +2 -1 ಸಂಯುಕ್ತ CaH2 ನಲ್ಲಿ ಪ್ರದರ್ಶಿಸುತ್ತದೆ. ಈ ಸಂಯುಕ್ತವನ್ನು ಕ್ಯಾಲ್ಸಿಯಂ ಹೈಡ್ರೈಡ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.
ಫ್ಲೋರಿನ್ ಪರಮಾಣು ಏಳು ವೇಲೆನ್ಸ್ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಹೊಂದಿದೆ, ಶಕ್ತಿಯ ಮಟ್ಟವನ್ನು ಪೂರ್ಣಗೊಳಿಸಲು ಒಂದು ಎಲೆಕ್ಟ್ರಾನ್ ಕಾಣೆಯಾಗಿದೆ. ಆದ್ದರಿಂದ, ಫ್ಲೋರಿನ್ನ ಕಡಿಮೆ (ಮತ್ತು ಏಕೈಕ) ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ -1 ಆಗಿದೆ. ಈ +2 -1 ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಯಲ್ಲಿರುವ ಫ್ಲೋರಿನ್ ಸಂಯುಕ್ತಗಳನ್ನು ಫ್ಲೋರೈಡ್ಗಳು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಉದಾಹರಣೆಗೆ, CaF 2 ಕ್ಯಾಲ್ಸಿಯಂ ಫ್ಲೋರೈಡ್ ಆಗಿದೆ.
ಸಲ್ಫರ್ ಪರಮಾಣು ಆರು ವೇಲೆನ್ಸ್ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಹೊಂದಿದೆ, ಶಕ್ತಿಯ ಮಟ್ಟವನ್ನು ಪೂರ್ಣಗೊಳಿಸಲು ಎರಡು ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಕಾಣೆಯಾಗಿವೆ. ಆದ್ದರಿಂದ, ಗಂಧಕದ ಕಡಿಮೆ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ -2 ಆಗಿದೆ. ಈ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಯಲ್ಲಿ +2 -2 ಸಲ್ಫರ್ ಸಂಯುಕ್ತಗಳನ್ನು ಸಲ್ಫೈಡ್ಸ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಉದಾಹರಣೆಗೆ, CaS ಕ್ಯಾಲ್ಸಿಯಂ ಸಲ್ಫೈಡ್ ಆಗಿದೆ.
ನೈಟ್ರೋಜನ್ ಪರಮಾಣು ಐದು ವೇಲೆನ್ಸ್ ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಹೊಂದಿದೆ; ಶಕ್ತಿಯ ನಷ್ಟವು ಪೂರ್ಣಗೊಳ್ಳುವ ಮೊದಲು ಮೂರು ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಕಾಣೆಯಾಗಿವೆ. ಆದ್ದರಿಂದ, ಸಾರಜನಕದ ಕಡಿಮೆ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ -3 ಆಗಿದೆ. ಈ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಯಲ್ಲಿ +2 -3 ನೈಟ್ರೋಜನ್ ಸಂಯುಕ್ತಗಳನ್ನು ನೈಟ್ರೈಡ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. Ca 3 N 2 ಕ್ಯಾಲ್ಸಿಯಂ ನೈಟ್ರೈಡ್ ಆಗಿದೆ.
74. ಪರಮಾಣುವಿನ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಯಿಂದ ಏನು ಅರ್ಥಮಾಡಿಕೊಳ್ಳಬೇಕು? ಇಂಗಾಲದ ಪರಮಾಣುವಿನ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಯನ್ನು ಮತ್ತು ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಅದರ ವೇಲೆನ್ಸಿಯನ್ನು ನಿರ್ಧರಿಸಿ: CH 4 ; CH 3 OH; UNSC; CO 2
ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಯು ಸಂಯುಕ್ತದಲ್ಲಿನ ಪರಮಾಣುವಿನ ಷರತ್ತುಬದ್ಧ ಚಾರ್ಜ್ ಆಗಿದೆ, ಇದು ಅಯಾನುಗಳನ್ನು ಮಾತ್ರ ಒಳಗೊಂಡಿರುತ್ತದೆ ಎಂಬ ಊಹೆಯಿಂದ ಲೆಕ್ಕಹಾಕಲಾಗುತ್ತದೆ. ಆಕ್ಸಿಡೀಕರಣ ಸಂಖ್ಯೆಯು ಋಣಾತ್ಮಕ, ಧನಾತ್ಮಕ ಅಥವಾ ಶೂನ್ಯವಾಗಿರಬಹುದು ಮತ್ತು ಸಂಪೂರ್ಣ ಅಥವಾ ಭಾಗಶಃ ಸಂಖ್ಯೆಯಾಗಿರಬಹುದು. ಸಂಯುಕ್ತದಲ್ಲಿನ ಪರಮಾಣುಗಳ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಗಳ ಬೀಜಗಣಿತದ ಮೊತ್ತವು ಯಾವಾಗಲೂ ಶೂನ್ಯಕ್ಕೆ ಸಮನಾಗಿರುತ್ತದೆ ಮತ್ತು ಸಂಕೀರ್ಣ ಅಯಾನುಗಳಲ್ಲಿ ಇದು ಅಯಾನಿನ ಚಾರ್ಜ್ಗೆ ಸಮಾನವಾಗಿರುತ್ತದೆ.
ಕೊಟ್ಟಿರುವ ಇಂಗಾಲದ ಸಂಯುಕ್ತಗಳಲ್ಲಿ, ಇಂಗಾಲದ ಪರಮಾಣು ಟೆಟ್ರಾವೇಲೆಂಟ್ ಆಗಿದೆ. ಆದರೆ ಈ ಸಂಯುಕ್ತಗಳಲ್ಲಿನ ಇಂಗಾಲದ ಪರಮಾಣುವಿನ ಆಕ್ಸಿಡೀಕರಣದ ಮಟ್ಟವು ವಿಭಿನ್ನವಾಗಿದೆ.
ಮೀಥೇನ್ನಲ್ಲಿ - CH 4 - ಇಂಗಾಲದ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ 4 ಆಗಿದೆ.
ಮೆಥನಾಲ್ನಲ್ಲಿ - CH3OH - ಕಾರ್ಬನ್ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ - 2; ಫಾರ್ಮಿಕ್ ಆಮ್ಲದಲ್ಲಿ HCOOH - ಇಂಗಾಲದ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ +2; ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ನಲ್ಲಿ - CO 2 - ಇಂಗಾಲದ ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿ +4.
94. 11.5 ಗ್ರಾಂ ದ್ರವ ಈಥೈಲ್ ಆಲ್ಕೋಹಾಲ್ನ ದಹನವು 308.71 kJ ಶಾಖವನ್ನು ಬಿಡುಗಡೆ ಮಾಡಿತು. ನೀರಿನ ಆವಿ ಮತ್ತು ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ರಚನೆಗೆ ಕಾರಣವಾಗುವ ಪ್ರತಿಕ್ರಿಯೆಗೆ ಥರ್ಮೋಕೆಮಿಕಲ್ ಸಮೀಕರಣವನ್ನು ಬರೆಯಿರಿ. C 2 H 5 OH (l) ರಚನೆಯ ಶಾಖವನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡಿ. ಉತ್ತರ: -277.67 ಕೆಜೆ
C 2 H 5 OH (l) + 3 O 2 (g) = 2 CO 2 (g) + 3 H 2 O (p)
1 ಮೋಲ್ ದ್ರವ ಈಥೈಲ್ ಆಲ್ಕೋಹಾಲ್ 46 ಗ್ರಾಂ ದ್ರವ್ಯರಾಶಿಯನ್ನು ಹೊಂದಿರುತ್ತದೆ.
ಥರ್ಮೋಕೆಮಿಕಲ್ ಸಮೀಕರಣವನ್ನು ಕಂಪೈಲ್ ಮಾಡಲು, ನಾವು ಅನುಪಾತವನ್ನು ರಚಿಸೋಣ:
11.5 ಗ್ರಾಂ ಎಥೆನಾಲ್ ---------- 308.71 ಕೆಜೆ
46 ಗ್ರಾಂ ಎಥೆನಾಲ್ ---------- x kJ
ನಂತರ ಮೀಥೇನ್ನ ಥರ್ಮೋಕೆಮಿಕಲ್ ಸಮೀಕರಣವು ರೂಪವನ್ನು ಪಡೆಯುತ್ತದೆ:
C 2 H 5 OH (l) + 3 0 2 (g) = 2 C0 2 (g) + 3 H 2 O (p); ∆Н° = -1234.84
ಕ್ರಿಯೆಯ ಸಮಯದಲ್ಲಿ ಶಾಖ ಬಿಡುಗಡೆಯಾಗುವುದರಿಂದ ನಾವು ಪ್ರತಿಕ್ರಿಯೆಯ ಉಷ್ಣ ಪರಿಣಾಮವನ್ನು ಮೈನಸ್ ಚಿಹ್ನೆಯೊಂದಿಗೆ ಬರೆಯುತ್ತೇವೆ.
ಹೆಸ್ಸ್ ಕಾನೂನಿನ ಪ್ರಕಾರ, ಪ್ರತಿಕ್ರಿಯೆಯ ಉಷ್ಣ ಪರಿಣಾಮವು ಪರಿವರ್ತನೆಯ ಹಾದಿಯನ್ನು ಅವಲಂಬಿಸಿರುವುದಿಲ್ಲ, ಆದರೆ ವ್ಯವಸ್ಥೆಯ ಅಂತಿಮ ಮತ್ತು ಆರಂಭಿಕ ಸ್ಥಿತಿಯನ್ನು ಮಾತ್ರ ಅವಲಂಬಿಸಿರುತ್ತದೆ.
∆Н° ಪ್ರತಿಕ್ರಿಯೆ = ∑∆Н° ಅಂತಿಮ. - ∑∆Н° ಹಿಂತಿರುಗುವ ಪ್ರಾರಂಭ
ನಾವು ಆರಂಭಿಕ ವಸ್ತುಗಳು ಮತ್ತು ಪ್ರತಿಕ್ರಿಯೆ ಉತ್ಪನ್ನಗಳ ರಚನೆಯ ಪ್ರಮಾಣಿತ ಎಂಥಾಲ್ಪಿಗಳನ್ನು ಉಲ್ಲೇಖ ಪುಸ್ತಕದಿಂದ ತೆಗೆದುಕೊಳ್ಳುತ್ತೇವೆ:
∆H° ಮಾದರಿ CO 2 (g) = -393.51 kJ/mol,
∆Н° arr H 2 O (ಉಗಿ) = -241.83 kJ/mol
∆H° ಮಾದರಿ O 2 (g) = 0 kJ/mol.
∆H° arr (C 2 H 5 OH (l)) = [∆H° arr (H 2 O) *3 + ∆H° arr (CO 2) *2] - ∆H° ಪ್ರತಿಕ್ರಿಯೆ = [(-241, 83)*3 + (- 393.51)*2 - (-1234, 84) = - 277.68 kJ/mol
114. ಕಾರ್ಬೋನೇಟ್ಗಳಲ್ಲಿ ಯಾವುದು: BeCO3, CaCO3 ಅಥವಾ BaCO3 ಅನ್ನು CO 2 ನೊಂದಿಗೆ ಅನುಗುಣವಾದ ಆಕ್ಸೈಡ್ಗಳ ಕ್ರಿಯೆಯಿಂದ ಪಡೆಯಬಹುದು? ಯಾವ ಪ್ರತಿಕ್ರಿಯೆಯು ಹೆಚ್ಚು ಶಕ್ತಿಯುತವಾಗಿ ಸಂಭವಿಸುತ್ತದೆ? ∆G° 298 ಪ್ರತಿಕ್ರಿಯೆಗಳನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡುವ ಮೂಲಕ ತೀರ್ಮಾನವನ್ನು ರಚಿಸಿ
ಆರಂಭಿಕ ವಸ್ತುಗಳು ಮತ್ತು ಪ್ರತಿಕ್ರಿಯೆಗಳ ಅಂತಿಮ ಉತ್ಪನ್ನಗಳಿಗಾಗಿ ಗಿಬ್ಸ್ ಶಕ್ತಿ ∆G° 298 ರ ಪ್ರಮಾಣಿತ ಮೌಲ್ಯಗಳನ್ನು ಉಲ್ಲೇಖ ಪುಸ್ತಕದಿಂದ ತೆಗೆದುಕೊಳ್ಳೋಣ: ∆G° 298 BeO = -569.54 kJ/mol, ∆G° 298 BeCO3 = -944.75, ∆G° 298 BaO = -525.84 kJ/mol, ∆G° 298 ВаСО 3 = -1132.77 kJ/mol; ∆G° 298 CaO = -603.46 kJ/mol,
∆G° 298 CaCO 3 = -1128.35 kJ/mol; ∆G° 298 CO 2 = -394.37 kJ/mol;
ನಂತರ BeO(k) + CO 2 (g) = BeCO3(k) ಪ್ರತಿಕ್ರಿಯೆಗಾಗಿ ಗಿಬ್ಸ್ ಶಕ್ತಿಯ ಪ್ರಮಾಣಿತ ಮೌಲ್ಯವು ಹೀಗಿರುತ್ತದೆ:
944.75-[(-569.54)+(-394.37)]=+19.16 kJ/mol.
ಈ ಪ್ರತಿಕ್ರಿಯೆಗಾಗಿ ಗಿಬ್ಸ್ ಶಕ್ತಿಯ ಧನಾತ್ಮಕ ಮೌಲ್ಯವು ಪ್ರಮಾಣಿತ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ ಈ ಪ್ರತಿಕ್ರಿಯೆಯು ಬಲದಿಂದ ಎಡಕ್ಕೆ ಪ್ರಧಾನವಾಗಿ ಮುಂದುವರಿಯುತ್ತದೆ ಮತ್ತು ಬೆರಿಲಿಯಮ್ ಕ್ಯಾಬೊನೇಟ್ ಅನ್ನು BeO ಮತ್ತು CO 2 ನಿಂದ ಪಡೆಯಲಾಗುವುದಿಲ್ಲ ಎಂದು ಸೂಚಿಸುತ್ತದೆ.
BaO(k) + CO 2 (g) = BaCO3(k) ಪ್ರತಿಕ್ರಿಯೆಗಾಗಿ ಗಿಬ್ಸ್ ಶಕ್ತಿಯ ಪ್ರಮಾಣಿತ ಮೌಲ್ಯವು ಹೀಗಿರುತ್ತದೆ:
1132.77-[(-525.84)+(-394.37)]=-212.56 kJ/mol/
ಪ್ರತಿಕ್ರಿಯೆಗೆ CaO(k) + CO 2 (g) = CaCO3(k) ಗಿಬ್ಸ್ ಶಕ್ತಿಯ ಪ್ರಮಾಣಿತ ಮೌಲ್ಯ ಹೀಗಿರುತ್ತದೆ:
1128.35-[(-603.46)+(-394.37)]=-130.52 kJ/mol.
ಈ ಪ್ರತಿಕ್ರಿಯೆಗಳಿಗೆ ಗಿಬ್ಸ್ ಶಕ್ತಿಯ ಮೌಲ್ಯವು ಋಣಾತ್ಮಕವಾಗಿರುತ್ತದೆ ಮತ್ತು ಈ ಪ್ರಕ್ರಿಯೆಗಳು ಮುಂದೆ ದಿಕ್ಕಿನಲ್ಲಿ ಮುಂದುವರಿಯುತ್ತವೆ, ಅಂದರೆ, ಕ್ಯಾಲ್ಸಿಯಂ ಮತ್ತು ಬೇರಿಯಮ್ ಕಾರ್ಬೋನೇಟ್ಗಳನ್ನು ಈ ರೀತಿಯಲ್ಲಿ ಪಡೆಯಬಹುದು. ಬೇರಿಯಮ್ ಆಕ್ಸೈಡ್ ಮತ್ತು ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ನಡುವೆ ಅತ್ಯಂತ ಶಕ್ತಿಯುತ ಪ್ರತಿಕ್ರಿಯೆಯು ಸಂಭವಿಸುತ್ತದೆ, ಏಕೆಂದರೆ ಈ ಪ್ರತಿಕ್ರಿಯೆಯ ಗಿಬ್ಸ್ ಶಕ್ತಿಯ ಮೌಲ್ಯವು ಹೆಚ್ಚು ಋಣಾತ್ಮಕ ಮೌಲ್ಯವನ್ನು ಹೊಂದಿರುತ್ತದೆ.
134. ಏಕರೂಪದ ವ್ಯವಸ್ಥೆಯ ಸಮತೋಲನ 4 HCl (g) + O 2 (g) ↔ 2H 2 0 (g) + 2Cl 2 (g) ಅನ್ನು ಪ್ರತಿಕ್ರಿಯಾಕಾರಿಗಳ ಕೆಳಗಿನ ಸಾಂದ್ರತೆಗಳಲ್ಲಿ mol/l ಸ್ಥಾಪಿಸಲಾಗಿದೆ: [H 2 O] p = 0.14; [Cl 2] ಪು =0.14; [HCl] P = 0.20; [O 2 ] p = 0.32. ಹೈಡ್ರೋಜನ್ ಕ್ಲೋರೈಡ್ ಮತ್ತು ಆಮ್ಲಜನಕದ ಆರಂಭಿಕ ಸಾಂದ್ರತೆಯನ್ನು ಲೆಕ್ಕಹಾಕಿ
[H 2 0] p = 0.14 mol/l
[Cl 2 ] p =0.14 mol/l
[HCl] P = 0.20 mol/l
[O 2 ] p = 0.32 mol/l
ಉಲ್ಲೇಖ =? ref=?
ಪ್ರತಿಕ್ರಿಯೆ ಸಮೀಕರಣದ ಆಧಾರದ ಮೇಲೆ, ಎಲ್ಲಾ ಕ್ಲೋರಿನ್ (2 mol) ಹೈಡ್ರೋಜನ್ ಕ್ಲೋರೈಡ್ (4 mol) ನಿಂದ ರೂಪುಗೊಳ್ಳುತ್ತದೆ ಮತ್ತು ಎಲ್ಲಾ ನೀರು ಮೂಲ ಹೈಡ್ರೋಜನ್ ಕ್ಲೋರೈಡ್ ಮತ್ತು ಆಮ್ಲಜನಕದಿಂದ ರೂಪುಗೊಳ್ಳುತ್ತದೆ.
ಆದ್ದರಿಂದ, 0.14 mol ಕ್ಲೋರಿನ್ ಅನ್ನು ರೂಪಿಸಲು, 0.28 mol ಹೈಡ್ರೋಜನ್ ಕ್ಲೋರೈಡ್ ಪ್ರತಿಕ್ರಿಯಿಸಬೇಕು ಮತ್ತು 0.14 mol ನೀರನ್ನು ಪಡೆಯಲು, 0.07 mol ಆಮ್ಲಜನಕವು ಪ್ರತಿಕ್ರಿಯಿಸಬೇಕು.
ಹೀಗಾಗಿ, HCl ನ ಆರಂಭಿಕ ಸಾಂದ್ರತೆಯು 0.20 + 0.28 = 0.48 mol/l ಆಗಿತ್ತು, ಮತ್ತು O 2 ನ ಆರಂಭಿಕ ಸಾಂದ್ರತೆಯು 0.32 + 0.07 = 0.39 mol/l ಗೆ ಸಮಾನವಾಗಿರುತ್ತದೆ.
ಉತ್ತರ: ಹೈಡ್ರೋಜನ್ ಕ್ಲೋರೈಡ್ ಮತ್ತು ಆಮ್ಲಜನಕದ ಆರಂಭಿಕ ಸಾಂದ್ರತೆಗಳು ಕ್ರಮವಾಗಿ 0.48 mol/L ಮತ್ತು 0.39 mol/L.
154. KOH ನ 1.4 ಗ್ರಾಂ ಹೊಂದಿರುವ 1 ಲೀಟರ್ ದ್ರಾವಣವನ್ನು ತಟಸ್ಥಗೊಳಿಸಲು, 50 cm 3 ಆಮ್ಲ ದ್ರಾವಣದ ಅಗತ್ಯವಿದೆ. ಸಮಾನವಾದ ಆಮ್ಲ ದ್ರಾವಣದ ಮೋಲಾರ್ ಸಾಂದ್ರತೆಯನ್ನು ಲೆಕ್ಕಹಾಕಿ
KOH ಪರಿಹಾರದ ಶೀರ್ಷಿಕೆಯನ್ನು ಕಂಡುಹಿಡಿಯೋಣ:
ಈಗ KOH ದ್ರಾವಣದ ಸಮಾನ ಮೋಲಾರ್ ಸಾಂದ್ರತೆಯನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡೋಣ:
KOH ದ್ರಾವಣದ ಸಮಾನ ಮೋಲಾರ್ ಸಾಂದ್ರತೆಯನ್ನು ತಿಳಿದುಕೊಂಡು, ನಾವು ಆಮ್ಲ ಸಮಾನತೆಯ ಮೋಲಾರ್ ಸಾಂದ್ರತೆಯನ್ನು ಲೆಕ್ಕ ಹಾಕುತ್ತೇವೆ:
174. ಎಷ್ಟು ಗ್ರಾಂ ಯೂರಿಯಾ CO (NH 2) 2 ಅನ್ನು 75 ಗ್ರಾಂ ನೀರಿನಲ್ಲಿ ಕರಗಿಸಬೇಕು ಇದರಿಂದ ದ್ರಾವಣದ ಸ್ಫಟಿಕೀಕರಣದ ಉಷ್ಣತೆಯು 0.465 ° ರಷ್ಟು ಕಡಿಮೆಯಾಗುತ್ತದೆ? ನೀರಿನ ಕ್ರಯೋಸ್ಕೋಪಿಕ್ ಸ್ಥಿರಾಂಕವು 1.86 ಆಗಿದೆ
ಯೂರಿಯಾದ ಮೋಲಾರ್ ದ್ರವ್ಯರಾಶಿ 60 ಗ್ರಾಂ/ಮೋಲ್ ಆಗಿದೆ. ದ್ರಾವಣದ ಘನೀಕರಿಸುವ ತಾಪಮಾನದಲ್ಲಿ ಇಳಿಕೆ ∆T K = 0.465 °C.
ರೌಲ್ಟ್ ನಿಯಮದ ಪ್ರಕಾರ, ಶುದ್ಧ ದ್ರಾವಕದ ಸ್ಫಟಿಕೀಕರಣ ತಾಪಮಾನಕ್ಕೆ ಹೋಲಿಸಿದರೆ ದ್ರಾವಣದ ಸ್ಫಟಿಕೀಕರಣ ತಾಪಮಾನದಲ್ಲಿನ ಇಳಿಕೆಯು ದ್ರಾವಕದ ಕ್ರಯೋಸ್ಕೋಪಿಕ್ ಸ್ಥಿರಾಂಕ ಮತ್ತು ದ್ರಾವಕದ ಮೋಲಾಲ್ ಸಾಂದ್ರತೆಯ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿರುತ್ತದೆ. ಇಲ್ಲಿಂದ ನೀವು ಕರಗಿದ ವಸ್ತುವಿನ ದ್ರವ್ಯರಾಶಿಯನ್ನು ಲೆಕ್ಕ ಹಾಕಬಹುದು - ದ್ರಾವಣದಲ್ಲಿ ಯೂರಿಯಾ.
194. ಅಯಾನು-ಆಣ್ವಿಕ ಸಮೀಕರಣಗಳಿಂದ ವ್ಯಕ್ತವಾಗುವ ಪ್ರತಿಕ್ರಿಯೆಗಳಿಗೆ ಆಣ್ವಿಕ ಮತ್ತು ಅಯಾನು-ಆಣ್ವಿಕ ಸಮೀಕರಣಗಳನ್ನು ಬರೆಯಿರಿ
Fe(OH)3 + 3 H + = Fe 3+ + 3 H 2 O
ಸಿಡಿ 2+ + 2 OH - = Cd(OH) 2
H + + NO 2 - =HNO 2
Fe(OH) 3 (t)+ 3 HCl = FeCl 3 + 3 H 2 O
Fe(OH) 3 (t) + 3 H + + 3 Cl - = Fe 3+ + 3Cl - + 3 H 2 O
Fe(OH) 3 (t) + 3 H + = Fe 3+ + 3 H 2 O
Cd(NO 3) 2 + 2 KOH = Cd(OH) 2 (t)+ 2 KNO 3
Cd 2+ + 2NO 3 +2K + +2OH - = Cd(OH) 2 (t)+ 2 K + + 2 NO 3 -
CD 2 + 2 OH - = Cd(OH) 2 (t)
HC1 + NaNO2 = NNO2 + NaС1
Н + + Сl - + Na + + NO 2 - = NNO 2 + Na + + Сl -
H + +NO 2 - =HNO 2
214. A1 2 (SO 4) 3 ಮತ್ತು Na 2 CO 3 ಅನ್ನು ಮಿಶ್ರಣ ಮಾಡುವಾಗ, ತೆಗೆದುಕೊಳ್ಳಲಾದ ಪ್ರತಿಯೊಂದು ಲವಣಗಳನ್ನು ಅನುಗುಣವಾದ ಬೇಸ್ ಮತ್ತು ಆಮ್ಲವನ್ನು ರೂಪಿಸಲು ಬದಲಾಯಿಸಲಾಗದಂತೆ ಹೈಡ್ರೊಲೈಸ್ ಮಾಡಲಾಗುತ್ತದೆ. ಅಯಾನಿಕ್ ಮತ್ತು ಆಣ್ವಿಕ ಸಮೀಕರಣಗಳನ್ನು ಬಳಸಿಕೊಂಡು ಈ ಜಂಟಿ ಜಲವಿಚ್ಛೇದನವನ್ನು ವ್ಯಕ್ತಪಡಿಸಿ
A1 2 (SO 4) 3 + 3 Na 2 CO 3 + 3 H 2 O → 2 A1 (OH) 3 (t) + 3 Na 2 SO 4 + 3SO 2 (g)
2 A1 3+ + 3 SO 4 2- + 6 Na + + 3SO 3 2- + 3 H 2 O → 2 Fe(OH) 3 (t) + 6 Na + + 3 SO 4 2- + 3SO 2 (g)
2 A1 3+ + 3SO 3 2- + 3 H 2 O → 2 A1(OH) 3 (t) + 3SO 2 (g)
254. ಕಬ್ಬಿಣ ಮತ್ತು ಬೆಳ್ಳಿಯ ಫಲಕಗಳನ್ನು ಬಾಹ್ಯ ವಾಹಕದಿಂದ ಸಂಪರ್ಕಿಸಲಾಗಿದೆ ಮತ್ತು ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದ ದ್ರಾವಣದಲ್ಲಿ ಮುಳುಗಿಸಲಾಗುತ್ತದೆ. ಈ ಗಾಲ್ವನಿಕ್ ಕೋಶದ ರೇಖಾಚಿತ್ರವನ್ನು ಬರೆಯಿರಿ ಮತ್ತು ಆನೋಡ್ ಮತ್ತು ಕ್ಯಾಥೋಡ್ನಲ್ಲಿನ ಪ್ರಕ್ರಿಯೆಗಳಿಗೆ ಎಲೆಕ್ಟ್ರಾನಿಕ್ ಸಮೀಕರಣಗಳನ್ನು ಬರೆಯಿರಿ.
(-)Fe |H 2 S0 4 | |Н 2 S0 4 |ಎಜಿ(+)
Fe-2 e = Fe 2+ ಪ್ರಕ್ರಿಯೆಯು ಆನೋಡ್ನಲ್ಲಿ (ಕಬ್ಬಿಣ) ಸಂಭವಿಸುತ್ತದೆ, ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ವಾಹಕದ ಮೂಲಕ ಬೆಳ್ಳಿಯ ತಟ್ಟೆಗೆ ಹಾದುಹೋಗುತ್ತವೆ ಮತ್ತು ಪ್ರಕ್ರಿಯೆಯು ಬೆಳ್ಳಿ ಕ್ಯಾಥೋಡ್ನ ಮೇಲ್ಮೈಯಲ್ಲಿ ಸಂಭವಿಸುತ್ತದೆ.
2 N + + 2 e = N 2 T.
ಕಬ್ಬಿಣದ ತಟ್ಟೆಯು ಕರಗುತ್ತದೆ ಮತ್ತು ಬೆಳ್ಳಿಯ ತಟ್ಟೆಯು ಹೈಡ್ರೋಜನ್ ವಿಕಾಸವನ್ನು ಪ್ರದರ್ಶಿಸುತ್ತದೆ.
274. KBr ದ್ರಾವಣದ ವಿದ್ಯುದ್ವಿಭಜನೆಯ ಸಮಯದಲ್ಲಿ ಗ್ರ್ಯಾಫೈಟ್ ವಿದ್ಯುದ್ವಾರಗಳ ಮೇಲೆ ಸಂಭವಿಸುವ ಪ್ರಕ್ರಿಯೆಗಳಿಗೆ ಎಲೆಕ್ಟ್ರಾನಿಕ್ ಸಮೀಕರಣಗಳನ್ನು ರಚಿಸಿ. 15 ಎ ಪ್ರವಾಹದಲ್ಲಿ 1 ಗಂಟೆ 35 ನಿಮಿಷಗಳ ಕಾಲ ವಿದ್ಯುದ್ವಿಭಜನೆಯನ್ನು ನಡೆಸಿದರೆ ಕ್ಯಾಥೋಡ್ ಮತ್ತು ಆನೋಡ್ನಲ್ಲಿ ಯಾವ ವಸ್ತುವಿನ ದ್ರವ್ಯರಾಶಿ ಬಿಡುಗಡೆಯಾಗುತ್ತದೆ? ಉತ್ತರ: 0.886 ಗ್ರಾಂ; 70.79 ಗ್ರಾಂ
ಕ್ಯಾಥೋಡ್ನಲ್ಲಿ ಜಡ (ಗ್ರ್ಯಾಫೈಟ್) ವಿದ್ಯುದ್ವಾರಗಳೊಂದಿಗೆ ಪೊಟ್ಯಾಸಿಯಮ್ ಬ್ರೋಮೈಡ್ನ ಜಲೀಯ ದ್ರಾವಣದ ವಿದ್ಯುದ್ವಿಭಜನೆಯ ಸಮಯದಲ್ಲಿ, ನೀರಿನ ಅಣುಗಳ ಕಡಿತದ ಪ್ರಕ್ರಿಯೆಯು ಸಂಭವಿಸುತ್ತದೆ ಮತ್ತು ಹೈಡ್ರೋಜನ್ ಬಿಡುಗಡೆಯಾಗುತ್ತದೆ:
2Н 2 О+2е =Н 2 +2О1H -
ಆನೋಡ್ನಲ್ಲಿ, ಬ್ರೋಮೈಡ್ ಅಯಾನುಗಳ ಉತ್ಕರ್ಷಣ ಪ್ರಕ್ರಿಯೆಯು ಸಂಭವಿಸುತ್ತದೆ ಮತ್ತು ಬ್ರೋಮಿನ್ ಬಿಡುಗಡೆಯಾಗುತ್ತದೆ: 2Br - - 2е = Br 2 ಹೈಡ್ರೋಜನ್ ಸಮಾನದ ಮೋಲಾರ್ ದ್ರವ್ಯರಾಶಿ 1 g/mol, ಮತ್ತು ಬ್ರೋಮಿನ್ ಸಮಾನತೆಯ ಮೋಲಾರ್ ದ್ರವ್ಯರಾಶಿ 79.904 g/mol ಆಗಿದೆ. .
ನಂತರ, ಫ್ಯಾರಡೆ ನಿಯಮಗಳ ಪ್ರಕಾರ, ಕ್ಯಾಥೋಡ್ ಮತ್ತು ಆನೋಡ್ನಲ್ಲಿ ಅನುಕ್ರಮವಾಗಿ ಬಿಡುಗಡೆಯಾಗುವ ಹೈಡ್ರೋಜನ್ ಮತ್ತು ಬ್ರೋಮಿನ್ ದ್ರವ್ಯರಾಶಿಯನ್ನು ಕಂಡುಹಿಡಿಯಬಹುದು.
294. ಸೀಸದ ಕೇಬಲ್ ಕವಚದ ಸವೆತದ ವಿರುದ್ಧ ಚಕ್ರದ ಹೊರಮೈಯಲ್ಲಿರುವ ರಕ್ಷಣೆಗಾಗಿ ಯಾವ ಲೋಹವನ್ನು ಆಯ್ಕೆ ಮಾಡಲು ಹೆಚ್ಚು ಸೂಕ್ತವಾಗಿದೆ: ಸತು, ಮೆಗ್ನೀಸಿಯಮ್ ಅಥವಾ ಕ್ರೋಮಿಯಂ? ಏಕೆ? ವಾಯುಮಂಡಲದ ಸವೆತದ ಆನೋಡಿಕ್ ಮತ್ತು ಕ್ಯಾಥೋಡಿಕ್ ಪ್ರಕ್ರಿಯೆಗಳಿಗೆ ಎಲೆಕ್ಟ್ರಾನಿಕ್ ಸಮೀಕರಣಗಳನ್ನು ರಚಿಸಿ. ತುಕ್ಕು ಉತ್ಪನ್ನಗಳ ಸಂಯೋಜನೆ ಏನು?
ತ್ಯಾಗದ ರಕ್ಷಣೆಯಲ್ಲಿ, ರಕ್ಷಕ, ರಕ್ಷಿತವಾಗಿರುವ ರಚನೆಯ ಲೋಹಕ್ಕಿಂತ ಹೆಚ್ಚು ಸಕ್ರಿಯವಾದ ಲೋಹವು ಆನೋಡ್ ಆಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತದೆ ಮತ್ತು ನಾಶವಾಗುತ್ತದೆ, ಇದರಿಂದಾಗಿ ರಚನೆಯನ್ನು ವಿನಾಶದಿಂದ ರಕ್ಷಿಸುತ್ತದೆ. ಆದ್ದರಿಂದ, ರಕ್ಷಕ ಲೋಹದ ಸಂಭಾವ್ಯತೆಯು ಹೆಚ್ಚು ನಕಾರಾತ್ಮಕವಾಗಿರುತ್ತದೆ, ರಕ್ಷಕ ರಕ್ಷಣೆಯು ಹೆಚ್ಚು ಪರಿಣಾಮಕಾರಿಯಾಗಿರುತ್ತದೆ. ಕಡಿಮೆ ಸಾಮರ್ಥ್ಯವು ಮೆಗ್ನೀಸಿಯಮ್ -2.37 ವಿ, (ಸತುವು - 0.763 ವಿ; ಕ್ರೋಮಿಯಂಗೆ - 0.74 ವಿ)
ಕೇಬಲ್ ಪೊರೆಯು ಸೀಸದಿಂದ ಮಾಡಲ್ಪಟ್ಟಿರುವುದರಿಂದ, ಮೆಗ್ನೀಸಿಯಮ್-ಲೀಡ್ ಗಾಲ್ವನಿಕ್ ಜೋಡಿಯು ಹೆಚ್ಚಿನ ಸಂಭಾವ್ಯ ವ್ಯತ್ಯಾಸವನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಮತ್ತು ಮೆಗ್ನೀಸಿಯಮ್ ಅತ್ಯುತ್ತಮ ರಕ್ಷಣಾತ್ಮಕ ರಕ್ಷಣೆಯಾಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತದೆ.
ಮೆಗ್ನೀಸಿಯಮ್ ರಕ್ಷಕದ ಮೇಲ್ಮೈಯಲ್ಲಿ ವಾತಾವರಣದ ಸವೆತದ ಸಮಯದಲ್ಲಿ, ಈ ಕೆಳಗಿನ ಪ್ರಕ್ರಿಯೆಯು ಸಂಭವಿಸುತ್ತದೆ:
2Mg - 4е = 2Mg 2+
ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ವಾಹಕದ ಮೂಲಕ ಸೀಸದ ಕೇಬಲ್ಗೆ ಹಾದು ಹೋಗುತ್ತವೆ ಮತ್ತು ಸೀಸದ ಮೇಲ್ಮೈಯಲ್ಲಿ ಆಮ್ಲಜನಕ ಡಿಪೋಲರೈಸೇಶನ್ ಸಂಭವಿಸುತ್ತದೆ:
O 2 + 2 H 2 O + 4е = 4 OH -
ವಾತಾವರಣದ ಸವೆತದ ಉತ್ಪನ್ನವು ಮೆಗ್ನೀಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಆಗಿರುತ್ತದೆ
2 Mg 2+ + 4 OH - = 2 Mg(OH) 2
314. ಕೆಳಗಿನ ಸಂಕೀರ್ಣ ಅಯಾನುಗಳ ಅಸ್ಥಿರತೆಯ ಸ್ಥಿರತೆಗಳಿಗೆ ಅಭಿವ್ಯಕ್ತಿಗಳನ್ನು ಬರೆಯಿರಿ: [Аg(СN) 2 ] - ; [Аg(NН 3) 2 ] + ; [Аg(SСМ) 2 ] - . ಅವು ಕ್ರಮವಾಗಿ 1.0 * 10 -21, 6.8 * 10 -8, 2.1 * 10 -11 ಗೆ ಸಮಾನವೆಂದು ತಿಳಿದುಕೊಂಡು, ಈ ಅಯಾನುಗಳನ್ನು ಒಳಗೊಂಡಿರುವ ಯಾವ ದ್ರಾವಣದಲ್ಲಿ, Ag + ಅಯಾನುಗಳ ಸಮಾನ ಮೋಲಾರ್ ಸಾಂದ್ರತೆಯೊಂದಿಗೆ, ಹೆಚ್ಚು ಇದೆಯೇ?
ಈ ಸಂಕೀರ್ಣ ಅಯಾನುಗಳಿಗೆ ಅಸ್ಥಿರತೆಯ ಸ್ಥಿರತೆಯ ಅಭಿವ್ಯಕ್ತಿಗಳನ್ನು ನಾವು ಬರೆಯೋಣ:

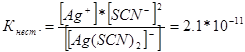
ನಿರ್ದಿಷ್ಟ ತಾಪಮಾನದಲ್ಲಿ, ಅಸ್ಥಿರತೆಯ ಸ್ಥಿರತೆಯ ಮೌಲ್ಯವು ಸ್ಥಿರ ಮೌಲ್ಯವಾಗಿದೆ. ಕಡಿಮೆ ಅಸ್ಥಿರತೆಯ ಸ್ಥಿರತೆ, ಸಂಕೀರ್ಣವು ಹೆಚ್ಚು ಸ್ಥಿರವಾಗಿರುತ್ತದೆ, ಆದ್ದರಿಂದ ಬೆಳ್ಳಿಯ ಅಯಾನುಗಳ ಹೆಚ್ಚಿನ ಸಾಂದ್ರತೆಯು ಸಂಕೀರ್ಣ ಅಯಾನು [Аg(NНз) 2 ] + ಹೊಂದಿರುವ ದ್ರಾವಣದಲ್ಲಿರುತ್ತದೆ.
ಸಾಹಿತ್ಯ
1. ಅಖ್ಮೆಟೋವ್ ಎನ್.ಎಸ್. ಸಾಮಾನ್ಯ ಮತ್ತು ಅಜೈವಿಕ ರಸಾಯನಶಾಸ್ತ್ರ. ಎಂ, 2002.
2. ಕರಾಪೆಟಿಯಂಟ್ಸ್ M.Kh., ಡ್ರಾಕಿನ್ S.I. ಸಾಮಾನ್ಯ ಮತ್ತು ಅಜೈವಿಕ ರಸಾಯನಶಾಸ್ತ್ರ. M. 1994.
3. ಗ್ಲಿಂಕಾ L. I. ಸಾಮಾನ್ಯ ರಸಾಯನಶಾಸ್ತ್ರ. M. 1984.
