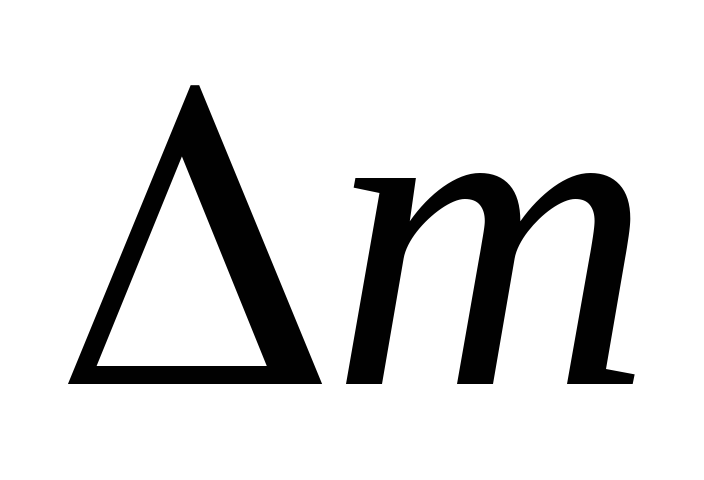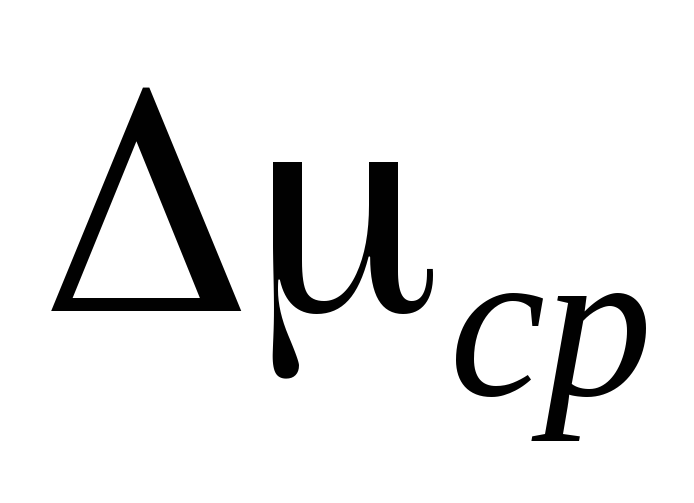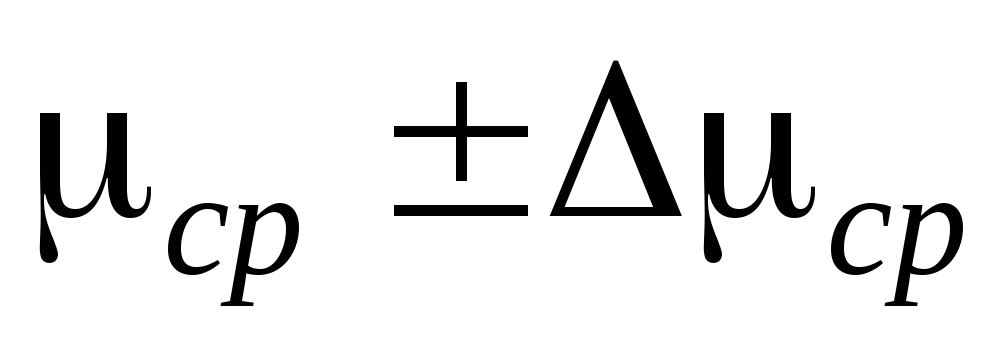Đơn vị khối lượng mol: g/mol. Vì khối lượng phân tử của CO2 và H2O và khối lượng nguyên tử của oxy lần lượt là 44; 18 và 16 amu thì khối lượng mol của chúng bằng nhau: a) 44 g/mol; b) 18 g/mol; c) 16 g/mol.
Theo cách tương tự, trọng lượng phân tử của các hợp chất khác được tính toán trong các phép tính hóa học. Khối lượng phân tử là đặc tính của khối lượng trung bình của một phân tử; nó tính đến thành phần đồng vị của tất cả các nguyên tố tạo thành một chất hóa học nhất định. Chỉ thị này cũng có thể được xác định cho hỗn hợp của một số chất có thành phần đã biết. Định luật này phát biểu rằng trong cùng điều kiện, cùng số lượng phân tử có mặt trong cùng một thể tích khí.
Khối lượng của một thể tích khí nhất định đã biết ở áp suất và nhiệt độ nhất định được xác định. Phương pháp này cho giá trị khối lượng phân tử khá chính xác, đôi khi còn được sử dụng để xác định khối lượng nguyên tử của các hợp chất hóa học. Để ước tính trọng lượng phân tử, khí thường được coi là khí lý tưởng và không cần thực hiện các hiệu chỉnh bổ sung.
Không khí cần thiết cho sự tồn tại bình thường của các sinh vật sống trên Trái đất. Trong công nghiệp và đời sống, oxy trong khí quyển được sử dụng để đốt cháy nhiên liệu nhằm tạo ra nhiệt và năng lượng cơ học trong động cơ đốt trong. Năm 1754, Joseph Black đã chứng minh bằng thực nghiệm rằng không khí là hỗn hợp các chất khí chứ không phải là chất đồng nhất. Biểu tượng đầu tiên là hình ảnh được chấp nhận chung của nguyên tố không khí. Hình ảnh thứ ba là quẻ không khí trong Kinh Dịch.
Tự do của con người được dệt từ không khí mỏng manh. Vì vậy, biểu tượng của không khí trước hết là biểu tượng của tự do. Đây là sự tự do không có rào cản, bởi vì không khí không thể bị giới hạn, không thể bị bắt giữ và định hình.
Không khí trong khí quyển là hỗn hợp của không khí khô và hơi nước (từ 0,2% đến 2,6%). Vì vậy, không khí hầu như luôn có thể được coi là ẩm ướt. Hỗn hợp cơ học của không khí khô và hơi nước được gọi là hỗn hợp không khí ẩm hoặc hỗn hợp không khí-hơi nước. Độ ẩm tuyệt đối của không khí là khối lượng hơi nước có trong 1 m3 không khí ẩm.
Khi dập tắt đám cháy bằng nước, cả hai điều kiện đều được tạo ra: nước làm mát các vật thể đang cháy và hơi của nó khiến không khí khó tiếp cận chúng. Câu hỏi về thành phần của không khí trong khoa học vẫn chưa được giải quyết ngay lập tức. Năm 1774, nhà khoa học người Pháp A. Lavoisier đã chứng minh rằng không khí là hỗn hợp chủ yếu của hai loại khí - nitơ và oxy. Ngoài ra, không khí còn chứa carbon monoxide (IV) và hơi nước. Thành phần không khí gần đúng được thể hiện trong bảng.
Hàn điện các kim loại dễ bị oxy hóa được thực hiện trong môi trường trơ của argon. Bóng đèn neon, argon, krypton và xenon. Bạn đã làm quen với quá trình đốt cháy các chất trong oxy. Theo quy luật, khi các chất cháy trong không khí, các sản phẩm giống nhau sẽ được tạo thành, tức là các loại oxit khác nhau. Số nguyên tử của các nguyên tố có trong thành phần chất cháy bằng nhau: C6H6 + O2 -> 6CO2 + 3H2O3.
Kỹ thuật này được sử dụng khi dập tắt đám cháy trong trường hợp đốt dầu và các sản phẩm của nó. Thành phần hóa học của không khí có tầm quan trọng lớn về mặt vệ sinh vì nó đóng vai trò quyết định đối với chức năng hô hấp của cơ thể.
Trong các khu dân cư, công cộng và thể thao, không có sự thay đổi đáng kể nào về hàm lượng oxy, vì không khí bên ngoài xâm nhập vào chúng. Khi hít phải không khí kéo dài có chứa 1-1,5% carbon dioxide, sức khỏe sẽ suy giảm và ở mức 2-2,5% thay đổi bệnh lý được phát hiện.
Cách tìm khối lượng mol của không khí
Nguyên tử của các nguyên tố được đặc trưng bởi một khối lượng nhất định (chỉ vốn có). Giá trị khối lượng phân tử tương đối được tính từ giá trị khối lượng nguyên tử tương đối, có tính đến số lượng nguyên tử của từng nguyên tố trong đơn vị công thức của một chất phức tạp. Tổng các phần khối lượng của các nguyên tố có trong một chất phức tạp là 1 (100%). Trong tính toán hóa học, khối lượng của chất phản ứng và sản phẩm ở dạng khí thường được thay thế bằng thể tích của chúng. Hằng số vật lý này là thể tích mol của chất khí ở điều kiện bình thường.
Chúng dựa trên các định luật bảo toàn khối lượng, hằng số thành phần, nhiều tỷ lệ, cũng như các định luật về khí - tỷ lệ thể tích và Avogadro. Trong sản xuất, cân bằng vật chất được tính toán trên cơ sở này. Định luật luôn đúng đối với chất khí và chất lỏng. Định luật đa tỷ lệ, giống như định luật về thành phần không đổi, không phổ biến và cũng không có giá trị đối với các chất ở trạng thái rắn. Ví dụ, khi 2 thể tích hydro và 1 thể tích oxy tương tác với nhau thì tạo thành 2 thể tích hơi nước. Những con số này trùng với các hệ số cân bằng hóa học trong phương trình phản ứng.

Khối lượng nguyên tử tương đối của các nguyên tố đã biết được cho trong bảng “Bảng tuần hoàn các nguyên tố D.I. Mendeleev”. Lượng chất B là đại lượng vật lý biểu thị số đơn vị công thức của chất đó so với hằng số Avogadro. Ngược lại, hằng số Avogadro biểu thị số lượng nguyên tử có trong 12g đồng vị cacbon 126C, hay số đơn vị khối lượng nguyên tử trong 1g chất.
10. Xác định khối lượng phân tử của các chất ở trạng thái khí.
Trên thực tế, đối với đồng vị cacbon 126C Ar = 12, và khối lượng mol của nguyên tử (theo định nghĩa của khái niệm “mol”) là 12 g/mol. Trong điều kiện bình thường (101,325 kPa; 273 K), thể tích mol của bất kỳ chất khí nào là 22,4 l/mol (chính xác hơn là Vn = 22,4 l/mol). Đối với các khí không lý tưởng, được gọi là khí thực, thể tích mol khác nhau và hơi khác so với giá trị chính xác. Nếu thể tích và áp suất của một chất khí được biểu thị bằng các đơn vị đo khác thì giá trị của hằng số khí trong phương trình Clapeyron–Mendeleev sẽ có một giá trị khác.
Vì vậy, chúng được sử dụng để chiếu sáng quảng cáo và đốt các chất trong không khí. Xác định khối lượng mol của các chất ở trạng thái khí Theo định luật, những thể tích khí bằng nhau được lấy ở cùng nhiệt độ và cùng áp suất chứa một số lượng phân tử bằng nhau. Khối lượng phân tử của không khí, giống như các loại khí khác, có thể được xác định bằng định luật Avogadro.
Viện Murom (chi nhánh)
cơ quan giáo dục ngân sách nhà nước liên bang
giáo dục chuyên nghiệp cao hơn
"Đại học bang Vladimir
được đặt theo tên của Alexander Grigorievich và
Nikolai Grigorievich Stoletov"
Sở: "FPM"
Môn học: Vật lý
Công việc thí nghiệm số 6.03
Đã được phê duyệt về phương pháp luận
hội thảo của khoa FPM
Cái đầu phòng ____________
Công việc thí nghiệm số 6.03
XÁC ĐỊNH KHỐI LƯỢNG PHÂN TỬ KHÔNG KHÍ
Mục đích của công việc- Làm quen với một trong các phương pháp xác định khối lượng phân tử của chất khí và đo khối lượng phân tử của không khí.
Thiết bị và phụ kiện: bình khí, lắp đặt cân hoặc cân kỹ thuật, đồng hồ đo áp suất, quả cân, bơm chân không.
SỰ AN TOÀN
Cẩn thận khi cầm hộp thủy tinh đựng trong túi vải lanh.
THÔNG TIN LÝ THUYẾT
Khối lượng phân tử là tỉ số giữa khối lượng của một phân tử của một chất nhất định và 1/12 khối lượng của nguyên tử cacbon C.
Khối lượng phân tử, theo định nghĩa, có thể được biểu diễn dưới dạng tổng khối lượng nguyên tử của các nguyên tố tạo nên phân tử
=
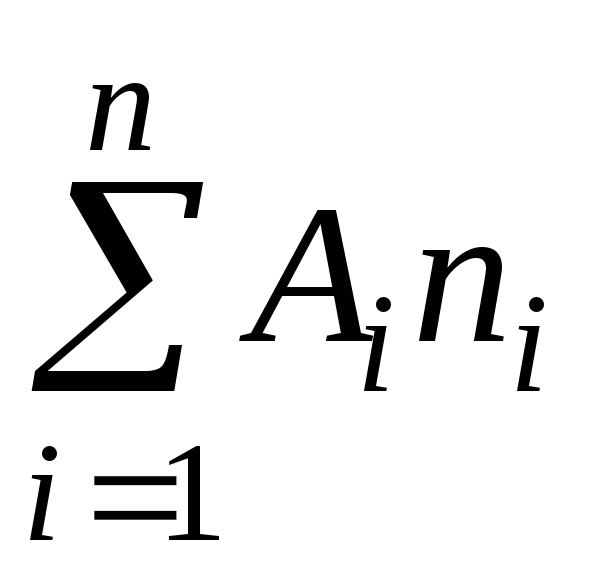 (1)
(1)
trong đó A là khối lượng nguyên tử th nguyên tố có trong thành phần của phân tử;
n là số lượng nguyên tử.
Các phương pháp xác định trọng lượng phân tử được chia thành hai nhóm - tuyệt đối và thống kê. Các phương pháp tuyệt đối mang lại giá trị “thực” của trọng lượng phân tử bao gồm phương pháp quang phổ khối. Các phương pháp khác chỉ cho biết trọng lượng phân tử trung bình.
Xác định khối lượng phân tử của khí dựa vào phương trình trạng thái của khí
PV = 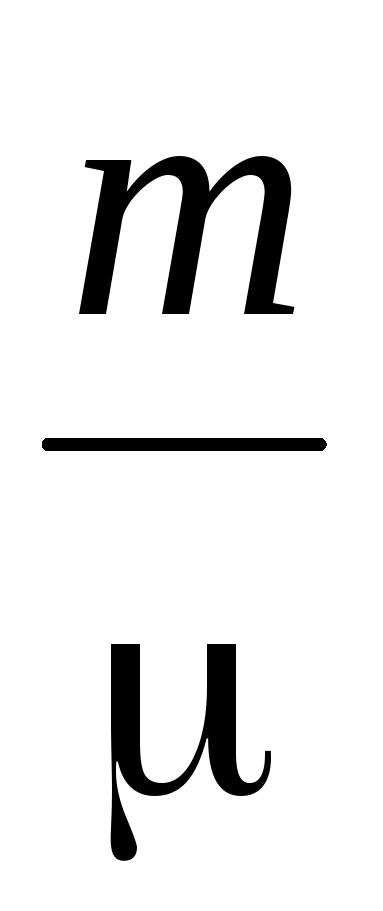 RT (2)
RT (2)
trong đó P là áp suất khí,
m, V – khối lượng và thể tích của nó,
T – nhiệt độ tuyệt đối
R - hằng số khí phổ quát,
– trọng lượng phân tử trung bình.
Phương trình 2 chỉ đúng cho khí lý tưởng. Khí lý tưởng là chất khí trong đó không có lực tương tác (lực hút hoặc lực đẩy) giữa các phân tử của nó. Các phân tử khí lý tưởng được biểu diễn dưới dạng những quả cầu đàn hồi có kích thước vô cùng nhỏ. Khí thực có lực tương tác giữa các phân tử và phân tử không phải lúc nào cũng được coi là những quả cầu đàn hồi có kích thước nhỏ bằng 0, do đó khí thực bị sai lệch định luật (2).
Tuy nhiên, ở áp suất không quá cao, khi các phân tử khí có thể tự do di chuyển quãng đường dài trước khi va chạm thì có thể bỏ qua tương tác giữa các phân tử, cũng có thể bỏ qua kích thước của các phân tử (khi thể tích khí đủ lớn), khi đó khí thực sẽ gần lý tưởng và phương trình (2) có thể được áp dụng. Ở áp suất khí quyển và nhiệt độ phòng, nhiều loại khí (nitơ, hydro, heli, oxy, không khí, v.v.) có thể được coi là khí lý tưởng với giá trị gần đúng khá tốt.
Một đặc tính quan trọng của chuyển động phân tử là đường đi tự do trung bình. Các phân tử trong chất khí ở trạng thái chuyển động hỗn loạn và liên tục, va chạm với nhau và tự do di chuyển theo một đường nhất định giữa các lần va chạm . Độ dài của đường đi này giữa hai lần va chạm là khác nhau, nhưng do số lượng phân tử lớn và tính ngẫu nhiên trong chuyển động của chúng nên chúng ta có thể nói về đường đi tự do trung bình của các phân tử. Quãng đường tự do trung bình của các phân tử có thể được xác định theo công thức
 =
=
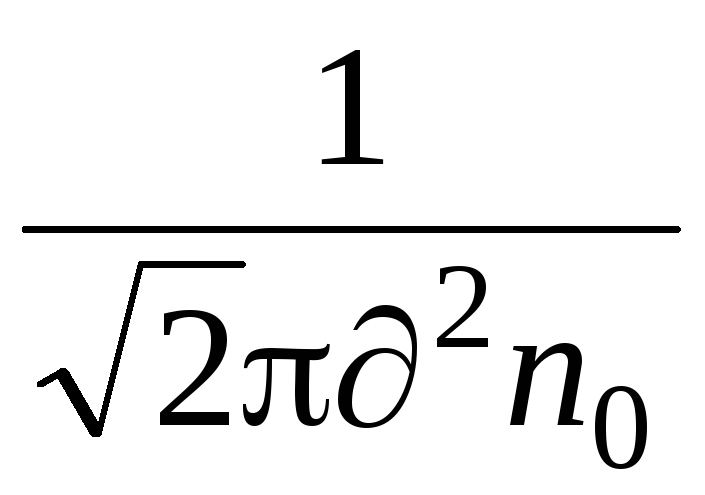 ,
,
trong đó là đường kính hiệu dụng của phân tử (đối với không khí = 0,27 10 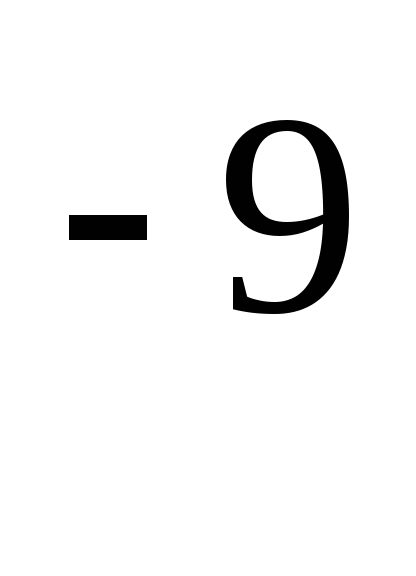 m),
m),
N  - số lượng phân tử trên một đơn vị thể tích.
- số lượng phân tử trên một đơn vị thể tích.
N  =
=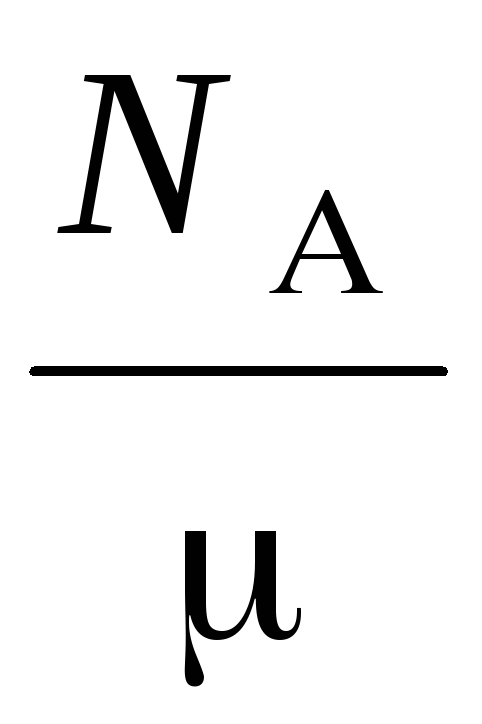
 ,
,
sau đó tính đến điều này trong công thức , với có dạng:
=
 ,
,
Ở đâu  – khối lượng phân tử của khí, N
– khối lượng phân tử của khí, N  – Số Avogadro, – mật độ khí.
– Số Avogadro, – mật độ khí.
Cho không khí trong hình trụ hở chiếm thể tích V., khối lượng của nó T, áp suất khí quyển P; bơm không khí từ xi lanh về P  . Lúc này khối lượng không khí trong xi lanh sẽ là m
. Lúc này khối lượng không khí trong xi lanh sẽ là m  . Đối với hai trạng thái này, chúng tôi viết phương trình (2)
. Đối với hai trạng thái này, chúng tôi viết phương trình (2)
PV =  RT (3)
RT (3)
P  V=
V= 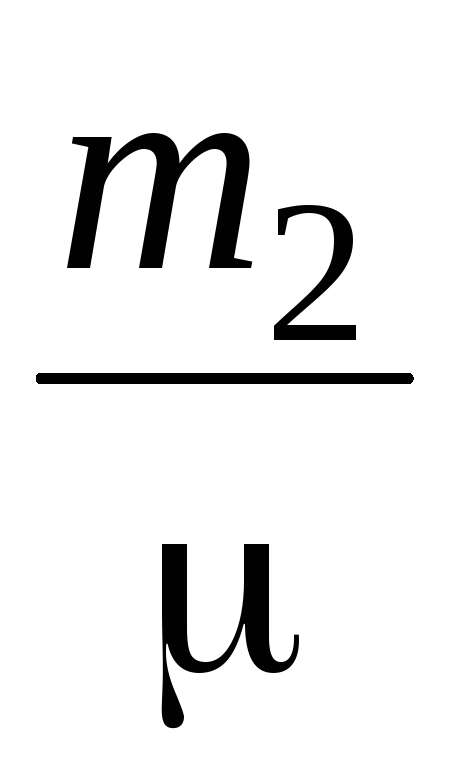 RT (4)
RT (4)
Trừ (3) (4), ta biểu thị .
=

 =
=
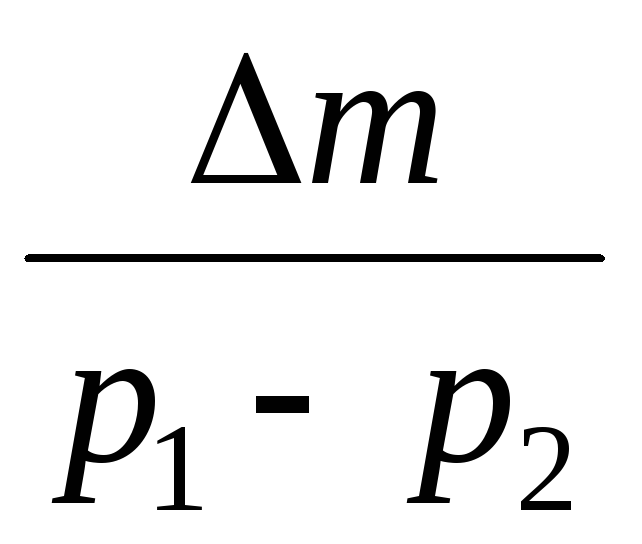
 (5)
(5)
Do đó, khi biết sự thay đổi khối lượng khi áp suất thay đổi, bạn có thể tìm khối lượng phân tử của không khí bằng công thức (5).
MÔ TẢ CÀI ĐẶT
Một cái nhìn chung về cài đặt được hiển thị trong Hình. 1. Việc lắp đặt bao gồm một máy bơm chân không(1) , vòi (2) (sử dụng vòi 2, hệ thống bị ngắt khỏi bơm chân không), máy đo chân không (3). Vòng quay của mũi tên con trỏ của máy đo chân không tỷ lệ thuận với độ chân không đạt được trong hệ thống, tức là. sự khác biệt giữa áp suất khí quyển và áp suất không khí trong quá trình lắp đặt. Giá trị 0 trên thang đo chân không tương ứng với áp suất khí quyển trong hệ thống lắp đặt. Thiết bị chỉ bắt đầu hiển thị khi không khí được bơm ra khỏi hệ thống, tức là. khi áp suất không khí trong hệ thống lắp đặt thấp hơn khí quyển.

Sử dụng vòi 4, hệ thống được kết nối với khí quyển. Trong hình. 1 thể hiện đường chân không (5), hình trụ có thể tháo rời (6) (thể tích TÔI/1225 ml) bằng một ống cao su và một kẹp (7), dùng để ngắt ống trụ 6 khỏi khí quyển khi cân ống trụ.
HOÀN THÀNH CÔNG VIỆC
Nhiệm vụ 1. Xác định khối lượng phân tử của không khí.
1. Mở vòi 2 và 4, kẹp 7 và ngắt kết nối xi lanh 6 khỏi hệ thống lắp đặt. Ta cân trụ 6 cùng với ống cao su và kẹp 7 rồi ghi kết quả đo vào Bảng I. Việc cân phải được thực hiện với độ chính xác khá cao và phải đặc biệt chú ý đến thao tác này.
2. Gắn xi lanh 6 vào hệ thống lắp đặt và bơm không khí ra khỏi xi lanh sao cho sự thay đổi áp suất là  P=0,1
P=0,1 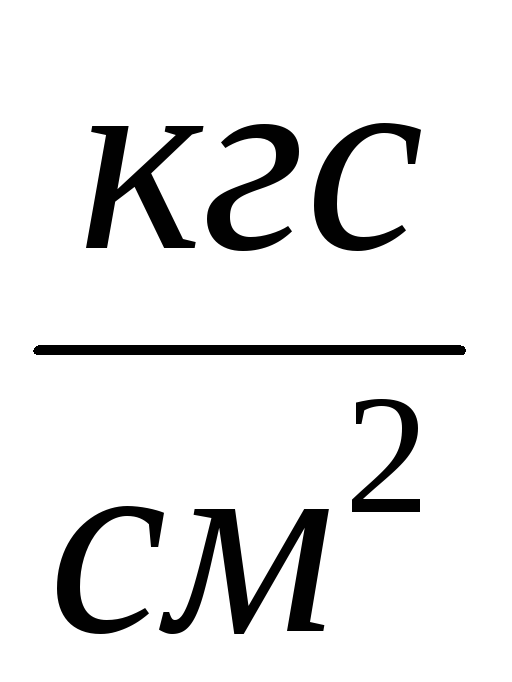 . Đóng nhấn 2 và thêm
. Đóng nhấn 2 và thêm  P vào bảng đo. Đóng vòi 4, sử dụng kẹp 7, ngắt kết nối xi lanh 6 khỏi hệ thống lắp đặt và cân nó. Kết quả đo được nhập vào bảng.
P vào bảng đo. Đóng vòi 4, sử dụng kẹp 7, ngắt kết nối xi lanh 6 khỏi hệ thống lắp đặt và cân nó. Kết quả đo được nhập vào bảng.
3. Mở kẹp 7, mở nhẹ nhàng vòi 2 và 4 và lặp lại bước 2 thêm 4 lần nữa cho các giá trị khác  P.
P.
4. Dựa trên kết quả đo, chúng tôi tính toán không khí và ước tính sai số đo.
Nhiệm vụ 2. Xác định mật độ không khí.
Chúng tôi xác định mật độ không khí bằng phương trình Mendeleev–Cliperon cho các loại khí lý tưởng.
PV = 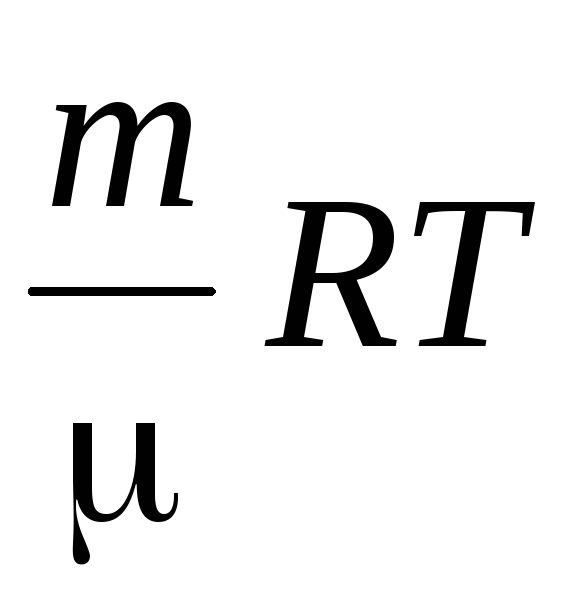 .
.
Từ phương trình này suy ra rằng, vì 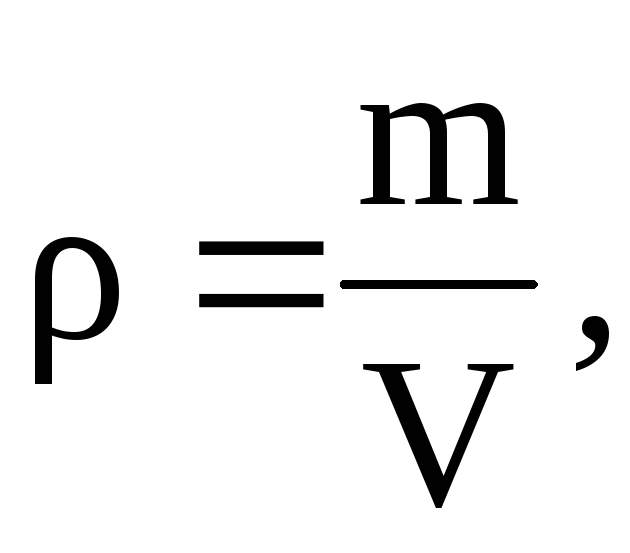 Cái đó
Cái đó
=
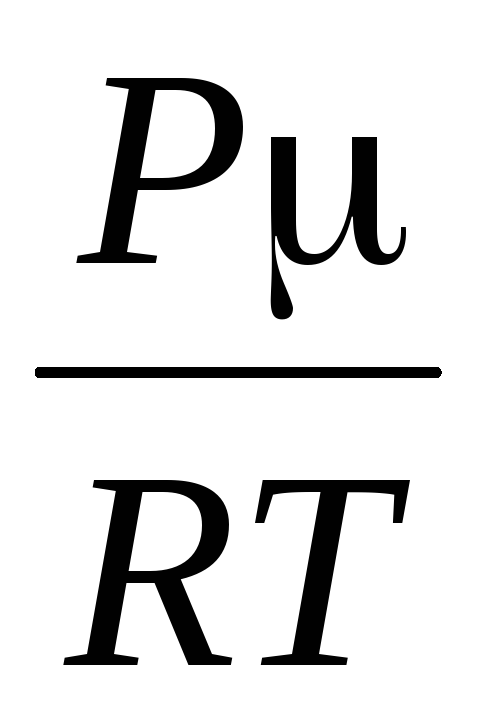 ,
,
trong đó R = 8,31*10 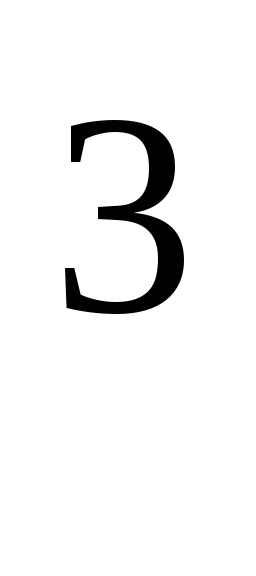 J/(kmol·K), hằng số khí phổ quát.
J/(kmol·K), hằng số khí phổ quát.
Đầu tiên chúng ta hãy xác định mật độ không khí trong xi lanh trước khi bơm, giả sử rằng áp suất P=P  bằng áp suất khí quyển (P
bằng áp suất khí quyển (P  = 101 kPa). Sau đó chúng tôi xác định mật độ không khí ở các mức khác nhau
= 101 kPa). Sau đó chúng tôi xác định mật độ không khí ở các mức khác nhau  P lấy từ bảng đo, giả sử áp suất trong bình là P = P
P lấy từ bảng đo, giả sử áp suất trong bình là P = P  -
- P.
P.
Dựa vào kết quả tính toán, vẽ đồ thị sự phụ thuộc của mật độ vào áp suất P: 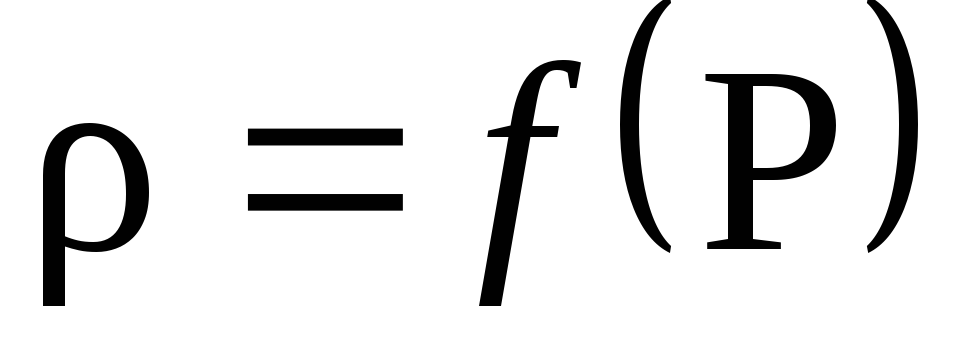
BÀN ĐO LƯỜNG
|
tôi |
|
|
|
|
|
| ||||||
Nhiệm vụ 3. Dựa vào tính toán , xác định bước sóng đường tự do trung bình và vẽ đồ thị sự phụ thuộc của vào : 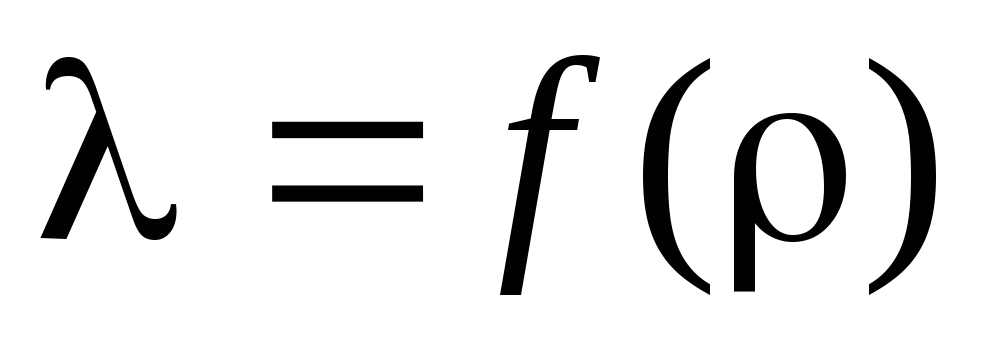 .
.
CÂU HỎI KIỂM TRA
1. Nêu những nội dung chính của thuyết động học phân tử của khí lý tưởng.
2. Những đại lượng vật lý nào được gọi là thông số trạng thái của chất khí, cho biết định nghĩa của chúng.
3. Xây dựng định luật về khí lý tưởng.
4. Trong những điều kiện nào chất khí tuân theo các định luật về khí lý tưởng?
5. Trong những điều kiện nào phương trình Clapeyron-Mendeleev có thể áp dụng được cho chất khí?
6. Trọng lượng phân tử là gì, trọng lượng phân tử phụ thuộc vào điều gì.
7. Mật độ không khí phụ thuộc vào điều gì?
8. Đường đi tự do trung bình của các phân tử khí và đường kính hiệu dụng.
9. Suy ra công thức tính và .
10. Cần thực hiện những phép đo nào để tính khối lượng phân tử và mật độ không khí .
Danh sách tài liệu được sử dụng
1. Savelyev I.V. Giáo trình vật lý đại cương. M.: Nauka, 1970. T.1, § 98.
2. A. A. Detlaff, B.M. Yavorsky. Khóa học vật lý. M.: Nhà xuất bản "Trường trung học", 1973, tr. 175-179.
Trang 1
Trọng lượng phân tử của không khí được tính toán có tính đến tỷ lệ phần trăm của các thành phần khác nhau. Khối lượng của một phân tử không khí được hiểu là giá trị trung bình của khối lượng các phân tử có trong không khí, có tính đến nồng độ tương đối của chúng.
Trọng lượng phân tử của không khí được tính toán có tính đến tỷ lệ phần trăm của các thành phần khác nhau. Khối lượng của một phân tử không khí là giá trị trung bình của khối lượng của các phân tử có trong không khí, có tính đến nồng độ tương đối của chúng.
ĐẾN; M là trọng lượng phân tử của không khí; rzab - áp suất không khí ở bên cạnh.
Rvzh - giống nhau, phía trên bề mặt chất lỏng bay hơi, kg / m3, Mw - trọng lượng phân tử của không khí bằng 29; MP là trọng lượng phân tử của hơi chất lỏng bay hơi.
Vì vậy, để tính số lượng phân tử không khí trong bầu khí quyển Trái đất, chỉ cần biết áp suất không khí ở mực nước biển, trọng lượng phân tử của không khí, bán kính Trái đất và gia tốc trọng trường g trên bề mặt của nó là đủ. Câu trả lời không bao gồm độ cao của khí quyển, chỉ là nó rất nhỏ so với bán kính Trái đất.
| Đặc điểm các thành phần hydrocarbon của khí tự nhiên.| Tính toán nhiệt độ và áp suất giả tới hạn của khí tự nhiên. |
Vì vậy, để xác định trọng lượng phân tử của một chất khí, cần phải nhân trọng lượng riêng của nó (lấy bằng 1 đối với không khí) với trọng lượng phân tử của không khí.
À, cm, trong 1 giây có chênh lệch áp suất ở hai bên vách ngăn Ar, dynes / cm2; M là khối lượng phân tử của không khí, g/mol; R - hằng số khí phổ quát, erg/mol - deg.
Dựa vào các định luật về chất khí lý tưởng, có thể chứng minh rằng trọng lượng riêng của chất khí cũng bằng tỉ số giữa khối lượng phân tử của chất khí và khối lượng phân tử của không khí.
Tuy nhiên, cũng có thể có sự khác biệt giữa độ thấm hơi của vật liệu và độ thấm khí của kết cấu hàng rào làm từ cùng một vật liệu. Điều này xảy ra do sự hiện diện không thể tránh khỏi của rò rỉ và vết nứt trong cấu trúc, làm tăng đáng kể khả năng thấm khí của hàng rào và cũng do trọng lượng phân tử của không khí và hơi nước không giống nhau.
Để mô tả đặc trưng của khí tự nhiên, trọng lượng riêng của nó được sử dụng rộng rãi. Mật độ tương đối của một chất khí được biểu thị bằng tỷ số giữa mật độ của khí ở áp suất khí quyển và nhiệt độ tiêu chuẩn với mật độ của không khí ở cùng áp suất và nhiệt độ. Vì ở áp suất khí quyển và nhiệt độ nhất định, mật độ của khí tỷ lệ thuận với trọng lượng phân tử của chúng, nên mật độ tương đối của khí có thể được biểu diễn bằng tỷ số giữa trọng lượng phân tử của khí và trọng lượng phân tử của không khí. Mật độ tương đối của khí tự nhiên thay đổi từ 0 6 đến 1 1 tùy thuộc vào nồng độ tương đối của các hydrocacbon nặng hơn trong khí.
Trong các nhà máy sản xuất carbon dioxide, việc sản xuất đá khô cũng đòi hỏi phải loại bỏ không khí khỏi hệ thống. Ngoài các đường xâm nhập của không khí được đề cập trước đó, trong máy làm đá khô trong máy làm đá, không khí được đưa vào hệ thống một cách có hệ thống khi các khối đá được lấy ra khỏi máy làm đá. Sau khi khối đá rơi ra, thể tích của máy làm đá sẽ chứa đầy không khí, khi máy làm đá được bật, không khí này sẽ bị máy nén hút ra và cùng với carbon dioxide, đi vào bình ngưng. Do trọng lượng phân tử của carbon dioxide lớn hơn trọng lượng phân tử của không khí nên bản chất các đường của đồ thị pa / (ga) tương tự như đối với freon. Nhưng vì trọng lượng phân tử của carbon dioxide và không khí, so với freon, khác nhau rất ít, nên các đường biểu đồ gần giống với các đường thẳng trên một diện tích đáng kể. Biểu đồ của carbon dioxide, do R. R. Skvarchenko (VNIHI) xây dựng, được thể hiện trong Hình 2.
Trong các nhà máy sản xuất carbon dioxide, việc sản xuất đá khô cũng đòi hỏi phải loại bỏ không khí khỏi hệ thống. Ngoài các đường xâm nhập của không khí được đề cập trước đó, trong máy làm đá khô trong máy làm đá, không khí được đưa vào hệ thống một cách có hệ thống khi các khối đá được lấy ra khỏi máy làm đá. Sau khi khối đá rơi ra, thể tích của máy làm đá sẽ chứa đầy không khí, khi máy làm đá được bật, không khí này sẽ bị máy nén hút ra và cùng với carbon dioxide, đi vào bình ngưng. Do trọng lượng phân tử của carbon dioxide lớn hơn trọng lượng phân tử của không khí nên tính chất các đường của đồ thị pa f (ga) tương tự như đối với freon. Nhưng vì trọng lượng phân tử của carbon dioxide và không khí, so với freon, khác nhau rất ít, nên các đường biểu đồ gần giống với các đường thẳng trên một diện tích đáng kể.